Method Article
Metodo elettrofisiologiche per la registrazione intracellulare di tensione Risposte di
In questo articolo
Riepilogo
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Abstract
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell's receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator's experimental objectives, it grants outstanding in vivo neurophysiological data.
Introduzione
La mosca della frutta occhio (Drosophila melanogaster) composto è un sistema di grande modello per studiare l'organizzazione funzionale degli array fotorecettori e interneuroni per il campionamento e l'elaborazione di immagini neurali, e per la visione degli animali. Il sistema ha lo schema elettrico più completa 1,2 ed è amabile a manipolazioni genetiche e accurato monitoraggio dell'attività neuronale (di alto rapporto segnale-rumore e risoluzione temporale) 3-10.
L'occhio Drosophila è modulare, contenente ~ 750 strutture di lenti-capped apparentemente regolari chiamati ommatidi, che insieme forniscono il campo visivo panoramico che copre quasi tutte le direzioni intorno alla sua testa volare. Informazioni primario della occhio di campionatura unità sono i suoi fotorecettori rabdomerici 7,8,11. Ogni ommatidium contiene otto fotorecettori (R1-R8), che condividono lo stesso obiettivo sfaccettatura, ma sono allineati a sette diverse direzioni. Mentre i fotorecettori esterni R1-R6 are più sensibile alla luce blu-verde, sensibilità spettrale delle celle interne R7 e R8, che si trovano l'uno sopra l'altro e puntare nella stessa direzione, presentano tre sottotipi distintive: pallido, giallo e dorsale zona cerchio (DRA) 12- 15.
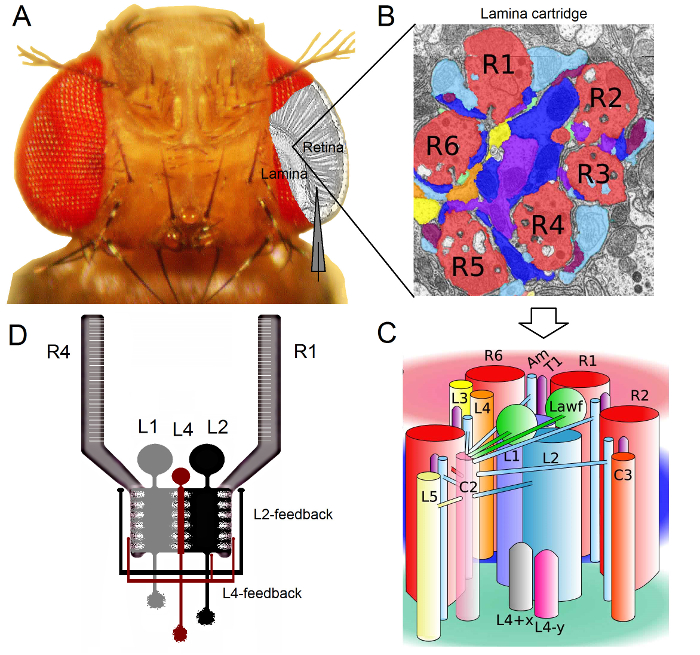
Figura 1. Organizzazione funzionale della Drosophila Eye. (A) I primi due gangli ottico, retina e la lamina, sono evidenziati in grigio all'interno dell'occhio mosca. Fotorecettori Retina R1-R6 e lamina grandi cellule monopolare (MLC: L1-L3) sono facilmente accessibili in vivo alle registrazioni di microelettrodi taglienti convenzionali. L'elettrodo schema evidenzia il percorso normale di registrare da R1-R6 nella retina. Un percorso di registrare da LMCs nella lamina è di spostare parallelamente l'elettrodo a sinistra. (B) Lamina è una matrice di organo retinotopicallycartucce ized, ognuno dei quali è ricco di neuroni che elabora le informazioni da una specifica piccola area nello spazio visivo. A causa della sovrapposizione neurale, sei fotorecettori provenienti da diversi ommatidi vicini inviano i loro assoni (R1-R6) per la stessa cartuccia lamina, formando sinapsi uscita istaminergici a L1-L3 e una cella amacrine (Am). (C) La diffusione delle informazioni neurali tra i terminali degli assoni R1-R6 e le interneuroni visivi (compresi L4, L5, Lawf, C2, C3 e T1), all'interno di una cartuccia lamina è complessa. (D) R1-R6 assoni fotorecettori ricevono una valutazione sinaptiche da cellule monopolare L2 e L4. (B) e (C) modificato da Rivera-alba et al 2. Cliccate qui per vedere una versione più grande di questa figura.
L'occhio Drosophila è del tipo neurale sovrapposizione 16. Questo significa tcappello i segnali neurali di otto fotorecettori appartenenti a sette ommatidi vicina, che guardano allo stesso punto dello spazio, vengono riunite insieme in una cartuccia neurale nei prossimi due neuropils: la lamina e midollo. Mentre i sei fotorecettori esterni progetto R1-R6 loro terminali assoni alle colonne neurali nel lamina (figura 1), cellule R7 e R8 bypassare questo strato e rendere contatti sinaptici con la loro corrispondente colonna medulla 17-19. Questi cablaggi esatte producono il substrato neurale per la mappatura retinotopica di volare visione iniziale, dopo di che ogni lamina (Figure 1A-C) e la colonna midollare (cartuccia) rappresenta un singolo punto nello spazio.
Ingressi diretti da fotorecettori R1-R6 sono ricevuti dai grandi cellule monopolare (MLC: L1, L2 e L3) e la cella amacrine (AM) nella lamina 1,2,20. Di questi, L1 e L2 sono i più grandi cellule, che mediano le principali vie di informazione (Figura 1D), WHIch rispondono alla On-Off e bordi off-movimento, e quindi costituiscono la base di calcolo del rilevatore di movimento 21,22. Esperimenti comportamentali suggerisce che in contrasto intermedia, i due percorsi facilitano il movimento percezione di direzioni opposte: back-to-front in L1 e frontale-to-back in cellule L2 23,24. Connettività implica inoltre che i neuroni L4 possono svolgere ruolo fondamentale nella comunicazione laterale tra cartucce vicini 25,26. sinapsi reciproci sono stati trovati tra le cellule L2 e L4 situati nello stesso e due cartucce adiacenti. A valle, ogni cella L2 e le sue tre celle L4 associati proiettano i loro assoni ad un obiettivo comune, il neurone Tm2 nel midollo, dove si ritiene ingressi da cartucce vicini per essere integrato per l'elaborazione di front-to-back motion 27. Anche se i neuroni L1 ricevono input da persone dello stesso cartuccia L2S via sia giunzioni e sinapsi, che non sono direttamente collegati alla cartucce lamina l4s e quindi adiacenti.
una valutazione Synaptic per R1-R6 assoni fotorecettori sono forniti solo dai neuroni appartenenti ai circuiti / L4 L2, ma non il percorso di 1,2 L1 (Figura 1D). Mentre i collegamenti dello stesso cartuccia sono selettivamente da L2 a R1 e R2 e da L4 a R5, tutti i fotorecettori R1-R6 ricevono un feedback sinaptica da L4 di una o entrambe le cartucce confinanti. Inoltre, ci sono forti connessioni sinaptiche da Am a R1, R2, R4 e R5, e cellule gliali sono anche sinapticamente collegati alla rete e possono quindi partecipare neurale elaborazione delle immagini 6. Infine, assonale gap giunzioni, che collega la vicina R1-R6 e tra R6 e R7 / R8 fotorecettori nella lamina, contribuiscono alla rappresentazione informazione asimmetrica e la lavorazione in ogni cartuccia 14,20,28.Registrazioni di tensione intracellulari di singoli fotorecettori e interneuroni visivi in quasi intatto Drosophila fornire alta R segnale-rumoredati azio con risoluzione sub-millisecondo 3,5,7-10,29, che è necessaria per dare un senso dei calcoli neurali veloci tra i neuroni connessi. Questo livello di precisione è impossibile dalle attuali tecniche di imaging ottico, che sono significativamente più rumoroso e tipicamente operano a 10-100 risoluzione msec. Inoltre, poiché gli elettrodi sono molto piccoli e taglienti punte, il metodo non è limitato a corpi cellulari, ma può fornire registrazioni diretti da piccole strutture neurali attive; come alberi dendritiche i LMCS 'o assoni dei fotorecettori, che non possono essere accessibili da molto più grandi punte di elettrodi di patch-clamp. È importante sottolineare che il metodo è anche strutturalmente meno invasiva e dannosa quanto la maggior parte delle applicazioni di patch-clamp, e quindi incide meno campionamento ambiente e le informazioni intracellulare delle cellule studiate. Così, convenzionali tecniche di microelettrodi taglienti hanno contribuito, e continuare a contribuire, scoperte fondamentali e visione originale in infor neuraleelaborazione mazioni alla scala momento opportuno; migliorare la nostra comprensione meccanicistica della visione 3-10.
Questo articolo spiega come nelle registrazioni intracellulari vivo da Drosophila fotorecettori R1-R6 e MLC vengono eseguite in laboratorio Juusola. Questo protocollo descrive come costruire un adeguato impianto di elettrofisiologia, la preparazione al volo, ed eseguire le registrazioni. Alcuni dati rappresentativi è presentato, e alcuni problemi comuni e le possibili soluzioni sono discusse che possono verificarsi quando si utilizza questo metodo.
Protocollo
Il seguente protocollo è conforme a tutte le linee guida per la cura degli animali dell'Università di Sheffield e Università Normale di Pechino.
1. Reagenti agricole per la preparazione
- La registrazione e configurazione Luce attrezzature Stimolazione
- Scegliere almeno una zona di registrazione 2,5 x 2,5 m per l'esecuzione di esperimenti elettrofisiologici in una stanza che ha l'aria condizionata con umidità regolamentato e mezzi per fornire condizioni di registrazione scure. Assicurarsi che questa zona è grande abbastanza da contenere comodamente un: (i) 1 x 1 m tavola vibrante-isolamento che ospita l'impianto di perforazione [volare stimolazione e apparecchi per la registrazione], stereomicroscopio e una sorgente di luce fredda con due colli d'oca, il tutto racchiuso all'interno di un grandi> 180 cm di altezza gabbia di Faraday; (Ii) un rack 38U per l'alloggiamento di un personal computer con un monitor LCD a schermo piatto, amplificatore microelettrodo, driver LED, filtri, unità di controllo della temperatura, oscilloscopi e altri strumenti elettrici necessari; e (iii) unpiccola scrivania e una sedia per il ricercatore.
- Posizionare il rig lontano da fonti di rumore elettrico e meccanico, come ad esempio frigoriferi, centrifughe e ascensori. Utilizzare limitatori di sovratensione separati per proteggere i dispositivi elettrici del rig da picchi di tensione che si verificano nella rete. Idealmente, collegare l'impianto di perforazione per il proprio gruppo di continuità (UPS batteria) per ridurre al minimo il rumore.
- Costruire una conica fly-titolare di ottone e plastica nera (Figura 2). Praticare un piccolo foro rastremazione attraverso l'unità di ottone con il suo bordo restringimento esterna a ~ 0,8 millimetri di diametro (corrispondente larghezza del torace di un tipico di volo).
Nota: Questo foro deve cono verso la punta del fly-supporto in modo che una più grande della media Drosophila, che si proietta dal basso dal flusso d'aria, otterrebbe bloccato spalla profonda sul bordo superiore. - Progettare e costruire un meccanicamente robusto, ma precisa, volare stimolazione e apparecchi per la registrazione (Figura 3). Costruire fuori of alluminio o ottone (metalli ad alta conduttività) un palo piattaforma di preparazione mosca e attorno ad esso un sistema cardanico-braccio, con cuscinetti a sfera incorporate, per fornire x lisci e precisi, y-posizionamento e bloccaggio dello stimolo luce.
Nota: Questo design composito integrato riduce al minimo le vibrazioni meccaniche, che potrebbero spostare la punta elettrodo di registrazione fuori dalla cella studiata. Si può integrare ulteriormente un sistema di controllo della temperatura a ciclo chiuso a base di Peltier-elemento, che consente agli investigatori di usare costrutti genetici sensibili alla temperatura, come ad esempio shibire TS, per valutare i calcoli dei circuiti sinaptici 9,30. Anodizzare l'apparecchio o Paint It Black di ridurre al minimo la luce stimoli dispersione.- Fissare la stimolazione volo e apparecchi per la registrazione sul tagliere del tavolo anti-vibrazioni; per esempio M6 bulloni, utilizzando i fori delle viti metriche. Utilizzare un tagliere nero o coprirlo con tessuto nero per ridurre al minimo la dispersione della luce durante gli esperimenti.
- Position e blocco (utilizzando una vite di serraggio) un preparato mosca palo piattaforma regolabile verticalmente al centro di un sistema cardanico-braccio. Posizionare il fly-preparato (all'interno del fly-titolare, vedere il punto 2) sul palo piattaforma in modo che la sorgente luminosa collegata al Cardan braccio indica radialmente alla testa della mosca. Assicurarsi che il centro degli occhi mosca è esattamente nel punto di intersezione (0, 0) del x- della cardanico braccio ed y, poiché questo consente x accurati, y-posizionamento della luce stimolo a qualsiasi punto all'interno della patta di campo visivo.
Nota: questa funzionalità è necessaria per la mappatura delle proprietà di risposta delle singole celle a specifiche posizioni degli occhi, ad esempio, durante la ricerca di prove elettrofisiologiche per adeguamenti strutturali, come ad esempio le zone luminose o acute, che mostrerebbero aumentando la sensibilità o la risoluzione, rispettivamente, 31.
- Montare lo stereomicroscopio dietro la stimolazione volo e apparecchi per la registrazione sul tavolo anti-vibrazioni in modoche offre una visione confortevole alto ingrandimento dell'occhio mosca.
- Montare la sorgente di luce fredda sulla parte superiore del microscopio con doppia testa semirigide guide di luce a collo d'oca della sorgente luminosa che punta verso il supporto preparato mosca. Liberamente mobile due illuminazione fascio rende più facile visualizzare l'elettrodo di registrazione quando si guida attraverso una piccola apertura nell'occhio mosca.
- Attaccare un appropriato x, y, set z-micromanipolatore (grossolana e fine) per l'elettrodo di registrazione e la testina stadio sul tavolo antivibrante, sul lato destro del dispositivo di stimolazione fly e la registrazione, utilizzando M6 bulloni o magnetico stand.
Nota: In laboratorio Juusola, diverse piattaforme sono dotate di diversi manipolatori; Per i dettagli, vedere la tabella dei materiali e reagenti. Tutti questi forniscono registrazioni intracellulari di alta qualità. - Montare un piccolo micromanipolatore 3 assi manuale per il titolare elettrodo di riferimento sul f regolabile verticalmentely palo piattaforma di preparazione. Orientare l'elettrodo di riferimento in modo che sia rivolto verso la preparazione mosca.
- Costruire una luce schermato gabbia di Faraday free-standing in acciaio pannelli attorno al tavolo anti-vibrazioni, che circonda l'apparato stimolazione volo e la registrazione, per evitare perturbazioni elettromagnetiche esterne. Lasciare la parte anteriore aperta della gabbia, all'accesso a trasportare la preparazione fly per gli esperimenti. Fissare tende nere in tessuto (con rame o alluminio-rete impiantati al loro interno per la messa a terra) al fronte per schermare il rumore e la luce. Dipingere l'interno della gabbia nera per minimizzare diffusione della luce e imbullonare i piedi della gabbia sul pavimento per evitare vibrazioni.
- Collegare la tensione e uscite in corrente dell'amplificatore intracellulare microelettrodo alta impedenza agli ingressi di due filtri passa-basso separati (Bessel o simili) utilizzando BNC-cavi. Allo stesso modo, collegare le uscite del filtro nei canali appropriati dei blo AD-connettoreCKS / assi del sistema di acquisizione dati (carte DA / AD). Collegare la scheda DA / AD (s) in un personal computer tramite cavi speciali, in base ai manuali dei fornitori.
- Installare software di acquisizione appropriato per il sistema di acquisizione dati di scelta sul personal computer. Assicurarsi che i driver di acquisizione dati sono compatibili con il sistema operativo del personal computer.
- Terra elettricamente la stimolazione volo e apparecchi per la registrazione, gabbia di Faraday, maglia di rame (entro le tende), microscopio, micromanipolatori, fonte di luce fredda, 38U rack con tutti i suoi strumenti (l'amplificatore intracellulare, filtri, unità di controllo della temperatura, PC e monitor LCD ecc) per un singolo punto di terra usando un cavo di messa a terra e M6 piegatura estremità anello di messa a terra. Utilizzare un multimetro elettrico per verificare che tutte le parti sono nello stesso terreno.
Nota: Per ottenere le migliori condizioni di registrazione a basso rumore possibili, le configurazioni di messa a terra tipicamente variano from un set-up ad un altro.- Se necessario, collegare il punto di terra più a terra dell'edificio, e / o massa centrale dell'amplificatore microelettrodo. Dopo aver testato il sistema completamente funzionante durante veri e propri esperimenti di elettrofisiologia, essere pronti a modificare la configurazione di messa a terra come necessario per minimizzare il rumore nelle registrazioni.
- Configurare l'amplificazione software (1 - 10X), filtraggio del segnale (tipicamente filtri passa-basso fissati a 500 Hz, che è adatto sia per i dati R1-R6 e LMC), e frequenza di campionamento (almeno 1 KHz). Verificare che le impostazioni obbediscono Nyquist-Shannon campionamento Teorema 32; per esempio, quando l'acquisizione dati che passa basso filtrata a 500 Hz, utilizzare una frequenza di campionamento di 1 kHz o superiore per minimizzare gli effetti di aliasing.
- Come risposte di tensione caratteristici di fotorecettori R1-R6 sono 40 - 65 mV, e quelli di MLC 20 - 45 mV, impostare l'amplificazione e la visualizzazione in scala di conseguenza per consentire ad alta risoluzione sampling e visualizzazione dei dati.

Figura 2. conico Fly-supporto Il fly-titolare è fatto di due pezzi:. L'unità di ottone centrale e la sua forma conica cappotto di plastica nera. Il foro centrale all'interno dell'unità di ottone si assottiglia ad un piccolo diametro che permette a malapena la mosca attraverso. Clicca qui per vedere una versione più grande di questa figura.

Figura 3. Panoramica del Rig elettrofisiologici. Il set-up contiene una gabbia di free-standing luce schermati Faraday, il tavolo anti-vibrazioni, l'apparato di stimolazione volo e la registrazione, e tende in tessuto nero con rame o alluminio-maglia all'interno per messa a terra. i inscremagliera trument è collegato elettricamente alla stessa terra centrale con tutte le attrezzature all'interno della gabbia di Faraday. Clicca qui per vedere una versione più grande di questa figura.
- Realizzazione microelettrodi
- Estrarre il microelettrodo di riferimento da borosilicato filamented (diametro esterno: 1,0 mm, diametro interno 0,6 mm) o vetro di quarzo (diametro esterno: 1,0 mm, diametro interno 0,5, 0,6 o 0,7 mm) tubazione utilizzando uno strumento pipetta estrattore. Cercate di ottenere una breve cono graduale.
Nota: Le impostazioni esatte del programma pipetta estrattore variano da uno strumento all'altro; maggiori dettagli nella tabella dei materiali e dei reggenti. La dimensione dei pori sulla punta non è cruciale perché la punta dell'elettrodo di riferimento sarà rotto prima di essere inserito nella preparazione mosca. - Tirare il microelettrodo di registrazione da borosilicato filamented (diametro esterno: 1,0 mm diametro interno 0,6 mm) o vetro di quarzo (diametro esterno: 1,0 mm, diametro interno 0,5, 0,6 o 0,7 mm) tubazione utilizzando uno strumento pipetta estrattore. Cercate di ottenere una lunga (10 - 15 mm) cono bene graduale.
- Ispezionare con un microscopio ottico che gli elettrodi di registrazione mostrano corretta rastremazione. Montare l'elettrodo su un vetrino con adesivo modellabile e utilizzare obiettivo dell'aria 40X per ispezionare la sua punta.
Nota: Un buon elettrodo assottiglia liscio fino a quando la sua invisibile piccola punta, attorno al quale continua più scuro paralleli e figure di interferenza più leggeri possono essere visti. Alcune impostazioni puller generano elettrodi ad alta resistenza, che non può cedere penetrazioni cellulari di successo perché i loro suggerimenti assomigliano "trombe". Così, ispezione visiva degli elettrodi è importante. - Attaccare gli elettrodi orizzontalmente su una grande piastra di Petri con plastilina (o adesivo modellabile simili) per la custodia e il trasporto per l'impianto di perforazione elettrofisiologia. Assicurarsi che le punte degli elettrodi unri sempre in aria e non toccare accidentalmente nulla.
- Back-riempire i elettrodi di registrazione e di riferimento appena prima l'esperimento con la soluzione salina appropriata. Utilizzare una piccola siringa da 5 ml collegata ad un filtro antiparticolato piccolo con una punta di plastica fine (come ad esempio un microloader).
- Per gli esperimenti fotorecettori, riempire l'elettrodo di registrazione completamente (una gocciolina forma nella sua estremità più grande) con 3 M KCl come questa soluzione minimizza l'effetto del potenziale giunzione liquida alla tensione registrata.
- Per indagare le MLC istaminergici, che rispondono a ingresso sinaptica da fotorecettori R1-R6 da cambiamenti di cloruro-conduttanza, riempire gli elettrodi di registrazione con 3 M acetato di potassio e 0,5 mM KCl, in quanto questa soluzione ha meno effetto sulla batteria cloruro della cellula. Riempire l'elettrodo di riferimento con la mosca Ringer, contenente in mm: 120 NaCl, 5 KCl, 10 TES (C 6 H 15 NO 6 S), 1,5 CaCl 2, 4 MgCl 2, e 30 di saccarosio 5.
- Testare la resistenza di un elettrodo di registrazione appena tirato nel sistema di registrazione.
- Assicurarsi che i fili d'argento all'interno dell'elettrodo detentori sono uniformemente rivestiti con cloruro d'argento (che appaiono viola-grigio - non lucido argenteo) per ridurre al minimo gli artefatti di registrazione (come ad esempio la deriva nel potenziale di giunzione). In caso contrario, sostituirli con i cavi correttamente clorurato.
- Se necessario, chloridize nuovi fili d'argento. Pulire accuratamente i fili (facendoli passare rapidamente attraverso una fiamma) in modo che questi appaiono argento luminoso a colori. Evitare di toccare con le dita, per depositare uno strato uniforme di AgCl. Mettere a bagno i fili in piena forza candeggina per uso domestico per 15 - 30 minuti fino a che non appaiono di colore viola-grigio. In alternativa, electroplate ciascun filo (rendendolo positivo rispetto ad una soluzione contenente 3 M KCl e passare una corrente attraverso di esso ad una velocità di 1 mA / cm 2 di superficie) per 10 - 15 sec finché adeguatamente rivestita.
- Collegare la registrazione di back-riempita e elettrodi di riferimento per i loro elettrodi detentori. Posizionare il bagno una piccola soluzione di Ringer sul palo piattaforma di preparazione fly regolabile in altezza. Guidare le punte degli elettrodi nella soluzione del Ringer e misurare la resistenza punta del elettrodo di registrazione.
Nota: questo passaggio è necessaria solo quando prova delle proprietà resistivi di elettrodi, che sono tirati da un nuovo lotto di tubo di vetro, o quando l'ottimizzazione dei programmi dello strumento microelettrodi estrattore attraverso iterazione. - Prima di eseguire le misure di resistenza, leggere le istruzioni contenute nel manuale d'uso del produttore dell'amplificatore per le impostazioni di misurazione adeguati. Per un buon elettrodo di registrazione, avere una resistenza punta di ~ 100-220 MW.
- Estrarre il microelettrodo di riferimento da borosilicato filamented (diametro esterno: 1,0 mm, diametro interno 0,6 mm) o vetro di quarzo (diametro esterno: 1,0 mm, diametro interno 0,5, 0,6 o 0,7 mm) tubazione utilizzando uno strumento pipetta estrattore. Cercate di ottenere una breve cono graduale.
2. Preparazione Drosophila
- Raccogliere 5 - 10 giorni mosche (dopo eclosion) e metterli in una provetta contenente mosca pulito stcibo Andard. È possibile ottenere buone registrazioni dal minore vola troppo, anche dalle "neonati"; ma a causa della loro occhi morbidi, taglio un'apertura corneale per l'elettrodo di registrazione è più difficile.
- Costruire un tubo mosca cattura e una preparazione fly supporto (figura 4). Vedere Figura 4 per l'idea generale di come questi strumenti self-made sono stati messi insieme.
- Per fare un tubo mosca cattura, tagliare la punta di fondo conico da 50 ml di plastica della provetta da centrifuga. Quindi, inserire e incollare il grande fine del 1 ml puntale su questa nuova apertura.
- Infine, tagliare l'estremità più piccola pipetta ad una dimensione che permette facilmente una mosca a piedi attraverso. Consultare un officina meccanica per assemblare una piccola fase di preparazione mosca che permette la rotazione a 2 assi e bloccaggio del fly-titolare di diverse posizioni.

figure 4. Strumenti ed elabora necessari per la formulazione della preparazione Fly. Vola tubo cattura è realizzato incollando un 1 ml punta di plastica pipetta ad un tubo di plastica da centrifuga da 50 ml. Bespoke Stand preparazione fly permette senza rotazione e bloccaggio del fly-titolare in una posizione preferita per la preparazione al volo. La mosca è fissato da cera d'api, utilizzando il elettrico cera riscaldatore. Vaselina viene applicata da un piccolo applicatore realizzato collegando un capello sorta di spessore su una maniglia. Clicca qui per vedere una versione più grande di questa figura.
- Raccogliere una mosca per l'esperimento in un puntale 1 ml, che permette a malapena una mosca per passare attraverso. Fissare la mosca cattura tubo, con la punta della pipetta su di esso, al tubo mosca. A prendere una mosca, approfittare della loro tendenza intrinseca a salire verso l'alto (antigravitaxis) nella punta della pipetta. Preferibilmente, selezionare il più grande femminile, come materia dimensionis in elettrofisiologia.
Nota: Più grande è la mosca, il più grande le sue cellule e maggiori saranno le probabilità per le registrazioni intracellulari di alta qualità. mosche più piccole (sia maschi e femmine) possono anche fornire eccellenti registrazioni, ma la preparazione è più difficile da fare. Una volta che la mosca è intrappolato in una grande punta della pipetta, ricordarsi di chiudere il tubo di volo per fermare altre mosche di fuggire. - Collegare una siringa da 100 ml con un tubo di plastica flessibile per la grande apertura della punta della pipetta - con la mosca ancora in esso.
- Inserire l'estremità stretta sul grande punta della pipetta, che è ingrandita solo lasciare un Drosophila attraverso, l'apertura sul fondo del fly-titolare e spremere un piccolo volume di aria dalla siringa per espellere la mosca nel fly-titolare .
- Guardare attraverso lo stereomicroscopio e amministrare delicatamente più aria fino a quando la testa della mosca sporge dalla fine conica del fly-titolare. Assicurarsi che la mosca è saldamente intrappolato dalla sua torace al piccolo opening sulla sommità del fly-titolare.
- Utilizzare un riscaldatore di cera per fissare al volo con cera d'api dalle sue "spalle" al fly-titolare. Regolare la temperatura del riscaldatore cera per essere il più basso possibile ancora pulito fusione della cera.
Nota: Quando la temperatura è corretta, la cera appare trasparente. Troppo alto di una temperatura rende la cera "bruciare"; troppo basso mantiene la rigida cera. Nel fissare la mosca, essere precisi e breve, come l'esposizione al calore prolungata potrebbe danneggiarlo. Utilizzando colla dentali fotopolimerizzabili non è consigliato qui come la sua applicazione è troppo lento.

Figura 5. Preparazione al volo per esperimenti in vivo. A sinistra, testa Un Drosophila s 'sia diritto nel fly-titolare e fissato da sua proboscide, l'occhio destro e le spalle al fly-titolare con essere riscaldatieswax. A destra, una piccola apertura è tagliata nella parte più spessa dell'occhio, appena sopra l'equatore e solo pochi ommatidi lontano dalla cuticola indietro, usando un bordo tagliente come un rasoio. Un pezzo di cornea viene delicatamente rimosso e il foro è sigillato con vaselina per evitare che l'occhio da prosciugamento. Clicca qui per vedere una versione più grande di questa figura.
- Immobilizzare la testa della mosca. Applicare cera d'api per la proboscide (Figura 5) e l'angolo dell'occhio destro, evitando la cornea, e fissare la testa da questi punti per il fly-titolare.
- Produrre un micro-coltello. Bloccare una lametta non in acciaio inox con due lame detentori / interruttori (entrambi con presa piatta) e crack una piccola striscia del suo bordo tagliente. Per la salute e la sicurezza, usare occhiali per la protezione degli occhi (anche se è altamente improbabile che pezzi sarebbero rimbalzare quando il rasoio è rotto). Idealmente,produrre un bordo tagliente come un rasoio che assomiglia ad una guglia. Assicurarsi che questo "guglia" è saldamente attaccato alla porta-lama, ma attenzione per evitare ogni autolesionismo!
- Utilizzando il micro-coltello, preparare una piccola dimensione apertura di alcuni ommatidi nell'occhio sinistro del fly - a circa 4-5 ommatidi dalla cuticola dorsale proprio sopra dell'equatore dell'occhio per fornire il passaggio per il microelettrodo registrazione. Eseguire allo stereomicroscopio, visualizzando la preparazione con alto ingrandimento.
Nota: Poiché l'occhio fly sente elastica e resistente per sondare, il buco è migliore taglio con un -Knife "guglia". La tecnica di taglio è molto impegnativo, in modo da prestare molta attenzione al video dimostrativo. Mantenendo il fly-titolare in alcuni orientamenti (in stand preparato volo) può rendere più facile la dissezione. Inizialmente, la microchirurgia può sentire difficile da imparare, ma una volta commesso, adattamento neurale migliora gradualmente 3D-percezione e la destrezza del ricercatore. - Rimuovi accuratamente il piccolo pezzo di cornea dall'apertura che è stato appena tagliata, esponendo la retina sottostante. Rapidamente coprire il foro in un occhio con una piccola goccia di vaselina con il capelli fini dell'applicatore vaselina.
Nota: Gelatina di petrolio serve più ruoli qui. Previene la disidratazione dei tessuti e la coagulazione del emolinfa che avrebbe rotto l'elettrodo di registrazione inserito. Esso ricopre anche incidentalmente il microelettrodi, riducendo la sua capacità intramurale. Questo può migliorare la risposta in frequenza del sistema di registrazione, e quindi la risoluzione temporale dei segnali neurali registrati. Evitare sbavature vaselina sul resto dell'occhio come questo confonde l'ottica.
3. Registrazione da R1-R6 Fotorecettori o MLC
- Sempre collegato a terra quando si utilizza l'amplificatore microelettrodo (per esempio toccando la superficie metallica della gabbia di Faraday o un tavolo antivibrante), come questo impedisce di accidentalmente fornireing una carica statica alla testa allo stadio, che potrebbe danneggiare i circuiti.
- Illuminare il palo piattaforma preparato fly dall'alto da due guide di luce a collo d'oca (Figura 6A) (con la sorgente di luce fredda all'interno della gabbia di Faraday) in modo che la mosca-supporto può essere posizionato sul palo nella posizione preferita sotto stretto controllo visivo .
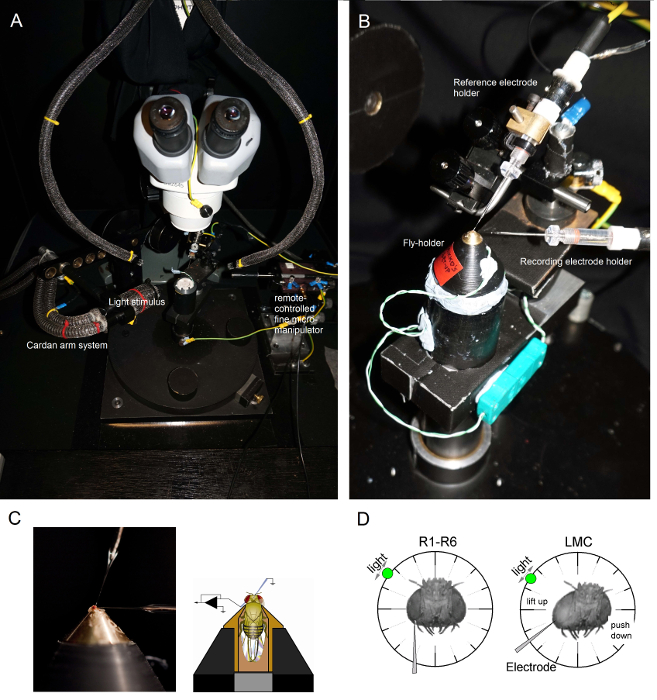
Figura 6. Posizionamento della Fly-titolare e gli elettrodi per gli esperimenti (AB) Il fly-titolare è posizionato sulla piattaforma di registrazione che fornisce anche il controllo della temperatura tramite un elemento Peltier (A: bianco piattaforma rotonda al centro).. Il cardanico braccio consente un posizionamento esatto del stimolo luminoso a uguale distanza (via x, y-rotazione) attorno al volo, con la sorgente di luce (una fibra ottica end fascio liquido o quarzo) direttamente punta al suo occhio. In molti dei our impianti, stimolazione luminosa è generata da LED (con correnti-drivers lineari) o da un monocromatore. Così, i loro stimoli portano uno specifico contenuto spettrale (banda-passato), selezionati tra 300-740 nm e coprono 4-6 log gamma Unità di intensità (come attenuato dai filtri a densità neutra separati). (C) Due microelettrodi, controllata da micromanipolatori separati, sono posizionati nella testa fly: l'elettrodo di riferimento (sopra) attraverso il ocelli; l'elettrodo di registrazione (a sinistra) attraverso la piccola apertura nell'occhio sinistro. (D) Per ottenere un numero massimo di registrazioni fotorecettori, microelettrodo registrazione viene spinto nel foro, parallela all'asse proboscide-ocellus. Quando penetra punta dell'elettrodo e tenute ad un fotorecettore, la sorgente di luce liberamente girevole è fissato nella posizione in cui la cellula produce la risposta massima tensione ad un dato stimolo luminoso. Questo punto nello spazio si trova nel centro del campo recettivo della cellula. Se i foris vicino alla cuticola, penetrazioni LMC possono inoltre essere realizzati con lo stesso angolo di elettrodo (a sinistra). Se il foro è più lontano dalla cuticola, un altro angolo di attacco elettrodo utile per ottenere registrazioni LMC è pure indicata (a destra). Clicca qui per vedere una versione più grande di questa figura.
- Montare il fly-titolare (con la mosca in esso!) Sul polo piattaforma di preparazione del volo. Ruotare il fly-supporto in modo che l'occhio sinistro della mosca si trova ad affrontare direttamente il ricercatore (Figura 6B).
- Inserire l'elettrodo di riferimento smussato dolcemente attraverso Occelli della mosca nella capsula testa con un piccolo micromanipolatore grossolana mentre si osserva la preparazione attraverso lo stereomicroscopio (Figura 6C). Non spingere l'elettrodo troppo in profondità, in quanto ciò può danneggiare il cervello mosca.
- In alternativa, inserire l'elettrodo di riferimento nella parte posteriore del torace. Sempre, assicurarsi che la mosca sembra heathy (sposta la sua antenne) ed i suoi occhi sono intatti; non danneggiato accidentalmente. Se la preparazione sembra meno immacolata, preparare una nuova mosca per gli esperimenti.
- Guidare il microelettrodo di registrazione tagliente nell'occhio sinistro attraverso la vaselina coperto piccola apertura preparato in precedenza. Utilizzare alto ingrandimento nella stereomicroscopio e spostare le guide di luce e il piano focale modo che la posizione punta dell'elettrodo diventa evidente in 3D dai modelli di riflettanza.
Nota: Figura 6D mostra come testa della mosca dovrebbe essere posizionato leggermente diverso (rispetto all'angolo il microelettrodo registrazione entra nell'occhio) per fotorecettori e registrazioni LMC. Guidando l'elettrodo nell'occhio senza rompere è la fase più difficile dell'esperimento. Se l'elettrodo non trova la piccola apertura nell'occhio, colpendo la cornea, si rompe in genere. - Accendere l'amplificatore microelettrodouna volta che entrambi gli elettrodi sono saldamente all'interno della preparazione, in contatto elettrico con i fluidi corporei della mosca.
- Spegnere la fonte di luce fredda (all'interno della gabbia di Faraday) e staccare la spina dalla presa di corrente. Collegare la spina a terra centrale per ridurre al minimo terra-ciclo indotto rumore elettrico, e spostare le guide di luce a collo di cigno di distanza in modo che il sistema cardanico-braccio può essere liberamente spostato al volo. Spegnere le luci della stanza per garantire che la preparazione mosca è ora in relativa oscurità.
- Misurare la resistenza dell'elettrodo di registrazione nell'occhio (come indicato nel manuale dell'amplificatore). Utilizzare elettrodi unica registrazione in cui la resistenza è 100-250 MW.
Nota: E 'praticamente impossibile ottenere registrazioni intracellulari di alta qualità da <70 elettrodi MW. Se la resistenza è <80 MW, è probabile che la punta dell'elettrodo è rotto. In questo caso, spegnere l'amplificatore e cambiare l'elettrodo di registrazione.- Una volta che l'elettrodoè sostituito e nell'occhio, attivare l'amplificatore per misurarne la resistenza. Talvolta, l'elettrodo può intasarsi da alcuni detriti mentre entra nel tessuto. Questo può essere risolto utilizzando le funzioni capacitivo ronzio e impulso di corrente dell'amplificatore che in genere chiaro che da una rapida risonanza o repulsione.
- Impostare l'amplificatore di corrente-clamp (CC) o modalità di registrazione ponte. Cancellare qualsiasi differenza di tensione arbitraria tra gli elettrodi di registrazione e di riferimento, come ciascuno di essi sono ora riposando nello spazio extracellulare interconnessi elettricamente, impostando lo scostamento del segnale (tensione registrazione) a zero. Seguire i cambiamenti di scostamento del segnale tramite la lettura del display del amplificatore o schermo di un oscilloscopio.
- Attendere 2-3 minuti per l'occhio di mosca scuro adattarsi.
- Guidare la punta elettrodo di registrazione a poco a poco più in profondità l'occhio con piccoli 0.1 a passi di 1 micron. Fare questo con un asse x piezo-passo-passo di un micromanipolatore oppure b telecomandatoy ruotando delicatamente la manopola risoluzione fine di un manipolatore manuale.
- Stimolare l'occhio volo con breve (1 - 10 msec) lampi di luce come l'elettrodo di registrazione è avanzata nel tessuto.
Nota: Se l'elettrodo di registrazione è posizionato nella retina e le funzioni dell'occhio normalmente, ciascun lampo luce causerà una breve e piccola caduta di tensione (0,2 - 5 mV iperpolarizzazione), chiamato elettroretinogramma (ERG). Questo cambiamento nel campo potenziale dello spazio extracellulare è causato dalla risposta collettiva cellule retiniche 'alla luce. Tuttavia, una volta che la punta dell'elettrodo entra la lamina, chiudendo sui MLC, l'ERG inverte, mostrando le risposte depolarizzanti. - Spostare la sorgente luminosa intorno all'occhio fly utilizzando il sistema cardanico-braccio e trovare la posizione in cui la luce evoca la risposta più grande ERG.
Nota: Questa posizione segna la piccola area nello spazio visivo in cui i fotorecettori (o MLC), che si trovano vicino alla punta dell'elettrodo di registrazione, Assaggiare il loro ingresso luce. - Penetrare una cella con l'elettrodo di registrazione.
Nota: La penetrazione può avvenire spontaneamente, o quando l'elettrodo è micro-fece avanti. Esso può essere ulteriormente facilitato picchiettando delicatamente il sistema micromanipolatore o utilizzando il ronzio funzione dell'amplificatore; queste azioni risuonano la punta dell'elettrodo nel tessuto. Quando l'elettrodo infilza membrana fotorecettore, entrando suo spazio intracellulare, la differenza di tensione tra la registrazione e elettrodo di riferimento scende improvvisamente da 0 mV a ~ -65 mV (tra -55 e -75 mV); mentre durante penetrazioni LMC, questo calo è in genere meno (tra -30 e -50 mV). Queste differenze di tensione rappresentano le potenzialità di riposo negativi delle cellule fornite. A seconda della qualità del l'elettrodo di registrazione (la sua nitidezza) e il processo cellulare penetrò, la lettura della tensione dall'elettrodo registrazione può stabilizzare rapidamente o gradualmente al potenziale di riposo, la membrana cellulareguarnizioni per lo strato esterno dell'elettrodo. Ma se la penetrazione è solo parziale o povero, l'elettrodo scivola tipicamente dalla cella con il potenziale arrampicata registrata indietro verso lo zero. - Localizzare il centro del campo recettivo della cellula penetrato quando l'elettrodo viene visualizzato correttamente sigillato, mostrando potenziale di membrana stabile (potenziale di riposo scuro). Spostare lo stimolo lampeggiante intorno all'occhio volo, utilizzando il sistema cardanico braccio, per trovare il punto dello spazio visivo, in cui il flash di luce evoca la risposta massima tensione della cellula. Bloccare il Cardan-braccio quando lo stimolo della luce si affaccia direttamente (punti al) centro campo recettivo.
Nota: Nel buio, fotorecettori Drosophila rispondono a impulsi di luce brillante con 40 - 65 mV risposte di tensione depolarizzante 4,5, mentre le registrazioni LMC stabili mostrano 20 a 45 mV risposte iperpolarizzanti 9,10,14. penetrazioni glia possono accadere raramente, indicato da <-80 mV potenzialità di riposo e molto più lentoe più piccolo (~ 5 mV) saturo depolarizzazioni indotti dalla luce. Fotorecettori in Drosophila con diverse pigmentazioni degli occhi, come il bianco degli occhi 7 e cinabro, mostrano la dimensione di risposta paragonabili a wild-type. - Utilizzando la modalità del amplificatore di corrente-clamp (CC), di compensare la capacità del elettrodo di registrazione iniettando piccolo 0,1 nA e di breve durata (100-200 msec) impulsi di corrente nella cella studiata per ridurre al minimo gli artefatti di registrazione durante la sua carica di membrana.
Nota: Questa procedura importante è spiegata in dettaglio nel manuale utente dell'amplificatore, e dovrebbe essere praticato con un modello di cella elettrica prima degli esperimenti attuali. - le risposte di tensione Record per impulsi di luce e altri stimoli di interesse, avendo diverse caratteristiche statistici o fisici (come ad esempio naturalistico serie tempo l'intensità della luce o modelli di contrasto casuali). Test, per esempio, come le risposte registrate cambiano con luce- o scuro-adattamento.
Nota: Si può con precisione liGHT-adattare il cellulare studiato da luce continua di intensità prescelto con l'aggiunta di filtri a densità neutra sul percorso della luce 4,5. In alternativa, per prolungato adattamento al buio spegnere lo stimolo luce per un tempo prestabilito. A causa della stabilità meccanica del sistema di registrazione, la qualità degli elettrodi di registrazione e l'integrità della preparazione, condizioni di registrazione stabili possono talvolta durare per molte ore. Così, in una buona giornata, è possibile raccogliere una grande quantità di dati a differenti condizioni adattandosi di una singola cella. Quando l'elettrodo scivola fuori dalla cella, le risposte registrate diminuiscono e la tensione media comincia ad avvicinarsi allo zero. - Far avanzare con cautela l'elettrodo di registrazione con il controllo fine asse x del micromanipolatore fino l'elettrodo entra in contatto e penetra la cella successiva (si tratta in genere il vicino neurale più vicino). Non spostare l'elettrodo lungo y o z-asse queste manovre renderebbero l'elettrodo a "plough il tessuto "di lato, danneggiare le strutture dell'occhio!
Nota: Con una buona elettrodo e una preparazione sana, si può registrare le risposte di alta qualità da molte fotorecettori (ma raramente da molti LMCs) nella stessa mosca su un periodo di diverse ore; di tanto in tanto, su tutta la giornata lavorativa (> 8 ore) senza l'esplicito deterioramento del segnale. - Salvare i file di dati periodicamente con le informazioni di identificazione, come ad esempio la data, il genotipo e il tipo di cella registrata. A causa della grande quantità di dati che possono essere raccolti in una sessione di registrazione di successo, conservare la documentazione scritta in un laboratorio-book per l'analisi dei dati futuri.
Risultati
Il metodo di registrazione microelettrodo tagliente, adattata qui per l'occhio Drosophila, può essere utilizzato per quantificare attendibilmente neurale campionamento ed elaborazione nelle cellule della retina e lamina, e la comunicazione tra loro 4,5,7,8,10,33. Utilizzando per studiare la codifica in diversi titoli wild-type, mutanti o ceppi mosca geneticamente modificati, il metodo ha dimostrato il suo valore; non solo nel quantificare gli effetti di una mutazione, temperatura, dieta o espressione selezionata 3,4,6,9,10,14,30,34, ma anche nel rivelare motivi meccanicistici per comportamenti visivi alterati 14,34. Il metodo è anche facilmente applicabile ad altri preparati insetti 35,36, che abilita gli studi visione neuroethological. Poi abbiamo vetrina alcuni esempi delle sue applicazioni di successo.

Figura 7. TensioneRisposte di frutta mosca R1-R6 fotorecettore ad un impulso di luce a 20 e 25 ° C. Poiché le penetrazioni di microelettrodi taglienti sono spesso molto stabile, è possibile registrare le risposte di tensione della stessa fotorecettore R1-R6 ad un dato stimolo luce diverse temperature ambiente tramite riscaldamento o raffreddamento al volo. Nei nostri assetti, fly-custodia viene posta su un sistema di regolazione della temperatura close-loop-based Peltier-elemento. Questo ci permette di cambiare la temperatura testa della mosca in pochi secondi. Temperatura più elevata accelera le risposte di tensione e tipicamente riduce il potenziale di riposo dei fotorecettori R1-R6 (come indicato dalle frecce rosse). Clicca qui per vedere una versione più grande di questa figura.
Studiando l'effetto della temperatura sulla fotorecettori uscita
Con un ben progettato e sistema di registrazione vibrazioni isolato, il metodo può essere utilizzato per misurare l'effetto della temperatura sulla produzione neurali di una singola cella tramite riscaldamento o raffreddamento al volo. La proposta esempio mostra le risposte di tensione ad un luminoso lungo 10 msec impulso, registrata nello stesso fotorecettore R1-R6 a 20 e 25 ° C (Figura 7). Come quantificati prima di 4,9, il riscaldamento riduce il potenziale di riposo di un fotorecettore nel buio, e accelera le sue risposte di tensione.
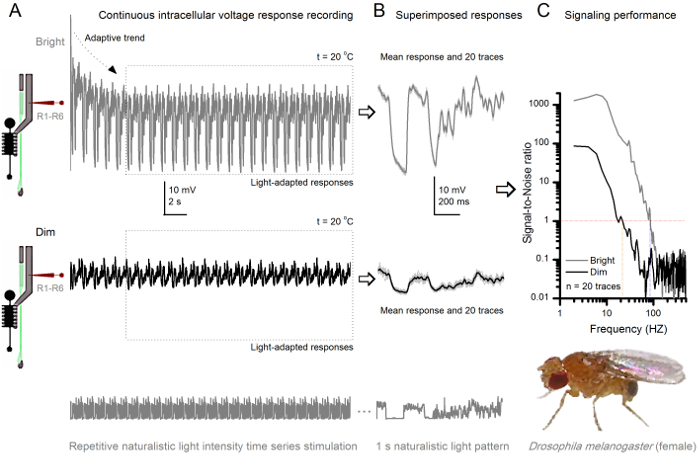
Figura 8. segnalazione delle prestazioni di un Fruit Fly R1-R6 fotorecettore migliora con intensità della luce (A) Uscita fotorecettore a dim (sotto) e luminosi. (Di cui sopra; 10.000 volte più luminosa luce) ripetuti naturalistico serie tempo l'intensità della luce registrata dalla stessa microelettrodonella stessa cella a 20 ° C. Le risposte allo stimolo luminoso sono più grandi, perché integrano più campioni, risposte elementari (dossi) a singoli fotoni 4,5,7,8. (B) 20 risposte tensione consecutivi di un secondo-lunghe sono sovrapposti. Risposte individuali (grigio chiaro) sono state prese dopo che le tendenze adattivi (freccia in A) si era ritirato (scatola tratteggiata in A). I mezzi di risposta corrispondente (segnali) sono le tracce più scure. La differenza tra il segnale e le risposte individuali è il rumore. (C) Le cellule 'prestazioni di segnalazione è stato quantificato dalle registrazioni' Signal-to-Noise Ratio (SNR) utilizzando i metodi standard di 4,5,7,8. Uscita fotorecettore ha circa 64 Hz più ampia gamma di segnalazione affidabile alla stimolazione luminosa ( '≥1 brillante, fino a 84 Hz rispetto alla dim (SNR SNR)' Dim ≥1, fino a 20 Hz), con signal-to-Noise Ratio migliorando notevolmente; da SNR Dim MAX = 87 a SNR luminoso MAX = 1.868. Fai clic qui per vedere una versione più grande di questa figura.
Studiare Adattamento e Neural codifica per Repetitive stimolazione
La non invasività del metodo, causando relativamente pochi danni alle strutture retina e lamina, lo rende ideale per studiare le prestazioni segnalazione di singole celle a differenti stimoli luminosi in loro prossimità stato fisiologico in vivo. La figura 8 mostra le risposte di tensione di un R1- R6 fotorecettore a una ripetuta serie naturalistica stimolo tempo l'intensità della luce fioca e luminoso a 20 ° C, mentre la figura 9 mostra le risposte di un'altra fotorecettori R1-R6 e LMC a un diverso stimolo naturalistico a 25 ° C. Le registrazioni pre-e post-sinaptici sono state eseguite separatamente da due mosche diverse perché simultanee registrazioni intracellulari di due taglienti microelettrodi nella stessa mosca, uno nella retina e l'altro nella lamina, sono troppo difficili da essere vitali 30.
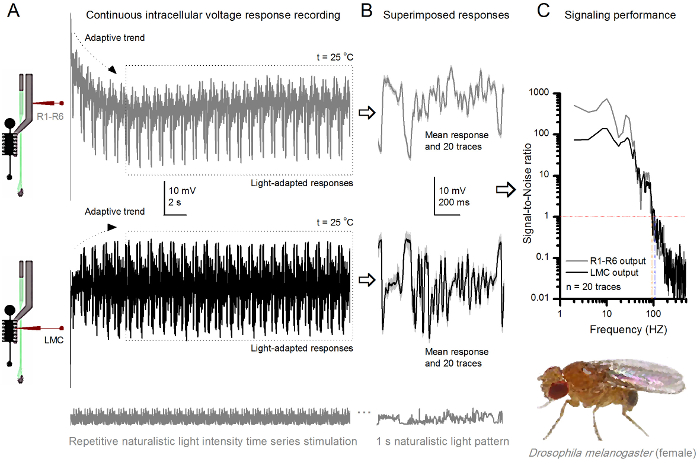
Figura 9. Le risposte di tensione di un frutto Fly R1-R6 fotorecettori e LMC a ripetuta stimolazione naturalistico a 25 ° C (A) R1-R6 (grigio) e LMC (nero) uscite registrate da diverse microelettrodi provenienti da diverse mosche. (B) 20 pre completamente luce-adattato consecutivi (sopra) e post-sinaptici (sotto) risposte al stesso modello di stimolo naturalistico con risposte individuali, mostrata in grigio chiaro und i corrispondenti mezzi di risposta (segnali) come le tracce più scure. La differenza tra il segnale e le risposte individuali è il rumore. (C) Le cellule 'prestazioni di segnalazione è stato quantificato dalle registrazioni' Signal-to-Noise Ratio (SNR). Uscita LMC ha circa 10 Hz più ampia gamma di segnalazione affidabile (SNR 'LMC ≥1, fino a 104 Hz) di uscita R1-R6 (SNR' R ≥1, fino a 94 Hz). Entrambi i rapporti segnale-rumore sono elevati (SNR LMC MAX = 142, SNR R MAX = 752), e come il rumore di registrazione era basso, le loro differenze riflettono le differenze di codifica reali tra le cellule. Cliccate qui per vedere una versione più grande questa figura.
Dopo l'esordio di stimolo, le registrazioni tipichely vedi veloce adattando le tendenze che in gran parte regrediscono entro 5-6 secondi. Da allora in poi, le cellule producono risposte altamente coerenti per ogni presentazione stimolo lungo 1 sec (ogni casella tratteggiata racchiude 20 di questi). La ripetibilità delle risposte diventa evidente quando questi sono sovrapposti (Figura 8B e Figura 9B). le risposte individuali sono le sottili tracce di grigio, e la loro media la traccia scura spessa. La risposta media è preso come segnale neurale, mentre il rumore neurale è la differenza tra la media e ogni 4,5,9,37,38 risposta individuale. I rispettivi rapporti segnale-rumore nel dominio della frequenza (Figura 8C e Figura 9C) sono stati ottenuti Fourier-trasformando il segnale e rumore blocchi di dati in spettri di potenza, e dividendo lo spettro di potenza del segnale medio con il corrispondente spettro di potenza del rumore medio 4, 5,9,37,38. Tipicamente, i rapporti massimi segnale-rumore of uscite neurali registrati alla stimolazione naturalistico sono elevate (100 - 1000), e nelle preparazioni più stabili con il rumore di registrazione molto bassa può raggiungere valori >> 1,000 (ad esempio, figura 8C.). Si noti inoltre che il riscaldamento espande le cellule 'larghezza di banda affidabile segnalazione 4 (SNR' luminoso ≥ 1); per esempio, la differenza relativa tra i due R1-R6S nelle figure 8 e 9, rispettivamente è 10 Hz (84 a 20 ° C e 94 Hz a 25 ° C).
Si può stimare ulteriormente tasso di ogni cellula del trasferimento di informazioni dal rapporto segnale-rumore utilizzando l'equazione Shannon 32, o calcolando la differenza tra entropia e rumorosità tassi entropia le risposte 'attraverso il metodo di estrapolazione tripla 39. Maggiori dettagli sulle informazioni analisi teoriche, e il loro uso e limitazionis specificamente con questo metodo sono riportati nelle pubblicazioni precedenti 7,8,39.
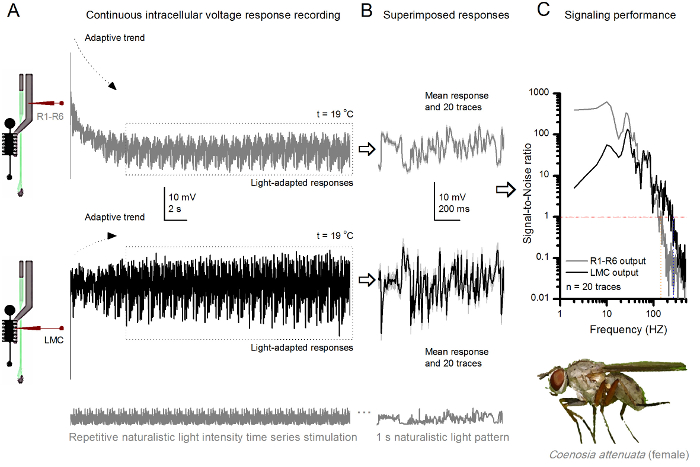
Figura 10. Le risposte di tensione di un Killer Fly R1-R6 fotorecettori e LMC a ripetuta stimolazione naturalistico a 19 o C. (A) R1-R6 (grigio) e LMC (nero) uscite registrate dalla stessa microelettrodo dallo stesso volo; prima postsinaptica e poi presinapticamente, come l'elettrodo è stato avanzato in un occhio. (B) 20 pre consecutive (sopra) e post-sinaptici (sotto) le risposte (tracce grigio chiaro) per lo stesso modello di stimolo naturalistico sono stati catturati dopo l'adattamento iniziale (scatola tratteggiata in A). I loro mezzi sono i segnali (le tracce più scure in alto), mentre le loro rispettive differenze nelle singole risposte danno il rumore. (C) La corrispondente Signal-to-Noise Ratio (SNR) sono stati calcolati come nelle figure 8C e 9C. Uscita LMC ha circa una gamma più ampia di 100 Hz segnalazione affidabile (SNR 'LMC MAX ≥1, fino a 234 Hz) di uscita R1-R6 (SNR' R MAX ≥1, fino a 134 Hz). Entrambi i rapporti segnale-rumore sono elevati (SNR LMC MAX = 137, SNR R MAX = 627), e come lo stesso microelettrodo è stato utilizzato nelle registrazioni, le loro differenze riflettono reali differenze nelle uscite neurali pre e post-sinaptici. Questi risultati implicano che il sistema di registrazione ha avuto a basso rumore, e la sua influenza sulle analisi è stato marginale. Cliccate qui per vedere una versione più grande di questa figura.
Neuroethological Studi Vision
Il metodo può anche essere usato per registrare le risposte pre e post-sinaptici tensione dagli occhi composti di diverse specie di insetti 7,8,35,36 (Figura 10), permettendo comparativi studi neuroethological di elaborazione delle informazioni visive. Per il sistema di registrazione presentata, l'unico adattamento richiesto è nuovo preparato detentori, ognuna con un'apertura opportunamente dimensionati per le specie studiate. Queste registrazioni sono esemplari da un killer di sesso femminile mosca (Coenosia attenuata). Essi mostrano risposte tensione intracellulari di un fotorecettore R1-R6 e LMC di identica stimolazione luminosa ripetitiva, usati per le controparti Drosophila in figura 9, ma a 19 o C. In questo caso, sia il pre e post-sinaptici dati sono stati registrati dal medesimo fly; uno dopo l'altro, con lo stesso elettrodo di registrazione (riempito con KCl 3 M) prima avanzando attraverso la lamina laterale prima di entrareing retina frontale. Rispetto ai dati Drosophila a 25 ° C, i dati Coenosia - anche alla temperatura cooler - mostra risposte con dinamiche più veloci; ampliando la gamma di segnalazione affidabile (segnale-rumore >> 1) su una gamma di frequenza più ampia. Tali adattamenti funzionali in codifica neurale di stimoli naturalistici sono in linea con lo stile di vita predatori Coenosia 's 36, che richiedono alta precisione le informazioni spazio-temporale per raggiungere i comportamenti di caccia aerei veloci.
Discussione
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier's recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine - having too high a resistance or intramural capacitance - to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode's time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer's solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax - if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas - picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips' electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today's optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells' electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Divulgazioni
The authors have nothing to disclose
Riconoscimenti
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ's current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
Materiali
| Name | Company | Catalog Number | Comments |
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30X eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| Nikon microscope | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| Newport | |||
| Micromanipulators | Narishige | Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| Huxley Bertram | Huxley xyz-axis with fine manual control | ||
| Sensapex | Sensapex triple axis | ||
| Märzhäuser | Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3 - 0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
Riferimenti
- Meinertzhagen, I. A., O'Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C., Ottoson, D. . Progress in Sensory Physiology. 5, 1-79 (1985).
- Borst, A. Drosophila's View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) - Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron - Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. . Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173 (2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon