Method Article
Электрофизиологические Способ записи ответов внутриклеточный амперных
В этой статье
Резюме
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Аннотация
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell's receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator's experimental objectives, it grants outstanding in vivo neurophysiological data.
Введение
Плодовой мушки (дрозофилы) соединение глаз является прекрасной модельной системой для изучения функциональной организации фоторецепторов и интернейронных массивов для нейронной выборки и обработки изображений, а также для животных видения. Система имеет наиболее полную электросхему 1,2 и любезен с генетическими манипуляциями и точного мониторинга нейронной активности (высокого отношения сигнала к шуму и временным разрешением) 3-10.
Глаз дрозофилы имеет модульную конструкцию, содержащий ~ 750 , казалось бы , обычные линзы шапками структуры , называемые омматидии, которые в совокупности обеспечивают весь панорамный поле зрения , которая охватывает практически все направления вокруг его головы. Первичная информация Оком выборки единиц являются его rhabdomeric фоторецепторы 7,8,11. Каждый омматидий содержит восемь фоторецепторов (R1-R8), которые совместно используют один и тот же объектив, но фасетки выравниваются по семи различным направлениям. В то время как внешние фоторецепторов R1-R6 аре наиболее чувствительны к сине-зеленый свет, спектральные чувствительности внутренних клеток R7 и R8, которые лежат друг на друга и указывают на ту же сторону, демонстрируют три отличительные подтипы: бледный, желтый и спинные площадь обода (ДРА) 12- 15.
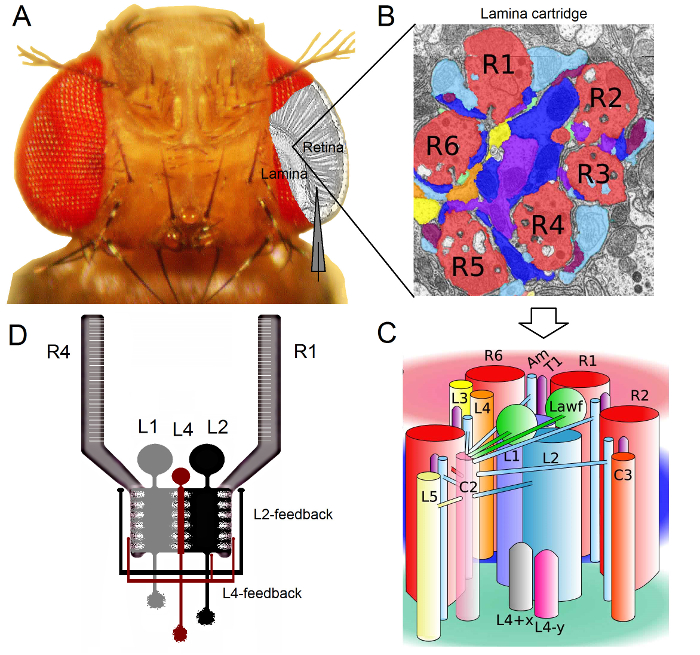
Рисунок 1. Функциональная организация Drosophila Eye. (A) Два первых оптических ганглиев, сетчатка и пластинкой, выделены серым цветом внутри летучей глаз. Сетчатка R1-R6 фоторецепторы и ламинированным Большие Монополярные клетки (LMCS: L1-L3) легко доступны в естественных условиях с обычными острыми записи микроэлектродов. Схематическое электрод выдвигает на первый план нормальный путь для записи из R1-R6 в сетчатке. Один путь для записи с LMCS в листовых пластинок является смещение параллельно электрода налево. (В) Lamina представляет собой матрицу retinotopically органанализованных картриджи, каждый из которых упакован с нейронами, которая обрабатывает информацию от конкретной небольшой области в визуальном пространстве. Из-за нервного суперпозиции, шесть фоторецепторы из разных соседних омматидиев послать свои аксоны (R1-R6) к тому же пластинкой картриджа, образуя гистаминэргических выходные синапсы в L1-L3 и амакринных клетки (Am). (C) Распространение нейронной информации между R1-R6 аксонов и визуальных интернейронов (включая L4, L5, Lawf, C2, C3 и T1), внутри тонким слоем картриджа является сложным. (D) R1-R6 фоторецепторов аксоны получают синаптические обратные связи от L2 и L4 монополярных клеток. (В) и (С) редактировался Ривера-Альба и др 2. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Глаз дрозофилы нервного типа суперпозиции 16. Это означает, что тшляпа нервные сигналы восьми фоторецепторов, принадлежащих к семи соседних омматидиев, которые выглядят в той же точке в пространстве, объединены вместе в одной нейронной картриджа в течение следующих двух neuropils: листовой пластинки и костный мозг. В то время как шесть внешних фоторецепторы R1-R6 проекта их аксонов к нейронным колонн в листовых пластинок (рис 1), R7 и R8 клетки обходят этот слой и сделать синаптические контакты с их соответствующими продолговатый столбец 17-19. Эти точные электропроводок производят нейронную субстрат для retinotopic отображения мух раннего видения, после чего каждую пластинку (рис 1A-C) и мозговое колонку (картридж) представляет собой единую точку в пространстве.
Прямые входы из R1-R6 фоторецепторов получены крупными монополярной клеток (LMCS: L1, L2 и L3) и амакриновые клетки (Am) в пластинкой 1,2,20. Из них, L1 и L2 являются крупнейшие клетки, опосредующие основные информационные пути (рис 1D), бееч реагируют на внебалансовой и перемещения краев, и , таким образом , образуют вычислительную основу детектора движения 21,22. Поведенческие эксперименты показывают , что при промежуточном противоположность этому , эти два пути облегчения восприятия движения в противоположных направлениях: спина к передней в L1 и спереди-назад в клетках L2 23,24. Связь также подразумевает , что нейроны могут L4 играть решающую роль в боковой связи между соседними патронами 25,26. Взаимные синапсы были обнаружены между клетками L2 и L4, расположенных в том же самом и двух соседних картриджей. Вниз по течению, каждая ячейка L2 и три ассоциированные клетки L4 проецировать свои аксоны к общей цели, нейрон Tm2 в мозговом веществе, где входы от соседних патронов , как полагают, быть интегрированы для обработки движения фронта к спине 27. Хотя L1 нейроны получают входной сигнал от же картриджем L2S как через щелевые контакты и синапсов, они не связаны непосредственно с L4S и, следовательно, соседних листовых пластинок картриджей.
Synaptic обратные связи в R1-R6 фоторецепторов аксонов обеспечиваются только нейронами , принадлежащими к / L4 цепей L2 , но не L1 пути 1,2 (рис 1D). В то время как соединения тот же Кассетноые выборочно из L2 в R1 и R2, и от L4 до R5, все фоторецепторов R1-R6 получают синаптические обратную связь от L4 любого или обоих соседних патронов. Кроме того, существуют сильные синаптические соединения от Am к R1, R2, R4 и R5, а также глиальные клетки , также синаптически подключены к сети , и таким образом , может принимать участие в нейронной обработки изображений 6. Наконец, аксонов гэп-перекрестки, связывающие соседние R1-R6 и между R6 и R7 / R8 фоторецепторов в пластинкой, способствуют асимметричного представления информации и обработки в каждом картридже 14,20,28.Внутриклеточные записи напряжения от отдельных фоторецепторов и визуальных интернейронов в почти неповрежденном дрозофилы обеспечивают высокое отношение сигнал-шум гДанные ATIO при разрешении 3,5,7-10,29 суб-миллисекунды, которая необходима для создания ощущения быстрых нейронных вычислений между связанных нейронов. Такой уровень точности невозможно по текущим оптических методов визуализации, которые значительно шумнее и, как правило, работают на 10 - 100 мс разрешением. Кроме того, поскольку электроды имеют очень маленькие и острые кончики, метод не ограничивается тела клеток, но может обеспечить прямые записи с небольших активных нервных структур; такие как дендритные деревьев LMCS 'или фоторецепторов аксонов, которые не могут быть доступны гораздо больших наконечников патч-зажим электродов. Важно отметить, что метод также структурно менее инвазивными и разрушительными, чем большинство приложений патч-зажим, и таким образом влияет меньше внутриклеточной среды и информационной выборки Исследуемый клеток. Таким образом, традиционные острые методы микроэлектродные способствовали и продолжают способствовать, фундаментальные открытия и оригинальные понимание нейронной инфоробработка формация в соответствующем масштабе времени; улучшение нашего понимания механистического видения 3-10.
В данной статье описывается , как в естественных условиях внутриклеточных записей от дрозофилы R1-R6 фоторецепторов и LMCS выполняются в лаборатории Juusola. Этот протокол описывает, как построить подходящий электрофизиологии буровой установки, подготовить муху, а также выполнять записи. Некоторые представительные данные представлены и некоторые общие проблемы и возможные решения обсуждаются, которые могут возникнуть при использовании этого метода.
протокол
Следующий протокол соответствует всем рекомендациям по уходу за животными Университета Шеффилда и Пекинского педагогического университета.
1. Реагенты и оборудование Подготовка
- Запись и настройка светостимуляции оборудование
- Выберите по крайней мере область записи 2,5 х 2,5 м для проведения электрофизиологических экспериментов в комнате с кондиционером с регулируемой влажностью и средства для обеспечения темных условий съемки. Убедитесь в том, что эта область является достаточно большим, чтобы удобно соответствовать: (I) 1 х 1 м таблицу вибрационной изоляции, где находится буровая установка [муха стимуляции и устройство записи], стереомикроскопа и источник холодного света с двумя гусиными шеями, все приложенные в пределах большой> 180 см высотой клетки Фарадея; (Б) а 38U оборудование стойки для размещения персонального компьютера с плоским ЖК-монитор, усилитель микроэлектродов, светодиодные драйверы, фильтры, блоки управления температурой, осциллографов и других необходимых электрических приборов; и (III) анебольшой письменный стол и стул для исследователя.
- Поместите вышке вдали от электрических и механических источников шума, таких как холодильники, центрифуг и лифтов. Используйте отдельные устройства защиты от перенапряжений для защиты электрических устройств буровой установки от скачков напряжения, возникающих в питающей сети. В идеале подключить буровой установки к собственному источнику бесперебойного питания (ИБП) батареи для минимизации шума.
- Построить коническую флай-держатель из латуни и черного пластика (рисунок 2). Дрель небольшое отверстие заострения через блок из латуни с его внешним ободом сужением до ~ диаметром 0,8 мм (соответствие ширины грудной клетки типичного мухи).
Примечание: Это отверстие должно сужаться в направлении кончика муху держателя так , что больше , чем в среднем у дрозофилы, который проецируется снизу воздушным потоком, застревали плечом глубоко в верхнем ободе. - Проектирование и строительство механически прочной, но точный, муха стимуляции и устройство записи (рисунок 3). Построить из Oе алюминий или латунь (высокая проводимость металлов) муха подготовка площадки полюса и вокруг него система Кардан рычага с внедренными шарикоподшипников, чтобы обеспечить плавное и точное х, у-позиционирования и фиксации светового стимула.
Примечание: Эта интегрированная композитная конструкция сводит к минимуму механические вибрации, которые в противном случае могут сместить кончик электрода записи из исследуемой клетки. Он может дополнительно включать в себя на основе Пельтье-элемента системы контроля температуры замкнутого контура, что позволяет исследователям использовать чувствительные к температуре генетические конструкции, такие как shibire TS, для оценки синаптических расчетов схемы 9,30. Anodize аппарат или краски его черным, чтобы минимизировать разброс светового стимула.- Закрепить стимуляцию летать и устройство записи на макете таблицы безвибрационными в; например, M6-болтами, используя свои метрические резьбовые отверстия. Используйте черный макет или покрыть ее черной тканью, чтобы свести к минимуму рассеяния света в ходе экспериментов.
- Положения ип и блокировка (с помощью стопорного винта) регулируемое по вертикали подготовки муха платформы полюс в центре системы карданного руки. Поместите маховое препарат (в пределах муху держателя, см шаг 2) на платформе полюса так, чтобы источник света прикреплен к карданным руки в радиальном направлении указывает на голову мухи. Убедитесь в том, что центр летучей глаз точно в точке пересечения (0, 0) х- карданного-Arm и у-осей, так как это позволяет точно х, у-позиционирование светового стимула к любой точке в пределах мухи поле зрения.
Примечание: Эта функция необходима для отображения свойств отклика отдельных клеток в определенных местах для глаз, например, при поиске электрофизиологических доказательств для структурных приспособлений, таких как яркие или острых зон, которые показали бы более глубоком осознании или разрешение, соответственно 31.
- Установить стереомикроскопа позади стимуляции лету и устройство записи на столе антивибрационной такчто она обеспечивает удобный просмотр с высоким увеличением мух глаза.
- Установите холодный источник света на верхней части микроскопа с полужесткие моноблочная световоды со сдвоенной головкой источника света, указывая вниз по направлению к держателю препарата муха. Свободно перемещающийся два луча подсветки облегчает визуализировать записи Верх электрода при движении его через небольшое отверстие в лету глаз.
- Прикрепите соответствующий х, у, г-Микроманипулятор набор (грубой и тонкой) для записи электрода и головной ступени на столе антивибрационные, на правой стороне муха стимуляции и записи устройства, с помощью M6-болтов или магнитной стоит.
Примечание: В лаборатории Juusola различные буровые установки оснащены различными манипуляторами; Для получения дополнительной информации смотри таблицу материалов и реагентов. Все они обеспечивают высокое качество внутриклеточные записи. - Смонтировать небольшой ручной 3-осевой микроманипулятора для держателя электрода сравнения на вертикально регулируемой FLY подготовка площадки полюс. Сориентируйте эталонный электрод так, чтобы он направлен в сторону подготовки мух.
- Построить свободно стоящую светозащищенные клетку Фарадея из стальных панелей вокруг стола антивибрационные, окружающая муха стимуляции и устройство записи, чтобы предотвратить внешнее электромагнитных помех. Оставьте переднюю часть клетки открытым, обеспечивая доступ к транспорту подготовки лету для экспериментов. Приложить черные шторы из ткани (имеющие медь- или алюминиевой сетки, имплантированных в них для заземления) на передней панели, чтобы оградить от шума и света. Краска интерьер клетки черного цвета, чтобы свести к минимуму рассеяния света и болт ноги клетки на полу, чтобы предотвратить вибрации.
- Подключение напряжения и тока выходы высокого импеданса усилителя внутриклеточная микроэлектродов на входы двух отдельных фильтров нижних частот (Бесселя или аналогичный) с помощью BNC-кабелей. Точно так же, соедините выходы фильтра в соответствующие каналы AD-разъем БлоCKS / платы системы сбора данных (DA / AD карт). Подключите / AD карту (ы) DA в персональный компьютер с помощью специализированных кабелей, в соответствии с руководствами поставщика.
- Установите соответствующее программное обеспечение сбора данных для системы сбора данных выбора на персональном компьютере. Убедитесь в том, что драйверы сбора данных совместимы с операционной системой на персональном компьютере.
- Цокольный электрически стимуляция муха и устройство записи, клетка Фарадея, медная сетка (в пределах шторы), микроскоп, микроманипуляторы, холодный источник света, 38U оборудование стойки со всеми своими инструментами (внутриклеточный усилитель, фильтры, блок контроля температуры, ПК и ЖК-монитор и т.д.) к одной центральной точке заземления, используя провод заземления оборудования и M6 обжимного кольца заземления концы. Используйте электрический мультиметр для проверки, что все части находятся в одном месте.
Примечание: Для достижения наилучших условий съемки с низким уровнем шума, конфигурации заземления обычно изменяются сюдам один комплект-до другой.- При необходимости, подключить центральную точку заземления дополнительно к строительной площадке, и / или центральная площадка микроэлектрода усилителя. После тестирования полностью функционирующей системы во время реальных электрофизиологических экспериментов, должны быть готовы изменить конфигурацию заземления в случае необходимости, чтобы минимизировать шум в записях.
- Настройка программного обеспечения усиления (1 - 10X), фильтрацию сигналов (обычно ФНЧ при 500 Гц, которая подходит как для данных R1-R6 и LMC), а также частоты дискретизации (по крайней мере, 1 кГц). Убедитесь , что параметры подчиняются Теорема Котельникова 32; например, при получении данных, которые нижних частот фильтруют при 500 Гц, используют частоту дискретизации 1 кГц или выше, чтобы свести к минимуму эффект наложения спектров.
- Поскольку характерные реакции напряжения R1-R6 фоторецепторов являются 40 - 65 мВ, а те из LMCS 20 - 45 мВ, установите усиление и отображение шкалы соответственно для включения высокого разрешения sampliнг и данные визуализации.

Рисунок 2. Коническая Fly-держатель Муха-держатель выполнен из двух частей:. Центральный блок из латуни и его конической формы из черного пластика пальто. Центральное отверстие внутри блока латунной суживается до небольшого диаметра , который едва позволяет летать через. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Обзор электрофизиологических Рог. Настроечный содержит свободно стоящую светозащищенные клетку Фарадея, таблицу антивибрационный, муха стимуляции и устройство записи и черной ткани шторы с медь- или алюминиевой сетки внутри для заземления. Входыtrument стойка электрически соединена с той же центральной земли со всем оборудованием внутри клетки Фарадея. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Перерабатывающие микроэлектродов
- Потяните опорный микроэлектрода от филаментированных боросиликатного (наружный диаметр: 1,0 мм; внутренний диаметр 0,6 мм) или из кварцевого стекла (наружный диаметр: 1,0 мм; внутренний диаметр 0,5, 0,6 или 0,7 мм) трубки с помощью пипетки съемник инструмента. Постарайтесь добиться короткий постепенное сужение.
Примечание: Точные настройки программы пипетка съемника варьируются от прибора к прибору; Более подробную информацию в таблице материалов и регентов. Размер пор в наконечнике не имеет решающего значения, так как кончик электрода будет сломана перед вставкой в подготовке мух. - Потянуть микроэлектрода записи от филаментированных боросиликатного (наружный диаметр: 1,0 мм; внутренний диаметр 0,6 мм) или из кварцевого стекла (наружный диаметр: 1,0 мм; внутренний диаметр 0,5, 0,6 или 0,7 мм) трубки с помощью пипетки съемник инструмента. Постарайтесь достичь длинный (10 - 15 мм) штраф постепенное сужение.
- Проверьте с помощью светового микроскопа, что регистрирующие электроды показывают правильную сужающийся. Установите электрод на предметное стекло с формовочной клеем и использовать цели 40X воздуха, чтобы осмотреть его наконечник.
Примечание: Хороший электрод не сужается гладко, пока его незримо небольшой наконечник, вокруг которого непрерывная параллельно темнее, а светлые интерференционные картины можно увидеть. Некоторые параметры съемник генерируют высокие электроды сопротивления, которые не могут привести к успешных прорывов клеток, потому что их советы напоминают "трубы". Таким образом, визуальный осмотр электродов имеет важное значение. - Прикрепите электроды в горизонтальном положении на большой чашки Петри с пластилином (или аналогичного формовочной клея) для безопасного хранения и транспортировки к электрофизиологии буровой установки. Убедитесь в том, что электрод Подсказкиповторно всегда в воздухе, и не случайно касаясь ничего.
- Back-заполнить записи и опорные электроды непосредственно перед экспериментом с соответствующим раствором соли. С помощью небольшой 5 мл шприц, соединенный с небольшим фильтром частиц с тонким пластиковым наконечником (например, microloader).
- Для фоторецепторов экспериментов, заполнения электрода записи до полного (капелька формы в ее большом конце) с 3 М KCl, как это решение сводит к минимуму влияние жидкости перехода потенциала к записанному напряжения.
- Для исследования гистаминэргических LMCS, которые реагируют на синаптические вход от R1-R6 фоторецепторов хлоридом-Проводимость изменений, заполняют регистрирующие электроды с 3 М ацетата калия и 0,5 мМ KCl, поскольку это решение оказывает меньшее влияние на батарее хлорида клетки. Заполните электрод сравнения с зольной Ringer, содержащий в мМ: 120 NaCl, 5 KCl, 10 TES (C 6 H 15 NO 6 S), 1,5 CaCl 2, 4 MgCl 2, и 30 сахарозы 5.
- Проверьте сопротивление вновь запряженных электрода записи в системе записи.
- Убедитесь в том, что серебряные провода внутри электрода держателей равномерно покрывают хлоридом серебра (появление пурпурно-серый - не блестящая серебристая), чтобы свести к минимуму записи артефактов (например, дрейф в потенциале перехода). Если нет, то замените их правильно chloridized проводов.
- При необходимости, chloridize новые серебряные провода. Тщательно очистите провода (за счет быстрого прохождения их через пламя), так что они появляются ярко-серебристого цвета. Избегайте касаний пальцами, для того, чтобы внести на ровный слой AgCl. Замочите провода в полную силу отбеливателя в течение 15 - 30 мин, пока они не появляются фиолетовый-серый цвет. В качестве альтернативы, гальванизирует каждый провод (сделав его положительным по отношению к раствору , содержащему 3 М КСl и пропускание тока через нее со скоростью 1 мА / см 2 площади поверхности) в течение 10 - 15 секунд до тех пор , пока адекватно покрыта.
- Подключите обратно заполненные записи и опорные электроды к их электродных держателей. Поместите ванну раствора маленького Рингера на вертикально регулируемой подготовки муха платформы полюса. Привод кончиков электродов в раствор Рингера и измерьте сопротивление наконечника записывающего электрода.
Примечание: Этот шаг необходим только при тестировании резистивных свойств электродов, которые вытягивают из новой партии стеклянной трубки, или при оптимизации программ прибора микроэлектродный съемника через итерации. - Перед выполнением измерений сопротивления, прочтите инструкции в руководстве при изготовлении усилителя для соответствующих настроек измерений. Для хорошей записи электрода, имеют сопротивление кончика ~ 100 - 220 МОм.
- Потяните опорный микроэлектрода от филаментированных боросиликатного (наружный диаметр: 1,0 мм; внутренний диаметр 0,6 мм) или из кварцевого стекла (наружный диаметр: 1,0 мм; внутренний диаметр 0,5, 0,6 или 0,7 мм) трубки с помощью пипетки съемник инструмента. Постарайтесь добиться короткий постепенное сужение.
2. Подготовка дрозофилы
- Соберите 5 - 10 дней мух (после вылупления) и поместить их в чистую пробирку, содержащую летучей улandard пищи. Можно добиться хороших записей с младших мух тоже, даже из "новорожденных"; но из-за их более мягких глаз, отрезания роговичный отверстие для записи электрода является более трудным.
- Построить муху ловить трубку и подготовка летучей стенд (рисунок 4). Смотрите рисунок 4 для общей идеи о том , как эти самодельные инструменты были объединены.
- Для того, чтобы муху ловить трубку, отрезать кончик коническим днищем 50 мл пластиковые центрифужные трубки. Затем вставьте и приклейте большой конец 1 мл кончика пипетки на этом новом открытии.
- И, наконец, вырезать маленький конец пипетки до размера, который легко позволяет летать с помощью ходьбы. Обратитесь к механической мастерской, чтобы собрать небольшую летучую подготовительный этап, который позволяет вращение и блокировка зольной держателя на разных позициях 2-осей.

Figurе 4. Инструменты и придумывает необходимо для создания Fly подготовки. Fly ловли трубка сделана наклеиванием 1 мл пластиковой пипетки 50 мл пластиковые центрифужные пробирки. Bespoke подготовка муха стенд позволяет свободное вращение-и блокировка мух держателя в предпочтительном положении для приготовления летать. Муха фиксируется пчелиным воском, используя электрический восковую нагреватель. Вазелин наносится небольшой аппликатор осуществляется посредством соединения толстый сортировки волосы на ручке. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Собирают муху для эксперимента в кончике пипетки 1 мл, который едва позволяет летать, чтобы соответствовать через. Приложить муху ловить трубку с наконечником пипетки на нем, к лету трубки. В ловле мух, воспользоваться присущей им тенденцией подниматься вверх (antigravitaxis) в наконечник пипетки. Предпочтительно, чтобы выбрать самую большую женщину, как размер материиs в электрофизиологии.
Примечание: Чем больше муха, тем больше его клетки и тем больше шансов на высокое качество внутриклеточных записей. Более мелкие мухи (как самки и самцы) могут также обеспечить отличные записи, но подготовка труднее сделать. После того, как муха в ловушке большой пипетки, не забудьте закрыть всплывающую трубку, чтобы остановить других мух от побега. - Подключение 100 мл шприца с гибким пластиковым шлангом к большему отверстие наконечника пипетки - с лету до сих пор в нем.
- Поместите узкий конец на большой кончик пипетки, которая расширенного просто позволить дрозофилы через, к отверстию в нижней части зольной держателя и выдавить небольшое количество воздуха из шприца , чтобы извлечь муха в лету держателя ,
- Посмотрите через стереомикроскопа и осторожно вводить больше воздуха, пока голова мухи не выступает из конического конца летучей держателя. Убедитесь в том, что муха прочно в ловушке из его грудной клетки к маленькому ОПЕнин на верхней части зольной держателя.
- Используйте нагреватель воска, чтобы закрепить муху с пчелиным воском от своих «плечи» к лету держателя. Отрегулируйте температуру воска нагревателя, чтобы быть как можно более низким еще чисто плавления воска.
Примечание: Если температура правильная, воск кажется прозрачным. Слишком высокая температура делает воск "сгорать"; слишком низко держит воск жесткой. При креплении муху, быть точным и кратким при длительном воздействии тепла может привести к его повреждению. Использование светоотверждаемый зубной клей не рекомендуется здесь, как его применение является слишком медленным.

Рисунок 5. Подготовка Fly для экспериментов в естественных условиях. Слева, Голова Drosophila 'ю.ш. расположена прямо в муху держателя и фиксируется от его хобота, правого глаза и плечи к лету держателя с подогревом ВЕeswax. Правильно, Небольшое отверстие вырезается в самой толстой части глаза, чуть выше экватора , и лишь немногие омматидиев от задней кутикулу, используя острый край бритвы. Кусок роговицы осторожно удаляют , а отверстие закупоривается вазелином , чтобы предотвратить глаз от высыхания. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Зафиксировать голову мухи. Применение пчелиного воска к хоботка (рисунок 5) и угла правого глаза, избегая роговицу, и зафиксировать голову от этих точек на лету держателя.
- Произведите микро-нож. Зажмите без нержавеющей стали бритву с двумя лезвиями держателями / выключатели (как с плоской рукояткой) и трещины небольшую полоску ее острым краем. Для здоровья и безопасности, используйте защитные очки для защиты глаз (хотя это весьма маловероятно, что куски бы рикошетом, когда бритва треснул). Идеально,производят острый край бритвы, который напоминает шпилем. Убедитесь в том, что это "Шпиль" прочно прикреплен к лопасти держателя, но будьте осторожны, чтобы избежать каких-либо самоповреждения!
- Использование микро-нож, подготовить небольшой размер отверстий несколько омматидиев в левом глазу мухи - около 4 - 5 омматидиев из спинной кутикулы чуть выше экватора глаза, чтобы обеспечить проход для микроэлектродом записи. Выполните под стереомикроскопа, рассматривая препарат с большим увеличением.
Примечание: Так как муха глаз чувствует себя упругой и стойкая к зондировании, отверстие лучше всего вырезать с "шпилем" гамма-ножа. Техника резки довольно сложно, поэтому обратите пристальное внимание на демонстрации видео. Сохраняя муха держателя в определенных направлениях (при подготовке стенда летать) может сделать рассечение проще. Первоначально микрохирургии может чувствовать себя трудно учиться, но когда-то совершили, нейронная адаптация постепенно улучшается исследователя 3D-восприятие и ловкость. - ралить тщательно маленький кусочек роговицы из отверстия, которое было просто вырезать, обнажая сетчатку снизу. Стремительно закрыть отверстие в глаза с крошечной каплей вазелина, используя тонкие волосы из вазелина аппликатором.
Примечание: Вазелин обслуживает несколько ролей здесь. Это предотвращает обезвоживание тканей и коагуляции гемолимфы, что нарушило бы вставленной записи электрода. Она также кстати пальто микроэлектродом, уменьшая его очный емкость. Это может улучшить частотные характеристики системы записи, и поэтому временное разрешение записанных нейросигналы. Избегать размазывания вазелин над остальной части глаза, как это размывает оптики.
3. Запись с R1-R6 фоторецепторов или LMCS
- Всегда быть заземлены при работе усилителя микроэлектродного (например, прикоснувшись к металлической поверхности клетки Фарадея или таблицы антивибрационные), так как это исключает один из случайно поставитьING статический заряд на головной стадии, которая может привести к повреждению схемы.
- Осветите подготовки муха платформы полюс сверху двух гузнек световодов (фиг.6а) (с источником холодного света внутри клетки Фарадея) , так что муха-держатель может быть размещен на полюсе в предпочтительном положении под пристальным визуальным контролем ,
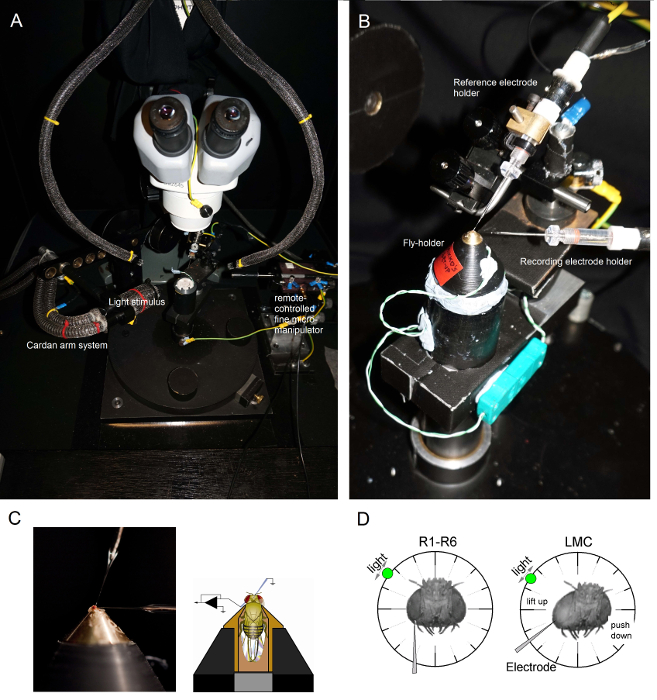
Рисунок 6. Позиционирование Муха-держатель и электроды для экспериментов (AB) Муха-держатель размещают на платформе записи , которая также обеспечивает регулирование температуры с помощью элемента Пельтье (A: белый круглый платформы в центре).. Карданного рука дает точное позиционирование светового раздражителя на равном расстоянии (через х, у-вращения) вокруг лету, с источником света (жидкость или кварцевый волоконно-оптический пучок конца) непосредственно указывая на его глаза. Во многих из НУг буровые установки, световая стимуляция генерируется с помощью светодиодов (с линейными тока водителей) или с помощью монохроматора. Таким образом, их стимулы носят специфический (полосам) прошел спектральный состав, выбранный между 300 - 740 нм и крышка 4 - 6 журнала диапазон Единица измерения интенсивности (как ослабляется отдельных фильтров нейтральной плотности). (C) Два микроэлектродов, управляются отдельными микроманипуляторами, расположены в головке зольной: электрод сравнения (выше) через глазков; электрод записи (слева) через небольшое отверстие в левом глазу. (D) для получения максимального количества фоторецепторов записей, микроэлектрода запись забивают в отверстие, параллельных оси хобот-глазка. Когда кончик электрода проникает и герметизирует фотоэлектрического элемента, свободно вращающийся источник света закреплен на положение, в котором клетка производит максимальный отклик напряжения на заданный световой раздражитель. Эта точка в пространстве лежит в центре рецептивного поля клетки. Если отверстие Iы близко к кутикуле, LMC проходки может дополнительно быть достигнуто с таким же углом электрода (слева). Если отверстие дальше от кутикулы, еще один полезный угол электрода подход для получения записей LMC также показан (справа). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Установить маховое держатель (с мухой в нем!) На лету подготовка платформы полюса. Поверните маховое держатель так , чтобы левый глаз мухи непосредственно перед следователем (Рисунок 6B).
- Вставьте тупой электрод сравнения мягко через occelli мухи в головной капсулы с использованием небольшого грубого микроманипулятор при наблюдении препарата через стереомикроскопа (6С). Не толкайте электрод слишком глубоко, так как это может привести к повреждению мозга мухи.
- В качестве альтернативы, вставьте электрод в задней части грудной клетки, Всегда убедитесь, что муха появляется вересковый (перемещает его усики) и его глаза нетронутыми; Не случайно повреждены. Если препарат выглядит менее безукоризненно, подготовить новую муху для экспериментов.
- Драйв резкое микроэлектрода записи в левый глаз через вазелином покрытые небольшое отверстие, подготовленный ранее. Используйте большое увеличение в стереомикроскопа и переместить световоды и фокальной плоскости так, что расположение рабочего конца электрода становится очевидным в 3D его картин отражательной способности.
Примечание: На рисунке показано , как 6D голова мухи должны быть слегка расположены по- разному (в отношении к углу микроэлектрода записи попадает в глаз) для фоторецепторов и записей LMC. Вождение электрод в глаза, не нарушая его самый трудный этап эксперимента. Если кончик электрода попадает в небольшое отверстие в глазу, попав на роговицу, он обычно ломается. - Включите усилитель микроэлектродовкак только оба электрода плотно внутри препарата, в электрическом контакте с жидкостями тела мухи.
- Выключите холодного света источник (внутри клетки Фарадея) и отключите его от сети. Подключите его штекер к центральному землю, чтобы свести к минимуму наземного контура индуцированный электрический шум, и переместить световоды гузнек прочь так, что система карданного рука может свободно перемещаться по всему лету. Выключить освещение в комнате, чтобы гарантировать, что препарат муха сейчас находится в относительной темноте.
- Измерьте сопротивление электрода записи в глаза (как указано в руководстве пользователя усилителя). Используйте только регистрирующих электродов, в которых сопротивление составляет 100 - 250 МОм.
Примечание: Это практически невозможно добиться высокого качества внутриклеточные записи на <70 МОм электрода. Если сопротивление <80 МОм, вполне вероятно, что кончик электрода нарушается. В этом случае выключите усилитель и изменить записи электрода.- После того, как электродзаменяется и в глаза, включить усилитель для измерения его сопротивления. Иногда, наконечник электрода может перекрыть какой-то детрит, как он входит в ткань. Это может быть исправлено с помощью емкостного Базз и импульс тока функции усилителя, что, как правило, ясно, что быстрым резонирование или отталкивания.
- Установите усилитель тока-зажим (CC) или в режиме записи моста. Отменить любую произвольную разность потенциалов между записывающими и электродов сравнения, поскольку оба из них сейчас отдыхает в электрически соединены межклеточное пространство, путем установки сигнала смещения (напряжение записи) до нуля. Следуйте сигнала смещения изменения, используя вывод данных на дисплей усилителя или экране осциллографа.
- Подождите 2-3 мин для мух глаза до темно адаптироваться.
- Ведите записи электрода кончик постепенно глубже в глаза с небольшими шагами микронных от 0,1 до 1. Делайте это с оси х пьезо-шаговых удаленного управлением микроманипулятора или бу осторожно вращая ручку точного разрешения ручного манипулятора.
- Стимулируют муха глаз с кратким (1 - 10 мс) вспышек света в качестве электрода записи выдвигается в ткани.
Примечание: Если электрод записи установлен в сетчатке и функции глаза нормально, каждый вспышка света вызывает короткое и небольшое падение напряжения (0,2 - 5 мВ гиперполяризации), называется электроретинограмму (ЭРГ). Это изменение в поле потенциала внеклеточного пространства обусловлена коллективным ответом клеток к сетчатке глаза "на свету. Однако, как только кончик электрода входит в пластинку, закрывая на LMCS, ЭРГ меняет, показывая деполяризующими ответов. - Перемещение источника света вокруг глаз мухи с помощью системы карданного руки и найти место, где свет вызывает большой отклик ERG.
Примечание: Эта позиция отмечает небольшую область в визуальном пространстве, где фоторецепторы (или LMCS), которые расположены рядом с кончиком электрода записи, Образец их легкий вход. - Проникнуть ячейку с электродом записи.
Примечание: Проникновение может происходить спонтанно, или, когда электрод микро-шаг вперед. Он может быть дополнительно облегчается аккуратным постукиванием системы Микроманипулятор или с помощью гудение-функции усилителя; Эти действия резонировать кончик электрода в ткани. Когда электрод пронзает фоторецепторов мембрану, введя его внутриклеточное пространство, разность напряжений между записью и электрода сравнения резко падает от 0 мВ до ~ -65 мВ (между -55 и -75 мВ); в то время как во время LMC проходок, это падение, как правило, меньше (от -30 до -50 мВ). Эти различия напряжения представляют собой отрицательные потенциалы упокоения данной клетки. В зависимости от качества записи электрода (заточку) и клеточного процесса проникал, показание напряжения от регистрирующего электрода может быстро или постепенно стабилизироваться потенциала покоя, в качестве клеточной мембраныУплотнения к наружному слою электрода. Но если проникновение происходит лишь частично или беден, электрод обычно выскальзывает из ячейки с записанной потенциальной восхождений обратно к нулю. - Локализуйте центр рецептивного поля пенетрирован- клетки, когда электрод появляется герметичны, показывая стабильный мембранный потенциал (темный потенциал покоя). Переместите мигающий световой стимул вокруг глаз мухи, с использованием системы карданного руки, чтобы найти точку в визуальном пространстве, где вспышка света вызывает максимальный отклик напряжения ячейки. Зафиксировать карданным руку, когда световой раздражитель непосредственно сталкивается (точки, в) воспринимающий центре поля.
Примечание: В темноте, дрозофила фоторецепторов реагируют на яркие световые импульсы с 40 - 65 мВ ответов деполяризующими напряжения 4,5, в то время как стабильные LMC записи показывают , от 20 до 45 мВ гиперполяризационные ответов 9,10,14. Glia проходки может произойти редко, обозначается <-80 мВ покоя потенциалов и гораздо медленнее,и меньше (~ 5 мВ) насыщенный Светоиндуцированный деполяризаций. Фоторецепторов у дрозофилы с различными глазными пигментации, таких как белый глаз 7 и киноварь, показывают сопоставимые размеры отклика дикого типа. - Использование режима усилителя тока зажим (CC), компенсируют емкость записывающего электрода, вводя небольшой 0,1 нА и краткое (100 - 200 мс) импульсы тока в исследуемой ячейке, чтобы свести к минимуму записи артефактов во время его зарядки мембраны.
Примечание: Эта важная процедура подробно описана в руководстве усилителя, и должно быть осуществлено на практике с моделью электрической клеток перед проведением эксперимента. - Ответы напряжения Запись на световых импульсов и других стимулов, представляющих интерес, имеющих различные статистические или физические свойства (например, натуралистического интенсивности света временных рядов или случайных узоров контраста). Тест, например, как записанные ответы изменить с легкими или темно-адаптации.
Примечание: Можно точно LiGHT-адаптируются исследуемую клетку путем непрерывного света заранее выбранной интенсивности, добавив фильтры нейтральной плотности на пути прохождения света 4,5. В качестве альтернативы, для длительной темной адаптации выключить световой раздражитель в течение заданного времени. Из-за механической устойчивости системы записи, высокое качество записи электродов и нетронутость препарата, стабильные условия съемки иногда может длиться в течение многих часов. Таким образом, в хороший день, можно собрать большое количество данных при различных условиях адаптируя из одной клетки. Когда электрод выскальзывает из ячейки, записанные ответы уменьшаются и среднее напряжение начинает приближаться к нулю. - тщательно Авансовые электрода записи с помощью точного контроля оси х микроманипулятора пока электрод не контактирует и проникает в следующую ячейку (как правило, это ближайший сосед нейронная). Не перемещайте электрод вдоль y- или оси, поскольку эти маневры делают электрод к "плтельное ткани "в сторону, повреждения структуры глаза!
Примечание: С хорошим электродом и здорового препарата, можно записывать высококачественные качество ответов от многих фоторецепторов (но редко из многих LMCS) в том же Облети в течение нескольких часов; время от времени, в течение всего рабочего дня (> 8 ч) без четкого ухудшения сигнала. - Сохранение файлов данных периодически с идентифицирующей информацией, такой как дата, генотип, и записываемого типа клеток. Из-за большого объема данных, которые могут быть собраны в успешной записи сессии, сохранить хорошие письменные записи в лабораторном книге для анализа будущих данных.
Результаты
Резкий способ записи микроэлектродный, адаптированной здесь для глаз дрозофилы, может быть использован для надежной количественной оценки нейронной информационной выборки и обработки в сетчатке и ламинированным клеток, а также связь между ними 4,5,7,8,10,33. При использовании его для изучения кодирования в различных запасов дикого типа, мутантов или генетически сконструированных штаммов мух, метод доказал свою ценность; не только в количественной оценке последствий мутации, температуры, диеты или выбранного выражения 3,4,6,9,10,14,30,34, но и в выявлении механистические причины измененными визуальными поведения 14,34. Способ также легко применимы к другим препаратам насекомых 35,36, расширяя возможности neuroethological исследования зрения. Далее мы представляем несколько примеров его успешного применения.

Рисунок 7. НапряжениеОтветы плодовой мушки R1-R6 фоторецептор световому импульсу при 20 и 25 ° С. Поскольку резкие микроэлектродные проникновений часто очень стабильны, можно записать ответы напряжения одного и того же R1-R6 фоторецепторов к данному световой раздражитель в различные температуры окружающей среды путем нагревания или охлаждения лету. В наших наборах, муха-держатель помещается на близком петли Пельтье элементом на основе системы контроля температуры. Это позволяет изменять температуру головы мухи за считанные секунды. Более высокая температура ускоряет реакцию напряжения и , что характерно снижает потенциал покоя R1-R6 фоторецепторов (как показано красными стрелками). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Изучение влияния температуры на фоторецептор Выход
С помощью хорошо продуманной и виброизолированного система записи, метод может быть использован для измерения влияния температуры на выходе нейронной отдельной клетки путем потепления или охлаждения летать. Данный пример показывает реакцию напряжения к светлому длиной 10 мс импульса, записанный в том же R1-R6 фоторецепторов при 20 и 25 ° С (рисунок 7). Как количественно , прежде чем 4,9, потепление снижает потенциал покоя фоторецептора в темноте, и ускоряет свои ответы напряжения.
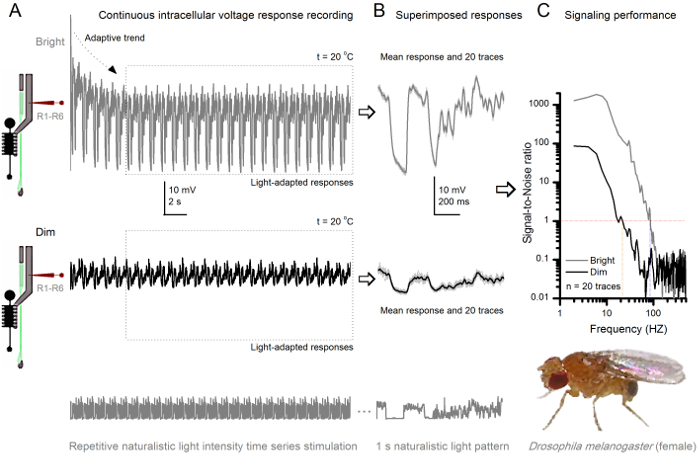
Рисунок 8. Signaling Производительность плодовой мушки R1-R6 фоторецептора Улучшает с Интенсивность света (А) выход фоторецептора тускнеть (ниже) и светлые. (Выше; 10000 раз более яркий свет) повторяется натуралистическое временных рядов интенсивности света , записанный тем же микроэлектродомв той же камере при температуре 20 о С. Ответы на яркий стимул крупнее, потому что они объединяют в себе большее количество образцов, элементарные ответы (выбоины) для одиночных фотонов 4,5,7,8. (B) 20 последовательных ответов один второй длинные напряжения накладываются. Индивидуальные ответы (светло - серый) были приняты после того, как адаптивных тенденций (стрелка А) отступило (пунктирная поле в A). Соответствующие средства ответа (сигналы) темные следы. Разница между сигналом и отдельных ответов является шум. (С) клеток "сигнализации производительности количественно с помощью записей , « сигнал-шуму (SNR) с использованием стандартных методов 4,5,7,8. Выход фоторецептора имеет около 64 Гц более широкий диапазон надежной сигнализации при ярком стимуляции ( "Светлый ≥1, до 84 Гц , чем при тусклом (SNR SNR) 'Dim ≥1, до 20 Гц), с Signal-шум значительно улучшается; от SNR Dim MAX = 87 до SNR Яркий MAX = 1,868. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Изучение адаптации и Neural Кодирование с помощью ритмической стимуляции
Неинвазивность метода, влечет за собой относительно небольшое повреждение в сетчатке и ламинированным структур, делает его идеальным для изучения характеристик передачи сигналов отдельных клеток в различных световых раздражителей в их вблизи естественного физиологического состояния в естественных условиях. На рисунке 8 показаны отклики напряжения постоянного R1- R6 фоторецепторов в тусклом и ярком неоднократного натуралистического света времени интенсивность серии раздражителя при 20 о с, в то время как рисунок 9 показывает ответы другого фоторецепторов R1-R6 и БМО к другому натуралистического раздражителя при 25 ° С Пре- и постсинаптические записи были выполнены отдельно от двух различных мух , так как одновременное внутриклеточные записей по двум острыми микроэлектродов в том же ходу, один в сетчатке , а другой в листовых пластинках, слишком сложно , чтобы быть жизнеспособным 30.
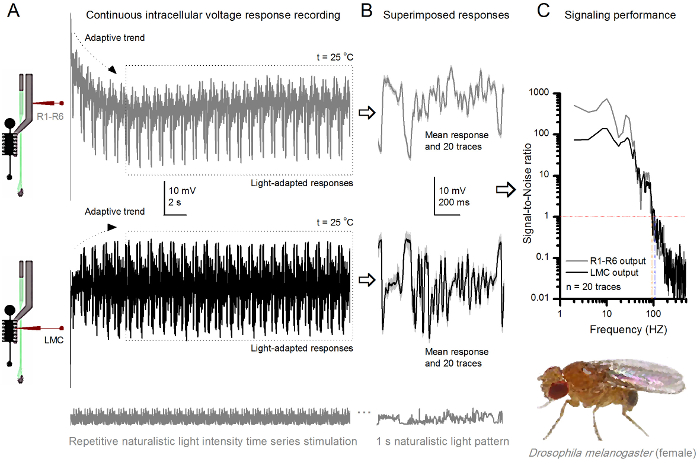
Рисунок 9. Реакции напряжения плодовой мушки R1-R6 фоторецептор и БМО к многократному натуралистического стимуляции при 25 ° С (А) R1-R6 (серый) и LMC (черный) выводит записанные различными микроэлектродов из разных мух. (B) Полностью свет адаптированный 20 последовательных пре- (выше) и постсинаптические (ниже) ответов на тот же натуралистического последовательности стимула с индивидуальными ответами, как показано на светло - серыйг соответствующие средства ответа (сигналы), как темные следы. Разница между сигналом и отдельных ответов является шум. (С) клеток "сигнализации производительности количественно с помощью записей , « сигнал-шуму (SNR). Выход LMC имеет около 10 Гц более широкий диапазон надежной передачи сигналов (SNR 'LMC ≥1, до 104 Гц) , чем выход R1-R6 (SNR' R ≥1, вплоть до 94 Гц). Оба отношения сигнал-шум высоки (SNR LMC MAX = 142, SNR R MAX = 752), а также шум записи была низкой, их различия отражают реальные различия кодирования между ячейками. Пожалуйста , нажмите здесь , чтобы увидеть увеличенную версию эта фигура.
После начала стимула, записи типичныйLY показывают быстро адаптируя тенденции, которые в значительной степени ослабевать в течение 5-6 сек. С тех пор, клетки производят весьма последовательные ответы на каждый 1 сек длительный стимул презентации (каждая пунктирная рамка охватывает 20 из них). Повторные ответов становится очевидным , когда они накладываются (8В и 9В). Индивидуальные ответы тонкие серые следы, и их средней толще темный след. Средний ответ принимается в качестве нейронного сигнала, в то время как нейронные шум является разница между средним значением и каждого отдельного 4,5,9,37,38 ответа. Соответствующие отношения сигнал-шум в частотной области (рис 8C и рисунке 9в) были получены с помощью Фурье-преобразования сигнала и шума кусками данных в спектрах мощности и разделения спектра мощности сигнала средней с соответствующим средним значением шума спектра мощности 4, 5,9,37,38. Характерно, что максимальные отношения сигнал-шум Oе записанные нейронные выходы к натуралистической стимуляции высоки (100 - 1000), а в наиболее стабильных препаратов с очень низким уровнем шума записи может достигать значений >> 1000 (например, рис 8C.). Заметьте также , что потепление расширяет клеток пропускную способность надежной сигнализации 4 (SNR 'Яркий ≥ 1); например, относительная разность между двумя R1-R6S на рисунках 8 и 9, соответственно, составляет 10 Гц (84 при 20 ° С и 94 Гц при 25 ° С).
Можно дополнительно оценить скорость каждой ячейки передачи информации от ее отношения сигнал-шум с помощью уравнения Шеннона 32, или путем вычисления разности между энтропией и шумовых ставок энтропии ответов "через тройной метод экстраполяции 39. Подробнее об информации, теоретического анализа, а также их использование и ограничениеы конкретно с помощью этого метода приведены в предыдущих публикациях 7,8,39.
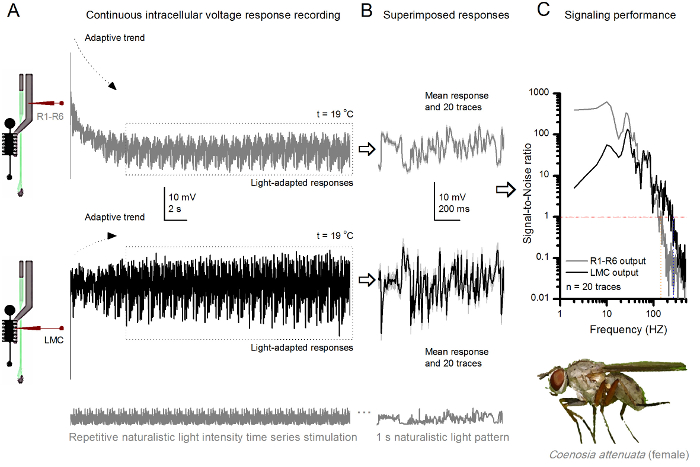
Рисунок 10. Ответы напряжения убийцы Fly R1-R6 фоторецептор и БМО к многократному натуралистического стимуляции при 19 о С (А) R1-R6 (серый) и LMC (черный) выводит записанные тем же микроэлектродом из того же лету; первый постсинаптически, а затем пресинаптически, как электрод был продвинут в глаза. (В) 20 последовательных заранее (выше) и постсинаптические (ниже) ответы (светло - серые следы) к тому же натуралистического последовательности стимула были захвачены после первоначальной адаптации (пунктирная коробки в A). Их средства сигналы (темные следы на вершине), в то время как их соответствующие отличия от отдельных ответов дают шум. (C) , соответствующий Signaл-к-шуму (SNR) рассчитывались как на фигурах 8С и 9С. Выход LMC имеет около 100 Гц более широкий спектр надежной передачи сигналов (SNR 'LMC MAX ≥1, до 234 Гц) , чем выход R1-R6 (SNR' R MAX ≥1, до 134 Гц). Оба отношения сигнал-шум высоки (SNR LMC MAX = 137, SNR R MAX = 627), а как же микроэлектродный был использован в записи, их различия отражают реальные различия в пре- и постсинаптических нервных выходов. Эти результаты означают , что система записи была низким уровнем шума, а также его влияние на анализе был незначительным. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Neuroethological Видение Исследования
Способ также может быть использован для записи до и постсинаптические реакции напряжение от сложных глаз различных видов насекомых 7,8,35,36 (рисунок 10), что позволяет сравнительными neuroethological исследования обработки визуальной информации. Для представленной системы записи, только необходимая адаптация нового препарата-держатели, каждый с соответствующим размера отверстия для изученных видов. Эти примерные записи взяты из женского убийцы мухи (Coenosia attenuata). Они показывают внутриклеточные реакции напряжения фотоэлектрического R1-R6 и БМО к идентичным повторяющейся световой стимуляции, используемый для аналогов дрозофилы на рисунке 9, но при 19 о С. В этом случае, как пред- и постсинаптические данные были записаны с той же мухи; один за другим, с тем же электродом записи (заполненной 3 М KCl) первый наступающей через боковую пластинкой, прежде чем войтиИНГ лобную сетчатку. По сравнению с данными дрозофилы при 25 ° C, данные Coenosia - даже при более низкой температуре - показывает ответы с более быстрой динамикой; расширение спектра надежной сигнализации (отношение сигнал-шум >> 1) в более широком диапазоне частот. Такие функциональные адаптации в нейронной кодировании натуралистических стимулов согласуются с хищным образом жизни 36 Coenosia 's, которые требуют высокой точности информации пространственно - временной для достижения быстрых воздушных охоты поведения.
Обсуждение
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier's recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine - having too high a resistance or intramural capacitance - to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode's time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer's solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax - if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas - picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips' electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today's optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells' electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Раскрытие информации
The authors have nothing to disclose
Благодарности
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ's current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
Материалы
| Name | Company | Catalog Number | Comments |
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30X eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| Nikon microscope | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| Newport | |||
| Micromanipulators | Narishige | Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| Huxley Bertram | Huxley xyz-axis with fine manual control | ||
| Sensapex | Sensapex triple axis | ||
| Märzhäuser | Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3 - 0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
Ссылки
- Meinertzhagen, I. A., O'Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C., Ottoson, D. . Progress in Sensory Physiology. 5, 1-79 (1985).
- Borst, A. Drosophila's View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) - Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron - Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. . Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173 (2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены