Method Article
Elektrophysiologische Verfahren zur Aufzeichnung von intrazellulärer Spannung Antworten von
In diesem Artikel
Zusammenfassung
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Zusammenfassung
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell's receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator's experimental objectives, it grants outstanding in vivo neurophysiological data.
Einleitung
Die Fruchtfliege (Drosophila melanogaster) -Verbindung Auge ist ein großes Modellsystem die funktionelle Organisation des Photorezeptors und Euron - Arrays für die neuronale Bild Probenahme und Verarbeitung sowie für die Tier Vision zu untersuchen. Das System verfügt über das umfassendste Schaltplan 1,2 und ist liebenswürdig zu genetischen Manipulationen und präzise neuronale Aktivitätsüberwachung (von hohen Signal-zu-Rausch - Verhältnis und Zeitauflösung) 10.03.
Das Drosophila Auge ist modular aufgebaut, mit ~ 750 scheinbar normalen Linse bedeckten Strukturen Ommatidien genannt, die zusammen das eine Panorama - Sichtfeld fliegen sorgen , dass fast jede Richtung um seinen Kopf bedeckt. Das Auge des primären Informationsstichprobeneinheiten sind seine rhabdomer Photorezeptoren 7,8,11. Jede Ommatidium enthält acht Sehzellen (R1-R8), welche die gleiche Facettenlinse teilen, sind jedoch sieben verschiedene Richtungen ausgerichtet sind. Während die äußeren Photorezeptoren R1-R6 are am empfindlichsten auf blau-grünes Licht, spektralen Empfindlichkeiten der inneren Zellen R7 und R8, die in die gleiche Richtung liegen übereinander und zeigen, zeigen drei verschiedene Subtypen: blass, gelb und dorsalen Randbereich (DRA) 12- 15.
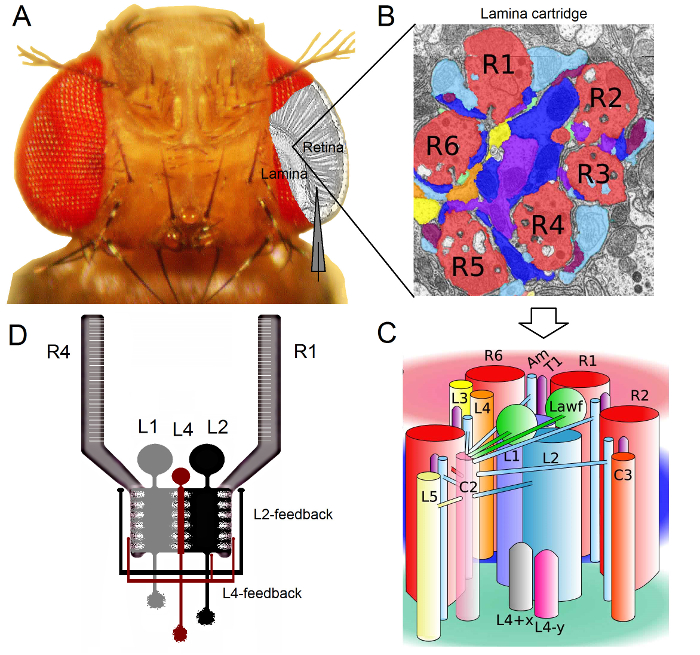
Abbildung 1. Funktionelle Organisation des Drosophila Auge. (A) Die beiden ersten Opticusganglien, Retina und Lamina, sind grau im Inneren des Fliegenaugen hervorgehoben. Retina R1-R6 und Photorezeptoren Lamina Große monopolare Zellen (LMCs: L1-L3) sind leicht zugänglich in vivo zu herkömmlichen scharfen Mikroelektroden - Aufnahmen. Die schematische Elektrode hebt den normalen Weg von R1-R6 in der Netzhaut aufzuzeichnen. Ein Weg aus LMCs in der Lamina zu erfassen ist parallel der Elektrode zu verschieben nach links. (B) Lamina ist eine Matrix von retinotop organized Patronen, von denen jede mit Neuronen gepackt, die Informationen von einem bestimmten kleinen Bereich in dem Bildraum verarbeitet. Aufgrund neuralen Überlagerung von sechs Photorezeptoren aus verschiedenen benachbarten Ommatidien senden ihre Axone (R1-R6) auf den gleichen Plättchen Patrone histaminerge Ausgangs Synapsen L1-L3 und einer amacrine Zelle (Am) bilden. (C) Die Ausbreitung der neuronalen Informationen zwischen R1-R6 Axonterminalen und die visuellen Inter (einschließlich L4, L5, Lawf, C2, C3 und T1), innerhalb einer Lamina Patrone komplex ist. (D) R1-R6 Photorezeptor Axone erhalten synaptischen Feedbacks von L2 und L4 monopolare Zellen. (B) und (C) modifiziert von Rivera-alba et al 2. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Das Drosophila Auge des neuronalen Überlagerung Typ 16. Dies bedeutet, tHut die neuronalen Signale von acht Photorezeptoren zu sieben gehör Ommatidien Nachbar, die im Raum an der gleichen Stelle suchen, werden zusammen in den nächsten zwei Neuropile an einer neuralen Patrone gepoolt: die Lamina und Medulla. Während die sechs äußeren Photorezeptoren R1-R6 Projekt ihre Axonterminalen zu neuronalen Spalten in der Lamina (Abbildung 1), R7 und R8 Zellen umgehen diese Schicht und synaptische Kontakte mit ihren Medulla Spalte 17-19 entspricht. Diese exakten Verdrahtungen erzeugen , das neuronale Substrat für die retinotopic Abbildung von Fly frühe Vision, wonach jede Lamelle (1A-C) und der Medulla Säule (Patrone) stellt einen einzigen Punkt im Raum.
Direkte Eingänge von R1-R6 Photorezeptoren sind durch die großen monopolare Zellen erhalten (LMCs: L1, L2 und L3) und die Amakrinzell (Am) in der Lamina 1,2,20. Von diesen L1 und L2 sind die größten Zellen, zu vermitteln wichtige Informationswege (1D), which reagieren auf On- und Off-bewegten Kanten und bilden somit die Berechnungsgrundlage des Bewegungsmelders 21,22. Verhaltensexperimente legen nahe , dass bei mittleren dagegen die beiden Bahnen Bewegungswahrnehmung von entgegengesetzten Richtungen zu erleichtern: Back-to-Front in L1 und Front-to-Back in L2 - Zellen 23,24. Konnektivität bedeutet ferner , dass L4 - Neuronen entscheidende Rolle zwischen benachbarten Patronen 25,26 in der seitlichen Kommunikation spielen kann. Gegenseitige Synapsen wurden zwischen L2 und L4-Zellen befindet sich in der gleichen und zwei benachbarte Patronen gefunden. Downstream jede L2 - Zelle und die drei zugeordneten L4 Zellen ihre Axone mit einem gemeinsamen Ziel - Projekt, das Tm2 Neuron in der Medulla, wobei Eingänge von benachbarten Patronen geglaubt werden , integriert werden zur Verarbeitung von vorne nach hinten Bewegung 27. Obwohl L1 Neuronen über beide gap junctions und Synapsen Eingang von gleich Patrone L2s erhalten, sind sie nicht direkt mit L4s und damit benachbarte Lamina Cartridges.
Synaptische Feedbacks zu R1-R6 Photorezeptor Axone werden nur von Neuronen, die zu den L2 / L4 - Schaltungen aber nicht die L1 - Weg 1,2 (1D) zur Verfügung gestellt. Während gleichen Patronen Verbindungen selektiv von L2 auf R1 und R2 und von L4 bis R5 alle R1-R6 Photorezeptoren erhalten synaptische Rückkopplung von L4 von einem oder beiden benachbarten Patronen. Darüber hinaus gibt es starke synaptische Verbindungen von Am zu R1, R2, R4 und R5 und Glia - Zellen werden auch synaptisch mit dem Netzwerk verbunden und kann somit in neuronalen Bildverarbeitung 6 teilnehmen. Schließlich tragen axonalen spalt Kreuzungen verbindet benachbarte R1-R6 und zwischen R6 und R7 / R8 Photorezeptoren in der Lamina, die asymmetrische Informationsdarstellung und -verarbeitung in jeder Patrone 14,20,28.Intrazellulärer Spannung Aufnahmen von einzelnen Photorezeptoren und visuelle Inter in nahezu intakten Drosophila bieten hohen Signal-zu-Rausch - ratio Daten an Sub-Millisekunden - Auflösung 3,5,7-10,29, die zur Herstellung von Sinn der schnellen neuronalen Berechnungen zwischen den verbundenen Neuronen notwendig ist. Dieser Grad an Genauigkeit ist durch aktuelle optische Abbildungstechniken unmöglich, die wesentlich geräuschvoller sind und typischerweise bei 10 arbeiten - 100 msec Auflösung. Darüber hinaus, da die Elektroden sehr klein und scharfe Spitzen haben, ist das Verfahren nicht auf Zellkörper beschränkt, sondern direkte Aufnahmen von kleinen aktiven neuronalen Strukturen zur Verfügung stellen kann; wie die dendritischen Bäume oder Photorezeptor Axone 'LMCs, die von viel größeren Spitzen Patch-Clamp-Elektroden nicht zugegriffen werden kann. Wichtig ist, dass das Verfahren auch strukturell weniger invasive und schädlich als die meisten Patch-Clamp-Anwendungen, und wirkt sich so weniger die intrazelluläre Milieu und Informationen Sampling 'studierte Zellen. So haben herkömmliche scharfe Mikroelektroden-Techniken beigetragen, und halten Sie auf einen Beitrag, grundlegenden Entdeckungen und originelle Einblicke in neuronale information Verarbeitung bei der entsprechenden Zeitskala; unser mechanistisches Verständnis der Vision Verbesserung 10.03.
Dieser Artikel beschreibt , wie in vivo intrazelluläre Aufnahmen von Drosophila R1-R6 und Photorezeptoren LMCs im Juusola Labor durchgeführt werden. Dieses Protokoll wird beschrieben, wie ein geeignetes Elektro rig zu konstruieren, bereiten die Fliege, und die Aufnahmen durchführen. Einige repräsentative Daten vorgestellt, und einige häufig auftretende Probleme und mögliche Lösungen diskutiert, die auftreten können, wenn mit dieser Methode.
Protokoll
Das folgende Protokoll erfüllt alle Tierpflege-Richtlinien von der University of Sheffield und der Beijing Normal University.
1. Reagenzien und Gerätevorbereitung
- Aufnahme und Lichtstimulation Geräte - Setup
- Wählen Sie mindestens eine 2,5 x 2,5 m Aufnahmebereich zur Durchführung von elektrophysiologischen Experimenten in einem Raum, der Klimaanlage mit geregelter Luftfeuchtigkeit und Mittel dunklen Aufnahmebedingungen zur Verfügung zu stellen. Stellen Sie sicher, dass dieser Bereich groß genug ist, bequem zu passen ein: (i) 1 x 1 m Schwingungsisolations Tabelle, die die Anlage beherbergt [Stimulation und Aufzeichnungsgerät fliegen], Stereo und eine Kaltlichtquelle mit zwei Schwanenhälse, die alle innerhalb einer geschlossenen groß> 180 cm groß Faradayschen Käfig; (Ii) einem 38U-Rack für den Wohnungsbau ein Personal-Computer mit einem flachen LCD-Monitor, Mikroelektroden-Verstärker, LED-Treiber, Filter, Temperaturregler, Oszilloskope und andere erforderliche elektrische Instrumente; und (iii) akleiner Schreibtisch und ein Stuhl für die Ermittler.
- Legen Sie das Rigg weit weg von elektrischen und mechanischen Geräuschquellen, wie zum Beispiel Kühlschränke, Zentrifugen und Aufzüge. Verwenden Sie Schutz separaten Stoß der rig die elektrischen Geräte vor Spannungsspitzen zu schützen, in dem Netz auftreten. Idealerweise verbinden das Rigg auf seine eigene unterbrechungsfreie Stromversorgung (USV-Batterie), um Lärm zu minimieren.
- Konstruieren Sie einen konischen Fliegenhalter aus Messing und schwarzem Kunststoff (Abbildung 2). Bohren Sie ein kleines Loch durch die sich verjüngenden Messing Einheit mit seinem Außenrand Verengung auf ~ 0,8 mm Durchmesser (eine typische Fliege Thorax Breite entspricht).
Hinweis: Dieses Loch in Richtung auf die Spitze des Fliegenhalter verjüngend braucht , so daß eine überdurchschnittlich große Drosophila, die von unten durch die Luftstrom projiziert wird, würde stuck Schulter tief am oberen Rand bekommen. - Entwurf und Bau einer mechanisch-robust, aber dennoch präzise, fliegen Stimulation und Aufzeichnungsgerät (Abbildung 3). Konstruieren Sie aus of Aluminium oder Messing (hohe Leitfähigkeit Metalle) eine Fliege Vorbereitungs Plattform Pol und um ihn herum ein Kardan-Arm-System, mit eingebetteten Kugellager, zu liefern glatte und genaue x, y-Positionierung und Verriegelung des Lichtreizes.
Hinweis: Diese integrierten Verbund Design minimiert mechanische Schwingungen, die sonst die Aufzeichnungselektrodenspitze aus der untersuchten Zelle lösen konnte. Es kann weiterhin ein Peltier-Element-basierte close-Schleife Temperatursteuerungssystem integrieren, so dass die Ermittler temperaturempfindliche genetische Konstrukte, wie shibire TS, für die Beurteilung der Synapsenschaltung Berechnungen 9,30 zu verwenden. Eloxieren das Gerät oder malen sie schwarz Lichtreiz Streuung zu minimieren.- Befestigen Sie die Fliege Stimulation und Aufzeichnungsgerät auf der Anti-Vibrationstisch Brotschneidebrett; zum Beispiel durch M6-Schrauben, mit seiner metrischen Schraubenlöcher. Verwenden Sie einen schwarzen Steckbrett oder decken Sie es mit schwarzem Stoff Lichtstreuung während der Experimente zu minimieren.
- Position und Schloss eine höhenverstellbare Fliegen Vorbereitung Plattform Pol in der Mitte eines Kardan-Arm-System (eine Verriegelungsschraube). Platzieren Sie den Fly-Vorbereitung (in-the-fly-Halter, siehe Schritt 2) auf der Plattform Pol, so dass die Lichtquelle an dem Kardan-Arm radial zeigt auf den Kopf der Fliege. Sicherzustellen, dass die Mitte der Fliegenaugen genau am Schnittpunkt (0, 0) des Kardan-Arm der x- und y-Achse, wie dies ermöglicht eine genaue x, y-Positionierung des Lichtreizes zu jedem Punkt innerhalb des Fliegen Sichtfeld.
Hinweis: Diese Funktion zur Abbildung der Antworteigenschaften der einzelnen Zellen auf bestimmte Augenstellen erforderlich ist, zB wenn für elektro Beweise für strukturelle Anpassungen der Suche, wie hell oder akute Zonen, die Erhöhung der Empfindlichkeit oder Auflösung zeigen würde, beziehungsweise 31.
- Montieren Sie die Stereo hinter dem Fliegen Stimulation und Aufzeichnungsgerät auf dem Anti-Vibrationstisch sodass es bequem mit hoher Vergrößerung Betrachtung des Fliegenaugen bietet.
- Montieren Sie die Kaltlichtquelle auf der Spitze des Mikroskops mit dem Doppelkopf halbstarre gooseneck Lichtleiter nach unten in Richtung der Fliege Vorbereitung Inhabers Lichtquelle. Frei bewegliche zwei Strahlbeleuchtung erleichtert die Aufnahme Elektrodenspitze sichtbar zu machen, wenn es durch eine kleine Öffnung in das Auge fliegen fahren.
- Bringen Sie eine geeignete x, y, z-Mikromanipulator Set (grob und fein) für die Aufzeichnungselektrode und der Kopf-Bühne auf der Anti-Vibrationstisch, auf der rechten Seite der Fliege Stimulation und Aufzeichnungsgerät, mit M6-Schrauben oder magnetische steht.
Hinweis: Im Juusola Labor werden verschiedene Anlagen ausgestattet mit verschiedenen Manipulatoren; Details siehe die Tabelle der Materialien und Reagenzien. Diese alle bieten qualitativ hochwertige intrazellulären Aufnahmen. - Montieren Sie ein kleines Handbuch 3-Achsen-Mikromanipulator für die Referenzelektrodenhalter auf der vertikal verstellbar fly Vorbereitung Plattform Pol. Ausrichten der Referenzelektrode, so daß er in Richtung des Flugvorbereitung.
- Konstruieren Sie eine freistehende Licht abgeschirmten Faradayschen Käfig aus Stahlplatten um die Anti-Vibrationstisch, rund um die Fliege Stimulation und Aufzeichnungsgerät, elektromagnetische Störungen zu verhindern. Lassen Sie die Vorderseite des Käfigs geöffnet und bietet Zugang der Flugvorbereitung für die Experimente zu transportieren. Bringen Sie schwarze Stoffvorhänge (mit kupfer- oder Aluminium-Gitter in ihnen für die Erdung implantiert) am vorderen Lärm und Licht abzuschirmen aus. Malen Sie das Innere des Käfigs schwarz Lichtstreuung zu minimieren, und nageln Sie die Füße des Käfigs auf dem Boden zu Schwingungen zu verhindern.
- Verbinden die Spannungs- und Stromausgänge der hochohmigen intrazellulären Mikroelektroden-Verstärkers mit den Eingängen von zwei getrennten Tiefpassfiltern (Bessel oder ähnliches) unter Verwendung von BNC-Kabel. Ebenso verbinden die Filterausgänge in die entsprechenden Kanäle der AD-Anschluss blocks / Bohlen des Datenerfassungssystems (DA / AD-Karten). Schließen Sie das DA / AD-Karte (n) in einen Personalcomputer durch spezialisierte Kabel, laut Hersteller Handbücher.
- Installieren geeigneter Erfassungssoftware für die Datenerfassungssystem der Wahl auf dem Personalcomputer. Sicherzustellen, dass die Datenerfassungstreiber mit dem Betriebssystem auf dem Personalcomputer kompatibel sind.
- Boden elektrisch die Fliege Stimulation und Aufzeichnungsgerät, Faraday-Käfig, Kupfernetz (innerhalb der Vorhänge), Mikroskop, Mikromanipulatoren, Kaltlichtquelle, 38U-Rack mit allen seinen Instrumenten (die intrazelluläre Verstärker, Filter, Temperaturregler, PC und LCD-Monitor etc.) zu einem zentralen Erdungspunkt durch Ausrüstung Erdungsdraht und M6 Ring Erdungsenden quetschen. Verwenden Sie einen elektrischen Multimeter zu testen, ob alle Teile in der gleichen Boden sind.
Hinweis: Um die bestmöglichen Low-Noise Aufnahmebedingungen zu erreichen, in der Regel die Erdungs Konfigurationen variieren from ein Set-up zu einem anderen.- Falls erforderlich, schließen Sie den zentralen Erdungspunkt weiter nach Baugrund, und / oder die zentrale Masse des Mikroelektroden-Verstärker. die voll funktionsfähiges System im realen elektrophysiologischen Experimenten Nach der Prüfung vorbereitet werden, um die Erdung Konfiguration zu ändern, wie in den Aufnahmen zu minimieren Lärm benötigt.
- Konfigurieren Sie Software-Amplifikation (1 - 10X), Signalfilterung (typischerweise Tiefpassfilter bei 500 Hz eingestellt, die für beide R1-R6 und LMC Daten geeignet ist), und die Abtastrate (mindestens 1 kHz). Stellen Sie sicher , dass die Einstellungen gehorchen Nyquist-Shannon - Abtasttheorem 32; Wenn zum Beispiel Datenerfassung, die mit einer Abtastfrequenz von 1 kHz oder höher bei 500 Hz Tiefpass-gefiltert ist, verwenden, um Aliasing-Effekte zu minimieren.
- Als charakteristische Spannung Antworten von R1-R6 Photorezeptoren sind 40 - 65 mV und die von LMCs 20 - 45 mV, stellen Sie die Verstärkung und Anzeigeskalen entsprechend hochauflösende sampli zu ermöglichenng und Datenvisualisierung.

Abbildung 2. Konische Fly-Halter Der Fly-Halter wird aus zwei Teilen:. Die zentrale Messing Einheit und seiner konischen schwarzen Plastikmantel. Das zentrale Loch in der Messingeinheit verjüngt sich zu einem kleinen Durchmesser, der kaum die Fliege durchlässt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 3. Überblick über das Elektrophysiologische Rig. Das Set-up enthält eine freistehende Licht abgeschirmten Faraday - Käfig, der Anti-Vibrationstisch, die Fliege Stimulation und Aufzeichnungsgerät, und schwarze Stoffvorhänge mit kupfer- oder Aluminium-Netz innen für Erdung. Die Instrument Rack ist elektrisch mit dem gleichen zentralen Masse verbunden mit allen Geräten innerhalb des Faraday'schen Käfigs. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Die Herstellung von Mikroelektroden
- Ziehen Sie den Bezug von Mikroelektroden filamentierten Borosilikat (Außendurchmesser: 1,0 mm; Innendurchmesser 0,6 mm) oder Quarzglas (Außendurchmesser: 1,0 mm; Innendurchmesser von 0,5, 0,6 oder 0,7 mm) Schlauch mit einer Pipette Abzieher Instrument. Versuchen Sie, eine kurze allmähliche Verjüngung zu erreichen.
Hinweis: Die genauen Einstellungen der Pipette Abzieher-Programm von Instrument zu Instrument variieren; Weitere Einzelheiten in der Tabelle der Materialien und Regenten. Die Porengröße an der Spitze ist nicht entscheidend, da die Spitze der Bezugselektrode wird bevor sie in die Flugvorbereitung eingesetzt gebrochen werden wird. - Ziehen Sie die Aufnahme von Mikroelektroden filamentierten Borosilikat (Außendurchmesser: 1,0 mm; Innendurchmesser 0,6 mm) oder Quarzglas (Außendurchmesser: 1,0 mm; Innendurchmesser von 0,5, 0,6 oder 0,7 mm) mit einer Pipette Abzieher Instrument Schlauch verwenden. Versuchen Sie, eine lange zu erreichen (10 bis 15 mm) fein allmähliche Verjüngung.
- Prüfen Sie mit einem Lichtmikroskop, das die Aufzeichnungselektroden richtig Verjüngungs zeigen. Montieren Sie die Elektrode auf einem Glasträger mit formbaren Klebstoff und verwenden 40X Luft Ziel seiner Spitze zu inspizieren.
Hinweis: Eine gute Elektrode verjüngt sich glatt, bis seine unsichtbar kleine Spitze, um die kontinuierliche parallel dunkleren und helleren Interferenzmuster zu sehen ist. Einige Abzieher Einstellungen erzeugen hohe Widerstandselektroden, die nicht erfolgreich Zelle Durchdringungen ergeben können, weil ihre Spitzen ähneln "Trompeten". Somit visuelle Inspektion der Elektroden ist wichtig. - Bringen Sie die Elektroden horizontal auf einer großen Petrischale mit Knetmasse (oder ähnlich formbare Kleber) zur sicheren Aufbewahrung und den Transport zum Elektro rig. Stellen Sie sicher, dass die Elektrodenspitzen einimmer in der Luft wieder und nicht aus Versehen etwas zu berühren.
- Back-füllen die Aufnahme und Referenzelektroden kurz vor dem Experiment mit der entsprechenden Salzlösung. Verwenden Sie einen kleinen 5-ml-Spritze zu einem kleinen Partikelfilter verbunden mit einer feinen Spitze aus Kunststoff (wie ein Micro).
- Für Experimente Photorezeptoren, füllen Sie die Aufzeichnungselektrode bis zur vollständigen (ein Tröpfchen bildet in seinem großen Ende) mit 3 M KCl, da diese Lösung die Wirkung der flüssigen Übergangspotential auf die aufgezeichnete Spannung minimiert.
- Für die histaminerge LMCs Untersuchung, die von R1-R6 Photorezeptoren durch Chlorid-Leitfähigkeit Änderungen an synaptischen Eingang reagieren, füllen Sie die Aufzeichnungselektroden mit 3 M Kaliumacetat und 0,5 mM KCl, da diese Lösung weniger Auswirkungen auf die Chlorid-Batterie-Zelle hat. Füllen Sie die Referenzelektrode mit Fliegen Ringer, enthaltend in mM: 120 NaCl, 5 KCl, 10 TES (C 6 H 15 NO 6 S), 1,5 CaCl 2, 4 MgCl 2 und 30 Saccharose 5.
- Testen der Widerstandsfähigkeit eines neu gezogen Aufzeichnungselektrode in dem Aufzeichnungssystem.
- Stellen Sie sicher, dass die Silberdrähte im Inneren der Elektrodenhalter gleichmäßig mit Silberchlorid beschichtet sind (erscheinen violett-grau - nicht silbrig glänzende) Aufnahme Artefakte (wie Drift in der Übergangspotential) zu minimieren. Wenn nicht, ersetzen Sie sie mit richtig chloriert Drähte.
- Bei Bedarf neue Silberdrähte chloridize. Reinigen Sie die Drähte (durch schnell sie durch eine Flamme vorbei), so dass diese hellen Silber in Farbe erscheinen. Vermeiden Sie sie mit den Fingern zu berühren, um auf einer gleichmäßigen Schicht von AgCl zu deponieren. Weichen Sie die Drähte in voller Stärke Haushaltsbleiche für 15 - 30 min, bis sie lila-graue Farbe erscheinen. Alternativ galvanisieren jeden Draht (durch positive bezüglich einer Lösung , die 3 M KCl zu machen und einen Strom durch sie mit einer Geschwindigkeit von 1 mA / cm 2 Oberfläche verläuft) für 10 bis 15 sec , bis ausreichend beschichtet.
- Verbinden Sie die Rückseite gefüllten Aufnahme und Referenzelektroden auf ihre Elektrodenhalter. Legen Sie eine kleine Ringerlösung Bad auf der höhenverstellbaren Fliegen Vorbereitung Plattform Pol. Fahren Sie die Elektrodenspitzen in der Ringerlösung und messen die Spitze Widerstand der Aufzeichnungselektrode.
Anmerkung: Dieser Schritt ist nur erforderlich, wenn das resistive Eigenschaften der Elektroden zu testen, die von einer neuen Charge von Glasrohr gezogen werden, oder wenn die Mikroelektroden-puller Instrument Programme durch Iteration optimiert. - Bevor die Widerstandsmessungen durchführen, lesen Sie die Anweisungen in der Bedienungsanleitung des Verstärkers Herstellung für die entsprechenden Messeinstellungen. Für eine gute Aufzeichnungselektrode, haben einen Spitzenwiderstand von ~ 100-220 MOhm.
- Ziehen Sie den Bezug von Mikroelektroden filamentierten Borosilikat (Außendurchmesser: 1,0 mm; Innendurchmesser 0,6 mm) oder Quarzglas (Außendurchmesser: 1,0 mm; Innendurchmesser von 0,5, 0,6 oder 0,7 mm) Schlauch mit einer Pipette Abzieher Instrument. Versuchen Sie, eine kurze allmähliche Verjüngung zu erreichen.
2. Drosophila Vorbereitung
- Sammelt 5 - 10 Tagen alt Fliegen (nach dem Schlüpfen) und legen Sie sie in einem sauberen Fliegen Röhrchen mit standard Essen. Es ist möglich, gute Aufnahmen zu erreichen von jüngeren zu fliegen, auch von den "Neugeborenen"; aber wegen ihrer weicheren Augen ist eine Hornhautöffnung für die Aufzeichnungselektrode Schneiden schwieriger.
- Konstruieren Sie eine Fliege fangen Rohr und eine Fliege Vorbereitung stehen (Abbildung 4). Siehe Abbildung 4 für die allgemeine Vorstellung davon , wie diese selbstgemachte Werkzeuge zusammengefügt wurden.
- die Spitze von 50 ml Kunststoff-Zentrifugenröhrchen des konischen Boden, um eine Fliege fangen Rohr machen, abgeschnitten. Dann legen und das große Ende von 1 ml Pipettenspitze auf diese neue Öffnung kleben.
- Schließlich schneiden Sie das kleine Ende der Pipette auf eine Größe, die leicht eine Fliege durch zu gehen lässt. Konsultieren Sie einen mechanischen Werkstatt ist eine kleine Fliege Vorbereitungsphase zu definieren, die 2-Achsen Drehung und Verriegelung des Fly-Halter zu verschiedenen Positionen ermöglicht.

figure 4. Werkzeuge und Devises benötigt , um den Fly Vorbereitung für die Herstellung. Fliegen - Fangrohr durch Kleben einer 1 ml Kunststoff - Pipettenspitze auf eine 50 - ml - Plastikzentrifugenröhrchen hergestellt. Bespoke Flugvorbereitung Stand ermöglicht eine freie Rotation und Verriegelung des Fly-Halter in einer bevorzugten Position für die Fliege vor. Die Fliege wird von Bienenwachs befestigt, die elektrische Wachs-Heizung verwendet wird. Vaseline durch einen kleinen Applikator hergestellt , indem eine dicke Art Haar auf einem Griff angewendet wird. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Sammeln Sie eine Fliege für das Experiment in einer 1 ml-Pipettenspitze, die kaum eine Fliege ermöglicht passen durch. Bringen Sie die Fliegen-Fangrohr, mit der Pipettenspitze auf sie, zum Fliegenrohr. In einer Fliege fangen, nutzen ihre inhärente Tendenz nach oben (antigravitaxis) steigen in die Pipettenspitze. Vorzugsweise wählen Sie die größte weiblich, wie die Größe eine Rolles in der Elektrophysiologie.
Hinweis: Je größer die Fliege, desto größer ist seine Zellen und desto besser sind die Chancen für eine hohe Qualität intrazellulären Aufnahmen. Kleinere Fliegen (sowohl Weibchen und Männchen) kann auch ausgezeichnete Aufnahmen bieten, aber die Herstellung ist schwieriger zu machen. Sobald die Fliege in einer großen Pipettenspitze gefangen ist, denken Sie daran, die Fliege Rohr zu schließen andere Fliegen an der Flucht zu stoppen. - Verbinden einer 100 ml-Spritze mit einem flexiblen Kunststoffschlauch an der größeren Öffnung der Pipettenspitze - mit der Fliege noch darin.
- Platzieren Sie den schmalen Ende auf der großen Pipettenspitze, die gerade vergrößert ist ein Drosophila durchzulassen, um die Öffnung in der Unterseite des Fliegenhalters und drücken ein kleines Volumen an Luft aus der Spritze die Fliege in die Fliegenhalter auszuwerfen .
- Schauen Sie durch das Stereomikroskop und sanft mehr Luft verabreichen, bis der Kopf des Fliege aus dem konischen Ende des Fliegenhalter vorsteht. Stellen Sie sicher, dass die Fliege fest von seinem Brustkorb zu dem kleinen ope gefangen ist, die am oberen Ende des Fly-Halter.
- Verwenden Sie eine Wachsheizung, die Fliege mit Bienenwachs aus seiner "Schultern" an den Fly-Halter zu befestigen. Stellen Sie die Temperatur des Wachsheizung so niedrig wie möglich sein, noch sauber, das Wachs schmilzt.
Hinweis: Wenn die Temperatur korrekt ist, das Wachs transparent erscheint. Zu hohe Temperatur macht das Wachs "verbrennen"; zu niedrig hält das Wachs steif. Wenn die Fliege Festsetzung genau und kurz wie längerer Hitzeeinwirkung kann es beschädigt werden. Mit lichthärtenden Dentalkleber wird hier nicht empfohlen, da seine Anwendung zu langsam ist.

Abbildung 5. Vorbereiten der Fliege für In - vivo - Experimente. Links ein Drosophila den Kopf ist gerade im Fliegenhalter positioniert und fixiert , von seinem Rüssel, das rechte Auge und Schultern zum Fliegenhalter mit erwärmt werdeneswax. Richtig, eine kleine Öffnung in der dickste Teil des Auges geschnitten, gerade über dem Äquator und nur ein paar Ommatidien weg von der Rückseite Kutikula, einen scharfen Messers Schneide verwendet wird . Ein Stück Hornhaut wird sanft entfernt und das Loch wird mit Vaseline versiegelt , um das Auge zu verhindern , vor dem Austrocknen. Bitte hier klicken um eine größere Version dieser Figur zu sehen.
- Unbeweglichkeitseffekt den Kopf des Fliege. Bewerben Bienenwachs auf den Rüssel (Abbildung 5) und die Ecke des rechten Auges, die Hornhaut zu vermeiden, und befestigen Sie den Kopf von diesen Punkten zum Fly-Halter.
- Produzieren Sie ein Mikro-Messer. Klemmen Sie einen nicht-Edelstahl-Rasierklinge mit zwei Messerhalter / Brecher (beide mit flachen Griff) und knacken einen kleinen Streifen seiner scharfen Kante. Für die Gesundheit und Sicherheit benutzen Brille zum Schutz der Augen (auch wenn es sehr unwahrscheinlich ist, dass Stücke abprallen würde, wenn der Rasierer geknackt wird). Ideal,erzeugen einen scharfen Messers Schneide, die einen Turm ähnelt. Stellen Sie sicher, dass diese "Turm" fest mit dem Klingenhalter befestigt ist, aber vorsichtig sein, jede Selbst Verletzungen zu vermeiden!
- Mit dem Mikro-Messer, bereiten eine kleine Öffnungsgröße von wenigen Ommatidien in das linke Auge des fly - bei etwa 4 - 5 Ommatidien von der dorsalen Kutikula knapp über dem Äquator des Auges den Durchgang für die Aufnahme Mikroelektrode zur Verfügung zu stellen. Führen Sie unter einem Stereomikroskop, das Präparat mit hoher Vergrößerung betrachtet.
Hinweis: Da die Fliege Auge elastischen und resistiven fühlt sich zu Sondierung, das Loch ist am besten Schnitt mit einem "Turm" -Messer. Die Schneidetechnik ist ziemlich schwierig, so achten Sie genau auf die Video-Demonstration. Keeping the fly Halter in bestimmten Orientierungen (in der Flugvorbereitung Stand) kann die Präparation zu erleichtern. Zu Beginn kann der Mikro schwer fühlen, zu lernen, aber einmal verpflichtet, neuronale Anpassung verbessert stufenweise den 3D-Wahrnehmung des Untersuchers und Geschicklichkeit. - Remove sorgfältig das kleine Stück Hornhaut von der Öffnung, die gerade geschnitten wurde, unter die Netzhaut freigelegt wird. Geschwind decken das Loch in das Auge mit einem winzigen Klecks Vaseline die feinen Haare des Vaseline auftragen.
Hinweis: Vaseline hier mehrere Rollen dient. Es verhindert, dass Gewebe Austrocknung und Koagulation des Hämolymphe, die die eingesetzten Aufzeichnungselektrode brechen würde. Es ist auch im übrigen Schichten die Mikroelektrode, seine intra-Kapazität zu reduzieren. Dies kann den Frequenzgang des Aufzeichnungssystems, zu verbessern und so die zeitliche Auflösung der aufgezeichneten neuronalen Signale. Vermeiden Vaseline über den Rest des Auges zu verschmieren, da dies die Optik verwischt.
3. Die Aufnahme von R1-R6 oder LMCs Photorezeptoren
- Immer geerdet werden, wenn die Mikroelektrode Verstärker arbeitet (beispielsweise durch die Metalloberfläche des Faradayschen Käfigs oder Antischwingungstisch berühren), da dies ein versehentliches ausschließt lieferning eine statische Ladung auf den Kopf-Stufe, die die Schaltung beschädigen könnten.
- Illuminate die Fliege Vorbereitung Plattform Pol von oben durch zwei Schwanenhalslichtleiter (6A) (mit der Kaltlichtquelle im Inneren des Faraday - Käfig) , so dass die Fliegenhalter kann auf der Stange in der bevorzugten Position unter enger visuelle Kontrolle gestellt werden .
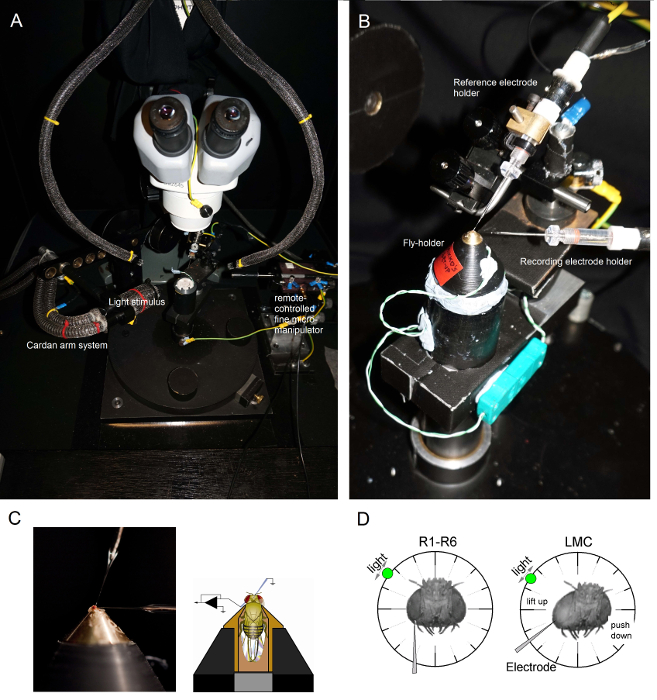
Abbildung 6. Positionierung des Fly-Halter und die Elektroden für die Experimente (AB) Der Fly-Halter auf der Aufzeichnungs Plattform platziert wird , die auch Temperaturregelung über ein Peltier - Element ist (A: weiße runde Plattform in der Mitte).. Die Kardan-Arm ermöglicht eine exakte Positionierung des Lichtreizes in einem gleichen Abstand (über x, y-Rotation) um die Fliege mit der Lichtquelle (eine Flüssigkeit oder Quarzglasfaserbündelende) direkt mit seinem Auge zeigt. In vielen our Rigs wird Licht Stimulation durch LEDs erzeugt (mit linearen Strom-Treiber) oder durch einen Monochromator. So tragen ihre Reize eine bestimmte (Band bestanden) spektralen Gehalt, ausgewählt zwischen 300-740 nm und die Abdeckung 4 - 6 log Intensität Einheit Bereich (wie durch separate Neutraldichtefilter abgeschwächt). (C) Zwei Mikroelektroden, gesteuert durch getrennte Mikromanipulatoren sind im Fliegenkopf positioniert: die Referenzelektrode (oben) durch die ocelli; die Aufzeichnungselektrode (links) durch die kleine Öffnung in dem linken Auge. (D) für eine maximale Anzahl von Photorezeptor - Aufnahmen erhalten, die Aufzeichnungsmikroelektrode in das Loch getrieben wird, parallel zu der rüssel ocellus Achse. Wenn die Elektrodenspitze penetriert und Dichtungen auf einem Photorezeptor, wird die frei drehbare Lichtquelle zu der Position befestigt, wo die Zelle, die die maximale Spannung als Reaktion auf eine gegebene Lichtreiz erzeugt. Dieser Punkt im Raum liegt in der Mitte der rezeptiven Feld der Zelle. Wenn das Loch is nahe an der Kutikula kann LMC Durchdringungen weiter mit diesem gleichen Elektrodenwinkel erreicht werden (links). Wenn das Loch weiter von der Kutikula ist, eine weitere nützliche Elektrode Annäherungswinkel zu LMC Aufnahmen erhalten , wird auch gezeigt (rechts). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Montieren Sie den Fly-Halter (mit der Fliege drin!) On the fly Vorbereitung Plattform Pol. Drehen Sie den Fly-Halter , so dass das linke Auge des Fliege direkt die Ermittler (6B) zugewandt ist.
- Legen Sie die stumpfe Referenzelektrode sanft durch die Occelli Fliege in die Kopfkapsel einen kleinen groben Mikromanipulator mit , während der Vorbereitung durch das Stereomikroskop (6C) zu beobachten. zu tief Elektrode nicht drücken, da dies das Fliegenhirn schädigen können.
- Alternativ legen Sie die Referenzelektrode in die Rückseite des Thorax. Immer darauf achten, dass die Fliege heathy erscheint (bewegt seine Antennen) und seine Augen sind intakt; nicht versehentlich beschädigt werden. Wenn die Zubereitung als makellos weniger sieht, eine neue Fliege für die Experimente vorzubereiten.
- Fahren Sie die scharfe Aufnahme Mikroelektrode in das linke Auge durch die Vaseline bedeckt kleine Öffnung vorbereitet früher. Verwenden hoher Vergrößerung in dem Stereomikroskop und bewegen Sie die Lichtleiter und die Brennebene, so dass die Elektrodenspitze Lage in 3D durch seine Reflexionsmuster sichtbar wird.
Hinweis: Abbildung 6D zeigt , wie der Kopf der Fliege sollte etwas anders positioniert werden (in Bezug auf den Winkel der Aufnahme Mikroelektrode in das Auge eintritt) für Photorezeptor und LMC - Aufnahmen. Fahren Sie die Elektrode in das Auge, ohne sie zu brechen ist die schwierigste Phase des Experiments. Wenn die Elektrodenspitze die kleine Öffnung im Auge gelangt sein, um die Hornhaut trifft, bricht es in der Regel. - Schalten Sie den Mikroelektroden-VerstärkerSobald beide Elektroden sind fest in der Zubereitung, in elektrischen Kontakt mit den Körperflüssigkeiten Fliege.
- Schalten Sie die Kaltlichtquelle (innerhalb des Faraday-Käfig) aus und ziehen Sie ihn vom Netz. Schließen Sie ihre Stecker an die zentrale Masse zu minimieren Erdungs- elektrisches Rauschen induziert wird, und bewegen Sie die Schwanenhals-Lichtleiter weg, so dass der Kardan-Arm-System kann frei um die Fliege bewegt werden. Schalten Sie die Raumbeleuchtung, um sicherzustellen, dass die Flugvorbereitung ist jetzt in relativer Dunkelheit.
- Den Widerstand der Aufzeichnungselektrode in das Auge (wie in den Verstärker Bedienungsanleitung angewiesen). Verwenden Sie nur Aufzeichnungselektroden in dem Widerstand von 100 bis 250 MOhm.
Hinweis: Es ist praktisch unmöglich ist, hohe Qualität intrazelluläre Aufnahmen von <70 MOhm Elektrode zu erreichen. Wenn der Widerstand <80 MOhm, ist es wahrscheinlich, daß die Elektrodenspitze gebrochen wird. In diesem Fall schalten Sie den Verstärker und ändern Sie die Aufzeichnungselektrode ab.- Sobald die Elektrodeersetzt wird und in das Auge an, schalten Sie den Verstärker seinen Widerstand zu messen. Manchmal kann die Elektrodenspitze durch eine Detritus verstopft werden, da sie das Gewebe eintritt. Dies kann durch Verwendung des Verstärkers kapazitive Summen und Stromimpulsfunktionen, die typischerweise deutlich, durch eine schnelle Mitschwingen oder Abstoßung behoben werden.
- Stellen Sie den Verstärker auf Stromklemme (CC) oder Brücke Aufnahmemodus. Aufheben jede beliebige Spannungsdifferenz zwischen den Aufzeichnungs- und Referenzelektroden, da beide von ihnen nun in der elektrisch miteinander verbundenen extrazellulären Raum ruht, indem das Signal-Offset (Aufzeichnungsspannung) Einstellen auf Null. Folgen Sie den Signaländerungen Offset des Verstärkers Displayanzeige oder ein Oszilloskop Bildschirm.
- Warten Sie 2-3 min für die Fliegenaugen bis dunkel anzupassen.
- Fahren Sie die Aufzeichnungselektrodenspitze allmählich tiefer in das Auge mit kleinen 0,1 bis 1 Mikrometer Schritten. Dies mit einem x-Achsen-Piezoschritt eines ferngesteuerten Mikromanipulators oder by Drehen sanft die feine Auflösung Knopf eines manuellen Manipulator.
- Stimulieren Sie die Fliege Auge mit kurzen (1 - 10 ms) Lichtblitze als die Aufzeichnungselektrode in das Gewebe vorgeschoben wird.
Hinweis: Wenn die Aufzeichnungselektrode in der Netzhaut und das Auge funktioniert normalerweise positioniert ist, wird jeder Lichtblitz eine kurze und kleine Abfall der Spannung verursachen (0,2-5 mV Hyperpolarisation), die Elektroretinogramms genannt (ERG). Diese Änderung des Feldpotentials der extrazellulären Raum durch die Netzhautzellen "kollektive Reaktion auf Licht verursacht. Sobald jedoch der Elektrodenspitze die Lamina eintritt, auf den LMCs Schließen der ERG umkehrt, zeigt depolarisierenden Antworten. - Bewegen Sie die Lichtquelle rund um die Fliegenaugen durch die Kardan-Arm-System und die Position, wo das Licht die größte ERG Reaktion hervorruft.
Anmerkung: Diese Position markiert den kleinen Bereich in dem Bildraum, wo die Photorezeptoren (oder LMCs), die neben der Spitze der Aufzeichnungselektrode angeordnet sind,Probe, deren Lichteingang. - Dringen eine Zelle mit der Aufzeichnungselektrode.
Hinweis: Das Eindringen spontan auftreten kann, oder wenn die Elektrode Vorwärtsmikro abgestuft ist. Es kann weiter sanft erleichtert werden, indem der Mikromanipulator-System tippen oder das Summen-Funktion des Verstärkers verwendet wird; diese Aktionen in Resonanz mit der Elektrodenspitze in das Gewebe. Wenn die Elektrode der Fotorezeptormembran aufspießt, seine intrazellulären Raum eintritt, fällt die Spannungsdifferenz zwischen der Aufzeichnungs- und Referenzelektrode plötzlich von 0 mV bis -65 mV ~ (zwischen -55 und -75 mV); während bei der LMC Durchdringungen, ist dieser Rückgang der Regel weniger (zwischen -30 und -50 mV). Diese Spannungsdifferenzen stellen die negativen Ruhepotentialen der gegebenen Zellen. Abhängig von der Qualität der Aufzeichnungselektrode (die Schärfe) und dem zellulären Prozess es der Spannungswert von der Aufzeichnungselektrode eingedrungen, kann dem Ruhepotential schnell oder allmählich zu stabilisieren, wie die ZellmembranDichtungen an der Außenschicht der Elektrode. Aber wenn das Eindringen nur teilweise oder schlecht ist, rutscht die Elektrode typischerweise aus der Zelle mit dem aufgezeichneten Potential climbing zurück in Richtung Null. - Localize das Zentrum des rezeptiven Feldes eingedrungen Zelle, wenn die Elektrode richtig verschlossen erscheint, zeigt stabile Membranpotential (dunkel Ruhepotential). Bewegen Sie den blinkenden Lichtreiz um das Fliegenauge, die Kardan-Arm-System, den Punkt im Bildraum zu finden, wo der Lichtblitz der Zelle maximalen Spannungsantwort hervorruft. Sperren Sie die Kardan-Arm, wenn der Lichtreiz direkt zugewandt ist (zeigt auf) das rezeptive Feld Zentrum.
Hinweis: In der Dunkelheit, Drosophila Photorezeptoren reagieren auf helle Lichtimpulse mit 40 - 65 mV depolarisierende Spannungsantworten 4,5, während stabile LMC Aufnahmen zeigen 20 bis 45 mV hyperpolarisierender Antworten 9,10,14. Glia Durchdringungen können in seltenen Fällen, angezeigt durch <-80 mV Ruhepotentiale passieren und viel langsamerund kleiner (~ 5 mV) durch Licht induzierten Depolarisationen gesättigt. Photorezeptoren in Drosophila mit verschiedenen Augen Pigmentierungen, wie Weißauge 7 und Zinnober, zeigen vergleichbare Antwortgrößen zu Wildtyp. - Mit Hilfe des Verstärkers Stromklemme (CC) Modus, kompensieren die Kapazität des Aufzeichnungselektrode durch kleine 0,1 nA Injektion und kurz (100-200 ms) Stromimpulse in den untersuchten Zell Aufnahme Artefakte während der Membranladung zu minimieren.
Hinweis: Dieser wichtige Vorgang wird im Detail erklärt in der Bedienungsanleitung des Verstärkers und sollte mit einer elektrischen Zellmodell vor den eigentlichen Experimente durchgeführt werden. - Nehmen Spannung Reaktionen auf Lichtimpulse und andere Stimuli von Interesse, unterschiedlichen statistischen oder physikalische Eigenschaften aufweisen (wie naturalistische Lichtintensität Zeitreihe oder zufälligen Kontrastmustern). Test, zum Beispiel, wie die aufgezeichneten Antworten mit Licht- oder Dunkeladaption ändern.
Hinweis: Man kann genau light-Anpassung der untersuchten Zelle durch kontinuierliches Licht von vorgewählten Intensität durch Zugabe von Neutraldichtefilter auf dem Lichtweg 4,5. Alternativ kann für längere Dunkel Anpassung der Lichtreiz für eine voreingestellte Zeit auszuschalten. Aufgrund der mechanischen Stabilität des Aufzeichnungssystems, die hohe Qualität der Aufzeichnungselektroden und die Intaktheit der Zubereitung kann eine stabile Aufzeichnungsbedingungen manchmal für viele Stunden dauern. Somit an einem guten Tag, ist es möglich, eine große Menge von Daten bei unterschiedlichen Anpassungsbedingungen aus einer einzigen Zelle zu sammeln. Wenn die Elektrode aus der Zelle gleitet, vermindern die aufgezeichneten Reaktionen und die mittlere Spannung Null beginnt zu nähern. - Vorzurücken sorgfältig die Aufzeichnungselektrode mit dem feinen x-Achsen-Steuerung des Mikromanipulators, bis die Elektrode in Kontakt kommt und dringt in die nächste Zelle (dies ist normalerweise die nächste neurale Nachbar). bewegen, um die Elektrode nicht entlang y- oder z-Achse wie diese Manöver die Elektrode machen würde "plough das Gewebe "zur Seite, zu beschädigen Augenstrukturen!
Hinweis: Mit einem guten Elektrode und eine gesunde Zubereitung kann man qualitativ hochwertige Antworten von vielen Photorezeptoren (aber selten von vielen LMCs) in der gleichen Fliege über einen Zeitraum von mehreren Stunden aufzuzeichnen; gelegentlich, über den gesamten Arbeitstag (> 8 h) ohne klare Signalverschlechterung. - Speichern Sie Dateien in regelmäßigen Abständen mit identifizierenden Informationen, wie Datum, Genotyp, und der aufgezeichneten Zelltyp. Aufgrund der großen Menge an Daten, die in einer erfolgreichen Aufnahmesitzung gesammelt werden können, halten gute schriftliche Aufzeichnungen in einem Labor-Buch für zukünftige Datenanalyse.
Ergebnisse
Die scharfe Mikroelektroden - Aufzeichnungsverfahren, wie hier für das Auge Drosophila angepasst, kann zuverlässig verwendet werden , um neuronale Informations Probenahme und Verarbeitung in der Netzhaut und Lamina Zellen, und die Kommunikation zwischen ihnen 4,5,7,8,10,33 quantifizieren. Durch die Verwendung Codierung in verschiedenen Wildtyp-Bestände zu untersuchen, Mutanten oder genetisch Fliegenstämme entwickelt, hat das Verfahren sich bewährt; nicht nur in die Auswirkungen einer Mutation, die Temperatur, Ernährung oder ausgewählten Ausdruck Quantifizierung 3,4,6,9,10,14,30,34, sondern auch mechanistischen Gründe für veränderte visuelle Verhalten 14,34 in enthüllt. Das Verfahren ist auch ohne weiteres auf andere Insekten Zubereitungen 35,36, Befähigung neuroethologischen Vision Studien. wir präsentieren Next einige Beispiele für seine erfolgreiche Anwendungen.

Abbildung 7. SpannungsAntworten eines Fruchtfliegen - R1-R6 Photorezeptor auf einen Lichtimpuls bei 20 und 25 ° C. Da die scharfen Mikroelektroden - Penetrationen oft sehr stabil sind, ist es möglich , Spannungsantworten des gleichen R1-R6 Photorezeptor zu einem gegebenen Lichtreiz aufnehmen zu unterschiedlichen Umgebungstemperaturen durch Erwärmen oder Abkühlen der Fliege. In unserem Set-ups ist die Fly-Halter auf einem geschlossenen Regelkreis-Peltier-Element-basierte Temperatur-Kontrollsystem gegeben. Dies ermöglicht uns, die Kopftemperatur in Sekunden Fliege ändern. Eine höhere Temperatur beschleunigt die Spannungsantworten und in charakteristischer Weise senkt das Ruhepotential der R1-R6 Photorezeptoren (wie durch rote Pfeile gekennzeichnet). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Die Untersuchung der Einfluss der Temperatur auf dem Photorezeptor Output
Mit einem gut gestalteten und schwingungsisolierten Aufnahmesystem kann das Verfahren verwendet werden, um den Einfluss der Temperatur auf einer einzelnen Zelle des neuronalen Ausgang durch Erwärmung messen oder Fliege Kühlung. Das gegebene Beispiel zeigt Spannungsantworten zu einer hellen 10 msec langen Impuls, in der gleichen R1-R6 Photorezeptor aufgezeichnet bei 20 und 25 o C (Abbildung 7). Wie quantifiziert vor 4,9 senkt Erwärmung ein Ruhepotential des Photorezeptors in der Finsternis, und beschleunigt seine Spannung Antworten.
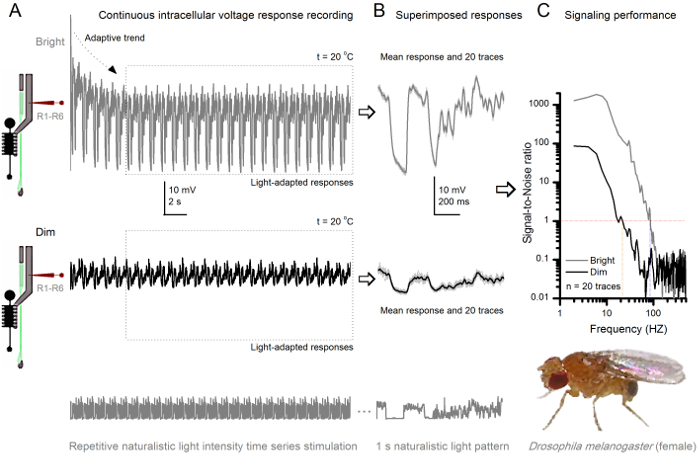
Abbildung 8. Signalleistung eine Fruchtfliegen - R1-R6 Photorezeptor Verbessert mit der Lichtintensität (A) Photorezeptor Ausgang zu dimmen (unten) und hell. (Oben; 10.000-mal heller Licht) wiederholt naturalistischen Lichtintensität Zeitreihe mit dem gleichen Mikroelektroden aufgezeichnetin der gleichen Zelle bei 20 o C. Die Reaktionen auf den hellen Reiz größer sind, weil sie mehr Proben, elementare Antworten (Bumps) auf einzelne Photonen 4,5,7,8 integrieren. (B) 20 aufeinanderfolgende Ein-Sekunden langen Spannungsantworten überlagert werden. Individuelle Antworten (hellgrau) wurden nach den adaptiven Trends genommen (in Pfeil A) hatte zurückgegangen (gepunktete Box in A). Die entsprechenden Antwortmittel (die Signale) sind die dunkleren Spuren. Die Differenz zwischen dem Signal und den individuellen Reaktionen ist das Rauschen. (C) Die Zellen Signal-zu-Rausch - Verhältnisse "Signalisierungsleistung wurde durch die Aufnahmen quantifiziert" (SNR) unter Verwendung der Standardmethoden 4,5,7,8. Der Photorezeptor - Ausgang hat etwa 64 Hz breiteres Spektrum an zuverlässigen Signalisierung an der hellen Stimulation (SNR 'Bright ≥1, bis zu 84 Hz) als an der dim (SNR' Dim ≥1, bis zu 20 Hz), mit signal-zu-Rausch-Verhältnis erheblich zu verbessern; von SNR Dim MAX = 87 bis SNR Hell MAX = 1.868. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Studieren Anpassung und Neuronale Kodierung durch repetitive Stimulation
Die Nichtinvasivität des Verfahrens, was relativ wenig Schaden in der Retina und Lamina Strukturen, macht es ideal für die Signalisierung Leistung der einzelnen Zellen auf unterschiedliche Lichtreize in ihrer nahen natürlichen physiologischen Zustand in vivo zu studieren. 8 zeigt Spannungsantworten eines R1- R6 Photorezeptor zu einem dunklen und hellen wiederholt naturalistischen Serie Stimulus Lichtintensität bei 20 ° C, während 9 zeigt Reaktionen eines anderen R1-R6 Photorezeptor und einer LMC zu einem anderen naturalistischen Reiz bei 25 o C. Die prä - und postsynaptischen Aufnahmen wurden getrennt von zwei verschiedenen Fliegen durchgeführt , weil die gleichzeitige intrazelluläre Aufnahme von zwei scharfen Mikroelektroden in der gleichen Fliege, eine in der Netzhaut und die andere in der Lamina, zu schwierig sind 30 lebensfähig zu sein.
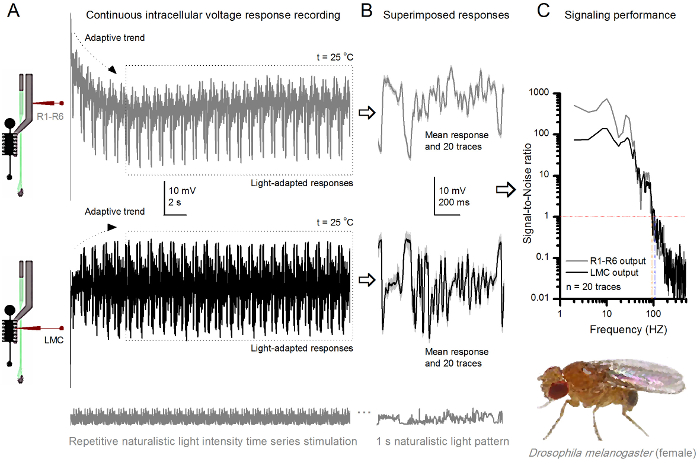
Abbildung 9. Spannungsantworten einer Fruchtfliege R1-R6 Photorezeptor und LMC Wiederholte Naturalistische Stimulation bei 25 o C (A) R1-R6 (grau) und LMC (schwarz) Ausgänge von verschiedenen Mikroelektroden aus verschiedenen Fliegen aufgezeichnet. (B) Völlig Licht angepasst 20 aufeinander folgenden Vor- (oben) und postsynaptischen (unten) Antworten auf die gleiche naturalistischen Reizmuster mit individuellen Antworten, in Licht gezeigt , dass ein graud die entsprechenden Antwortmittel (die Signale) als die dunkleren Spuren. Die Differenz zwischen dem Signal und den individuellen Reaktionen ist das Rauschen. (C) Die Zellen Signal-Rausch - Verhältnis (SNR) "Signalisierungsleistung wurde durch die Aufnahmen quantifiziert". LMC - Ausgang hat etwa 10 Hz breiteres Spektrum an zuverlässigen Signalisierung (SNR 'LMC ≥1, bis zu 104 Hz) als R1-R6 - Ausgang (SNR' R ≥1, bis zu 94 Hz). Beide Signal-zu-Rausch - Verhältnisse sind hoch (SNR LMC MAX = 142, SNR R MAX = 752), und als das Aufzeichnungsrauschen gering war, ihre Unterschiede spiegeln reale Codierung Unterschiede zwischen den Zellen. Bitte hier klicken , um eine größere Version zu sehen diese Figur.
Nach dem Beginn des Stimulus, die Aufnahmen typischly zeigen schnelle Trends anzupassen, die innerhalb von 5-6 sec weitgehend abklingen. Von da an produzieren die Zellen sehr konsistente Antworten auf jede 1 Sekunde lang Stimuluspräsentation (jede gepunktete Box 20 davon umschließt). Die Wiederholbarkeit der Antworten wird offensichtlich , wenn diese überlagert sind (8B und 9B). Die individuellen Antworten sind die dünnen grauen Spuren, und ihre die dicker dunkler Spur bedeuten. Die mittlere Antwort wird als neuronales Signal genommen, während das neuronale Rauschen die Differenz zwischen dem Mittelwert und jeder einzelnen Antwort 4,5,9,37,38 ist. Die jeweiligen Signal-zu-Rausch - Verhältnis im Frequenzbereich (8C und 9C) wurden durch erhaltenen Fourier-Transformieren der Signal- und Rauschdatenabschnitte in Leistungsspektren, und Dividieren des mittleren Signalleistungsspektrum mit dem entsprechenden mittleren Rauschleistungsspektrum 4, 5,9,37,38. Charakteristischer die maximalen Signal-zu-Rausch-Verhältnisse of die aufgezeichneten neuronalen Ausgänge auf naturalistische Stimulation sind hoch (100 - 1000), und in den stabilsten Zubereitungen mit sehr niedrigen Aufzeichnungsrauschen kann Werte erreichen >> 1000 ( zum Beispiel 8C.). Beachten Sie auch , dass die Erwärmung dehnt sich die Zellen der Bandbreite von zuverlässigen Signalisierung 4 (SNR 'Bright ≥ 1); die relative Differenz zwischen den beiden R1-R6s beispielsweise in den Figuren 8 bzw. 9, 10 Hz (84 bei 20 o C und 94 Hz bei 25 o C).
Man kann weiter jede Rate der Zelle Schätzung der Informationsübertragung von seinem Signal-zu-Rausch - Verhältnis durch die Gleichung Shannon mit 32, oder durch den Unterschied zwischen den Antworten der Entropie und Lärm Entropierate durch die dreifache Extrapolationsmethode 39 zu berechnen. Weitere Einzelheiten zu den Informationen theoretischen Analysen und deren Verwendung und Beschränkungs speziell mit dieser Methode sind in den früheren Veröffentlichungen 7,8,39 gegeben.
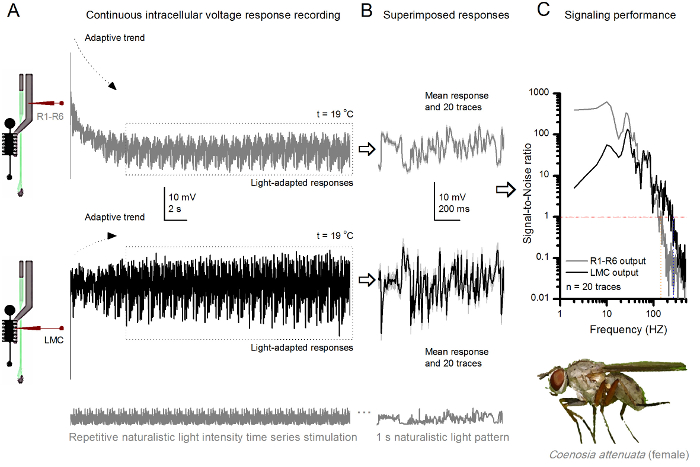
Abbildung 10. Spannungsantworten eines Killer - Fly R1-R6 Photorezeptor und LMC Wiederholte Naturalistische Stimulation bei 19 o C (A) R1-R6 (grau) und LMC (schwarz) gibt mit dem gleichen Mikroelektrode aus dem gleichen Fliege aufgezeichnet; erste postsynaptisch und später präsynaptisch, da die Elektrode im Auge fortgeschritten war. (B) 20 aufeinanderfolgende prä- (oben) und postsynaptischen (unten) Antworten (hellgrau Spuren) auf denselben naturalistischen Reizmuster wurden nach der ersten Anpassung (gepunktete Box in A) erfasst. Ihre Mittel sind die Signale (die dunkleren Spuren oben), während ihre jeweiligen Differenzen zu den einzelnen Antworten der Lärm geben. (C) Das entsprechende Signal-zu-Rausch - Verhältnis (SNR) wurden , wie in den 8C und 9C berechnet. LMC - Ausgang über ein 100 Hz breiteres Spektrum an zuverlässigen Signalisierung (SNR 'LMC MAX ≥1 bis zu 234 Hz) als R1-R6 - Ausgang (SNR' R MAX ≥1, bis 134 Hz). Beide Signal-zu-Rausch - Verhältnisse sind hoch (SNR LMC MAX = 137, SNR R MAX = 627) und als die gleiche Mikroelektrode in die Aufnahmen eingesetzt, deren Unterschiede spiegeln wirkliche Unterschiede in den prä- und postsynaptischen neuronalen Ausgänge. Diese Ergebnisse implizieren , dass das Aufzeichnungssystem geringes Rauschen hatte, und dessen Einfluss auf die Analysen war marginal. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Neuroethologischen Vision - Studien
Das Verfahren kann auch prä - und postsynaptischen Spannung Antworten von den Facettenaugen verschiedener Insektenarten 7,8,35,36 (Abbildung 10), ermöglicht vergleichende neuroethologischen Studien der visuellen Informationsverarbeitung zur Aufzeichnung verwendet werden. Für die dargestellten Aufzeichnungssystem ist die einzige erforderliche Anpassung neuer Vorbereitung Halter, die jeweils mit einem angemessen dimensionierten Öffnung für die untersuchten Arten. Diese beispielhaften Aufnahmen sind aus einer weiblichen Killer fliegen (Coenosia attenuata). Sie zeigen intrazellulärem Spannungsantworten eines R1-R6 Photorezeptor und LMC identische sich wiederholende Lichtstimulation, wie sie für die Drosophila Pendants in Figur 9 verwendet, aber bei 19 o C. In diesem Fall sind sowohl die prä- und postsynaptischen Daten wurden aus der gleichen fly aufgezeichnet; einer nach dem anderen, zuerst mit dem gleichen Aufzeichnungselektrode (gefüllt mit 3 M KCl) durch die seitliche lamina Vorschieben vor eingebening die frontale Retina. Im Vergleich zu den Drosophila - Daten bei 25 o C, die Coenosia Daten - selbst bei der Kühlertemperatur - zeigt Antworten mit schnelleren Dynamik; die Erweiterung der Palette an zuverlässigen Signalisierung (Signal-zu-Rausch-Verhältnis >> 1) über einen breiteren Frequenzbereich. Derartige funktionelle Anpassungen in neuronale Codierung der naturalistischen Reize sind im Einklang mit Coenosia 's räuberische Lebensweise 36, die hochpräzise Raumzeit - Informations erfordern schnelle Luftjagdverhalten zu erreichen.
Diskussion
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier's recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine - having too high a resistance or intramural capacitance - to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode's time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer's solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax - if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas - picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips' electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today's optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells' electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Offenlegungen
The authors have nothing to disclose
Danksagungen
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ's current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
Materialien
| Name | Company | Catalog Number | Comments |
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30X eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| Nikon microscope | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| Newport | |||
| Micromanipulators | Narishige | Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| Huxley Bertram | Huxley xyz-axis with fine manual control | ||
| Sensapex | Sensapex triple axis | ||
| Märzhäuser | Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3 - 0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
Referenzen
- Meinertzhagen, I. A., O'Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C., Ottoson, D. . Progress in Sensory Physiology. 5, 1-79 (1985).
- Borst, A. Drosophila's View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) - Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron - Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. . Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173 (2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten