Method Article
الطريقة الكهربية لالردود تسجيل بين الخلايا الجهد ل
In This Article
Summary
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Abstract
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell's receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator's experimental objectives, it grants outstanding in vivo neurophysiological data.
Introduction
ذبابة الفاكهة (ذبابة الفاكهة) مجمع العين هو نظام نموذج رائع للتحقيق في التنظيم الوظيفي للمبصرة وعصبون المصفوفات لأخذ العينات صورة العصبية وتجهيزها، ولرؤية الحيوانات. النظام لديه مخطط الأسلاك الأكثر اكتمالا 1،2 وودي إلى التلاعب الجيني ودقيقة للرصد النشاط العصبي (ارتفاع نسبة الإشارة إلى الضوضاء والوقت قرار) 3-10.
العين ذبابة الفاكهة هي وحدات، والتي تحتوي على 750 ~ الهياكل المغطاة عدسة على ما يبدو العادية يسمى ommatidia، والتي توفر معا تطير المجال البصري بانورامية التي تغطي الاتجاه تقريبا في جميع أنحاء رأسه. المعلومات الأولية العين أخذ العينات وحدات هي خلايا مستقبلة للضوء رابدوميريك لها 7،8،11. كل مقيلة يحتوي على ثمانية خلايا مستقبلة للضوء (R1-R8)، التي تشترك في نفس العدسة الوجه ولكن الانحياز إلى سبعة اتجاهات مختلفة. في حين أن خلايا مستقبلة للضوء الخارجي R1-R6 عالبريد الأكثر حساسية للضوء الأخضر والأزرق والحساسيات الطيفية للخلايا الداخلية R7 وR8، التي تقع فوق بعضها البعض، وأشر إلى نفس الاتجاه، المعرض ثلاثة أنواع فرعية مميزة: شاحب والأصفر وظهري منطقة حافة (DRA) 12- 15.
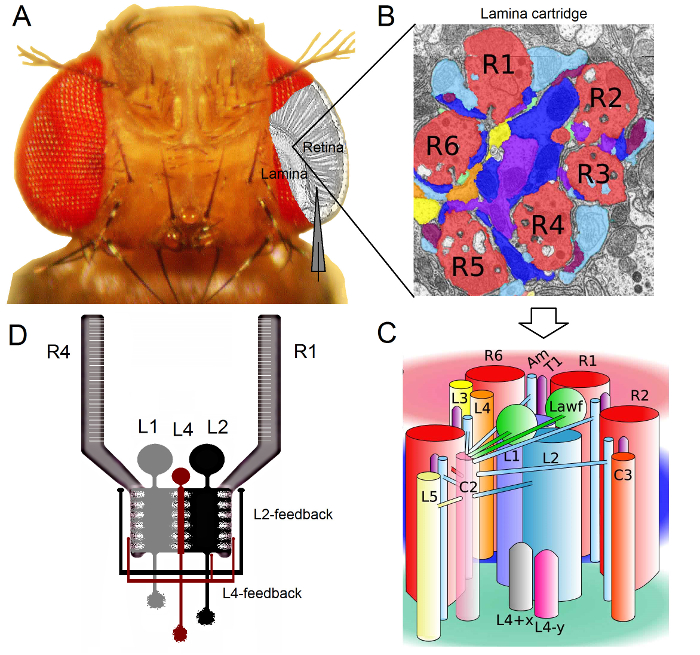
الشكل 1. منظمة الوظيفية من ذبابة الفاكهة العين. (أ) أول اثنين من العقد البصري، شبكية العين والصفيحة، ويسلط الضوء في الرمادي داخل العين الطاير. مبصرات شبكية العين R1-R6 والصفيحة خلايا القطب كبيرة (LMCs: L1-L3) يمكن الوصول إليها بسهولة في الجسم الحي إلى تسجيلات مسرى مكروي حادة التقليدية. القطب التخطيطي يسلط الضوء على مسار طبيعي للتسجيل من R1-R6 في شبكية العين. مسار واحد لتسجيل من LMCs في الصفيحة هو التحول في مواز القطب إلى اليسار. (ب) صفيحة هو مصفوفة من الجهاز retinotopicallyخراطيش أوتوماتيكية، كل واحدة منها هي معبأة مع الخلايا العصبية التي بمعالجة المعلومات من منطقة صغيرة محددة في الفضاء البصري. بسبب تراكب العصبي، ست خلايا مستقبلة للضوء من ommatidia المجاورة مختلفة ترسل محاور منها (R1-R6) لنفس خرطوشة الصفيحة، وتشكيل نقاط الاشتباك العصبي الناتج هيستاميني الفعل إلى L1-L3 وخلية عديم الاستطالات (ص). (ج) نشر المعلومات العصبية بين محطات محوار R1-R6 وinterneurons البصرية (بما في ذلك L4، L5، Lawf، C2، C3 و T1)، داخل خرطوشة الصفيحة معقدة. (D) R1-R6 محاور مبصرة تتلقى ردود متشابك من L2 و L4 خلايا أحادي. (ب) و (ج) المعدلة من ريفيرا ألبا وآخرون (2). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
العين ذبابة الفاكهة هي من نوع العصبية تراكب 16. وهذا يعني رقبعة الإشارات العصبية من المستقبلات الضوئية ثمانية ينتمون إلى سبع ommatidia المجاورة، والتي تبدو في نفس النقطة في الفضاء، يتم تجميع معا في خرطوشة العصبية واحدة في neuropils المقبلين: الصفيحة والنخاع. في حين أن ستة خلايا مستقبلة للضوء الخارجي R1-R6 مشروع محطات محوار لأعمدة العصبية في الصفيحة (الشكل 1)، وخلايا R7 وR8 تجاوز هذه الطبقة وإجراء اتصالات متشابك مع هم العمود النخاع 17-19 المقابلة. هذه التمديدات الدقيق تنتج الركيزة العصبية لرسم خرائط شبكي التوضع من رؤية الطيران في وقت مبكر، وعندها كل الصفيحة (الشكلان 1A-C) والعمود النخاع (خرطوشة) يمثل نقطة واحدة في الفضاء.
وردت مدخلات مباشرة من المستقبلات الضوئية R1-R6 من قبل خلايا القطب كبيرة (LMCs: L1 و L2 و L3) وخلية عديم الاستطالات (ص) في الصفيحة 1،2،20. للخروج من هذه، L1 و L2 هي أكبر الخلايا، والتوسط مسارات المعلومات الكبرى (1D الشكل)، مبادرة الخوذ البيضاء الفصل الاستجابة إلى داخل وخارج حواف تتحرك، وبالتالي تشكل الأساس الحسابي لكشف الحركة 21،22. التجارب السلوكية تشير إلى أن في المقابل المتوسط، ومسارات اثنين تسهل تصور الحركة من اتجاهين متعاكسين:-العودة إلى الجبهة في L1 ومن الأمام إلى الخلف في الخلايا L2 23،24. يعني الربط أيضا أن الخلايا العصبية L4 قد تلعب دورا حاسما في التواصل الأفقي بين خراطيش المجاورة 25،26. تم العثور على نقاط الاشتباك العصبي متبادلة بين الخلايا L2 و L4 تقع في نفس واثنين من خراطيش المجاورة. المصب، كل خلية L2 وثلاث خلايا L4 المرتبطة مشروعها المحاور الخاصة بهم إلى الهدف المشترك، والخلايا العصبية TM2 في النخاع، حيث يعتقد المدخلات من خراطيش المجاورة لتكون متكاملة لتجهيز الأمام إلى الخلف حركة 27. على الرغم من أن الخلايا العصبية L1 تلقي المدخلات من نفس خرطوشة L2s سواء عن طريق تقاطعات الفجوة ونقاط الاشتباك العصبي، فهي ليست مرتبطة مباشرة إلى خراطيش الصفيحة L4s وبالتالي المجاورة.
الطبقة = "jove_content"> يتم توفير تغذية مرتدة متشابك إلى محاور مبصرة R1-R6 فقط من الخلايا العصبية التي تنتمي إلى دوائر / L4 L2 لكن ليس L1 مسار 1،2 (1D الشكل). بينما صلات نفس خرطوشة هي انتقائي من L2 لR1 و R2 ومن L4 لR5، تتلقى جميع المستقبلات الضوئية R1-R6 ردود الفعل متشابك من L4 من أحدهما أو كليهما خراطيش المجاورة. وعلاوة على ذلك، هناك اتصالات متشابك قوية من صباحا إلى R1، R2، R4 وR5، والخلايا الدبقية أيضا على اتصال synaptically إلى الشبكة، وبالتالي يمكن أن تشارك في معالجة الصور العصبي 6. وأخيرا، محور عصبي الفجوة تقاطعات، وربط R1-R6 وبين R6 وR7 / R8 المستقبلات الضوئية المجاورة في الصفيحة، والمساهمة في تمثيل المعلومات غير المتماثلة والمعالجة في كل خرطوشة 14،20،28.
تسجيلات الجهد داخل الخلايا من خلايا مستقبلة للضوء الفردية وinterneurons البصرية في ذبابة الفاكهة سليمة تقريبا توفر عالية ص الإشارة إلى الضوضاءالبيانات ATIO في قرار ميلي ثانية واحدة الفرعي 3،5،7-10،29، وهو أمر ضروري لجعل الشعور الحسابية العصبية السريعة بين الخلايا العصبية المتصلة. هذا المستوى من الدقة أمر مستحيل من خلال تقنيات التصوير الضوئية الحالية، والتي هي ضجيج كبير وتعمل عادة في 10-100 قرار مللي ثانية. وعلاوة على ذلك، لأن أقطاب لديها نصائح صغيرة جدا وحادة، لا يقتصر على طريقة لأجسام الخلايا، ولكن يمكن أن توفر التسجيلات المباشرة من الهياكل العصبية نشطة الصغيرة؛ مثل أشجار شجيري من LMCs "أو المحاور العصبية مستقبلة للضوء، والتي لا يمكن الوصول إليها من قبل نصائح أكبر بكثير من الأقطاب الكهربائية التصحيح، المشبك. الأهم من ذلك، فإن هذه الطريقة أيضا هيكليا أقل الغازية وضررا من معظم التطبيقات التصحيح، المشبك، وذلك يؤثر على أقل الوسط والمعلومات أخذ العينات داخل الخلايا الخلايا درس. وهكذا، وقد ساهمت التقنيات مسرى مكروي حادة التقليدية، والحفاظ على المساهمة والاكتشافات الأساسية والبصيرة الأصلي إلى تقنية المعلومات العصبيةمعالجة املعلومات في نطاق الوقت المناسب. تحسين فهمنا الآلية الرؤية 3-10.
توضح هذه المقالة كيفية في التسجيلات داخل الخلايا المجراة من ذبابة الفاكهة خلايا مستقبلة للضوء R1-R6 وLMCs تتم في المختبر Juusola. وهذا البروتوكول يصف كيفية بناء تلاعب الكهربية مناسبة، وإعداد الطاير، وإجراء التسجيلات. ويرد بعض البيانات تمثيلا، وتتم مناقشة بعض القضايا المشتركة والحلول المحتملة التي قد تواجهها عند استخدام هذا الأسلوب.
Protocol
يتوافق بروتوكول التالية مع جميع المبادئ التوجيهية رعاية الحيوان من جامعة شيفيلد وجامعة بكين للمعلمين.
1. الكواشف وإعداد المعدات
- تسجيل وإعداد الخفيفة تحفيز معدات
- اختيار ما لا يقل عن منطقة تسجيل 2.5 × 2.5 م لإجراء التجارب الكهربية في الغرفة التي يوجد تكييف الهواء مع الرطوبة التنظيم والوسائل لتوفير ظروف التسجيل المظلمة. تأكد من أن هذه المنطقة هي كبيرة بما يكفي لتناسب بشكل مريح على: (أ) 1 × 1 م الجدول الاهتزاز والعزل الذي يضم تلاعب [يطير التحفيز وأجهزة تسجيل]، مجهر تشريحي ومصدر ضوء بارد مع اثنين من رقاب أوزة، كل محاطة داخل كبيرة> 180 سم قفص فاراداي. (ب) معدات 38U رف للسكن جهاز كمبيوتر شخصي مع شاشات الكريستال السائل المسطحة، مكبر للصوت مسرى مكروي، والسائقين الصمام، والمرشحات، ووحدات التحكم في درجة الحرارة، الذبذبات وغيرها من الأدوات الكهربائية المطلوبة؛ و (ج) لمكتب صغير وكرسي للمحقق.
- وضع تلاعب بعيدا عن مصادر الضوضاء الكهربائية والميكانيكية، مثل الثلاجات وأجهزة الطرد المركزي والمصاعد. استخدام حماة تصاعد منفصلة لحماية الأجهزة الكهربائية تلاعب من الجهد المسامير التي تحدث في التيار الكهربائي. من الناحية المثالية، ربط تلاعب لالخاصة إمدادات الطاقة غير المنقطعة (UPS البطارية) للحد من الضوضاء.
- بناء مخروطي يطير حامل من النحاس والبلاستيك الأسود (الشكل 2). حفر حفرة صغيرة مستدق من خلال وحدة النحاس الأصفر مع حافة تضييق الخارجي إلى ~ 0.8 مم (مطابقة عرض الصدر ذبابة نموذجي).
ملاحظة: هذا الثقب يحتاج إلى تفتق نحو غيض من ذبابة حامل بحيث أكبر من متوسط ذبابة الفاكهة، والذي من المتوقع من أدناه عن طريق تدفق الهواء، فإن واجهتك مشكلة في الكتف العميق على حافة العليا. - تصميم وبناء ميكانيكيا قوية، بعد دقيقة، ويطير التحفيز وجهاز تسجيل (الشكل 3). بناء من سو الألمنيوم أو النحاس (المعادن عالية الموصلية) ذبابة منصة إعداد قطب وحوله نظام كاردان الذراع، مع الكرات جزءا لا يتجزأ، لتوفير س سلسة ودقيقة، ذ لتحديد المواقع وقفل التحفيز خفيفة.
ملاحظة: هذا التصميم مركب متكامل يقلل الاهتزازات الميكانيكية، والتي يمكن أن إزاحة إلا غيض القطب تسجيل الخروج من الخلية التي شملتها الدراسة. ويمكن مواصلة إدماج وثيقة حلقة نظام التحكم في درجة الحرارة استنادا بلتيير عنصر، وتمكين المحققين على استخدام التركيبات الوراثية حساسة للحرارة، مثل shibire TS، لتقييم حسابات الدوائر متشابك 9،30. أنودة الجهاز أو رسمه الأسود لتقليل ضوء مبعثر التحفيز.- إصلاح تحفيز الطيران وأجهزة التسجيل على اللوح الجدول مضادة للاهتزاز؛ و على سبيل المثال عن طريق M6 البراغي، وذلك باستخدام الثقوب لها المسمار متري. استخدام اللوح الأسود أو تغطية ذلك مع قماش سوداء لتقليل الضوء المبعثر خلال التجارب.
- Positioن وقفل (باستخدام المسمار تأمين) وقابل للتعديل عموديا منصة القطب إعداد ذبابة في مركز نظام كاردان الذراع. وضع ذبابة إعداد (داخل ذبابة حامل، راجع الخطوة 2) على القطب منصة بحيث مصدر الضوء تعلق على كاردان الذراع يشير شعاعيا على رأس الذبابة. ضمان أن مركز عيون الذبابة بالضبط عند نقطة تقاطع (0، 0) من X- في كاردان الذراع و-y محاور، وهذا يتيح س دقيقة، ذ-المواقع من التحفيز الضوء إلى أي نقطة داخل الذبابة المجال البصري.
ملاحظة: هذه الوظيفة ضرورية لرسم خرائط خصائص استجابة الخلايا الفردية إلى مواقع العين محددة؛ على سبيل المثال، عند البحث عن أدلة الكهربية لالتكييف الهيكلي، مثل المناطق مشرق أو الحادة، التي من شأنها أن تظهر زيادة حساسية أو قرار، على التوالي 31.
- تركيب مجهر تشريحي وراء تحفيز الطيران وتسجيل الجهاز على الطاولة مضادة للاهتزاز حتىأنه يوفر مريحة مشاهدة عالية التكبير للعين الذبابة.
- جبل مصدر الضوء البارد على رأس المجهر مع شبه جامدة أدلة ضوء معقوفة الرأس المزدوج مصدر الضوء لافتا إلى أسفل نحو حامل إعداد الطاير. منقولة بحرية اثنين شعاع الإضاءة يجعل من الاسهل لتصور القطب تسجيل معلومات سرية أثناء القيادة من خلال فتحة صغيرة في العين الطاير.
- إرفاق س، ص، مجموعة ض micromanipulator المناسب (خشن وناعم) عن القطب تسجيل والمرحلة الرأس على الطاولة مضادة للاهتزاز، في الجانب الأيمن من جهاز تحفيز الطيران والتسجيل، وذلك باستخدام M6 البراغي أو المغناطيسي تقف.
ملاحظة: في المختبر Juusola، وقد تم تجهيز منصات مختلفة المتلاعبين مختلف؛ لمزيد من التفاصيل انظر جدول المواد والكواشف. كل هذه توفر تسجيلات داخل الخلايا ذات جودة عالية. - جبل صغير اليدوي 3-محور micromanipulator لصاحب المرجعية القطب على و قابل للتعديل عموديالاي برنامج إعداد القطب. توجيه القطب المرجعية بحيث يشير نحو إعداد الطاير.
- بناء محمية ضوء قفص فاراداي قائمة بذاتها من الفولاذ فريقي حول الطاولة مضادة للاهتزاز، المحيطة جهاز تحفيز الطيران والتسجيل، لمنع التدخل الخارجي الكهرومغناطيسي. ترك الجزء الأمامي من القفص مفتوحا، وتوفير الوصول لنقل إعداد الطيران للتجارب. تعلق الستائر السوداء النسيج (وجود نحاسية أو الألومنيوم شبكة مزروع بداخلها عن التأريض) في الجزء الأمامي لحماية من الضجيج والضوء. الطلاء الداخلية للقفص الأسود للحد من الضوء المبعثر والترباس القدمين من القفص على الأرض لمنع الاهتزازات.
- توصيل التيار الكهربائي والنواتج الحالية لمقاومة عالية مسرى مكروي الخلايا مكبر للصوت المدخلات اثنين من مرشحات تمرير منخفض منفصلة (بسل أو ما شابه ذلك) باستخدام BNC كابلات. وبالمثل، وربط مخرجات مرشح في القنوات المناسبة للالمفكره AD-موصلCKS / ألواح لنظام الحصول على البيانات (بطاقات DA / م). ربط DA / بطاقة ميلادي (ق) في أجهزة الكمبيوتر الشخصية عن طريق كابلات المتخصصة، وفقا لأدلة المورد.
- تثبيت برنامج الحصول على المناسب لنظام الحصول على البيانات من خيار في أجهزة الكمبيوتر الشخصية. تأكد من أن السائقين الحصول على البيانات متوافقة مع نظام التشغيل على أجهزة الكمبيوتر الشخصية.
- الأرض كهربائيا تحفيز الطيران وأجهزة التسجيل، قفص فاراداي، شبكة النحاس (داخل الستائر)، المجهر، micromanipulators، مصدر ضوء بارد، المعدات 38U الرف مع كافة أدواته (مكبر للصوت داخل الخلايا، والمرشحات، وحدة التحكم في درجة الحرارة، وأجهزة الكمبيوتر وشاشات الكريستال السائل الخ) إلى نقطة الأرض مركزية واحدة باستخدام الأسلاك المعدات أسس وM6 تجعيد ينتهي حلقة التأريض. استخدام متعدد الكهربائية لاختبار أن جميع الأجزاء في نفس الأرض.
ملاحظة: لتحقيق أفضل ظروف التسجيل منخفضة الضوضاء الممكنة، في تكوينات أسس عادة تختلف جيئة وذهابام مجموعة واحدة إلى مركز آخر.- إذا لزم الأمر، قم بتوصيل نقطة الأرض المركزية أيضا على أرض الواقع بناء و / أو الأرض المركزية مكبر للصوت مسرى مكروي ل. بعد اختبار النظام يعمل بشكل كامل خلال التجارب الكهربية حقيقية، تكون على استعداد لتغيير تكوين أسس حسب الحاجة للحد من الضوضاء في التسجيلات.
- تكوين التضخيم البرمجيات (1 - 10X)، تصفية إشارة (عادة مرشحات تمرير منخفض وضعت في 500 هرتز، الذي هو مناسبة لكلا بيانات R1-R6 ومركز إدارة السيولة المالية)، ومعدل أخذ العينات (على الأقل 1 كيلو هرتز). تأكد من أن الإعدادات طاعة مبرهنة الاستعيان 32؛ على سبيل المثال، عند الحصول على البيانات التي الاسعار المنخفضة تمرير تصفيتها في 500 هرتز، استخدم تردد أخذ العينات من 1 كيلو هرتز أو أعلى لتقليل الآثار التعرج.
- كما الردود الجهد مميزة من المستقبلات الضوئية R1-R6 هي 40 - 65 فولت، وتلك من LMCs 20-45 بالسيارات، تعيين والتضخيم، وعرض جداول وفقا لذلك لتمكين عالية الدقة sampliنانوغرام والبيانات التصور.

الشكل 2. مخروطي يطير حامل يتكون حامل يطير من قطعتين: وحدة النحاس المركزية ومخروطي الشكل معطف أسود من البلاستيك. ثقب مركزي داخل وحدة النحاس التناقص التدريجي لقطرها صغير يتيح بالكاد الطاير من خلال. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 3. لمحة عامة عن تلاعب الكهربية. ويتضمن انشاء ومحمية ضوء قفص فاراداي قائمة بذاتها، الجدول مضادة للاهتزاز، وجهاز التحفيز الطاير والتسجيل، ونسيج الستائر السوداء مع نحاسية أو الألومنيوم شبكة داخل ل التأريض. خصوصياترف trument متصل بالكهرباء لنفس الأرض المركزية مع جميع المعدات داخل قفص فاراداي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- افتعال الميكروية
- سحب مسرى مكروي إشارة من البورسليكات الخيطية (القطر الخارجي: 1.0 مم؛ القطر الداخلي 0.6 ملم) أو زجاج الكوارتز (القطر الخارجي: 1.0 مم؛ القطر الداخلي 0.5، 0.6 أو 0.7 مم) أنابيب باستخدام أداة ماصة مجتذب. في محاولة لتحقيق تفتق تدريجي قصيرة.
ملاحظة: تختلف الضبط الدقيق للبرنامج ماصة مجتذب من أداة لالصك؛ مزيد من التفاصيل في الجدول المواد والحكام. حجم المسام في الطرف ليس حاسما لأن غيض من القطب إشارة وسيتم تقسيم قبل أن يتم إدراجها في إعداد الطاير. - سحب مسرى مكروي تسجيل من الخيطية البورسليكات (القطر الخارجي: 1.0 مم؛ القطر الداخلي 0.6 ملم) أو زجاج الكوارتز (القطر الخارجي: 1.0 مم؛ القطر الداخلي 0.5، 0.6 أو 0.7 مم) أنابيب باستخدام أداة ماصة مجتذب. في محاولة لتحقيق طويلة (10-15 ملم) تفتق تدريجي غرامة.
- تفقد مع المجهر الخفيفة التي تظهر الأقطاب تسجيل مستدق الصحيح. جبل القطب على شريحة زجاجية مع لاصق قابل للتشكيل واستخدام هدف الهواء 40X لتفقد طرفها.
ملاحظة: القطب جيد التناقص التدريجي بسلاسة حتى طرفها صغيرة غير مرئية، وتجمع حولها أكثر قتامة موازية مستمرة وأنماط التدخل أخف وزنا ويمكن رؤية. بعض الإعدادات مجتذب توليد كهربائية مقاومة عالية، والتي لا يمكن أن تسفر عن اختراقات خلية ناجحة لنصائحهم تشبه "الأبواق". وبالتالي، الفحص البصري من الأقطاب الكهربائية مهم. - نعلق الأقطاب أفقي على كبير بيتري الطبق مع الصلصال (أو لاصق قابل للتشكيل مماثل) لحفظها والنقل إلى تلاعب الكهربية. تأكد من أن نصائح القطب لإعادة دائما في الهواء وليس عن طريق الخطأ لمس أي شيء.
- الخلفية ملء تسجيل وإشارة كهربائية قبل التجربة مع محلول الملح المناسب. استخدام صغيرة حقنة 5 مل متصلة مرشح الجسيمات الصغيرة مع طرف من البلاستيك على ما يرام (مثل microloader).
- للتجارب خلايا مستقبلة للضوء، وملء القطب تسجيل حتى الشبع (تتشكل قطرات في نهايته كبيرة) مع 3 M بوكل لأن هذا الحل يقلل من تأثير إمكانية تقاطع السائلة إلى الجهد المسجل.
- للتحقيق في LMCs هيستاميني الفعل، التي تستجيب لإدخال متشابك من المستقبلات الضوئية R1-R6 بالتغيرات كلوريد تصرف، وملء أقطاب تسجيل مع 3 M خلات البوتاسيوم و 0.5 ملي بوكل، وهذا الحل له تأثير أقل على بطارية كلوريد الخلية. ملء القطب المرجعية مع ذبابة قارع الأجراس، التي تحتوي في ملي: 120 كلوريد الصوديوم، 5 بوكل، 10 TES (C 6 H 15 NO 6 S)، 1.5 CaCl 2 و 4 MgCl 2، و 30 السكروز 5.
- اختبار مقاومة القطب تسجيل سحبت حديثا في نظام التسجيل.
- تأكد من أن أسلاك الفضة داخل أصحاب الكهربائي والمغلفة بالتساوي مع كلوريد الفضة (تظهر الأرجواني والرمادي - وليس فضي لامع) للحد من القطع الأثرية تسجيل (مثل الانجراف في إمكانية تقاطع). إذا لم يكن كذلك، استبدالها بأسلاك chloridized بشكل صحيح.
- إذا لزم الأمر، chloridize أسلاك الفضة جديدة. بعناية تنظيف الأسلاك (عن طريق تمريرها بسرعة من خلال لهب) بحيث تظهر هذه الفضة مشرق في اللون. تجنب لمسها بالأصابع، من أجل لإيداع على مستوى واحد طبقة من أجكل. نقع الأسلاك في كامل قوته التبييض المنزلية ل15-30 دقيقة حتى تظهر الأرجواني اللون الرمادي. بدلا من ذلك، بالكهرباء كل سلك (بجعله إيجابية فيما يتعلق محلول يحتوي على 3 M بوكل وتمرير تيار من خلال ذلك بمعدل 1 مللي أمبير / سم 2 من المساحة السطحية) لمدة 10 - 15 ثانية حتى المغلفة بشكل كاف.
- ربط تسجيل المليئة الظهر وأقطاب المرجعية لأصحاب القطب الخاصة بهم. ضع حمام حل لقارع الأجراس الصغيرة حول تعديل عموديا منصة القطب إعداد الطاير. دفع نصائح الكهربائي في حل رينغر وقياس المقاومة طرف القطب تسجيل في.
ملاحظة: هناك حاجة إلى هذه الخطوة إلا عند اختبار خصائص مقاوم من الأقطاب الكهربائية التي يتم سحبها من دفعة جديدة من أنابيب الزجاج، أو عند تحقيق الاستفادة المثلى من برامج أداة مسرى مكروي مجتذب من خلال التكرار. - قبل تنفيذ قياسات المقاومة، وقراءة التعليمات في دليل المستخدم تصنيع مكبر للصوت لضبط القياس المناسبة. لتسجيل الكهربائي جيد، لديها مقاومة غيض من ~ 100-220 MΩ.
- سحب مسرى مكروي إشارة من البورسليكات الخيطية (القطر الخارجي: 1.0 مم؛ القطر الداخلي 0.6 ملم) أو زجاج الكوارتز (القطر الخارجي: 1.0 مم؛ القطر الداخلي 0.5، 0.6 أو 0.7 مم) أنابيب باستخدام أداة ماصة مجتذب. في محاولة لتحقيق تفتق تدريجي قصيرة.
2. إعداد ذبابة الفاكهة
- جمع 5-10 أيام الذباب القديمة (بعد eclosion) ووضعها في أنبوب ذبابة نظيفة تحتوي على شارعالغذاء andard. فمن الممكن لتحقيق تسجيلات جيدة من الذباب الأصغر سنا أيضا، حتى من "حديثي الولادة". ولكن بسبب ليونة أعينهم، وقطع فتحة القرنية للالقطب تسجيل أكثر صعوبة.
- بناء أنبوب ذبابة صيد وإعداد ذبابة تقف (الشكل 4). انظر الشكل 4 لفكرة عامة عن كيفية وضع هذه الأدوات عصامي معا.
- لجعل أنبوب ذبابة صيد، وقطع غيض من قاع مخروطي 50 مل من البلاستيك أنبوب الطرد المركزي ل. ثم، تضاف والغراء نهاية كبيرة من 1 مل ماصة على هذا الانفتاح الجديد.
- وأخيرا، وقطع صغيرة من نهاية ماصة إلى الحجم الذي يسمح بسهولة ذبابة على المشي من خلال. استشارة ورشة ميكانيكية لتجميع مرحلة إعداد ذبابة صغيرة تمكن دوران 2-محاور وقفل الطاير حامل في مناصب مختلفة.

شملت رقمه 4. أدوات ويضع اللازمة لاتخاذ إعداد يطير. يطير يتم اصطياد أنبوب من قبل الإلتصاق 1 مل ماصة بلاستيكية تلميح إلى 50 مل أنبوب الطرد المركزي البلاستيك. مفصل موقف إعداد ذبابة يتيح دوران حر وقفل الطاير حامل في الموضع المفضل لإعداد الطاير. يتم إصلاح ذبابة بواسطة شمع العسل، وذلك باستخدام الشمع الكهربائية سخان. يتم تطبيق الفازلين بواسطة قضيب صغير مصنوع من خلال ربط الشعر نوع سميك على التعامل معها. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- جمع ذبابة للتجربة في تلميح ماصة 1 مل، والتي تمكن بالكاد ذبابة لتناسب من خلال. إرفاق ذبابة صيد أنبوب، مع طرف ماصة على ذلك، إلى أنبوب الطاير. في اصطياد ذبابة، والاستفادة من ميلها المتأصل لتسلق صعودا (antigravitaxis) في تلميح ماصة. يفضل اختيار أكبر من الإناث، كما يهم الحجمالصورة في الكهربية.
ملاحظة: أكبر الطاير، وأكبر خلاياه وأفضل فرص للتسجيلات داخل الخلايا ذات جودة عالية. الذباب أصغر (الإناث والذكور على حد سواء) ويمكن أيضا أن توفر تسجيلات ممتازة، ولكن إعداد أكثر صعوبة لجعل. بمجرد المحاصرين الطاير في طرف ماصة كبير، تذكر لإغلاق أنبوب الطيران لمنع الذباب أخرى من الهرب. - توصيل حقنة 100 مل مع خرطوم البلاستيك المرن لافتتاح أكبر من طرف ماصة - مع الذبابة لا تزال فيه.
- وضع نهاية الضيقة على الطرف ماصة كبير، والتي يتم تكبير فقط السماح لذبابة الفاكهة من خلال لفتحة في الجزء السفلي من ذبابة حامل ويسجل كمية صغيرة من الهواء من الحقنة لإخراج الطيران في ذبابة حامل .
- ننظر من خلال مجهر تشريحي وإدارة بلطف مزيد من الهواء حتى رأس الذبابة وجاحظ من نهاية مخروطية من ذبابة حامل. ضمان الطاير محصور بقوة من الصدر لفي مكتب مستشار رئيس الوزراء صغيرنينغ على رأس ذبابة حامل.
- استخدام سخان الشمع لربط الطاير مع شمع العسل من على "أكتاف" لذبابة حامل. ضبط درجة حرارة سخان الشمع لتكون في أدنى مستوى ممكن بعد ذوبان الشمع نظيفة.
ملاحظة: عندما تكون درجة الحرارة الصحيحة، يظهر الشمع الشفاف. عالية جدا من الحرارة يجعل الشمع "تحرق". منخفض جدا يبقي قاسية الشمع. عند تحديد الطاير، أن تكون دقيقة ومختصرة قدر التعرض للحرارة لفترة طويلة قد يسبب ضررا. عن طريق الشفاء ضوء الغراء الأسنان لا ينصح هنا كان تطبيقه بطيء جدا.

الرقم 5. إعداد يطير لفي فيفو التجارب. اليسار، يتم وضع رأس ذبابة الفاكهة الصورة مباشرة في الطيران حامل وثابتة من خرطوم لها، العين اليمنى والكتفين إلى الطاير حامل مع تكون ساخنةeswax. الحق، ويتم قطع فتحة صغيرة في الجزء السميكة من العين، فقط فوق خط الاستواء، وفقط عدد قليل من ommatidia بعيدا عن بشرة الظهر، وذلك باستخدام الحلاقة حافة حادة. تتم إزالة قطعة من القرنية بلطف ووختم الحفرة مع الفازلين لمنع العين من الجفاف. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- شل رأس الذبابة. تطبيق شمع العسل للخرطوم (الشكل 5) وزاوية العين اليمنى، وتجنب القرنية، وإصلاح الرأس من هذه النقاط على الطاير حامل.
- إنتاج سكين الصغيرة. المشبك على razorblade غير الفولاذ المقاوم للصدأ مع اثنين من حاملي شفرة / قواطع (على حد سواء مع قبضة شقة) والكراك شريط صغير من حافته حادة. للصحة والسلامة، واستخدام نظارات واقية لحماية العين (على الرغم من أنه من غير المرجح أن القطع سوف النبو عندما مشققة الحلاقة). من الناحية المثالية،إنتاج الحلاقة حافة حادة تشبه مستدقة. تأكد من أن هذا "عشب" وترتبط بقوة مع شفرة حامل، ولكن يجب الحرص على تجنب أي إيذاء الذات!
- باستخدام سكين الصغيرة، وإعداد حجم فتحة صغيرة من عدد قليل من ommatidia في العين اليسرى الذبابة - في حوالي 4-5 ommatidia من إهاب الظهرية فقط فوق خط الاستواء العين لتوفير ممر لمسرى مكروي تسجيل. أداء تحت مجهر تشريحي، وعرض إعداد مع التكبير عالية.
ملاحظة: نظرا لأن عين الذبابة يشعر مرنة ومقاوم للتحقق، وثقب هو أفضل قطع مع -knife "عشب". تقنية القطع هي صعبة جدا، لذلك إيلاء اهتمام وثيق للمظاهرة الفيديو. يمكن الحفاظ على ذبابة حامل في بعض التوجهات (في إعداد موقف ذبابة) جعل تشريح أسهل. في البداية، قد يشعر المجهرية من الصعب معرفة، ولكن مرة واحدة ملتزمة، التكيف العصبي يحسن تدريجيا 3D التصور المحقق والبراعة. - Remove بعناية قطعة صغيرة من القرنية من فتح التي قطعت للتو، وفضح الشبكية تحتها. تغطية بسرعة ثقب في العين مع فقاعة صغيرة من الفازلين باستخدام شعر ناعم من قضيب الفازلين.
ملاحظة: يخدم الفازلين الأدوار المتعددة هنا. ويمنع جفاف الأنسجة وتخثر الدملمف التي من شأنها كسر القطب تسجيل المدرجة. انها المعاطف أيضا بالمناسبة مسرى مكروي، والحد من السعة التي جماعية. هذا يمكن أن يحسن من استجابة التردد من نظام التسجيل، وذلك القرار الزمني للإشارات العصبية المسجلة. تجنب تلطخ الفازلين على بقية العين لأن هذا يطمس البصريات.
3. تسجيل من R1-R6 خلايا مستقبلة للضوء أو LMCs
- دائما أن أرضي عند تشغيل مكبر للصوت مسرى مكروي (على سبيل المثال عن طريق لمس سطح معدني من قفص فاراداي أو الجدول مضادة للاهتزاز)، وهذا يحول دون واحد من تقديم عن طريق الخطأجي تهمة ثابتة إلى مرحلة الرأس، والتي يمكن أن تلحق الضرر الدوائر.
- إلقاء الضوء على منصة القطب إعداد يطير من فوق من قبل اثنين من المرشدين ضوء أوزة الرقبة (الشكل 6A) (مع مصدر ضوء بارد داخل قفص فاراداي) بحيث حامل ذبابة يمكن وضعها على قطب في موقف المفضل تحت المراقبة البصرية وثيقة .
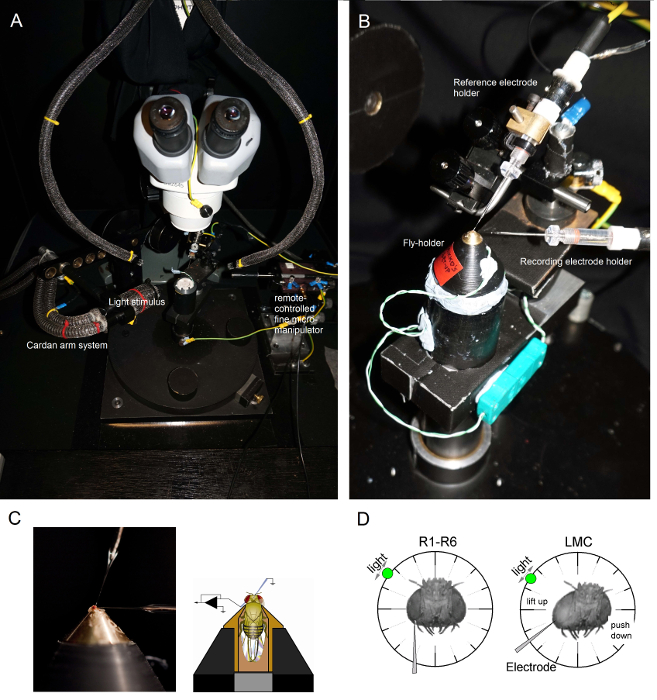
الشكل 6. تحديد المواقع يطير حامل ويتم وضع حامل ذبابة على منصة التسجيل الذي يوفر أيضا التحكم في درجة الحرارة عن طريق عنصر بلتيير (A: منصة دائرية بيضاء في الوسط) وأقطاب للتجارب (AB). وكاردان الذراع يتيح المواقع الدقيقة للتحفيز الضوء على مسافة متساوية (عبر X، Y-دوران) حول ذبابة، مع مصدر الضوء (نهاية الباقة السائلة أو الكوارتز الألياف الضوئية) لافتا مباشرة إلى عينيها. في كثير من أوومنصات ص، يتم إنشاء التحفيز ضوء المصابيح التي كتبها (مع الخطية برامج التشغيل الحالية) أو عن طريق مستوحد اللون. وهكذا، المحفزات التي تحمل محددة (-مرت الفرقة) محتوى الطيفية، اختار بين 300-740 نانومتر، وتغطي 4-6 سجل مجموعة وحدة كثافة (كما الموهن من مرشحات الكثافة محايدة مستقلة). (C) اثنين الميكروية، التي تسيطر عليها micromanipulators منفصل، يتم وضعه في الرأس الطيران: القطب المرجعية (أعلاه) من خلال ocelli. القطب تسجيل (يسار) من خلال فتحة صغيرة في العين اليسرى. (D) للحصول على الحد الأقصى لعدد التسجيلات مبصرة، هو الدافع وراء مسرى مكروي تسجيل في حفرة، موازية للمحور خرطوم-ocellus. عندما تخترق القطب طرف والأختام لمستقبلة للضوء، يتم إصلاح مصدر الضوء تدوير بحرية إلى موقف حيث تنتج الخلايا استجابة الجهد القصوى لحافز ضوء معين. هذه النقطة في الفضاء تقع في وسط الميدان تقبلا للخلية. إذا كنت حفرةق على مقربة من إهاب، الاختراقات مركز إدارة السيولة المالية يمكن أن تزيد من تحقيقه مع هذه الزاوية القطب نفس (يسار). إذا كان الثقب هو أبعد عن بشرة، مفيدة زاوية النهج القطب أخرى للحصول على تسجيلات مركز إدارة السيولة المالية يظهر أيضا (إلى اليمين). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- جبل الذبابة حامل (مع الذبابة في ذلك!) على القطب ذبابة منصة إعداد. تدوير الطاير حامل بحيث عينه اليسرى الذبابة يواجه مباشرة المحقق (الشكل 6B).
- إدراج القطب إشارة حادة بلطف من خلال occelli الذبابة في الكبسولة رئيس باستخدام micromanipulator الخشنة الصغيرة مع مراعاة إعداد من خلال مجهر تشريحي (الشكل 6C). لا تدفع القطب عميق جدا، وهذا يمكن أن يؤدي إلى تلف الدماغ ذبابة.
- بدلا من ذلك، إدراج القطب إشارة إلى الجزء الخلفي من القفص الصدري. دائما، تأكد من أن يطير يبدو heathy (يتحرك هوائيات) وعينيه وسليمة. لم تتضرر بطريق الخطأ. إذا كان إعداد يبدو أقل من طاهر، وإعداد ذبابة جديد للتجارب.
- دفع تسجيل مسرى مكروي حاد في العين اليسرى خلال الفازلين غطت فتحة صغيرة أعدت في وقت سابق. استخدام التكبير العالية في مجهر تشريحي ونقل أدلة الخفيفة وطائرة الوصل بحيث يصبح موقع القطب طرف واضح في 3D من أنماط الانعكاس لها.
ملاحظة: يبين الشكل 6D كيف ينبغي وضع رأس الذبابة بشكل مختلف قليلا (فيما يتعلق زاوية ومسرى مكروي تسجيل يدخل إلى العين) لمستقبلة للضوء والتسجيلات مركز إدارة السيولة المالية. القيادة الكهربائي في العين دون كسرها هي المرحلة الأكثر صعوبة التجربة. إذا كان طرف القطب يغفل فتحة صغيرة في العين، لتصل إلى القرنية، فإنه يكسر عادة. - تشغيل مكبر للصوت مسرى مكرويمرة واحدة كل من الأقطاب الكهربائية هي بقوة داخل الإعداد، في اتصال الكهربائية مع سوائل جسم الذبابة.
- إيقاف مصدر الباردة ضوء (داخل قفص فاراداي) وفصله من التيار الكهربائي. ربط المكونات لها على الأرض المركزية للحد من الأرض حلقة يسببها الضجيج الكهربائي، ونقل أدلة ضوء أوزة الرقبة بعيدا حتى أن النظام كاردان الذراع يمكن نقلها بحرية في جميع أنحاء الطاير. إيقاف تشغيل أضواء الغرفة للتأكد من أن إعداد الذبابة الآن في الظلام النسبي.
- قياس مقاومة القطب تسجيل في العين (وفقا للتعليمات في دليل المستخدم مكبر للصوت). استخدام تسجيل فقط الأقطاب الكهربائية التي المقاومة 100-250 MΩ.
ملاحظة: من المستحيل عمليا لتحقيق تسجيلات داخل الخلايا عالية الجودة من خلال <70 MΩ الكهربائي. إذا كانت المقاومة هي <80 MΩ، فمن المرجح أن الطرف الكهربائي مكسورة. في هذه الحالة، إيقاف تشغيل مكبر للصوت وتغيير القطب تسجيل.- مرة واحدة في القطبيتم استبدال وفي العين، والتبديل على مكبر للصوت لقياس مقاومته. في بعض الأحيان، وغيض الكهربائي يمكن أن تصبح سدت بعض المخلفات كما أنه يدخل في الأنسجة. هذا لا يمكن علاجه باستخدام الطنانة بالسعة ونبض الحالية وظائف مكبر للصوت التي عادة واضحة من قبل resonation السريع أو تنافر.
- تعيين مكبر للصوت المشبك الحالي (CC) أو طريقة التسجيل الجسر. يلغي أي فرق الجهد التعسفي بين تسجيل وإشارة كهربائية، لأن كلا منهم يستريح الآن في الفضاء خارج الخلية المترابط كهربائيا، من خلال وضع إشارة الإزاحة (تسجيل الجهد) إلى الصفر. متابعة التغيرات إشارة يقابلها باستخدام قراءات عرض مكبر للصوت أو شاشة الذبذبات.
- الانتظار 2-3 دقائق للعين الذبابة إلى dark-التكيف.
- دفع طرف القطب تسجيل أعمق تدريجيا في العين مع صغيرة 0،1-1 الخطوات ميكرون. هل هذا مع محور س بيزو السائر من micromanipulator للتحكم عن بعد أو بذ الدورية بلطف القرار مقبض غرامة تتلاعب اليدوي.
- تحفيز العين الطاير مع باختصار (1 - 10 ميللي ثانية) ومضات الضوء كما يتم متقدمة القطب تسجيل في الأنسجة.
ملاحظة: إذا تم وضع القطب تسجيل في شبكية العين وظائف العين بشكل طبيعي، فإن كل ومضة ضوء يسبب انخفاض موجز وبسيط في الجهد (0،2-5 بالسيارات فرط الاستقطاب)، ويسمى مخطط كهربية (أرج). يحدث هذا التغيير في إمكانية مجال الفضاء خارج الخلية من الاستجابة الجماعية للخلايا الشبكية "للضوء. ومع ذلك، وبمجرد أن يدخل طرف القطب الصفيحة، ليغلق على LMCs، وأرج عكس، والتي تبين ردود depolarizing. - نقل مصدر الضوء حول العين الطيران باستخدام نظام كاردان الذراع والعثور على موقف حيث ضوء تثير أكبر رد أرج.
ملاحظة: هذا الموقف يمثل منطقة صغيرة في المساحة المرئية حيث خلايا مستقبلة للضوء (أو LMCs)، والتي تقع بالقرب من غيض من القطب تسجيل، نموذج إدخال ضوءها. - اختراق خلية مع القطب تسجيل.
ملاحظة: يمكن أن يحدث الاختراق بشكل عفوي، أو عندما يكون القطب هو الصغير صعدت إلى الأمام. ويمكن كذلك سهلت من خلال استغلال بلطف نظام micromanipulator أو باستخدام وظيفة شرب حتى الثمالة من مكبر للصوت. هذه الأعمال صدى طرف القطب في الأنسجة. عندما يخوزق القطب غشاء مبصرة، دخول مجالها داخل الخلايا، وفرق الجهد بين التسجيل والقطب المرجع يسقط فجأة من 0 بالسيارات إلى ~ -65 بالسيارات (بين -55 و -75 فولت)؛ بينما خلال الاختراقات مركز إدارة السيولة المالية، هذا الانخفاض هو عادة أقل (ما بين -30 و -50 فولت). وتمثل هذه الاختلافات الجهد إمكانات الراحة السلبية لخلايا معينة. اعتمادا على نوعية القطب تسجيل (حدته)، وعملية الخلوية اخترقت، القراءة الجهد من القطب تسجيل يمكن تحقيق الاستقرار بسرعة أو تدريجيا إلى إمكانية يستريح، وغشاء الخليةالأختام إلى الطبقة الخارجية من القطب. ولكن إذا كان الاختراق هو جزئي فقط أو الفقراء، القطب زلات عادة خارج الخلية مع تسلق المحتملين المسجلة نحو الصفر. - توطين وسط الميدان تقبلا الخلية اخترقت عندما يظهر القطب محكمة الغلق، والتي تبين إمكانية غشاء مستقرة (المظلمة يستريح المحتملة). نقل التحفيز ضوء وامض حول العين الطيران، وذلك باستخدام نظام كاردان الذراع، للعثور على نقطة في الفضاء البصري، حيث تثير ومضة ضوء استجابة الجهد القصوى للخلية. قفل كاردان الذراع عندما يواجه التحفيز الضوء مباشرة (نقطة في) وسط الميدان تقبلا.
ملاحظة: في الظلام، مبصرات ذبابة الفاكهة الاستجابة لنبضات الضوء الساطع مع 40-65 بالسيارات الردود depolarizing الجهد 4،5، في حين تشير التسجيلات مركز إدارة السيولة المالية مستقرة 20-45 بالسيارات hyperpolarizing الردود 9،10،14. قد يحدث اختراقات الدبقية نادرا، وأشار <-80 بالسيارات إمكانات الراحة وأبطأ بكثيروأصغر (~ 5 فولت) المشبعة اللاإستقطابات depolarizations الناجم عن الضوء. خلايا مستقبلة للضوء في ذبابة الفاكهة مع تصبغات العين المختلفة، مثل البيض العين 7 وكبريتيد، تظهر الأحجام استجابة مماثلة لمن النوع البري. - عن طريق وضع مكبر للصوت الحالي المشبك (CC)، تعويض السعة القطب تسجيل عن طريق حقن صغيرة 0.1 غ وجيزة - البقول الحالية (100 200 ميللي ثانية) في الخلية درس للحد من القطع الأثرية التسجيل أثناء الشحن الغشاء.
ملاحظة: يتم شرح هذا الإجراء المهم بالتفصيل في دليل المستخدم مكبر للصوت، ويجب أن يمارس مع نموذج الخلية الكهربائي قبل التجارب الفعلية. - ردود سجل الجهد لنبضات الضوء وغيرها من المحفزات من الفائدة، مع اختلاف الصفات الإحصائية أو الجسدية (مثل طبيعي السلاسل الزمنية شدة الضوء أو أنماط النقيض عشوائي). اختبار، على سبيل المثال، كيف تتغير ردود سجلت مع ضوئية أو داكنة التكيف.
ملاحظة: يمكن للمرء أن بدقة لىGHT-التكيف مع الخلية التي يدرسها ضوء مستمر من شدة انتقاؤه من خلال إضافة مرشحات الكثافة محايدة في مسار الضوء 4،5. بدلا من ذلك، لفترة طويلة داكنة التكيف إيقاف التحفيز خفيفة بعد انتهاء وقت معين. بسبب الاستقرار الميكانيكي للنظام التسجيل، والجودة العالية للتسجيل أقطاب وintactness من إعداد ويمكن ظروف التسجيل مستقرة تستمر أحيانا لعدة ساعات. وهكذا، في يوم جيد، فمن الممكن أن يحصل على كمية كبيرة من البيانات في ظروف التكيف المختلفة من خلية واحدة. عندما ينزلق القطب خارج الخلية، ردود سجلت تتضاءل ويبدأ الجهد المتوسط للاقتراب الصفر. - دفع بعناية القطب تسجيل مع سيطرة محور س غرامة من micromanipulator حتى القطب يجعل الاتصال وتخترق الخلية التالية (هذا هو عادة أقرب جار العصبي). لا تتحرك القطب على طول Y- أو ض محور حيث أن هذه المناورات من شأنه أن يجعل القطب إلى "ررough النسيج "جانبية، وإلحاق أضرار الهياكل العين!
ملاحظة: مع القطب جيد وإعداد صحي، يمكن للمرء أن يسجل الاستجابات ذات جودة عالية من العديد من المستقبلات الضوئية (ولكن نادرا ما من العديد من LMCs) في نفس ذبابة على مدى عدة ساعات. في بعض الأحيان، على مدى يوم عمل كامل (> 8 ساعات) دون تدهور إشارة واضحة. - حفظ ملفات البيانات بشكل دوري مع تحديد المعلومات، مثل التاريخ وراثى، ونوع من الخلايا المسجلة. ونظرا لكمية كبيرة من البيانات التي يمكن جمعها في تسجيل الدورة ناجحة، والحفاظ على سجلات مكتوبة جيدة في المختبر الكتاب لتحليل البيانات في المستقبل.
النتائج
طريقة الحاد تسجيل مسرى مكروي، وتكييفها هنا للعين ذبابة الفاكهة، ويمكن استخدامها لقياس موثوق أخذ العينات العصبية المعلومات ومعالجتها في خلايا شبكية العين والصفيحة، والاتصالات بينهما 4،5،7،8،10،33. عن طريق استخدامه لدراسة الترميز في مختلف الأسهم من النوع البري، المسوخ أو سلالات ذبابة المعدلة وراثيا، وقد ثبت أن الطريقة قيمتها. ليس فقط في قياس آثار الطفرة، ودرجة الحرارة، والنظام الغذائي، أو في المختارة التعبير 3،4،6،9،10،14،30،34، ولكن أيضا في الكشف عن الأسباب الميكانيكية لسلوكيات البصرية المتغيرة 14،34. طريقة ينطبق أيضا بسهولة إلى الاستعدادات الحشرات الأخرى 35،36، وتمكين دراسات رؤية neuroethological. بعد ذلك قمنا بعرض بعض الأمثلة على تطبيقاته الناجحة.

الرقم 7. الجهد ردود على ذبابة ثمار R1-R6 مبصرة لنبض الضوء في 20 و 25 درجة مئوية بسبب الاختراقات مسرى مكروي حادة غالبا ما تكون مستقرة جدا، فمن الممكن لتسجيل استجابات الجهد من نفس مبصرة R1-R6 لحافز خفيفة معينة في درجات الحرارة المحيطة مختلفة عن الاحترار أو التبريد الطاير. في لدينا مجموعة عمليات، يتم وضع الطيران حامل على نظام التحكم في درجة الحرارة حلقة قريبة أساس بلتيير عنصر. وهذا يمكننا من تغيير الذبابة درجة حرارة الرأس في ثوان. ارتفاع درجة الحرارة يسرع الردود الجهد ومميز يقلل من إمكانات يستريح من المستقبلات الضوئية R1-R6 (كما يتبين من السهام الحمراء). اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
دراسة تأثير درجة الحرارة على الناتج مبصرة
الآثار البيئية-together.within الصفحات = "1"> مع مصممة تصميما جيدا ونظام تسجيل معزولة الاهتزاز، وهذه الطريقة يمكن أن تستخدم لقياس تأثير درجة الحرارة على الانتاج العصبية خلية فردية من قبل ارتفاع درجات الحرارة أو التبريد الطاير. يوضح المثال المعطى الردود الجهد لنبضة 10 ميللي ثانية طويل مشرق، وسجلت في نفس مبصرة R1-R6 في 20 و 25 درجة مئوية (الشكل 7). كما كميا قبل 4،9، والاحترار يخفض احتمال يستريح على مستقبلة للضوء في الظلام، وتسارع ردود الجهد لها.
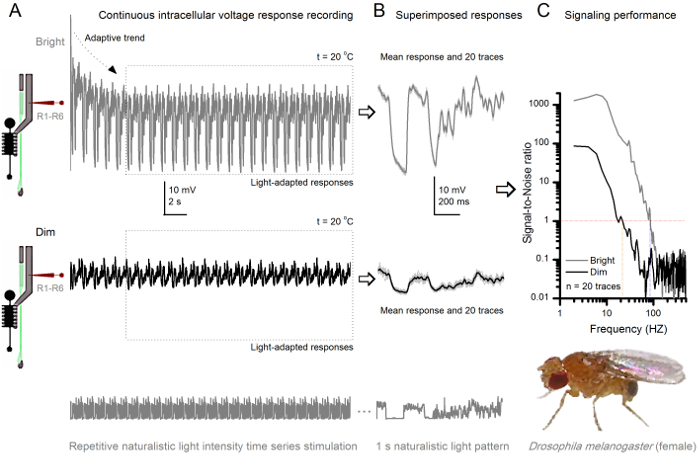
الرقم 8. اشارة الأداء على ذبابة ثمار R1-R6 مبصرة يحسن مع شدة الضوء (A) الناتج مبصرة لقاتمة (أدناه) ومشرقة. (أعلاه؛ 10،000 مرات أكثر إشراقا ضوء) تتكرر الطبيعية شدة الضوء السلاسل الزمنية التي سجلتها نفسه مسرى مكرويفي نفس الخلية في 20 درجة مئوية. الردود على التحفيز مشرق أكبر، لأنها تدمج المزيد من العينات، ردود الابتدائية (المطبات) إلى الفوتونات واحدة 4،5،7،8. (ب) يتم فرضه 20 الردود الجهد متتالية ثانية واحدة طويلة. اتخذت الاستجابات الفردية (رمادي فاتح) بعد الاتجاهات التكيفية (السهم في A) قد انحسر (مربع منقط في A). وسائل الاستجابة المقابلة (الإشارات) هي آثار قتامة. الفرق بين إشارة والاستجابات الفردية هو الضجيج. "وكان كميا أداء الإشارات التي كتبها التسجيلات" (C) الخلايا نسب الإشارة إلى الضوضاء (SNR) باستخدام الطرق القياسية 4،5،7،8. الناتج مبصرة لديها مجموعة وحوالي 64 هرتز أوسع من الإشارات الموثوق بها على التحفيز مشرق (SNR "≥1 مشرق، تصل إلى 84 هرتز) عما كانت عليه في قاتمة (SNR" خافت ≥1، تصل إلى 20 هرتز)، مع الصورةignal إلى نسبة الضوضاء تتحسن إلى حد كبير؛ من SNR خافت MAX = 87 إلى SNR برايت MAX = 1،868. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
دراسة التكيف والعصبية ترميز بواسطة المتكرر تحفيز
وnoninvasiveness الأسلوب، مما تسبب في أضرار طفيفة نسبيا في هياكل شبكية العين والصفيحة، يجعلها مثالية لدراسة أداء الإشارات من الخلايا الفردية للمؤثرات ضوئية مختلفة في القريب الحالة الفسيولوجية الطبيعية في الجسم الحي. الشكل 8 يظهر استجابات الجهد من R1- R6 مبصرة لضوء الوقت كثافة طبيعي سلسلة من الحوافز قاتمة ومشرق المتكررة عند 20 درجة مئوية، في حين أن الرقم 9 يظهر ردود مبصرة R1-R6 آخر ومركز إدارة السيولة المالية لحافز طبيعي مختلفة في 25 درجة مئوية. أجريت التسجيلات قبل وبعد المشبكي بشكل منفصل عن اثنين من الذباب مختلفة لأن التسجيلات داخل الخلايا في وقت واحد من قبل اثنين من الميكروية حادة في نفس الطيران، واحدة في شبكية العين، والآخر في الصفيحة، من الصعب جدا أن تكون قابلة للحياة 30.
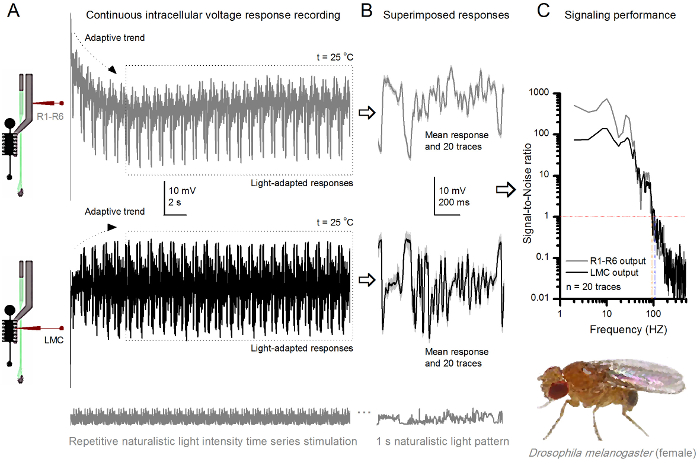
الرقم 9. الردود الجهد من ذبابة الفاكهة R1-R6 مبصرة ومركز إدارة السيولة المالية إلى تكرار طبيعي تحفيز على 25 درجة مئوية (A) R1-R6 (الرمادي) ومركز إدارة السيولة المالية (أسود) النواتج التي سجلتها الميكروية مختلفة من الذباب مختلفة. (ب) 20 ما قبل ضوء تكييفها بالكامل على التوالي (أعلاه) وبعد المشبكي (أدناه) الردود على نفس النمط التحفيز الطبيعي مع الاستجابات الفردية، كما هو موضح في ضوء رمادي لد وسائل المقابلة استجابة (الإشارات) على أنها آثار قتامة. الفرق بين إشارة والاستجابات الفردية هو الضجيج. "وكان كميا أداء الإشارات التي كتبها التسجيلات" (C) الخلايا نسب الإشارة إلى الضوضاء (SNR). مركز إدارة السيولة المالية الانتاج لديها مجموعة وحوالي 10 هرتز أوسع من إشارات يمكن الاعتماد عليها (SNR "مركز إدارة السيولة المالية ≥1، تصل إلى 104 هرتز) من الناتج R1-R6 (SNR 'R ≥1، وتصل إلى 94 هرتز). كل من نسب الإشارة إلى الضوضاء مرتفعة (SNR مركز إدارة السيولة المالية MAX = 142، SNR R MAX = 752)، وكما كان الضجيج تسجيل منخفضة، وخلافاتهم تعكس الاختلافات الترميز حقيقية بين الخلايا. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد ظهور التحفيز، والتسجيلات نموذجيةلاي تظهر التكيف بسرعة الاتجاهات التي تهدأ إلى حد كبير داخل 5-6 ثانية. ومنذ ذلك الحين، والخلايا تنتج استجابات متسقة للغاية على كل 1 ثانية عرض الحوافز طويلة (كل مربع منقط يرفق 20 من هذه). والتكرار من الردود يصبح واضحا عندما يتم فرضه هذه (الشكل 8B والشكل 9B). الاستجابات الفردية هي آثار رمادية رقيقة، ويعني بها سمكا أكثر قتامة أثر. يتم أخذ استجابة يعني مثل إشارة العصبية، في حين أن الضجيج العصبي هو الفرق بين المتوسط وكل 4،5،9،37،38 استجابة الفرد. وقد تم الحصول على نسب كل إشارة إلى الضوضاء في نطاق التردد (الشكل 8C والشكل 9C) من خلال فورييه تحويل الإشارة والضجيج قطع البيانات إلى أطياف السلطة، وتقسيم متوسط طيف الطاقة إشارة مع ما يوازيها من متوسط الضوضاء السلطة الطيف 4، 5،9،37،38. مميز، الحد الأقصى للنسب الإشارة إلى الضوضاء سو مخرجات العصبية المسجلة لتحفيز طبيعي مرتفعة (100 - 1000)، وفي الأعمال التحضيرية الأكثر استقرارا مع منخفضة جدا الضوضاء التسجيل يمكن أن تصل إلى القيم >> 1000 (على سبيل المثال، الشكل 8C). لاحظ أيضا أن الاحترار توسع الخلايا عرض النطاق الترددي من موثوق يشير 4 (SNR "برايت ≥ 1)؛ على سبيل المثال، والفرق النسبي بين اثنين R1-R6S في أرقام 8 و 9 على التوالي، هو 10 هرتز (84 في 20 درجة مئوية و 94 هرتز عند 25 درجة مئوية).
يمكن للمرء أن أبعد تقدير نسبة كل خلية من نقل المعلومات من لنسبة الإشارة إلى الضوضاء باستخدام معادلة شانون 32، أو عن طريق حساب الفرق بين معدلات الكون الكون والضوضاء الردود من خلال طريقة الاستقراء الثلاثي 39. مزيد من التفاصيل عن التحليلات النظرية المعلومات واستخدامها والحدق على وجه التحديد مع هذه الطريقة هي التي وردت في المنشورات السابقة 7،8،39.
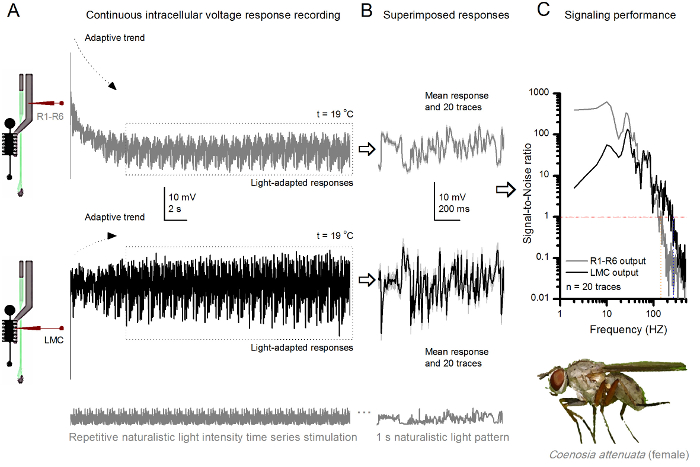
الرقم 10. الردود الجهد من القاتل ذبابة R1-R6 مبصرة ومركز إدارة السيولة المالية إلى تكرار طبيعي تحفيز على 19 درجة مئوية (A) R1-R6 (الرمادي) ومركز إدارة السيولة المالية (أسود) النواتج التي سجلتها نفسه مسرى مكروي من نفس ذبابة. postsynaptically أولا وبعد ذلك presynaptically، كما تقدمت القطب في العين. تم القبض على (ب) 20 ما قبل التوالي (أعلاه) وبعد المشبكي (أدناه) الردود (آثار رمادي فاتح) على نفس نمط التحفيز الطبيعي بعد التكيف الأولي (مربع منقط في A). وسائلهم هي إشارات (آثار قتامة على أعلى)، في حين أن الاختلافات كل منهما إلى الاستجابات الفردية تعطي الضوضاء. (ج) سينيا المقابلةتم حساب نسب لتر إلى الضوضاء (SNR) كما هو الحال في أرقام 8C و9C. مركز إدارة السيولة المالية الانتاج لديها نحو مجموعة 100 هرتز أوسع من إشارات يمكن الاعتماد عليها (SNR "مركز إدارة السيولة المالية MAX ≥1، وتصل إلى 234 هرتز) من الناتج R1-R6 (SNR 'R MAX ≥1، تصل إلى 134 هرتز). كل من نسب الإشارة إلى الضوضاء مرتفعة (SNR مركز إدارة السيولة المالية MAX = 137، SNR R MAX = 627)، وكما تم استخدام نفس مسرى مكروي في التسجيلات، خلافاتهم تعكس اختلافات حقيقية في مخرجات العصبية قبل وبعد المشبكي. وتعني هذه النتائج أن نظام تسجيل زيارتها انخفاض مستوى الضجيج، وكان تأثيره على التحليلات هامشية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Neuroethological الدراسات الرؤية
يمكن أن تستخدم أيضا طريقة لتسجيل استجابات قبل وبعد المشبكي الجهد من عيون مجمع أنواع الحشرات المختلفة 7،8،35،36 (الشكل 10)، والسماح الدراسات neuroethological النسبية لمعالجة المعلومات البصرية. لنظام تسجيل المقدمة، والتكيف المطلوب فقط هو أصحاب إعداد جديد، مع كل فتحة مناسبة الحجم لتلك الانواع. هذه التسجيلات المثالية هي من قاتل الإناث ذبابة (Coenosia attenuata). وهي تظهر استجابات الجهد داخل الخلايا لمبصرة R1-R6 ومركز إدارة السيولة المالية لمطابقة التحفيز ضوء المتكررة، كما تستخدم لنظرائهم ذبابة الفاكهة في الشكل 9، ولكن في 19 درجة مئوية. في هذه الحالة، وسجلت كل من قبل والبيانات بعد المشبكي من نفس ذبابة. واحدا تلو الآخر، مع نفس تسجيل الكهربائي (مليئة 3 M بوكل) تقدم لأول مرة من خلال الصفيحة الجانبية قبل الدخولجي الشبكية الأمامية. وبالمقارنة مع بيانات ذبابة الفاكهة في 25 درجة مئوية، والبيانات Coenosia - حتى في درجة حرارة أكثر برودة - يظهر استجابات مع ديناميات أسرع. توسيع نطاق إشارات موثوقة (نسبة الإشارة إلى الضوضاء >> 1) على نطاق وتردد على نطاق أوسع. هذه التكيفات الوظيفية في ترميز العصبي للمحفزات طبيعية تتماشى مع نمط الحياة Coenosia الصورة المفترسة 36، والتي تتطلب درجة عالية من الدقة المعلومات الزمانية المكانية لتحقيق سريع السلوكيات الصيد الجوي.
Discussion
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier's recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine - having too high a resistance or intramural capacitance - to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode's time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer's solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax - if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas - picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips' electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today's optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells' electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Disclosures
The authors have nothing to disclose
Acknowledgements
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ's current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
Materials
| Name | Company | Catalog Number | Comments |
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30X eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| Nikon microscope | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| Newport | |||
| Micromanipulators | Narishige | Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| Huxley Bertram | Huxley xyz-axis with fine manual control | ||
| Sensapex | Sensapex triple axis | ||
| Märzhäuser | Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3 - 0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
References
- Meinertzhagen, I. A., O'Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C., Ottoson, D. . Progress in Sensory Physiology. 5, 1-79 (1985).
- Borst, A. Drosophila's View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) - Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron - Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. . Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173 (2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved