Method Article
Méthode électrophysiologique de réponses d'enregistrement intracellulaire tension de
Dans cet article
Résumé
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Résumé
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell's receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator's experimental objectives, it grants outstanding in vivo neurophysiological data.
Introduction
La mouche des fruits (Drosophila melanogaster) composé oeil est un système modèle grand pour enquêter sur l'organisation fonctionnelle des photorécepteurs et interneurones tableaux pour l' image neuronal échantillonnage et le traitement, et pour la vision des animaux. Le système a le schéma de câblage le plus complet 1,2 et est aimable aux manipulations génétiques et précise la surveillance de l' activité neuronale (de haut rapport signal-bruit et résolution temporelle) 3-10.
L'œil de drosophile est modulaire, contenant ~ 750 structures de lentilles coiffées apparemment régulières appelées ommatidia, qui fournissent ensemble le champ visuel panoramique qui couvre presque toutes les directions autour de sa tête volée. L' information primaire de l'œil unités d' échantillonnage sont ses photorécepteurs rhabdomeric 7,8,11. Chaque ommatidium contient huit cellules photoréceptrices (R1 à R8), qui partagent le même objectif de facette, mais sont alignés sur sept directions différentes. Alors que les photorécepteurs externes R1-R6 are plus sensible à la lumière bleu-vert, les sensibilités spectrales des cellules internes R7 et R8, qui se situent au - dessus de l'autre et pointer vers la même direction, présentent trois sous - types distincts: pâle, zone de bord jaune et dorsale (DRA) 12- 15.
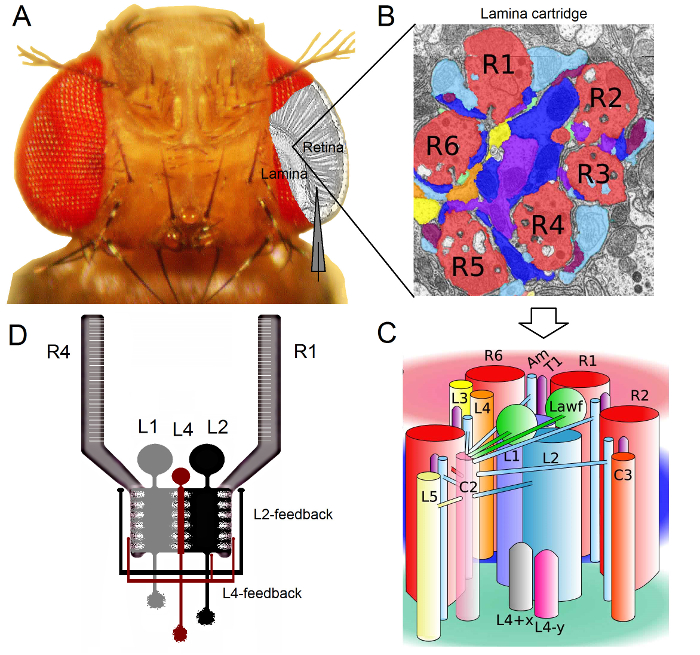
Figure 1. Organisation fonctionnelle du Drosophila Eye. (A) Les deux premiers noyaux optiques, rétine et lamina, sont mis en évidence en gris dans l'œil de mouche. Photorécepteurs Retina R1-R6 et lamina grandes cellules monopolaires (LMC: L1-L3) sont facilement accessibles in vivo à des enregistrements classiques de microélectrodes pointus. L'électrode schématique montre le trajet normal à enregistrer à partir de R1 à R6 dans la rétine. Un chemin d'accès à enregistrer à partir de LMC dans le limbe est de déplacer en parallèle l'électrode à gauche. (B) Lamina est une matrice d'organe rétinotopiquecartouches lisés, dont chacun est emballé avec les neurones qui traite des informations à partir d'une petite zone spécifique dans l'espace visuel. En raison de la superposition de neurones, six photorécepteurs de différents ommatidia voisins envoient leurs axones (R1-R6) à la même cartouche de lame, formant des synapses de sortie histaminergiques à L1 à L3 et d'une cellule amacrine (Am). (C) La diffusion de l' information neuronale entre les terminaisons axonales R1-R6 et les interneurones visuels (y compris L4, L5, Lawf, C2, C3 et T1), à l' intérieur d' une cartouche de lamina est complexe. (D) R1-R6 axones photoréceptrices reçoivent des évaluations synaptiques de cellules monopolaires L2 et L4. (B) et (C) modifié de Rivera-alba et al 2. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
L'œil de drosophile est du type neuronal superposition 16. Cela signifie que tchapeau les signaux neuronaux de huit photorécepteurs appartenant à sept ommatidia voisin, qui ressemblent au même point dans l'espace, sont réunies ensemble à une cartouche de neurones dans les deux prochaines neuropils: le limbe et la moelle. Tandis que les six photorécepteurs externes du projet R1-R6 leurs terminaisons axonales de neurones à des colonnes dans la feuille (figure 1), les cellules R7 et R8 contourner cette couche et à établir des contacts synaptiques avec leur colonne rachidien 17-19 correspondante. Ces câblages exactes produisent le substrat neuronal pour la cartographie rétinotopique de mouche vision précoce, après quoi tous les lamina (Figures 1A-C) et de la colonne medulla (cartouche) représente un seul point dans l' espace.
Les apports directs de photorécepteurs R1-R6 sont reçus par les grandes cellules monopolaires (de LMC: L1, L2 et L3) et la Cellule amacrines (Am) dans la lamina 1,2,20. Parmi ceux - ci, L1 et L2 sont les plus grandes cellules, médiateurs principales voies d'information (figure 1D), which répondent à l' intérieur et à bords Off-déplacement, et forment ainsi la base de calcul du détecteur de mouvement 21,22. Expériences comportementales suggèrent qu'au contraste intermédiaire, les deux voies facilitent la perception du mouvement des directions opposées: back-to-front en L1 et avant-arrière dans les cellules L2 23,24. Connectivité implique en outre que les neurones L4 peuvent jouer un rôle essentiel dans la communication latérale entre les cartouches voisines 25,26. synapses réciproques ont été trouvées entre les cellules L2 et L4 situées dans le même et deux cartouches adjacentes. En aval, chaque cellule L2 et ses trois cellules L4 associés projettent leurs axones vers un objectif commun, le neurone Tm2 dans le bulbe rachidien, où les entrées de cartouches voisines sont soupçonnés d'être intégré pour le traitement de l' avant vers l' arrière le mouvement 27. Bien que les neurones L1 reçoivent des commentaires du même cartouche L2 via les jonctions lacunaires et synapses, ils ne sont pas directement reliés aux cartouches lamina L4S et donc adjacents.
évaluations synaptiques à R1-R6 axones photoréceptrices sont fournis uniquement par les neurones appartenant aux circuits / L4 L2 mais pas la voie 1,2 L1 (figure 1D). Tandis que les connexions de même cartouche sont sélectivement L2 R1 et R2 et de R5 à L4, les photorécepteurs R1-R6 synaptiques reçoivent une rétroaction à partir L4 de l'une ou les deux cartouches voisines. En outre, il y a de fortes connexions synaptiques de Am à R1, R2, R4 et R5, et les cellules gliales sont également synaptique connectés au réseau et peuvent ainsi participer au traitement de l' image neuronal 6. Enfin, gap-jonctions axonales, reliant voisins R1-R6 et entre R6 et R7 / R8 photorécepteurs dans la lamina, contribuent à la représentation de l' asymétrie d' information et de traitement dans chaque cartouche 14,20,28.Enregistrements de tension intracellulaires de photorécepteurs individuels et des interneurones visuels dans presque intact Drosophila offrent une haute r signal-bruitdonnées atio à une résolution inférieure à la milliseconde 3,5,7-10,29, qui est nécessaire pour donner un sens aux calculs neuronaux rapides entre les neurones connectés. Ce niveau de précision est impossible par des techniques d'imagerie optique actuelles, qui sont nettement plus bruyants et opèrent généralement à 10-100 résolution msec. En outre, parce que les électrodes ont de très petits et pointus conseils, la méthode ne se limite pas à des organismes cellulaires, mais peut fournir des enregistrements directs de petites structures neurales actives; tels que des arbres dendritiques des LMC ou axones photoréceptrices, qui ne peuvent être accessibles par beaucoup plus grandes pointes des électrodes de patch-clamp. Fait important, la méthode est aussi structurellement moins invasive et dommageable que la plupart des applications de patch-clamp, et affecte donc moins intracellulaire milieu et de l'information d'échantillonnage »les cellules étudiées. Ainsi, les techniques classiques de microélectrodes nettes ont contribué, et de continuer à contribuer, les découvertes fondamentales et un aperçu original dans infor neuronalle traitement de l'infor- à l'échelle de temps appropriée; améliorer notre compréhension des mécanismes de la vision 10/03.
Cet article explique comment les enregistrements intracellulaires in vivo de la drosophile photorécepteurs et LMC R1-R6 sont effectuées dans le laboratoire Juusola. Ce protocole décrit comment construire une plate-forme d'électrophysiologie approprié, préparer la mouche, et effectuer les enregistrements. Certaines données représentatives sont présentées, et des problèmes communs et les solutions possibles sont discutées qui peuvent être rencontrées lors de l'utilisation de cette méthode.
Protocole
Le protocole suivant est conforme à toutes les directives de protection des animaux de l'Université de Sheffield et de l'Université normale de Beijing.
1. Réactifs et préparation Équipement
- Enregistrement et Lumière Équipement Stimulation Setup
- Choisissez au moins une zone d'enregistrement de 2,5 x 2,5 m pour réaliser des expériences électrophysiologiques dans une chambre qui a l'air conditionné avec une humidité régulée et des moyens pour fournir des conditions d'enregistrement sombres. Assurez-vous que cette zone est assez grand pour accueillir confortablement un: (i) 1 x 1 m de table vibrations isolement qui abrite la plate-forme [mouche stimulation et un appareil d'enregistrement], stéréomicroscope et une source de lumière froide avec deux cols de cygne, tous enfermés dans un grandes> 180 cm de hauteur de la cage de Faraday; (Ii) un rack 38U pour loger un ordinateur personnel avec un écran LCD plat, amplificateur de microélectrodes, les conducteurs de LED, des filtres, des unités de contrôle de la température, des oscilloscopes et autres instruments électriques nécessaires; et (iii) unpetit bureau et une chaise pour l'enquêteur.
- Placez la plate-forme loin des sources de bruit électriques et mécaniques, tels que les réfrigérateurs, les centrifugeuses et les ascenseurs. Utilisez des parasurtenseurs séparés pour protéger les appareils électriques de la plate-forme de pointes de tension qui se produisent dans le secteur. Idéalement, connectez la plate-forme à sa propre alimentation sans coupure (UPS batterie) pour minimiser le bruit.
- Construire un porte-mouche conique en laiton et en plastique noir (Figure 2). Percer un petit trou conique à travers l'unité de laiton avec son rétrécissement de la jante externe à ~ 0,8 mm de diamètre (correspondant à la largeur du thorax d'une mouche typique).
Remarque: Ce trou doit se rétrécissent vers la pointe du porte-mouche pour qu'un plus grand que la moyenne Drosophila, qui est projeté par le bas par le flux d' air, serait coincé épaule profonde au niveau du rebord supérieur. - Concevoir et construire une stimulation et un appareil d'enregistrement mécanique robuste, mais précis, voler (Figure 3). Construire sur of aluminium ou en laiton (métaux à haute conductivité) un pôle de plate-forme de préparation à la mouche et autour d'elle un système Cardan-bras, avec roulements à billes intégrés, pour fournir x lisses et précises, y-positionnement et le verrouillage du stimulus lumineux.
Note: Cette conception composite intégré minimise les vibrations mécaniques qui, sinon, déloger la pointe de l'électrode d'enregistrement à partir de la cellule étudiée. Il peut en outre intégrer un système de contrôle de température en boucle fermée à base de Peltier-élément, ce qui permet aux enquêteurs d'utiliser des constructions génétiques sensibles à la température, tels que shibire TS, pour évaluer les calculs de circuits synaptiques 9,30. Anodisation l'appareil ou de peindre en noir pour minimiser stimulus diffusion de la lumière.- Fixer la stimulation à la mouche et un appareil d'enregistrement sur la maquette de la table anti-vibration; par exemple par des boulons M6, en utilisant les métriques trous de vis. Utilisez une planche à pain noir ou le couvrir avec tissu noir pour minimiser la dispersion de lumière au cours des expériences.
- Position et de blocage (à l'aide d'une vis de blocage), une plate-forme de pôle de préparation de braguette réglable verticalement au centre d'un système à bras Cardan. Placez la mouche-préparation (dans le porte-mouche, voir étape 2) sur le pôle de la plate-forme de telle sorte que la source de lumière attachée à la Cardan bras pointe radialement à la tête de la mouche. Assurez-vous que le centre des yeux de mouche est exactement au point d'intersection (0, 0) de x- du Cardan-bras et axes y, car cela permet x précis, y-positionnement du stimulus de la lumière à un point quelconque de la mouche de champ visuel.
Remarque: Cette fonctionnalité est nécessaire pour cartographier les propriétés des cellules individuelles à des emplacements oculaires spécifiques d'intervention, par exemple, lors de la recherche des preuves électrophysiologiques des adaptations structurelles, telles que les zones claires ou aiguës, qui montrent une sensibilité ou une résolution augmentant respectivement 31.
- Monter le stéréomicroscope derrière la stimulation de la mouche et un appareil d'enregistrement sur la table anti-vibration afinqu'il offre un confort de visionnage à fort grossissement de l'oeil de mouche.
- Monter la source de lumière froide sur le dessus du microscope à double tête semi-rigides guides de lumière à col de cygne de la source de lumière vers le bas en direction du support de préparation à la mouche. Librement mobile deux illumination du faisceau, il est plus facile de visualiser la pointe de l'électrode d'enregistrement lors de la conduite à travers une petite ouverture dans l'œil de la mouche.
- Attachez un x, y, ensemble z-micromanipulateur appropriée (grossière et fine) pour l'électrode d'enregistrement et la tête-étape sur la table anti-vibration, sur le côté droit de l'appareil de stimulation à la mouche et l'enregistrement, en utilisant M6-boulons ou magnétique peuplements.
Remarque: Dans le laboratoire Juusola, différentes plates-formes sont équipées de différents manipulateurs; pour plus de détails voir la Table des Matériaux et réactifs. Ceux-ci fournissent tous les enregistrements intracellulaires de haute qualité. - Monter un petit manuel micromanipulateur 3 axes pour le porte-électrode de référence sur le f réglable verticalemently pôle de plate-forme de préparation. Orienter l'électrode de référence afin qu'il soit dirigé vers la préparation de mouche.
- Construire un abri de la lumière cage de Faraday autoportante en acier panneaux autour de la table anti-vibration, entourant l'appareil de stimulation à la mouche et l'enregistrement, pour éviter les interférences électromagnétiques extérieures. Laisser le devant de la cage ouverte, offrant un accès pour transporter la préparation de mouche pour les expériences. Fixer des rideaux noirs de tissu (ayant cuivre ou aluminium-mesh implantés en eux pour la terre) à l'avant pour protéger le bruit et la lumière. Peindre l'intérieur de la cage noire pour minimiser la dispersion de lumière et visser les pieds de la cage sur le sol pour éviter les vibrations.
- Raccordez la tension et les sorties de courant de l'amplificateur à haute impédance de microélectrodes intracellulaires aux entrées de deux filtres passe-bas séparés (Bessel ou similaires) en utilisant BNC-câbles. De même, relier les sorties de filtre dans les canaux appropriés des blo AD-connecteurcks / conseils d'administration du système d'acquisition de données (cartes DA / AD). Connectez le / carte AD DA (s) dans un ordinateur personnel par des câbles spécialisés, selon les manuels des fournisseurs.
- Installer le logiciel d'acquisition correspondant au système d'acquisition de données de choix sur l'ordinateur personnel. Assurez-vous que les pilotes d'acquisition de données sont compatibles avec le système d'exploitation de l'ordinateur personnel.
- Rez-de-électriquement la stimulation à la mouche et un appareil d'enregistrement, cage de Faraday, maille de cuivre (dans les rideaux), microscope, micromanipulateurs, source de lumière froide, porte-38U équipement avec tous ses instruments (l'amplificateur intracellulaire, les filtres, l'unité de contrôle de la température, PC et écran LCD etc.) à un seul point de terre central en utilisant le fil équipement de mise à la terre et M6 à sertir les extrémités bague de mise à la terre. Utiliser un multimètre électrique pour vérifier que toutes les parties sont dans le même sol.
Remarque: Pour obtenir les meilleures conditions d'enregistrement à faible bruit possibles, les configurations de mise à la terre varient typiquement from un set-up à l'autre.- Si nécessaire, connectez le point de terre central encore au sol du bâtiment, et / ou la masse centrale de l'amplificateur de microélectrodes. Après avoir testé le système pleinement opérationnel au cours des expériences électrophysiologiques réels, être prêt à modifier la configuration de mise à la terre au besoin pour réduire le bruit dans les enregistrements.
- Configurer l'amplification du logiciel (1 - 10X), le filtrage du signal (typiquement des filtres passe-bas fixé à 500 Hz, ce qui convient à la fois des données R1-R6 et LMC), et le taux d'échantillonnage (au moins 1 KHz). Assurez -vous que les paramètres obéissent Nyquist-Shannon théorème d' échantillonnage de 32; par exemple, lors de l'acquisition des données qui sont passe-bas filtré à 500 Hz, en utilisant une fréquence d'échantillonnage de 1 kHz ou plus pour réduire les effets de crénelage.
- Comme les réponses de tension caractéristiques de photorécepteurs R1-R6 sont 40 - 65 mV, et ceux de LMC 20 - 45 mV, régler l'amplification et l'affichage des échelles en conséquence pour permettre à haute résolution Sampling et la visualisation des données.

Figure 2. Fly-porte Conical Le porte-mouche est faite de deux pièces:. L'unité de laiton central et son manteau de plastique noir conique. Le trou central à l' intérieur de l'unité de laiton se rétrécit à un petit diamètre qui permet à peine la mouche à travers. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 3. Vue d'ensemble du Rig électrophysiologique. Le set-up contient une cage de Faraday autoportante abri de la lumière, la table anti-vibration, l'appareil de stimulation à la mouche et l' enregistrement, et rideaux en tissu noir avec du cuivre ou de l' aluminium-mesh intérieur pour mise à la terre. Les insrack trument est connecté électriquement à la même masse centrale avec tout l'équipement intérieur de la cage de Faraday. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
- Fabricating microélectrodes
- Tirez la microélectrode de référence de borosilicate filamentaire (diamètre extérieur: 1,0 mm; diamètre intérieur de 0,6 mm) ou de verre de quartz (diamètre extérieur: 1,0 mm; diamètre intérieur de 0,5, 0,6 ou 0,7 mm) tube à l'aide d'un instrument pipette extracteur. Essayez d'obtenir un cône progressif court.
Remarque: Les paramètres exacts du programme pipette de traction varient d'un instrument à; plus de détails dans la table des matières et régents. La taille des pores à la pointe est pas cruciale parce que la pointe de l'électrode de référence sera brisé avant d'être inséré dans la préparation à la mouche. - Tirez le microélectrodes d'enregistrement de borosilicate filamentaire (diamètre extérieur: 1,0 mm; diamètre intérieur 0,6 mm) ou en verre de quartz (diamètre extérieur: 1,0 mm, diamètre intérieur 0,5, 0,6 ou 0,7 mm) à l'aide d'un instrument tube pipette de traction. Essayez d'obtenir une longue (10 à 15 mm) Cône amende progressive.
- Inspectez avec un microscope optique que les électrodes d'enregistrement montrent correct effilé. Monter l'électrode sur une lame de verre avec de l'adhésif moulable et d'utiliser l'objectif de l'air 40X pour inspecter sa pointe.
Remarque: Une bonne électrode se rétrécit doucement jusqu'à ce que son invisiblement petit bout, autour de laquelle plus sombre continue parallèle et des motifs d'interférence plus légers peuvent être vus. Certains paramètres de traction génèrent des électrodes à haute résistance, ce qui peut ne pas donner des pénétrations cellulaires réussies parce que leurs conseils ressemblent "trompettes". Ainsi, une inspection visuelle des électrodes est importante. - Fixez les électrodes horizontalement sur une grande boîte de Pétri avec la pâte à modeler (ou adhésif moulable similaire) pour la garde et le transport vers la plate-forme d'électrophysiologie. Veiller à ce que les pointes d'électrodes unre toujours dans l'air et rien toucher accidentellement.
- Remblayage d'enregistrement et de référence des électrodes juste avant l'expérience avec la solution de sel appropriée. Utilisez une petite seringue de 5 ml reliée à un filtre de petites particules avec une pointe en plastique fine (comme un microloader).
- Pour photorécepteurs expériences, remplir l'électrode d'enregistrement jusqu'au complet (une gouttelette se forme dans sa grande extrémité) avec 3 M KCl que cette solution minimise l'effet du potentiel de jonction liquide à la tension enregistrée.
- Pour étudier les CMT histaminergiques qui réagissent à l'entrée synaptique à partir photorécepteurs R1 à R6 par des changements de chlorure conductance, remplir les électrodes d'enregistrement avec 3 M d'acétate de potassium et du KCl 0,5, car cette solution a moins d'effet sur la batterie du chlorure de la cellule. Remplir l'électrode de référence à la mouche Ringer, contenant en mM: 120 NaCl, 5 KCl, 10 TES (C 6 H 15 NO 6 S), 1,5 CaCl 2, 4 MgCl 2, et 30 saccharose 5.
- Tester la résistance d'une électrode d'enregistrement nouvellement tiré dans le système d'enregistrement.
- Veiller à ce que les fils d'argent à l'intérieur de supports d'électrode sont les enrobées uniformément avec du chlorure d'argent (apparaissant violet-gris - pas argenté brillant) pour réduire au minimum les artefacts d'enregistrement (tels que la dérive dans le potentiel de jonction). Sinon, remplacez-les avec des fils correctement chlorée.
- Si nécessaire, chloridize nouveaux fils d'argent. Nettoyer soigneusement les fils (en les passant rapidement à travers une flamme) de telle sorte que ceux-ci apparaissent argent brillant en couleur. Evitez de les toucher avec les doigts, afin de déposer sur une couche uniforme de AgCl. Faire tremper les fils en pleine eau de Javel domestique de résistance pendant 15 - 30 minutes jusqu'à ce qu'ils apparaissent couleur pourpre-gris. En variante, la galvanoplastie chaque fil (en rendant positif par rapport à une solution contenant 3 M de KCl et de faire passer un courant à travers elle à une vitesse de 1 mA / cm2 de surface) pendant 10 à 15 secondes jusqu'à ce que revêtu de manière appropriée.
- Connectez l'enregistrement de retour rempli et des électrodes de référence aux porteurs d'électrodes-leurs. Placez le bain de solution d'une petite sonnerie sur le pôle de la plate-forme de préparation à la mouche réglable verticalement. Conduisez les pointes d'électrodes dans la solution de Ringer et mesurer la résistance à la pointe de l'électrode d'enregistrement.
Remarque: Cette étape est nécessaire uniquement lors de l'essai les propriétés résistives d'électrodes, qui sont tirés à partir d'un nouveau lot de tubes de verre, ou lors de l'optimisation des programmes d'instruments microélectrodes de traction par itération. - Avant d'effectuer les mesures de résistance, lire les instructions dans le manuel utilisateur de la fabrication de l'amplificateur pour les paramètres de mesure appropriés. Pour une bonne électrode d'enregistrement, avoir une résistance de ~ 100 de la pointe - 220 MQ.
- Tirez la microélectrode de référence de borosilicate filamentaire (diamètre extérieur: 1,0 mm; diamètre intérieur de 0,6 mm) ou de verre de quartz (diamètre extérieur: 1,0 mm; diamètre intérieur de 0,5, 0,6 ou 0,7 mm) tube à l'aide d'un instrument pipette extracteur. Essayez d'obtenir un cône progressif court.
2. Préparation de Drosophila
- Collecter 5 - 10 jours anciens mouches (après l'éclosion) et les placer dans un tube de mouche propre contenant stalimentaire andard. Il est possible d'obtenir de bons enregistrements de jeunes mouches aussi, même des «nouveau-né»; mais à cause de leurs yeux plus doux, coupe une ouverture de la cornée pour l'électrode d'enregistrement est plus difficile.
- Construire un tube de mouche capture et une préparation à la mouche debout (Figure 4). Voir la figure 4 pour l'idée générale de la façon dont ces outils self-made ont été mis ensemble.
- Pour faire un tube de mouche attraper, couper la pointe de fond conique de 50 ml en plastique centrifugeuse tube. Ensuite, insérez et collez le gros bout de 1 ml pointe de la pipette sur cette nouvelle ouverture.
- Enfin, couper le petit bout de la pipette à une taille qui permet facilement une mouche marcher à travers. Consulter un atelier de mécanique pour assembler une petite étape de préparation à la mouche qui permet la rotation de 2 axes et le verrouillage du porte-mouche à différentes positions.

Figure 4. Outils et Conçoit nécessaires à la fabrication de la préparation Fly. Fly tube de capture est réalisée par collage d' une pointe de pipette en plastique de 1 ml dans un tube en plastique de centrifugeuse de 50 ml. Bespoke stand de préparation à la mouche permet de rotation libre et le blocage du porte-mouche dans une position préférée pour préparer la volée. La mouche est fixée par la cire d'abeille, en utilisant la cire de chauffage électrique. La gelée de pétrole est appliquée par un petit applicateur réalisé en connectant un cheveux épais de tri sur une poignée. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Recueillir une mouche pour l'expérience dans un embout de pipette 1 ml, ce qui permet à peine une mouche pour passer à travers. Attacher la mouche attraper le tube, avec la pointe de la pipette sur elle, au tube de mouche. Dans la capture une mouche, profiter de leur tendance inhérente à monter vers le haut (antigravitaxis) dans la pointe de la pipette. De préférence, sélectionnez la plus grande femelle, comme la taille importes en électrophysiologie.
Note: Plus la mouche, plus ses cellules et plus les chances pour les enregistrements intracellulaires de haute qualité. Les petites mouches (deux femelles et les mâles) peuvent également fournir d'excellents enregistrements, mais la préparation est plus difficile à faire. Une fois que la mouche est piégé dans une grande pointe de la pipette, rappelez-vous de fermer le tube de mouche pour arrêter d'autres mouches de fuir. - Connecter une seringue de 100 ml avec un tuyau en plastique souple à la plus grande ouverture de la pointe de la pipette - à la mouche encore en elle.
- Placez l'extrémité étroite sur la pointe de la pipette grande, qui est agrandie juste pour une drosophile à travers, à l'ouverture dans le fond du porte-mouche et presser un petit volume d'air de la seringue pour éjecter la mouche dans le porte-mouche .
- Regardez à travers le stéréomicroscope et administrer doucement plus d'air jusqu'à ce que la tête de la mouche est en saillie à partir de l'extrémité conique du porte-mouche. Assurez-vous que la mouche est fermement coincé de son thorax au petit opening sur le haut du porte-mouche.
- Utilisez un chauffe-cire pour fixer la volée avec la cire d'abeille de ses «épaules» au porte-mouche. Réglez la température du chauffe-cire pour être aussi bas que possible pour l'instant de fusion proprement la cire.
Remarque: Lorsque la température est correcte, la cire apparaît transparente. Trop élevé d'une température rend la cire "brûler"; trop faible maintient la raideur de la cire. Lors de la fixation à la volée, être précis et bref exposition prolongée à la chaleur peut endommager. Utilisation de la colle dentaire photopolymérisable est pas recommandé ici que son application est trop lent.

Figure 5. Préparer la mouche pour expériences in vivo. Gauche, tête de l 'A Drosophila est positionné directement dans le porte-mouche et fixé de sa trompe, l' œil droit et les épaules au porte-mouche avec soit chaufféeeswax. Droit, Une petite ouverture est découpée dans la partie la plus épaisse de l'œil, juste au- dessus de l'équateur et à seulement quelques ommatidia loin de la cuticule en arrière, à l' aide d' un bord de rasoir. Un morceau de cornée est délicatement retiré et le trou est scellé avec de la vaseline pour empêcher l'œil de sécher. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Immobiliser la tête de la mouche. Appliquer la cire d' abeille à la trompe (Figure 5) et le coin de l'œil droit, en évitant la cornée, et fixer la tête de ces points au porte-mouche.
- Produire un micro-couteau. Fixer une lame de rasoir non en acier inoxydable avec deux porte-lames / disjoncteurs (à la fois avec grip plat) et casser une petite bande de son tranchant. Pour la santé et la sécurité, utiliser des lunettes de protection des yeux (même si il est hautement improbable que les pièces seraient ricocher lorsque le rasoir est fissuré). Idéalement,produire un bord de rasoir qui ressemble à une flèche. Assurez-vous que cette «flèche» est fermement attaché au porte-lame, mais attention à éviter toute automutilation!
- Utilisation de la micro-couteau, préparer une petite taille de quelques ommatidia dans l'œil gauche de la volée d'ouverture - à environ 4-5 ommatidia de la cuticule dorsale juste au-dessus de l'équateur de l'œil pour fournir le passage pour le microélectrodes d'enregistrement. Effectuer un stéréomicroscope, la visualisation de la préparation avec un fort grossissement.
Remarque: Parce que l'œil de la mouche se sent élastique et résistant au sondage, le trou est meilleure coupe avec une "flèche" -Knife. La technique de coupe est assez difficile, donc une attention particulière à la vidéo de démonstration. Garder le porte-mouche dans certaines orientations (dans le stand de préparation à la mouche) peut rendre la dissection plus facile. Initialement, la microchirurgie peut se sentir difficile à apprendre, mais une fois engagé, l'adaptation neurale améliore progressivement 3D-perception et de la dextérité de l'enquêteur. - Remove soigneusement le petit morceau de la cornée de l'ouverture qui vient d'être coupé, l'exposition de la rétine en dessous. couvrir Swiftly le trou dans les yeux avec une petite goutte de gelée de pétrole en utilisant les cheveux fins de l'applicateur de la gelée de pétrole.
Remarque: Vaseline sert plusieurs rôles ici. Il prévient la déshydratation des tissus et la coagulation de l'hémolymphe qui briserait l'électrode d'enregistrement inséré. Il recouvre aussi accessoirement le microélectrodes, ce qui réduit sa capacité intra-muros. Cela peut améliorer la réponse en fréquence du système d'enregistrement, de sorte que la résolution temporelle des signaux neuronaux enregistrés. Évitez enduisant la gelée de pétrole sur le reste de l'œil, car cela brouille les optiques.
3. Enregistrement à partir de R1-R6 photorécepteurs ou LMC
- Toujours être mise à la terre lors de l'utilisation de l'amplificateur de microélectrodes (par exemple en touchant la surface métallique de la cage de Faraday ou d'une table anti-vibration), que celui-ci empêche accidentellement livrerment une charge statique à la tête-scène, ce qui pourrait endommager les circuits.
- Illuminez la plate - forme pôle de préparation à la mouche au - dessus de deux guides de lumière d' oie du cou (figure 6A) (avec la source de lumière froide à l' intérieur de la cage de Faraday) , de sorte que le porte-mouche peut être placé sur le poteau dans la position préférée sous contrôle visuel à proximité .
Figure 6. Positionnement du porte-mouche et les électrodes pour les expériences (AB) Le porte-mouche est placé sur la plate - forme d'enregistrement qui fournit également un contrôle de la température par l' intermédiaire d' un élément Peltier (A: plate - forme ronde blanc au centre).. Le Cardan-bras permet le positionnement exact du stimulus lumineux à une égale distance (via x, y-rotation) autour de la mouche, avec la source de lumière (un liquide ou un quartz fibre optique bundle) pointant directement à son oeil. Dans beaucoup de ousplates-formes de r, la stimulation lumineuse est générée par des LED (avec courant-conducteurs linéaires) ou par un monochromateur. Ainsi, leurs stimuli portent un spécifique (bande-passé) contenu spectral, choisi entre 300-740 nm et couvrent 4-6 log gamme des unités d'intensité (comme atténuée par les filtres de densité neutre séparés). (C) Deux microélectrodes, contrôlée par micromanipulateurs séparés, sont positionnés dans la tête de mouche: l'électrode de référence (ci - dessus) à travers les ocelles; l'électrode d'enregistrement (à gauche) à travers la petite ouverture dans l'oeil gauche. (D) pour l' obtention d' un nombre maximal d'enregistrements de photorécepteur, le micro - électrodes d'enregistrement est entraîné dans le trou, parallèle à l'axe trompe-ocelle. Quand pénètre l'extrémité de l'électrode et des joints d'étanchéité à un photorécepteur, la source de lumière pouvant tourner librement est fixé à la position dans laquelle la cellule produit la réponse de la tension maximale à un stimulus lumineux donné. Ce point dans l'espace situé dans le centre du champ récepteur de la cellule. Si le trou is près de la cuticule, pénétrations LMC peuvent en outre être obtenus avec ce même angle d'électrode (à gauche). Si le trou est plus éloigné de la cuticule, un autre angle d'approche d'électrode utile pour obtenir des enregistrements LMC est également montré ( à droite). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Monter le porte-mouche (à la mouche en elle!) Sur le pôle mouche plate-forme de préparation. Tourner le porte-mouche de sorte que l' œil gauche de la mouche est directement en face de l'enquêteur (figure 6B).
- Insérez l'électrode de référence émoussée doucement à travers la Occelli de la mouche dans la capsule de tête à l' aide d' un petit micromanipulateur grossier tout en observant la préparation à travers le stéréomicroscope (Figure 6C). Ne pas pousser l'électrode trop profond, car cela peut endommager le cerveau de la mouche.
- Vous pouvez également insérer l'électrode de référence à l'arrière du thorax. Toujours, veiller à ce que la mouche apparaît heathy (déplace ses antennes) et ses yeux sont intacts; pas accidentellement endommagé. Si la préparation a l'air moins immaculée, préparer une nouvelle mouche pour les expériences.
- Conduire le microélectrodes d'enregistrement pointu dans l'oeil gauche par la gelée de pétrole couvert petite ouverture préparée plus tôt. Utilisez un fort grossissement dans le stéréomicroscope et déplacer les guides de lumière et le plan focal de sorte que l'emplacement de la pointe de l'électrode devient apparente en 3D par ses motifs de réflexion.
Remarque: La figure 6D montre comment la tête de la mouche doit être positionné de façon légèrement différente (par rapport à l'angle du microélectrodes d'enregistrement pénètre dans l'œil) pour photorécepteur et enregistrements LMC. Commander l'électrode dans l'oeil sans le casser est la phase la plus difficile de l'expérience. Si la pointe de l'électrode manque la petite ouverture dans les yeux, frapper la cornée, il se casse généralement. - Allumez l'amplificateur de microélectrodesune fois les deux électrodes sont fermement à l'intérieur de la préparation, en contact électrique avec les fluides corporels de la mouche.
- Coupez la source de lumière froide (l'intérieur de la cage de Faraday) et le débrancher du secteur. Branchez sa fiche à la masse centrale pour minimiser la boucle souterraine induite bruit électrique, et déplacer les guides de lumière col de cygne loin pour que le système Cardan-bras peut être déplacé librement autour de la mouche. Eteignez les lumières de la pièce pour assurer que la préparation à la mouche est maintenant dans l'obscurité relative.
- Mesurer la résistance de l'électrode d'enregistrement dans l'œil (comme indiqué dans le manuel d'utilisation de l'amplificateur). Utilisez des électrodes d'enregistrement seulement dans lequel la résistance est 100-250 MQ.
Remarque: Il est pratiquement impossible d'obtenir des enregistrements intracellulaires de haute qualité par <70 MQ électrode. Si la résistance est <80 MQ, il est probable que la pointe de l'électrode est cassée. Dans ce cas, éteignez l'amplificateur et changer l'électrode d'enregistrement.- Une fois que l'électrodeest remplacé et dans l'oeil, allumer l'amplificateur pour mesurer sa résistance. Parfois, la pointe de l'électrode peut être bloqué par certains détritus comme il pénètre dans le tissu. Cela peut être résolu en utilisant capacitive buzz et impulsions de courant des fonctions de l'amplificateur que généralement clair par resonation rapide ou de répulsion.
- Réglez l'amplificateur à courant-clamp (CC) ou le mode d'enregistrement de pont. Annuler toute différence de tension arbitraire entre l'enregistrement et de référence, comme les deux sont maintenant au repos dans l'espace extracellulaire interconnectés électriquement, en réglant le signal de décalage (tension d'enregistrement) à zéro. Suivez les signaux de décalage modifications à l'aide de l'affichage de l'écran de l'amplificateur ou un écran d'oscilloscope.
- Attendez 2-3 min pour l'œil de la mouche à foncé adapter.
- Conduisez la pointe de l'électrode d'enregistrement progressivement plus profondément dans l'œil avec de petites 0,1 à pas de 1 micron. Pour ce faire, avec un axe x piezo-stepper d'un micromanipulateur ou b télécommandéey tourner doucement la résolution bouton amende d'un manipulateur manuel.
- Stimulez l'œil de la mouche avec une brève (1 - 10 msec) clignote comme l'électrode d'enregistrement est avancé dans le tissu.
Remarque: Si l'électrode d'enregistrement est positionné dans la rétine et les fonctions oculaires normalement, chaque flash de lumière provoquera une chute brève et de faible tension (0,2 à 5 mV hyperpolarisation), appelé l'électrorétinogramme (ERG). Ce changement dans le potentiel de champ de l'espace extracellulaire est causée par la réponse collective des cellules de la rétine à la lumière. Cependant, une fois que la pointe de l'électrode entre dans la lamina, fermeture sur les LMC, l'ERG inverse, montrant des réponses dépolarisants. - Déplacer la source de lumière autour de l'œil de la mouche à l'aide du système Cardan-bras et trouver la position où la lumière évoque la plus grande réponse ERG.
Note: Cette position marque la petite zone dans l'espace visuel où les photorécepteurs (ou LMC), qui sont situés à côté de la pointe de l'électrode d'enregistrement, Goûter leur entrée de lumière. - Pénétrer dans une cellule avec l'électrode d'enregistrement.
Remarque: La pénétration peut se produire spontanément, ou lorsque l'électrode est micro-pas en avant. Il peut être facilitée en tapotant doucement le système de micromanipulateur ou en utilisant le buzz fonction de l'amplificateur; ces actions résonnent la pointe de l'électrode dans le tissu. Lorsque l'électrode empale la membrane du photorécepteur, entrant dans l'espace intracellulaire, la différence de tension entre l'enregistrement et l'électrode de référence tombe brusquement de 0 mV à -65 mV ~ (entre -55 et -75 mV); alors que pendant les pénétrations LMC, cette baisse est généralement inférieure (entre -30 et -50 mV). Ces différences de tension représentent les potentiels de repos négatif des cellules données. En fonction de la qualité de l'électrode d'enregistrement (sa netteté) et le processus cellulaire a pénétré, la lecture de tension de l'électrode d'enregistrement peut se stabiliser rapidement ou progressivement au potentiel de repos, comme la membrane cellulairejoints à la couche extérieure de l'électrode. Mais, si la pénétration est partielle ou faible, l'électrode glisse typiquement hors de la cellule avec la montée de potentiel enregistré de nouveau vers zéro. - Localisez le centre du champ récepteur de la cellule pénétré lorsque l'électrode apparaît correctement scellé, montrant le potentiel de membrane stable (potentiel de repos foncé). Déplacer le stimulus lumineux clignotant autour de l'œil de la mouche, en utilisant le système Cardan-bras, pour trouver le point dans l'espace visuel, où le flash de lumière évoque la réponse de tension maximale de la cellule. Verrouiller le Cardan-bras lorsque le stimulus lumineux directement face (points) au centre du champ réceptif.
Remarque: Dans l' obscurité, les photorécepteurs de drosophile répondent à des impulsions de lumière brillante avec 40 - 65 mV tension de dépolarisation réponses 4,5, alors que les enregistrements LMC stables montrent 20 à 45 mV réponses hyperpolarisants 9,10,14. penetrations gliales peuvent survenir rarement, indiqué par <-80 mV potentiels de repos et beaucoup plus lentet plus petit (~ 5 mV) saturée dépolarisations induites par la lumière. Photorécepteurs chez la drosophile avec différentes pigmentations oculaires, comme le blanc des yeux 7 et cinabre, montrent des tailles de réponse comparables à de type sauvage. - Utilisation actuelle-clamp (CC) le mode de l'amplificateur, compenser la capacité de l'électrode d'enregistrement en injectant petit 0,1 nA et brève (100 - 200 msec) des impulsions de courant dans la cellule étudiée pour minimiser les artefacts d'enregistrement au cours de sa charge de membrane.
Remarque: Cette procédure importante est expliquée en détail dans le manuel d'utilisation de l'amplificateur, et doit être pratiqué avec un modèle de pile électrique avant les expériences réelles. - réponses de tension d'enregistrement à impulsions lumineuses et d'autres stimuli d'intérêt, ayant diverses qualités statistiques ou physiques (telles que les séries chronologiques d'intensité lumineuse naturaliste ou motifs de contraste aléatoires). Essai, par exemple, comment les réponses enregistrées changent avec éclairage ou adaptation à l'obscurité.
Note: On peut précisément light-adapter la cellule étudiée par la lumière continue d'intensité présélectionnée en ajoutant des filtres de densité neutre sur le trajet de la lumière 4,5. Sinon, pour adaptation à l'obscurité prolongée éteindre le stimulus lumineux pendant une durée prédéfinie. En raison de la stabilité mécanique du système d'enregistrement, la qualité élevée des électrodes d'enregistrement et l'intégrité de la préparation, des conditions d'enregistrement stables peuvent parfois durer plusieurs heures. Ainsi, dans un bon jour, il est possible de recueillir une grande quantité de données à différentes conditions d'Adaptation d'une seule cellule. Lorsque l'électrode se glisse hors de la cellule, les réponses enregistrées diminuent et que la tension moyenne commence à se rapprocher de zéro. - Avancez avec précaution l'électrode d'enregistrement avec le réglage fin de l'axe des x du micromanipulateur jusqu'à ce que l'électrode est en contact et pénètre dans la cellule suivante (ce qui est généralement le voisin neuronal le plus proche). Ne pas déplacer l'électrode le long de l'axe z y- ou comme ces manœuvres feraient l'électrode à "plOugh le tissu "de côté, endommager l'oeil!
Note: Avec une bonne électrode et une préparation en bonne santé, on peut enregistrer les réponses de haute qualité à partir de nombreux photorécepteurs (mais rarement de nombreux LMC) dans la même volée sur une période de plusieurs heures; de temps en temps, sur toute la journée de travail (> 8 h) sans détérioration de signal clair. - Enregistrer les fichiers de données périodiquement avec des informations d'identification, telles que la date, le génotype et le type de cellule enregistrée. En raison de la grande quantité de données qui peuvent être recueillies lors d'une séance d'enregistrement avec succès, garder de bons dossiers écrits dans un laboratoire-livre pour l'analyse des données futures.
Résultats
La méthode d'enregistrement de microélectrodes forte, adaptée ici pour l'œil de drosophile, peut être utilisé pour quantifier de façon fiable neuronal échantillonnage de l' information et de traitement dans les cellules de la rétine et de la lamina, et la communication entre les 4,5,7,8,10,33. En l'utilisant pour étudier le codage dans différentes actions de type sauvage, des mutants ou des souches de mouches génétiquement modifiées, la méthode a fait ses preuves; non seulement pour quantifier les effets d'une mutation, la température, l' alimentation ou l' expression sélectionnée 3,4,6,9,10,14,30,34, mais aussi en révélant des raisons mécanistes pour les comportements visuels altérés 14,34. Le procédé est également facilement applicable à d' autres préparations d'insectes, 35,36 habilitation des études de vision neuroethological. Ensuite, nous présentons quelques exemples de ses applications réussies.

Figure 7 TensionRéponses d'un Fruit Fly R1-R6 photorécepteur à une impulsion de lumière à 20 et 25 o C. Parce que les pénétrations de microélectrodes vives sont souvent très stable, il est possible d'enregistrer les réponses de tension de la même photorécepteur R1-R6 à un stimulus lumineux donné au différentes températures ambiantes par le réchauffement ou le refroidissement de la mouche. Dans nos set-ups, le porte-mouche est placé sur un système de contrôle de température à base Peltier-élément en boucle fermée. Cela nous permet de changer la température de la tête de la mouche en quelques secondes. Une température plus élevée accélère les réactions de tension et abaisse le potentiel de repos de photorécepteurs R1-R6 (comme indiqué par des flèches rouges) caractéristique. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
L' étude de l'effet de la température sur photorécepteur sortie
Avec un bien conçu et un système d'enregistrement isolé des vibrations, la méthode peut être utilisée pour mesurer l'effet de la température sur la production de neurones d'une cellule individuelle par le réchauffement ou le refroidissement de la mouche. L'exemple suivant montre les réponses de tension à une impulsion de 10 msec de temps lumineux, enregistré dans le même photorécepteur R1 à R6 et 20 à 25 ° C (figure 7). Comme quantifiée avant 4,9, le réchauffement réduit le potentiel de repos d'un photorécepteur dans l' obscurité, et accélère ses réponses de tension.
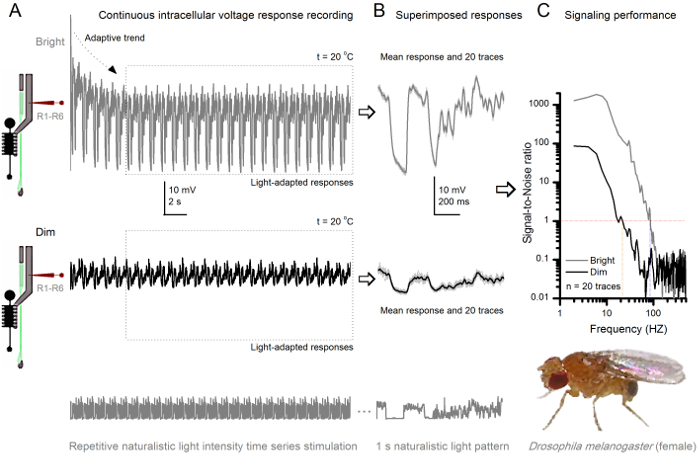
Figure 8. Signalisation Performance d' un Fruit Fly R1-R6 photorécepteur améliore avec l' intensité lumineuse (A) Sortie de photorécepteur à dim (ci - dessous) et lumineux. (Ci - dessus; 10.000 fois la lumière plus brillante) répétées séries temporelles d'intensité lumineuse naturaliste enregistrée par le même microélectrodesdans la même cellule à 20 ° C. Les réponses au stimulus lumineux sont plus grandes, parce qu'ils intègrent plus d' échantillons, des réponses élémentaires (bosses) à photons uniques 4,5,7,8. (B) 20 réponses consécutives de tension d' une seconde-longues sont superposées. Les réponses individuelles (lumière gris) ont été prises après les tendances adaptatives (flèche en A) a reculé (encadré en pointillés dans A). Les moyens de réponse correspondants (les signaux) sont les traces foncées. La différence entre le signal et les réponses individuelles est le bruit. (C) Les cellules «performances de signalisation a été quantifiée par les enregistrements de signal-bruit Ratios (SNR) en utilisant les méthodes standard 4,5,7,8. Sortie photorécepteur a une portée d' environ 64 Hz plus large de la signalisation fiable à la stimulation lumineuse ( 'de ≥1 vive, jusqu'à 84 Hz qu'au dim (SNR SNR)' Dim ≥1, jusqu'à 20 Hz), avec s-Ignal à bruit en améliorant grandement; de SNR Dim MAX = 87 à SNR brillant MAX = 1,868. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Etudier l' adaptation et Neural Encoding par Répétitive Stimulation
La non - invasivité du procédé, ce qui provoque relativement peu de dommages aux structures de la rétine et de la lame, il est idéal pour étudier les performances de la signalisation des cellules individuelles à différents stimuli lumineux dans leur état physiologique naturel près in vivo. La figure 8 montre les réponses de tension d'un R1- R6 photorécepteur à un naturaliste temps d'intensité lumineuse série stimulus répété faible et lumineux à 20 ° C, tandis que la figure 9 montre les réponses d' une autre photorécepteur R1-R6 et un LMC à un stimulus naturaliste différent à 25 o C. Les enregistrements pré et post - synaptiques ont été réalisées séparément de deux mouches différentes parce que les enregistrements intracellulaires simultanés par deux tranchants microélectrodes dans la même volée, l' une dans la rétine et l'autre dans la lamina, sont trop difficiles pour être viable 30.
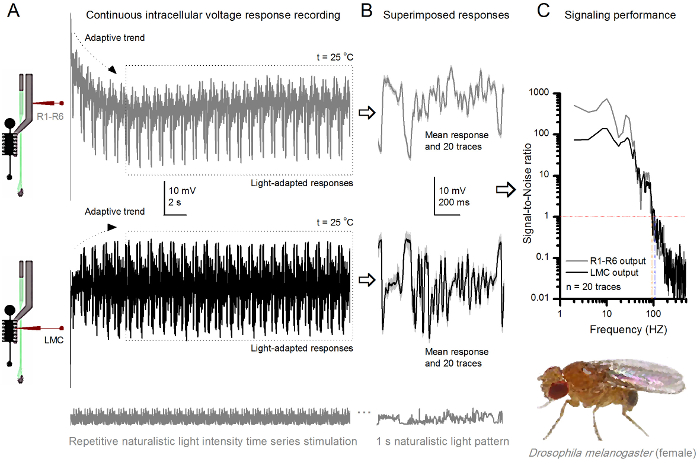
Figure 9. Réponses de tension d'un Fruit Fly R1-R6 photorécepteur et LMC à répétition Naturalistic Stimulation à 25 o C (A) R1-R6 (gris) et LMC (noir) sorties enregistrées par microélectrodes différentes de différentes mouches. (B) 20 avant entièrement la lumière adaptée consécutive (ci - dessus) et post - synaptiques (ci - dessous) les réponses au même schéma de relance naturaliste avec des réponses individuelles, représenté en gris clair und les moyens correspondants de réponse (les signaux) que les traces les plus sombres. La différence entre le signal et les réponses individuelles est le bruit. (C) Les cellules «performances de signalisation a été quantifiée par les enregistrements de signal-bruit Ratios (SNR). Sortie LMC a une portée d' environ 10 Hz plus large de la signalisation fiable (SNR 'LMC ≥1, jusqu'à 104 Hz) que la sortie R1-R6 (SNR' R ≥1, jusqu'à 94 Hz). Les deux rapports signal sur bruit est élevé (SNR LMC MAX = 142, SNR R MAX = 752), et comme le bruit d'enregistrement était faible, leurs différences reflètent des différences réelles de codage entre les cellules. S'il vous plaît cliquer ici pour voir une version plus grande cette figure.
Après le début de relance, les enregistrements typiquesly montrent l'adaptation rapide des tendances qui s'atténuent largement dans 5-6 sec. A partir de là, les cellules produisent des réponses très cohérentes à chaque présentation à long stimulus 1 sec (chaque boîte en pointillés entoure 20 de ceux-ci). La reproductibilité des réponses devient évidente lorsque celles - ci sont superposées (figure 8B et figure 9B). Les réponses individuelles sont les traces grises minces, et de leur dire la trace sombre plus épaisse. La réponse moyenne est pris comme signal de neurones, alors que le bruit de neurones est la différence entre la moyenne et chaque 4,5,9,37,38 de réponse individuelle. Les rapports respectifs signal-bruit dans le domaine fréquentiel (figure 8C et la figure 9C) ont été obtenus par transformation de Fourier du signal et de bruit blocs de données dans les spectres de puissance, et en divisant le spectre de puissance moyenne du signal avec le spectre de puissance de bruit moyenne correspondante 4, 5,9,37,38. De façon caractéristique, les rapports maximaux signal-bruit of les sorties neuronaux enregistrées à la stimulation naturaliste sont élevés (100 - 1000), et dans les préparations les plus stables avec le bruit d'enregistrement très bas peut atteindre des valeurs >> 1000 (par exemple, la figure 8C.). Notez également que le réchauffement augmente les cellules de la bande passante de données fiables de signalisation 4 (SNR Bright ≥ 1); par exemple, la différence relative entre les deux R1- les R6 sur les figures 8 et 9, respectivement, est de 10 Hz (84 à 20 ° C et 94 Hz à 25 ° C).
On peut en outre estimer le taux de transfert d'information de son rapport signal sur bruit de chaque cellule en utilisant l'équation Shannon 32, ou en calculant la différence entre l' entropie et le bruit des taux d'entropie des réponses grâce à la méthode d'extrapolation triple 39. Plus de détails sur les informations des analyses théoriques, et leur utilisation et limitations spécifiquement avec cette méthode sont donnés dans les publications antérieures 7,8,39.
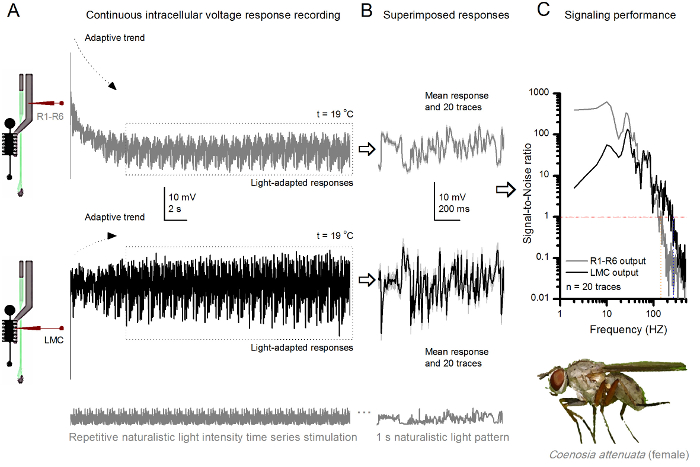
Figure 10. Réponses de tension d'un tueur Fly R1-R6 photorécepteur et LMC à répétition Naturalistic Stimulation à 19 o C (A) R1-R6 (gris) et LMC (noir) sorties enregistrées par le même microélectrodes de la même volée; postsynaptique premier et ensuite présynaptique, que l'électrode a été avancé dans l'oeil. (B) 20 pré consécutifs (ci - dessus) et post - synaptiques (ci - dessous) Réponses (traces gris clair) pour le même motif de stimulus naturaliste ont été capturés après l' adaptation initiale (boîte en pointillés dans A). Leurs moyens sont les signaux (les traces sombres sur le dessus), tandis que leurs différences respectives aux réponses individuelles donnent le bruit. (C) correspondant SignaLes ratios l-bruit (SNR) ont été calculées comme dans les figures 8C et 9C. Sortie LMC a environ une plage de 100 Hz plus large de signalisation fiable (SNR 'LMC MAX ≥1, jusqu'à 234 Hz) que la sortie R1-R6 (SNR' R MAX ≥1, jusqu'à 134 Hz). Les deux rapports signal sur bruit est élevé (SNR LMC MAX = 137, SNR R MAX = 627), et que le même microélectrodes a été utilisé dans les enregistrements, leurs différences reflètent des différences réelles dans les sorties de neurones pré- et post - synaptiques. Ces résultats impliquent que le système d'enregistrement avait peu de bruit, et son influence sur les analyses était marginal. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Neuroethological études Vision
Le procédé peut également être utilisé pour enregistrer les réponses pré- et post - synaptiques tension des yeux composés de différentes espèces d'insectes 7,8,35,36 (figure 10), ce qui permet des études comparatives neuroethological de traitement de l' information visuelle. Pour le système d'enregistrement présenté, la seule adaptation nécessaire est-détenteurs de préparation de nouvelles, chacune avec une ouverture de taille appropriée pour les espèces étudiées. Ces enregistrements sont exemplaires à partir d'un tueur femelle voler (Coenosia de attenuata). Ils montrent des réponses de tension intracellulaire d'un photorécepteur R1 à R6 et LMC à une stimulation lumineuse répétitif identique, que celle utilisée pour les homologues de Drosophila de la figure 9, mais à 19 ° C Dans ce cas, à la fois pré- et post-synaptiques des données ont été enregistrées à la même volée; une après l'autre, avec la même électrode d'enregistrement (rempli de 3 M de KCl) avançant à travers la première lame latérale avant de la saisirment la rétine frontale. En comparaison avec les données de drosophile à 25 o C, les données Coenosia - même à la température plus froide - montre les réponses avec une dynamique plus rapide; élargir la gamme de signalisation fiable (rapport signal-bruit >> 1) sur une gamme de fréquences plus large. De telles adaptations fonctionnelles dans le codage neuronal des stimuli naturalistes sont compatibles avec le mode de vie prédateur de Coenosia 36, qui exigent de haute précision des informations spatiotemporelle pour atteindre les comportements de chasse aériens rapides.
Discussion
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier's recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine - having too high a resistance or intramural capacitance - to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode's time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer's solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax - if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas - picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips' electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today's optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells' electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Déclarations de divulgation
The authors have nothing to disclose
Remerciements
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ's current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
matériels
| Name | Company | Catalog Number | Comments |
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30X eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| Nikon microscope | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| Newport | |||
| Micromanipulators | Narishige | Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| Huxley Bertram | Huxley xyz-axis with fine manual control | ||
| Sensapex | Sensapex triple axis | ||
| Märzhäuser | Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3 - 0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
Références
- Meinertzhagen, I. A., O'Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C., Ottoson, D. . Progress in Sensory Physiology. 5, 1-79 (1985).
- Borst, A. Drosophila's View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) - Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron - Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. . Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173 (2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon