Method Article
Protein Etkileşimleri keşfetmek ve HaloTag Teknoloji Kullanımı Protein Fonksiyonu Karakterizasyonu
Bu Makalede
Özet
HaloTag teknolojisi, memeli hücrelerinden, küçük ve büyük protein komplekslerinin izolasyonu ile önemli bir başarı göstermiştir çok fonksiyonlu bir teknolojidir. Burada mevcut alternatiflere göre bu teknolojinin avantajları vurgulamak ve ökaryot hücrelerin içindeki protein fonksiyonunun birçok yönlerini incelemek için onun yararını göstermektedir.
Özet
Proteomikte Araştırma virüs, bakteri, maya ve de dahil olmak üzere çok sayıda proteomlarda, karakterizasyonu yol açmıştır kütle spektrometresi yetenekleri gelişmeler ile son yıllarda patladı. Buna karşılık, insan proteomun analizi kısmen çalışılması gereken proteinlerin çokluğu, aynı zamanda ağlar ve etkileşimlerin bu mevcut karmaşıklığı, gerisindedir. Özellikle insan proteomesini anlama zorlukları çözmek için, biz, protein izolasyonu için HaloTag teknolojisini geliştirdi multiprotein kompleksleri izolasyonu için özellikle güçlü ve düşük bolca zayıf veya geçici etkileşimler ve / veya proteinlerin daha verimli yakalama izin var. HaloTag genetik olarak kodlanmış protein füzyon, kovalent için tasarlanmış etiket, özel ve hızlı immobilizasyon veya çeşitli ligandlarla proteinlerin etiketleme. Bu özellikleri yararlanan, memeli hücreleri için çok sayıda uygulama karakter için geliştirilmiştirprotein işlevi ize ve burada biz dahil yöntemlerini sunuyoruz: Protein roman etkileşimleri veya fonksiyonel deneyleri keşif için kullanılan çekme-çıkışlar, ve hücresel lokalizasyonu. Bu hız, özgüllük, ve diğer geleneksel olmayan kovalent yaklaşımlara kıyasla proteomik analiz için yüzeyleri için füzyon proteinlerinin kovalent yakalama önemli avantajlar bulabilirsiniz. Bu ve bunun örnekleri, insan bromodomain protein BRD4 ve histon deasetilaz HDAC1 olarak iki önemli epigenetik proteinleri kullanılarak teknolojinin geniş bir kullanım gösterilmektedir. Bu örnekler yeni etkileşimlerin keşfini sağlayan ve ökaryotlarda hücresel lokalizasyonu karakterize bu teknolojinin gücünü göstermek, hangi olacak insan işlevsel proteomiks birlikte başka bir anlayış.
Giriş
Hücresel fonksiyonun, uyaranlara yanıt, kalkınma ve / veya hastalık durumlarında değişiklikler anlayış girift bu farklı dinamik devletlerin 1,2 genelinde proteomun de kıvrımlı bağlıdır. Çok proteinlerin sayısı ve tüm olası etkileşimleri göz önüne alındığında, bu insan proteomesini 1,3-7 ele çok zor olmuştur, bununla birlikte, daha düşük organizmaların proteomesini anlamak için yapılmıştır. Kütle spektrometresi gelişmeler büyük ölçüde bu çalışmaları üstlenmek yeteneği sağlamıştır, ve burada protein kompleksleri ve memeli hücrelerinde 8-10 insan proteinlerinin fonksiyonel karakterizasyonu hem verimli yakalanması için HaloTag teknolojinin gelişmesi ile ek ve önemli bir ilerleme mevcut. Bu teknoloji yakın zamanda yeni bir protein fonksiyonunun ve understandi fikir sağlayan, önemli etkileşimlerin keşfi için kritik bir faktör olduğu çeşitli çalışmalarda gösterilmiştirHastalığın 11-13 ng.
HaloTag proteini füzyon başlangıçta geleneksel afinite etiketleri ve protein yakalama, saflaştırma ve etiketleme 8-10 ilişkili olarak antikorların çeşitli zorlukları gidermek için geliştirilmiştir. Yakalama ve protein saflaştırma için hemen hemen tüm yöntemler dahilinde, özel bir proteinin 14 zenginleştirilmesi için kullanılan bir kovalent olmayan etkileşim aşaması yoktur. Bu adım sırasında, protein ve / veya karmaşık işleminin tamamlanması saat yerine dakika gerektirir, özellikle difüzyon nedeniyle kesmek olabilir. Bu sorunu gidermek için, füzyon proteini, özellikle, hızlı ve geri dönüşü olmayan partiküller, yüzeyler ya da flüorofor 9 ya da olabilir, ligandlarına etkileşim üretilmiştir. Bu nedenle ligandına bağlı bir kez, diğer afinite etiketleri ile karşılaştırıldığında en önemli ayırt edici faktör biri olan, bağlı kalır. Ayrıca burada gösterdi yeteneğidirligandlar 9 (Şekil 1) alternatif mümkündür tek bir konstruktun, farklı biyolojik soruları için. Örneğin, protein etkileşimleri veya işlevi sorgulamak için, bir yüzey proteini ya da ligand komplekslerinin yakalama (Şekil 1) için kullanılır. Ayrı bir deneyde, aynı füzyon proteini floresan hücresel yerleşimi kaçakçılığı veya protein ciro (Şekil 1) çalışma etiketli olabilir. Bu ligand irreversible, bu bir yüzey ya da bir florofor olup olmadığını, bağlı olduğu ve bu nedenle diğer ligandlar daha sonra daha sonra aynı deneyde bağlı olamaz ancak bu kez hatırlamak önemlidir.
Protein etkileşimlerini eşleştirmek için mevcut teknolojiler analizi verimli bir şekilde daha fazla geçici ya da daha düşük bolca 1,6,7,14,15 içinde olduğu olanlar da dahil olmak üzere spesifik etkileşimler, izole etmek için bir zorluk ortaya çıkarmaktadır. Çok sayıda grup tarafından da, son işs, geleneksel izolasyon yöntemleri içinde, özellikle de insan proteomik alanında, kütle spektrometrisi analizi 16 için de geçerlidir Uygulayıcılar sinyalleri maskeleyebilir kirletici protein önemli bir sayıda olduğu ilgi göstermektedir. HaloTag protein ve iyi eş gelişmiş reçine adresi bu endişeleri için geliştirilen özellikleri. In komplekslerinin bağlayıcı kompleks Pulldowns için protokol (Şekil 1), her ikisi de kompleks yakalama teşvik eden ve spesifik olmayan bağlanma 8 seviyelerini düşürmek için, 15 dakika içinde elde edilebilir. Buna ek olarak, geri dönüşü olmayan bağlanması düşük bolluk proteinlerin etkin yakalama sağlar ve daha az hücrelerin kullanımına izin verir, daha arka 8 azaltır. Komplekslerinin yakalama kurulduktan sonra, protokol karmaşık bütünlüğünü korumak için hafif yıkama koşulları içerir. Yakalanan komplekslerinin elüsyon yöntem olup, alt anal hedef tarafından dikte edilir ve iki yöntem seçimi ile gerçekleştirilebilirYsis. Arzu analiz ya da Western blot ya da kütle spektrometrisi ile etkileşen proteinleri bulmak için ise, o zaman bu tür SDS ve üre (Şekil 1) gibi denatüranlar ile kompleksler elüt edilmesi için tavsiye edilir. Bu aslında HaloTag kaynaşık protein, yem protein olarak adlandırılan gibi, reçineye bağlı geride kalır ve bu nedenle, kütle spektrometrisi tespit peptit popülasyonunu hakim olmaz kütle spektrometresi için özellikle avantajlıdır. Bu aynı zamanda, yem protein muhtemelen western blot, diğer kovalent olmayan afinite saflaştırma veya ko-İmmüno ile karşılaştırıldığında önemli bir fark ile analiz görünür olmayacaktır, ancak anlamına gelir. Amaç fonksiyonel çalışmalarda kullanılmak üzere karmaşık bir sağlam arındırmak için ise, elüsyon füzyon proteini ve yem protein (Şekil 1) ile kodlanan ile aynı soydan gelen bölünme dizisini tanır TEV (Tütün Etch Virüsü) proteaz kullanılarak gerçekleştirilebilir. THese örnekleri ayrıca kütle spektrometresi ile analiz edilebilir, ancak daha sonra gösterildiği gibi, daha düşük bolluk saptanmasını, özel inter aktörlerin engelleyebilir yem, proteinin önemli bir miktarda ihtiva edecektir.
Burada iki önemli terapötik proteinler, protein bromodomain BRD4 ve bir histon deasetilaz, HDAC1 17 uygulanır açılan ve görüntüleme protokolleri mevcut. Kütle spektrometrisi, HDAC1 karmaşık izolasyon sonrasında enzimatik aktivite, ve her ikisi için uygun hücresel lokalizasyonu ile belirlendiği gibi biz beklenen ortakları ile, bu örnekler, etkileşim ile göstermiştir. Birlikte bu sonuçlar, ökaryotik protein etkileşimleri ve fonksiyon karakterizasyonu için teknolojinin çok fonksiyonlu doğası ve gücü göstermektedir.
Protokol
Not: Aşağıdaki protokol bir HaloTag füzyon ve seçim Sabit olarak veya geçici transfekte edilmiş herhangi bir hücre soyu içinde kullanılabilir. Bu örnekler için, HEK293T veya HeLa hücrelerinde HaloTag füzyonlar geçici transfeksiyonu için protokoller verecektir. Bütün deneyler için, biz sadece protein kontrol kullanmanızı öneririz.
1.. Fusion Protein Expression Testi
- Füzyon proteini yapı edinin:
- Önceden yapılmış HaloTag füzyon elde vektör veya varolan vektörleri kullanılarak inşa. Mevcut yapıları hakkında daha fazla bilgi için, Özgül Reaktitlerin Tablo bakın.
- Her klon, bu DNA sırası doğrulamak için tavsiye edilir.
- Füzyon proteini ve kontrol ifadesini test edilmesi:
- Her numune için, 1X SDS yükleme Boya tamponu 250 ul hazırlanması (60 mM Tris HCL pH 6.8, 0.75 mM mavi,% 12.5 gliserol, 100 mM ditiotreitol,% 0.5 SDS bromofenol).
- Her bir füzyon proteini içinve kontrol, bir standart 24 oyuklu bir plaka içerisinde 2-4 x 10 5 hücre / ml 'lik bir yoğunlukta bunların uygun ortam içinde HEK293T veya HeLa hücreleri, 0.5 ml plaka.
- Tavsiye edildiği gibi transfekte sonra, 37 ° C'de 18-24 saat ve% 5 CO2 inkübe edin.
- 24 saat post-transfeksiyon, her bir gözün ortama 5 mM'lik bir tetra-metil rodamin (TMR) ligand 0.5 ul ekleyin ve yavaşça plaka karıştırın.
- 37 ° C'de ve% 5 CO2, 15 dakika boyunca ligandı içeren transfekte hücreler inkübe edin.
- Aspire medya ligandı içeren ve 1 ml RT PBS ile hafifçe hücrelerin her iyi yıkayın.
- PBS aspire ve 1 ml PBS ile RT ikinci yıkama yapar.
- PBS çıkarın ve hücrelere doğrudan boya tampon yüklüyor 1X SDS 200 ul ekleyin.
- 1,5 ml eppendorf tüpüne levhadan Pipet lizat.
- 95 ° C'de 5 dakika boyunca kaynatılır lisat
- SDS-PAGE jeli üzerine reaksiyonun ve yük 5-10 ul çıkarın.
- Bir floresan algılama tarayıcı kullanın(TMR Uyarma: 555 nm, Emisyon: 585 nm) bantları algılamak için. Standartlar olarak floresan protein işaretleri kullanın.
- Bir floresan saptama tarayıcı mevcut değilse, yem protein ya da füzyon proteininin ekspresyonunu tespit etmek için bir füzyon proteini ya da etiketi karşı antikor kullanılarak western blot gerçekleştirin.
2.. Protein PULLDOWNS
- Geçici olarak transfekte hücrelerin hazırlanması:
- Her füzyon veya kontrol 3-4 x 10 5 hücre / ml veya 1-1.2 x 10 7 hücre başı toplam yapı, hücreler 30 ml ile 15 cm yemek hazırlamak için.
- 37 ° C'de 18-24 saat süreyle inkübe edin ve% 5 CO2, daha sonra tavsiye edildiği gibi inşa transfekte.
- 24-48 saat sonrası transfeksiyon sonra, medyayı çıkarın ve yavaşça buz soğuk PBS 20-25 ml hücre tabakasını yıkayın.
- PBS yıkama çıkarın, daha sonra 25-30 eklemek 4 ° C ml PBS soğutulmuş ve nazikçe kapalı plaka hücreleri kazıyın.
- Konik boru ve merkezkaç içine hücreleri toplamak2000 x g'de 5-10 dakika ve 4 ° C'de için fuge
- Süpernatant atılır ve 30 dakika ya da 6 aylık bir süre içinde en az -80 ° C 'de hücre pelletini yerleştirin.
- HaloLink reçine dengeleme:
- Her bir füzyon ya da kontrol örneği için, reçine Dengeleme / Yıkama tamponu 12 ml hazırlanması (100 mM Tris-HCl pH 7.5, 150 mM NaCl ve% 0.005 IGEPAL CA-630) Not:. Reçine yapmak ve kullanmak için çok önemlidir denge tampon çözeltisi ile seyreltildi, IGEPAL CA-630 olarak 12 saat içinde bu süre dışında kararlı ya da etkili değildir.
- Yavaşça homojen bir süspansiyon elde etmek için reçine sallayın veya karıştırın.
- Her açılan deney için, 1.5 ml mikrosantrifüj tüpler içine reçine 200 ul dağıtmak.
- 800 xg'de 1 dakika boyunca (örneğin, bir mikrosantrifüj içinde 3,000 rpm) için santrifüj ve ardından dikkatli bir şekilde çıkarın ve tüpün altındaki reçineyi bozmadan süpernatantı (etanol) atın.
- Reçine Dengeleme / Wa 800 ul ekleyinsh tampon ve tüpü birkaç kez ters yüz edilerek iyice karıştırın.
- 800 x g'de 2 dakika boyunca santrifüje tabi tutun, daha sonra dikkatli bir şekilde çıkarın ve supernatant atın.
- Adım 3 yıkama toplam 2.2.5 ve 2.2.6 'adımları iki kere daha.
- Kurumasını reçine önlemek için aşağıda tarif hücresel lizatlarını (Adım 2.3.8) eklemek için hazır olana kadar nihai yıkama veya süpernatant çıkarmayın.
- Bağlayıcı ve füzyon komplekslerinin yıkama:
- Her numune için, 500 Memeli Lizis Tamponu (50 mM Tris-HCl pH 7.5, 150 mM NaCI,% 1 Triton X-100,% 0,1 Na deoksikolat) ve 1X ul TBS tamponu 1 ml hazırlanması (100 mM Tris-HCI, pH 7.5 ve 150 mM NaCl).
- Yukarı ve aşağı pipetleme veya kısaca vorteks Memeli lizis tamponu 300 ul hücre pelet tekrar süspansiyon ve çözülme.
- 50X Proteaz İnhibitörü Kokteyli 6 ul (800 ug / ml benzamidin HCI, 500 ug / ml fenantrolin, 500 ug / ml aprotinin, 500 ug / ml löpeptin, 500 & #. 181; g / ml pepstatin A, 50 mM PMSF) Not: Bu protein füzyon tag bağlanmasına müdahale olarak AEBSF Proteaz kokteyl kullanılamaz.
- 3 ul RQ1 DNase ilave edin ve oda sıcaklığında 10 dakika boyunca ters.
- Cam homojenizatör 2.0 ml boyutu Dounce; . 25-30 buz üzerinde vuruş, ya 25 ya da 27 G iğne ile hücrelere geçerler 5-10 kez lizisini tamamlamak için Not: Sonikasyon kompleksleri darmadağın olabilir ve aşırı ısınma proteini füzyon etiketi aktivitesini etkileyebilir olarak tavsiye edilmez.
- Lizat temizlemek için 4 ° C'de 5 dakika boyunca 14,000 x g'de santrifüjleyin.
- Buz üzerinde yeni bir tüpe ve yerine açık lisatını, yaklaşık 300 ul toplam hacmi, aktarın.
- 1X TBS tampon ek bir 700 ul lizata temizleyin ve aşağı yukarı pipetleme ve iyice karıştırın ekle.
- Aşama 2.2.8 hazırlanan dengelenmiş reçine tüpler alın ve tüpün altındaki reçineyi bozmadan reçineden son yıkama / süpernatant kaldırmak.
- Her tu ekleReçine, seyreltilmiş lisat 1 ml olması.
- 22 ° C Not 15 dakika boyunca bir boru rotator (ya da yumuşak bir karıştırıcı) hakkında karıştırılarak inkübe: bu süre içinde reçinenin giderilmesi bağlanma etkinliğini azaltır. 4 ° C'de bağlama isteniyorsa, 1 saat boyunca karıştırma bunu.
- 800 x g'de 2 dakika ve supernatant atmak santrifüj reçine tüpleri.
- Aşama 2.2.1 yapılan reçine Dengeleme / Yıkama tamponu 1 ml ilave edilir ve birkaç kez el ile reçine tüpü ters çevirme ile iyice karıştırın.
- 800 x g'de 2 dakika süre ile ve yıkama atmak Santrifüj tüpleri reçine.
- 2.3.12 2.3.14 üç ek kez izledi Adımları tekrarlayın.
- Reçine Dengeleme / Yıkama tamponu 1 ml ilave edilir ve sürekli bir rotasyon ile 5 dakika boyunca 22 ° C'de inkübe edin.
- 800 x g'de 2 dakika süre ile ve yıkama atmak Santrifüj tüpleri reçine.
- Uç uygulamasına bağlı olarak (daha fazla açıklama için bkz), Bölüm 2.4 veya 2.5 ya geçin.
- SDenatüre edici jel, western blotlar ya da kütle spektrometresi için DS elüsyon:
- 50 ul SDS elüsyon tamponu içinde her bir örnekten (% 1 SDS ve 50 mM Tris-HCl pH 7.5) yeniden süspanse edin, reçineyi
- 30 dakika boyunca oda sıcaklığında çalkalayın tüpler.
- Analizi için yeni tüplere 800 x g ve transfer yıkama sıvılarından 2 dakika boyunca santrifüj.
- Western blot veya gümüş leke jel, bir SDS denatüre jel üzerinde yük 5-10 ul.
- Kütle spektrometrisi için, -20 ° C de, her numunenin 40 ul ayarları
- Fonksiyonel deneyleri, Western blot ya da kütle spektrometresi için TEV Proteaz elüsyon:
- Son yıkama ayrılmasından sonra, 50 ul tampon ve ProTEV bölünme TEV enzim 30 adet reçine tekrar süspansiyon.
- 1 saat boyunca çalkalanarak 25 ° C'de inkübe edin.
- 800 x g, 2 dakika boyunca santrifüj.
- Taze tüplerine Eluat aktarın.
- Fonksiyonel deneylerde acil kullanım için 4 ° C'de saklayın örneği.
3.Bir sitoplazmik ve nükleer geçirgen ligandını kullanarak floresan Labelled füzyon proteinlerinin hücresel Görüntüleme
- Transfect, etiket, ve görüntü hücreleri:
- X 10 5 hücre / ml 'lik bir yoğunlukta 1-2 her bir füzyon proteini ya da kontrol, her bir kendi uygun ortamı içinde HeLa hücrelerinin plaka 400 ul için bir 8 de odacıklı coverglass olarak.
- Tavsiye edildiği gibi transfekte sonra, 37 ° C'de 18-24 saat ve% 5 CO2 inkübe edin.
- 18-24 saat post-transfeksiyon, daha sonra her bir oyuğa bu çözeltinin 100 ul ekleyin ve hafifçe karıştırın, TMR ligandın uygun hücresel ortam içinde 1:200 seyreltik.
- 37 ° C'de ve% 5 CO2, 15 dakika boyunca ligandı içeren transfekte hücreler inkübe edin.
- Ligand ve 37 ° C'ye ön-ısıtılmış olan protein füzyon tag ligandı eksik, uygun ortam maddesinin 500 ul ile değiştirin ihtiva eden ortam aspire
- Üç yıkamadan bir toplam iki kez tekrarlayın.
- (Geri kuvöz içine hücreleri koyun 376, C ve% 5 CO2) 30 dakika karıştırıldı.
- Aspire medya ve 37 ° C'ye önceden ısıtılmış olan uygun ortamın, 500 ul ile değiştirin
- Uygun toplama parametreleri (: 555 nm, Emisyon: 585 nm TMR Uyarma) kullanarak bir mikroskop görüntü.
Sonuçlar
Herhangi bir yeni füzyon proteini ile çalışırken, transfeksiyondan sonra bu proteinin ifadesi için ilk test için önemlidir ve aynı zamanda uygun bir moleküler ağırlığa sahip bir protein üretilen olduğunu doğrulamak olduğunu. HaloTag füzyon proteinleri floresan kovalent geçirgen ya da lokalizasyonu bağlı olarak, geçirgen olmayan ligandlar ile etiketlenmiş olduğu gibi, hızlı bir Fluorimager ile ilgili tarama ve ardından denatüre edici jel elektroforezi ile hücre lizatları uygulayarak ekspresyonunu tespit etmek mümkündür. Bölüm 1.2, Halo-BRD4 (189 kD) ekspresyonu ve HaloTag tek başına kontrol (Ctrl) görülmektedir (34 kD, Şekil 2A) 'de tanımlanan protokol kullanılarak. Protokolde belirtildiği gibi, füzyon proteinlerinin ekspresyonu, aynı zamanda anti-HaloTag antikorları ile geleneksel Western lekeleri kullanılarak tespit edilebilir, veya mevcut ise, yem proteinine antikor. Mümkünse, t daha spesifik daha hızlı ve daha kolay olduğu için bunun yerine floresan ligan kullanılması önerilirhan antikor tespiti ve 10 aynı zamanda nicel.
Uygun tam uzunlukta bir füzyon proteininin ifadesi doğrulandıktan sonra, protein Pulldowns gerçekleştirilebilir. Yüksek tekrarlanabilirlik göstermektedir SDS (Protokol Bölüm 2.4) ile elüt Halo-BRD4 ve Ctrl Pulldowns biyolojik çoğaltır gümüş lekeli jeller, Şekil 2B'de gösterilmiştir. Gümüş Leke jeller proteinlerin önemli bir kısmı BRD4 protein ve kontrol (Şekil 2B), çok düşük arka plan ile etkileşim bulunmuştur göstermektedir. Giriş kısmında belirtildiği gibi, kovalent olarak bağlı kalan, elüsyon bu süreçte, Halo-BRD4 reçineden elüe olmayacaktır. Bu yüzden, önemli bir grup gümüş leke (Şekil 2B) ya da western blot (veriler gösterilmemiştir) tespit edilir, bu moleküler ağırlıkta yoktur. Bu proteinlerin BRD4 özgü olup olmadığını belirlemek için, sıvı kromatografi kütle spektrometrisi (LC-MS/MS) c gerçekleştirildiSDS çıkarma işleminden sonra elde edilen karışım, omplex. Spektral sayımı ve normalleştirilmiş spektral bolluk faktör Halo-BRD4 kütle spektrometresi analizi bulunan BRD4 18-20 bilinen uygulayıcı için (NSAF) değerleri Şekil 2C'de gösterilmiştir. PTEFb 18,20 bileşenlerin ve ayrıca BRD9 19 proteininin yüksek bolluk BRD4 komplekslerinin spesifik yakalama teyit etmektedir. Gümüş leke jeller (Şekil 2B) tarafından tahmin edildiği gibi, çok sayıda başka proteinler de kontrol (veriler gösterilmemiştir) gözlenmiştir değildi BRD4 potansiyel uygulayıcı olarak tespit edilmiştir. Bu önceden bilinmeyen olduğundan, protein, gerçek bir uygulayıcı olup olmadığını teyit etmek için bağımsız olarak diğer metodolojiler tarafından doğrulanması gerekir, ve eğer öyleyse, doğrudan veya dolaylı olarak BRD4 ile ilişkili olup olmadığını.
İzole kompleksleri de aktivitesi için incelenebilir; bunların functionali korumak, böylece TEV proteaz (Protokol Bölüm 2.5) ile elüt kompleksleri tavsiye edilmektedirty. Şekil 3A'da, TEV proteaz kullanılarak reçineden serbest Halo-HDAC1 açılan komplekslerinin bir gümüş leke jel gösterilmiştir. TEV proteaz protein füzyon etiketinin ve füzyon ortağı, yem protein önemli miktarda bu durumda HDAC1, gözlenmektedir (Şekil 3A) arasında bir bağlayıcı bölgede yaracaktır gibi. Bu fraksiyon, HDAC1 aktiviteye sahip olup olmadığını belirlemek için, elüt TEV numuneler bir lüminesan HDAC tahlilinde, HDAC-Glo 21 test edildi. Şekil 3B'de gösterildiği gibi, HDAC1 açılan örnekleri HDAC1 etkinliğinin yüksek düzeyde spesifik olarak bilinen bir HDAC inhibitörü, SAHA 22 (Sütun 2) ile inhibe edilmiştir (Kolon 1) göstermiştir. Denetimler özgüllük göstermek için olduğu gibi, herhangi bir HDAC inhibisyon ilgili sirtuin aile inhibitörü, EX-527 22 (Sütun 3) ve herhangi bir sinyal (Sütun 4) ilave HDAC1 açılan numune olmadan tek başına tampon madde kullanılarak tespit edildi gözlenmiştir.
Fonksiyonun önemli bir bileşenial proteomikler ve anlayış kompleksleri, aynı zamanda protein yerelleştirme ve / veya ticaretini anlayışıdır. Bu aynı füzyon yapılar, flüoresan hücre içine etiketlenebilir gibi, konfokal görüntüleme kullanarak lokalizasyonu izlenir. Bölüm 3'te protokol izlenerek, geçici Halo-BRD4 (Şekil 4A) ve Halo-HDAC1 (Şekil 4B) ile transfekte edilmiş HeLa hücreleri, floresan TMR ligand ile etiketlenmiş ve görüntülendi. Şekiller 4A ve 4B 'de gösterildiği üzere, her ikisi de 17 beklendiği gibi çekirdekte lokalize. Bu veriler, etiketin varlığı füzyon ortaklarının fizyolojik hücresel lokalizasyonunu değiştirmediğini gösterir.

Şekil 1.. Proteini pulldown ve konfokal görüntüleme uygulamaları şematik. Olarak kullanma ingle memeli hücrelerinde protein işlevi anlamak için çeşitli uygulamalar oluşturmak mümkündür. Bütün, bir konstrukt ya da bir füzyon Halo Sabit olarak veya geçici yapışkan ya da süspansiyon memeli hücrelerinde ifade edilir. Protein kompleksi Pulldowns için, hücreler daha sonra kovalent kompleksler reçinesi üzerinde yakalanır, lize edilir ve SDS elüsyon (sol yol) ya da TEV yarılma (sağ yol) ya da içinden elüt edilmiştir. TEV yarılma işlevsel analizinin gerçekleştirilmesi için en uygun süre SDS yürütme, kütle spektrometre analizi için devam için tavsiye edilir. Ifade, hücresel lokalizasyon, ticareti olay veya protein devir karakterize etmek için, füzyon proteinleri eksprese eden hücreler canlı bir floresanla işaretlenmiş ve daha fazla SDS PAGE jelleri üzerinde ya da confocal görüntüleme kullanarak analiz edilir. Her iki hücre geçirgen veya geçirgen olmayan floresan ligandlar, hücre içinde füzyon proteinin lokalizasyonu veya sunum bağlı olarak mevcuttur.
ŞEKIL 2 "fo: İçerik-width =" 6in "src =" / files/ftp_upload/51553/51553fig2highres.jpg "width =" 600 "/>
Şekil 2,. Halo-BRD4 protein ekspresyonu, açılan ve kütle spektrometre analizi. TMR ligand (Protokol Bölüm 2.1) ile etiketlenmiş bir HEK293T hücre lizatı içinde Halo-BRD4 füzyon proteini, 189 kD ve tek başına Halo protein füzyon tag, 34 kD, kontrol (Ctrl) ekspresyonunu gösteren (A) A SDS PAGE jelleri. Jeller tespiti için flüoroimager ile tarandı ve bir floresan moleküler ağırlık işaretleyici kullanılmıştır. (B) SDS ile akıtılan Halo-BRD4 ve Ctrl numunelerin Pulldowns için biyolojik çoğaltır Gümüş leke jeller. Molekül ağırlığı jel boyutları için endikedir. (C) spektral sayısı (sol panel) ve protein için Halo-biyolojik replicate kütle spektrometresi analizinde belirlenen protein moleküler ağırlığı hesaba normalleştirilmiş spektral bolluk faktörleri (NSAF) değerleri (sağ panel) BRD4 ve Ctrl. Gösterilmiştir w etkileşim bilinen proteinlerpTEFb (CDK9 ve Siklin T) bileşenleri 18,20 yanı sıra BRD9 19 dahil olmak üzere, ith BRD4. Bu proteinlerden Resim peptidler, Ctrl tespit edilmiştir.

Şekil 3,. Halo-HDAC1 karmaşık izolasyon ve aktivite analizi. (A) TEV yarılma sonra Ctrl (Protokol Bölüm 2.5) Halo-HDAC1 kompleksleri ve arka izolasyonunu gösteren gümüş leke jeller. Belirgin HDAC1 bant (55 kDa) ve TEV proteaz bant etiketli. Serbest HDAC1 reçinesi (Şekil 1). (B) Grafik bir lüminesan histon deasetilaz tahlilinde, HDAC-in HDAC1 karmaşık izolasyon örneklerinin aktivitesini gösteren üzerinde yakalama sonra HaloTag ve HDAC1 füzyon sekans arasında optimize bir bağlayıcı içinde TEV yarılma tarafından oluşturulan 21 glo. Grafiğin sütun 1, yüksek l gösterirHalo-HDAC1 açılan örnekleri (HDAC1) ile yer HDAC aktivitesinin düzeyleri,. Sütun 2, bu aktivite, özellikle HDAC1 açılan örnekler, ki burada HDAC inhibitörü, SAHA 22 eklenmesiyle azaltılabilir ortaya koymaktadır. Kontroller olarak, Sütun 3 sirtuin ailesine özgü bir deasetilaz inhibitörü gösterir, ancak HDAC'ler, EX-527 22, HDAC1 aktivitesi ve sütun Şekil 4, tek başına herhangi bir faaliyet tamponu kullanılarak gözlenmiştir inhibe etmez.
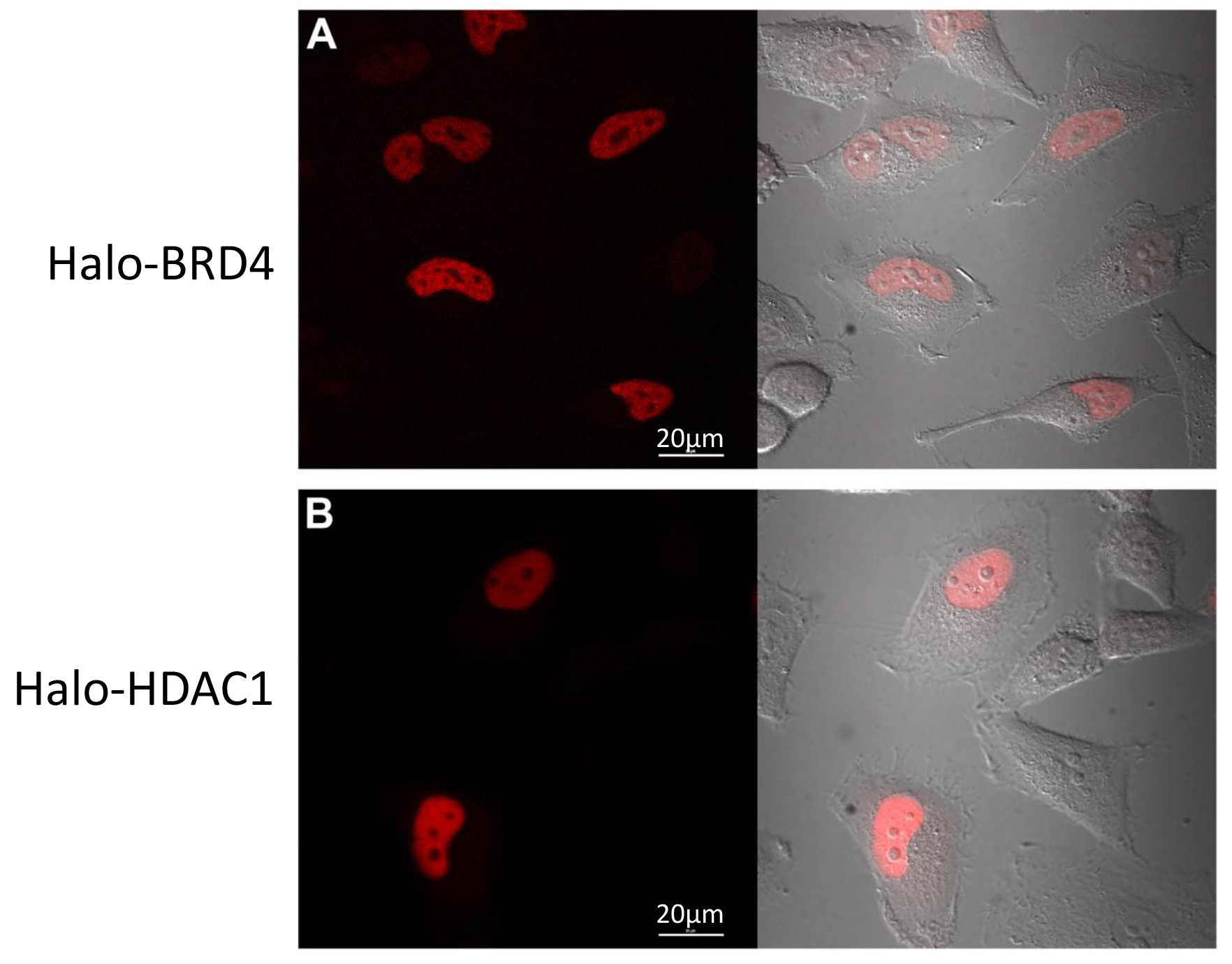
Şekil 4,. Halo-BRD4 ve Halo-HDAC1 konfokal görüntüleme. Halo-BRD4 (A) ya da Halo-HDAC1 TMR flüoresan etiketli ligand ile (B) ile transfekte edilmiş HeLa hücrelerinin hücre confocal görüntüleme canlı. (A) Halo-BRD4 ifade sınırlandırılmıştır çekirdeğe ve (B) Halo-HDAC1 ifade ağırlıklı Nuc olduğulear. Panellerin sol tarafı floresan kanal ve sağ taraf her DIC kanal ile floresan kanalın bir bindirme olduğunu. Görüntüler, uygun filtre setleri kullanılarak 37 ° C + CO 2 çevre odasının ile donatılmış bir konfokal mikroskop elde edilmiştir. Ölçek çubukları 20 um =.
Tartışmalar
İki füzyon proteinleri, Halo-BRD4 ve Halo-HDAC1, ökaryotik ekspresyon için, memeli hücrelerinde, özelliği protein kompleksi, izolasyon ve aktivitesi ve hücresel lokalizasyon burada sunulmuştur. Bu çeşitli protokoller aracılığıyla çalışan, her deney başarısı için bazı önemli adımlar vardır. Kendisi fizyolojisi korumak için kritik olabilir etiketin herhangi bir füzyon proteini ekspresyon seviyesi ve yerleştirme ile olduğu gibi. Bu önce bilgi ya da başka bir etiket ile çalışmak tercih edilen özel bir protein için gösterilen edilmemiş ise N-ve / veya C-terminal füzyonları tasarlanmış olması gerekir dikkate almak önemlidir. Seviyesi çok yüksek ise, ifade ile ilgili olarak, DNA uygun olan seyreltme seviyesine ulaşmak için daha zayıf promotörler ile vektörlerin transfeksiyon ya da kullanımı sırasında mümkün olan gerçekleştirilebilir. Önceki iş endojen le makromoleküler komplekslerin etkili izolasyonunu gösteren gerçekleştirilir olmuşturİfade çok düşük seviyelerde çalışmasını sağlayan ifadenin 8. VELS. Mümkünse, hücresel lokalizasyon çalışmaları da uygun fizyolojisi için gerekli en uygun etiket yerleştirme pozisyonu yanı sıra göreceli ifade seviyesi olarak bakış açısı sağlamak mümkün olacaktır.
Füzyon proteinlerinin en büyük avantajlarından biri olarak karmaşık izolasyon hızıdır, bu bağlayıcı, lizis tavsiye edilen zaman dilimlerini takip etmek çok önemlidir protokolü ve yıkama bölümleri ile maksimum başarı elde edilmesi için, açılan deneyler için hazır sonra süreci. Bu adımların her zaman içinde uzatılmış ise gibi bir antikor bazlı yakalama yöntemi için gerekli olan, karmaşık bir ayrışma riski ya da 8, artan bağlama spesifik olmayan yoktur. Kez hücresel lizis veya bağlayıcı sırasında kısalır Benzer şekilde eğer, hücreleri tamamen parçalanır ya da verimli sırasıyla ele olmayabilir. Yıkama sayısı decr iseazaltılması veya reçinenin iyi bir karıştırma bağlayıcı ya da yıkama sırasında meydana gelmez, daha sonra non-spesifik proteinler arka plan düzeyi artırılacaktır. Ayrıca, liziz araçlarının reçinesine bağlanma etkisi ile ilgili olarak çok önemlidir. , Örnekleri sonikasyon önerilen Deterjanı ortadan kaldırmak, ya da diğer güçlü SDS deterjanı ve / veya proteaz inhibitörü AEBSF eklemek için girişimler azaltılmış veya reçineye füzyon proteinleri ve komplekslerinin bağlanmasının kaybı ile sonuçlanacaktır.
Memeli hücrelerinde ve kütle spektrometresi 16 tarafından analiz arka plan azaltılması meydan insan proteomik analiz mücadeleden karmaşık izolasyonu için mevcut yöntemler. Bu kirletici proteinlerin bir depo çok sayıda kütle spektrometresi gruplar 16 tarafından yaratılmış olan o kadar önemli olmuştur. Kütle spektrometrisi açılan örneklerde Arka tanımlanmasını önleyen bir şey olarak tanımlanabiliryem protein doğru Uygulayıcılar. Bu nedenle, arka plan non-spesifik proteinler ya da protein yem veya yem proteinleri çökeltmek için kullanılan antikor konsantrasyonları büyük kirletici ortaya çıkabilir. Önemli çalışma Burada yer alan açılan protokolü gibi açılan işleminde spesifik olmayan kirletici proteinlerin düzeyi en aza indirmek için her iki reçine optimize yapıldı. Bu, gümüş leke jeller ve denetimin kütle spektrometresi analizi (Şekil 2) belirgindir. Yem protein ya da başka yöntemler ile mücadele ettiği gibi kirletici maddeler ve aynı derecede zararlı olabilir antikorların yüksek düzeyde ele almak için, SDS elüsyon ile açılan (Protokol Bölüm 2.4) tavsiye edilir. Nedeniyle reçineye kovalent bağlanması için, bu işlem, kovalent olarak reçineye bağlanmış başlangıç füzyon proteininin çoğunluğu bırakacaktır. Yem küçük bir kısmı inanılmaktadır kütle spektrometresi analizi görülmektedirhidroliz yoluyla ortaya çıkarmak için, ancak diğer zayıf ya da geçici etkileşimleri 8 tespiti için bir sorun teşkil etmez.
Girişte belirtildiği gibi, proteomikteki önemli gelişmeler kütle spektrometresi 1,7 önemli gelişmeler etkin olmuştur. Bu nedenle, bu Pulldowns elde proteinlerin karışımı deconvolute için kütle spektrometresi analizi seçimi önemli parametreleri vurgulamak önemlidir. Aletler sağlam ve rutin ve verimli bir şekilde <1 ug genellikle daha az proteinin küçük bir miktar ihtiva eden numune analiz yeteneğine sahip olmalıdır. 100-300 nl / dk aralığında akış oranları ile 50-75 mikron iç çapı HPLC kolonları içeren nano ölçekli kromatografisi genellikle küçük örneklem büyüklüğü ile uyumluluk için kullanılır ve kütle spektrometresi hassasiyetini maksimize etmek. Tek bir analiz devlet o edindiği bilgi maksimize etmekf Anılan nano ayrımları ile uyumlu bir zaman ölçeğinde, ≥ 10 Hz yüksek çözünürlüklü kütle spektrumları elde edebilen sanat kütle spektrometre, tipik istihdam edilmektedir. Bu araçlar duyarlılık attomolar düzeyleri ve rutin alt ppm öncüsü ve ürün iyon kütle hata toleransları ile veri elde edebilirsiniz. Bu performans özellikleri tespit proteinlerin sayısının verimi ve bu kimlik bilgileri ile ilişkili güven artırmak için vermektedir.
Yeni etkileşimleri keşfi için potansiyeli ile birlikte protein etkileşimleri ve tek bir yapı kullanılarak, aktif komplekslerin izole: Bu bilgiler ile, fizyolojik hücresel lokalizasyonunu, doğru protein göstermektedir. Gerçekten de alternatif teknolojiler, ancak muhtemelen tüm 23,24 için, bu farklı yönlerinin her biri için kullanılabilir. HaloTag teknoloji ile, çok fonksiyonlu bir yaklaşım proteom ilerleyen kullanılabilirICS çalışmaları ve memeli hücrelerinde protein fonksiyonunun daha tam bir anlayış elde edilir.
Açıklamalar
Bu yazı için yayın ücreti Promega Corporation tarafından sponsor. Danette L. Daniels, Jacqui Méndez, Hélène Benink, Andrew Niles, Nancy Murphy ve Marjeta Urh Promega Corporation, HaloTag teknoloji ve uygulamaları patent atama ile ticari sahibinin çalışanı bulunmaktadır. Michael Ford, Richard Jones, Ravi Amunugama ve David Allen Bu yazıda anlatılan kütle spektrometresi hizmet vermektedir MSBioworks, çalışanlarıdır.
Teşekkürler
Biz yazının eleştirel okuma için Dr Martin Rosenberg, Dr Gary Tarpley, ve Dr Keith Wood, bu çalışmaları desteklemek için, ve Dr James Cali teşekkür ederim. DLD, JM, HB, NM, AN, JC, ve MU Promega Corporation çalışanlarıdır. MF, RJ, RA, ve DA MS BIOWORKS, LLC çalışanlarıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | CCL-2 | Adherent |
| HEK293T Cells | ATCC | CRL-11268 | Adherent |
| Cellular growth media | Invitrogen/Gibco | ||
| PBS - tissue culture certified | Invitrogen/Gibco | ||
| FuGENE HD Transfection Reagent | Promega | E2311 | |
| HaloTag Control Vector | Promega | G6591 | |
| HaloTag-BRD4 | Kazusa DNA Research Institute | FHC11882 | N-terminal HaloTag fusion |
| HaloTag-HDAC1 | Kazusa DNA Research Institute | FHC02563 | N-terminal HaloTag fusion |
| HaloTag Clones containing content | Promega | Various | http://www.promega.com/FindMyGene/ |
| HaloTag Flexi Vectors for cloning (N- or C-terminal) | Promega | Various | Choose based upon expression level and HaloTag orientation |
| HaloTag TMR Ligand | Promega | G8251 | |
| IGEPAL CA-630 | Sigma | 18896 | |
| HaloTag Mammalian Pull-Down and Labelling System | Promega | G6500 | Contains HaloTag TMR ligand |
| HaloTag Mammalian Pull-Down System | Promega | G6504 | |
| Protease Inhibitor Cocktail, 50X | Promega | G6521 | |
| Mammalian Lysis Buffer | Promega | G9381 | |
| HaloTag Monoclonal Antibody | Promega | G9211 | |
| ProTEV Plus | Promega | V6101 | |
| RQ1 Dnase | Promega | M6101 | |
| HaloLink Resin | Promega | G1912 | |
| HDAC-Glo | Promega | G6420 | |
| PBS + 0.1% Triton X-100 | For optional imaging | ||
| 4% paraformaldehyde/0.2 M sucrose/PBS | For optional imaging | ||
| Ethanol | |||
| Tissue culture vessels and dishes | |||
| Cell culture incubator | |||
| Disposable cell lifter | Thermo Fisher Scientific | 08-773-1 | |
| Glass homogenizer such as Kontes Dounce Tissue Grinder | Thermo Fisher Scientific | K885300-0002 | 25-27 G needle could also be used |
| Microcentrifuge | |||
| Tube rotator such as Labquake | Thermo Fisher Scientific | 4002110Q | Ideal for binding and washing steps |
| Shaking platform such as Eppendorf Thermomixer | Thermo Fisher Scientific | 05-400-200 | Ideal for SDS elution and TEV cleavage steps |
| Chambered cover glass | Thermo Fisher Scientific | 155409 | For optional imaging |
| Fluorescent Microscrope (555 nm Ex/585 nm Em) | For optional imaging |
Referanslar
- Altelaar, A. F., Munoz, J., Heck, A. J. Next-generation proteomics: towards an integrative view of proteome dynamics. Nat Rev Genet. 14, 35-48 (2013).
- Tyers, M., Mann, M. From genomics to proteomics. Nature. 422, 193-197 (2003).
- Coulombe, B., et al. Interaction networks of the molecular machines that decode, replicate, and maintain the integrity of the human genome. Mol Cell Proteomics. 3, 851-856 (2004).
- Gavin, A. C., et al. Proteome survey reveals modularity of the yeast cell machinery. Nature. 440, 631-636 (2006).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Sardiu, M. E., et al. Probabilistic assembly of human protein interaction networks from label-free quantitative proteomics. Proc Natl Acad Sci U S A. 105, 1454-1459 (2008).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312, 212-217 (2006).
- Daniels, D. L., et al. Examining the complexity of human RNA polymerase complexes using HaloTag technology coupled to label free quantitative proteomics. J Proteome Res. 11, 564-575 (2012).
- Encell, L. P., et al. Development of a dehalogenase-based protein fusion tag capable of rapid, selective and covalent attachment to customizable ligands. Curr Chem Genomics. 6, 55-71 (2012).
- Ohana, R. F., et al. HaloTag-based purification of functional human kinases from mammalian cells. Protein Expr Purif. 76, 154-164 (2011).
- Black, J. C., et al. KDM4A Lysine Demethylase Induces Site-Specific Copy Gain and Rereplication of Regions Amplified in Tumors. Cell. 154, 541-555 (2013).
- Deplus, R., et al. TET2 and TET3 regulate GlcNAcylation and H3K4 methylation through OGT and SET1/COMPASS. EMBO J. 32, 645-655 (2013).
- Galbraith, M. D., et al. HIF1A Employs CDK8-Mediator to Stimulate RNAPII Elongation in Response to Hypoxia. Cell. 153, 1327-1339 (2013).
- Collins, M. O., Choudhary, J. S. Mapping multiprotein complexes by affinity purification and mass spectrometry. Curr Opin Biotechno. 19, 324-330 (2008).
- Collins, S. R., et al. Toward a comprehensive atlas of the physical interactome of Saccharomyces cerevisiae. Mol Cell Proteomics. 6, 439-450 (2007).
- Mellacheruvu, D., et al. The CRAPome: a contaminant repository for affinity purification-mass spectrometry data. Nat Methods. 10, 730-736 (2013).
- Dawson, M. A., Kouzarides, T. Cancer epigenetics: from mechanism to therapy. Cell. 150, 12-27 (2012).
- Jang, M. K., et al. The bromodomain protein Brd4 is a positive regulatory component of P-TEFb and stimulates RNA polymerase II-dependent transcription. Mol Cell. 19, 523-534 (2005).
- Rahman, S., et al. The Brd4 extraterminal domain confers transcription activation independent of pTEFb by recruiting multiple proteins, including NSD3. Mol Cell Biol. 31, 2641-2652 (2011).
- Yang, Z., et al. Recruitment of P-TEFb for stimulation of transcriptional elongation by the bromodomain protein Brd4. Mol Cell. 19, 535-545 (2005).
- Halley, F., et al. A bioluminogenic HDAC activity assay: validation and screening. J Biomol Screen. 16, 1227-1235 (2011).
- Mack, G. S. To selectivity and beyond. Nat Biotechnol. 28, 1259-1266 (2010).
- Daniels, D. L., Urh, M. Isolation of intracellular protein--DNA complexes using HaloCHIP, an antibody-free alternative to chromatin immunoprecipitation. Methods Mol Biol. 977, 111-124 (2013).
- Urh, M., Rosenberg, M. HaloTag a Platform Technology for Protein Analysis. Curr Chem Genomics. 6, 72-78 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır