Method Article
גילוי אינטראקציות חלבון ואפיון תפקוד חלבון באמצעות HaloTag טכנולוגיה
In This Article
Summary
טכנולוגית HaloTag היא טכנולוגיה רב תכליתי שהראתה הצלחה משמעותית בבידוד של קומפלקסי חלבונים קטנים וגדולים מתאי יונקים. כאן אנו מדגישים את היתרונות של טכנולוגיה זו בהשוואה לחלופות קיימות ולהפגין השירות שלה כדי ללמוד היבטים רבים של תפקוד חלבון בתוך תאי אוקריוטים.
Abstract
מחקר בפרוטאומיקה התפוצץ בשנים האחרונות עם התקדמות ביכולות ספקטרומטריית מסה שהביאו לאפיון של מספר רב של proteomes, כוללים אלה מוירוסים, חיידקים ושמרים. לשם השוואה, ניתוח של proteome האדם מפגר, באופן חלקי בשל המספר העצום של חלבונים שחייבים להיחקר, אלא גם את המורכבות של רשתות ואינטראקציות אלה הנוכחיים. במיוחד לענות על האתגרים של הבנת proteome האדם, פיתחנו טכנולוגית HaloTag לבידוד חלבון, חזק במיוחד לבידוד של מתחמי multiprotein ומאפשרים לכידה יעילה יותר של אינטראקציות ו / או חלבונים חלשים או חולפות בשפע נמוך. HaloTag הוא תג מקודד גנטי היתוך חלבון, המיועד לקוולנטיים, ספציפי, וחוסר תנועה או תיוג של חלבונים עם ligands השונים מהירים. מינוף נכסים אלה, יישומים רבים לתאי יונקים פותחו לאופיize תפקוד חלבון וכאן אנו מציגים מתודולוגיות ובם: משיכה מורדת חלבון המשמש לגילוי של אינטראקציות רומן או מבחני תפקודיים, ולוקליזציה הסלולר. אנו מוצאים יתרונות משמעותיים במהירות, הסגוליות, ולכידה קוולנטיים של חלבוני היתוך למשטחים לניתוח proteomic בהשוואה לגישות שאינן קוולנטיים מסורתיות אחרות. אנו מדגימים אלה ושירות הרחב של הטכנולוגיה באמצעות שני חלבונים אפיגנטיים חשובים כדוגמאות, חלבון bromodomain אדם BRD4, וHDAC1 deacetylase היסטון. דוגמאות אלה ממחישות את כוחה של טכנולוגיה זו ובמאפשר הגילוי של אינטראקציות רומן ואפיון לוקליזציה הסלולר באאוקריוטים, אשר תהיה הבנה משותפת נוספת של פרוטאומיקה הפונקציונלית אדם.
Introduction
הבנה של תפקוד תאי, תגובה לגירויים, ושינויים במצבי פיתוח ו / או מחלה קשורה בצורה מורכבת דה פיתול של proteome ברחבי המדינות דינמיות השונות אלה 1,2. נעשה הרבה כדי להבין את proteome של אורגניזמים נמוכים יותר, עם זאת, בהתחשב במספרם של חלבונים ואת כל האינטראקציות אפשריות, זה היה מאוד מאתגר בהתמודדות proteome האדם 1,3-7. התקדמות בספקטרומטריית מסה אפשרה במידה רבה את היכולת לבצע מחקרים אלה, וכאן אנו מציגים התקדמות נוספת ומשמעותית בפיתוח של טכנולוגית HaloTag עבור שתי הלכידה היעילה של קומפלקסי חלבונים ואפיון פונקציונלי של חלבונים אנושיים מתאי יונקים 8-10. לאחרונה טכנולוגיה זו הוכח במספר מחקרים כגורם קריטי לגילוי של אינטראקציות חשובות, המאפשר לתובנה תפקוד חלבון רומן וunderstandiננוגרם של המחלה 11-13.
היתוך חלבון HaloTag פותח בתחילה כדי לטפל בכמה אתגרים של תגי זיקה מסורתיים ונוגדנים קשורים כללכידת חלבון, טיהור, וסימון 8-10. בתוך כמעט כל שיטות ללכידת חלבון וטיהור, יש צעד אינטראקציה שאינה קוולנטיים המשמש להעשרה של חלבון מסוים 14. במהלך שלב זה, החלבון ו / או מורכב יכול לנתק עקב דיפוזיה, במיוחד אם התהליך דורש שעות במקום דקות כדי להשלים. כדי לענות על חשש זה, חלבון ההיתוך תוכנן במיוחד במהירות ובאופן בלתי הפיך לאינטראקציה עם ליגנד שלו, שיכול להיות חלקיקים, משטחים, או fluorophores 9. לכן ברגע שהיא מחויבת ליגנד שלה, היא נשארת קשורה, שהוא אחד מהגורמים המבדילים ביותר בהשוואה לתגי זיקה אחרות. כמו כן הפגין כאן, היא היכולתכדי לענות על שאלות ביולוגיות שונות במבנה אחד, שניתן על ידי לסירוגין ligands 9 (איור 1). לדוגמה, כדי לחקור אינטראקציות חלבון או פונקציה, ligands המשטח משמשים ללכידתו של חלבון או מתחמים (איור 1). בניסוי נפרד, אותו חלבון ההיתוך יכול להיות שכותרתו fluorescently ללמוד לוקליזציה הסלולר, סחר, או מחזור חלבון (איור 1). חשוב לזכור, עם זאת, אחת ליגנד קשור, בין אם מדובר במשטח או fluorophore, זה בלתי הפיך ולכן ligands האחר לא יכול אז להיות מחויב לאחר מכן באותו הניסוי.
ניתוח של טכנולוגיות קיימות למפה אינטראקציות חלבון לחשוף את הקושי לבודד ביעילות אינטראקציות ספציפיות, כוללים אלה שהם יותר חולפים או נמצאים בשפע נמוך 1,6,7,14,15. כמו כן, העבודה האחרונה על ידי קבוצה רבותים מציג את החשש כי בתוך שיטות בידוד מסורתיות, במיוחד בתחום של פרוטאומיקה אדם, יש מספר לא מבוטל של מזהמים חלבון אשר עשוי להסוות אותות מinteractors האמיתי בניתוח ספקטרומטריית מסת 16. התכונות שפותחו עבור חלבון HaloTag והכתובת שלו שיתוף מפותח שרף היטב את החששות האלה. בפרוטוקול לpulldowns המורכב (איור 1), כריכה של קומפלקסים יכול להיות מושגת ב15 דקות, שני קידום הלכידה מורכב והפחתת רמות של הלא ספציפי מחייב 8. בנוסף לכך, באופן בלתי הפיך מחייבים מאפשר ללכידה יעילה של חלבוני שפע נמוכים ומאפשר שימוש בהרבה פחות תאים, שוב הפחתת רקע 8. ברגע לכידתו של מתחמים היא הוקמה, הפרוטוקול כולל תנאים לשטוף קלים כדי לשמור על שלמות מורכבת. Elution של מתחמים שנתפסו יכול להתבצע על ידי שתי שיטות ובחירה באיזו שיטה מוכתבת על ידי המטרה של אנאלי במורד הזרםיסיס. אם הרצון הוא לנתח או לגלות חלבוני אינטראקציה על ידי כתם מערבי או ספקטרומטריית מסה, אז מומלץ לelute מתחמים עם denaturants כגון SDS או אוריאה (איור 1). זהו יתרון במיוחד עבור ספקטרומטריית מסה כמו החלבון התמזגו במקור כדי HaloTag, כינה חלבון הפיתיון, יישאר מאחורי הכבול לשרף ולכן לא שולט באוכלוסייה של פפטידים זוהו בספקטרומטריית המסה. זה גם אומר, עם זאת, את חלבון הפיתיון סביר להניח שלא יהיה גלוי בניתוח על ידי כתם מערבי, הבדל משמעותי בהשוואה לpurifications אחרת שאינו קוולנטיים זיקה או שיתוף immunoprecipitations. אם המטרה היא לטהר את מתחם בשלמותה כדי לשמש למחקרים פונקציונליים, elution יכול להתבצע באמצעות פרוטאז TEV (וירוס Etch טבק), אשר מכיר רצף המחשוף מאותו המקור שלה מקודד בין חלבון ההיתוך וחלבון הפיתיון (איור 1). Tדגימות hese גם יכולים להיות מנותחות על ידי ספקטרומטריית מסה, אבל כפי שהראה מאוחר יותר, הם מכילים כמות משמעותית של חלבון פיתיון של שעלולה למנוע זיהוי של שפע נמוך יותר, interactors הספציפי.
כאן אנו מציגים פרוטוקולי הנפתח והדמיה מיושמים על שני חלבונים טיפוליים חשובים, חלבון bromodomain BRD4 וdeacetylase היסטון, HDAC1 17. הראנו בדוגמאות אלה, אינטראקציה עם שותפים צפויים כפי שנקבע על ידי ספקטרומטריית מסה, פעילות אנזימטית לאחר בידוד מורכב עבור HDAC1, ולוקליזציה הסלולר ראויה לשניהם. יחד, תוצאות אלו ממחישות את האופי וכוח רב תכליתיים של הטכנולוגיה לאפיון של אינטראקציות חלבון אוקריוטים ותפקוד.
Protocol
הערה: הפרוטוקול הבא יכול לשמש עם כל היתוך HaloTag ובשורת תאים כל בחירה ביציבות או transiently transfected. לדוגמאות אלה, אנו נותנים לי פרוטוקולים לtransfection חולף של התכה HaloTag בתאי HEK293T או הלה. לכל הניסויים, אנו ממליצים על שימוש בשליטה רק החלבון.
בדיקת ביטוי חלבון היתוך 1.
- השג מבנה חלבון היתוך:
- השג וקטור היתוך HaloTag שהוכן מראש, או לבנות באמצעות וקטורים קיימים. לקבלת מידע נוסף על מבנים זמינים, אנא ראה טבלה של חומרים כימיים מסוימים.
- אם מה שהופך את כל שיבוט, מומלץ לרצף לאמת את ה-DNA.
- בדיקת ביטוי חלבון היתוך ושליטה:
- עבור כל דגימה, להכין 250 μl של חיץ טעינת צבע 1X SDS (60 מ"מ טריס-HCL pH6.8, 0.75 מ"מ bromophenol, גליצרול הכחול 12.5%, 100 dithiothreitol מ"מ, 0.5% SDS).
- עבור כל חלבון היתוךובקרה, צלחת 0.5 מיליליטר של HEK293T או תאי הלה בתקשורת המתאימה בצפיפות של 2-4 x 10 5 תאים / מיליליטר בצלחת גם סטנדרטית 24.
- דגירה של 18-24 שעות ב 37 ° C ו 5% CO 2, ולאחר מכן transfect כמומלץ.
- 24 שעות שלאחר transfection, להוסיף 0.5 μl של rhodamine טטרה התיל 5mm ליגנד (ת.מ. ר) לתקשורת של כל טוב ולערבב בעדינות צלחת.
- דגירה תאי transfected המכילים ליגנד ל15 דקות ב 37 ° C ו 5% CO 2.
- את התקשורת לשאוב המכילה ליגנד ולשטוף היטב בכל תאים בעדינות עם 1 מיליליטר RT-PBS.
- לשאוב את PBS ולבצע שטיפה שנייה עם 1 מיליליטר RT-PBS.
- הסר PBS ולהוסיף 200 μl של 1X SDS טוען חיץ לצבוע ישירות לתאים.
- lysate פיפטה מצלחת לתוך 1.5 מיליליטר צינור Eppendorf.
- מרתיחים lysate 5 דקות ב95 ° C.
- הסר 5-10 μl של התגובה ועומס על ג'ל SDS-PAGE.
- השתמש בסורק זיהוי ניאון(עירור TMR: 555 ננומטר, פליטה: 585 ננומטר) כדי לאתר להקות. השתמש בסמני חלבון פלואורסצנטי כסטנדרטים.
- אם סורק זיהוי ניאון אינו זמין, לבצע כתמים מערביים באמצעות נוגדנים נגד או חלבון הפיתיון או תג היתוך חלבון כדי לזהות ביטוי של חלבון ההיתוך.
2. Pulldowns החלבון
- הכנת תאי transfected transiently:
- עבור כל היתוך או שליטה להכין את מאכל 15 סנטימטר אחד עם 30 מיליליטר של תאים ב3-4 x 10 5 תאים / מיליליטר או 1-1.2 x 10 7 תאים הכולל לכל מבנה.
- דגירה של 18-24 שעות ב 37 ° C ו 5% CO 2, ולאחר מכן transfect לבנות כפי שהומלץ.
- לאחר 24-48 לאחר transfection שעה, להסיר את המדיה ולשטוף בעדינות את שכבת התאים עם 20-25 מיליליטר של PBS הקר כקרח.
- הסר לשטוף PBS, ולאחר מכן להוסיף 25-30 מיליליטר של 4 מעלות צלזיוס מקורר PBS ועדינות לגרד תאים מהצלחת.
- איסוף תאים לתוך צינורות וcentri חרוטיFUGE ל5-10 דקות XG ב 2000 ו4 ° C.
- בטל supernatant ולמקם את התא גלולה ב -80 מעלות צלזיוס למשך התקופה מינימאלית של 30 דקות או מקסימום של 6 חודשים.
- איזון של שרף HaloLink:
- עבור כל דגימת היתוך או שליטה, להכין 12 מיליליטר של חיץ שרף איזון / לשטוף (100 מ"מ טריס-HCl pH 7.5, 150 mM NaCl, ו0.005% IGEPAL CA-630) הערה:. זה מאוד חשוב לעשות ולהשתמש בשרף איזון הצפת בתוך 12 שעות בדילול IGEPAL CA-630 אינה יציבה או אפקטיבית מעבר למסגרת זמן זו.
- נער בעדינות או לערבב את השרף לקבל השעיה אחידה.
- עבור כל ניסוי הנפתח, לוותר 200 μl של שרף ל1.5 מיליליטר microcentrifuge צינורות.
- צנטריפוגה 1 דקות בXG 800 (למשל, 3,000 סל"ד בmicrocentrifuge), ולאחר מכן להסיר בזהירות וזורקים supernatant (אתנול) מבלי להפריע לשרף בחלק התחתון של הצינור.
- הוספת 800 μl של שרף איזון / ווהsh חיץ ומערבבים היטב על ידי צינור היפוך כמה פעמים.
- צנטריפוגה במשך 2 דקות ב800 XG, ולאחר מכן להסיר בזהירות וזורקים supernatant.
- חזור על השלבים 2.2.5 ו 2.2.6 עוד פעמיים עבור סכום כולל של 3 שוטף.
- אל תסיר את הכביסה או supernatant הסופיים עד מוכן להוסיף lysates הסלולרי המתואר להלן (שלב 2.3.8) כדי למנוע את השרף מהתייבשות.
- עקידת ושטיפה של קומפלקסי היתוך:
- עבור כל דגימה, להכין 500 μl של יונקי תמוגה חוצץ (50 מ"מ טריס-HCl pH 7.5, 150 mM NaCl, 1% טריטון X-100, 0.1% Deoxycholate Na) ו1 מיליליטר של חיץ 1X TBS (100 מ"מ טריס-HCl pH 7.5 ו150 mM NaCl).
- להפשיר את כדורי התא וresuspend ב 300 μl של יונקי תמוגה הצפת על ידי pipetting למעלה ולמטה או בקצרה vortexing.
- הוסף 6 μl של קוקטייל 50X מעכבי פרוטאז (800 מיקרוגרם / מיליליטר benzamidine HCl, 500 מיקרוגרם / מיליליטר phenanthroline, 500 מיקרוגרם / מיליליטר aprotinin, 500 מיקרוגרם / מיליליטר leupeptin, # & 500. 181; גר '/ מיליליטר pepstatin, 50mm PMSF) הערה: קוקטיילים פרוטאז הכוללים AEBSF לא ניתן להשתמש כמו אלה להפריע לתג היתוך חלבון מחייב.
- הוסף 3 DNase RQ1 μl ולהפוך ל10 דקות ב RT.
- Dounce עם homogenizer זכוכית 2.0 מיליליטר גודל; . 25-30 משיכות על קרח, או להעביר את התאים דרך 25 או 27 מחט G 5-10 פעמים כדי להשלים תמוגה הערה: Sonication אינו מומלץ כמתחמים עלולים להתפרק ועל החימום עשוי להשפיע על פעילות תג היתוך חלבון.
- צנטריפוגה ב XG 14,000 במשך 5 דקות ב 4 ° C כדי לנקות את lysate.
- העבר את lysate ברור, כ 300 נפח כולל μl, לצינור ומקום חדשים על קרח.
- הוסף ללנקות lysate 700 μl נוסף של חיץ 1X TBS ומערבבים היטב על ידי pipetting למעלה ולמטה.
- קח את צינורות שרף equilibrated מוכנים בשלב 2.2.8 ולהסיר לשטוף / supernatant סופי משרף מבלי להפריע לשרף בחלק התחתון של הצינור.
- הוסף לכל tuלהיות של שרף, 1 מיליליטר של lysate בדילול מלא.
- דגירה עם ערבוב על הכתף צינור (או מיקסר עדין) במשך 15 דקות בהערת 22 ° C.: התייצבות של שרף בתקופה זו מפחיתה את יעילות מחייבת. אם מחייב על 4 מעלות צלזיוס הוא רצוי, לעשות זאת על ידי ערבוב במשך שעה 1.
- צינורות שרף צנטריפוגות במשך 2 דקות על XG 800 וזורקים supernatant.
- הוסף 1 מיליליטר של חיץ שרף איזון / לשטוף נעשה בשלב 2.2.1 ומערבבים היטב על ידי צינור היפוך השרף ביד כמה פעמים.
- צינורות שרף צנטריפוגות במשך 2 דקות על XG 800 וזורקים את הכביסה.
- חזור על צעדים 2.3.12 אחרי 2.3.14 שלוש פעמים נוספות.
- הוסף 1 מיליליטר של חיץ שרף איזון / לשטוף ולדגור על 22 מעלות צלזיוס למשך 5 דקות עם רוטציה קבועה.
- צינורות שרף צנטריפוגות במשך 2 דקות על XG 800 וזורקים את הכביסה.
- בהתאם ליישום הסוף (ראה מבוא להסבר נוסף), או להמשיך לסעיף 2.4 או 2.5.
- Selution DS לג'לי denaturing, כתמים מערביים, או ספקטרומטריית מסה:
- Resuspend השרף מכל מדגם ב50 חיץ SDS Elution μl (SDS 1% ו50 מ"מ טריס-HCl pH7.5)
- Shake צינורות על RT במשך 30 דקות.
- צנטריפוגה במשך 2 דקות ב800 eluates XG ולהעביר צינורות טריים לניתוח.
- עבור כתם מערבי או ג'ל כתם כסף, עומס 5-10 μl על ג'ל denaturing SDS.
- לספקטרומטריית מסה, לחסוך 40 μl של כל דגימה ב -20 ° C.
- elution TEV פרוטאז עבור מבחני פונקציונליים, כתמים מערביים, או ספקטרומטריית מסה:
- לאחר הסרת לשטוף האחרון, resuspend השרף ב50 חיץ μl ProTEV מחשוף ו30 יחידות של אנזים TEV.
- לדגור על 25 ° C עם רעד במשך שעה 1.
- צנטריפוגה במשך 2 דקות ב800 x גרם.
- העבר את eluate לצינורות טריים.
- מדגם חנות ב 4 מעלות צלזיוס לשימוש מיידי במבחנים תפקודיים.
3.הדמיה נייד של fluorescently שחלבוני Fusion מדביק לו תווית שימוש cytoplasmic והגרעיני חדיר ליגנד
- Transfect, תווית, ותאי תמונה:
- בcoverglass 8 תאיים גם עבור כל חלבון היתוך או שליטה, צלחת 400 μl של תאי הלה בתקשורת המתאימה שלהם בכל טוב בצפיפות של 1-2 x 10 5 תאים / מיליליטר.
- דגירה של 18-24 שעות ב 37 ° C ו 5% CO 2, ולאחר מכן transfect כמומלץ.
- 18-24 שעות שלאחר transfection, לדלל יגנד TMR 1:200 בתקשורת סלולרית המתאימה, ולאחר מכן להוסיף בפתרון זה 100 μl היטב כל אחד ולערבב בעדינות.
- דגירה תאי transfected המכילים ליגנד ל15 דקות ב 37 ° C ו 5% CO 2.
- את תקשורת לשאוב המכילה ליגנד ולהחליף עם 500 μl של המדיה המתאימה חסרי יגנד תג היתוך חלבון, אשר כבר מראש לחמם 37 ° C.
- חזור פעמיים עבור סכום כולל של שלושה שוטף.
- שים את התאים בחזרה לתוך חממה (376; CO C ו 5% 2) ל30 דקות.
- תקשורת לשאוב את ולהחליף עם 500 μl של המדיה מתאימה, אשר כבר מראש לחמם 37 ° C.
- תמונה במיקרוסקופ באמצעות פרמטרים רכישה מתאימים (עירור TMR: 555 ננומטר, פליטה: 585 ננומטר).
תוצאות
כאשר עובדים עם כל חלבון היתוך חדש, חשוב למבחן הראשון לביטוי של חלבון שלאחר transfection וגם לאמת כי חלבון של המשקל המולקולרי הראוי הוא להיות מיוצר. כחלבוני היתוך HaloTag יכולים להיות fluorescently וכותרתו קוולנטית עם ligands החדיר או בהתאם ללוקליזציה, בלתי חדיר, זה אפשרי לקבוע ביטוי במהירות על ידי יישום lysates הסלולרי לdenaturing ג'ל אלקטרופורזה ואחרי הסריקה בfluorimager. באמצעות הפרוטוקול המתואר בסעיף 1.2, ביטוי של Halo-BRD4 (189 KD) ושליטת HaloTag לבד (Ctrl) הוא ציין (34 KD, איור 2 א). כפי שצוין בפרוטוקול, הביטוי של חלבוני איחוי יכול גם להתגלות באמצעות כתמים מערביים מסורתיים עם נוגדנים נגד HaloTag, או אם הם זמינים, נוגדנים לחלבון הפיתיון. במידת האפשר, מומלץ להשתמש בליגנד הניאון במקום כפי שהוא יותר ספציפי, מהיר יותר, וקל יותר tאיתור האן נוגדנים, וגם כמותית 10.
לאחר הביטוי של חלבון ההיתוך באורך מלא, הנכון מאומת, ניתן לבצע pulldowns החלבון. שמוצג באיור 2 הם ג'לים המוכתם הכסף של משכפל ביולוגי של pulldowns Halo-BRD4 וCtrl eluted ידי SDS (פרוטוקול סעיף 2.4) המדגים שחזור גבוה. ג'לים כתם הכסף להראות מספר משמעותי של חלבונים נמצאים באינטראקציה עם חלבון BRD4 ורקע נמוך מאוד בשליטה (איור 2). כפי שהוזכר במבוא, בתהליך זה של elution, Halo-BRD4 לא eluted מהשרף כפי שהוא נשאר קשור קוולנטית. לכן, יש לא להקה משמעותית במשקל מולקולרי זה שיראו בכתם הכסף (איור 2) או כתם מערבי (מידע לא מוצג). כדי לקבוע אם חלבונים אלה הם ספציפיים לBRD4, ספקטרומטריית מסה נוזלית כרומטוגרפיה (LC-MS/MS) בוצעה על גתערובת omplex מתקבלת לאחר elution SDS. שמוצגים באיור 2C הם ספירות רפאים וגורם שפע רפאים מנורמלים ערכים (NSAF) לinteractors הידוע של BRD4 18-20 נמצא בניתוח ספקטרומטריית מסת Halo-BRD4. השפע הגבוה של רכיבים מpTEFb 18,20 וגם החלבון BRD9 19 לאשר לכידה ספציפית של מתחמי BRD4. כצפוי על ידי ג'לים כתם הכסף (איור 2), חלבונים רבים אחרים זוהו גם כinteractors פוטנציאל של BRD4 שלא נצפו בשליטה (מידע לא מוצג). כמו אלה הם לא היו ידועים קודם, הם צריכים להיות באופן עצמאי על ידי שיטות אחרות כדי לאשר אם החלבון הוא interactor נכון, ואם כן, אם הוא ישיר או עקיף הקשורים BRD4.
מתחמים מבודדים גם ניתן ללמוד על פעילות; הוא ממליץ לelute מתחמים באמצעות פרוטאז TEV (פרוטוקול סעיף 2.5), כך שהם שומרים על functionality. באיור 3 א, ג 'כתם כסף של מתחמים הנפתח Halo-HDAC1 שוחררו מהשרף באמצעות פרוטאז TEV מוצג. כפרוטאז TEV יהיה לדבוק באזור מקשר בין תג היתוך חלבון ושותף ההיתוך שלו, כמויות משמעותיות של חלבון הפיתיון, במקרה זה HDAC1, הם נצפו (איור 3 א). כדי לקבוע אם חלק קטן הזה הכיל פעילות HDAC1, דגימות TEV eluted נבדקו בassay HDAC זורח, HDAC-Glo 21. כפי שניתן לראות באיור 3 ב, דגימות הנפתח HDAC1 הראו רמות גבוהות של פעילות HDAC1 (טור 1), שהיה עצור באופן ספציפי על ידי מעכב ידוע HDAC, סח"ה 22 (טור 2). כבקרות כדי להדגים סגוליות נוספות, אין עיכוב HDAC נצפה עם מעכבי קשורים הסירטואינים משפחה, EX-527 22 (טור 3) ואין אות זוהתה באמצעות חיץ לבד בלי מדגם הנפתח HDAC1 הוסיף (טור 4).
מרכיב משמעותי בתפקודפרוטאומיקה אל ומתחמי הבנה, גם הבנת לוקליזציה חלבון ו / או סחר בנשים. כפי שניתן שכותרתו מבנים אותו היתוך אלה fluorescently בתוך תאים, אנחנו במעקב הלוקליזציה שלהם באמצעות ההדמיה confocal. בעקבות הפרוטוקול בסעיף 3, תאי הלה transiently transfected עם Halo-BRD4 (איור 4 א) וHalo-HDAC1 (איור 4) שכותרתו fluorescently עם יגנד TMR וצלמו. כפי שניתן לראות באיורי 4 א ו -4 ב, שתי נקודתיים לגרעין כצפוי 17. נתונים אלה מראים כי הנוכחות של תג לא שינתה לוקליזציה הסלולר פיזיולוגית של שותפי ההיתוך שלה.

איור 1. סכמטי של הנפתח חלבון ויישומי הדמיה confocal. שימוש כ ingle לבנות מספר יישומים להבנת תפקוד חלבונים בתאי יונקים הם אפשריים. לכל, לבנות היתוך Halo הוא גם ביציבות או transiently לידי ביטוי בתאי יונקים חסיד או השעיה. לpulldowns המורכב חלבון, תאים אז lysed, מתחמים נלכדים קוולנטית על שרף, וeluted או דרך elution SDS (מסלול שמאלי) או מחשוף TEV (מסלול מימין). elution SDS מומלץ לימשיך לניתוח ספקטרומטריית מסה, בעוד שמחשוף TEV הוא אופטימלי לביצוע ניתוח פונקציונלי. כדי לאפיין ביטוי, לוקליזציה הסלולר, אירועי סחר, או מחזור חלבון, תאי חיים המבטאים חלבוני היתוך שכותרתו fluorescently וניתחו נוסף על ג'לי עמוד SDS או באמצעות ההדמיה confocal. שני ligands הניאון החדיר או חדיר התאים זמינים בהתאם ללוקליזציה או המצגת של חלבון ההיתוך בתוך התא.
igure 2 "עבור: תוכן width =" 6in "src =" / files/ftp_upload/51553/51553fig2highres.jpg "width =" 600 "/>
איור 2. ביטוי Halo-BRD4 חלבון, הנפתח, וניתוח ספקטרומטריית מסה. ג'לי () SDS עמוד המציג את ביטוי חלבון Halo-BRD4 היתוך, 189 KD, ותג היתוך חלבון Halo לבד, 34 KD, בקרה (Ctrl) של בתוך lysate הסלולרי HEK293T שכותרתו עם ליגנד ת.מ. ר (פרוטוקול סעיף 2.1). ג'לים נסרק עם fluorimager לגילוי וסמן משקל מולקולרי ניאון היה בשימוש. (B) ג'לי כתם כסף של משכפל ביולוגי לpulldowns של דגימות Halo-BRD4 וCtrl eluted עם SDS. גדלי משקל מולקולריים מצוינים לג'ל. (ג) ספירת ספקטרלי (פנל משמאל) וגורמים מנורמלים רפאים שפע ערכים (NSAF) (פנל מימין) המהווים חלבון משקל מולקולרי של חלבונים שזוהו בניתוח ספקטרומטריית מסה של משכפל ביולוגי של Halo- BRD4 ו-Ctrl. מוצגים הם חלבונים ידועים האינטראקציה wה-i BRD4, כולל רכיבים של pTEFb (CDK9 וCyclin T) 18,20, כמו גם BRD9 19. אין פפטידים מחלבונים אלה זוהו בCtrl.

איור 3. בידוד Halo-HDAC1 מורכב וניתוח פעילות. () ג'לי כתם כסף מראה את הבידוד של מתחמי Halo-HDAC1 ורקע מCtrl לאחר מחשוף TEV (פרוטוקול סעיף 2.5). הלהקה הבולטת HDAC1 (55 KDA) ולהקת פרוטאז TEV מסומנות. HDAC1 החופשי מופקת על ידי מחשוף TEV בתוך מקשר אופטימיזציה בין רצף היתוך HaloTag וHDAC1 לאחר לכידה על השרף (איור 1). (B) גרף המציג את הפעילות של דגימות בידודים מורכבים HDAC1 בassay זורח deacetylase היסטון, HDAC- Glo 21. עמודה 1 של הגרף מראה גבוה ליטרevels פעילות HDAC הכיל עם דגימות Halo-HDAC1 הנפתח (HDAC1). עמודה 2 מגלה פעילות זו יכולה להיות ירידה באופן ספציפי על ידי תוספת של מעכבי HDAC, סח"ה 22, לדגימות הנפתח HDAC1. כשולט, טור 3 מדגים מעכב deacetylase ספציפי למשפחת הסירטואינים, אבל לא HDACs, EX-527 22, לא לעכב את פעילות HDAC1 וטור 4 מראה שום פעילות הוא ציין באמצעות חיץ לבד.
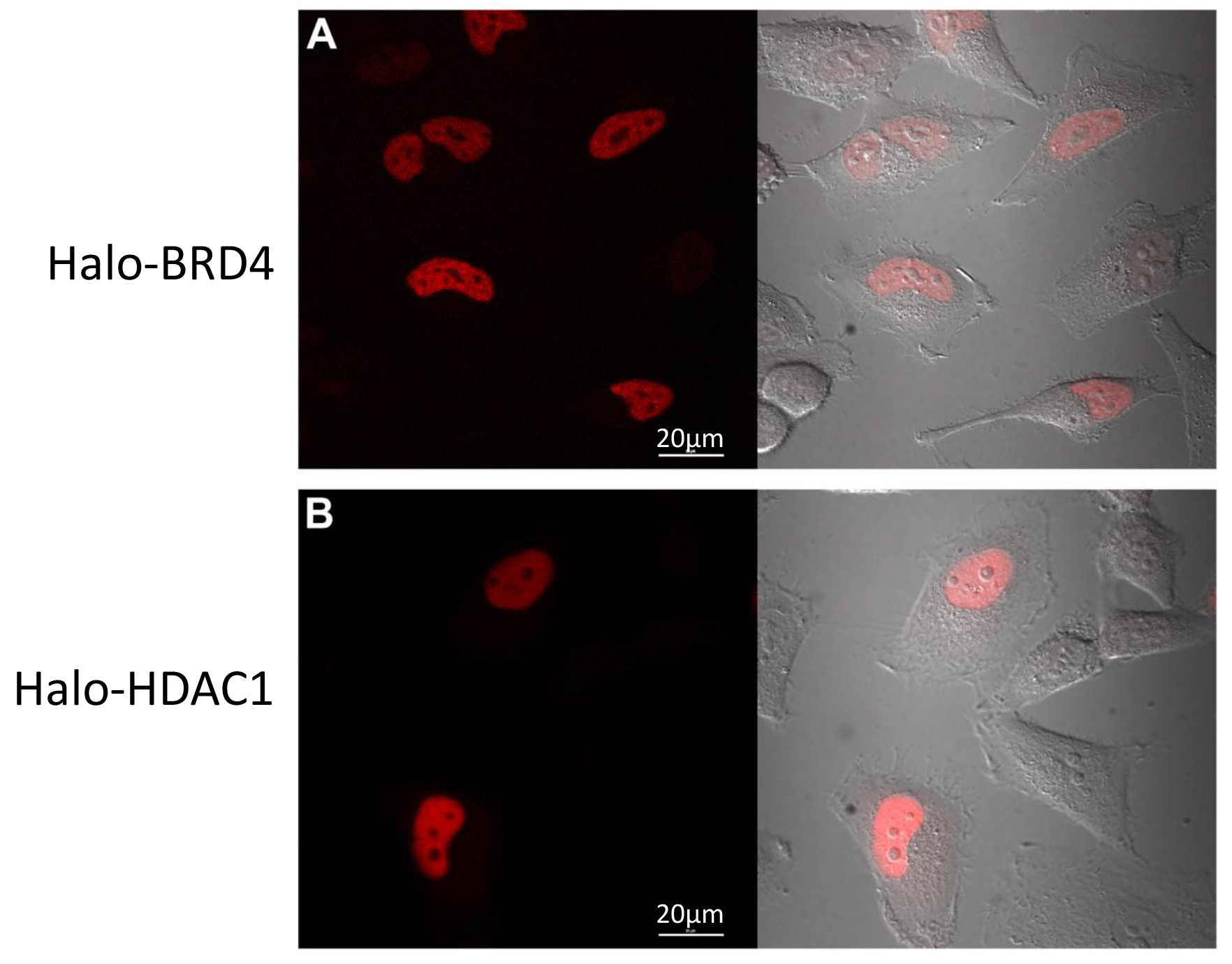
איור 4. Halo-BRD4 וHalo-HDAC1 הדמיה confocal. חי confocal הדמיה תא של תאי הלה transfected עם Halo-BRD4 (א) או Halo-HDAC1 (ב ') שכותרתו fluorescently עם יגנד TMR. () ביטוי Halo-BRD4 מוגבל לגרעין ו( ב ') ביטוי Halo-HDAC1 הוא בעיקר nucליר. צד שמאלי של לוחות הוא ערוץ ניאון וצד ימין הוא כיסוי של ערוץ הניאון עם ערוץ דסק"ש עבור כל אחד. תמונות נרכשו על מיקרוסקופ confocal מצויד ב+ CO 2 תא סביבתי 37 מעלות צלזיוס באמצעות מערכות סינון מתאימות. ברים סולם = 20 מיקרומטר.
Discussion
מוצגים כאן הם שני חלבוני איחוי, Halo-BRD4 וHalo-HDAC1, מאופיין בתאי יונקים אוקריוטים לביטוי, בידוד החלבון מורכב ופעילות, ולוקליזציה הסלולר. בעבודה באמצעות אלה פרוטוקולים שונים, ישנם מספר צעדים חשובים להצלחתו של כל ניסוי. כמו במקרה עם כל חלבון היתוך, רמת ביטוי ומיקום של התג עצמו יכול להיות קריטי לשמירה על פיזיולוגיה. לכן חשוב להביא בחשבון כי N-ו / או שילובים בטרמינל C-יצטרכו להיות מתוכנן אם ידע מוקדם או לעבוד עם תג אחר לא הודגם לחלבון המסוים של בחירה. בנוגע לביטוי, אם הרמה היא גבוהה מדי, דילול של ה-DNA יכול להתבצע במהלך transfection או שימוש בוקטורים עם מקדמים חלשים יותר הם אפשריים כדי להשיג את הרמה מתאימה. עבודות קודמות שבוצעה מראים בידוד יעיל של קומפלקסי macromolecular באנדוגני leVels ביטוי 8, מה שמאפשר עבודה ברמות נמוכות מאוד של ביטוי. במידת האפשר, את לימודי לוקליזציה הסלולר יהיו מסוגלים לספק תובנה לגבי המיקום האופטימלי תג המיקום כמו גם ברמת ביטוי היחסית הנחוץ לפיזיולוגיה נכונה גם.
ברגע שחלבוני ההיתוך מוכנים לניסויים הנפתחים, כדי להשיג הצלחה מקסימלית עם הפרוטוקול זה הוא חשוב מאוד לעקוב מסגרות הזמן המומלצת בתמוגה, מחייב, וחתכים כביסה, כאחד מהיתרונות הגדולים ביותר היא המהירות של הבידוד המורכב תהליך. אם כל אחד מהצעדים הללו התארכו בזמן, כגון נדרש לשיטת לכידה המבוסס על נוגדנים, קיים סיכון של התנערות מורכבת או שאינו ספציפי מוגברים מחייבים 8. באופן דומה, אם הפעמים הם קיצרו במהלך תמוגה הסלולרית או מחייב, תאים לא יכולים להיות lysed לחלוטין או ביעילות נתפסו בהתאמה. אם המספר של שוטף הוא decrקל או ערבוב טוב של השרף אינו מתרחש במהלך שוטף מחייב, או, אז רמות רקע של חלבונים שאינם ספציפיים תוגדל. כמו כן, אמצעי תמוגה חשוב מאוד כקשור ליעילות מחייב את השרף. ניסיונות sonicate הדגימות, להסיר את חומר הניקוי המומלץ, להוסיף SDS או חומר ניקוי חזק אחר, ו / או לכלול AEBSF מעכבי פרוטאז יגרמו מופחת או אובדן של קשירה של חלבוני היתוך והמתחמים שלהם לשרף.
שיטות קיימות לבידוד מורכב מתאי יונקים ומאבק ניתוח proteomic אדם עם האתגר של הפחתת רקע בניתוח על ידי ספקטרומטריית מסת 16. זה לא היה כל כך משמעותי, כי מאגר של חלבונים מזהמים נוצר על ידי קבוצות ספקטרומטריית מסה רבות 16. רקע בדגימות הנפתח ספקטרומטריית מסה יכול להיות מוגדר כדבר המונע זיהוי שלinteractors האמיתי של חלבון הפיתיון. ככזה, רקע יכול לנבוע מזיהום חלבונים שאינם ספציפיים או גם ריכוזים גדולים חלבון פיתיון או נוגדנים המשמשים כדי לזרז חלבוני פיתיון של. עבודה משמעותית שנעשתה באופטימיזציה של שני פרוטוקול הנפתח המוצג כאן, כמו גם את השרף כדי למזער את רמת החלבונים מזהמים שאינם ספציפיים בתהליך הנפתח. זה בא לידי ביטוי בג'לים כתם הכסף וניתוח ספקטרומטריית מסה של השליטה (איור 2). כדי להתמודד עם הרמות גבוהות של חלבון פיתיון או נוגדנים שיכולים להיות באותה מידה מזיקה כמזהמים ובי מתודולוגיות אחרות מאבק של, הנפתח עם elution SDS מומלץ (פרוטוקול סעיף 2.4). בשל הקובץ המצורף קוולנטיים לשרף, תהליך זה ישאיר את רוב חלבון היתוך ההתחלה קוולנטית המצורפת לשרף. אחוז קטן של פיתיון הוא ציין בניתוח ספקטרומטריית המסה, שהוא האמיןלהתרחש באמצעות הידרוליזה, אבל זה לא מהווה בעיה לזיהוי של אינטראקציות חלשות או ארעיות אחרות 8.
כפי שהוזכר במבוא, התקדמות משמעותית בפרוטאומיקה כבר מופעלת על ידי התקדמות משמעותית ב1,7 ספקטרומטריית מסה. לכן, חשוב להדגיש פרמטרים חשובים של הבחירה של ניתוח ספקטרומטריית מסה לdeconvolute התערובת של חלבונים שהתקבלו בpulldowns. מכשור חייב להיות חזק ומסוגל באופן שיגרתי וביעילות ניתוח דגימות המכילות כמות קטנה של חלבון, לעתים קרובות פחות מ <1 מיקרוגרם. כרומטוגרפיה ננו מעורבת 50-75 מיקרומטר עמודות HPLC הקוטר פנימיות עם ספיקות בטווח NL / min 100-300 מועסקת בדרך כלל לתאימות עם גודל המדגם הקטן ועל מנת למקסם את הרגישות של ספקטרומטר המסה. על מנת למקסם את המידע שנרכש במדינת o ניתוח יחידו ספקטרומטר מסות אמנות מסוגלת לרכוש ספקטרום המוני ברזולוציה גבוהה בזמן בקנה מידה תואמת עם הפרדות ננו האמורות, ≥ 10 הרץ, הם מועסקים בדרך כלל. יש מכשירים אלו רמות attomolar של רגישות ויכולים לרכוש באופן שגרתי הנתונים עם מבשר עמודים לדקה משנה וטולרנסים שגיאה המונית יון המוצר. מאפייני ביצועים אלו משמשים כדי להגדיל את התשואה של מספר החלבונים שזוהו ואת הביטחון הקשורים להזדהויות אלה.
עם נתונים אלה אנו מדגימים לוקליזציה פיזיולוגית סלולרית, חלבון נאות: אינטראקציות חלבון יחד עם פוטנציאל לגילוי של אינטראקציות רומן, ובידוד של מתחמים פעילים כל שימוש במבנה אחד. טכנולוגיות חלופיות ואכן ניתן להשתמש בם לכל אחד מההיבטים השונים הללו, אבל כנראה לא לכל 23,24. בעזרת טכנולוגית HaloTag, ניתן להשתמש בגישה רב תכליתי, קידום proteomמחקרי ics והשגת הבנה של תפקוד חלבון בתאי יונקים שלמה יותר.
Disclosures
עמלות פרסום לכתבה זו ממומנות על ידי חברת Promega. Danette L. דניאלס, ג'קי מנדס, הלן Benink, אנדרו ניילס, ננסי מרפי וMarjeta Urh הם עובדי תאגיד Promega, הבעלים המסחריים על ידי הקצאה של פטנטים של טכנולוגית HaloTag והיישומים שלה. מייקל פורד, ריצ'רד ג'ונס, ראווי Amunugama, ודיוויד אלן הם עובדי MSBioworks, המספק שירותי ספקטרומטריית מסה מתוארים בכתב היד הזה.
Acknowledgements
אנו מודים לד"ר מרטין רוזנברג, ד"ר גארי Tarpley, ד"ר קית' עץ לתמיכה על עבודה זו, וד"ר ג'יימס קאלי לקריאה ביקורתית של כתב היד. DLD, JM, HB, NM,, JC, וMU הם עובדי תאגיד Promega. MF, RJ, דלקת מפרקים שגרונית, והתובע הנן עובדים של MS Bioworks, LLC.
Materials
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | CCL-2 | Adherent |
| HEK293T Cells | ATCC | CRL-11268 | Adherent |
| Cellular growth media | Invitrogen/Gibco | ||
| PBS - tissue culture certified | Invitrogen/Gibco | ||
| FuGENE HD Transfection Reagent | Promega | E2311 | |
| HaloTag Control Vector | Promega | G6591 | |
| HaloTag-BRD4 | Kazusa DNA Research Institute | FHC11882 | N-terminal HaloTag fusion |
| HaloTag-HDAC1 | Kazusa DNA Research Institute | FHC02563 | N-terminal HaloTag fusion |
| HaloTag Clones containing content | Promega | Various | http://www.promega.com/FindMyGene/ |
| HaloTag Flexi Vectors for cloning (N- or C-terminal) | Promega | Various | Choose based upon expression level and HaloTag orientation |
| HaloTag TMR Ligand | Promega | G8251 | |
| IGEPAL CA-630 | Sigma | 18896 | |
| HaloTag Mammalian Pull-Down and Labelling System | Promega | G6500 | Contains HaloTag TMR ligand |
| HaloTag Mammalian Pull-Down System | Promega | G6504 | |
| Protease Inhibitor Cocktail, 50X | Promega | G6521 | |
| Mammalian Lysis Buffer | Promega | G9381 | |
| HaloTag Monoclonal Antibody | Promega | G9211 | |
| ProTEV Plus | Promega | V6101 | |
| RQ1 Dnase | Promega | M6101 | |
| HaloLink Resin | Promega | G1912 | |
| HDAC-Glo | Promega | G6420 | |
| PBS + 0.1% Triton X-100 | For optional imaging | ||
| 4% paraformaldehyde/0.2 M sucrose/PBS | For optional imaging | ||
| Ethanol | |||
| Tissue culture vessels and dishes | |||
| Cell culture incubator | |||
| Disposable cell lifter | Thermo Fisher Scientific | 08-773-1 | |
| Glass homogenizer such as Kontes Dounce Tissue Grinder | Thermo Fisher Scientific | K885300-0002 | 25-27 G needle could also be used |
| Microcentrifuge | |||
| Tube rotator such as Labquake | Thermo Fisher Scientific | 4002110Q | Ideal for binding and washing steps |
| Shaking platform such as Eppendorf Thermomixer | Thermo Fisher Scientific | 05-400-200 | Ideal for SDS elution and TEV cleavage steps |
| Chambered cover glass | Thermo Fisher Scientific | 155409 | For optional imaging |
| Fluorescent Microscrope (555 nm Ex/585 nm Em) | For optional imaging |
References
- Altelaar, A. F., Munoz, J., Heck, A. J. Next-generation proteomics: towards an integrative view of proteome dynamics. Nat Rev Genet. 14, 35-48 (2013).
- Tyers, M., Mann, M. From genomics to proteomics. Nature. 422, 193-197 (2003).
- Coulombe, B., et al. Interaction networks of the molecular machines that decode, replicate, and maintain the integrity of the human genome. Mol Cell Proteomics. 3, 851-856 (2004).
- Gavin, A. C., et al. Proteome survey reveals modularity of the yeast cell machinery. Nature. 440, 631-636 (2006).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Sardiu, M. E., et al. Probabilistic assembly of human protein interaction networks from label-free quantitative proteomics. Proc Natl Acad Sci U S A. 105, 1454-1459 (2008).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312, 212-217 (2006).
- Daniels, D. L., et al. Examining the complexity of human RNA polymerase complexes using HaloTag technology coupled to label free quantitative proteomics. J Proteome Res. 11, 564-575 (2012).
- Encell, L. P., et al. Development of a dehalogenase-based protein fusion tag capable of rapid, selective and covalent attachment to customizable ligands. Curr Chem Genomics. 6, 55-71 (2012).
- Ohana, R. F., et al. HaloTag-based purification of functional human kinases from mammalian cells. Protein Expr Purif. 76, 154-164 (2011).
- Black, J. C., et al. KDM4A Lysine Demethylase Induces Site-Specific Copy Gain and Rereplication of Regions Amplified in Tumors. Cell. 154, 541-555 (2013).
- Deplus, R., et al. TET2 and TET3 regulate GlcNAcylation and H3K4 methylation through OGT and SET1/COMPASS. EMBO J. 32, 645-655 (2013).
- Galbraith, M. D., et al. HIF1A Employs CDK8-Mediator to Stimulate RNAPII Elongation in Response to Hypoxia. Cell. 153, 1327-1339 (2013).
- Collins, M. O., Choudhary, J. S. Mapping multiprotein complexes by affinity purification and mass spectrometry. Curr Opin Biotechno. 19, 324-330 (2008).
- Collins, S. R., et al. Toward a comprehensive atlas of the physical interactome of Saccharomyces cerevisiae. Mol Cell Proteomics. 6, 439-450 (2007).
- Mellacheruvu, D., et al. The CRAPome: a contaminant repository for affinity purification-mass spectrometry data. Nat Methods. 10, 730-736 (2013).
- Dawson, M. A., Kouzarides, T. Cancer epigenetics: from mechanism to therapy. Cell. 150, 12-27 (2012).
- Jang, M. K., et al. The bromodomain protein Brd4 is a positive regulatory component of P-TEFb and stimulates RNA polymerase II-dependent transcription. Mol Cell. 19, 523-534 (2005).
- Rahman, S., et al. The Brd4 extraterminal domain confers transcription activation independent of pTEFb by recruiting multiple proteins, including NSD3. Mol Cell Biol. 31, 2641-2652 (2011).
- Yang, Z., et al. Recruitment of P-TEFb for stimulation of transcriptional elongation by the bromodomain protein Brd4. Mol Cell. 19, 535-545 (2005).
- Halley, F., et al. A bioluminogenic HDAC activity assay: validation and screening. J Biomol Screen. 16, 1227-1235 (2011).
- Mack, G. S. To selectivity and beyond. Nat Biotechnol. 28, 1259-1266 (2010).
- Daniels, D. L., Urh, M. Isolation of intracellular protein--DNA complexes using HaloCHIP, an antibody-free alternative to chromatin immunoprecipitation. Methods Mol Biol. 977, 111-124 (2013).
- Urh, M., Rosenberg, M. HaloTag a Platform Technology for Protein Analysis. Curr Chem Genomics. 6, 72-78 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved