Method Article
Descobrindo Interações proteína e caracterização da função das proteínas Usando HaloTag Tecnologia
Neste Artigo
Resumo
Tecnologia HaloTag é uma tecnologia multifuncional que demonstrou o sucesso significativo no isolamento de pequenas e grandes complexos de proteínas a partir de células de mamíferos. Aqui destacam-se as vantagens desta tecnologia em relação às alternativas existentes e demonstrar a sua utilidade para estudar vários aspectos da função da proteína dentro das células eucarióticas.
Resumo
Pesquisa em proteômica explodiu nos últimos anos com os avanços na capacidade de espectrometria de massa que levaram à caracterização de inúmeros proteomas, incluindo os de vírus, bactérias e fungos. Em comparação, a análise do proteoma humano fica para trás, em parte devido ao grande número de proteínas que devem ser estudados, mas também a complexidade das redes e interações destes presentes. Para abordar especificamente os desafios de compreender o proteoma humano, desenvolvemos tecnologia HaloTag para o isolamento de proteínas, particularmente forte para o isolamento de complexos multiprotein e permitindo a captura mais eficiente de interações fracas ou transitórios e / ou proteínas de baixa abundância. HaloTag é uma tag geneticamente codificado proteína de fusão, projetado para covalente, específico, e imobilização rápida ou rotulagem de proteínas com vários ligantes. Aproveitando essas propriedades, inúmeras aplicações para as células de mamíferos foram desenvolvidos para personagemize a função da proteína e aqui apresentamos metodologias incluindo: proteína pull-downs utilizados para a descoberta de novas interações ou ensaios funcionais e localização celular. Encontramos vantagens significativas na rapidez, especificidade e captura covalente de proteínas de fusão de superfície para análise proteómica, em comparação com outros métodos tradicionais não covalentes. Demonstramos estes e a ampla utilidade da tecnologia que utiliza duas proteínas epigenética importantes, como exemplos, a proteína humana bromodomain BRD4, e histona deacetilase HDAC1. Estes exemplos demonstram o poder desta tecnologia para permitir a descoberta de novas interações e caracterizar localização celular em eucariotos, o que, em conjunto, uma maior compreensão da proteômica funcionais humanos.
Introdução
Compreensão da função celular, resposta a estímulos e mudanças no desenvolvimento e / ou doença estados está intrinsecamente ligada à de-convolução do proteoma ao longo destes diferentes estados dinâmicos 1,2. Muito tem sido feito para entender o proteoma dos organismos inferiores, no entanto, dado o número de proteínas e todas as interações possíveis, este tem sido um grande desafio para enfrentar o proteoma humano 1,3-7. Avanços em espectrometria de massas permitiram grandemente a capacidade de realizar esses estudos, e aqui apresentamos um avanço adicional e significativa com o desenvolvimento da tecnologia HaloTag tanto para captura eficiente de complexos de proteínas e caracterização funcional de proteínas humanas a partir de células de mamíferos 8-10. Esta tecnologia foi recentemente demonstrado em vários estudos como um fator crítico para a descoberta de importantes interações, permitindo a visão sobre a função da proteína novela e understanding de doença 11-13.
A proteína de fusão HaloTag foi inicialmente desenvolvido para resolver vários desafios de marcas tradicionais e afinidade anticorpos como relacionados à captura de proteínas, purificação e rotulagem 8-10. Dentro de quase todos os métodos de captura e de purificação de proteínas, há um passo de interacção não covalente que é utilizado para o enriquecimento de uma proteína particular 14. Durante esta etapa, a proteína e / ou de complexo podem dissociar devido à difusão, especialmente se o processo requer horas em vez de minutos. Para resolver esta preocupação, a proteína de fusão foi especificamente concebido para interagir de forma rápida e irreversivelmente com os seus ligandos, que podem ser ou partículas, superfícies ou fluoróforos 9. Portanto, uma vez que está ligada ao seu ligando, que permanece ligado, que é um dos factores mais diferenciador relativamente a outras marcas de afinidade. Também demonstrado aqui, é a capacidadepara abordar questões biológicas diferentes com uma construção única, que é possível por ligantes 9 (Figura 1) alternadas. Por exemplo, para interrogar as interacções proteína ou função, os ligandos da superfície são usadas para a captura de proteínas ou complexos (Figura 1). Em uma experiência separada, a mesma proteína de fusão pode ser marcada por fluorescência para estudar a localização celular, tráfico, ou retorno da proteína (Figura 1). É importante lembrar, contudo, que uma vez que um ligando está ligado, se se trata de uma superfície ou um fluoróforo, é irreversível e, por conseguinte, outros ligandos não pode, então, ser subsequentemente ligado no mesmo experimento.
Análise das tecnologias existentes para mapear as interações proteína revelam a dificuldade de isolar eficientemente interações específicas, incluindo aquelas que são mais transitória ou estão em menor abundância 1,6,7,14,15. Além disso, trabalhos recentes de numeroso grupos mostra a preocupação de que os métodos de isolamento dentro tradicionais, especialmente na área de proteómica humanos, há um número significativo de contaminantes de proteínas, que podem mascarar os sinais de verdadeiros interactores em análise por espectrometria de massa 16. As propriedades desenvolvidos para a proteína HaloTag e seu endereço resina co-desenvolvido bem estas preocupações. No protocolo para pulldowns complexos (Figura 1), a ligação dos complexos pode ser alcançada em 15 min, ambos promovendo a captura complexa e reduzir os níveis de ligação não específica 8. Além disso, de forma irreversível ligação permite a captura eficiente de proteínas de baixa abundância e permite a utilização de muito menos células, reduzindo de novo o fundo 8. Uma vez que a captura dos complexos é estabelecida, o protocolo inclui condições suaves de lavagem para manter a integridade do complexo. A eluição de complexos capturados podem ser realizados por dois métodos e a escolha de qual o método é ditada pelo objectivo da anal jusanteysis. Se o desejo é o de analisar ou descobrir proteínas que interagem por Western blot ou espectrometria de massa, então recomenda-se a eluição com complexos de desnaturantes, tais como o SDS ou ureia (Figura 1). Isto é particularmente vantajoso para a espectrometria de massa como a proteína inicialmente fundida com HaloTag, denominada proteína isca, irá permanecer atrás ligado à resina e, portanto, não irá dominar a população de péptidos detectados em espectrometria de massa. Isto também significa, porém, que a proteína isca provavelmente não será visível na análise por western blot, uma diferença significativa em relação a outras purificações afinidade não covalentes ou colegas de imunoprecipitações. Se o objectivo é o de purificar um complexo intacto para ser utilizado para estudos funcionais, a eluição pode ser realizada utilizando TEV (Tobacco Etch Vírus) da protease, a qual reconhece a sua sequência de clivagem cognato codificado entre a proteína de fusão e da proteína de isco (Figura 1). Tamostras stes também podem ser analisados por espectrometria de massa, mas, como mostrado mais tarde, irão conter uma quantidade significativa de proteína isco, que pode impedir a detecção de baixa abundância, interactores específicos.
Apresentamos aqui os protocolos de imagiologia e de pulldown aplicados a duas proteínas terapêuticas importantes, a proteína bromodomain BRD4 e uma histona-desacetilase, HDAC1 17. Mostrámos com estes exemplos, a interacção com os parceiros esperados, conforme determinado por espectrometria de massa, a actividade enzimática após o isolamento complexo para HDAC1, e localização celular adequada para ambos. Juntos, estes resultados demonstram a natureza multifuncional e força da tecnologia para a caracterização de proteínas interacções eucarióticas e função.
Protocolo
Nota: O protocolo seguinte pode ser utilizado com qualquer fusão HaloTag e em qualquer linha celular escolhida de forma estável ou transientemente transfectadas. Para estes exemplos, vamos dar protocolos de transfecção transiente de fusões HaloTag em células HEK293T ou HeLa. Para todos os experimentos, recomendamos o uso do único controle proteína.
1. Fusão Protein Expression Teste
- Obter fusão construção de proteínas:
- Obter pré-fabricados vetor fusão HaloTag ou construir usando vetores existentes. Para mais informações sobre construções disponíveis, por favor, consulte a Tabela de reagentes específicos.
- Se fazer qualquer clone, é recomendado verificar sequenciar o ADN.
- Testando expressão da proteína de fusão e controle:
- Para cada amostra, preparar 250 mL de tampão corante 1X SDS (60 mM de Tris HCL, pH 6,8, 0,75 mM de azul de bromofenol, 12,5% de glicerol, ditiotreitol 100 mM, SDS a 0,5%).
- Para cada proteína de fusãoe controlo, placa 0,5 ml de HEK293T ou células HeLa em seus meios de comunicação apropriada para uma densidade de 2-4 x 10 5 células / ml numa placa de 24 poços padrão.
- Incubar durante 18-24 horas a 37 ° C e 5% de CO 2, depois transfectar como recomendado.
- 24 horas após a transfecção, adicione 0,5 mL de 5 mM de tetra-metil rodamina (TMR) ligante para a mídia de cada poço e misture delicadamente prato.
- Incubar as células transfectadas contendo ligando durante 15 min a 37 ° C e 5% de CO 2.
- Aspirar mídia off contendo ligando e lavar cada poço de células cuidadosamente com 1 ml de PBS temperatura ambiente.
- Aspirar off PBS e realizar uma segunda lavagem com 1 ml RT PBS.
- Remover PBS e adicionar 200 mL de 1X SDS carregando corante tampão directamente às células.
- Pipeta lisado a partir de chapa em 1,5 ml tubo eppendorf.
- Ferver lisado durante 5 min a 95 ° C.
- Retirar 5-10 ul da reacção e da carga em gel de SDS-PAGE.
- Use um scanner de detecção fluorescente(TMR Excitação: 555 nm, emissão: 585 nm) para detectar bandas. Utilizar marcadores de proteínas fluorescentes como padrões.
- Se um scanner de detecção fluorescente não estiver disponível, realizar transferências Western usando anticorpos contra a proteína ou o isco ou marcação da proteína de fusão para detectar a expressão da proteína de fusão.
2. Pulldowns Proteína
- Preparação de células transfectadas de forma transiente:
- Para cada fusão ou controlo preparar um prato de 15 centímetros, com 30 ml de células a 3-4 x 10 5 células / ml ou 1-1,2 x 10 7 células construção total por.
- Incubar durante 18-24 horas a 37 ° C e 5% de CO 2, depois transfectar construir como recomendado.
- Após 24-48 horas pós-transfecção, remova a mídia e lavar cuidadosamente a camada de células com 20-25 ml de PBS gelado.
- Remover lavagem PBS, em seguida, adicionar 25-30 ml de 4 ° C refrigerados PBS e raspe as células fora do prato.
- Coletar as células em tubos cônicos e centrifuge durante 5-10 min a 2000 x g e 4 ° C.
- Elimine o sobrenadante e coloca sedimento celular a -80 ° C durante um mínimo de 30 minutos ou, no máximo de 6 meses.
- Equilíbrio da resina HaloLink:
- Para cada fusão ou controlo de exemplo, preparar 12 ml de tampão de Equilibration Resina / lavagem (100 mM Tris-HCl pH 7,5, NaCl 150 mM e 0,005% IGEPAL CA-630) Nota:. Isso é muito importante para fazer e utilizar a resina Tampão de Equilíbrio dentro de 12 horas como diluído IGEPAL CA-630 não é estável ou eficaz para além deste período de tempo.
- Gentilmente agite ou misture resina para obter uma suspensão uniforme.
- Para cada experimento suspenso, dispensar 200 mL de resina em um 1,5 ml microtubos.
- Centrifugar durante 1 minuto a 800 xg (por exemplo, 3000 RPM numa microcentrífuga), em seguida, cuidadosamente remover e descartar o sobrenadante (etanol), sem perturbar a resina na parte inferior do tubo.
- Adicionar 800 ul de Resina de Equilíbrio / Wash tampão e misture bem, invertendo o tubo várias vezes.
- Centrifugar durante 2 min a 800 x g, então, cuidadosamente remover e descartar o sobrenadante.
- Repita os passos 2.2.5 e 2.2.6 mais duas vezes para um total de 3 lavagens.
- Não remova a lavagem final ou sobrenadante até que esteja pronto para adicionar lisados celulares descritos abaixo (Passo 2.3.8) para evitar que a resina de secar.
- Encadernação e lavagem de complexos de fusão:
- Para cada amostra, preparar 500 mL de tampão de lise de mamíferos (50 mM Tris-HCl pH 7,5, 150 mM de NaCl, 1% Triton X-100, 0,1% de Na Desoxicolato) e 1 ml de tampão 1X TBS (100 mM Tris-HCl pH 7,5 e NaCl 150 mM).
- Descongele as pelotas de células e ressuspender em 300 mL de tampão de lise de mamíferos por pipetagem cima e para baixo ou brevemente vortex.
- Adicionar 6 ul de 50X Protease Inhibitor Cocktail (800 ug / ml de cloridrato de benzamidina, 500 ug / ml fenantrolina, 500 ug / ml de aprotinina, 500 ug / ml de leupeptina, 500 & #. 181; g / ml de pepstatina A, 50 mM de PMSF) Nota: cocktail de protease que incluem AEBSF não pode ser usado como estes interferem com a ligação de marcação de proteínas de fusão.
- Adiciona-se 3 ul de ADNase RQ1 e inverter durante 10 min à temperatura ambiente.
- Dounce com homogeneizador de vidro de 2,0 ml de tamanho; 25-30. Golpes no gelo, ou passar as células através de uma agulha G 25 ou 27 5-10 vezes para completar a lise Nota: Sonication não é recomendado como complexos podem desmoronar e sobre-aquecimento pode afetar a atividade tag proteína de fusão.
- Centrifugar a 14.000 xg durante 5 min a 4 ° C para limpar o lisado.
- Transferir lisado claro, cerca de 300 mL volume total, para novo tubo e colocar no gelo.
- Adicionar para limpar lisado um adicional de 700 mL de tampão TBS 1X e misture bem por pipetagem cima e para baixo.
- Tome tubos de resina equilibrada preparadas no Passo 2.2.8 e remover final de lavagem / sobrenadante a partir da resina, sem perturbar a resina na parte inferior do tubo.
- Adicione a cada tuser de resina, o 1 ml de lisado diluído.
- Incubar, com mistura, em um tubo de rotor (ou misturador suave) durante 15 min a 22 ° C. Nota: A sedimentação da resina durante esse tempo reduz a eficiência de ligação. Se ligação a 4 ° C é desejável, tanto pela mistura durante 1 hora.
- Tubos de resina Centrífuga para 2 min a 800 xg e descartar o sobrenadante.
- Adicionar 1 ml de tampão de Resina Equilíbrio / Wash feitos no Passo 2.2.1 e misture bem, invertendo o tubo de resina com a mão várias vezes.
- Tubos de resina Centrífuga para 2 min a 800 xg e descartar a lavagem.
- Repetir Passos 2.3.12 2.3.14 seguido por três vezes adicionais.
- Adicionar 1 ml de tampão de Equilibration Resina / Wash e incubar a 22 ° C durante 5 minutos, com rotação constante.
- Tubos de resina Centrífuga para 2 min a 800 xg e descartar a lavagem.
- Dependendo da aplicação final (ver Introdução para mais explicações), de avançar para a Seção 2.4 ou 2.5.
- SDS eluição de géis desnaturantes, as transferências Western, ou espectrometria de massa:
- Ressuspender a resina de cada amostra em 50 ul de tampão de eluição de SDS (SDS a 1% e 50 mM Tris-HCl pH 7,5)
- Agitar os tubos a temperatura ambiente durante 30 min.
- Centrifugar durante 2 minutos a 800 xg e transferência de produtos de eluição para tubos frescos para análise.
- Para western blot ou gel prata mancha, carga 5-10 mL em um gel desnaturante SDS.
- Para a espectrometria de massa, salvo 40 ul de cada amostra a -20 ° C.
- Protease TEV eluição para os ensaios funcionais, as transferências Western, ou espectrometria de massa:
- Após a remoção da última lavagem, ressuspender a resina em 50 mL de tampão de clivagem ProTEV e 30 unidades da enzima de TEV.
- Incubar a 25 ° C com agitação durante 1 hora.
- Centrifugar durante 2 minutos a 800 x g.
- Transferir fluido para tubos frescos.
- Amostra Armazenar a 4 ° C para utilização imediata em ensaios funcionais.
3.Imagem de celular fluorescente Labelled Proteínas de Fusão Usando um citoplasmática e nuclear Permeável Ligand
- Transfecção, etiqueta, e células de imagem:
- Em uma lamela 8 bem compartimentado para cada proteína de fusão ou de controlo, a placa 400 uL de células HeLa em seus meios de comunicação apropriada em cada poço a uma densidade de 1-2 x 10 5 células / ml.
- Incubar durante 18-24 horas a 37 ° C e 5% de CO 2, depois transfectar como recomendado.
- 18-24 h após a transfecção, diluir TMR ligando 1:200 em meios celulares adequadas, em seguida adicionar 100 ul desta solução a cada poço e misturar suavemente.
- Incubar as células transfectadas contendo ligando durante 15 min a 37 ° C e 5% de CO 2.
- Aspirar a mídia off contendo ligante e substituir por 500 mL de mídia apropriada falta de fusão da proteína ligante tag, que foi pré-aquecido a 37 ° C.
- Repita duas vezes para um total de três lavagens.
- Coloque as células de volta em incubadora (376; C e 5% CO 2) durante 30 min.
- Aspirar off mídia e substitua-o por 500 mL de meios de comunicação adequados, que foi pré-aquecido a 37 ° C.
- Imagem em um microscópio utilizando parâmetros de aquisição apropriados (TMR de excitação: 555 nm; emissão: 585 nm).
Resultados
Quando se trabalha com qualquer nova proteína de fusão, que é importante para o primeiro ensaio para a expressão dessa proteína, após a transfecção e também validar que uma proteína de peso molecular correcto está a ser produzido. Como proteínas de fusão HaloTag pode ser fluorescente e covalentemente marcada com ligantes, permeáveis ou impermeáveis, dependendo da localização, pode-se determinar rapidamente a expressão pela aplicação de lisados celulares a electroforese em gel desnaturante seguido por varrimento sobre um fluorimager. Usando o protocolo descrito na Seção 1.2, a expressão de Halo-BRD4 (189 kD) e só o controle HaloTag (Ctrl) é observada (34 kD, Figura 2A). Como mencionado no protocolo, a expressão de proteínas de fusão também pode ser detectada utilizando Western blots tradicionais com anticorpos anti-HaloTag, ou se eles estiverem disponíveis, os anticorpos para a proteína de isco. Se possível, é recomendável usar o ligando fluorescente em vez disso, uma vez que é mais específica, mais rápida, mais fácil e than detecção de anticorpos, e também quantitativa 10.
Após a expressão do correcto comprimento total da proteína de fusão é verificado, puxadas da proteína pode ser realizada. Mostrado na Figura 2B são os géis de prata manchadas de repetições biológicas de Halo-Brd4 e Ctrl pulldowns eluídas por SDS (Protocolo Seção 2.4) que demonstram alta reprodutibilidade. Os géis de mancha de prata mostram um número significativo de proteínas encontram-se a interagir com a proteína BRD4 e muito baixo fundo no controlo (Figura 2B). Como mencionado na introdução, no presente processo de eluição, o halo-BRD4 não ser eluída a partir da resina, uma vez que continua a ser ligado de forma covalente. Portanto, não há uma banda significativa a este peso molecular a ser detectada em mancha de prata (Figura 2B) ou Western blot (dados não mostrados). Para determinar se estas proteínas são específicas de BRD4, espectrometria de massa de cromatografia líquida (LC-MS/MS) foi realizada sobre o complex mistura obtida após SDS eluição. Mostrado na Figura 2C são contagens espectrais e normalizado fator abundância espectral valores (NSAF) para interagentes conhecidos de BRD4 18-20 encontrados na análise de espectrometria de massa Halo-BRD4. A elevada quantidade de componentes de pTEFb 18,20 e também a proteína 19 BRD9 confirmar captura específica dos complexos Brd4. Como previsto pelos géis de mancha de prata (Figura 2B), numerosas outras proteínas também foram identificados como potenciais interactores de BRD4 que não foram observados no controlo (dados não apresentados). Como estes são previamente desconhecido, eles precisam ser verificadas de forma independente por outras metodologias para confirmar se a proteína é um verdadeiro interator, em caso afirmativo, se está direta ou indiretamente associada a BRD4.
Isolado complexos pode também ser estudado para a actividade; é recomendável para eluir complexos utilizando protease TEV (Protocolo Seção 2.5), de modo que eles mantenham functionality. Na Figura 3A, um gel de coloração de prata de complexos pulldown Halo-HDAC1 libertados a partir da resina utilizando protease de TEV é mostrado. Como protease TEV vai clivar numa região ligante entre o tag de proteína de fusão e do seu parceiro de fusão, uma quantidade significativa de proteína isco, neste caso, HDAC1, sejam observados (Figura 3A). Para determinar se esta fracção continha actividade de HDAC1, TEV amostras eluídas foram testadas num ensaio luminescente de HDAC, HDAC-Glo 21. Como mostrado na Figura 3B, as amostras de HDAC1 pulldown mostrou níveis elevados de actividade HDAC1 (coluna 1), o qual foi especificamente inibida por um inibidor de HDAC conhecidos, SAHA 22 (Coluna 2). Como controlos para demonstrar ainda mais a especificidade, nenhuma inibição de HDAC foi observada com um inibidor da família SIRTUINA relacionada, EX-527 22 (coluna 3) e nenhum sinal foi detectado utilizando tampão sozinha, sem a amostra HDAC1 suspenso adicionado (Coluna 4).
Um componente significativa da funçãoproteômica ai e compreensão complexos, também é o entendimento de localização e / ou tráfico de proteína. Como essas construções mesmo de fusão pode ser fluorescente etiquetado no interior das células, acompanhámos a sua localização utilizando imagens confocal. Seguindo o protocolo na Seção 3, as células HeLa transfectadas transitoriamente com Halo-BRD4 (Figura 4A) e Halo-HDAC1 (Figura 4B) foram fluorescente etiquetado com o ligante TMR e fotografada. Como mostrado nas Figuras 4A e 4B, tanto localizadas ao núcleo 17 como esperado. Estes dados demonstram que a presença de etiqueta não alterou a localização celular fisiológica dos seus parceiros de fusão.

Figura 1. Esquema de suspenso proteínas e aplicações de imagem confocal. Usando como ingle construir várias aplicações para entender a função da proteína em células de mamíferos são possíveis. Por tudo, uma construção de fusão de halo ou é expressa de forma transiente ou de forma estável em células de mamífero aderentes ou em suspensão. Para proteína pulldowns complexos, as células são então lisadas, complexos são covalentemente capturado em resina, e eluída através de eluição ou SDS (via da esquerda) ou de clivagem TEV (via direita). SDS eluição é recomendado para proceder à análise por espectrometria de massa, enquanto que a clivagem de TEV é ideal para a realização de análise funcional. Para caracterizar expressão, localização celular, os eventos de tráfico, ou turnover de proteína, as células vivas que expressam proteínas de fusão são fluorescente etiquetado e posteriormente analisado em SDS PAGE ou usando imagens confocal. Ambas as células ligantes fluorescentes permeáveis ou impermeáveis estão disponíveis, dependendo da localização ou a apresentação da proteína de fusão no interior da célula.
igura 2 "fo: Content-width =" 6 pol "src =" / files/ftp_upload/51553/51553fig2highres.jpg "width =" 600 "/>
Expressão Figura 2. Halo-BRD4 proteína, suspenso, e análise de espectrometria de massa. Géis (A) A SDS página que mostra a expressão da proteína Halo-BRD4 fusão, 189 kD, e só o Halo tag proteína de fusão, 34 kD, controle (Ctrl) dentro de um lisado celular HEK293T rotulados com TMR ligante (Protocolo Seção 2.1). Os géis foram escaneados com fluorimager para detecção e um marcador fluorescente peso molecular foi usado. (B) géis de prata mancha de repetições biológicas para pulldowns de Halo-Brd4 e Ctrl amostras eluídas com SDS. Tamanhos de peso molecular são indicados para o gel. (C) contagens espectrais (painel esquerdo) e normalizados factores abundância espectrais valores (NSAF) (painel da direita), que representam a proteína de peso molecular de proteínas identificadas na análise por espectrometria de massa de réplicas biológicas de Halo- BRD4 e Ctrl. Mostram-se as proteínas conhecidas por interagirem wom BRD4, incluindo componentes de pTEFb (CDK9 ciclina e t) 18,20, bem como BRD9 19. Nenhum destes péptidos a partir de proteínas foram identificadas no Ctrl.

Halo-HDAC1 isolamento Figura 3. Complexo e análise da atividade. (A) géis de prata mancha mostrando o isolamento de complexos de Halo-HDAC1 e fundo do Ctrl após TEV clivagem (Protocolo Seção 2.5). O destaque HDAC1 banda (55 kDa) ea banda protease TEV são rotulados. O HDAC1 livre é gerada por clivagem TEV dentro de um ligante optimizado entre a sequência de fusão HaloTag e HDAC1 após captura sobre a resina (Figura 1). (B) O gráfico mostra a actividade de HDAC1 amostras isolations complexos num ensaio de histona deacetilase luminescente, HDAC- Glo 21. Coluna 1 do gráfico mostra alta levels de atividade HDAC contidos com as amostras suspensos Halo-HDAC1 (HDAC1). A coluna 2 revela que esta actividade pode ser especificamente diminuída pela adição do inibidor de HDAC, a SAHA 22, para as amostras de pulldown HDAC1. Como controles, Coluna 3 demonstra um inibidor da deacetilase específico para a família sirtuin, mas não HDAC, EX-527 22, não inibe a atividade HDAC1 e Coluna 4 mostra nenhuma atividade é observada utilizando tampão sozinho.
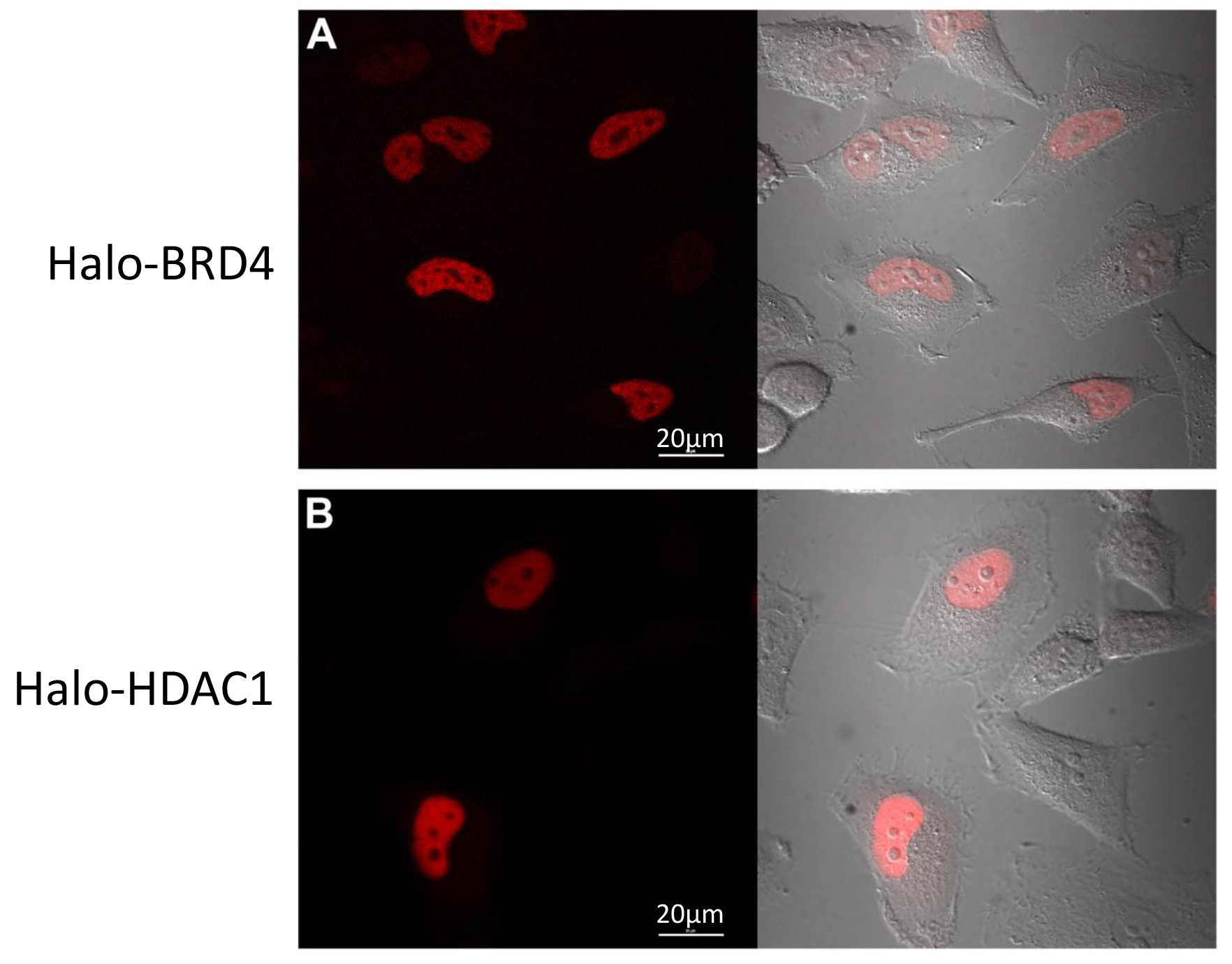
Figura 4. Halo-BRD4 e Halo-HDAC1 imagem confocal. Vivo de células de imagem confocal de células HeLa transfectadas com halo-BRD4 (A) ou do halo-HDAC1 (B) marcado por fluorescência com TMR ligando. (A) a expressão halo-BRD4 é restrito para o núcleo e (B) a expressão halo-HDAC1 é predominantemente nuclear. O lado esquerdo de painéis é o canal fluorescente e do lado direito é uma sobreposição do canal fluorescente com o canal de DIC para cada um. As imagens foram adquiridas com um microscópio confocal equipado com um + CO2 câmara ambiental a 37 ° C por meio de filtros adequados. Barras de escala = 20 um.
Discussão
Apresentado aqui são duas proteínas de fusão, Halo-BRD4 e Halo-HDAC1, caracterizada em células de mamíferos eucarióticas para a expressão de proteínas, isolamento e atividade complexa e localização celular. No trabalho através destes vários protocolos, existem vários passos importantes para o sucesso de cada experimento. Como é o caso com qualquer proteína de fusão, o nível de expressão e a colocação da etiqueta propriamente dito pode ser crítico para a manutenção da fisiologia. Por conseguinte, é importante ter em conta que as fusões de C-terminal N-e / ou necessita de ser concebido, se o conhecimento prévio ou trabalhar com outra marca não tem sido demonstrado para a proteína particular de escolha. No que se refere a expressão, se o nível for muito alto, a diluição do DNA pode ser realizada durante a transfecção ou a utilização de vectores com promotores mais fracos são possíveis para alcançar o nível que é apropriado. Os trabalhos anteriores foram realizados mostrando eficiente isolamento de complexos macromoleculares em endógena levels de expressão 8, permitindo o trabalho em níveis muito baixos de expressão. Se possível, estudos de localização de celular também seria capaz de fornecer informações sobre a tag posição ótima colocação, bem como o nível de expressão relativa necessária para a fisiologia adequada.
Uma vez que as proteínas de fusão estão prontos para experiências suspensos, para obter o máximo de sucesso com o protocolo que é muito importante para seguir os intervalos de tempo recomendados na lise, de ligação, e as secções de lavagem, como um dos maiores vantagens é a velocidade do isolamento complexo processo. Se qualquer um destes passos são prolongadas no tempo, tal como é exigido para um método de captura com base em anticorpo, existe um risco de dissociação ou complexo aumentou ligação não específica 8. Da mesma forma, se os tempos são encurtados durante a lise celular ou ligação, as células podem não ser completamente lisadas ou eficientemente capturados respectivamente. Se o número de lavagens é decrfacilitado ou boa mistura da resina não ocorre durante as lavagens de ligação ou, em seguida, os níveis de proteínas não-específicos de fundo será aumentada. Além disso, os meios de lise é muito importante, relacionada com a eficiência de ligação à resina. Tentativas para sonicar as amostras, remover o detergente recomendado, adicionar SDS ou outro detergente forte, e / ou que contém o inibidor de protease AEBSF irá resultar na redução ou perda de ligação de proteínas de fusão e os seus complexos para a resina.
Métodos para isolamento complexo de células de mamíferos e luta análise proteômica humano com o desafio de reduzir a fundo na análise por espectrometria de massa 16 existentes. Este tem sido tão significativa que um repositório de proteínas contaminantes foi criado por numerosos grupos de espectrometria de massa 16. Fundo em amostras de espectrometria de massa suspensos pode ser definida como qualquer coisa que impede a identificação deverdadeiros interagentes da proteína isca. Como tal, o fundo pode surgir a partir de proteínas contaminantes não-específicos ou também grandes concentrações de proteína isco ou anticorpos utilizados para precipitar proteínas isco. O trabalho significativo foi feito em optimizar o protocolo suspenso aqui apresentada, bem como a resina de minimizar o nível de proteínas contaminantes não-específicos do processo suspenso. Isto é evidente nos géis de mancha de prata e análise de espectrometria de massa do controlo (Figura 2). Para lidar com os altos níveis de proteína isca ou anticorpos que podem ser igualmente prejudiciais como contaminantes e com que outras metodologias lutam, o menu suspenso com SDS eluição é recomendada (Protocolo Seção 2.4). Devido à ligação covalente à resina, este processo vai deixar a maior parte da proteína de fusão de partida de forma covalente ligado à resina. Uma pequena percentagem de isca é observada na análise por espectrometria de massa, o qual se acreditaa ocorrer através de hidrólise, mas que não apresentam um problema para a detecção de outras interacções fracas ou transientes 8.
Como mencionado na introdução, avanços significativos em proteômica têm sido ativado por avanços significativos em 1,7 espectrometria de massa. Portanto, é importante realçar os parâmetros importantes da escolha de análise de espectrometria de massa para deconvolute a mistura de proteínas obtidas nas puxadas. Instrumentação deve ser robusto e capaz de rotina e eficiente de analisar amostras que contêm uma pequena quantidade de proteína, frequentemente menos do que <1 pg. Cromatografia em nanoescala envolvendo 50-75 mM colunas de HPLC de diâmetro interno com caudais 100-300 nl / min gama é normalmente empregado para fins de compatibilidade com as amostras de pequenas dimensões e de maximizar a sensibilidade do espectrômetro de massa. Para maximizar a informação adquirida em um estado único de análise of os espectrômetros de massa de arte capaz de adquirir espectros de massa de alta resolução em uma escala de tempo compatível com separações em nanoescala acima mencionados, ≥ 10 Hz, são normalmente empregadas. Estes instrumentos têm níveis attomolar de sensibilidade e pode rotineiramente adquirir dados com precursor ppm sub e tolerâncias de erro massa de íons produto. Estas características de desempenho servem para aumentar o rendimento do número de proteínas identificadas e a confiança associada com estas identificações.
Com esses dados podemos demonstrar localização fisiológica celular, proteína adequada: interações proteína, juntamente com potencial para a descoberta de novas interações, e isolamento de complexos ativos tudo usando um único construto. Com efeito tecnologias alternativas podem ser usadas para cada um destes diferentes aspectos, mas não provável para todos 23,24. Com a tecnologia HaloTag, uma abordagem multifuncional pode ser usado, avançando proteomics estudos e obter uma compreensão mais completa da função das proteínas em células de mamíferos.
Divulgações
Taxas de publicação para este artigo são patrocinados pela Promega Corporation. Danette L. Daniels, Jacqui Méndez, Hélène Benink, Andrew Niles, Nancy Murphy e Marjeta Urh são funcionários da Promega Corporation, o proprietário comercial, através de cessão de patentes da tecnologia HaloTag e suas aplicações. Michael Ford, Richard Jones, Ravi Amunugama e David Allen são funcionários da MSBioworks, que fornece serviços de espectrometria de massa descritos neste manuscrito.
Agradecimentos
Agradecemos ao Dr. Martin Rosenberg, Dr. Gary Tarpley, e Dr. Keith Madeira para o apoio a este trabalho, e Dr. James Cali para a leitura crítica do manuscrito. DLD, JM, HB, NM, AN, JC, e MU são funcionários da Promega Corporation. MF, RJ, RA, e DA são funcionários da MS BioWorks, LLC.
Materiais
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | CCL-2 | Adherent |
| HEK293T Cells | ATCC | CRL-11268 | Adherent |
| Cellular growth media | Invitrogen/Gibco | ||
| PBS - tissue culture certified | Invitrogen/Gibco | ||
| FuGENE HD Transfection Reagent | Promega | E2311 | |
| HaloTag Control Vector | Promega | G6591 | |
| HaloTag-BRD4 | Kazusa DNA Research Institute | FHC11882 | N-terminal HaloTag fusion |
| HaloTag-HDAC1 | Kazusa DNA Research Institute | FHC02563 | N-terminal HaloTag fusion |
| HaloTag Clones containing content | Promega | Various | http://www.promega.com/FindMyGene/ |
| HaloTag Flexi Vectors for cloning (N- or C-terminal) | Promega | Various | Choose based upon expression level and HaloTag orientation |
| HaloTag TMR Ligand | Promega | G8251 | |
| IGEPAL CA-630 | Sigma | 18896 | |
| HaloTag Mammalian Pull-Down and Labelling System | Promega | G6500 | Contains HaloTag TMR ligand |
| HaloTag Mammalian Pull-Down System | Promega | G6504 | |
| Protease Inhibitor Cocktail, 50X | Promega | G6521 | |
| Mammalian Lysis Buffer | Promega | G9381 | |
| HaloTag Monoclonal Antibody | Promega | G9211 | |
| ProTEV Plus | Promega | V6101 | |
| RQ1 Dnase | Promega | M6101 | |
| HaloLink Resin | Promega | G1912 | |
| HDAC-Glo | Promega | G6420 | |
| PBS + 0.1% Triton X-100 | For optional imaging | ||
| 4% paraformaldehyde/0.2 M sucrose/PBS | For optional imaging | ||
| Ethanol | |||
| Tissue culture vessels and dishes | |||
| Cell culture incubator | |||
| Disposable cell lifter | Thermo Fisher Scientific | 08-773-1 | |
| Glass homogenizer such as Kontes Dounce Tissue Grinder | Thermo Fisher Scientific | K885300-0002 | 25-27 G needle could also be used |
| Microcentrifuge | |||
| Tube rotator such as Labquake | Thermo Fisher Scientific | 4002110Q | Ideal for binding and washing steps |
| Shaking platform such as Eppendorf Thermomixer | Thermo Fisher Scientific | 05-400-200 | Ideal for SDS elution and TEV cleavage steps |
| Chambered cover glass | Thermo Fisher Scientific | 155409 | For optional imaging |
| Fluorescent Microscrope (555 nm Ex/585 nm Em) | For optional imaging |
Referências
- Altelaar, A. F., Munoz, J., Heck, A. J. Next-generation proteomics: towards an integrative view of proteome dynamics. Nat Rev Genet. 14, 35-48 (2013).
- Tyers, M., Mann, M. From genomics to proteomics. Nature. 422, 193-197 (2003).
- Coulombe, B., et al. Interaction networks of the molecular machines that decode, replicate, and maintain the integrity of the human genome. Mol Cell Proteomics. 3, 851-856 (2004).
- Gavin, A. C., et al. Proteome survey reveals modularity of the yeast cell machinery. Nature. 440, 631-636 (2006).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Sardiu, M. E., et al. Probabilistic assembly of human protein interaction networks from label-free quantitative proteomics. Proc Natl Acad Sci U S A. 105, 1454-1459 (2008).
- Domon, B., Aebersold, R. Mass spectrometry and protein analysis. Science. 312, 212-217 (2006).
- Daniels, D. L., et al. Examining the complexity of human RNA polymerase complexes using HaloTag technology coupled to label free quantitative proteomics. J Proteome Res. 11, 564-575 (2012).
- Encell, L. P., et al. Development of a dehalogenase-based protein fusion tag capable of rapid, selective and covalent attachment to customizable ligands. Curr Chem Genomics. 6, 55-71 (2012).
- Ohana, R. F., et al. HaloTag-based purification of functional human kinases from mammalian cells. Protein Expr Purif. 76, 154-164 (2011).
- Black, J. C., et al. KDM4A Lysine Demethylase Induces Site-Specific Copy Gain and Rereplication of Regions Amplified in Tumors. Cell. 154, 541-555 (2013).
- Deplus, R., et al. TET2 and TET3 regulate GlcNAcylation and H3K4 methylation through OGT and SET1/COMPASS. EMBO J. 32, 645-655 (2013).
- Galbraith, M. D., et al. HIF1A Employs CDK8-Mediator to Stimulate RNAPII Elongation in Response to Hypoxia. Cell. 153, 1327-1339 (2013).
- Collins, M. O., Choudhary, J. S. Mapping multiprotein complexes by affinity purification and mass spectrometry. Curr Opin Biotechno. 19, 324-330 (2008).
- Collins, S. R., et al. Toward a comprehensive atlas of the physical interactome of Saccharomyces cerevisiae. Mol Cell Proteomics. 6, 439-450 (2007).
- Mellacheruvu, D., et al. The CRAPome: a contaminant repository for affinity purification-mass spectrometry data. Nat Methods. 10, 730-736 (2013).
- Dawson, M. A., Kouzarides, T. Cancer epigenetics: from mechanism to therapy. Cell. 150, 12-27 (2012).
- Jang, M. K., et al. The bromodomain protein Brd4 is a positive regulatory component of P-TEFb and stimulates RNA polymerase II-dependent transcription. Mol Cell. 19, 523-534 (2005).
- Rahman, S., et al. The Brd4 extraterminal domain confers transcription activation independent of pTEFb by recruiting multiple proteins, including NSD3. Mol Cell Biol. 31, 2641-2652 (2011).
- Yang, Z., et al. Recruitment of P-TEFb for stimulation of transcriptional elongation by the bromodomain protein Brd4. Mol Cell. 19, 535-545 (2005).
- Halley, F., et al. A bioluminogenic HDAC activity assay: validation and screening. J Biomol Screen. 16, 1227-1235 (2011).
- Mack, G. S. To selectivity and beyond. Nat Biotechnol. 28, 1259-1266 (2010).
- Daniels, D. L., Urh, M. Isolation of intracellular protein--DNA complexes using HaloCHIP, an antibody-free alternative to chromatin immunoprecipitation. Methods Mol Biol. 977, 111-124 (2013).
- Urh, M., Rosenberg, M. HaloTag a Platform Technology for Protein Analysis. Curr Chem Genomics. 6, 72-78 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados