Method Article
Sistematik Analizi
Bu Makalede
Özet
Bu çalışma, önemli fizyolojik olarak ilgili kesme akımı altında, hücre haddeleme çalışmalar artırıp, çok oyuklu bir plaka mikroakışkan sistemi kullanılır. Silsilesini ve hastalarda hücre ekzojen popülasyonlarının sistemik olarak uygulanmasını takiben hücre hedeflemesi önemini homing çok adımlı, hücre haddeleme önemi göz önüne alındığında, bu sistem, hücre bazlı tedaviyi geliştirmek için bir tarama platform olarak potansiyel sunmaktadır.
Özet
Hücre bazlı tedavisi için önemli bir sorun, sistemik damar içine veya intra-arteryel infüzyonla, aşağıdaki ilgi dokularına yüksek verim ile yaşayabilir hücrelerin büyük bir miktarda hedef yetersizliğidir. Sonuç olarak, hücre homing artan anda hücre tedavisini geliştirmek için bir strateji olarak incelenmiştir. Vasküler endotel yuvarlanan hücre hücre hedeflemesi sürecinde önemli bir adımdır ve bir paralel plaka akış odası (PPFC) kullanılarak in-vitro olarak tanınacak. Ancak bu zayıf kontrol edilen akış koşulları, son derece can sıkıcı, düşük akış tahlilidir. Bunun yerine, tam olarak kontrol edilen, fizyolojik olarak ilgili kesme akışı altında 1,2 daha yüksek bir verim içinde hücresel yuvarlanma özellikleri çalışma sağlayan bir çok oyuklu bir plaka mikroakışkan sistemi kullanılır. Bu yazıda, P-ve E-selectin kaplı yüzeylerde hem de hücre tek-kaplı yüzeylerde HL-60 (insan promiyelositik lösemi) hücrelerinin yuvarlanma özelliklerini readil olabilir göstermeky incelenmiştir. Daha iltihaplı koşulların simüle edilmesi için, mikroakışkan kanal yüzeyi daha sonra önemli ölçüde dinamik koşullar altında HL-60 hücreleri ile etkileşimleri, artan tümör nekroz faktörü-α (TNF-α) ile aktive edilmiş endotel hücreleri (EC) ile kaplandı. Geliştirilmiş verimlilik ve bu hızları haddeleme ve yolunu haddeleme gibi parametrelerin hızlı analizi izin verir entegre çoklu parametre yazılımı analizi platformu, in-vitro hücre haddeleme özelliklerini değerlendirmek için önemli bir avantaj oluşturmaktadır. Hücre haddeleme ve homing darbe için tasarlanmış mühendislik yaklaşımları, hızlı ve doğru analiz sağlayan, bu platform önceden eksojen hücre tabanlı tedavi yardımcı olabilir.
Giriş
Hücre tabanlı tedavinin başarılı klinik çeviride önemli zorluklardan biri verimsiz dağıtım veya arzu sitelere 3,4 sistemik aşılanmış hücrelerin hedef olduğunu. Sonuç olarak, hücre homing geliştirmek için yaklaşımlar için bir arayışlar sürmektedir, ve özellikle de, hücre terapisi geliştirmek için bir strateji olarak, haddeleme hücre. Kan damarları üzerinde yuvarlanan Cep klasik hastalık sitelerine 5 alınsın lökositler için tanımlanan hücre homing kaskad, önemli bir adımdır. Bu adım, endotel selektinler arasındaki spesifik etkileşimlere tarafından yönetilir örneğin, P-selektin ve E-(P-ve E-sel) ve lökositlerin 5,6 yüzeyinde kontra ligandları. Daha iyi anlaşılması ve hücre hedeflemesi geliştirilmiş verimlilik ve özellikle haddeleme adım, hücre tabanlı tedavi geliştirmek için yeni platformlar için arayış içinde büyük önem taşımaktadır. Bugüne kadar bu iki düz plat oluşan, paralel plaka akış odaları (PPFCs) kullanılarak elde edilmiştirBir hücre süspansiyonu bir şırınga 7,8, 9, pompa kullanılarak perfüze, üzerinden, üst plaka üzerinde yer alan bir giriş ve çıkış bağlantı noktası ile aralarında bir conta ile es. Taban levhasının yüzeyi bir ilgili hücre tek tabaka / alt-tabakalar kaplanabilir ve kesme akımı altında perfüze hücreleri ve yüzey arasındaki etkileşimi, daha sonra 7 araştırılmıştır. Ancak, PPFC kabarcık oluşumu, sızıntı ve büyük sakıncalar sergilemesi kötü kontrollü akışı ile düşük verim, reaktif tüketim, ve oldukça sıkıcı bir yöntemdir.
Geleneksel PPFC için alternatif bir teknik, düşük reaktif tüketimi 1,10 ile, doğru, bilgisayar kontrollü kesme akımı altında hücresel tahlillerde daha yüksek verim performansı (PPFCs en fazla 10 kat daha yüksek) izin, bir çok-yuvalı plaka mikroakışkan sistemidir. Hücre deneyleri haddeleme USI hücre mono tabakaları veya oluşturulmuş bir alt-tabakalar ile kaplanır ve görüntülü edilebilir, mikroakışkan kanal içinde yapılmaktadırng haddeleme özelliklere sahip bir mikroskop, hali hazırda, uygun bir yazılım kullanılarak analiz edildi. Bu çalışmada, insan promiyelositik lösemi farklı yüzeylerde (HL-60) hücreleri yuvarlanma özelliklerini inceleyerek bu çok-çukurlu plaka mikroakışkan sisteminin yeteneklerini gösterir. HL-60 P-ve E-sel, hem de farklı haddeleme reseptörleri ifade eden hücre tekli katmanları üzerinde, analiz edilmiştir gibi alt-tabakalar üzerinde yuvarlanan. Buna ek olarak, antikor (Ab), bu yüzeyler üzerinde HL-60 yuvarlanma hareketine aracılık özel selektinler doğrudan katılımını göstermek için kullanılmıştır engelleme. Yuvarlanan deneyleri, hız haddeleme, haddeleme hücre sayısı ve haddeleme yolu özellikleri gibi kilit dönme parametrelerini etkin analizi sağlayan, minimal reaktif / hücre tüketimi, kararlı kesme akışı altında, yüksek verim ile yapılmıştır.
Protokol
1.. Hücre Kültürü
- Insan promiyelositik lösemi (HL-60) hücreleri
- 75 cm kültür HL-60 hücreleri,% 20 (v / v) cenin sığır serumu (FBS),% 1 (v / v), L-glutamin ve 1 ile takviye edilmiş Iscove Modifiye Dulbecco ortamı (IMDM), 15 ml 2 şişe % (v / v) penisilin-streptomisin.
- Hücre süspansiyonu hacminin yarısı aspirasyon ve tam IMDM ortamı ile değiştirilmesiyle her 3 günde bir ortam kullanın.
- Carboxyfluorescein diasetat için, süksinimidil ester (CFSE) boyama, santrifüj HL-60 hücre süspansiyonu (400 x g, 5 dakika), 1 uM CFSE çözelti içinde tekrar süspansiyon (önceden ısıtılmış PBS içinde hazırlandı) ve 37 ° C'de 15 dakika boyunca inkübe Daha sonra, 30 dakika için önceden ısıtılmış taze ortam içinde hücreler, santrifüj, aspirat supernatant ve tekrar süspansiyon hücreleri. PBS içinde hücreleri yıkayın ve daha sonra (P-sel kaplı yüzey üzerine CFSE boyanmış HL-60 hücreleri için temsili görüntüsü Şekil 1B'ye bakınız) haddeleme deneyler için kullanın.
Not: CFSE boyama isteğe bağlıdır, ve mikroakışkan kanalda haddeleme fenomen göstermek için burada sunulmuştur. Bu yazıda sunulan haddeleme parametrelerinin analizi standart aydınlık görüntüleme kullanarak boyanmamış hücreler üzerinde yapıldı.
- Akciğer mikrovasküler endotelyal hücreler (LMVECs)
- Coat 100 mm Petri% 0.1 jelatin çözeltisi (PBS içerisinde v / v) ile yemekleri ve en az 30 dakika boyunca 37 ° C'de inkübe edin.
- Tam endotelyal büyüme ortamı içinde jelatin kaplı 100 mm petri çanakları üzerine kültür LMVECs (endotelyal bazal ortamı-2 (EBM-2)), spesifik bir büyüme takviyesi kiti ile takviye edilmiş) REAJANLAR bkz. Medya% 80-90 ulaşan üzerine her gün ve alt-kültür hücreleri değiştirmek.
- Alt-kültürü için, hücreler, PBS ile yıkayın ve daha sonra ayırma hücreleri 1 x tripsin-EDTA 4 ml ile 3 dakika boyunca 37 ° C'de ve tam EBM-2 ortamının bir eşit hacmi içinde nötralize eder. Bir 15 ml tüp ve centrifug hücre süspansiyonu aktarıne (400 xg, 5 dk). Santrifüj sonrasında, tam endotelyal ortam 1 ml pelet tekrar süspansiyon ve bir hemasitometre ile hücre sayımı. Bu tüm deneyler için geçiş 7 altında yalnızca hücre morfoloji ve fonksiyon kullanımını etkilediği gibi, değil over-geçit hücreleri.
- Çin Hamsteri Yumurtalık-P-selektin (CHO-P) Hücreler
- Şekilde insan P-sel ifade transfekte CHO hücreleri olan CHO-P hücreleri, işbirlikçiler (Beth Israel Deaconess Tıp Merkezi, Harvard Tıp Okulu) 11,12 tarafından sağlandı.
- F-12 ortamı içinde 25 ml T175 cm kültür CHO-P hücreleri 2 şişe hazırlanmıştır.
- Geçirilmesi için, 4-5 saniye boyunca, 10 ml PBS ile yıkayın ve daha sonra hücreler, tam ortam içinde nötralize ardından 37 ° C'de 3 dakika boyunca 1 x tripsin-EDTA, 10 ml trypsinize.
- Santrifüj hücre süspansiyonu (400 x g, 5 dakika), dikkatli bir şekilde, süpernatan aspire tam ortam içinde 1 ml hücre pelletini ile hücre sayımıBir hemositometre.
2. Entegre Multi-iyi Plate mikroakışkan Sisteminin İşletilmesi
- Tüm ekipman düzgün bağlandığından emin olun ve farklı modülleri açmak: bilgisayar, kontrolör, ters mikroskop ve CCD kamera.
- Görüntüleme yazılımı açın, çoklu-plaka modülü ve görüntüleme modülü düzgün ekranda sunulmaktadır emin olun.
- (Denetleyiciye bağlı) buhar tuzak tüpleri bağlamak ve aynı zamanda onları Basınç Arayüzüne bağlanamıyorum.
- Plaka ısıtıcı / adaptörü, çok oyuklu plaka koyun. Oyuklara (aşağıda tarif edilmiştir) reaktiflerin ilave edin ve plaka üstüne arayüzü ekleyin. Otomatik sahnede görüntüleme için plaka koyun.
- Arayüz plakanın üstüne eklenir ve çok-yuvalı plaka kullanılarak kolaylıkla kontrol tarafından belirlenen akış hızında mikroakışkan kanallardan sıvı, sürücü, kuyu üstüne denetleyicisinden bir pnömatik basınç uygularManuel modu altında modül ekranı.
- Çukurlara arasında yer alan bir gözlem alanı genelinde kanal akışında Reaktifler. Mikroakışkan kanal boyutları 70 mikron boyunda 350 mm genişliğinde x vardır. Doğrusal kanalın uzunluğu 1 mm ve kanalların alt aydınlık faz, floresans ve konfokal mikroskopi ile uyumlu olan bir 180 mikron cam lamel içerir.
- Bir CCD kamera (stream edinimi, 11 kare / sn) kullanarak video Edinme ve uyumlu yazılım aracılığıyla analiz.
3. Bir protein alt-tabakasına ya da bir tekli hücre katmanı ile mikroakışkan Kanallarının Kaplama
- Fibronektin ya da P-/E-selectin ile mikroakışkan kanal kaplama
- PBS içinde 20 ug / ml fibronektin çözeltisi 1 ml hazırlayın. Kaplanacak kanal sayısı (kanal başına fibronektinin 25-50 ul kullanım) göre ses değiştirin.
- De her bir girişine fibronektin çözeltisi 25-50 ul ekleyin. 2 dyn / cm 2 kesme kuvveti uygulayın5 dakika kanalı serpmek için. Sıvı iyi çıkışında görünen boncuk unutmayınız. Oda sıcaklığında 30-45 dakika inkübe
- Kuyulardan çözümü (kanalı besleyen orta daire doğrudan aspire etmeyin) 1,13 aspire. Çıkış kuyuya 200-500 ul PBS ilave edin ve 5 dakika boyunca 2 din / cm 2 makaslama akışı uygulayarak PBS ile kanal yıkayın. Kanal artık düzgün fibronektin ve kullanıma hazır ile kaplanmıştır.
- Yüzey kaplama izin vermek için 37 ° C'de 1 saat inkübasyona bırakıldı ile, yukarıda tarif edildiği gibi P-veya E-sel, PBS içinde arzu edilen insan rekombinant protein, 5 mg / ml çözelti hazırlamak ve kat kat kanalları için.
- Mikroakışkan kanal içinde CHO-P ya da LMVEC tek tabaka oluşturulması
- Yavaşça tam ortam ve santrifüj 2 kat bir hacmi (400 x g, 5 dakika) ile söndürülmesi, 3 dakika boyunca kültür kaplarından Hücreleri tripsinize edin. Tam medya ve santrifüj 10 ml (400 x g'de 5 dakika) ile süspanse edin hücreleri Again.
- Süspansiyon içinde hücre konsantrasyonunu saptamak için hücre sayımı. , Kanal içinde bir konfluent tek tabaka LMVEC oluşumunu sağlamak 15-20000000 hücre / ml hücre konsantrasyonunu getirmek için. Konfluent CHO-P hücre tek tabaka için, 50-60000000 hücre / ml kullanmak. Her bir kanal için hücre süspansiyonu 25-50 ul kullanma - göre deney için kullanılan ilk hücre sayısı belirler.
- De girişine uygun bir konsantrasyonda hücre süspansiyonu 25-50 ul ekleyin. Mikroskop sahnede plakayı ve hücreler tüm dolum kanallar ekranda görülür ve daha sonra akışını durdurmak kadar kanalı (2 dyn / cm 2) içine hücreleri tanıtmak.
- Tam LMVEC veya CHO ortamı ya da 200 ul ile çıkış ve giriş hem de doldurun. Hücreler yerleşmek olsun ve kuluçka makinesi içinde 3 saat için bağlı (37 ° C,% 5 CO2).
- 3 saat inkübasyondan sonra, bağlı olmayan kaldırmak için tam ortam (2 dyn / cm 2, 10-15 dakika) ile kanal yıkayınhücreleri. Hücreler artık tamamen birleşen görünmelidir ve kanal artık kullanıma hazırdır. Başlangıç hücre yoğunluğuna bağlı olarak, bir zaman yerleşen ek 2-3 saat hücreler ile yüzeyin tam kapsama sağlamak için gerekli olabilir.
4. LMVEC Pro-inflamatuar Aktivasyon ve P-/E-selectin antikor tarafından bloke edilmesi
- LMVEC bazal ortam maddesi içinde bir TNF-α çözeltisi (10 ng / ml) hazırlayın.
- , Kanallarda LMVEC inflamatuar aktivasyonuna sebep de girişine TNF-α çözeltisi 100 ul ilave edin ve 5 dakika boyunca 2 din / cm 2 makaslama akışı uygulayarak kanalın içine çözelti tanıtmak. Kontrol kanalları için (etkisizleştirilmiş EC), girişine LMVEC bazal ortam, 100 ul de ekleyin ve kanalı (5 dakika boyunca 2 dyn / cm 2) haline getirmektedir. Kanal artık bir yuvarlanma deneyi için hazır.
- P-sel ve LMVECs ve CHO-P hücrelerinde E-sel engellemek için, P-sel (klon AK4, ba 5 ug / ml nötralize tanıtmaksal ortamı) ya da E-sel (klon P2H3, bazal ortam maddesi içinde 5 ug / ml) antikor kanal içine ve 37 ° C'de 1 saat boyunca inkübe Daha sonra, (5 dakika boyunca 2 dyn / cm 2) bazal ortam ile kanal yıkayın. Kanallar artık yuvarlanan bir tahlil için hazırız.
5. Yüzey / Cep tabakalı-Kaplamalı mikroakışkan Kanallar HL-60 Rolling Deneyi
- Dikkatle kanal uygun bir şekilde (hücreler ile kaplama durumunda, tam olarak tek katlı bir birleşik hücre dikkate alınmalıdır) kaplanmıştır onaylamak için mikroskop altında kanal inceleyin.
- Haddeleme deneyler, santrifüj HL-60 hücre süspansiyonu (400 x g, 5 dakika) için HL-60 hücre süspansiyonu hazırlamak ve bazal ortamı ile bir kere yıkayın. 5.000.000 hücre / ml bir HL-60 hücre süspansiyonu elde etmek üzere (Ca 2 + ve Mg2 + ihtiva eden bazal ortam,) IMDM'de tekrar süspansiyon hücreleri ve sayılır. Haddeleme tahlili gerçekleştirmek için, her bir kanal için hücre süspansiyonu 25-50 ul kullanın.
- Hücre suspe 25-50 ul eklension mikroskop sahnede sıcaklık kontrollü plaka tutucu (37 ° C) ve yer içinde, iyi bir yerde plaka çıkış için. Daha sonra, (hücre girişine çıkışından akan 10-15 saniye içinde dikkat edilmelidir) 2 din / cm 2 makaslama kuvveti uygulanarak kanala hücreleri tanıtmak.
- Makaslama gerilmesinin bir fonksiyonu olarak yuvarlanma tepkisini incelemek için, (5 dyn kadar 0.25 yavaş yavaş kesme artırmak dyn / cm 2 0.25 kesme azaltmak ve istenen her makaslamada ("stream satın alma" fonksiyonunu kullanarak) 20-30 sn video edinmeniz / 2 cm. It) daha yüksek bir makas kullanımı da mümkündür.
- Bir CCD kamera (stream edinimi, 11 kare / sn) kullanarak video Edinme ve uyumlu yazılımı ile yollarını haddeleme ve haddeleme hızları analiz.
6. Yüzey moleküllerinin ekspresyonunu tespit etmek için akış sitometrisi
- Tripsinizasyon sonra, arzu edilen hücre tipi (HL-60, CHO-(1-2 x 10 5 hücre / örnek kullanarak) bir hücre süspansiyonunun hazırlanmasıPBS içinde ya da P LMVECs) (- / -),% 2 FBS ile takviye edilmiştir. Iki kez hücreleri yıkayın ve 50 ul (aynı tampon kullanarak) örnek hacmi getirmek.
- 20 dakika boyunca 4 ° C 'de arzu edilen fluorofor ile konjüge Ab (daha ayrıntılı bilgi için ekli tabloya bakınız) (alüminyum folyo ile kapak) ile her bir örnek inkübe edin.
- Iki kez (aynı tamponu) hücreleri yıkanır ve 200 ul hücre süspansiyonu, lekeli son hacim getirir. Yüzey moleküllerinin ekspresyonunu tespit etmek için bir akış sitometrisi kullanılarak örnekleri analiz edin.
Sonuçlar
HL-60 hücreleri, fibronektin üzerinde P-ve E-selektin rulo yüzeyler üzerinde değil,
Bu haddeleme ligandlann P-glikoprotein sel ligand-1 (PSGL-1) ve Sialil-Lewis X (Slex) gibi güdümlü ligand, bir dizi 5,14 (Şekil 1A salgılarlar HL-60 hücreleri, altın standart "olarak silindirler" olarak kabul edilir .) Ile spesifik etkileşimi aracılık tetra-sakarit Slex için bir iskele olarak yüzey protein PSGL-1 eylemler, P-ve E-sel, iltihaplanma 5,6,15 sırasında endotel üzerinde up-regüle olan. Çok-çukurlu levha mikroakışkan sisteminin yeteneklerini test etmek için, çok sayıda mikroakışkan kanal bu yüzeyler ile analiz edildi farklı alt-tabaka ve HL-60 hücrelerinin haddeleme etkileşimleri ile eş zamanlı olarak kaplanmıştır. HL-60 hücreleri ayrı bir dönme hareketi ile, ardından birinci akımı yakalanan hücreleri ile, P-sel kaplı yüzey üzerine sağlam bir haddeleme davranış sergilemiştir. Şekil 1C 'de gösterildiği ve de oluşmaktadırliteratür ile ent, HL-60 hücreleri, E-sel yüzeylere benzer bir haddeleme davranış sergileyen, henüz fibronektin kaplı alt-tabakalar üzerinde 14,16-19. Uyumlu yazılım aracılığıyla analiz hücre hız, üzerinde hücrelerin sağlam bir yuvarlanma tepki göstererek, kesme strese karşı çizildi P-ve 1-12 mm / sn arasında bir ortalama hız ile E-sel.
HL-60 hücreleri mikroakışkan kanal kaplama CHO-P tabaka üzerinde rulo
Sonra, biz verimli ilgi hücreleri ve yüzey kaplama bir hücre tek tabaka arasındaki etkileşimleri test etmek için bu mikroakışkan sistemi kullanarak fizibilitesini değerlendirmek amaçlanmıştır. Haddeleme işaretlerini ifade eden bir hücre tek tabaka ile HL-60 hücrelerinin etkileşimini incelemek için, kararlı bir şekilde ifade etmek üzere transfekte edilen CHO hücrelerinin P-,-P el değil, E-, sel (Şekil 2A. De temsilcisi Şekil 2B, bakınız mikroakışkan kanal) 11,12 kaplama CHO-P tek tabaka üzerinde HL-60 hücrelerinin görüntüsü. HL-60 hücreleri CHO-P hücreleri üzerinde güçlü bir haddeleme yanıt (Şekil 2C) gösterilir. Bu dönme hareketi gerçekten P-sel tarafından aracılık olup olmadığını test etmek için, CHO-P tek tabaka için bloke edici antikor ile önceden inkübe edilmiş P-ya da önce kanala HL-60 hücrelerinin E-perfüzyon sel, ya da. Ab, P-sel gösteren yüzeyinde HL-60 hücreleri haddeleme sayısında önemli bir azalmaya neden olmuştur, P-sel ile CHO-P bloke tek tabaka, Şekil 2C 'de gösterildiği üzere gerçekten HL-60, daha önce tarif edilen haddeleme aracılık 14,18. Mikroakışkan kanal tahlili yapılması 25 ul kadar az sadece küçük miktarlar kullanılarak, farklı koşulları ve reseptörlerinin etkili bloke hızlı tarama izin verir. İzotip kontrol ya da Ab (CHO-P hücreleri üzerinde ifade edilmediği her hangi) E-sel bloke doğru belirli Surfac doğrudan katılımını pin işaret bu tahlilin gücünü gösteren CHO-P hücreleri üzerinde haddeleme hücre sayısını etkilemedihücresel haddeleme etkileşimleri e belirteçler.
TNF-a-aktive LMVECs on HL-60 hücrelerinin E-selektin Rolling aracılık
Endotel hücreleri enflamasyon 5,6 sitelerine lökositlerin yardımcı, enflamasyon sırasında, örneğin, P-ve E-sel olarak regüle yapışma yüzey markerlerine bilinmektedir. Murin EC interlökin-1 (IL-1) ve tümör nekroz faktörü-α (TNF-α) gibi iltihap uyarıcıya tepki olarak P-ve E-sel iki ifade Bununla birlikte, insan EC sadece bu yanıt olarak E-sel ekspres 20,21 sitokinler. Bu E-sel ifadesini gösteren testte eden akış sitometrisi valide, ancak değildi P-sel, TNF-α stimülasyonu (Şekil 3A) tepki olarak akciğer mikrovasküler endotelyal hücreleri (LMVEC) hakkında. Çok-çukurlu plaka mikroakışkan çok farklı koşullarda daha yüksek verim test sağlayan, çok sayıda ayrı mikroakışkan kanal oluşur. Bu avantajlı bir tasarım elBirden çok hızlı bir şekilde koşullar altında EC'ler ile birlikte HL-60 hücrelerinin etkileşimlerini analiz etmek için mikroakışkan kanal (Şekil 3B) içine LMVECs plaka. Enflamatuar ayarlarını taklit etmek için, LMVECs pro-inflamatuar sitokin, TNF-α ile önceden muamele edilmiştir. İlginç bir şekilde, HL-60 hücreleri, un-aktive LMVECs etkileşim yoktu ve hücreler bu yüzey üzerinde hiç gözlenmemiştir. Aksine, HL-60 hücreleri, 5-15 um / sn 'lik ortalama hız (Şekil 3C) ile, TNF-α-aktive LMVECs üzerinde güçlü bir dönme davranışı sergilemiştir.
Daha sonra HL-60 hücreleri ve aktive LMVECs arasındaki haddeleme etkileşimde P-sel veya E-sel katılımını araştırılması amaçlanmıştır. Bunun için, TNF-α-aktive EC P-sel veya bloke edici antikor E-sel ile önceden inkübe edildi ve HL-60 hücrelerinin haddeleme analiz edilmiştir. TNF-α-aktive LMVECs on up-regüle olan E-sel, bloke etme, Şekil 4A'da gösterildiği gibi, bir signific sonuçlandıAktive olan endotel hücreleri tek tabaka üzerinde yuvarlanan sayısında karınca düşüş. Bunun aksine, aktif EC'ler ifade değildi P-sel, karşı bir izotip kontrolü ya da Ab ile HL-60 aktive edilmiş endotel tabaka üzerinde yuvarlanan üzerinde anlamlı bir etkisi yoktu. Bu veri önceki raporlarda 20,21 ile tutarlı, TNF-α-aktive EC'lere yuvarlanan HL-60 E-sel doğrudan katılımını göstermektedir. Alınan video itibaren, analiz yazılımı alt-tabaka ile etkileşim tek tek hücrelerin yolu izlemek için bir izin verir. Biz özellikle E-sel bloke wo w / TNF-α-aktive EC'ler ile etkileşim tek tek hücrelerin yolunu izlemek için bu özelliği kullanılır. Şekil 4B gösterildiği gibi, engellenmemiş aktive LMVECs üzerindeki hücrelerin haddeleme sayısı aktive EC E-sel-bloke üzerinde önemli ölçüde daha yüksek oldu. Bundan başka, bu engellenmemiş LMVECs on HL-60 dönme hareketi sürekli ve sağlam olduğunu ortaya ise hücrelerin haddeleme yollarıE-sel-bloke EC'lere üzerine (her renk farklı bir hücreyi temsil eder, Şekil 4B gl vs af örnek, hücre için bakınız) parçalanmış oldu. Bu bulgu ile uyumlu olarak, engellenmemiş TNF-α-aktive EC'lere on HL-60 hücrelerinin yuvarlanma hızı E-sel-bloke EC'lere (Şekil 4C) kendi haddeleme hızından daha düşüktü.
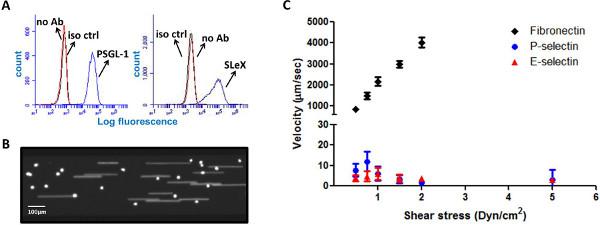
Şekil 1. HL-60 hücreleri, P-ve E-selectin kaplı yüzeylerde rulo. (A) HL-60 hücreleri ifade yuvarlanan ligandlar PSGL-1 ve Slex (Iso ctr - izotop kontrol, hayır Ab - hayır antikor). (B) P-sel on KAKE lekeli HL-60 hücrelerinin Temsilcisi enstantane görüntü akış altında yüzeyi kaplanabilir. (C) HL-60 hücreleri, sağlam P-ve E-sel kaplı yüzeylerde rulo değil, fibronektin kaplı yüzey üzerinde. Rolling hız kesme strese karşı çizilen (n = 10-1 edilirVeri noktası başına 5 hücreleri, hızlar) uyumlu yazılım tarafından analiz edilmiştir. büyük rakam görmek için buraya tıklayın .

Şekil 2. HL-60 CHO-P hücre tekli katmanı üzerinde doğrudan haddeleme P-sel tarafından aracılık edilir. (A) CHO hücreleri, P-P-sel ifade değil, E-sel. (B) mikroakışkan kanal (10 X büyütme) yüzeyini kaplama CHO-P tek tabaka üzerinde HL-60 hücrelerinin Örnek görüntüsü. (C) HL *, CHO-P, bir tek-tabakalı bir izotip kontrolü ile inkübe edilmiş bir antikor, izotip ctr-CHO,-P tek tabaka ile enkübe değildi - Ab engellemesi kaldırıldı (deneyi bloke ile gösterildiği gibi P-CHO tek tabaka üzerinde yuvarlanan -60 hücre doğrudan P-sel tarafından aracılık p <0.05, ANOVA Tukey HSD post-hoc testi ile kullanılan tek yönlü, hata çubukları temsilSEM, n = 3.
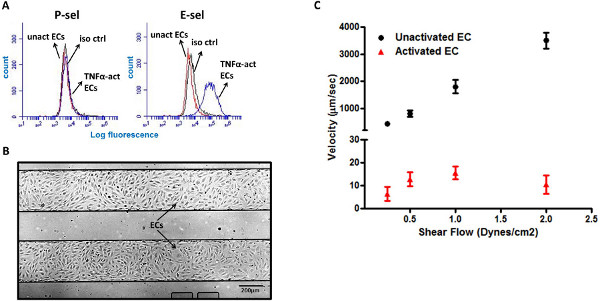
Şekil 3,. HL-60 hücreleri TNF-α-aktive LMVECs rulo. (A) LMVECs of TNF-α aktivasyon E-sel yüzey sentezlenmesinin uyarılması, fakat P-sel. (B), iki mikroakışkan kanal (4X büyütme) içinde birleşik LMVEC tek tabaka temsili görüntüsü. (C) HL-60 hücreleri, sergi TNF-α-aktive LMVECs üzerinde sağlam haddeleme tepki, ancak un aktive LMVECs üzerinde. Iso ctr - izotop kontrol, unact EC - aktive edilmemiş endotel hücreleri, TNF-α-hareket EC -. TNF-α-aktive endotel hücreleri büyük rakam görmek için buraya tıklayın .
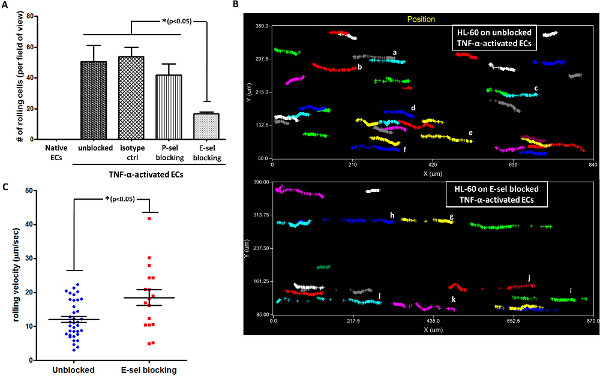 < br /> Şekil 4. HL-60, TNF-α-aktive LMVECs haddeleme E-selektin ile aracılık eder. (A) HL-60 üzerinde yuvarlanan TNF-α-aktive Ab bloke gösterdiği gibi LMVECs, daha çok P-sel göre, E-sel tarafından aracılık Tahlil (İzotipe kontrolü ile inkübe izotip ctr-EC tek tabaka; * p <0.05, ANOVA Tukey HSD post-hoc testi ile kullanılan tek yönlü, hata çubukları SEM temsil etmektedir, n = 3) (B) Hücre yol analizi sürekli ortaya koymaktadır. ve engellenmemiş aktive EC'lere üzerinde HL-60 hücrelerinin sağlam yuvarlanma E-sel-bloke aktive EC'lere gözlenen parçalanmış, zayıf haddeleme kıyasla (her renk farklı bir hücreyi temsil eder. Analizi uygun yazılım aracılığıyla gerçekleştirildi). (C) HL-60 haddeleme TNF-α-aktive EC'lere üzerindeki hız E-sel-bloke aktive EC'lere (kullanılan kayma gerilmesi göre engellenmemiş aktive EC'lere üzerinde yavaştır:. 2 dyn / cm 2 * p <0.05, eşleşmemiş iki kuyruklu t-testi, hata çubukları temsil SEM, grup başına n = 17-36 hücre).www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg "target =" _blank "> büyük rakam görmek için buraya tıklayın.
< br /> Şekil 4. HL-60, TNF-α-aktive LMVECs haddeleme E-selektin ile aracılık eder. (A) HL-60 üzerinde yuvarlanan TNF-α-aktive Ab bloke gösterdiği gibi LMVECs, daha çok P-sel göre, E-sel tarafından aracılık Tahlil (İzotipe kontrolü ile inkübe izotip ctr-EC tek tabaka; * p <0.05, ANOVA Tukey HSD post-hoc testi ile kullanılan tek yönlü, hata çubukları SEM temsil etmektedir, n = 3) (B) Hücre yol analizi sürekli ortaya koymaktadır. ve engellenmemiş aktive EC'lere üzerinde HL-60 hücrelerinin sağlam yuvarlanma E-sel-bloke aktive EC'lere gözlenen parçalanmış, zayıf haddeleme kıyasla (her renk farklı bir hücreyi temsil eder. Analizi uygun yazılım aracılığıyla gerçekleştirildi). (C) HL-60 haddeleme TNF-α-aktive EC'lere üzerindeki hız E-sel-bloke aktive EC'lere (kullanılan kayma gerilmesi göre engellenmemiş aktive EC'lere üzerinde yavaştır:. 2 dyn / cm 2 * p <0.05, eşleşmemiş iki kuyruklu t-testi, hata çubukları temsil SEM, grup başına n = 17-36 hücre).www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg "target =" _blank "> büyük rakam görmek için buraya tıklayın.
Tartışmalar
Eksojen hücre tabanlı tedavi başarılı çevirisinde önemli zorluklardan biri verimli, yüksek verimlilik engraftmınt 3 ile yaralanma ve inflamasyon sitelere hücreleri sunmak için yetersizliğidir. Hücre haddeleme sonunda dokuya 5 içine endotel yoluyla sağlam yapışması ve göçü yol açan, kan damarlarının duvarlarında hücrelerin yavaşlama kolaylaştıran, hücre homing sürecinde kritik bir adım teşkil etmektedir. Aday hücre tipleri için haddeleme işlemi daha iyi anlaşılması hücre homing geliştirmek ve hücre tabanlı tedavi geliştirmeye yönelik önemli katkıda tekniklerinin gelişmesine neden olabilir.
PPFC kesme akışı altında hücre haddeleme, hem de diğer hücre davranışları araştırmak için yaygın olarak kullanılan bir araçtır. Endotel üzerindeki nötrofil yapışmasını incelenmesi için PPFC uygulaması ilk kez 1987 yılında. Lawrence ve arkadaşları tarafından okudu, ve o zamandan beri piyasada mevcut üretimi edildits 8,9 geliştirilmiştir. PPFCs bölmenin 7 boyutlarını kontrol eden bir conta ile ayrılmış iki düz plakalar oluşur. Üst levha, bir şırınga pompası kullanımı ile odacık 7,8 ile hücre süspansiyonu perfüzyon sağlayan bir giriş ve çıkış bağlantı noktası içerir. Birlikte 7 basılı plakaları tutmak için negatif basınç (vakum) uygulanır ilave port vardır. Paralel plaka akış odaları etkili kesme akış koşulları altında hücre haddeleme gibi hücresel yanıtları, araştırmak için kullanılmış olsa da, onun etkinliğini azaltmak sayıda sınırlamalar vardır. Akış gözlerinden önemli bir sınırlama hücreleri ve nedeniyle akış sistemi 7 içinde geniş bir ölü hacme gerekmektedir reaktiflerin büyük hacimlerde yüksek sayıdır. Bir diğer kritik konu kolayca potansiyel hücre tek tabaka ve alt tabaka engellemekle, akış odası montaj esnasında oluşabilecek hava kabarcıklarının varlığı olduğunualt plaka 22 kaplanması. Bununla birlikte, daha fazla değişiklik havanın çıkarılmasını kolaylaştırmak için bir baloncuk tuzağı olarak hareket etmek için, üst plaka üzerinde ilave bir bağlantı noktası dahil etmek için, geleneksel PPCFs yapılmıştır 23, kabarcıklar. PPFC deney kurma da sıkıcı, ve conta hasarlı veya özenle monte ise akış hücresi sızıntı açıktır. Son olarak, düzgün akış oranlarının dar bir aralık içinde arzu edilen sonuçları ve deneysel olarak uygulanan kesme oranları arasında bir fark yoktur. Teorik giriş ve çıkış pozisyonlarını değişen dört PPFCs karşılaştırarak, bu iki yapılandırma% 75'e 24 ile hesaplanan kesme oranları sapmış kesme hızları modellenmiştir bulunmuştur. Aynı bölmeyi yeniden kullanmak için zaman alan bir yıkama basamağını gerektirir ve yukarıda tarif edilen sorunlar ile birlikte bu PPFCs oldukça sıkıcı ve düşük verim sağlar.
Bizim çalışmamızda, tam entegre bir multi-iyi p kullanılırdoğru kontrollü kayma akış 1,2,13 dayanarak geç mikroakışkan sistemi. Bu 48 de mikroakışkan plaka, bir mikroakışkan kanal 1,25 ile bağlı komşu kuyu çiftinin her biri ile 24 mikroakışkan kanal içerir. 10-12 haddeleme deneyler, bir gün içinde birkaç düzine koşullarının hızlı bir biçimde taranmasına izin veren, 1 saat içerisinde gerçekleştirilebilir. Mikroakışkan kanal kolaylıkla, bir protein alt-tabaka ya da hücre mono tabakaları ile kaplanabilir, ve ilgi ve yüzeyin hücreleri arasındaki etkileşim bir CCD kamerası tarafından alınan ve uygun bir yazılım ile analiz bir mikroskop kullanılarak görüntülenebilir. Bu tür hücre ölçümü, haddeleme hızı hesaplanması ve belirli bir parça yol analizi gibi temel parametreleri kolayca verimli çoklu yüzeylerde 13 haddeleme davranışını analiz etmek için elde edilebilir. Bu çalışmada, anahtar ifade, iyi kurulmuş "makara" HL-60 promiyelositik lösemi hücre çizgisi kullanılarak hücre haddeleme okuyan bu sistemin etkinliğini değerlendirmeyebirlikte P-ve E-sel 15,26 için ligandlar olarak hareket muadili gibi PSGL-1 ve Slex olarak haddeleme ligandlar. Önceki raporlar ile korelasyon, HL60 hücrelerinin gerçekten 1-12 mikron / sn 14,17-19 yavaş haddeleme hızları ile, P-ve E-sel-kaplı microfluidic kanalları üzerinde sağlam bir yuvarlanma davranışı sergiledi. HL-60 hücreleri, farklılaşmamış HL-60 hücreleri, 16 fibronektin ile etkileşimleri yapışkan sergilemeyen olduğunu gösteren önceki raporlar ile uyumludur, fibronektin yüzey üzerinde değildi. Kadar olan deneyler, 10-12 / saat sağlayan çok-çukurlu levha mikroakışkan sisteminin tasarımı, PPFCs kullanılarak test edilebilir sadece 1-2 deneyler / saat, önemli ölçüde en az 5 kat artar verimi ile karşılaştırıldığında. Ayrıca, PPFCs daha fazla performans hızını yavaşlatmaya, her yeniden kullanılmadan önce yeniden birleştirilen ve yıkanmasına gerek. Buna ek olarak, kolaylıkla kontrol edilen bir akış, bundan sonra, uygun bir yazılım ile analiz edilebilir kesme bağımlı deneyler, hızlı bir performans sağlar.
Daha sonra süspansiyona eklenir ve kanal kaplama bir tek tabakalı hücre hücrelerarası etkileşimleri keşfetmek bu mikroakışkan sisteminin etkinliğini test etmek için amaçlanmıştır. Bu amaç için, kararlı bir şekilde P-sel (Şekil 2A) 11,12 aşırı ifade etmek üzere transfekte edilen CHO-P, CHO hücreleri kullanılmıştır. HL-60 hücreleri, etkili bir şekilde hücre mono tabakasının bütünlüğünü tehlikeye sokabilir kabarcıkların oluşumunu önleyen bir tasarım sağlanmasına kesme akışı altında, hücre-hücre etkileşimi araştırmak için bu sistemi kullanma yeteneği gösteren CHO-P hücreleri üzerinde önemli bir haddeleme gösterdiler hangi PPFCs 22,23 kullanırken sıklıkla oluşur. Daha sonra, haddeleme işlemi de potansiyel katılımı keşfetmek için P-veya E-sel antikorlar ile CHO-P hücreleri bloke etti. P-sel engelleme önemli ölçüde önceki raporlarda 14,18,20 ile tutarlı HL-60 haddeleme, aracılık P-sel doğrudan katılımını gösteren, CHO-P tek tabaka hücreleri haddeleme sayısını azalttı.E-sel Ab ve izotip kontrol antikor verimli bir şekilde bloke edilmesi, hücre-hücre etkileşimi aracılık eden özel işaretleri tespit etmek için bu mikroakışkan sistemde kullanılabileceğini gösteren CHO-P HL-60 haddeleme üzerinde herhangi bir etki. Önemli bir şekilde, her bir kanal reaktif alıcı PPFC ve tipik büyük ölü hacimleri 7 farklı olarak, bu deney için pahalı Abs ya da bir hücre süspansiyonu hacmi, sadece minimal, az 25-50 kadar ul gerektirir.Önümüzdeki HL-60 hücreleri ve EC mikroakışkan kanal kaplama arasındaki etkileşimleri analiz ederek, bu çok iyi bir plaka sistemi test etti. EC ifade P-ve E-sel enflamatuvar süreç 5 sırasında bilinmektedir. Inflamatuar bir uyaran ile ECS sağlamak için, TNF-α ile muamele edilmiş. E-sel up-regüle iken, P-sel, literatür insan EC E-sel ifade değil, P-sel, TNF-α aktivasyonuna yanıt olarak primat P-sel promoter TNF yoksun tarihi gösteren tutarlı değildi -α yanıt elemanları, resuSadece E-sel 20,21 transkripsiyonel indüklenmesinde lting. İltihaplı koşulların ardından EC yüzeyi ile etkileşimi araştırmak için HL-60 hücre perfüzyonu ardından, TNF-α, AT tek tabaka inkübe edilerek kanal içinde simüle edilmiştir. HL-60 aktive edilmemiş EC'ler ile etkileşim yoktu, literatürde 22 kendi bilgi tepki ile korelasyon TNF-α-aktive EC'ler (Şekil 3C) üzerine sağlam bir haddeleme tepkisi görüntüler yaptı. Ab deneyleri (Şekil 4A) bloke sonra E-sel, fakat P-sel, aktive edilmiş EC'ler üzerinde yuvarlanan HL-60 belirgin bir azalma ile sonuçlandı engelleme gösterdi. Bu veriler E-sel doğrudan katılımını göstermek, ve TNF-α-aktive insan EC'lere 20,21 üzerinde HL-60 haddeleme arabuluculuk değil P-sel,. Ab tersine P-sel-aracılı CHO-P haddeleme vs aktive EC'lere on E-sel-aracılı haddeleme gösteren deneyler engelleme, ayrıca Ab blocki fizibilitesini ve alaka doğrularng deneyler hızla bu mikroakışkan sisteminde gerçekleştirilir. İlginç bir şekilde, haddeleme, bu inhibisyonu, VCAM-1 gibi diğer yüzeyi reseptörleri, aynı zamanda aktive edilmiş EC'ler 27 üzerinde yuvarlanan HL-60 katılmak düşündürmektedir (yaklaşık% 70 azalma) tam değildi. İz yol analizi diğer ilginç bir fenomen ortaya - engellenmemiş aktive EC'lere üzerinde HL-60 haddeleme sürekli ve güçlü iken, hala e-sel haddelenmiş hücre sayısının düşük EC (bloke EC'lere üzerinde parçalanmış bir yuvarlanma yolu görüntülenir aktif bloke Şekil 4B). Bu olgu, P-bloke sel veya bir izotip kontrolü (veriler gösterilmemiştir) ile inkübe EC'ler gözlenmedi. Bu güçlü EC E-sel bloke olduğunda bir yuvarlanma tepki diğer belirteçler ile mümkün iken, bu haddeleme aktive EC'lere 5,22 sadece gevşek, kısmi haddeleme yanıt destekleyen, zayıf, kısmi HL-60-EC etkileşimlerine dayanır düşündürmektedir ,27-29. Bu, Şekil 4C'de gösterilen verilerle desteklenmektedir , E-sel-bloke aktive EC'lere kendi haddeleme göre engellenmemiş aktive EC'lere üzerinde HL-60 hücrelerinin önemli ölçüde daha yavaş yuvarlanması gösteren E-sel-bloke EC'lere üzerinde zayıf bir yuvarlanma tepki gösteren. Çok-çukurlu levha mikroakışkan sistemi kullanılarak yerine PPFC doğru, kesme akışı kontrol kabarcıklar kaçınarak ve Abs ve hücrelerin sadece minimum miktarlar kullanırken bize, hızlı bir şekilde hassas HL60-EC deneyler bırakıldı. Hücre haddeleme uygulamalar için Mikroakiskan avantajlı kullanımı, daha önce 30-33 gösterdi, ve burada sunulan çok oyuklu bir plaka sistemi ile Mikroakiskan akımının geliştirilmesi edilmiş, biraz daha özeti karşı önemli bir yuvarlanma özellikleri etkin ve kesin bir analizi için bu teknolojinin potansiyel tedavi uygulamaları geliştirilmiştir .
Bu çalışma, HL-60 hücre ile fizyolojik olarak uygun ve doğru bir şekilde kontrol edilen kesme akışı altında, protein alt tabakaları ve hücre tekli katmanları üzerinde yuvarlanan incelenmesi üzerine odaklanmıştırbir çok-yuvalı plaka mikroakışkan sistemi. Benzer şekilde, başka hücre tipleri ve diğer alt-tabakalar / hücre mono tabakaları kolayca, yuvarlanma özelliklerini incelemek için kullanılabilir. Kullanımı ve basit bir analiz kolaylığı önemli yuvarlanma özellikleri ve farklı büyüme faktörlerinin inhibitörleri ile ya da antikor ya da aktivasyonu bloke haddeleme yanıt olarak moleküler belirteçlerin potansiyel katılımı keşfetmek için kullanılabilen bir hassas analiz izin verir. Bu kök hücre bazlı tedavi 34-36 iyileştirmek için tasarlanmış olabilir kök hücre haddeleme ve homing, okuyan karşı özellikle faydalı olabilir. Önemli olarak, birden çok şekli plaka tasarımı nedeniyle haddeleme özellikleri hızlı ve etkili bir çalışma izin, geliştirilmiş verim (PPFCs genel 5-10 kat daha fazla) ile test edilebilir. , Hücre yapışması, kemotaksi ve göçü gibi hücre homing hakkında diğer deneyler, aynı zamanda bu sistemi 1,10,13 kullanılarak incelenebilir. Genel olarak, bu mikrofluidik sistem hücre haddeleme ve s incelemek için güçlü bir teknik olarak ortayahould eksojen hücre bazlı tedavisinin klinik çeviri yardımcı olmak için yararlı bir araç olarak hizmet eder.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan ederim.
Teşekkürler
CHO-P hücreleri Dr Barbara Furie (Beth Israel Deaconess Tıp Merkezi, Harvard Tıp Okulu) bir tür hediye edildi. Bu çalışma JMK Bu çalışma aynı zamanda JMK bir Movember-Prostat Kanseri Vakfı Yarışması Ödülü tarafından kısmen desteklenen Sağlık hibe HL095722 Ulusal Enstitüsü tarafından desteklenen
Malzemeler
| Name | Company | Catalog Number | Comments |
| Human Lung Microvascular Endothelial Cells | Lonza | CC-2527 | |
| P-selectin-expressing Chinese Hamster Ovary Cells (CHO-P) | Kind gift by Dr. Barbara Furie11,12 | ||
| HL-60 Cells | ATCC | CCL-240 | |
| Cell Culture Reagents | |||
| Endothelial Basal Medium | Lonza | CC-3156 | |
| EBM-2 Media | Lonza | CC-3156 | |
| Endothelial Basal Medium Supplements | Lonza | CC-4147 | |
| EGM-2 MV SingleQuots | Lonza | CC-4147 | |
| IMDM - Iscove's Modified Dulbecco's Medium 1x | Gibco | 12440 | |
| F-12 (1x) Nutrient Mixture (Ham) | Gibco | 11765-054 | |
| Penicillin Streptomycin (P/S) | Gibco | 15140 | |
| L-Glutamine (L/G) 200 mM | Gibco | 25030 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | Sa550 | |
| Petri Dishes | BD Falcon | BD-353003 | |
| 100 mm Cell Culture Dish, Tissue-Culture Treated Polystyrene | |||
| Centrifuge Tubes (15 ml polypropylene conical tubes) | MedSupply Partners | TC1500 | |
| T75 Flasks | BD Falcon | 353136 | |
| Gelatin Solution (2%) | Sigma | G1393 | |
| dPBS (without calcium chloride and magnesium chloride) | Sigma | D8537 | |
| Trypsin-EDTA Solution (10x) | Sigma | T4174 | |
| Antibodies | |||
| Anti-hE-Selectin/CD62E | R&D Systems | BBA21 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA21 | |
| Anti-hP-Selectin | R&D Systems | BBA34 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA34 | |
| FITC Mouse IgG1 κ Isotype Control | BD Bioscience | 555748 | |
| Anti-SLeX /CD15s Ab, Clone: 5F18 | Santa Cruz | SC70545 | |
| FITC Conjugated | Santa Cruz | SC70545 | |
| Normal Mouse IgM-FITC Isotype Control | Santa Cruz | SC2859 | |
| PE Mouse Anti-Human CD162, Clone: KPL-1 | BD Pharmingen | 556055 | |
| PE Mouse IgG1 k Isotype Control | BD Pharmingen | 550617 | |
| Anti-P-Selectin Ab (AK4) | Santa Cruz | SC19996 | |
| Anti-E-Selectin Ab, Clone P2H3 | Millipore | MAB2150 | |
| Mouse IgG1 Isotype Control | Santa Cruz | SC3877 | |
| Other Reagents | |||
| Recombinant Human TNF-alpha | PeproTech | 300-01A | |
| Cell Trace CFSE Cell Proliferation Kit - For Flow Cytometry | Invitrogen | C34554 | |
| Human P-selectin-FC recombinant protein | R&D Systems | 137-PS-050 | |
| Human E-selectin-FC recombinant protein | R&D Systems | 724-ES-100 | |
| Fibronectin Human, Plasma | Invitrogen | 33016-015 | |
| Equipment | |||
| Bioflux 1000 | Fluxion Biosciences | Bioflux Montage was the software used to run the experiments and analyze the data | |
| BioFlux 48-well plates | Fluxion Biosciences | ||
| BD Accuri C6 Flow Cytometer | BD Bioscience | CFlow Plus was the software used to run the experiments and analyze the data | |
| Nikon Eclipse Ti-S | Nikon | ||
| CoolSnap HQ2 CCD camera | Photometrics | ||
Referanslar
- Conant, C. G., et al. Well plate microfluidic system for investigation of dynamic platelet behavior under variable shear loads. Biotechnol. Bioeng. 108, 2978-2987 (2011).
- Conant, C. G., Schwartz, M. A., Ionescu-Zanetti, C. Well plate-coupled microfluidic devices designed for facile image-based cell adhesion and transmigration assays. J. Biomol. Screen. 15, 102-106 (2010).
- Ankrum, J., Karp, J. M. Mesenchymal stem cell therapy: Two steps forward, one step back. Trends Mol. Med. 16, 203-209 (2010).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4, 206-216 (2009).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Ley, K. The role of selectins in inflammation and disease. Trends Mol. Med. 9, 263-268 (2003).
- Sperandio, M., Pickard, J., Unnikrishnan, S., Acton, S. T., Ley, K. Analysis of leukocyte rolling in vivo and in vitro. Methods Enzymol. 416 (06), 346-371 (2006).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunol. 2, 9 (2001).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Conant, C. G., Schwartz, M. A., Nevill, T., Ionescu-Zanetti, C. Platelet adhesion and aggregation under flow using microfluidic flow cells. J. Vis. Exp. (10), e1644 (2009).
- Furie, B., Furie, B. C. Role of platelet P-selectin and microparticle PSGL-1 in thrombus formation. Trends Mol. Med. 10, 171-178 (2004).
- Tchernychev, B., Furie, B., Furie, B. C. Peritoneal macrophages express both P-selectin and PSGL-1. J. Cell Biol. 163, 1145-1155 (2003).
- Conant, C. G., et al. Using well-plate microfluidic devices to conduct shear-based thrombosis assays. J Lab Autom. 16, 148-152 (2011).
- Larsen, G. R., et al. P-selectin and E-selectin. Distinct but overlapping leukocyte ligand specificities. J. Biol. Chem. 267, 11104-11110 (1992).
- Varki, A. Selectin ligands: will the real ones please stand up. J. Clin. Invest. 100, S31-S35 (1997).
- Bohnsack, J. F., Chang, J. Activation of beta 1 integrin fibronectin receptors on HL60 cells after granulocytic differentiation. Blood. 83, 543-552 (1994).
- Lawrence, M. B., Kansas, G. S., Kunkel, E. J., Ley, K. Threshold levels of fluid shear promote leukocyte adhesion through selectins (CD62L,P,E). J. Cell Biol. 136, 717-727 (1997).
- Moore, K. L., et al. P-selectin glycoprotein ligand-1 mediates rolling of human neutrophils on P-selectin. J. Cell Biol. 128, 661-671 (1995).
- Lawrence, M. B., Springer, T. A. Neutrophils roll on E-selectin. J Immunol. 151, 6338-6346 (1993).
- Yao, L., et al. Divergent inducible expression of P-selectin and E-selectin in mice and primates. Blood. 94, 3820-3828 (1999).
- Sackstein, R. Glycoengineering of HCELL, the human bone marrow homing receptor: sweetly programming cell migration. Ann. Biomed. Eng. 40, 766-776 (2012).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of physiologic E-selectin-mediated leukocyte rolling on microvascular endothelium. J. Vis. Exp. , e1009 (2009).
- Muller, W. A., Luscinskas, F. W. Assays of transendothelial migration in vitro. Methods Enzymol. 443, 155-176 (2008).
- Bakker, D. P., vander Plaats, A., Verkerke, G. J., Busscher, H. J., vander Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Appl. Environ. Microbiol. 69, 6280-6287 (2003).
- Benoit, M. R., Conant, C. G., Ionescu-Zanetti, C., Schwartz, M., Matin, A. New device for high-throughput viability screening of flow biofilms. Appl. Environ. Microbiol. 76, 4136-4142 (2010).
- Varki, A. Selectin ligands. Proc. Natl. Acad. Sci. U.S.A. 91, 7390-7397 (1994).
- Ramos, C. L., et al. Direct demonstration of P-selectin- and VCAM-1-dependent mononuclear cell rolling in early atherosclerotic lesions of apolipoprotein E-deficient mice. Circ. Res. 84, 1237-1244 (1999).
- Yago, T., et al. Core 1-derived O-glycans are essential E-selectin ligands on neutrophils. Proc. Natl. Acad. Sci. U.S.A. 107, (2010).
- Yago, T., et al. E-selectin engages PSGL-1 and CD44 through a common signaling pathway to induce integrin alphaLbeta2-mediated slow leukocyte rolling. Blood. 116, 485-494 (2010).
- Simone, G., et al. Cell rolling and adhesion on surfaces in shear flow. A model for an antibody-based microfluidic screening system. Microelectronic Eng. 98, 668-671 (2012).
- Perozziello, G., et al. Microfluidic devices modulate tumor cell line susceptibility to NK cell recognition. Small. 8, 2886-2894 (2012).
- Perozziello, G., et al. Microfluidic biofunctionalisation protocols to form multivalent interactions for cell rolling and phenotype modification investigations. Electrophoresis. , (2013).
- Simone, G., et al. A facile in situ microfluidic method for creating multivalent surfaces: toward functional glycomics. Lab Chip. 12, 1500-1507 (2012).
- Sarkar, D., et al. Engineered cell homing. Blood. 118, e184-e191 (2011).
- Cheng, Z., et al. Targeted Migration of Mesenchymal Stem Cells Modified With CXCR4 Gene to Infarcted Myocardium Improves Cardiac Performance. Mol. Ther. 16, 571-579 (2008).
- Enoki, C., et al. Enhanced mesenchymal cell engraftment by IGF-1 improves left ventricular function in rats undergoing myocardial infarction. Int. J. Cardiol. 138, 9-18 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır