Method Article
Análisis sistemático de
En este artículo
Resumen
En este estudio se utilizó un sistema de microfluidos placa de múltiples pocillos, aumentando significativamente el rendimiento de los estudios de laminación celular bajo flujo cortante fisiológicamente relevante. Dada la importancia de la laminación celular en la célula de múltiples pasos homing cascada y la importancia de homing de las células después de la entrega sistémica de las poblaciones de células exógenas en los pacientes, este sistema ofrece un potencial como una plataforma de cribado para mejorar la terapia basada en células.
Resumen
Un reto importante para la terapia basada en células es la incapacidad para apuntar sistémicamente una gran cantidad de células viables con una alta eficiencia a los tejidos de interés después de la infusión intravenosa o intraarterial. En consecuencia, el aumento de homing de células se estudia en la actualidad como una estrategia para mejorar la terapia celular. Celular a rodar sobre el endotelio vascular es un paso importante en el proceso de homing de las células y se puede probar in vitro usando una cámara de flujo de placas paralelas (PPFC). Sin embargo, esta es una, ensayo bajo rendimiento extremadamente tedioso, con condiciones de flujo mal controlados. En lugar de ello, se utilizó un sistema de microfluidos placa de múltiples pocillos que permite el estudio de las propiedades de laminación celular en un rendimiento superior bajo controlada con precisión, por flujo de cizallamiento fisiológicamente relevante 1,2. En este trabajo, se muestra cómo las propiedades de rodadura de HL-60 (leucemia promielocítica humana) en las superficies de las células E-selectina recubierto P-y al igual que en las superficies de una sola capa con recubrimiento de células pueden ser readilY examinó. Para simular mejor las condiciones inflamatorias, la superficie del canal microfluídico se revistió con células endoteliales (EC), que luego se activaron con factor de necrosis tumoral-α (TNF-α), aumentando significativamente interacciones con células HL-60 bajo condiciones dinámicas. El rendimiento mejorado y multi-plataforma de análisis de parámetros de software integrado, que permite un rápido análisis de parámetros tales como la laminación velocidades y el camino de rodadura, son ventajas importantes para evaluar las propiedades de celda Rolling In-vitro. Permitiendo el análisis rápido y preciso de los enfoques de ingeniería diseñados para impactar de laminación celular y homing, esta plataforma puede ayudar a la terapia basada en células exógeno antelación.
Introducción
Uno de los principales retos en la traducción clínica de éxito de la terapia basada en células es la entrega ineficiente o la orientación de las células infundidas por vía sistémica a los sitios deseados 3,4. En consecuencia, hay una búsqueda constante de métodos para mejorar homing de células y célula específicamente a rodar, como una estrategia para mejorar la terapia celular. Celular rodando en los vasos sanguíneos es un paso clave en la cascada de homing de células, clásicamente definida para los leucocitos que son reclutados a sitios de la enfermedad 5. Este paso se rige por interacciones específicas entre las selectinas del endotelio, es decir, P-y E-selectina sus ligandos contador en la superficie de los leucocitos 5,6 (P-y E-SEL), y. Una mejor comprensión y una mejor eficiencia de homing de las células, y específicamente la etapa de laminación, son de gran importancia en la búsqueda de nuevas plataformas para mejorar la terapia basada en células. Hasta la fecha esto se ha logrado mediante el uso de cámaras de flujo de placa paralelos (PPFCs), que comprende dos plat planaES con una junta entre ellos, con un puerto de flujo de entrada y flujo de salida situado en la placa superior, a través del cual una suspensión de células se perfunde mediante el uso de una bomba de jeringa de 7,8, 9. La superficie de la placa inferior puede estar recubierto con una monocapa de células / sustratos relevantes y la interacción entre las células perfundidos y la superficie bajo flujo de cizallamiento es entonces exploró 7. Sin embargo, PPFC es un rendimiento bajo, reactivo de consumo y el método bastante tedioso, con la formación de burbujas, las fugas, y el flujo de un mal control de la presentación de los principales inconvenientes.
Una técnica alternativa a la PPFC tradicional es un sistema de microfluidos placa de múltiples pocillos, lo que permite un mayor rendimiento rendimiento de ensayos celulares (hasta 10 veces más alta que PPFCs) bajo, flujo preciso de cizallamiento controlado por ordenador, con un bajo consumo de reactivos 1,10. Experimentos de rodadura de la célula se llevan a cabo dentro de los canales microfluídicos, que puede ser recubierto con monocapas de células o sustratos de ingeniería y la imagen USIng un microscopio, con propiedades de rodadura analizó fácilmente utilizando un software adecuado. En este estudio, hemos demostrado las capacidades de este sistema de microfluidos placa de múltiples pocillos mediante el estudio de las propiedades de rodadura de (HL-60) las células en diferentes superficies de la leucemia promielocítica humana. HL-60 que rueda sobre sustratos como, se analizó P-y E-SEL, así como sobre monocapas de células que expresan diferentes receptores de rodadura. Además, el anticuerpo (Ab) de bloqueo se utiliza para demostrar la participación directa de selectinas específicos en la mediación del movimiento de rodadura de HL-60 en esas superficies. Experimentos de laminación se realizaron con mayor rendimiento, bajo un flujo estable al cizallamiento, con el mínimo consumo de reactivos / célula, permitiendo el análisis eficiente de los parámetros de rodadura clave como la velocidad de rotación, el número de células que ruedan y ruedan propiedades de la ruta.
Protocolo
1. Cultivo Celular
- Células (HL-60) leucemia promielocítica humana
- Cultura células HL-60 en 75 cm 2 frascos con 15 ml de Iscove modificado de Dulbecco Medio (IMDM), suplementado con 20% (v / v) de suero bovino fetal (FBS), 1% (v / v) L-glutamina y 1 % (v / v) penicilina-estreptomicina.
- Cambio de medio cada 3 días por aspiración de la mitad del volumen de suspensión celular y su sustitución por medios IMDM completo.
- Para diacetato de carboxifluoresceína, succinimidil éster (CFSE) tinción, centrífuga de HL-60 suspensión de células (400 x g, 5 min), se resuspende en una solución 1 M de CFSE (preparado en PBS precalentado) e incubar durante 15 min a 37 ° C. Luego centrifugar las células, se aspira el sobrenadante y volver a suspender las células en medio fresco y precalentado durante 30 minutos. Lavar las células en PBS y luego usar para experimentos de rodadura (véase Figura 1B para una imagen representativa de la tinción con CFSE células HL-60 en la superficie P-sel-revestido).
Nota: tinción CFSE es opcional, y se presenta aquí para demostrar el fenómeno de rodadura en el canal de microfluidos. Análisis de parámetros de rodadura presentados en este manuscrito se realizó en células no teñidas utilizando imágenes de campo claro estándar.
- Células endoteliales microvasculares de pulmón (LMVECs)
- Coat 100 mm placas de Petri con solución de gelatina al 0,1% (v / v en PBS) y se incuba a 37 ° C durante al menos 30 min.
- LMVECs Cultura en 100 mm placas de Petri recubiertas con gelatina en medio completo de crecimiento endotelial (medio basal endotelial-2 (EBM-2)), suplementado con un kit específico suplemento de crecimiento, ver REACTIVOS). Cambie los medios cada dos células sub-cultura día y al llegar a un 80-90% de confluencia.
- Por sub-cultura, lavar las células con PBS y luego separar las células con 4 ml de 1x Tripsina-EDTA durante 3 min a 37 ° C y neutralizar en un volumen igual de completos EBM-2 medios de comunicación. Transferir la suspensión celular a un tubo de 15 ml y centrifugE (400 xg, 5 min). Después de la centrifugación, se resuspende el sedimento en 1 ml de medios completos endoteliales y contar las células con un hemocitómetro. No se exceda en el paso de las células, ya que esto afecta a su morfología y función del uso de sólo las células bajo el paso 7 para todos los experimentos.
- Ovario de hámster chino-P-selectina (CHO-P) Células
- Células CHO-P, los cuales son células CHO transfectadas establemente para expresar P-sel humana, fueron proporcionados por los colaboradores (Beth Israel Deaconess Medical Center, Harvard Medical School) 11,12.
- Cultura células CHO-P en T175 cm 2 frascos de 25 ml de F-12 medios de comunicación.
- Para los pases, lavar las células con 10 ml de PBS durante 4-5 seg y luego trypsinize en 10 ml de 1x Tripsina-EDTA durante 3 min a 37 ° C, seguido de neutralización en medios completos.
- Centrifugar la suspensión celular (400 xg, 5 min), aspirar cuidadosamente el sobrenadante, resuspender el sedimento celular en 1 ml de medio completo y el recuento de las células conun hemocitómetro.
2. Funcionamiento del sistema de microfluidos integrado Multi-así placa
- Asegúrese de que todo el equipo está conectado correctamente y encienda los diferentes módulos: ordenador, controlador, microscopio invertido, y de la cámara CCD.
- Abra el software de imagen, asegúrese de que el módulo de placas de pocillos múltiples y el módulo de imagen están debidamente presentados en la pantalla.
- Conectar los tubos a la trampa de vapor (conectado al controlador) y también se conectan a la interfaz de presión.
- Coloque la placa de múltiples pocillos en la placa de calefacción / adaptador. Añadir los reactivos a los pocillos (descritos a continuación) y adjuntar interfaz en la parte superior de la placa. Coloque la placa para la imagen en el escenario automatizado.
- La interfaz se conecta a la parte superior de la placa y se aplica una presión neumática desde el controlador a la parte superior de los pozos, la conducción del fluido a través de los canales de microfluidos en la tasa de flujo definido, fácilmente controlado utilizando la placa de múltiples pocillospantalla del módulo en el modo Manual.
- Reactivos en el canal de flujo a través de un área de observación, situada entre los pozos. Dimensiones del canal de microfluidos son 350 m de ancho x 70 m de altura. La longitud del canal lineal es 1 mm y la parte inferior de los canales comprende un vidrio cubreobjetos 180 micras, que es compatible con campo claro, de fase, de fluorescencia y microscopía confocal.
- Adquirir vídeos con una cámara CCD (adquisición arroyo, 11 cuadros / seg) y analizar a través de software compatible.
3. Recubrimiento de canales de microfluidos con un sustrato de proteína o una monocapa de células
- Revestimiento canal de microfluidos con fibronectina o P-/E-selectin
- Preparar 1 ml de 20 mg solución de fibronectina ml / en PBS. Alter volumen basado en el número de canales a recubrir (utilizar 25-50 l de fibronectina por canal).
- Añadir 25-50 l de solución de fibronectina a cada entrada bien. Aplicar fuerza de corte de 2 dyn / cm 2durante 5 min para perfundir el canal. Tenga en cuenta el talón de líquido que aparece en la salida también. Se incuba durante 30-45 minutos a temperatura ambiente
- Aspirar la solución de los pozos (no aspirar directamente desde el círculo central que alimenta el canal) 1,13. Añadir 200-500 l de PBS en el tomacorriente bien y lavar con PBS canal mediante la aplicación de flujo de cizallamiento de 2 dyn / cm 2 durante 5 min. El canal está ahora revestido adecuadamente con fibronectina y listo para ser utilizado.
- Para recubrir con P-o E-sel, preparar una solución de 5 mg / ml de la proteína recombinante humana deseada en PBS, y revista las canales como los descritos anteriormente, con 1 hora de incubación a 37 ° C para permitir revestimiento de la superficie.
- Creación de CHO-P o LMVEC monocapa en el interior del canal de microfluidos
- Trypsinize suavemente las células de placas de cultivo durante 3 min, se inactiva utilizando un volumen de 2 veces de medios completos y centrifugar (5 min a 400 xg). Resuspender las células con 10 ml de medio completo y centrifugar (5 min a 400 xg) again.
- Contar las células para determinar la concentración de células en la suspensión. Para asegurar la formación de una monocapa confluente LMVEC el interior del canal, llevar la concentración de células 15-20 millones de células / ml. Para una monocapa confluente de células CHO-P, utilizar 50 hasta 60 millones de células / ml. Utilice 25-50 l de suspensión de células para cada canal - determinar el número de células inicial utilizado para el experimento en consecuencia.
- Añadir 25-50 l de suspensión celular en la concentración apropiada a la entrada así. Coloque la placa en la platina del microscopio e introducir las células en el canal (2 dyn / cm 2) hasta que se observan células en la pantalla de llenar los canales enteras, y luego se detiene el flujo.
- Llene las dos salida y la entrada con 200 l de cualquiera LMVEC completo o medio CHO. Deje que las células se asientan y se adhieren durante 3 horas en la incubadora (37 ° C, 5% de CO 2).
- Después de la incubación de 3 horas, lavar el canal con plena medios de comunicación (2 dyn / cm 2, 10-15 min) para eliminar desapegadocélulas. Las células deben aparecer ahora completamente confluentes y el canal ya está listo para su uso. Dependiendo de la densidad inicial de la siembra de células, 2-3 horas adicionales de tiempo de establecimiento puede ser necesaria para asegurar una cobertura completa de la superficie con las células.
4. LMVEC activación Pro-inflamatorios y anticuerpo bloqueante de P-/E-selectin
- Preparar una solución de TNF-α (10 ng / ml) en LMVEC medio basal.
- Para inducir la activación inflamatoria de LMVEC en los canales, añadir 100 l de la solución de TNF-α a la entrada y así introducir la solución en el canal mediante la aplicación de flujo de cizallamiento de 2 dyn / cm 2 durante 5 min. Para los canales de control (EC no activado), añadir 100 l de LMVEC medio basal a la entrada y así introducir en el canal (2 dyn / cm 2 durante 5 min). Canal está ahora listo para un ensayo de rodadura.
- Para bloquear el P-sel y E-sel en LMVECs y células CHO-P, la introducción de neutralizar P-sel (AK4 clon, 5 g / ml en basal de medios) o E-sel (P2H3 clon, 5 g / ml en medio basal) anticuerpos en el canal y se incuban durante 1 hora a 37 ° C. A continuación, lavar canales con medio basal (2 dyn / cm 2 durante 5 min). Canales ya están listos para un ensayo de rodadura.
5. HL-60 Ensayo de balanceo en Sustrato / Teléfonos monocapa-Coated canales de microfluidos
- Examine cuidadosamente los canales bajo el microscopio para confirmar que los canales están revestidos adecuadamente (en el caso de revestimiento con células, se debe observar una monocapa celular confluente totalmente).
- Para preparar HL-60 suspensión de células para los experimentos rodantes, centrífuga HL-60 suspensión de células (5 min a 400 xg) y lavar una vez con medio basal. Contar las células y resuspender en IMDM (medios basales, que contienen Ca 2 + y Mg 2 +) para crear una suspensión de células HL-60 con 5 millones de células / ml. Utilice 25-50 l de suspensión de células para cada canal para realizar el ensayo de rodadura.
- Añadir 25-50 l de la suspe celularnsion a una toma de corriente, así, el lugar dentro de la placa de soporte de la placa a temperatura controlada (37 º C), y meterlo en la platina del microscopio. A continuación, introducir células en el canal mediante la aplicación de fuerza de corte de 2 dyn / cm 2 (células deben ser observados dentro de 10 a 15 segundos que fluye desde la salida a la entrada).
- Para examinar la respuesta de laminación en función de la tensión de corte, reducir la cizalladura de 0,25 dinas / cm 2 y adquirir vídeos 20-30 seg (mediante la función de "adquisición stream") en cada uno de cizallamiento deseada (aumentar la cizalladura gradualmente desde 0,25 hasta 5 dyn / cm 2. También es posible utilizar tijeras superiores).
- Adquirir vídeos con una cámara CCD (adquisición arroyo, 11 cuadros / seg) y analizar ondulantes caminos y rodantes velocidades a través del software compatible.
6. La citometría de flujo para detectar la expresión de moléculas de superficie
- Después de tripsinización, preparar una suspensión de células (de 1-2 x 10 5 células / muestra) de tipo celular deseado (HL-60, CHO-P o LMVECs) en PBS (- / -), suplementado con 2% de FBS. Lavar las células dos veces y se ajusta el volumen de la muestra de 50 l (utilizando el mismo tampón).
- Incubar cada muestra con el fluoróforo conjugado Ab deseada (véase el cuadro adjunto para obtener información detallada) a 4 ° C durante 20 minutos (cubrir con papel de aluminio).
- Lavar las células dos veces (mismo tampón) y llevar el volumen final de la suspensión de células teñidas a 200 l. Analizar las muestras usando un citómetro de flujo para detectar la expresión de moléculas de superficie.
Resultados
HL-60 células rodar sobre superficies P-y E-selectina, pero no en la fibronectina
HL-60 células se consideran "rodillos" estándar de oro ya que expresan una variedad de ligandos mensajeras, incluyendo los ligandos de rodadura P-sel de glicoproteína ligando-1 (PSGL-1) y Sialyl-Lewis X (SLeX) 5,14 (Figura 1A ). Las proteínas de superficie PSGL-1 actúa como un andamio para el tetra-sacárido SLeX, que median la interacción específica con P-y E-sel, que están regulados en el endotelio durante la inflamación 5,6,15. Para probar las capacidades del sistema de microfluidos placa de múltiples pocillos, numerosos canales de microfluidos se recubrieron simultáneamente con diferentes sustratos y las interacciones de rodadura de células HL-60 se analizaron con esas superficies. Células HL-60 exhibieron un comportamiento de giro en la superficie robusta P-SEL recubiertos, con células capturadas primera de flujo, seguido por un movimiento de rodadura distinta. Como se muestra en la Figura 1C, y consistenENT con la literatura, células HL-60 exhiben un comportamiento de giro similar sobre superficies E-sel, aún no sobre sustratos recubiertos de fibronectina 14,16-19. Velocidad de la célula, analizado a través de software compatible, se representó frente a la tensión de cizallamiento, que muestra una respuesta de laminación robusta de las células en la P-y E-SEL con una velocidad promedio de entre 1-12 m / seg.
Células HL-60 ruedan en CHO-P monocapa recubrir el canal microfluídico
A continuación, se intentó evaluar la viabilidad de utilizar este sistema de microfluidos para probar de manera eficiente las interacciones entre las células de interés y una monocapa de células que recubre la superficie. Para explorar la interacción de las células HL-60 con una monocapa de células que expresa marcadores de rodadura, utilizamos células CHO-P, que se transfectan para expresar de forma estable-P, pero no E-, sel (Figura 2A. También vemos la figura 2B de representante imagen de células HL-60 en la monocapa de CHO-P revestimiento del canal microfluídico) 11,12. HL-60 células muestran una fuerte respuesta de balanceo en células CHO-P (Figura 2C). Para probar si este movimiento de rodadura es, en efecto mediada por P-SEL, la monocapa de CHO-P se preincubó con el bloqueo de anticuerpos, ya sea para P-o E-SEL, antes de la perfusión de células HL-60 en el canal. Como se muestra en la Figura 2C, el bloqueo de la monocapa de CHO-P con un P-SEL Ab resultó en una disminución significativa en el número de rodadura células HL-60 en la superficie, lo que demuestra que P-SEL de hecho media la HL-60 de rodadura como se ha descrito previamente 14,18. Realizar el ensayo en un canal microfluídico permite la detección rápida de diferentes condiciones de bloqueo y eficiente de los receptores mediante el uso de sólo pequeños volúmenes, tan poco como 25 l. Control de isotipo o Ab bloqueando E-sel (que no se expresa en las células CHO-P) no afectó el número de células que ruedan en las células CHO-P, lo que demuestra la fuerza de este ensayo in precisión pin-señalando la participación directa de las superficies en concretoe indicadores en las interacciones celulares rodantes.
Balanceo de células HL-60 en LMVECs TNF-a-activado es mediada por E-selectina
Las células endoteliales son conocidos para los marcadores de superficie regular por incremento de adhesión, tales como P-y E-SEL, durante la inflamación, la asistencia en el reclutamiento de leucocitos a los sitios de inflamación 5,6. Sin embargo, mientras murino EC expresan tanto P-y E-SEL en respuesta a estímulos inflamatorios como la interleuquina-1 (IL-1) y factor de necrosis tumoral-α (TNF-α), ECs humano sólo expresan E-SEL En respuesta a estas citoquinas 20,21. Este fue validado en nuestro citometría de flujo ensayo, que muestra la expresión de E-sel, pero no P-sel, en las células endoteliales microvasculares de pulmón (LMVEC) en respuesta a la estimulación de TNF-α (Figura 3A). La placa de microfluidos con múltiples pocillos se compone de numerosos canales de microfluidos separadas, lo que permite mayor prueba de rendimiento de varias condiciones diferentes. Hemos utilizado este diseño ventajosoa la placa LMVECs el interior de los canales de microfluidos (Figura 3B) para analizar rápidamente las interacciones de las células HL-60 con EC bajo varias condiciones. Para simular la configuración inflamatorias, LMVECs fueron premeditados, con el pro-inflamatoria de citoquinas, TNF-α. Curiosamente, células HL-60 no interactúan con LMVECs ONU-activado, y las células no se observaron a rodar en esta superficie. Por el contrario, células HL-60 muestran un fuerte comportamiento de giro sobre el TNF-α-activado LMVECs, con una velocidad promedio de 5-15 m / seg (Figura 3C).
Entonces nos propusimos explorar la participación de P-sel o E-sel en la interacción de rodadura entre las células HL-60 y los LMVECs activados. Para esto, el TNF-α-activado ECs fueron preincubadas con P-SEL o anticuerpos bloqueantes E-SEL, y se analizó la rodadura de células HL-60. Como se muestra en la figura 4A, el bloqueo de E-sel, que fue hasta reguladas en el TNF-α activada LMVECs, se tradujo en un significdisminución de hormigas en el número de células que rueda sobre la monocapa endotelial activada. En contraste, el uso de un control de isotipo o un Ab contra la P-SEL, que no se expresa en la EC activado, no tuvo un efecto significativo sobre la HL-60 que rueda sobre la capa endotelial activada. Estos datos demuestran la participación directa de E-sel en HL-60 rodando por TNF-α activado ECs, en consonancia con los informes anteriores 20,21. De los vídeos adquiridos, el software de análisis permite a uno realizar un seguimiento de los caminos de las células individuales que interactúan con el sustrato. Hemos utilizado esta capacidad para rastrear específicamente la vía de las células individuales que se comunicaron con TNF-α activado ECs w / sin bloqueo E-sel. Como se muestra en la Figura 4B, el número de células que rueda sobre LMVECs activados no bloqueados fue significativamente mayor que en E-SEL bloqueado-ECS activado. Además, parecía que el movimiento de rodadura de HL-60 en LMVECs no bloqueados es continua y robusto, mientras que los caminos de rodadura de célulasen E-SEL-bloqueado ECs fue fragmentado (cada color representa una celda diferente, véase, por ejemplo, las células AF vs GL en la Figura 4B). En coherencia con este hallazgo, la velocidad de rotación de células HL-60 en el TNF-α desbloqueado activado ECs fue significativamente inferior a su velocidad de rotación en E-sel-bloqueado ECs (Figura 4C).
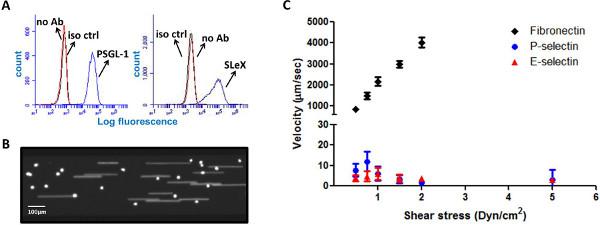
Figura 1. HL-60 células rodar sobre superficies E-selectina recubierto P-y. (A) HL-60 células expresan los ligandos rodando PSGL-1 y SLeX (Iso ctr - isotipo de control, sin Ab - sin anticuerpos). Imagen instantánea Representante de teñidos con CFSE células HL-60 en P-sel (B) recubrir en su superficie bajo flujo. (C) células HL-60 ruedan robustamente en las superficies E-sel-recubierto P-y, pero no en la superficie recubiertos de fibronectina. Velocidad de rotación se representa frente a la tensión de cizallamiento (n = 10-15 células por punto de datos, las velocidades fueron analizados por el software compatible). Haga clic aquí para ver más grande la figura .

Figura 2. HL-60 que rueda sobre monocapa de células CHO-P está mediada directamente por P-sel. (A) células CHO-P expresan P-SEL, pero no E-SEL. (B) Imagen representativa de células HL-60 en la monocapa de CHO-P recubrimiento de la superficie de la canal microfluídico (magnificación 10X). (C) HL -60 celular a rodar en CHO-P monocapa está mediada directamente por P-SEL como se demuestra por Ab ensayo de bloqueo (desbloqueado - CHO-P monocapa no se incubó con un anticuerpo, isotipo CTR-CHO-P monocapa se incubaron con un control de isotipo; * p <0,05, ANOVA de una vía se utilizó con el test post-hoc de Tukey HSD, barras de error representanSEM, n = 3.
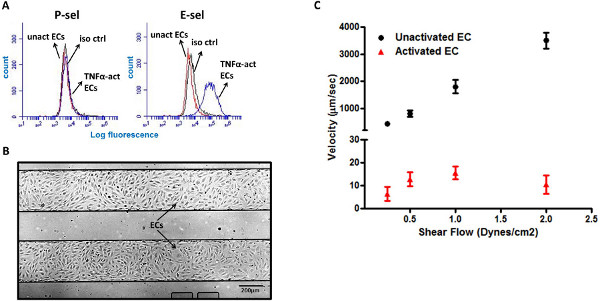
Figura 3. HL-60 células ruedan por el TNF-α activada LMVECs. (A) la activación de TNF-α de LMVECs inducir la expresión en la superficie de E-SEL, pero no P-SEL. (B) Imagen representativa de confluente LMVEC monocapa en dos canales de microfluidos (magnificación 4x). (C) células HL-60 exhiben una respuesta de laminación robusta sobre el TNF-α-LMVECs activado, pero no en LMVECs ONU-activado. Iso ctr - control de isotipo, unact EC - células endoteliales no activadas, TNF-α EC-acto -. Células endoteliales TNF-α activada Haz click aquí para ver más grande la figura .
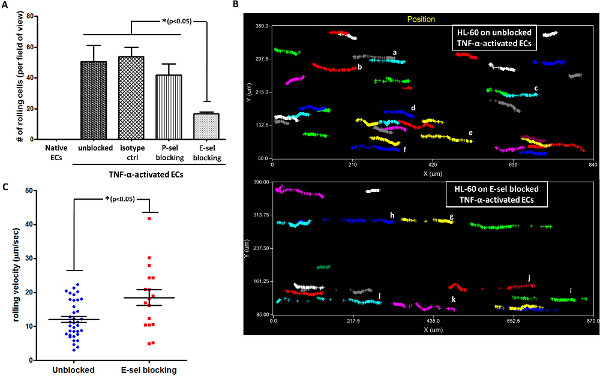 < br /> Figura 4. HL-60 rodando sobre el TNF-α-activado LMVECs está mediada por E-selectina. (A) HL-60 rodando sobre el TNF-α-activa LMVECs está mediada por E-SEL, en lugar de P-SEL, como se ha demostrado por el bloqueo de Ab ensayo (monocapa isotipo ctr-CE se incubaron con un control de isotipo, * p <0,05, ANOVA de una vía se utilizó con el test post-hoc HSD de Tukey, barras de error representan SEM, n = 3) (B) análisis de la trayectoria de la célula revela continua. y robusto de rodadura de células HL-60 en los EC activadas no bloqueados en comparación con fragmentada, laminados débil observado en bloqueado-E-SEL EC activado (cada color representa una celda diferente. El análisis se realizó a través de un software adecuado). (C) HL-60 de laminación velocidad en ECs activada por TNF-α es más lento en los EC activadas no bloqueados en comparación con bloqueado-E-sel ECs activado (esfuerzo cortante utilizado:. 2 dyn / cm 2 * p <0,05, no apareados t-test, las barras de error de dos colas representan SEM, n = 17-36 células por grupo).www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg "target =" _blank "> Haga clic aquí para ver más grande la figura.
< br /> Figura 4. HL-60 rodando sobre el TNF-α-activado LMVECs está mediada por E-selectina. (A) HL-60 rodando sobre el TNF-α-activa LMVECs está mediada por E-SEL, en lugar de P-SEL, como se ha demostrado por el bloqueo de Ab ensayo (monocapa isotipo ctr-CE se incubaron con un control de isotipo, * p <0,05, ANOVA de una vía se utilizó con el test post-hoc HSD de Tukey, barras de error representan SEM, n = 3) (B) análisis de la trayectoria de la célula revela continua. y robusto de rodadura de células HL-60 en los EC activadas no bloqueados en comparación con fragmentada, laminados débil observado en bloqueado-E-SEL EC activado (cada color representa una celda diferente. El análisis se realizó a través de un software adecuado). (C) HL-60 de laminación velocidad en ECs activada por TNF-α es más lento en los EC activadas no bloqueados en comparación con bloqueado-E-sel ECs activado (esfuerzo cortante utilizado:. 2 dyn / cm 2 * p <0,05, no apareados t-test, las barras de error de dos colas representan SEM, n = 17-36 células por grupo).www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg "target =" _blank "> Haga clic aquí para ver más grande la figura.
Discusión
Uno de los principales retos en la traducción exitosa de la terapia basada en células exógena es la incapacidad de entregar eficientemente las células a los sitios de lesión y la inflamación con una alta eficiencia de injerto 3. Laminación celular representa un paso crítico en el proceso de homing de células, facilitando la desaceleración de las células en las paredes de los vasos sanguíneos, llevando eventualmente a su firme adhesión y la transmigración a través del endotelio hacia el tejido 5. Una mejor comprensión del proceso de laminación para los tipos de células candidato puede conducir al desarrollo de técnicas para mejorar homing de las células y contribuir de manera significativa a la mejora de la terapia basada en células.
PPFC es una herramienta ampliamente utilizada para explorar la rodadura de células, así como otros comportamientos celulares bajo un flujo de cizallamiento. La aplicación de PPFC para el examen de la adhesión de neutrófilos sobre el endotelio se estudió primero por Lawrence et al. En 1987, y desde entonces la producción disponible comercialmenteTS se han desarrollado 8,9. PPFCs consisten en dos placas planas separadas por una junta que controla las dimensiones de la cámara 7. La placa superior contiene un flujo de entrada y orificio de salida, que a través del uso de una bomba de jeringa permite la perfusión de la suspensión de células a través de la cámara de 7,8. También hay un puerto adicional que se aplica la presión negativa (vacío) para mantener las placas se pulsa junto 7. Aunque las cámaras de flujo de placas paralelas se han utilizado eficazmente para investigar las respuestas celulares, incluyendo células de laminación, bajo condiciones de flujo de cizallamiento, hay numerosas limitaciones que reducen su eficacia. Una limitación importante de cámaras de flujo es el alto número de células y grandes volúmenes de reactivos que se requieren debido a la gran volumen muerto en el sistema de flujo 7. Otro aspecto crítico es la presencia de burbujas de aire, que puede surgir fácilmente durante el montaje cámara de flujo, potencialmente obstaculizar la monocapa de células y sustratorecubrimiento sobre la placa inferior 22. Sin embargo, se han realizado otras modificaciones al PPCFs tradicionales para incorporar un puerto adicional en la placa superior para actuar como una trampa de burbujas para facilitar la eliminación de burbujas de aire 23. Configuración del experimento PPFC también es tediosa, y la celda de flujo es susceptible a las fugas si la junta está dañada o no montado cuidadosamente. Finalmente, hay una diferencia entre las velocidades de cizallamiento deseados y aplicados experimentalmente, lo que resulta en una gama estrecha de velocidades de flujo uniformes. Al comparar teóricamente cuatro PPFCs con diferentes posiciones de entrada y salida, se encontró que dos de las configuraciones de modelado velocidades de cizallamiento que se desviaron de las velocidades de cizallamiento calculados hasta en un 75% 24. Para volver a utilizar la misma cámara requiere etapas de lavado que consumen mucho tiempo, y en combinación con los retos descritos anteriormente, esto hace que los PPFCs bastante tedioso y de bajo rendimiento.
En nuestro estudio, hemos utilizado una p de múltiples pozos totalmente integradosistema de microfluidos tarde, confiando en 1,2,13 flujo de cizallamiento controlado con precisión. Esta placa de microfluidos 48 incluye 24 canales de microfluidos, con cada par de pozos adyacentes conectados con un 1,25 canal de microfluidos. 10-12 ensayos de laminación se puede realizar en 1 hora, lo que permite la detección rápida de varias docenas de condiciones en un solo día. Los canales de microfluidos pueden ser fácilmente recubiertos con un sustrato de proteína o monocapas de células, y la interacción entre las células de interés y la superficie se pueden obtener imágenes con un microscopio, adquirida por una cámara CCD y se analizaron mediante el software compatible. Los parámetros clave tales como la cuantificación de células, el cálculo de la velocidad de rotación y el análisis de ruta de pista específica se pueden obtener fácilmente de analizar de manera eficiente el comportamiento de balanceo en múltiples sustratos 13. En este estudio, se evaluó la eficacia de este sistema en el estudio de la rodadura de células mediante el uso de HL-60 promielocítica línea celular de leucemia y bien establecidos "rodillos" que expresan claveligandos de laminación, tales como PSGL-1 y la SLeX, que en conjunto actúan como los ligandos de contrapartida para P-y E-SEL 15,26. En relación con los informes anteriores, las células HL60 hecho exhibieron un comportamiento de giro robusto en los canales de microfluidos E-sel recubierto P-y, con velocidades lentas de rodadura de 1.12 m / seg 14,17-19. Células HL-60 no ruedan sobre la superficie de la fibronectina, de acuerdo con informes anteriores que muestran que células HL-60 diferenciadas, que no presentan interacciones adhesivas con fibronectina 16. El diseño del sistema de microfluidos placa de pocillos múltiples, que permite hasta 10 a 12 ensayos / h en comparación con sólo el 1-2 ensayos / hr que se puede probar usando PPFCs, aumenta significativamente el rendimiento de por lo menos 5 veces. Por otra parte, PPFCs necesitan ser vuelto a montar y se lava antes de cada reutilización, además ralentizar la tasa de rendimiento. Además, el flujo fácilmente controlada permite la rápida ejecución de los experimentos de cizalla-dependiente, que luego pueden ser analizadas fácilmente a través de un software adecuado.
entonces El objetivo de probar la eficacia de este sistema de microfluidos en la exploración de las interacciones entre las células en suspensión y una monocapa de células recubriendo el canal. Para este fin, hemos utilizado células CHO, CHO-P que se transfectadas establemente sobreexpresan P-sel (Figura 2A) 11,12. Células HL-60 mostraron una respuesta significativa de laminación en células CHO-P, lo que demuestra la capacidad de utilizar este sistema para explorar de manera eficiente las interacciones célula-célula en virtud de flujo de cizallamiento dado un diseño que evita la formación de burbujas que pueden poner en peligro la integridad de la monocapa de células , que a menudo se produce cuando se utiliza PPFCs 22,23. Entonces nos bloqueamos las células CHO-P con anticuerpos P-o E-sel para explorar su potencial implicación en el proceso de laminación. El bloqueo de P-SEL redujo significativamente el número de células que rueda sobre la monocapa de CHO-P, que indica una participación directa de la P-SEL en la mediación de la HL-60 de laminación, de acuerdo con informes anteriores 14,18,20.Control de E-SEL Ab y isotipo no tuvo efecto sobre la rodadura en HL-60 en células CHO-P, lo que demuestra que el bloqueo de Ab se puede utilizar en este sistema de microfluidos para detectar de manera eficiente marcadores específicos que median las interacciones célula-célula. Es importante destacar que cada canal requiere sólo volumen mínimo de Abs costoso o suspensión de células para este ensayo, tan poco como 25-50 l, a diferencia del reactivo que consume PPFC y sus típicos grandes volúmenes muertos 7.Estamos próximos a prueba este sistema de múltiples pocillos placa mediante el análisis de las interacciones entre las células HL-60 y EC recubrir el canal de microfluidos. Los CE son conocidos para expresar P-y E-SEL durante el proceso inflamatorio 5. Para proporcionar los EC con un estímulo inflamatorio, les pretratadas con TNF-α. Aunque E-sel fue hasta reguladas, P-sel no era, en consonancia con la literatura que demuestra que los EC humana expresan E-sel, pero no P-sel, en respuesta a la activación de TNF-α desde el promotor P-sel primate carece de TNF -α elementos de respuesta, resulting en la inducción de la transcripción de sólo E-sel 20,21. Las condiciones inflamatorias fueron simuladas a continuación, en el interior del canal mediante la incubación de la monocapa CE con TNF-α, seguido de la perfusión de células HL-60 para explorar sus interacciones con la superficie CE. Mientras HL-60 no interaccionan con los EC no activado, lo hicieron mostrar una respuesta robusta de rodadura sobre el TNF-α-activado ECS (Figura 3C), correlacionado con su respuesta reportado en la literatura 22. Ab experimentos de bloqueo (Figura 4A) a continuación, mostró que E-SEL, pero no P-SEL, bloqueando resultaron en una reducción significativa en HL-60 rodando sobre las CE activado. Estos datos demuestran la participación directa de E-sel, y no P-sel, en la mediación de la rodadura de HL-60 sobre el TNF-α humano activado EC 20,21. El Ab experimentos de bloqueo, que muestra a la inversa de rodadura mediada por E-sel en ECs activado vs mediada por P-sel rodando por CHO-P, valida aún más la viabilidad y pertinencia de Ab Blockiexperimentos ng realizaron rápidamente en este sistema de microfluidos. Curiosamente, esta inhibición de la rodadura no era completa (reducción de alrededor del 70%) lo que sugiere que otros receptores de la superficie, tales como la VCAM-1, también participan en HL-60 que rueda sobre activada EC 27. Análisis de la ruta Track reveló además otro fenómeno interesante -, mientras que el laminado de HL-60 en desbloqueado EC activa era continuo y robusto, el bajo número de células que todavía rodaba por E-sel bloqueado activado ECs muestra un camino de rodadura fragmentada en la EC bloqueado ( Figura 4B). Este fenómeno no se observó en ECs se incubaron con bloqueo P-SEL o control de isotipo (datos no mostrados). Esto sugiere fuertemente que mientras que una respuesta de laminación es posible a través de otros marcadores cuando EC E-SEL está bloqueado, esta laminación se basa en interacciones débiles, parciales HL-60-CE, que soporta solamente una respuesta parcial de laminación suelto con las EC activadas 5,22 ,27-29. Esto es apoyado por los datos mostrados en la Figura 4C , lo que demuestra significativamente más lento de laminación de células HL-60 en los EC activadas no bloqueados en comparación con su balanceo en bloqueado-E-SEL EC activado, lo que indica una respuesta de rodadura más débil en E-SEL-bloqueado ECs. Usando el sistema de microfluidos placa de múltiples pocillos en vez de PPFC nos permitió realizar la delicada experimentos HL60-ECS rápidamente, mientras se controla con precisión el flujo de corte, evitando las burbujas y utilizar sólo los volúmenes mínimos de Abs y células. Uso ventajoso de microfluidos para aplicaciones de laminación celular previamente se demostró 30-33, y la mejora de rendimiento de microfluidos mediante el sistema de placa de múltiples pocillos que aquí se presenta, destaca aún más el potencial de esta tecnología para el análisis eficiente y preciso de las propiedades de rodadura clave hacia la mejora de las aplicaciones terapéuticas .
Este estudio se centró en el examen de HL-60 células rodando sobre sustratos proteicos y monocapas de células bajo flujo de cizalla fisiológicamente relevantes y controlada con precisión utilizandoun sistema de microfluidos placa de múltiples pocillos. De manera similar, otros tipos de células y otras monocapas de sustratos / celulares pueden ser fácilmente utilizados para estudiar sus propiedades de laminación. Facilidad de uso y análisis simple permite un análisis preciso de importantes propiedades de rodadura y de bloqueo Ab o activación con diferentes factores de crecimiento o inhibidores se pueden usar para explorar la implicación potencial de marcadores moleculares en la respuesta a la rodadura. Esto puede ser especialmente útil para el estudio de la rodadura y homing de células madre, que pueden ser diseñados para mejorar la terapia basada en células madre 34-36. Es importante destacar que, varias condiciones pueden ser probados con un mejor rendimiento (5-10 veces mayor vs PPFCs), lo que permite el estudio rápido y eficiente de las propiedades de rodadura debido a la construcción de placa. Otros ensayos pertinentes para homing de las células, tales como la adhesión celular, la quimiotaxis y la transmigración también pueden ser estudiados utilizando este sistema 1,10,13. En general, este sistema de microfluidos emerge como una poderosa técnica para el estudio de laminación celular y should servir como una herramienta útil para ayudar en la traducción clínica de la terapia basada en células exógenas.
Divulgaciones
Autores declaran no tener conflicto de intereses.
Agradecimientos
Células CHO-P fueron una especie de regalo de la Dra. Barbara Furie (Beth Israel Deaconess Medical Center, Harvard Medical School). Este trabajo fue apoyado por el Instituto Nacional de Salud de subvención HL095722 a JMK Este trabajo también fue apoyado en parte por una Fundación de Cáncer de Próstata Premio Movember-Desafío a JMK
Materiales
| Name | Company | Catalog Number | Comments |
| Human Lung Microvascular Endothelial Cells | Lonza | CC-2527 | |
| P-selectin-expressing Chinese Hamster Ovary Cells (CHO-P) | Kind gift by Dr. Barbara Furie11,12 | ||
| HL-60 Cells | ATCC | CCL-240 | |
| Cell Culture Reagents | |||
| Endothelial Basal Medium | Lonza | CC-3156 | |
| EBM-2 Media | Lonza | CC-3156 | |
| Endothelial Basal Medium Supplements | Lonza | CC-4147 | |
| EGM-2 MV SingleQuots | Lonza | CC-4147 | |
| IMDM - Iscove's Modified Dulbecco's Medium 1x | Gibco | 12440 | |
| F-12 (1x) Nutrient Mixture (Ham) | Gibco | 11765-054 | |
| Penicillin Streptomycin (P/S) | Gibco | 15140 | |
| L-Glutamine (L/G) 200 mM | Gibco | 25030 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | Sa550 | |
| Petri Dishes | BD Falcon | BD-353003 | |
| 100 mm Cell Culture Dish, Tissue-Culture Treated Polystyrene | |||
| Centrifuge Tubes (15 ml polypropylene conical tubes) | MedSupply Partners | TC1500 | |
| T75 Flasks | BD Falcon | 353136 | |
| Gelatin Solution (2%) | Sigma | G1393 | |
| dPBS (without calcium chloride and magnesium chloride) | Sigma | D8537 | |
| Trypsin-EDTA Solution (10x) | Sigma | T4174 | |
| Antibodies | |||
| Anti-hE-Selectin/CD62E | R&D Systems | BBA21 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA21 | |
| Anti-hP-Selectin | R&D Systems | BBA34 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA34 | |
| FITC Mouse IgG1 κ Isotype Control | BD Bioscience | 555748 | |
| Anti-SLeX /CD15s Ab, Clone: 5F18 | Santa Cruz | SC70545 | |
| FITC Conjugated | Santa Cruz | SC70545 | |
| Normal Mouse IgM-FITC Isotype Control | Santa Cruz | SC2859 | |
| PE Mouse Anti-Human CD162, Clone: KPL-1 | BD Pharmingen | 556055 | |
| PE Mouse IgG1 k Isotype Control | BD Pharmingen | 550617 | |
| Anti-P-Selectin Ab (AK4) | Santa Cruz | SC19996 | |
| Anti-E-Selectin Ab, Clone P2H3 | Millipore | MAB2150 | |
| Mouse IgG1 Isotype Control | Santa Cruz | SC3877 | |
| Other Reagents | |||
| Recombinant Human TNF-alpha | PeproTech | 300-01A | |
| Cell Trace CFSE Cell Proliferation Kit - For Flow Cytometry | Invitrogen | C34554 | |
| Human P-selectin-FC recombinant protein | R&D Systems | 137-PS-050 | |
| Human E-selectin-FC recombinant protein | R&D Systems | 724-ES-100 | |
| Fibronectin Human, Plasma | Invitrogen | 33016-015 | |
| Equipment | |||
| Bioflux 1000 | Fluxion Biosciences | Bioflux Montage was the software used to run the experiments and analyze the data | |
| BioFlux 48-well plates | Fluxion Biosciences | ||
| BD Accuri C6 Flow Cytometer | BD Bioscience | CFlow Plus was the software used to run the experiments and analyze the data | |
| Nikon Eclipse Ti-S | Nikon | ||
| CoolSnap HQ2 CCD camera | Photometrics | ||
Referencias
- Conant, C. G., et al. Well plate microfluidic system for investigation of dynamic platelet behavior under variable shear loads. Biotechnol. Bioeng. 108, 2978-2987 (2011).
- Conant, C. G., Schwartz, M. A., Ionescu-Zanetti, C. Well plate-coupled microfluidic devices designed for facile image-based cell adhesion and transmigration assays. J. Biomol. Screen. 15, 102-106 (2010).
- Ankrum, J., Karp, J. M. Mesenchymal stem cell therapy: Two steps forward, one step back. Trends Mol. Med. 16, 203-209 (2010).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4, 206-216 (2009).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Ley, K. The role of selectins in inflammation and disease. Trends Mol. Med. 9, 263-268 (2003).
- Sperandio, M., Pickard, J., Unnikrishnan, S., Acton, S. T., Ley, K. Analysis of leukocyte rolling in vivo and in vitro. Methods Enzymol. 416 (06), 346-371 (2006).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunol. 2, 9 (2001).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Conant, C. G., Schwartz, M. A., Nevill, T., Ionescu-Zanetti, C. Platelet adhesion and aggregation under flow using microfluidic flow cells. J. Vis. Exp. (10), e1644 (2009).
- Furie, B., Furie, B. C. Role of platelet P-selectin and microparticle PSGL-1 in thrombus formation. Trends Mol. Med. 10, 171-178 (2004).
- Tchernychev, B., Furie, B., Furie, B. C. Peritoneal macrophages express both P-selectin and PSGL-1. J. Cell Biol. 163, 1145-1155 (2003).
- Conant, C. G., et al. Using well-plate microfluidic devices to conduct shear-based thrombosis assays. J Lab Autom. 16, 148-152 (2011).
- Larsen, G. R., et al. P-selectin and E-selectin. Distinct but overlapping leukocyte ligand specificities. J. Biol. Chem. 267, 11104-11110 (1992).
- Varki, A. Selectin ligands: will the real ones please stand up. J. Clin. Invest. 100, S31-S35 (1997).
- Bohnsack, J. F., Chang, J. Activation of beta 1 integrin fibronectin receptors on HL60 cells after granulocytic differentiation. Blood. 83, 543-552 (1994).
- Lawrence, M. B., Kansas, G. S., Kunkel, E. J., Ley, K. Threshold levels of fluid shear promote leukocyte adhesion through selectins (CD62L,P,E). J. Cell Biol. 136, 717-727 (1997).
- Moore, K. L., et al. P-selectin glycoprotein ligand-1 mediates rolling of human neutrophils on P-selectin. J. Cell Biol. 128, 661-671 (1995).
- Lawrence, M. B., Springer, T. A. Neutrophils roll on E-selectin. J Immunol. 151, 6338-6346 (1993).
- Yao, L., et al. Divergent inducible expression of P-selectin and E-selectin in mice and primates. Blood. 94, 3820-3828 (1999).
- Sackstein, R. Glycoengineering of HCELL, the human bone marrow homing receptor: sweetly programming cell migration. Ann. Biomed. Eng. 40, 766-776 (2012).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of physiologic E-selectin-mediated leukocyte rolling on microvascular endothelium. J. Vis. Exp. , e1009 (2009).
- Muller, W. A., Luscinskas, F. W. Assays of transendothelial migration in vitro. Methods Enzymol. 443, 155-176 (2008).
- Bakker, D. P., vander Plaats, A., Verkerke, G. J., Busscher, H. J., vander Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Appl. Environ. Microbiol. 69, 6280-6287 (2003).
- Benoit, M. R., Conant, C. G., Ionescu-Zanetti, C., Schwartz, M., Matin, A. New device for high-throughput viability screening of flow biofilms. Appl. Environ. Microbiol. 76, 4136-4142 (2010).
- Varki, A. Selectin ligands. Proc. Natl. Acad. Sci. U.S.A. 91, 7390-7397 (1994).
- Ramos, C. L., et al. Direct demonstration of P-selectin- and VCAM-1-dependent mononuclear cell rolling in early atherosclerotic lesions of apolipoprotein E-deficient mice. Circ. Res. 84, 1237-1244 (1999).
- Yago, T., et al. Core 1-derived O-glycans are essential E-selectin ligands on neutrophils. Proc. Natl. Acad. Sci. U.S.A. 107, (2010).
- Yago, T., et al. E-selectin engages PSGL-1 and CD44 through a common signaling pathway to induce integrin alphaLbeta2-mediated slow leukocyte rolling. Blood. 116, 485-494 (2010).
- Simone, G., et al. Cell rolling and adhesion on surfaces in shear flow. A model for an antibody-based microfluidic screening system. Microelectronic Eng. 98, 668-671 (2012).
- Perozziello, G., et al. Microfluidic devices modulate tumor cell line susceptibility to NK cell recognition. Small. 8, 2886-2894 (2012).
- Perozziello, G., et al. Microfluidic biofunctionalisation protocols to form multivalent interactions for cell rolling and phenotype modification investigations. Electrophoresis. , (2013).
- Simone, G., et al. A facile in situ microfluidic method for creating multivalent surfaces: toward functional glycomics. Lab Chip. 12, 1500-1507 (2012).
- Sarkar, D., et al. Engineered cell homing. Blood. 118, e184-e191 (2011).
- Cheng, Z., et al. Targeted Migration of Mesenchymal Stem Cells Modified With CXCR4 Gene to Infarcted Myocardium Improves Cardiac Performance. Mol. Ther. 16, 571-579 (2008).
- Enoki, C., et al. Enhanced mesenchymal cell engraftment by IGF-1 improves left ventricular function in rats undergoing myocardial infarction. Int. J. Cardiol. 138, 9-18 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados