Method Article
Analyse systématique des
Dans cet article
Résumé
Cette étude a utilisé un système microfluidique plaque multi-puits, ce qui augmente considérablement le débit des études de roulement de cellule sous flux de cisaillement physiologiquement pertinents. Compte tenu de l'importance de laminage de cellules dans la cellule multi-homing étape cascade et l'importance de la prise d'origine cellulaire après une délivrance systémique de populations de cellules exogènes chez les patients, ce système présente un potentiel en tant que plate-forme de criblage pour améliorer la thérapie à base de cellules.
Résumé
Un défi majeur pour la thérapie à base de cellules est l'incapacité à cibler systématiquement une grande quantité de cellules viables avec une grande efficacité pour les tissus d'intérêt après la perfusion intraveineuse ou intra-artérielle. Par conséquent, l'augmentation de la prise d'origine cellulaire est actuellement étudiée comme une stratégie pour améliorer la thérapie cellulaire. Cellule roulant sur l'endothélium vasculaire est une étape importante dans le processus de prise d'origine cellulaire et peut être sondé in vitro en utilisant une chambre d'écoulement à plaques parallèles (PPFC). Cependant, il s'agit d'un essai de débit extrêmement fastidieuse, bas, avec des conditions d'écoulement mal contrôlées. Au lieu de cela, nous avons utilisé un système microfluidique plaque multi-puits qui permet l'étude des propriétés de roulement cellulaire dans un débit plus élevé dans des conditions contrôlées précisément, les flux de cisaillement physiologiquement pertinents 1,2. Dans cet article, nous montrons comment les propriétés de roulement de HL-60 (leucémie promyélocytaire humaine) des cellules sur des surfaces E-sélectine-P-enduit et ainsi que sur les surfaces de monocouches-enrobées de cellules peuvent être readily examinée. Pour mieux simuler les conditions inflammatoires, la surface du canal microfluidique a été revêtu de cellules endothéliales (EC), qui ont ensuite été activés avec facteur de nécrose tumorale α (TNF-α), ce qui augmente considérablement les interactions avec les cellules HL-60 dans des conditions dynamiques. Le débit amélioré et intégré multi-paramètre plate-forme d'analyse d'un logiciel, qui permet une analyse rapide des paramètres tels que la vitesse de laminage et de chemin de roulement, présente des avantages importants pour l'évaluation des propriétés de laminage de cellules in vitro. Permettant une analyse rapide et précise des approches d'ingénierie conçues pour influer sur roulement cellulaire et homing, cette plate-forme peut aider à la thérapie avance à base de cellules exogène.
Introduction
L'un des principaux défis dans la traduction clinique de succès de la thérapie à base de cellules est la livraison inefficace ou le ciblage des cellules systémique infusées aux sites désirés 3,4. Par conséquent, il ya une recherche constante des approches visant à améliorer la prise d'origine cellulaire, et plus particulièrement cellule de roulement, comme une stratégie pour améliorer la thérapie cellulaire. Cellule roulant sur les vaisseaux sanguins est une étape clé dans la cascade de ralliement de la cellule, classiquement défini pour les leucocytes qui sont recrutés à des sites de la maladie 5. Cette étape est gouvernée par des interactions spécifiques entre les sélectines endothéliales, c'est à dire P-sélectine E et leurs contre-ligands sur la surface de leucocytes 5,6 (P-et E-sel), et. Une meilleure compréhension et une meilleure efficacité de la prise d'origine cellulaire, et plus précisément l'étape de laminage, sont d'une grande importance dans la quête de nouvelles plates-formes pour améliorer la thérapie à base de cellules. À ce jour, cela a été réalisé à l'aide de chambres d'écoulement parallèles de la plaque (les PPFCs), comprenant deux plate plates avec un joint d'étanchéité entre eux, avec un orifice d'entrée et de sortie situés sur la plaque supérieure, à travers lequel une suspension cellulaire est perfusé à l'aide d'une pompe à seringue 7,8, 9. La surface de la plaque de fond peut être revêtue d'une monocouche de cellules / substrats pertinents et l'interaction entre les cellules perfusées et la surface sous écoulement de cisaillement est ensuite exploré 7. Cependant, PPFC est un débit faible, réactif consommant, et méthode assez fastidieuse, la formation de bulles, de fuite et de flux mal contrôlés présentant des inconvénients majeurs.
Une technique alternative pour la FPNC traditionnel est un système microfluidique plaque multi-puits, ce qui permet de meilleures performances de débit de dosages cellulaires (jusqu'à 10 fois plus élevé que PPFCs) sous précis, le flux de cisaillement contrôlé par ordinateur, avec une faible consommation de réactif de 1,10. Expériences cellule de laminage sont exécutées à l'intérieur des canaux microfluidiques, qui peut être revêtu avec des monocouches de cellules ou de substrats innovants et usi imagéeng d'un microscope, avec des propriétés de roulement facilement analysée en utilisant un logiciel approprié. Dans cette étude, nous démontrons les capacités de ce système microfluidique plaque multi-puits par l'étude des propriétés de roulement de leucémie promyélocytaire humaine (HL-60) cellules sur différentes surfaces. HL-60 roulant sur des substrats tels que P-et E-sel, ainsi que sur des monocouches de cellules exprimant différents récepteurs de roulement, ont été analysées. En outre, un anticorps (Ab) de blocage a été utilisé pour démontrer l'implication directe des sélectines spécifiques dans la médiation du mouvement de roulement du HL-60 sur ces surfaces. Expériences de roulement ont été réalisées avec un débit accru, sous flux de cisaillement stable, avec un minimum de consommation du réactif / cellulaire, permettant une analyse efficace des paramètres de laminage clés tels que la vitesse de roulement, le nombre de cellules de roulement et roulement propriétés du chemin.
Protocole
Une. Culture cellulaire
- Leucémie promyélocytaire humaine (HL-60), les cellules
- Culture cellules HL-60 en flacons de 75 cm2 avec 15 ml d'Iscove Modified Medium (l'IMDM) de Dulbecco, supplémenté avec 20% (v / v) de sérum bovin fœtal (FBS), 1% (v / v) de L-glutamine et 1 % (v / v) de pénicilline-streptomycine.
- Changer de support tous les 3 jours en aspirant la moitié du volume de la suspension cellulaire et de la remplacer avec des milieux IMDM complet.
- Pour le diacétate de carboxyfluorescéine, ester de succinimidyle (CFSE), la coloration, la centrifugeuse HL-60 suspension de cellules (400 x g, 5 min), remettre en suspension dans une solution à 1 pM de CFSE (préparé dans du PBS préchauffé) et incuber pendant 15 min à 37 ° C. Puis centrifuger les cellules, aspirer le surnageant et remettre les cellules en milieu préchauffé frais pendant 30 min. Laver les cellules dans du PBS et ensuite utiliser pour des expériences de roulement (voir la figure 1B pour image représentative de CFSE colorées cellules HL-60 sur P-sel-surface revêtue).
Note: CFSE coloration est facultative, et est présenté ici pour démontrer le phénomène de roulement dans le canal microfluidique. Analyse des paramètres de laminage présentés dans ce manuscrit a été réalisée sur des cellules non colorées en utilisant l'imagerie en fond clair standard.
- Cellules endothéliales microvasculaires pulmonaires (LMVECs)
- Manteau de 100 mm des boîtes de Pétri avec une solution de gélatine à 0,1% (v / v dans du PBS) et incuber à 37 ° C pendant au moins 30 min.
- LMVECs de culture sur 100 mm plats enrobés de gélatine de Petri dans un milieu complet de croissance de l'endothélium (endothélium milieu de base-2 (EBM-2)), complété par un kit spécifique de supplément de croissance, voir réactifs). Changer de support tous les jours et les cellules sous-culture à 80-90% de confluence.
- Pour la sous-culture, laver les cellules avec du PBS, puis détacher les cellules avec 4 ml de trypsine-EDTA 1x pendant 3 min à 37 ° C et neutraliser dans un volume égal d'complets EBM-2 médias. Transférer la suspension cellulaire à un tube de 15 ml et centrifuge (400 xg, 5 min). Après la centrifugation, remettre en suspension le culot dans 1 ml de milieu complet endothéliales et compter les cellules avec un hémocytomètre. Ne pas trop le passage des cellules, car cela affecte leur morphologie et de la fonction d'utilisation seulement des cellules dans le passage 7 pour toutes les expériences.
- Ovaire de hamster chinois-P-sélectine (CHO-P) Cellules
- CHO-P cellules, qui sont des cellules CHO transfectées de façon stable pour exprimer P-sel humaine, ont été fournis par les collaborateurs (Beth Israel Deaconess Medical Center, Harvard Medical School) 11,12.
- Culture CHO-P cellules T175 cm 2 flacons de 25 ml de F-12 médias.
- Pour les passages, laver les cellules avec 10 ml de PBS pendant 4-5 secondes, puis trypsiniser dans 10 ml de 1 x trypsine-EDTA pendant 3 min à 37 ° C, suivie d'une neutralisation dans des milieux complets.
- Centrifuger la suspension cellulaire (400 xg, 5 min), aspirer soigneusement le surnageant, remettre en suspension le culot cellulaire dans 1 ml de médias complètes et compter les cellules avecun hémocytomètre.
2. Fonctionnement du système microfluidique intégré plaque multi-puits
- Assurez-vous que tout le matériel est correctement connecté et tourner sur les différents modules: ordinateur, contrôleur, microscope inversé, et la caméra CCD.
- Ouvrez le logiciel d'imagerie; s'assurer que le module de plaque multi-puits et le module d'imagerie sont correctement présentées à l'écran.
- Raccorder les tubes du piège de la vapeur (connecté au contrôleur) et également les connecter à l'interface de pression.
- Placer la plaque multi-puits de la plaque de chauffage / adaptateur. Ajouter les réactifs dans les puits (décrits ci-dessous) et fixer l'interface sur le dessus de la plaque. Placer la plaque pour l'imagerie sur scène automatisé.
- L'interface se fixe sur le dessus de la plaque et applique une pression pneumatique à partir de l'unité de commande à la partie supérieure des puits, entraînant le fluide à travers les canaux microfluidiques à la vitesse d'écoulement définie, facilement contrôlé en utilisant la plaque multi-puitsécran du module en mode manuel.
- Les réactifs dans le flux de canal à travers une zone d'observation, situé entre les puits. Dimensions du canal microfluidique sont 350 m de large x 70 um de hauteur. La longueur de la chaîne linéaire est de 1 mm et le fond des canaux comprend une lamelle couvre-objet en verre de 180 um, ce qui est compatible avec le fond clair, de la phase, de la fluorescence et microscopie confocale.
- Acquérir des vidéos en utilisant une caméra CCD (acquisition de flux, 11 images / s) et d'analyser via un logiciel compatible.
3. Revêtement de canaux microfluidiques avec un substrat protéique ou une monocouche de cellules
- Revêtement canal microfluidique avec la fibronectine ou P-/E-selectin
- Préparer 1 ml de 20 pg / ml solution de fibronectine dans du PBS. Modifier le volume en fonction du nombre de canaux à revêtir (25 à 50 ul en utilisant de la fibronectine par canal).
- Ajouter 25 à 50 ul d'une solution de fibronectine à chaque puits d'entrée. Appliquer la force de cisaillement de 2 dyn / cm 2pendant 5 min pour perfuser le canal. S'il vous plaît noter le cordon de liquide apparaissant dans le puits de sortie. Incuber pendant 30-45 min à température ambiante
- Aspirer la solution de puits (ne pas aspirer directement à partir du cercle du milieu qui alimente le canal) 1,13. Ajouter 200-500 ul de PBS dans une prise bien et laver avec du PBS canal en appliquant flux de cisaillement de 2 dyn / cm 2 pendant 5 min. Le canal est maintenant convenablement revêtue avec de la fibronectine et prêt à être utilisé.
- Pour enrober de P-ou E-SEL, préparer une solution à 5 ug / ml de la protéine humaine recombinante souhaitée dans du PBS, et enduire les canaux tels que décrits ci-dessus, avec une heure d'incubation à 37 ° C pour permettre le revêtement de surface.
- Création de CHO-P ou LMVEC monocouche à l'intérieur du canal microfluidique
- Trypsiniser en douceur les cellules de boîtes de culture pendant 3 minutes, éteindre en utilisant un volume de 2 fois de médias complètes et centrifuger (5 min à 400 g). Resuspendre les cellules avec 10 ml de milieu complet et centrifuger (5 min à 400 g) contn.
- Compter les cellules pour déterminer la concentration des cellules dans la suspension. Afin d'assurer la formation d'une monocouche confluente LMVEC à l'intérieur du canal, amener la concentration cellulaire de 15 à 20 millions de cellules / ml. Pour une confluence CHO-P monocouche de cellules, utilisez 50-60000000 cellules / ml. Utilisation de 25 à 50 pl de suspension de cellules pour chaque canal - déterminer le nombre initial de cellules utilisées pour l'expérience en conséquence.
- Ajouter 25 à 50 ul de suspension de cellules dans la concentration appropriée à l'avaloir. Placer la plaque sur la platine du microscope et introduire des cellules dans le canal (2 dyn / cm 2) jusqu'à ce que les cellules sont observées sur l'écran remplissage des canaux entiers, puis arrêter le flux.
- Remplissez la fois entrée et la sortie avec 200 ul de LMVEC plein ou CHO médias. Laissez les cellules se déposent et adhèrent pendant 3 heures dans l'incubateur (37 ° C, 5% de CO 2).
- Après l'incubation de 3 heures, lavez le canal en pleine médias (2 dyn / cm 2, 10-15 min) pour éliminer les seulescellules. Les cellules doivent maintenant semblent complètement confluentes et le canal est maintenant prêt à l'emploi. En fonction de la densité initiale de l'ensemencement des cellules, 2-3 hr supplémentaires de temps de décantation peut être nécessaire pour assurer une couverture complète de la surface avec les cellules.
4. LMVEC activation pro-inflammatoire et des anticorps bloquant P-/E-selectin
- Préparer une solution de TNF-α (10 ng / ml) dans du milieu de base LMVEC.
- Pour induire l'activation inflammatoire des LMVEC dans les canaux, ajouter 100 ul de la solution de TNF-α à l'avaloir et introduire la solution dans le canal en appliquant l'écoulement de cisaillement de 2 dynes / cm 2 pendant 5 min. Pour les canaux de contrôle (non activé EC), ajouter 100 ul de LMVEC milieux de base à l'entrée et ainsi introduire dans le canal (2 dyn / cm 2 pendant 5 min). La chaîne est maintenant prêt pour un essai de roulement.
- Pour bloquer P-sel et E-sel sur LMVECs et les cellules CHO-P, introduire neutraliser P-sel (clone AK4, 5 ug / ml dans bamédias sal) ou E-sel (clone P2H3, 5 ug / ml dans les milieux de base) des anticorps dans le canal et incuber pendant 1 heure à 37 ° C. Ensuite, laver les canaux avec les médias de base (2 dyn / cm 2 pendant 5 min). Les canaux sont maintenant prêt pour un essai de roulement.
5. HL-60 roulement Essai sur monocouches-Coated Substrat / Téléphones canaux microfluidiques
- Examiner attentivement les canaux sous le microscope pour confirmer que les chaînes sont correctement revêtus (dans le cas d'un revêtement avec des cellules, une monocouche de cellules totalement confluent doit être observé).
- Pour préparer HL-60 suspension de cellules pour les expériences de roulement, centrifugeuse HL-60 suspension de cellules (5 min à 400 g) et laver une fois avec les médias de base. Compter les cellules et remettre en suspension dans IMDM (milieu de base, contenant du Ca 2 + et Mg 2 +) pour créer une suspension de cellules HL-60 avec 5 millions de cellules / ml. Utilisation de 25 à 50 pl de suspension de cellules pour chaque canal pour réaliser le dosage de roulement.
- Ajouter 25-50 pi de la suspe cellulairension bien sortie, place plaque à l'intérieur de la plaque support à température contrôlée (37 ° C) et le placer sur la platine du microscope. Ensuite, introduire des cellules dans le canal en appliquant une force de cisaillement de 2 dyn / cm 2 (cellules doivent être observées dans 10-15 secondes s'écoulant de la sortie à l'entrée).
- Pour examiner la réponse de roulement en fonction de la contrainte de cisaillement, de réduire cisaillement à 0,25 dyn / cm 2 et acquérir 20-30 vidéos sec (en utilisant la fonction «d'acquisition de flux") dans chaque cisaillement désirée (augmenter cisaillement progressivement de 0,25 à 5 dyn / cm 2. Il est également possible d'utiliser des cisailles supérieures).
- Acquérir des vidéos en utilisant une caméra CCD (acquisition de flux, 11 images / s) et d'analyser roulant des chemins de roulement et les vitesses via un logiciel compatible.
6. La cytométrie en flux pour détecter l'expression de molécules de surface
- À la suite de traitement à la trypsine, préparer une suspension de cellules (à l'aide de 1 à 2 x 10 5 cellules / échantillon) de type cellulaire souhaité (HL-60, des cellules CHO-P ou LMVECs) dans du PBS (- / -), supplémenté avec 2% de FBS. Laver les cellules deux fois et porter le volume de l'échantillon de 50 pi (en utilisant le même tampon).
- Incuber chaque échantillon avec le fluorophore conjugué Ab souhaitée (voir tableau ci-joint pour plus d'informations) à 4 ° C pendant 20 min (couvrir de papier d'aluminium).
- Laver les cellules deux fois (même tampon) et porter le volume final de la suspension de cellules colorées à 200 ul. Analyser des échantillons en utilisant un cytomètre en flux pour détecter l'expression de molécules de surface.
Résultats
Cellules HL-60 roulent sur des surfaces de la P-sélectine et E-, mais pas sur la fibronectine
Cellules HL-60 sont considérés comme l'étalon-or "rouleaux" parce qu'ils expriment une variété de ligands à tête chercheuse, y compris les ligands de roulement P-glycoprotéine ligand sel-1 (PSGL-1) et Sialyl-Lewis X (sLex) 5,14 (figure 1A ). Les protéines de surface PSGL-1 agit comme un échafaudage pour le tétra-saccharide sLex, médiatrices interaction spécifique avec P-et E-sel, qui est régulée à la hausse sur l'endothélium lors de l'inflammation 5,6,15. Pour tester les capacités du système microfluidique plaque multi-puits, de nombreux canaux microfluidiques ont été revêtus simultanément avec différents substrats et les interactions de roulement de cellules HL-60 avec les surfaces ont été analysés. Cellules HL-60 ont présenté un comportement de roulement robuste sur P-sel-surface revêtue, avec les cellules capturées à partir de l'écoulement d'abord, suivi par un mouvement de roulement distinct. Comme le montre la figure 1C, et se composentent avec la littérature, cellules HL-60 présentent un comportement similaire au roulement sur les surfaces E-SEL, mais pas sur des substrats revêtues de fibronectine 14,16-19. vitesse de cellule, analysé par un logiciel compatible, a été tracée en fonction de la contrainte de cisaillement, montrant une réponse robuste laminage de cellules sur-P et E-sel avec une vitesse moyenne comprise entre 1 à 12 um / sec.
Cellules HL-60 roulent sur des cellules CHO-P revêtement monocouche canal microfluidique
Ensuite, nous avons cherché à évaluer la faisabilité de l'utilisation de ce système microfluidique pour tester efficacement les interactions entre les cellules d'intérêt et une monocouche de cellules recouvrant la surface. Pour explorer l'interaction des cellules HL-60 avec une monocouche de cellules exprimant des marqueurs de roulement, nous avons utilisé des cellules CHO-P, qui sont transfectées pour exprimer de façon stable P, mais pas E, sel (figure 2A. Voir aussi la figure 2B pour représentant l'image des cellules HL-60 sur la monocouche des cellules CHO-P enrobant le canal microfluidique) 11,12. HL-60 cellules ont montré une réponse forte de roulement sur les cellules CHO-P (figure 2C). Pour tester si ce mouvement de roulement est en effet à médiation par P-sel, la monocouche des cellules CHO-P a été pré-incubée avec des anticorps de blocage ou l'autre de P-ou E-sel, avant la perfusion de cellules HL-60 dans le canal. Comme le montre la figure 2C, le blocage de la monocouche des cellules CHO-P avec un P-sel Ab a entraîné une diminution significative du nombre de laminage cellules HL-60 sur la surface, ce qui montre que P-sel en effet HL-60 médie roulant comme décrit précédemment 14,18. La réalisation du test dans un canal microfluidique permet un dépistage rapide des différentes conditions et le blocage efficace des récepteurs à l'aide seulement de petits volumes, aussi peu que 25 pi. contrôle isotypique ou Ab blocage E-sel (qui n'est pas exprimé sur les cellules CHO-P) n'ont pas affecté le nombre de cellules roulant sur des cellules CHO-P, démontrant la force de cet essai en précision broches pointant l'implication directe de surfactant spécifiquemarqueurs électroniques dans les interactions cellulaires de roulement.
Laminage de cellules HL-60 sur LMVECs de TNF-a activé est médiée par la E-sélectine
Les cellules endothéliales sont connus de l'adhérence réguler à la hausse des marqueurs de surface, tels que les P-et E-sel, au cours de l'inflammation, de l'assistance dans le recrutement de leucocytes aux sites d'inflammation 5,6. Cependant, alors que les EC expriment à la fois murine P-E-sel et en réponse à des stimuli inflammatoires comme l'interleukine-1 (IL-1) et facteur de nécrose tumorale α (TNF-α), EC humain n'expriment E-sel en réponse à ceux-ci cytokines 20,21. Ceci a été validé dans notre test de cytométrie en flux, montrant l'expression de la E-sel, mais pas P-sel, sur des cellules endothéliales microvasculaires pulmonaires (LMVEC) en réponse à la stimulation de TNF-α (figure 3A). La plaque microfluidique multi-puits se compose de nombreux canaux microfluidiques séparées, permettant le test de débit plus élevé de plusieurs conditions différentes. Nous avons utilisé cette conception avantageuseà l'assiette LMVECs l'intérieur des canaux microfluidiques (figure 3B) pour analyser rapidement les interactions des cellules HL-60 avec EC sous de multiples conditions. Pour simuler les paramètres inflammatoires, LMVECs ont été prétraitées avec de la cytokine pro-inflammatoire, le TNF-α. Fait intéressant, les cellules HL-60 n'ont pas interagir avec LMVECs ONU-activé, et les cellules n'ont pas été observés à rouler sur cette surface. Au contraire, les cellules HL-60 ont montré une forte comportement de roulement sur le TNF-α-LMVECs activé, avec une vitesse moyenne de 5 à 15 um / sec (figure 3C).
Nous avons ensuite cherché à explorer la participation de P-sel ou E-sel dans l'interaction de roulement entre les cellules HL-60 et les LMVECs activés. Pour cela, le TNF-α-activated EC ont été préincubées avec P-sel ou E sel anticorps bloquants, et le laminage de cellules HL-60 a été analysée. Comme le montre la figure 4A, le blocage de E-sel, qui a été régulée à la hausse sur le TNF-α-LMVECs activé, conduit à une significant recul du nombre de laminage sur la monocouche de cellules endothéliales activées. En revanche, l'utilisation d'un contrôle isotypique ou un Ab contre P-sel, qui n'a pas été exprimé sur le EC activé, n'a pas eu d'effet significatif sur la HL-60 roulant sur la couche endothéliale activée. Ces données démontrent l'implication directe des E-sel dans HL-60 roulant sur le TNF-α activé EC, compatible avec les rapports précédents 20,21. A partir des vidéos acquises, le logiciel d'analyse qui permet de suivre les chemins de cellules individuelles en interaction avec le substrat. Nous avons utilisé cette capacité de suivre précisément le chemin des cellules individuelles qui interagissent avec le TNF-α activé EC w / wo blocage E-sel. Comme le montre la figure 4B, le nombre de cellules roulant sur LMVECs activés non bloquées était significativement plus élevé que le E-sel-bloqué activé EC. En outre, il est apparu que le mouvement de roulement de HL-60 non bloqués sur LMVECs est continue et solide, tandis que les chemins de roulement des cellulessur E-sel-EC a été bloqué fragmenté (chaque couleur représente une cellule différente, voir par exemple les cellules af vs gl figure 4B). En cohérence avec cette observation, la vitesse de laminage de cellules HL-60 non bloqué sur le TNF-α-activated EC était significativement inférieure à la vitesse de laminage sur E-sel-bloqué EC (Figure 4C).
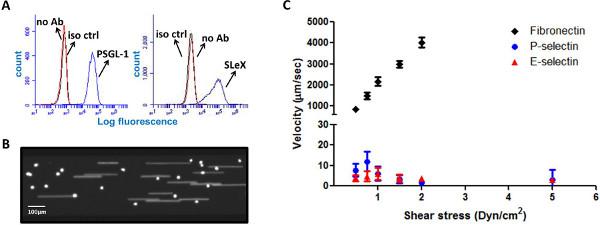
Figure 1. Cellules HL-60 roulent sur les surfaces E-sélectine-P-enduit et. (A) cellules HL-60 expriment les ligands de roulement PSGL-1 et slex (Iso ctr - isotype contrôle, aucune Ab - pas d'anticorps). (B) de l'image représentant instantané de CFSE colorées cellules HL-60 sur P-sel à revêtement de surface sous flux (C). cellules HL-60 roulent sur des surfaces robuste E-SEL-enduit et P-, mais pas sur la surface de la fibronectine. Vitesse de roulement est tracée contre la contrainte de cisaillement (n = 10-15 cellules par point de données, les vitesses ont été analysés par un logiciel compatible). Cliquez ici pour agrandir la figure .

Figure 2. HL-60 roulant sur CHO-P monocouche de cellules est directement médiée par P-sel. (A) Des cellules CHO-P expriment P-sel, mais pas E-sel. (B) l'image représentative de cellules HL-60 sur les cellules CHO-P monocouche revêtement de la surface du canal microfluidique (10X grossissement). (C) HL -60 cellule roulant sur des cellules CHO-P monocouche est directement médiée par P-sel tel que démontré par Ab blocage dosage (débloquent - CHO-P monocouche a pas incubé avec un anticorps, l'isotype ctr-CHO-P monocouche incubées avec un contrôle isotypique *; p <0,05, ANOVA a été utilisé avec le test post-hoc de HSD de Tukey, barres d'erreur représententSEM, n = 3.
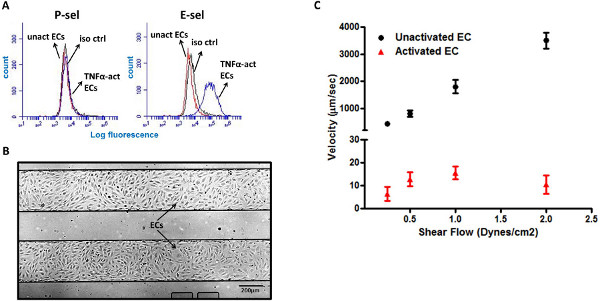
Figure 3. Cellules HL-60 roulent sur le TNF-α-LMVECs activé. (A) l'activation du TNF-α de LMVECs induire l'expression de surface de E-sel, mais pas P-sel. (B) de l'image représentative de confluence LMVEC monocouche en deux canaux microfluidiques (4X de grossissement). (C) cellules HL-60 présentent une laminage réponse robuste sur le TNF-α-LMVECs activé, mais pas sur LMVECs ONU-activé. Iso ctr - contrôle isotype, unact EC - cellules endothéliales non activées, TNF-α EC-loi -. Cellules endothéliales de TNF-α activé Cliquez ici pour agrandir la figure .
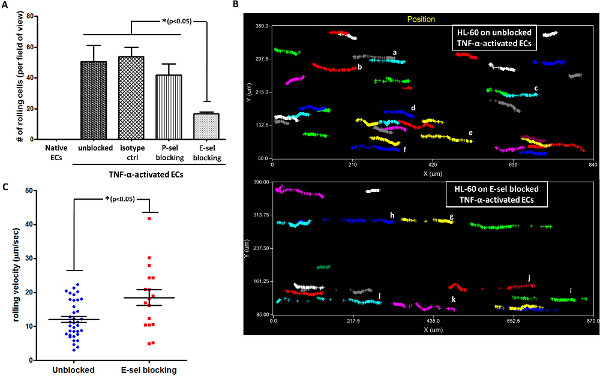 < br /> Figure 4. HL-60 roulant sur le TNF-α-activated LMVECs est médiée par la E-sélectine. (A) HL-60 roulant sur le TNF-α-activé LMVECs est médiée par E-sel, plutôt que P-sel, tel que démontré par blocage Ab test (monocouche isotype ctr-CE incubées avec un contrôle isotypique; * p <0,05, ANOVA a été utilisé avec le test post-hoc HSD de Tukey, les barres d'erreur représentent la SEM, n = 3) (B) l'analyse du chemin cellulaire révèle continu. et roulement robuste de cellules HL-60 sur EC activés bloqués par rapport à la fragmentation, roulement faible observée sur E-sel-bloqué EC activé (chaque couleur représente une cellule différente. analyse a été effectuée par un logiciel approprié). (C) HL-60 roulement vitesse sur le TNF-α activé EC est plus lente sur EC activés bloqués par rapport à E-sel-bloqué EC activé (de contrainte de cisaillement utilisé:. 2 dyn / cm 2 * p <0,05, test t, les barres d'erreur de deux à queue non appariées représentent SEM, n = 17 à 36 cellules par groupe).www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg "target =" _blank "> Cliquez ici pour agrandir la figure.
< br /> Figure 4. HL-60 roulant sur le TNF-α-activated LMVECs est médiée par la E-sélectine. (A) HL-60 roulant sur le TNF-α-activé LMVECs est médiée par E-sel, plutôt que P-sel, tel que démontré par blocage Ab test (monocouche isotype ctr-CE incubées avec un contrôle isotypique; * p <0,05, ANOVA a été utilisé avec le test post-hoc HSD de Tukey, les barres d'erreur représentent la SEM, n = 3) (B) l'analyse du chemin cellulaire révèle continu. et roulement robuste de cellules HL-60 sur EC activés bloqués par rapport à la fragmentation, roulement faible observée sur E-sel-bloqué EC activé (chaque couleur représente une cellule différente. analyse a été effectuée par un logiciel approprié). (C) HL-60 roulement vitesse sur le TNF-α activé EC est plus lente sur EC activés bloqués par rapport à E-sel-bloqué EC activé (de contrainte de cisaillement utilisé:. 2 dyn / cm 2 * p <0,05, test t, les barres d'erreur de deux à queue non appariées représentent SEM, n = 17 à 36 cellules par groupe).www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg "target =" _blank "> Cliquez ici pour agrandir la figure.
Discussion
L'un des principaux défis dans la traduction réussie de la thérapie à base de cellules exogène est l'incapacité de livrer efficacement les cellules à des sites de lésion et l'inflammation à haute efficacité greffe 3. Cellule de roulement représente une étape cruciale dans le processus de prise d'origine cellulaire, facilitant la décélération de cellules sur les parois des vaisseaux sanguins, conduisant finalement à leur adhésion ferme et la transmigration à travers l'endothélium dans le tissu 5. Une meilleure compréhension du processus de laminage pour les types de cellules de candidat peut conduire au développement de techniques pour améliorer la prise d'origine cellulaire et contribuer de manière significative à l'amélioration de la thérapie à base de cellules.
FPNC est un outil largement utilisé pour étudier des cellules de laminage, ainsi que d'autres comportements cellulaires sous un écoulement de cisaillement. L'application de PPFC pour examiner l'adhésion des neutrophiles sur l'endothélium a été étudié par Lawrence et al., En 1987, et depuis lors, la production disponible dans le commercets ont été développés 8,9. PPFCs sont constitués de deux plaques plates séparées par un joint d'étanchéité qui contrôle les dimensions de la chambre 7. La plaque supérieure comporte une entrée et orifice de sortie qui, grâce à l'utilisation d'une pompe à seringue permet la perfusion de la suspension de cellules à travers la chambre de 7,8. Il existe également un orifice supplémentaire qui applique une pression négative (vide) afin de maintenir les plaques pressées ensemble 7. Bien parallèles chambres d'écoulement de la plaque ont été effectivement utilisés pour étudier les réponses cellulaires, y compris le matériel de la cellule, dans des conditions d'écoulement de cisaillement, il existe de nombreuses limitations qui réduisent son efficacité. Une limitation majeure de chambres d'écoulement est le nombre élevé de cellules et de grands volumes de réactifs qui sont nécessaires en raison du grand volume mort dans le système d'écoulement 7. Un autre problème critique est la présence de bulles d'air, ce qui peut facilement se produire lors de l'assemblage de la chambre d'écoulement, ce qui pourrait gêner la monocouche cellulaire et le substratle revêtement sur la plaque de fond 22. Cependant, d'autres modifications ont été apportées à PPCFs traditionnelles pour incorporer un port supplémentaire sur la plaque supérieure pour agir comme un piège à bulles pour faciliter l'élimination des bulles d'air 23. Mise en place de l'expérience PPFC est aussi fastidieux, et la cellule d'écoulement est susceptible de fuite si le joint est endommagé ou non assemblés avec soin. Enfin, il existe une différence entre les vitesses de cisaillement désirées et expérimentalement appliqués, ce qui se traduit par une plage étroite de débits uniformes. En comparant avec PPFCs théoriquement quatre positions variables d'entrée et de sortie, on a constaté que deux des configurations modélisées taux de cisaillement s'écartant à partir des taux de cisaillement calculées par jusqu'à 75% de 24. Pour réutiliser la même chambre nécessite des étapes de lavage de temps, et combiné avec les défis décrits ci-dessus, ce qui rend les PPFCs assez fastidieux et bas débit.
Dans notre étude, nous avons utilisé un multi-puits p entièrement intégréSystème microfluidique de retard, en s'appuyant sur 1,2,13 d'écoulement à cisaillement contrôlé de façon précise. Cette plaque 48 puits microfluidique comprend 24 canaux microfluidiques, chaque paire de puits adjacents reliés par un canal microfluidique de 1,25. 10-12 essais de roulement peuvent être effectuées en 1 heure, ce qui permet un dépistage rapide de plusieurs dizaines de conditions en une seule journée. Les canaux microfluidiques peuvent être facilement revêtus d'un substrat de protéine ou des monocouches de cellules, et l'interaction entre les cellules d'intérêt et la surface peuvent être visualisés à l'aide d'un microscope, acquise par une caméra CCD et analysés par un logiciel compatible. Les paramètres clés tels que la quantification des cellules, le calcul de la vitesse de roulement et l'analyse spécifique de chemin de piste peuvent être facilement obtenus à analyser efficacement le comportement de roulement sur plusieurs substrats 13. Dans cette étude, nous avons évalué l'efficacité de ce système de laminage dans l'étude de la cellule à l'aide de HL-60 lignée cellulaire de leucémie promyélocytaire, «rouleaux» bien établies qui expriment cléligands de roulement, tels que PSGL-1 et sLex, qui agissent ensemble en tant que ligands de contrepartie pour P-E-sel et 15,26. En corrélation avec les rapports précédents, les cellules HL60 en effet montré un comportement de roulement robuste sur les canaux microfluidiques P-et E-SEL-enduit, avec des vitesses de roulement lent de 1-12 um / s 14,17-19. Cellules HL-60 ne roulent pas sur la surface de la fibronectine, en accord avec des rapports antérieurs montrant que les cellules indifférenciées HL-60 ne présentent pas d'interactions adhésives avec de la fibronectine 16. La conception du système microfluidique plaque multi-puits, permettant jusqu'à 10-12 essais / h, comparativement à seulement 1-2 tests / h qui peut être testée en utilisant PPFCs, augmente considérablement le débit d'au moins 5 fois. En outre, PPFCs doivent être remontés et lavé avant chaque réutilisation, ce qui ralentit encore le taux de rendement. En outre, l'écoulement facile de contrôler l'exécution rapide permet des expériences de cisaillement-dépendante, qui peut ensuite être facilement analysés par un logiciel approprié.
Nous avons ensuite cherché à tester l'efficacité de ce système microfluidique à explorer les interactions entre les cellules en suspension et un revêtement monocouche de cellules du canal. Pour ce faire, nous avons utilisé des cellules CHO-P, des cellules CHO transfectées de manière stable, qui sont pour surexprimer P-sel (figure 2A) 11,12. Cellules HL-60 ont montré une réponse de roulement significatif sur les cellules CHO-P, ce qui démontre la possibilité d'utiliser ce système pour explorer efficacement les interactions cellule-cellule sous écoulement de cisaillement donné une conception qui empêche la formation de bulles qui pourraient compromettre l'intégrité de la monocouche cellulaire , qui se produit souvent lors de l'utilisation PPFCs 22,23. Nous avons ensuite bloqué les cellules CHO-P avec des anticorps P ou E-SEL pour explorer leur implication potentielle dans le processus de laminage. Blocage P-sel réduit de façon significative le nombre de cellules roulant sur la monocouche CHO-P, indiquant une implication directe des P-sel dans la médiation du laminage HL-60, compatible avec les rapports précédents 14,18,20.E-sel et Ab isotype contrôle est sans effet sur le roulement sur HL-60 sur des cellules CHO-P, ce qui démontre que le blocage Ab peut être utilisé dans ce système microfluidique pour détecter efficacement les marqueurs spécifiques de médiation des interactions cellule-cellule. Fait important, chaque canal ne nécessite qu'un volume minimal de Abs coûteux ou de la suspension de cellules pour cette analyse, aussi peu que 25 à 50 ul, à la différence de la FPNC réactif coûteux typiques et ses grands volumes morts 7.Nous avons ensuite testé ce système de plaque à puits multiples en analysant les interactions entre les cellules HL-60 et EC revêtir le canal microfluidique. EC sont connues pour exprimer P-et E-sel au cours du processus inflammatoire 5. Pour fournir les EC avec un stimulus inflammatoire, on les pré-traité avec le TNF-α. Alors que E-sel était régulée à la hausse, P-sel n'était pas compatible avec la littérature montrant que les CE humaine exprimer E-sel, mais pas P-sel, en réponse à l'activation du TNF-α depuis le primate promoteur P-sel manque TNF éléments-α de réponse, resulting dans l'induction de la transcription de seulement E-sel 20,21. Les états inflammatoires ont ensuite été simulés à l'intérieur du canal en faisant incuber la monocouche CE avec le TNF-α, suivie par une perfusion de cellules HL-60 pour explorer ses interactions avec la surface, CE. Bien que HL-60 n'a pas interagi avec les EC non activé, ils ont fait afficher une réponse robuste laminage sur le TNF-α-activated ECS (figure 3C), en corrélation avec leur réponse rapportés dans la littérature 22. Ab expériences de blocage (figure 4A) a ensuite montré que E-sel, mais pas P-sel, le blocage a entraîné une réduction significative de la HL-60 roulant sur activé EC. Ces données démontrent l'implication directe des E-sel, et non P-sel, dans la médiation du laminage de HL-60 sur le TNF-α activé EC humain 20,21. Le Ab expériences de blocage, montrant à l'inverse roulant E-sel-médiation sur activé EC vs P-sel-médiation roulant sur CHO-P, valide encore davantage la faisabilité et la pertinence d'Ab Blockiexpériences ng effectuées rapidement dans ce système microfluidique. Fait intéressant, cette inhibition de roulement n'a pas été complète (réduction d'environ 70%), ce qui suggère que d'autres récepteurs de surface, tels que VCAM-1, participent également à HL-60 roulant sur activé EC 27. l'analyse du chemin de la piste a également révélé un autre phénomène intéressant - tandis que le roulement de HL-60 sur débloqué EC activé était continu et robuste, le faible nombre de cellules qui encore roulé sur E-sel bloqué activé EC affiché un chemin de roulement fragmenté sur le EC bloqué ( Figure 4B). Ce phénomène n'a pas été observé dans les EC incubées avec blocage P-sel ou de contrôle d'isotype (données non présentées). Cela suggère fortement que tout une réponse de roulement est possible par l'intermédiaire d'autres marqueurs lors CE E-sel est bloqué, ce roulement repose sur la faiblesse, partielles interactions HL-60-CE, en soutenant qu'une réponse de roulement lâche, partielle avec l'EC activé 5,22 ,27-29. Cette hypothèse est étayée par les données présentées sur la figure 4C , démontrant au roulement nettement plus lente des cellules HL-60 sur EC activés bloqués par rapport à leur roulement sur E-sel-bloqué activé EC, indiquant une réponse de roulement plus faible sur E-sel-bloqué EC. En utilisant le système microfluidique plaque multi-puits à la place de PPFC permis de mener les expériences HL60-ECS délicates rapidement, tout en contrôlant avec précision le débit de cisaillement, en évitant les bulles et en utilisant uniquement des volumes minimaux de Abs et les cellules. Utilisation avantageuse de la microfluidique pour des applications de roulement de la cellule a été précédemment démontré 30-33, et améliorer le débit de la microfluidique via le système de plaque multi-puits présenté ici, souligne encore le potentiel de cette technologie pour l'analyse efficace et précise des propriétés de roulement clés vers l'amélioration des applications thérapeutiques .
Cette étude a porté sur l'examen des cellules HL-60 roulant sur des substrats protéiques et des monocouches de cellules sous flux de cisaillement physiologiquement pertinente et contrôlée avec précision en utilisantun système microfluidique plaque multi-puits. De même, d'autres types de cellules et d'autres monocouches substrats / cellules peuvent facilement être utilisés pour étudier les propriétés de roulement. Facilité d'utilisation et analyse simple permet une analyse précise des propriétés de roulement importants et blocage Ab ou l'activation de différents facteurs de croissance ou des inhibiteurs peuvent être utilisés pour explorer le rôle potentiel des marqueurs moléculaires de la réponse de roulement. Cela peut être particulièrement utile pour étudier de roulement sur les cellules souches et la prise d'origine, ce qui peut être conçu pour améliorer la thérapie à base de cellules souches 34-36. Surtout, plusieurs conditions peuvent être testés avec un débit amélioré (5-10 fois plus élevé par rapport PPFCs), permettant l'étude rapide et efficace des propriétés de roulement en raison de la conception de la plaque. D'autres dosages utiles pour la prise d'origine cellulaire, telles que l'adhésion cellulaire, la chimiotaxie et la transmigration peuvent également être étudiés en utilisant ce système 1,10,13. Dans l'ensemble, ce système microfluidique apparaît comme une technique puissante pour étudier roulement et de cellulehould servir comme un outil utile pour aider à l'application clinique de la thérapie à base de cellules exogène.
Déclarations de divulgation
Auteurs déclarent aucun conflit d'intérêts.
Remerciements
Cellules CHO-P étaient une sorte de cadeau du Dr Barbara Furie (Beth Israel Deaconess Medical Center, Harvard Medical School). Ce travail a été soutenu par l'Institut national de la santé HL095722 de subvention à JMK Ce travail a également été soutenue en partie par une Fondation du cancer du Challenge Award Movember prostatique à JMK
matériels
| Name | Company | Catalog Number | Comments |
| Human Lung Microvascular Endothelial Cells | Lonza | CC-2527 | |
| P-selectin-expressing Chinese Hamster Ovary Cells (CHO-P) | Kind gift by Dr. Barbara Furie11,12 | ||
| HL-60 Cells | ATCC | CCL-240 | |
| Cell Culture Reagents | |||
| Endothelial Basal Medium | Lonza | CC-3156 | |
| EBM-2 Media | Lonza | CC-3156 | |
| Endothelial Basal Medium Supplements | Lonza | CC-4147 | |
| EGM-2 MV SingleQuots | Lonza | CC-4147 | |
| IMDM - Iscove's Modified Dulbecco's Medium 1x | Gibco | 12440 | |
| F-12 (1x) Nutrient Mixture (Ham) | Gibco | 11765-054 | |
| Penicillin Streptomycin (P/S) | Gibco | 15140 | |
| L-Glutamine (L/G) 200 mM | Gibco | 25030 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | Sa550 | |
| Petri Dishes | BD Falcon | BD-353003 | |
| 100 mm Cell Culture Dish, Tissue-Culture Treated Polystyrene | |||
| Centrifuge Tubes (15 ml polypropylene conical tubes) | MedSupply Partners | TC1500 | |
| T75 Flasks | BD Falcon | 353136 | |
| Gelatin Solution (2%) | Sigma | G1393 | |
| dPBS (without calcium chloride and magnesium chloride) | Sigma | D8537 | |
| Trypsin-EDTA Solution (10x) | Sigma | T4174 | |
| Antibodies | |||
| Anti-hE-Selectin/CD62E | R&D Systems | BBA21 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA21 | |
| Anti-hP-Selectin | R&D Systems | BBA34 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA34 | |
| FITC Mouse IgG1 κ Isotype Control | BD Bioscience | 555748 | |
| Anti-SLeX /CD15s Ab, Clone: 5F18 | Santa Cruz | SC70545 | |
| FITC Conjugated | Santa Cruz | SC70545 | |
| Normal Mouse IgM-FITC Isotype Control | Santa Cruz | SC2859 | |
| PE Mouse Anti-Human CD162, Clone: KPL-1 | BD Pharmingen | 556055 | |
| PE Mouse IgG1 k Isotype Control | BD Pharmingen | 550617 | |
| Anti-P-Selectin Ab (AK4) | Santa Cruz | SC19996 | |
| Anti-E-Selectin Ab, Clone P2H3 | Millipore | MAB2150 | |
| Mouse IgG1 Isotype Control | Santa Cruz | SC3877 | |
| Other Reagents | |||
| Recombinant Human TNF-alpha | PeproTech | 300-01A | |
| Cell Trace CFSE Cell Proliferation Kit - For Flow Cytometry | Invitrogen | C34554 | |
| Human P-selectin-FC recombinant protein | R&D Systems | 137-PS-050 | |
| Human E-selectin-FC recombinant protein | R&D Systems | 724-ES-100 | |
| Fibronectin Human, Plasma | Invitrogen | 33016-015 | |
| Equipment | |||
| Bioflux 1000 | Fluxion Biosciences | Bioflux Montage was the software used to run the experiments and analyze the data | |
| BioFlux 48-well plates | Fluxion Biosciences | ||
| BD Accuri C6 Flow Cytometer | BD Bioscience | CFlow Plus was the software used to run the experiments and analyze the data | |
| Nikon Eclipse Ti-S | Nikon | ||
| CoolSnap HQ2 CCD camera | Photometrics | ||
Références
- Conant, C. G., et al. Well plate microfluidic system for investigation of dynamic platelet behavior under variable shear loads. Biotechnol. Bioeng. 108, 2978-2987 (2011).
- Conant, C. G., Schwartz, M. A., Ionescu-Zanetti, C. Well plate-coupled microfluidic devices designed for facile image-based cell adhesion and transmigration assays. J. Biomol. Screen. 15, 102-106 (2010).
- Ankrum, J., Karp, J. M. Mesenchymal stem cell therapy: Two steps forward, one step back. Trends Mol. Med. 16, 203-209 (2010).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4, 206-216 (2009).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Ley, K. The role of selectins in inflammation and disease. Trends Mol. Med. 9, 263-268 (2003).
- Sperandio, M., Pickard, J., Unnikrishnan, S., Acton, S. T., Ley, K. Analysis of leukocyte rolling in vivo and in vitro. Methods Enzymol. 416 (06), 346-371 (2006).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunol. 2, 9 (2001).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Conant, C. G., Schwartz, M. A., Nevill, T., Ionescu-Zanetti, C. Platelet adhesion and aggregation under flow using microfluidic flow cells. J. Vis. Exp. (10), e1644 (2009).
- Furie, B., Furie, B. C. Role of platelet P-selectin and microparticle PSGL-1 in thrombus formation. Trends Mol. Med. 10, 171-178 (2004).
- Tchernychev, B., Furie, B., Furie, B. C. Peritoneal macrophages express both P-selectin and PSGL-1. J. Cell Biol. 163, 1145-1155 (2003).
- Conant, C. G., et al. Using well-plate microfluidic devices to conduct shear-based thrombosis assays. J Lab Autom. 16, 148-152 (2011).
- Larsen, G. R., et al. P-selectin and E-selectin. Distinct but overlapping leukocyte ligand specificities. J. Biol. Chem. 267, 11104-11110 (1992).
- Varki, A. Selectin ligands: will the real ones please stand up. J. Clin. Invest. 100, S31-S35 (1997).
- Bohnsack, J. F., Chang, J. Activation of beta 1 integrin fibronectin receptors on HL60 cells after granulocytic differentiation. Blood. 83, 543-552 (1994).
- Lawrence, M. B., Kansas, G. S., Kunkel, E. J., Ley, K. Threshold levels of fluid shear promote leukocyte adhesion through selectins (CD62L,P,E). J. Cell Biol. 136, 717-727 (1997).
- Moore, K. L., et al. P-selectin glycoprotein ligand-1 mediates rolling of human neutrophils on P-selectin. J. Cell Biol. 128, 661-671 (1995).
- Lawrence, M. B., Springer, T. A. Neutrophils roll on E-selectin. J Immunol. 151, 6338-6346 (1993).
- Yao, L., et al. Divergent inducible expression of P-selectin and E-selectin in mice and primates. Blood. 94, 3820-3828 (1999).
- Sackstein, R. Glycoengineering of HCELL, the human bone marrow homing receptor: sweetly programming cell migration. Ann. Biomed. Eng. 40, 766-776 (2012).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of physiologic E-selectin-mediated leukocyte rolling on microvascular endothelium. J. Vis. Exp. , e1009 (2009).
- Muller, W. A., Luscinskas, F. W. Assays of transendothelial migration in vitro. Methods Enzymol. 443, 155-176 (2008).
- Bakker, D. P., vander Plaats, A., Verkerke, G. J., Busscher, H. J., vander Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Appl. Environ. Microbiol. 69, 6280-6287 (2003).
- Benoit, M. R., Conant, C. G., Ionescu-Zanetti, C., Schwartz, M., Matin, A. New device for high-throughput viability screening of flow biofilms. Appl. Environ. Microbiol. 76, 4136-4142 (2010).
- Varki, A. Selectin ligands. Proc. Natl. Acad. Sci. U.S.A. 91, 7390-7397 (1994).
- Ramos, C. L., et al. Direct demonstration of P-selectin- and VCAM-1-dependent mononuclear cell rolling in early atherosclerotic lesions of apolipoprotein E-deficient mice. Circ. Res. 84, 1237-1244 (1999).
- Yago, T., et al. Core 1-derived O-glycans are essential E-selectin ligands on neutrophils. Proc. Natl. Acad. Sci. U.S.A. 107, (2010).
- Yago, T., et al. E-selectin engages PSGL-1 and CD44 through a common signaling pathway to induce integrin alphaLbeta2-mediated slow leukocyte rolling. Blood. 116, 485-494 (2010).
- Simone, G., et al. Cell rolling and adhesion on surfaces in shear flow. A model for an antibody-based microfluidic screening system. Microelectronic Eng. 98, 668-671 (2012).
- Perozziello, G., et al. Microfluidic devices modulate tumor cell line susceptibility to NK cell recognition. Small. 8, 2886-2894 (2012).
- Perozziello, G., et al. Microfluidic biofunctionalisation protocols to form multivalent interactions for cell rolling and phenotype modification investigations. Electrophoresis. , (2013).
- Simone, G., et al. A facile in situ microfluidic method for creating multivalent surfaces: toward functional glycomics. Lab Chip. 12, 1500-1507 (2012).
- Sarkar, D., et al. Engineered cell homing. Blood. 118, e184-e191 (2011).
- Cheng, Z., et al. Targeted Migration of Mesenchymal Stem Cells Modified With CXCR4 Gene to Infarcted Myocardium Improves Cardiac Performance. Mol. Ther. 16, 571-579 (2008).
- Enoki, C., et al. Enhanced mesenchymal cell engraftment by IGF-1 improves left ventricular function in rats undergoing myocardial infarction. Int. J. Cardiol. 138, 9-18 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon