Method Article
Систематический анализ
В этой статье
Резюме
В настоящем исследовании использованы микрофлюидных многопартийной системы и пластины, что значительно увеличивает пропускную способность исследований клеток качения под физиологически соответствующего сдвигового течения. Учитывая важность клеток прокатки в многоступенчатом клетки самонаведения каскад и важность клеток самонаведения следующий системной доставки экзогенных популяциях клеток у пациентов, эта система предлагает потенциал в качестве скринингового платформы для улучшения клеточной терапии.
Аннотация
Одна из основных задач для клеточной терапии является невозможность системно целевой большое количество жизнеспособных клеток с высокой эффективностью в тканях интерес после внутривенного или внутриартериального вливания. Следовательно, увеличение клеток самонаведения в настоящее время изучается как стратегии по улучшению клеточной терапии. Сотовый прокатки на эндотелий сосудов является важным шагом в процессе клеточного самонаведения и может прощупываться в пробирке с помощью параллельного проточную камеру пластина (PPFC). Тем не менее, это крайне утомительной, низкой пропускной анализ, с плохо контролируемых условий потока. Вместо этого мы использовали микрофлюидных многопартийной системы и пластины, что позволяет изучение свойств сотовой прокатки в более высокой пропускной способности при точно контролируемой, физиологически соответствующего сдвигового течения 1,2. В этой статье мы покажем, как The Rolling свойства HL-60 (промиелоцитарный лейкоза человека) клеток на P-и E-селектина покрытием поверхностей, а также на однослойных покрытием поверхностей клеток может быть readilу рассмотрели. Чтобы лучше имитировать воспалительных состояний, микрофлюидных поверхность канала была покрыта эндотелиальных клеток (ECS), которые затем были активированных фактор некроза опухоли-α (ФНО-α), что значительно увеличивает взаимодействия с HL-60 клеток в динамических условиях. Повышенная пропускная способность и интегрированная многопараметрический анализ программная платформа, которая позволяет быстрый анализ параметров, таких как прокатки скорости и подвижного путь, являются важными преимуществами для оценки свойств ячеек прокатки в пробирке. Разрешение быстрый и точный анализ инженерных подходов, направленных на влияние клеток прокатки и самонаведения, эта платформа может способствовать продвижению экзогенный клеточной терапии.
Введение
Одна из основных проблем в успешной клинической переводе клеточной терапии является неэффективным поставки или адресности системно переплетаются клеток к желаемым сайтов 3,4. Следовательно, существует постоянный поиск подходов к повышению клеток самонаведения, и, в частности клеток прокат, в качестве стратегии для улучшения клеточной терапии. Сотовый прокатки на кровеносные сосуды является ключевым шагом в клетки самонаведения каскада, классически, определенной для лейкоцитов, которые набраны на сайты болезни 5. Этот шаг регулируется специфических взаимодействий между эндотелиальными селектинов, то есть P-и E-селектина (P-и E-SEL), и их лиганды счетчик на поверхности лейкоцитов 5,6. Лучшее понимание и повышение эффективности клеточной самонаведения, и, в частности подвижного шаг, имеют большое значение в поиске новых платформ для улучшения клеточной терапии. На сегодняшний день это было достигнуто с помощью параллельных камер потока пластина (PPFCs), включающий два плоских Platэс с прокладкой между ними, с притоком и оттоком порт, расположенный на верхней пластине, через которые клеточную суспензию перфузии с помощью шприцевой насос 7,8, 9. Поверхность нижней пластины могут быть покрыты соответствующими монослой клеток / подложек и взаимодействие между клетками и перфузии поверхности под сдвиговом потоке затем исследовали 7. Тем не менее, PPFC является низкая пропускная способность, реагент трудоемкий, и довольно утомительно метод, с образованием пузырьков, утечки, и плохо контролируемым потоком, представляя основные недостатки.
Альтернативный метод с традиционным PPFC является многопрофильным лунками микрофлюидных система, позволяющая более высокую пропускную способность сотовых анализов (до 10 раз выше, чем PPFCs) под точной, сдвигового течения с компьютерным управлением, с низким потреблением реагента 1,10. Эксперименты Cell прокатки выполняется внутри микроканалов, которые могут быть покрыты клеточных монослоев или модифицированных субстратов и отображаемого USIнг микроскоп, с прокатных свойств легко проанализированы с использованием подходящего программного обеспечения. В этом исследовании мы демонстрируем возможности этого мульти-луночного планшета микрофлюидных системы от изучения прокатки свойства человеческого промиелоцитарного лейкоза (HL-60) клеток на различных поверхностях. HL-60 прокатки на подложках, таких как P-и E-SEL, а также на монослои клеток, экспрессирующих различные рецепторы прокатки, была проанализирована. Кроме того, антитела (Ab) блокирование был использован, чтобы продемонстрировать непосредственное участие конкретных селектинов в посредничестве прокатки движение HL-60 на тех поверхностях. Прокатные Эксперименты проводились с повышенной пропускной способности, при устойчивом сдвиговом потоке, с минимальным потреблением реагента / клеток, что позволяет проводить эффективный анализ ключевых параметров прокатки, таких как скорости качения, количество прокатных клеток и прокатных свойств пути.
протокол
1. Культура клеток
- Человека промиелоцитарный лейкоз (HL-60) клетки
- Культура HL-60 клеток в 75 см 2 колбы с 15 мл Искова модифицированной Дульбекко среды (IMDM), дополненной 20% (объем / объем) фетальной бычьей сывороткой (FBS), 1% (об / об) L-глутамина и 1 % (объем / объем) пенициллин-стрептомицин.
- Изменение СМИ каждые 3 дня путем аспирации половину объема клеточной суспензии и заменить его полной IMDM СМИ.
- Для Карбоксифлуоресцеин диацетат, сукцинимидил эфир (CFSE) окрашивание, центрифуге HL-60 клеточной суспензии (400 XG, 5 мин), ресуспендируют в растворе 1 мкМ CFSE (полученного в предварительно нагретом PBS) и инкубировали в течение 15 мин при 37 ° С Тогда центрифуги клетки, аспирации супернатант и ресуспендирования клеток в свежей нагретого среды в течение 30 мин. Вымойте клеток в PBS, а затем использовать для прокатки экспериментов (см. рис 1В для представительного образа CFSE окрашенных HL-60 клеток на P-сель покрытием поверхности).
Примечание: окрашивание CFSE не является обязательным, и представлена здесь, чтобы продемонстрировать качению явление в микрофлюидных канала. Анализ прокатки параметров, представленных в этой рукописи была выполнена на неокрашенных клеток с использованием стандартного изображений светлое.
- Легких эндотелиальные клетки микрососудов (LMVECs)
- Coat 100 мм чашки Петри с 0,1% раствора желатина (об / об) в ЗФР и инкубируют при 37 ° С в течение по крайней мере 30 мин.
- Культура LMVECs на покрытые желатином 100 мм чашках Петри в полной среде роста эндотелия (эндотелиальный базальный среда-2 (EBM-2)) с добавлением определенного набора добавок рост см. реактивов). Изменение носителя через день и суб-культуры клеток по достижении 80-90% слияния.
- Для субкультуры, мыть клетки с PBS, а затем отделить клетки с 4 мл 1х трипсин-ЭДТА в течение 3 мин при 37 ° С и нейтрализуют в равном объеме полных EBM-2 сред. Передача клеточной суспензии в 15 мл пробирку и centrifugе (400 XG, 5 мин). После центрифугирования ресуспендируют осадок в 1 мл полной эндотелиальных информации и подсчета клеток с помощью гемоцитометра. Не более-проход клетки, так как это влияет на их морфологию и функцию-использование только ячейки при переходе 7 для всех экспериментов.
- Яичника китайского хомячка-P-селектин (CHO-P) Клетки
- СНО-P клетки, которые являются СНО, стабильно трансфицированные выразить человеческую P-Сель, были предоставлены сотрудниками (Beth Израиля Медицинский Центр Диаконисы, Гарвардской медицинской школы) 11,12.
- Культура СНО-P клетки в T175 см 2 колбы в 25 мл F-12 средств массовой информации.
- Для пассирования, мыть клетки с 10 мл PBS в течение 4-5 сек, а затем Trypsinize в 10 мл 1х трипсин-ЭДТА в течение 3 мин при 37 ° С, с последующей нейтрализацией в полном объеме средств массовой информации.
- Центрифуга клеточной суспензии (400 XG, 5 мин), тщательно аспирата супернатант, ресуспендируют осадок клеток в 1 мл полной информации и подсчет клеток сгемоцитометр.
2. Работы интегрированной плиты на нескольких хорошо микрофлюидных системы
- Убедитесь, что все оборудование подключено и включите различных модулей: компьютерные, контроллеров, инвертированный микроскоп, и ПЗС камеры.
- Откройте для обработки изображений; убедиться, что модуль пластина нескольких хорошо и модуль визуализации правильно представлены на экране.
- Подключите трубы к пароблокировки (подключенного к контроллеру), а также соединить их к интерфейсу давления.
- Поместите пластину мульти-а в своей тарелке отопителя / адаптера. Добавить реагентов в лунки (см. ниже) и прикрепить интерфейс на верхней части пластины. Поместите пластину для работы с изображениями на автоматизированной этапе.
- Интерфейс прикрепляется к верхней части пластины и применяет пневматическое давление от контроллера к верхней части скважин, движущей текучей среды через микроканалов на определенной скорости потока, легко управлять с помощью мульти-луночный планшет сМодуль экрана под ручном режиме.
- Реагенты в потоке канала через смотровой площадке, расположенной между скважинами. Микрофлюидных размеры канала являются 350 мкм в ширину х 70 мкм в высоту. Длина линейного канала составляет 1 мм, а нижний из каналов содержит покровное стекло 180 мкм, который совместим с светлого, фазы флуоресценции и конфокальной микроскопии.
- Приобретать видео с помощью ПЗС-камеры (приобретение поток, 11 кадров / сек) и анализировать с помощью совместимого программного обеспечения.
3. Покрытие микроканалов с белковым субстратом или клеточный монослой
- Покрытие микрофлюидных канал с фибронектина или P-/E-selectin
- Подготовка 1 мл 20 мкг / мл фибронектина раствора в PBS. Изменение громкости в зависимости от количества каналов для нанесения покрытия (25-50 мкл использовать фибронектина на канал).
- Добавить 25-50 мкл фибронектина решение для каждого входе хорошо. Применить сдвига силу 2 дин / см 2в течение 5 мин, чтобы заливать канал. Пожалуйста, обратите внимание борт жидкости появляются на выходе хорошо. Инкубировать в течение 30-45 минут при комнатной температуре
- Аспирируйте решение от скважин (не аспирации непосредственно из средней окружности, которая кормит канал) 1,13. Добавить 200-500 мкл PBS в выходе хорошо и мыть канал с PBS, применяя поток сдвиг 2 дин / см 2 в течение 5 мин. Теперь канал должным образом покрыты фибронектина и готов к использованию.
- Для пальто с P-или E-SEL, подготовить 5 мкг / мл раствор желаемого человеческого рекомбинантного белка в PBS, и пальто каналов, как описано выше, с 1 ч инкубации при 37 ° С, чтобы позволить покрытие поверхности.
- Создание СНО-P или LMVEC монослоя внутри микрожидкостных канал
- Осторожно Trypsinize клетки из культуральных чашек в течение 3 мин, погасить с помощью 2-кратный объем полных сред и центрифуге (5 мин при 400 х г). Ресуспендируют клеток с 10 мл полной информации и центрифуги (5 мин при 400 х г) Агаин.
- Граф клеток для определения концентрации клеток в суспензии. Чтобы обеспечить формирование сливной LMVEC монослоя внутри канала, довести концентрацию клеток до 15-20 млн. клеток / мл. Для сливной СНО-P клеточный монослой, использовать 50-60 миллионов клеток / мл. Использование 25-50 мкл клеточной суспензии для каждого канала - определить начальное число клеток использовали для эксперимента соответственно.
- Добавить 25-50 мкл клеточной суспензии в соответствующей концентрации к впускному отверстию скважины. Место пластины на столик микроскопа и ввести клетки в канал (2 дин / см 2), пока клетки наблюдаются на экране занимает весь каналов, а затем остановить поток.
- Заполните как выход и вход с 200 мкл либо полной LMVEC или СНО СМИ. Пусть клетки осесть и придерживаться в течение 3 ч в инкубаторе (37 ° C, 5% CO 2).
- После 3 ч инкубации, мыть канал с полным СМИ (2 дин / см 2, 10-15 мин), чтобы удалить одинокихклетки. Теперь Клетки должны появиться полностью сливающиеся и канал готов к использованию. В зависимости от начальной плотности посева клеток, дополнительные 2-3 часа заселения время может потребоваться для обеспечения полного охвата поверхности с клетками.
4. LMVEC провоспалительных Активация и антител Блокирование P-/E-selectin
- Подготовка TNF-α раствор (10 нг / мл) в LMVEC основных сред.
- Чтобы индуцировать воспалительный активацию LMVEC в каналах, добавьте 100 мкл TNF-α раствора к входному отверстию хорошо и вводить раствор в канал с применением сдвиговом потоке 2 дин / см 2 в течение 5 мин. Для каналов управления (неактивированных ECS), добавить 100 мкл LMVEC основных сред на вход хорошо и ввести в канал (2 дин / см 2 в течение 5 мин). Канал готов к прокатного анализа.
- Чтобы заблокировать P-Сель и E-Сель на LMVECs и СНО-P клеток, ввести нейтрализации P-SEL (клон AK4, 5 мкг / мл в басал носитель) или E-SEL (клон P2H3, 5 мкг / мл в базальной среде) антител в канал и инкубировать в течение 1 часа при 37 ° С. Затем промыть каналы с базальной СМИ (2 дин / см 2 в течение 5 мин). Каналы теперь готовы для прокатки анализа.
5. HL-60 Роллинг Анализ на Субстрат / клеточный монослой покрытием микроканалов
- Тщательно изучить каналов под микроскопом, чтобы подтвердить, что каналы должным образом с покрытием (в случае покрытия с клетками, полностью сливной монослой клеток следует соблюдать).
- Для подготовки HL-60 клеточной суспензии для прокатных экспериментов, центрифуги HL-60 клеточной суспензии (5 мин при 400 х г) и мыть один раз с базальных СМИ. Граф клеток и ресуспендируют в IMDM (базальные средств массовой информации, содержащие Са 2 + и Mg 2 +), чтобы создать HL-60 клеточной суспензии с 5 миллионов клеток / мл. Использование 25-50 мкл клеточной суспензии для каждого канала для выполнения прокатки анализа.
- Добавить 25-50 мкл клеточной suspension к выходу хорошо, место пластину внутри контролируемой температурой держателе (37 ° C) и места на столик микроскопа. Затем ввести клетки в канал с применением сдвига силу 2 дин / см 2 (клетки должны соблюдаться в пределах 10-15 сек, вытекающей из розетки, чтобы вход).
- Для изучения качению ответ в зависимости от напряжения сдвига, уменьшить сдвиг до 0,25 дин / см 2 и приобрести 20-30 секунд видео (с помощью функции "приобретения поток") в каждой требуемой сдвига (увеличение сдвига постепенно от 0,25 до 5 дин / см 2. Кроме того, можно использовать более высокие ножницы).
- Приобретать видео с помощью ПЗС-камеры (приобретение поток, 11 кадров / сек) и анализировать прокатных пути и подвижного скорости через совместимое программное обеспечение.
6. Проточной цитометрии для обнаружения экспрессии поверхностных молекул
- После трипсинизации, подготовить суспензии клеток (с помощью 1-2 × 10 5 клеток / образец) желаемого типа клеток (HL-60, СНО-P или LMVECs) в PBS (- / -), с добавлением 2% FBS. Вымойте клетки дважды и принести объем образца 50 мкл (используя тот же буфер).
- Инкубируют каждый образец с желаемым флуорофора, конъюгированным АВ (см. прилагаемую таблицу для более подробной информации) при 4 ° С в течение 20 мин (покрывают алюминиевой фольгой).
- Вымойте клетки дважды (тот же буфер) и принести окончательный объем окрашенных клеточной суспензии в 200 мкл. Анализ образцов использованием проточного цитометра, чтобы обнаружить экспрессию поверхностных молекул.
Результаты
HL-60 клеток кататься по P-и E-селектина поверхностей, но не на фибронектине
HL-60 клетки считаются золотым стандартом "ролики", как они выражают различные самонаводящихся лигандов, в том числе подвижного лигандов P-гликопротеинов SEL лиганд-1 (PSGL-1) и сиалил-Льюиса X (Slex) 5,14 (фиг.1А ). Поверхности белка PSGL-1 действует как эшафот для тетра-сахарид Slex, посреднические специфическое взаимодействие с Р-и Е-Сель, которые до-регулируются на эндотелия при воспалении 5,6,15. Для проверки возможности мульти-луночного планшета микрофлюидных системы, многочисленные микрофлюидных каналы были покрыты одновременно с различных подложках и прокатных взаимодействий HL-60 клеток с анализировали те поверхности. HL-60 клетки демонстрировали устойчивую прокатки поведение на P-SEL поверхности, покрытой с клетками первого захваченных из потока, а затем отдельной прокатки движения. Как показано на рисунке 1C, и состоятENT с литературой, HL-60 клетки обладают аналогичной прокатки поведение на E-SEL поверхностей, но не на покрытой фибронектином субстратов 14,16-19. Скорость сотовый, проанализированы с помощью совместимого программного обеспечения, был заговор против напряжения сдвига, показывая надежную качению реакции клеток на Р-и Е-Сель со средней скоростью между 1-12 мкм / сек.
HL-60 клеток кататься по СНО-P монослоя покрытием микрожидкостных канал
Далее мы направлена на оценку возможности использования этого микрофлюидных систему для эффективного тестирования взаимодействия между клетками, представляющих интерес и клеточный монослой покрытия поверхности. Чтобы исследовать взаимодействие HL-60 клеток с монослое клеток, который выражает прокатки маркеры были использованы CHO-P клетки, которые трансфицировали в стабильной экспрессии P-, а не E-, SEL (Фигура 2А. Также см. фиг.2В для представителя Образ HL-60 клеток на СНО-P монослоя, покрывающих микрофлюидных канал) 11,12. НL-60 клеток отображается сильный качению ответ на СНО-P клеток (рис. 2, в). Чтобы проверить, является ли эта прокатки движение действительно опосредовано P-SEL, CHO-P монослой предварительно инкубируют с блокирующие антитела для либо P-или E-SEL, до перфузии HL-60 клеток в канале. Как показано на фиг.2С, блокируя CHO-P монослой с P-SEL результате Ab к значительному снижению количества подвижного HL-60 клеток на поверхности, демонстрируя, что P-SEL действительно опосредует HL-60 прокатки, как описано ранее 14,18. Выполнение анализа в микрофлюидном канала позволяет быстро скрининг различных условиях и эффективного блокирования рецепторов, используя только небольшие объемы, как мало, как 25 мкл. Контроль Изотип или Ab блокирования E-Сель (который не экспрессируется на СНО-P клеток) не влияет на количество прокатных клеток на СНО-P клеток, демонстрируя силу этого анализа в точно пин-указывая непосредственное участие конкретного Surfacе маркеры в сотовых прокатки взаимодействий.
Прокатка HL-60 клеток на TNF-активированных LMVECs опосредуется Е-селектина
Эндотелиальные клетки, как известно, до-регулировать поверхностных маркеров адгезии, таких как Р-и Е-сель, во время воспаления, оказывает помощь в вербовке лейкоцитов к участкам воспаления 5,6. Тем не менее, в то время как мышиный ЭК выразить как P-и E-Сель в ответ на воспалительные стимулы, как интерлейкин-1 (ИЛ-1) и фактор некроза опухоли-α (ФНО-α), человеческий ЭК только выразить E-Сель в ответ на них цитокинов 20,21. Это было подтверждено в нашей проточной цитометрии, показывающий экспрессию Е-SEL, но не P-SEL, на легких микрососудистой эндотелиальных клеток (LMVEC) в ответ на TNF-α стимуляции (фиг.3А). Мульти-хорошо микрофлюидных пластина состоит из многочисленных отдельных микроканалов, что позволяет повысить пропускную тестирование нескольких различных условиях. Мы использовали этот выгодный проектк пластине LMVECs внутри микрожидкостных каналов (рис. 3В), чтобы быстро проанализировать взаимодействий HL-60 клеток с ЭК под несколькими условиями. Чтобы смоделировать воспалительные параметры, LMVECs предварительно обрабатывали провоспалительного цитокина TNF-, α. Интересно, что HL-60 клетки не взаимодействуют с не-активированный LMVECs, и клетки не были обнаружены в рулон на этой поверхности. Напротив, HL-60 клеток продемонстрировали сильное прокатки поведение на TNF-α-активированный LMVECs, со средней скоростью 5-15 мкм / сек (фиг.3С).
Затем направлена на изучение участие P-SEL или E-SEL в направлении прокатки взаимодействия между HL-60 клеток и активированных LMVECs. Для этого, TNF-α-активированный ЭК предварительно инкубировали с P-SEL или E-SEL блокирующие антитела, а прокатка HL-60 клеток была проанализирована. Как показано на фиг.4А, блокирование E-SEL, который был повышающей регуляции на TNF-α-активированный LMVECs, привело к significмуравей снижение количества подвижного клеток на активированной эндотелия монослоя. В отличие от этого, с помощью элемента управления изотипа или Ab против Р-сель, который не был экспрессируется на активированных ЭК, не было существенного влияния на HL-60 прокатки на активированной эндотелия слоя. Эти данные показывают, непосредственное участие E-сель в HL-60 катится по TNF-α-активированный ЭК, в соответствии с предыдущими докладами 20,21. Из полученных видео, программное обеспечение анализ позволяет один отслеживать пути отдельных клеток, взаимодействующих с подложкой. Мы использовали эту возможность, чтобы специально отслеживать путь отдельных клеток, что взаимодействовали с TNF-α-активированный ЭК с / без блокировки E-сель. Как показано на рисунке 4В, количество подвижного клеток на неблокированных активированных LMVECs была значительно выше, чем на E-Сель-заблокирован активирована этике. Кроме того, оказалось, что прокатки движение HL-60 на неблокированных LMVECs непрерывна и надежной, в то время как прокатные пути клетокна E-сель-заблокирован ЭК была фрагментирована (каждый цвет представляет собой другую ячейку, см., например, клеток аф против гл в фиг.4В). В консистенции с этой находки, скорость качения из HL-60 клеток на разблокированном TNF-α-активированный ЭК была значительно ниже, чем их скорости качения на E-сель-заблокирован ECS (Рисунок 4C).
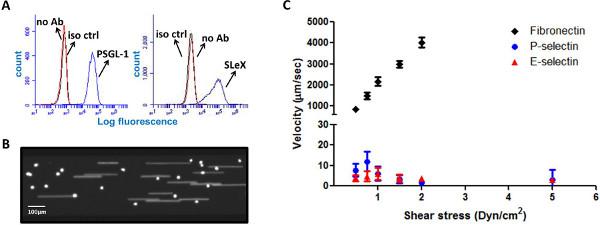
Рисунок 1. HL-60 клеток кататься по P-и E-селектина покрытием поверхностей. () HL-60 клеток выразить прокатки лиганды PSGL-1 и Slex (Iso CTR - изотипический контроль, нет Ab - нет антител). (В) представитель моментальный снимок образ CFSE окрашенных HL-60 клеток на P-сель покрытием поверхности в потоке. (С) HL-60 клеток надежно свернуть на Р-и Е-SEL покрытием поверхностей, но не на фибронектине. Роллинг скорость заговор против напряжения сдвига (п = 10-15 клеток на точки данных, скорости были проанализированы совместимого программного обеспечения). Нажмите здесь, чтобы увеличить рисунок .

Рисунок 2. HL-60 прокатки на СНО-P клеточный монослой напрямую опосредуется P-сель. (A) СНО-клетки экспрессируют P P-SEL, но не E-SEL. (B) представитель изображение HL-60 клеток на CHO-P монослоя покрытие поверхности микрожидкостных канал (10x). (C) HL -60 клеток кататься по СНО-P монослоя напрямую опосредуется P-сель о чем свидетельствует Ab блокирования анализа (разблокирован - СНО-П монослой не инкубировали с антителами, изотипу CTR-СНО-P монослоя инкубированной с изотипического контроля; * р <0,05, в одну сторону ANOVA был использован с HSD теста после специальной Тьюки, планки погрешностей представляютSEM, п = 3.
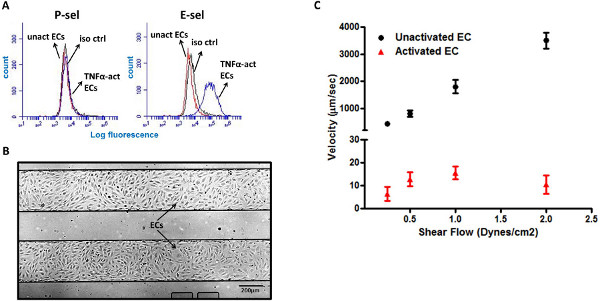
Рисунок 3. HL-60 клеток кататься по TNF-α-активированный LMVECs. (A) TNF-α активации LMVECs вызывать поверхностную экспрессию Е-SEL, но не P-SEL. (B) представитель изображение сливной LMVEC монослое в двух микроканалов (4x-кратное увеличение). (C) HL-60 клетки обладают надежная прокатки ответ на TNF-α-активированный LMVECs, но не на не-активируется LMVECs. Iso CTR - изотипу контроль, unact ЭК - неактивированных эндотелиальные клетки, TNF-α-акт по этике -. TNF-α-активированный эндотелиальные клетки Нажмите здесь, чтобы увеличить рисунок .
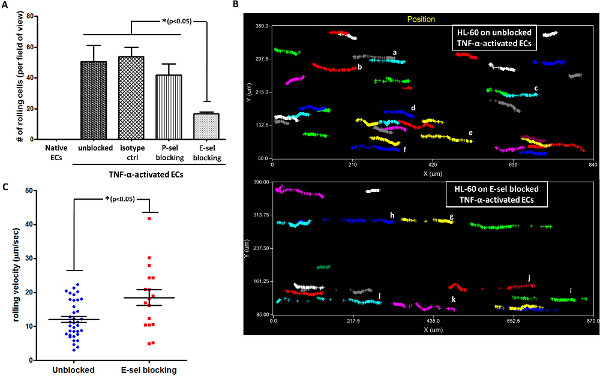 < бр /> Рисунок 4. HL-60 прокатки на TNF-α-активированный LMVECs опосредуется Е-селектина. (A) HL-60 прокатки на TNF-α-активированный LMVECs опосредуется E-SEL, а не P-SEL, о чем свидетельствует блокирования Ab анализ (изотипу CTR-ЕС монослой инкубировали с изотипического контроля; * р <0,05, в одну сторону ANOVA был использован с HSD теста после специальной Тьюки, планки погрешностей представляют SEM, п = 3) (В) Анализ путь Сотовый показывает непрерывно. и надежный прокатка HL-60 клеток на Разблокированные активированных ЭК по сравнению с фрагментированной, слабый прокатки, наблюдаемой на E-SEL-блокированного активированного ECS (каждый цвет представляет другую ячейку. Анализ проводили с помощью соответствующего программного обеспечения). (C) HL-60 прокатка скорость на ФНО-α-активированной ЭК медленнее на неблокированных активированных ЭК по сравнению с E-Сель-блокированного активированного ECS (напряжение сдвига используется:. 2 дин / см 2 * р <0,05, непарные двухсторонний т-тест, Столбики ошибок обозначают SEM, n = 17-36 клеток в группе).www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg "целевых =" _blank "> Нажмите здесь, чтобы увеличить рисунок.
< бр /> Рисунок 4. HL-60 прокатки на TNF-α-активированный LMVECs опосредуется Е-селектина. (A) HL-60 прокатки на TNF-α-активированный LMVECs опосредуется E-SEL, а не P-SEL, о чем свидетельствует блокирования Ab анализ (изотипу CTR-ЕС монослой инкубировали с изотипического контроля; * р <0,05, в одну сторону ANOVA был использован с HSD теста после специальной Тьюки, планки погрешностей представляют SEM, п = 3) (В) Анализ путь Сотовый показывает непрерывно. и надежный прокатка HL-60 клеток на Разблокированные активированных ЭК по сравнению с фрагментированной, слабый прокатки, наблюдаемой на E-SEL-блокированного активированного ECS (каждый цвет представляет другую ячейку. Анализ проводили с помощью соответствующего программного обеспечения). (C) HL-60 прокатка скорость на ФНО-α-активированной ЭК медленнее на неблокированных активированных ЭК по сравнению с E-Сель-блокированного активированного ECS (напряжение сдвига используется:. 2 дин / см 2 * р <0,05, непарные двухсторонний т-тест, Столбики ошибок обозначают SEM, n = 17-36 клеток в группе).www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg "целевых =" _blank "> Нажмите здесь, чтобы увеличить рисунок.
Обсуждение
Одна из основных проблем в успешного перевода экзогенного клеточной терапии является невозможность эффективно доставлять клетки к местам повреждения и воспаления с высокой эффективностью приживления 3. Сотовый прокатки представляет собой важный шаг в процессе клеточного самонаведения, облегчая замедление клеток на стенках кровеносных сосудов, в конечном счете, приводит к их фирмы адгезии и переселение через эндотелий в ткани 5. Лучшее понимание процесса прокатки для типов кандидат клеток может привести к развитию методов повышения клеток самонаведения и вносят значительный вклад в направлении улучшения клеточной терапии.
PPFC является широко используемым инструментом для изучения клеток прокатки, а также других клеточных поведения в потоке сдвига. Применение PPFC для изучения нейтрофилов адгезии на эндотелии сначала изучали Лоуренс и соавт. В 1987 году, и с тех пор в продаже производствоTS были разработаны 8,9. PPFCs состоит из двух плоских пластин, разделенных прокладкой, которая управляет размеры камеры 7. Верхняя пластина содержит приток и отток порт, который с использованием шприцевого насоса позволяет перфузию клеточной суспензии через камеру 7,8. Существует также дополнительный порт, который применяется отрицательное давление (вакуум), чтобы держать тарелки прижаты друг к другу 7. Хотя параллельные камеры потока пластина были эффективно использованы для расследования клеточные ответы, в том числе клеток прокатки, в условиях сдвига потока, имеются многочисленные ограничения, которые снижают его эффективность. Главное ограничение проточных камерах является большое число клеток и больших объемов реагентов, которые необходимы в связи с большим мертвым объемом в системе потока 7. Другим важным вопросом является наличие пузырьков воздуха, которые могут легко возникнуть в ходе камеры поток сборки, потенциально препятствуя клеточный монослой и подложкипокрытие на нижней пластине 22. Однако дальнейшие модификации были сделаны с традиционными PPCFs включать дополнительный порт на верхней пластине действовать в качестве пузыря ловушку для облегчения удаления пузырьков воздуха 23. Настройка эксперимент PPFC также утомительным, и клетка поток подвержен утечке если прокладка повреждена или не собран тщательно. Наконец, существует разница между желаемым и экспериментально применяемых скоростях сдвига, что приводит в узком диапазоне единых скорости потока. По теоретически сравнении четыре PPFCs с различной входной и выходной позиции, было обнаружено, что две из конфигураций моделируется скорости сдвига, что отклоняется от расчетных скоростях сдвига до 75% 24. Чтобы повторно использовать ту же камеру требует трудоемких стадий промывки и в сочетании с описанными выше проблемами, это делает PPFCs довольно трудоемким и низкой пропускной.
В нашем исследовании мы использовали полностью интегрированный мульти-а рпоздно микрофлюидных система, опираясь на точное управление 1,2,13 потока сдвига. Это 48 хорошо микрофлюидных пластина включает в себя 24 микрофлюидных каналов, с каждой парой соседних скважин, связанных с микрофлюидном 1,25 канала. 10-12 прокатки анализы могут быть выполнены в 1 ч, позволяя быстрого скрининга нескольких десятков условиях в течение одного дня. Микрофлюидных каналы могут быть легко покрыты белковым субстратом или монослоев клеток, а также взаимодействие между клетками интерес и поверхностью могут быть отображены с помощью микроскопа, приобретенный с помощью ПЗС-камеры и анализируют с помощью совместимого программного обеспечения. Основные параметры, такие как клетки, количественного расчета скорости качения и конкретного анализа след траектории могут быть легко получены эффективно анализировать поведение прокатки на нескольких подложек 13. В этом исследовании, мы оценили эффективность этой системы в изучении клеток прокатки с помощью HL-60 промиелоцитарной линию клеток лейкемии, солидные "ролики", которые выражают ключпрокат лиганды, такие как PSGL-1 и Slex, которые вместе выступают в качестве контрагентов лигандов для P-и E-сель 15,26. В корреляции с предыдущими докладами, HL60 клетки действительно выставлены надежную качению поведение на P-и E-Сель-покрытием микроканалов, с медленными скоростями прокатки 1-12 мкм / сек 14,17-19. HL-60 клетки не катиться по поверхности фибронектин, в соответствии с предыдущими сообщениями, показывающими, что недифференцированные HL-60 клетки не обладают адгезивных взаимодействий с фибронектином 16. Конструкция мульти-луночного планшета микрофлюидных системы, что позволяет до 10-12 анализов / час по сравнению с только 1-2 анализах / час, что может быть проверена с помощью PPFCs, значительно увеличивает пропускную способность, по крайней мере в 5 раз. Кроме того, PPFCs должны быть собраны и промывают перед каждым повторным использованием, дальнейшее замедление скорости производительности. Кроме того, легко контролируемый поток обеспечивает быстрое выполнение сдвига в зависимости от экспериментов, которые затем могут быть легко проанализированы с помощью соответствующего программного обеспечения.
Затем мы направлены для проверки эффективности этой микрофлюидных системы в изучении взаимодействия между клетками в суспензии и клеточный монослой покрытия канала. Для этой цели мы использовали CHO-П, клетки СНО, которые стабильно трансфицированных для сверхэкспрессии P-SEL (рис. 2а) 11,12. HL-60 клеток наблюдалось значительное качению ответ на СНО-P клеток, демонстрируя способность использовать эту систему, чтобы эффективно исследовать межклеточные взаимодействия в рамках сдвиговом учитывая дизайн, который предотвращает образование пузырей, которые могут поставить под угрозу целостность клеточного монослоя , который часто встречается при использовании PPFCs 22,23. Затем мы заблокировали СНО-P клетки с P-или E-Сель антител для изучения их возможного участия в процессе прокатки. Блокируя Р-Сель значительно сократили количество подвижного клеток на СНО-P монослоя, что указывает на непосредственное участие P-сель в опосредовании HL-60 прокатки, в соответствии с предыдущими докладами 14,18,20.E-Сель Ab и изотипу управления не имели никакого эффекта на катания на HL-60 на СНО-П, демонстрируя, что блокирование Ab могут быть использованы в этом микрофлюидных системы для эффективного выявления специфических маркеров посреднические межклеточные взаимодействия. Важно отметить, что каждый канал требует только минимальный объем дорогостоящих Абс или клеточной суспензии для этого анализа, как мало, как 25-50 мкл, в отличие от реагента отнимает PPFC и ее типичных больших мертвых объемов 7.Далее мы тестировалась системы мульти-пластины также путем анализа взаимодействий между HL-60 клеток и ЭК покрытие микрофлюидных каналов. ЭК, как известно, выразить Р-и E-Сель во время воспалительного процесса 5. Для обеспечения ECs с воспалительным стимулом, мы предварительно их с TNF-α. В то время как E-Сель регулировался, Р-Сель не было, в соответствии с литература показывает, что человеческая ЭК выразить E-Сель, но не Р-Сель, в ответ на ФНО-α активации, так как предстоятель Р-Сель промоутер не хватает TNF -α элементы реагирования, Resulting в индукции транскрипции лишь Электронная сель 20,21. Воспалительные условия были смоделированы затем внутри канала путем инкубации монослой EC с TNF-α, а затем перфузии HL-60 клеток, чтобы исследовать его взаимодействие с поверхностью EC. В то время как HL-60 не взаимодействуют с неактивированной ECS, они сделали отображения надежную прокатки ответ на TNF-α-активированный ECS (фиг.3С), коррелирует с их сообщалось ответ в литературе 22. Ab блокирования экспериментов (рис. 4, а), то показал, что E-Сель, но не Р-Сель, блокирование привело к значительному сокращению HL-60 подвижного на активированном ЭК. Эти данные показывают, непосредственное участие E-сель, а не P-Сель, в посредничестве качение HL-60 на ФНО-α-активированный человека ЭК 20,21. Ab блокирования эксперименты, наоборот, показывая E-Сель-опосредованной прокатки на активированном ЭК против Р-Сель-опосредованной кататься по СНО-P, еще раз подтверждает целесообразность и актуальность Ab BlockiЭксперименты нг быстро выполняется в этой микрофлюидный системы. Интересно, что это ингибирование прокатки не была завершена (снижение около 70%) предполагая, что другие рецепторы поверхности, например, VCAM-1, также принимают участие в HL-60 прокатки на активированном ЭК 27. Анализ Путь Трек дальнейшем выяснилось, еще один интересный феномен - в то время как прокатка HL-60 на разблокированном активированного ЭК был непрерывным и надежным, небольшое число клеток, которые все еще катались по E-сель заблокировал активирована ЭК отображается фрагментированный путь качению на заблокированных ECS ( Фиг.4В). Это явление не наблюдалось в ЭК инкубировали с блокированием P-SEL или контроля изотипа (данные не показаны). Это наводит на мысль, что в то время прокатки ответ можно через другие маркеры, когда ЕС E-Сель блокируется, это прокатки полагается на слабых, частичные взаимодействия HL-60-EC, поддерживая только свободную, частичный ответ качению с активированным ЭК 5,22 ,27-29. Это подтверждается данными, приведенными на фиг.4С , демонстрируя значительно более медленный прокатку HL-60 клеток на неблокированных активированных ЭК по сравнению с их прокатки на E-Сель-блокированного активированного ЭК, что указывает на слабую реакцию качению на E-сель-заблокирован ЭК. Использование нескольких хорошо пластины микрофлюидных систему вместо PPFC позволило нам быстро проводить тонкие эксперименты HL60-ECS, в то время точно контролировать поток сдвига, избегая пузырьков и используя лишь минимальные объемы Абс и клеток. Выгодное использование микрофлюидики для приложений клеточной прокатки ранее продемонстрировали 30-33, и улучшение пропускной способности микрофлюидики через систему мульти-луночного планшета, представленного здесь, еще раз подчеркивает потенциал этой технологии для эффективного и точного анализа ключевых прокатных свойств к улучшилось терапевтические применения .
Это исследование сфокусировано на изучении HL-60 клеток прокатки на белковых субстратов и клеточных монослоев под физиологически соответствующего и точно контролируемого потока сдвига с помощьюмульти-луночный планшет микрофлюидных система. Аналогичным образом, другие типы клеток и другие монослои субстраты / сотовые легко может быть использован для изучения их свойств прокатки. Простота использования и простого анализа позволяет точный анализ важных прокатных свойств и блокирование Ab или активации с различными факторами роста или ингибиторов может быть использован для изучения возможного участия молекулярных маркеров в прокатном ответ. Это может быть особенно полезно на изучение стволовых клеток прокатки и самонаводить, который может быть сконструирован для улучшения клеточной терапии стволовых 34-36. Важно отметить, что несколько условий могут быть проверены с улучшенной пропускной способности (в 5-10 раз более высокой по сравнению с PPFCs), что позволяет быстро и эффективно изучение прокатных свойств в связи с защитной пластиной. Другие анализы, имеющие значение для клеток самонаведения, такие как клеточной адгезии, хемотаксиса и переселения также могут быть изучены с помощью этой системы 1,10,13. В целом, это микрофлюидных система выступает как мощный метод для изучения клеток прокатки и Should служить в качестве полезного инструмента для оказания помощи в клинической перевода экзогенного клеточной терапии.
Раскрытие информации
Авторы заявляют никакого конфликта интересов.
Благодарности
СНО-P клетки были своего рода подарок от доктора Барбары Furie (Бет Израиль медицинский центр Deaconess, Гарвардской медицинской школы). Эта работа была поддержана Национальным институтом здравоохранения гранта HL095722 чтобы JMK Эта работа также была частично поддержана в Movember-рака простаты фонда Вызовы премии к JMK
Материалы
| Name | Company | Catalog Number | Comments |
| Human Lung Microvascular Endothelial Cells | Lonza | CC-2527 | |
| P-selectin-expressing Chinese Hamster Ovary Cells (CHO-P) | Kind gift by Dr. Barbara Furie11,12 | ||
| HL-60 Cells | ATCC | CCL-240 | |
| Cell Culture Reagents | |||
| Endothelial Basal Medium | Lonza | CC-3156 | |
| EBM-2 Media | Lonza | CC-3156 | |
| Endothelial Basal Medium Supplements | Lonza | CC-4147 | |
| EGM-2 MV SingleQuots | Lonza | CC-4147 | |
| IMDM - Iscove's Modified Dulbecco's Medium 1x | Gibco | 12440 | |
| F-12 (1x) Nutrient Mixture (Ham) | Gibco | 11765-054 | |
| Penicillin Streptomycin (P/S) | Gibco | 15140 | |
| L-Glutamine (L/G) 200 mM | Gibco | 25030 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | Sa550 | |
| Petri Dishes | BD Falcon | BD-353003 | |
| 100 mm Cell Culture Dish, Tissue-Culture Treated Polystyrene | |||
| Centrifuge Tubes (15 ml polypropylene conical tubes) | MedSupply Partners | TC1500 | |
| T75 Flasks | BD Falcon | 353136 | |
| Gelatin Solution (2%) | Sigma | G1393 | |
| dPBS (without calcium chloride and magnesium chloride) | Sigma | D8537 | |
| Trypsin-EDTA Solution (10x) | Sigma | T4174 | |
| Antibodies | |||
| Anti-hE-Selectin/CD62E | R&D Systems | BBA21 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA21 | |
| Anti-hP-Selectin | R&D Systems | BBA34 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA34 | |
| FITC Mouse IgG1 κ Isotype Control | BD Bioscience | 555748 | |
| Anti-SLeX /CD15s Ab, Clone: 5F18 | Santa Cruz | SC70545 | |
| FITC Conjugated | Santa Cruz | SC70545 | |
| Normal Mouse IgM-FITC Isotype Control | Santa Cruz | SC2859 | |
| PE Mouse Anti-Human CD162, Clone: KPL-1 | BD Pharmingen | 556055 | |
| PE Mouse IgG1 k Isotype Control | BD Pharmingen | 550617 | |
| Anti-P-Selectin Ab (AK4) | Santa Cruz | SC19996 | |
| Anti-E-Selectin Ab, Clone P2H3 | Millipore | MAB2150 | |
| Mouse IgG1 Isotype Control | Santa Cruz | SC3877 | |
| Other Reagents | |||
| Recombinant Human TNF-alpha | PeproTech | 300-01A | |
| Cell Trace CFSE Cell Proliferation Kit - For Flow Cytometry | Invitrogen | C34554 | |
| Human P-selectin-FC recombinant protein | R&D Systems | 137-PS-050 | |
| Human E-selectin-FC recombinant protein | R&D Systems | 724-ES-100 | |
| Fibronectin Human, Plasma | Invitrogen | 33016-015 | |
| Equipment | |||
| Bioflux 1000 | Fluxion Biosciences | Bioflux Montage was the software used to run the experiments and analyze the data | |
| BioFlux 48-well plates | Fluxion Biosciences | ||
| BD Accuri C6 Flow Cytometer | BD Bioscience | CFlow Plus was the software used to run the experiments and analyze the data | |
| Nikon Eclipse Ti-S | Nikon | ||
| CoolSnap HQ2 CCD camera | Photometrics | ||
Ссылки
- Conant, C. G., et al. Well plate microfluidic system for investigation of dynamic platelet behavior under variable shear loads. Biotechnol. Bioeng. 108, 2978-2987 (2011).
- Conant, C. G., Schwartz, M. A., Ionescu-Zanetti, C. Well plate-coupled microfluidic devices designed for facile image-based cell adhesion and transmigration assays. J. Biomol. Screen. 15, 102-106 (2010).
- Ankrum, J., Karp, J. M. Mesenchymal stem cell therapy: Two steps forward, one step back. Trends Mol. Med. 16, 203-209 (2010).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4, 206-216 (2009).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Ley, K. The role of selectins in inflammation and disease. Trends Mol. Med. 9, 263-268 (2003).
- Sperandio, M., Pickard, J., Unnikrishnan, S., Acton, S. T., Ley, K. Analysis of leukocyte rolling in vivo and in vitro. Methods Enzymol. 416 (06), 346-371 (2006).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunol. 2, 9 (2001).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Conant, C. G., Schwartz, M. A., Nevill, T., Ionescu-Zanetti, C. Platelet adhesion and aggregation under flow using microfluidic flow cells. J. Vis. Exp. (10), e1644 (2009).
- Furie, B., Furie, B. C. Role of platelet P-selectin and microparticle PSGL-1 in thrombus formation. Trends Mol. Med. 10, 171-178 (2004).
- Tchernychev, B., Furie, B., Furie, B. C. Peritoneal macrophages express both P-selectin and PSGL-1. J. Cell Biol. 163, 1145-1155 (2003).
- Conant, C. G., et al. Using well-plate microfluidic devices to conduct shear-based thrombosis assays. J Lab Autom. 16, 148-152 (2011).
- Larsen, G. R., et al. P-selectin and E-selectin. Distinct but overlapping leukocyte ligand specificities. J. Biol. Chem. 267, 11104-11110 (1992).
- Varki, A. Selectin ligands: will the real ones please stand up. J. Clin. Invest. 100, S31-S35 (1997).
- Bohnsack, J. F., Chang, J. Activation of beta 1 integrin fibronectin receptors on HL60 cells after granulocytic differentiation. Blood. 83, 543-552 (1994).
- Lawrence, M. B., Kansas, G. S., Kunkel, E. J., Ley, K. Threshold levels of fluid shear promote leukocyte adhesion through selectins (CD62L,P,E). J. Cell Biol. 136, 717-727 (1997).
- Moore, K. L., et al. P-selectin glycoprotein ligand-1 mediates rolling of human neutrophils on P-selectin. J. Cell Biol. 128, 661-671 (1995).
- Lawrence, M. B., Springer, T. A. Neutrophils roll on E-selectin. J Immunol. 151, 6338-6346 (1993).
- Yao, L., et al. Divergent inducible expression of P-selectin and E-selectin in mice and primates. Blood. 94, 3820-3828 (1999).
- Sackstein, R. Glycoengineering of HCELL, the human bone marrow homing receptor: sweetly programming cell migration. Ann. Biomed. Eng. 40, 766-776 (2012).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of physiologic E-selectin-mediated leukocyte rolling on microvascular endothelium. J. Vis. Exp. , e1009 (2009).
- Muller, W. A., Luscinskas, F. W. Assays of transendothelial migration in vitro. Methods Enzymol. 443, 155-176 (2008).
- Bakker, D. P., vander Plaats, A., Verkerke, G. J., Busscher, H. J., vander Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Appl. Environ. Microbiol. 69, 6280-6287 (2003).
- Benoit, M. R., Conant, C. G., Ionescu-Zanetti, C., Schwartz, M., Matin, A. New device for high-throughput viability screening of flow biofilms. Appl. Environ. Microbiol. 76, 4136-4142 (2010).
- Varki, A. Selectin ligands. Proc. Natl. Acad. Sci. U.S.A. 91, 7390-7397 (1994).
- Ramos, C. L., et al. Direct demonstration of P-selectin- and VCAM-1-dependent mononuclear cell rolling in early atherosclerotic lesions of apolipoprotein E-deficient mice. Circ. Res. 84, 1237-1244 (1999).
- Yago, T., et al. Core 1-derived O-glycans are essential E-selectin ligands on neutrophils. Proc. Natl. Acad. Sci. U.S.A. 107, (2010).
- Yago, T., et al. E-selectin engages PSGL-1 and CD44 through a common signaling pathway to induce integrin alphaLbeta2-mediated slow leukocyte rolling. Blood. 116, 485-494 (2010).
- Simone, G., et al. Cell rolling and adhesion on surfaces in shear flow. A model for an antibody-based microfluidic screening system. Microelectronic Eng. 98, 668-671 (2012).
- Perozziello, G., et al. Microfluidic devices modulate tumor cell line susceptibility to NK cell recognition. Small. 8, 2886-2894 (2012).
- Perozziello, G., et al. Microfluidic biofunctionalisation protocols to form multivalent interactions for cell rolling and phenotype modification investigations. Electrophoresis. , (2013).
- Simone, G., et al. A facile in situ microfluidic method for creating multivalent surfaces: toward functional glycomics. Lab Chip. 12, 1500-1507 (2012).
- Sarkar, D., et al. Engineered cell homing. Blood. 118, e184-e191 (2011).
- Cheng, Z., et al. Targeted Migration of Mesenchymal Stem Cells Modified With CXCR4 Gene to Infarcted Myocardium Improves Cardiac Performance. Mol. Ther. 16, 571-579 (2008).
- Enoki, C., et al. Enhanced mesenchymal cell engraftment by IGF-1 improves left ventricular function in rats undergoing myocardial infarction. Int. J. Cardiol. 138, 9-18 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены