Method Article
的系统分析
摘要
本研究采用多孔板微流体系统,根据有关生理剪切流显著增加通量细胞滚动研究。定小区轧制的多步骤细胞归巢级联和细胞归巢的下列全身递送的细胞的患者的外源性群体的重要性的重要性,该系统提供了潜在的作为筛选平台,以提高基于细胞的疗法。
摘要
细胞为基础的治疗的一个主要挑战是无法系统地针对大量活菌,高效率的兴趣组织下静脉或动脉内注射。因此,增加细胞归巢目前正在研究作为一项战略,以改善细胞疗法。细胞滚动对血管内皮是在细胞归巢的过程中的重要一步,可以使用平行板流室(PPFC) 在体外进行探测。然而,这是一个非常繁琐的,低通量的检测,控制不良的流动条件。相反,我们使用了一个多穴板的微流体系统,可以使蜂窝轧制性能研究在更高的吞吐量下精确控制的,生理学相关的剪切流动1,2。在本文中,我们表明HL-60(人早幼粒细胞白血病)上的P-和E-选择蛋白包被的表面,以及对细胞单层涂层表面细胞的轧制性能如何可以readilŸ检查。以更好地模拟炎性病症,所述微流体通道的表面上涂布的内皮细胞(EC),然后将其与肿瘤坏死因子-α(TNF-α)激活时,在动态条件下显著增加与HL-60细胞的相互作用。增强的吞吐量和集成的多参数分析的软件平台,允许的参数,如轧制速度和轧路径的快速分析,对评估体外细胞滚动属性重要的优点。使工程设计方法来影响细胞的滚动和归巢的快速,准确的分析,这个平台可以帮助推进外源性细胞为基础的治疗。
引言
一种在基于细胞的疗法的成功临床翻译的主要挑战是低效的交货或全身性输注的细胞靶向至期望的位点3,4。因此,人们不断寻求方法来改善细胞的归巢,并且特别是信元轧制,作为一个策略,以改善细胞疗法。细胞滚动血管在细胞归巢级联,经典的定义被招募到发病部位5白细胞的关键一步。这一步是由内皮细胞选择素之间的特异性相互作用制约, 即 P-和E-选择素(P-和E-SEL),和他们的白细胞5,6表面上柜台的配体。更好地了解和细胞归巢的提高效率,特别是轧制工序,是在寻求新的平台,以提高细胞为基础的治疗具有重要意义。迄今这已经通过使用平行平板流动腔(PPFCs),包括两个平板型实现ES与它们之间的垫圈,与位于上板的流入和流出端口,通过该细胞悬浮液是通过使用注射器泵7,8,9灌注。底板的表面可以涂覆有一个相关的细胞单层/基板和下剪切流灌注细胞和表面之间的相互作用,然后探讨7。然而,PPFC是低吞吐量,试剂消耗,以及相当繁琐的方法,用泡沫形成,泄漏,控制不佳的流量呈现主要缺点。
一种替代技术对传统PPFC是一个多穴板的微流体系统中,根据精确的,计算机控制的剪切流动,允许细胞分析的更高的吞吐量性能(比PPFCs高10倍),具有低试剂消耗1,10。细胞轧制实验内的微流体通道中进行的,它可以涂覆有细胞单层或工程衬底和成像USI吴显微镜,采用滚动属性,使用适当的软件易于分析。在本研究中,我们证明此多孔板的微流体系统的通过研究人早幼粒白血病在不同的表面(HL-60)细胞的滚动性能的能力。 HL-60轧像P-和E-SEL,以及对表达不同的轧制受体细胞单层,分析底物。此外,抗体(抗体)阻断被用于证明特定选择素介导的那些表面上的HL-60的滚动运动的直接参与。轧制实验,以增加吞吐量进行的,在稳定的剪切流动,以最少的试剂/细胞消耗,从而允许键滚动参数,如轧制速度,轧细胞的数目,并且滚道特性有效的分析。
研究方案
1。细胞培养
- 人类早幼粒细胞白血病(HL-60)细胞
- 培养HL-60细胞在75cm 2培养瓶中用15毫升的Iscove氏改良的Dulbecco氏培养基(IMDM),补充有20%(V / V)胎牛血清(FBS),1%(V / V)L-谷氨酰胺和1个%(体积/体积)青霉素 - 链霉素。
- 通过吸一半的细胞悬液体积和完整的IMDM培养基取代它改变媒体每3天。
- 为羧基二乙酸酯,琥珀酰亚胺酯(CFSE)染色,离心机的HL-60细胞悬浮液(400×g离心5分钟),重悬在1μM的CFSE溶液(在PBS中预温制得)并孵育15分钟,在37℃下然后离心细胞,吸出上清,重悬的细胞在新鲜培养基中预热30分钟。在PBS中洗涤细胞,然后用对轧制实验(参见图1B为CFSE染色的HL-60细胞上的P-SEL-涂覆的表面的代表图像)。
注意:CFSE染色是可选的,并在这里提出,以证明在微流体通道的滚动现象。使用标准的明场成像未染色的细胞进行的这个手稿提出轧制参数分析。
- 肺微血管内皮细胞(LMVECs)
- 清漆100毫米培养皿用0.1%明胶溶液(在PBS中的体积/体积)并在37℃下进行至少30分钟。
- 在明胶包被的100毫米培养皿中完全内皮细胞生长培养基中培养LMVECs(内皮基础培养基-2(EBM-2)),补充有特定生长添加剂套件,请参阅试剂)。改变媒体在达到80-90%汇合每隔一天和子培养细胞。
- 次级培养,在37℃下用PBS洗涤细胞,然后分离细胞用4ml 1X胰蛋白酶-EDTA的3分钟,中和在完整的EBM-2介质的等体积。细胞悬液转移到15毫升管和centrifugE(400×g离心5分钟)。离心后,沉淀重悬在1ml完整内皮的介质,并用血细胞计数器计数细胞。不要过度通道的细胞,因为这会影响他们的形态和功能使用的通道下7只电池的所有实验。
- 中国仓鼠卵巢-P-选择素(CHO-P)细胞
- CHO-P细胞,这是CHO细胞稳定转染表达人类的P-SEL,由合作者(贝斯以色列女执事医疗中心,哈佛大学医学院)11,12提供。
- 文化的CHO-P细胞的T175厘米2瓶25毫升的F-12介质。
- 用于传代,洗涤细胞,用10ml的PBS中为4-5秒,然后胰蛋白酶消化在10ml 1X胰蛋白酶-EDTA的为3分钟,在37℃,随后通过中和在完全介质。
- 离心细胞悬液(400×g离心5分钟),小心吸出上清液,重悬细胞沉淀1毫升全媒体,并与细胞计数血球。
2。集成多孔板微流控系统的操作
- 确保所有的设备已正确连接并开启不同的模块:计算机,控制器,倒置显微镜和CCD摄像头。
- 打开成像软件;确保多孔板模块和成像模块被正确显示在屏幕上。
- 管子连接到蒸汽疏水阀(连接到控制器),并把它们连接到压力接口。
- 将多孔板在板加热器/适配器。添加试剂到井(在下面描述),并连接接口上的板的顶部。将板成像的自动化阶段。
- 接口附加到所述板的顶部和施加一个气动压力从控制器到孔的上方,驱动通过所述微流体通道中的流体在定义的流率,很容易地控制使用多井板在手动模式下模块屏幕。
- 试剂在整个观察区域,位于所述孔之间的通道流动。微流体通道尺寸为350μm宽×70微米高。线性通道的长度为1毫米,通道的底部包括一个180微米的玻璃盖玻片上,这与明场,相位,荧光和共聚焦显微镜兼容。
- 使用CCD摄像头(流采集,11帧/秒)视频采集,并通过兼容的软件进行分析。
3。微流体通道与蛋白质底物或细胞单层涂层
- 涂层微流体通道与纤连蛋白或P-/E-selectin
- 制备将1ml 20微克/毫升纤连蛋白在PBS中的溶液。基于信道要被涂敷的数量(使用25-50微升每通道的纤连蛋白)改变音量。
- 加入25-50微升的纤维连接蛋白的解决方案,以每口井。申请的2达因/厘米2的剪切力5分钟灌注的通道。请注意,液体出现在出口以及胎圈。孵育在室温下30-45分钟
- 吸从孔中的溶液(不要直接从中间的圆圈,饲料通道吸)1,13。加入200-500微升PBS为出口良好,通过施加2达因/厘米2的剪切流5分钟洗净通道用PBS。该频道现在正确涂有纤维连接蛋白,随时可以使用。
- 涂布用的P-或E-SEL,制备5μg/ ml的溶液在PBS中的所希望的人重组蛋白,和外套,如上所述,用1小时培养,在37℃,以允许表面涂层的通道。
- 创作的微流体通道内的CHO-P或LMVEC单层
- 轻轻的胰蛋白酶消化细胞从培养皿中3分钟,淬火用完全介质和离心机的2倍体积(5分钟,在400×g离心)。悬浮细胞10毫升全媒体和离心机(5分钟400 XG)agaiÑ。
- 计数细胞,以确定在悬浮液中的细胞浓度。以确保形成一个融合LMVEC单层的通道内,使细胞浓度为15〜20百万个细胞/ ml。对于一个铺满的CHO-P的细胞单层,用50-60百万细胞/ ml。用25-50微升细胞悬浮液为每个信道的 - 用于实验据此确定初始细胞数。
- 添加25-50微升细胞悬浮液中的适当的浓度,以进井。将板在显微镜载物台上,并引入细胞进入通道(2达因/厘米2),直到细胞中观察到的画面充满整个通道上,然后停止流动。
- 用200微升的要么是完全LMVEC或CHO媒体既填补出口和入口。让细胞沉淀,坚持3个小时的孵化器(37℃,5%CO2)。
- 继3小时培养,洗净通道与全媒体(2达因/厘米2,10〜15分钟),除去独立的细胞。电池现在应该会出现完全融合和渠道,现在可以使用了。取决于初始细胞接种密度,可能需要额外的2-3小时的稳定时间,以确保该表面的完全覆盖的细胞。
4。 LMVEC促炎性激活和P-/E-selectin的抗体阻断
- 在LMVEC基础培养基制备以下的TNF-α溶液(10纳克/毫升)。
- 以诱导炎症活化LMVEC在通道中,添加100微升的TNF-α溶液的入口以及与通过施加2达因/厘米2的剪切流5分钟,该溶液引入到通道中。对于控制通道(非活化内皮细胞),加入100μl的LMVEC基本培养基的入口以及与引入通道(2达因/厘米2 5分钟)。通道现在可以滚动试验。
- 要阻止P-SEL和LMVECs和CHO-P细胞的E-SEL,引入中和P-SEL(克隆AK4,5微克/毫升巴中SAL媒体)或E-SEL(克隆P2H3,5微克/毫升的基础培养基)抗体的进入通道,并培育1小时,在37℃下接着,用基础培养基洗涤通道(2达因/厘米2,5分钟)。渠道现在已经准备好了轧制试验。
5。 HL-60轧含量对基板/细胞单层包覆的微流体通道
- 仔细检查显微镜下通道,以确认信道被适当地涂覆(在涂层与细胞的情况下,一个完全汇合的细胞单层,应观察到的)。
- 以制备的HL-60细胞悬浮液的轧制实验,离心机的HL-60细胞悬浮液(5分钟,在400×g离心),并用基础培养基洗涤一次。计数细胞,重悬在IMDM(基本培养基,含Ca 2 +,Mg 2 +的)来创建一个HL-60细胞悬液500万细胞/ ml。用25-50微升的细胞悬浮液对每个信道进行轧制试验。
- 加入25-50微升细胞suspe的nsion到出口良好,现浇板温度控制的板夹(37°C)和里面的地方显微镜舞台上。接着,通过施加2达因/厘米2的剪切力(细胞应在10-15秒从出口到入口流被观察到的)引入细胞进入通道。
- 检查轧制响应作为剪切应力的函数,减少剪切到0.25达因/厘米2,并获得20-30秒的视频(使用“流采集”功能)在每个所需的剪切力(从0.25逐渐增加剪切高达5达因/厘米2,它也可以使用较高的剪)。
- 使用CCD摄像头(流采集,11帧/秒)视频采集,并通过兼容的软件分析滚动路径和滚动速度。
6。流式细胞术检测表达表面分子
- 以下胰蛋白酶消化,制备所需的细胞类型(HL-60,CHO-的细胞悬浮液(使用1-2×10 5细胞/样品)P或LMVECs)的PBS( - / - ),补充有2%FBS中。洗涤细胞两次,并把样品体积至50μl(使用相同的缓冲液中)。
- 孵育各样品具有所需荧光团共轭抗体(参见详细信息附表),在4℃下进行20分钟(用铝箔覆盖)。
- 洗涤细胞两次(相同的缓冲区),并把染色的细胞悬浮液终体积为200微升。使用流式细胞仪来检测表面分子的表达分析的样品。
结果
HL-60细胞滚上的P-和E-选择素面,但不能在纤维连接蛋白
HL-60细胞被认为是金标准“辊”,因为它们表达多种归巢的配体,包括轧制配体的P-SEL糖蛋白配体-1(PSGL-1)和唾液酸-路易斯X(SLEX)的5,14( 图1A )。表面蛋白PSGL-1作为一个支架的四糖SLEX,介导特异性相互作用与P-和E-SEL,这是炎症5,6,15中上调的内皮。为了测试多穴板的微流体系统的功能,许多微流体通道均具有不同的底物和HL-60细胞的轧制相互作用的那些表面进行分析同时涂布。 HL-60细胞显示出强大的滚动行为上的P-SEL-涂覆的表面上,细胞首先从流捕获,随后是截然不同的滚动运动。 如图1C所示 ,并且由耳鼻喉科与文献,HL-60细胞表现出对E-SEL表面类似的滚动行为,尚未对纤维连接蛋白包被的基质14,16-19。细胞的速度,通过兼容软件进行分析,作图对剪切应力,表现出细胞的鲁棒轧制响应P-和E-SEL以1-12微米/秒之间的平均速度。
HL-60细胞上滚动的CHO-P单层涂覆在微流体通道
接着,我们的目的是评估使用该微流体系统,以有效地检测感兴趣的细胞和细胞单层涂覆的表面之间的相互作用的可能性。探索与单层细胞表达滚动标记HL-60细胞的相互作用,我们采用CHO-P细胞,转染到稳定表达的P-,而不是电子,SEL( 图2A,还可以看到图2B为代表的图像HL-60细胞的CHO-P单层涂覆在微流体通道)11,12。 ħL-60细胞显示在CHO-P细胞强烈轧制响应( 图2C)。为了测试是否当前的滚动运动是由P-SEL确实介导的CHO-P单层预孵育以阻断抗体对于任何P-或E-SEL,前HL-60细胞进入通道的灌注。如在图2C所示,阻断CHO-P单层有P-SEL抗体导致在表面上滚动HL-60细胞,这表明P-SEL的数目显著减少确实介导的HL-60滚动如前所述14,18。进行检测的微流体通道只使用少量,只要少少的25微升允许不同的条件和受体的阻断高效快速筛查。同种型对照抗体或阻断E-SEL(其不表达于CHO-P细胞)没有影响轧制细胞对CHO-P的细胞数量,这表明在准确针指向的特定表面活性的直接参与该试验的强度ê标志物在细胞滚动的相互作用。
HL-60细胞的TNF-α的激活LMVECs的滚动是通过E-选择素介导的
内皮细胞是已知的上调粘附表面标志物,如P-和E-SEL,在炎症期间,协助白细胞的募集炎症5,6的位点。然而,虽然小鼠内皮细胞同时表达P-和E-SEL在炎症刺激样白介素-1(IL-1)和肿瘤坏死因子-α(TNF-α),人内皮仅供网友表达的E-SEL以回应这些细胞因子20,21。这在我们的流式细胞术分析进行了验证,表示E-SEL的表达,但不是P-SEL,对肺微血管内皮细胞(LMVEC)响应于TNF-α的刺激( 图3A)。多井微板包括许多独立的微流体通道,允许多个不同的条件更高的吞吐量测试。我们利用这个有利的设计在板内的微流体通道( 图3B)LMVECs快速分析多种条件下HL-60细胞与内皮细胞的相互作用。以模拟炎性设置,LMVECs预处理与促炎细胞因子TNF-α。有趣的是,HL-60细胞没有与未活化的LMVECs交互,和细胞中未观察到滚动在该表面上。与此相反,HL-60细胞上显示TNF-α激活的LMVECs很强的侧倾状况,具有5-15微米/秒的平均速度( 图3C)。
然后,我们的目的是探讨P-SEL,或E-SEL,在HL-60细胞和活化的LMVECs之间的滚动相互作用的参与。对于这一点,TNF-α激活的内皮细胞预孵育以P-SEL,或E-SEL阻断抗体,和HL-60细胞的轧制进行了分析。 如图4A所示 ,阻挡E-SEL,其上调对TNF-α激活的LMVECs,导致signific蚂蚁的下降对活化的内皮单层滚动的细胞数。相比之下,使用同种型对照或抗体针对P-SEL,其不表达于被激活的内皮细胞,并没有对HL-60滚动激活的内皮层上的显著作用。此数据表明E-SEL的HL-60的直接参与滚动TNF-α激活内皮细胞,与以前的报告20,21一致。从获得的录像,分析软件允许一个跟踪单个细胞与基质相互作用的路径。我们用这个功能来专门追踪与TNF-α激活内皮细胞相互作用的有/无E-SEL阻断单个细胞的路径。 如图4B所示 ,在畅通激活LMVECs滚动细胞的数量比上E-SEL-阻断活化的内皮细胞显著较高。此外,似乎HL-60的畅通LMVECs滚动运动是连续的,强大的,而细胞的滚动路径关于E-SEL-阻断内皮细胞被割裂(每种颜色代表着不同的细胞,例如见细胞自动对焦与GL 图4B)。在一致性与这一发现,HL-60细胞的畅通,TNF-α激活内皮细胞的滚动速度比他们的E-SEL-阻断内皮细胞( 图4C)轧制速度显著降低。
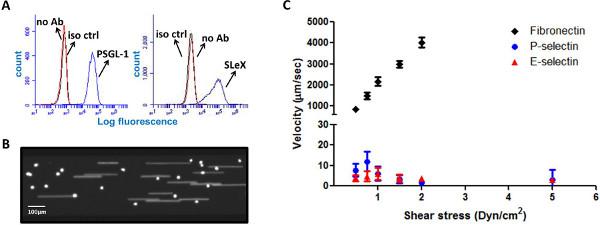
图1。 HL-60细胞滚上的P-和E-选择素涂层表面。 (一)HL-60细胞表达的配体滚动PSGL-1和SLEX(异CTR -同型对照,无抗体-无抗体)(B)CFSE染色的HL-60细胞上的P-SEL的代表单元拍摄的图像涂覆的表面下流动(C)HL-60细胞鲁棒滚上的P-和E-SEL-涂覆的表面,而不是在纤连蛋白包被的表面上。滚动速度暗算剪应力(N = 10-1每个数据点5个细胞,速度由兼容的软件进行分析)。 点击这里查看大图 。

图2。 HL-60上滚动的CHO-P细胞单层直接由P-SEL介导的。 (一)CHO-P细胞表达P-SEL,但不是E-SEL(B)HL-60细胞的CHO-P单层涂层的微流体通道(放大10倍)的表面的形象代表。(C)HL *; CHO-P单层未孵育培养与同种型对照抗体,同型CTR-CHO-P单层 - -60细胞上滚动的CHO-P单层直接由P-SEL就证明了抗体阻断试验(介畅通P <0.05,单因素方差分析,用Tukey的HSD事后检验使用的,误差棒代表扫描电镜中,n = 3。
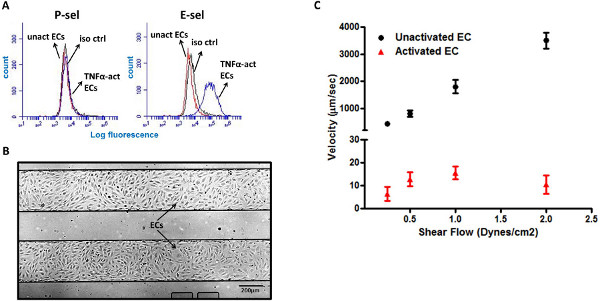
图3。 HL-60细胞上滚动TNF-α激活的LMVECs。 (一)TNF-α的激活LMVECs的诱导E-SEL的表面表达,但不是P-SEL(B)的融合LMVEC单层两微流体通道(4倍放大倍数)代表图像(C)HL-60细胞表现出对TNF-α激活LMVECs强大的横摇响应,但不能在未激活的LMVECs。异CTR -同型对照,unact ECS -未活化的内皮细胞,TNF-α的行为ECS - 。TNF-α活化的内皮细胞点此查看大图 。
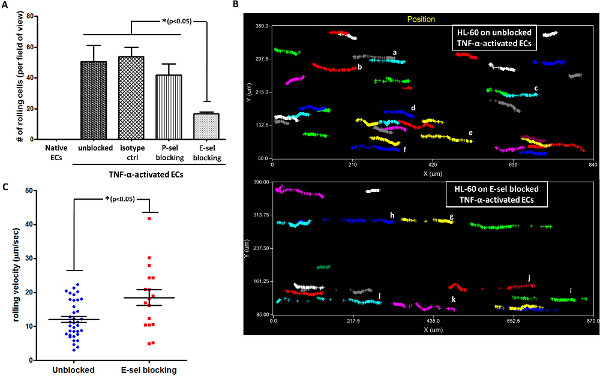 < BR /> 图4。 HL-60上滚动TNF-α激活LMVECs是通过E-选择素介导的(A)的HL-60上滚动TNF-α激活LMVECs用E-SEL介导的,而不是P-SEL,就证明了抗体阻断测定(同种型CTR-EC单层培养与同种型对照,* P <0.05,单因素方差分析,用Tukey的HSD事后检验使用的,误差棒表示SEM,n = 3时)(B)移动路径分析揭示了连续的。和HL-60细胞的活化畅通内皮细胞强健滚动相比于E-SEL-阻断活化的内皮细胞观察到分散,薄弱滚动(每种颜色代表了不同的细胞。分析是通过适当的软件进行)(C)的HL-60轧对TNF-α激活的内皮速度较慢的畅通激活内皮细胞相比,E-SEL-阻断活化的内皮细胞(用于剪切应力:2达因/厘米2 * P <0.05,不成对的双尾t-检验,误差棒代表扫描电镜,每组n = 17-36细胞)。www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg“目标=”_blank“>点击这里查看大图。
< BR /> 图4。 HL-60上滚动TNF-α激活LMVECs是通过E-选择素介导的(A)的HL-60上滚动TNF-α激活LMVECs用E-SEL介导的,而不是P-SEL,就证明了抗体阻断测定(同种型CTR-EC单层培养与同种型对照,* P <0.05,单因素方差分析,用Tukey的HSD事后检验使用的,误差棒表示SEM,n = 3时)(B)移动路径分析揭示了连续的。和HL-60细胞的活化畅通内皮细胞强健滚动相比于E-SEL-阻断活化的内皮细胞观察到分散,薄弱滚动(每种颜色代表了不同的细胞。分析是通过适当的软件进行)(C)的HL-60轧对TNF-α激活的内皮速度较慢的畅通激活内皮细胞相比,E-SEL-阻断活化的内皮细胞(用于剪切应力:2达因/厘米2 * P <0.05,不成对的双尾t-检验,误差棒代表扫描电镜,每组n = 17-36细胞)。www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50866/50866fig4large.jpg“目标=”_blank“>点击这里查看大图。
讨论
其中外源性细胞为基础的治疗成功翻译的主要挑战是无法有效地提供细胞损伤和炎症,高效率的植入3的站点。细胞轧制代表在细胞归巢的过程中的一个关键步骤,促进血管壁上的细胞的减速,通过血管内皮细胞进入组织5最终导致其牢固粘附和轮回。轧制过程中对候选小区类型的更好的理解可能导致的技术的开发,提高细胞的归巢和朝着改善的基于细胞的疗法显著贡献。
PPFC是一种广泛使用的工具,以探索在剪切下的流动池轧制,以及其它细胞的行为。 PPFC的审查中性粒细胞粘附于血管内皮细胞的应用是首次研究了劳伦斯等人于1987年,从那时起市售生产TS已经开发了8,9。 PPFCs包括通过控制所述腔室7的尺寸的垫圈隔开的两个平坦的板。上板包含一个流入和流出端口,它通过使用注射器泵使细胞悬浮液的灌注通过室7,8。还有应用于负压(真空),以保持板压在一起7额外的端口。虽然平行板流动腔已经被有效地用于研究细胞反应,包括细胞轧制,剪切流动条件下,有许多限制,降低其有效性。流室的一个主要限制是大量细胞和大量需要,由于流动系统内7大死体积的试剂的。另一个关键问题是气泡的存在,它可以流动室组装过程中很容易产生,潜在地阻碍了细胞单层和衬底涂敷在底板22上 。然而,进一步的改进已对传统PPCFs把一个额外的端口,在上板作为一个气泡捕捉器,以便去除空气中的气泡23。设立PPFC实验也是繁琐的,并且流程细胞易受泄漏垫圈是否损坏或不小心组装。最后,还有一个期望的和实验上所施加的剪切速率,这导致在一个狭窄的范围内均匀流动速率之间的差异。通过理论上比较4 PPFCs具有不同的入口和出口的位置时,发现有两个配置的建模的剪切速率下,从计算出的剪切速率偏离高达75%24。重复使用相同的腔室,需要费时的洗涤步骤,并结合上述的挑战,这使得PPFCs相当繁琐和低吞吐量。
在我们的研究中,我们使用了一个完全集成的多井p后期微流体系统,依靠精确控制剪切流1,2,13。此48孔微板包括24个微流体通道,每对具有一个微流体通道1,25连接在相邻的孔中。 10-12轧制测定可以在1小时内进行,使之几十的条件在单个天快速筛选。微流体通道可以很容易地涂覆有蛋白底物或细胞单层,和感兴趣的和表面的细胞之间的相互作用可以利用显微镜,由CCD相机获取和兼容软件分析进行成像。关键参数如细胞定量,轧制速度的计算与特定轨道路径分析可以容易地获得能够有效地分析对多个基板13的滚动行为。在这项研究中,我们评估了该系统在研究细胞滚动使用的HL-60早幼粒细胞白血病细胞系,以及建立了“滚筒”,表达关键的效率滚动配体,如PSGL-1和SLEX,它们共同作为对口配体的P-和E-SEL 15,26。与之前的报道的相关性,HL60细胞确实表现出对P-和E-SEL涂层的微流体通道一个强大的滚动行为,以1-12微米/秒14,17-19缓慢滚动的速度。 HL-60细胞没有滚上的纤连蛋白的表面上,示出了未分化的HL-60细胞没有显示出与纤维连接蛋白16的粘合剂的相互作用以前的报道相一致。的多穴板的微流体系统的设计,允许多达10-12测定/小时相比,只有1-2测定/小时,可使用PPFCs进行测试,以至少5倍显著增加吞吐量。此外,PPFCs需要进行重新组合和各洗后方可重新使用,进一步降低系统性能速度。此外,很容易控制流量使剪切速率依赖实验,然后可以通过合适的软件可以容易地进行分析的快速性能。
然后我们的目的是测试此微流体系统的效率在探索中悬浮和细胞单层涂覆通道的细胞之间的相互作用。为了这个目的,我们使用的CHO-P,CHO细胞,这些细胞被稳定地转染以过表达P-SEL( 图2A)11,12。 HL-60细胞表现出对CHO-P细胞的一个显著滚动响应,表明使用这个系统来有效地探索考虑到防止气泡,可能会危及细胞单层的完整性,形成一个设计下剪切流动的细胞 - 细胞相互作用的能力,经常使用PPFCs 22,23时出现。然后,我们封锁了CHO-P细胞的P-或E-SEL抗体,探讨其在轧制过程中潜在的参与。 P-SEL阻断显著减少了对CHO-P单层轧制细胞,表明P-SEL在介导对HL-60的滚动,与先前的报道一致14,18,20直接参与的数量。E-SEL抗体和同种型对照,对在CHO-P对HL-60的轧制没有影响,表明抗体阻断可以在此微流体系统,用于有效地检测特异性标记物介导细胞 - 细胞相互作用。重要的是,每个通道都需要昂贵的ABS或细胞悬液仅最小的体积为这个实验中,少至25-50微升,不同于试剂耗费PPFC及其典型的大的死体积7。我们接下来通过分析HL-60细胞和内皮细胞涂布在微流体通道之间的相互作用进行测试此多孔板系统。内皮细胞系表达的P-和E-SEL在炎症过程5。为了提供与内皮炎症刺激,我们这些预处理与TNF-α。而E-SEL上调,P-SEL不是,与文献报道显示,人类内皮细胞表达E-SEL,但不是P-SEL,为应对TNF-α的激活,因为灵长类动物的P-SEL促进肿瘤坏死因子缺乏一致-α的反应元件,RESUlting在转录诱导的只有E-SEL 20,21。炎症性条件,则该通道内模拟孵化欧共体单层与TNF-α,其次为HL-60细胞的灌注,探讨其与EC表面的相互作用。而HL-60不与未活化的内皮细胞相互作用,他们没有显示在TNF-α激活的内皮细胞( 图3C)健壮轧制响应,与文献22报道他们的响应相关。抗体阻断实验( 图4A),则表明E-SEL,但不是P-SEL,阻塞导致显著降低HL-60轧上激活内皮细胞。这些数据表明E-SEL的直接参与,而不是P-SEL,在介导的HL-60对TNF-α激活人内皮细胞20,21滚动。该抗体阻断实验,反之显示的E-SEL-介导轧上激活内皮细胞与P-SEL-介导的滚动CHO-P,进一步验证了抗体blocki的可行性和相关性纳克实验迅速地在此微流体系统中进行。有趣的是,这种抑制轧制的是不完全的(减少约70%),这表明其它表面受体,如VCAM-1,也参与对HL-60上滚动激活内皮27。轨道路径分析进一步揭示了另一个有趣的现象 - 而HL-60对畅通激活内皮细胞的滚动是连续的,强大的,细胞数量少仍然在推出的E-SEL受阻激活内皮细胞显示在阻断内皮一个支离破碎的滚动路径( 图4B)。这种现象并没有在内皮细胞培养用的P-SEL阻挡或同种型对照(数据未示出)观察。这有力地表明,尽管滚动响应通过其他标记是可能的,当欧盟的E-SEL被封锁,这个滚动依靠微弱,部分HL-60-EC的相互作用,只支持一松,部分滚动与激活的内皮细胞5,22响应,27-29。这是支持在图4C所示的数据,在畅通激活内皮展示HL-60细胞的显著减慢滚动相比,他们对E-SEL-阻断活化的内皮细胞滚动,显示在E-SEL-阻断内皮细胞较弱的横摇响应。使用多穴板的微流体系统,而不是PPFC使我们能够迅速地进行微妙的HL60-内皮细胞的实验中,当正确地控制剪切流,从而避免气泡和采用ABS和细胞中,只有最小量。有利使用微流体细胞轧制应用先前证明30-33,并且通过此处提供的多孔板系统吞吐量提高微流体的,进一步突出了这种技术的关键属性轧制效率和精确的分析对潜在改善的治疗应用。
这项研究的重点检查下生理有关,准确地控制剪切流动对蛋白质底物和单层细胞HL-60细胞用滚动一个多穴板的微流体系统。类似地,其他类型的细胞和其它基材/细胞单层可容易地用于研究其滚动属性。易用性和简单的分析允许的重要轧制性质和抗体阻断或激活具有不同的生长因子或抑制剂,可用于探索的分子标志物在轧制反应可能参与了精确的分析。这可能是对研究干细胞轧制和归巢,其可被工程化以提高干细胞为基础的治疗34-36特别有用。重要的是,多个条件可以提高吞吐量(高5-10倍与PPFCs)进行测试,允许由于板式设计轧制性能的快速,高效的学习。相关的细胞归巢其它测定法,例如细胞粘附,趋化作用和轮回也可以使用本系统1,10,13研究。总体来说,这款微流体系统涌现作为一个强大的技术来研究细胞滚动和should作为一个有用的工具,外源性细胞治疗的临床转化提供帮助。
披露声明
作者宣称没有利益冲突。
致谢
CHO-P细胞从芭芭拉FURIE博士(贝斯以色列女执事医疗中心,哈佛大学医学院)是一种礼物。到JMK这项工作是由一个Movember的前列腺癌基金会挑战奖,以JMK也支持这部分工作为卫生补助HL095722研究所
材料
| Name | Company | Catalog Number | Comments |
| Human Lung Microvascular Endothelial Cells | Lonza | CC-2527 | |
| P-selectin-expressing Chinese Hamster Ovary Cells (CHO-P) | Kind gift by Dr. Barbara Furie11,12 | ||
| HL-60 Cells | ATCC | CCL-240 | |
| Cell Culture Reagents | |||
| Endothelial Basal Medium | Lonza | CC-3156 | |
| EBM-2 Media | Lonza | CC-3156 | |
| Endothelial Basal Medium Supplements | Lonza | CC-4147 | |
| EGM-2 MV SingleQuots | Lonza | CC-4147 | |
| IMDM - Iscove's Modified Dulbecco's Medium 1x | Gibco | 12440 | |
| F-12 (1x) Nutrient Mixture (Ham) | Gibco | 11765-054 | |
| Penicillin Streptomycin (P/S) | Gibco | 15140 | |
| L-Glutamine (L/G) 200 mM | Gibco | 25030 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | Sa550 | |
| Petri Dishes | BD Falcon | BD-353003 | |
| 100 mm Cell Culture Dish, Tissue-Culture Treated Polystyrene | |||
| Centrifuge Tubes (15 ml polypropylene conical tubes) | MedSupply Partners | TC1500 | |
| T75 Flasks | BD Falcon | 353136 | |
| Gelatin Solution (2%) | Sigma | G1393 | |
| dPBS (without calcium chloride and magnesium chloride) | Sigma | D8537 | |
| Trypsin-EDTA Solution (10x) | Sigma | T4174 | |
| Antibodies | |||
| Anti-hE-Selectin/CD62E | R&D Systems | BBA21 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA21 | |
| Anti-hP-Selectin | R&D Systems | BBA34 | |
| FITC Conjugated Mouse IgG1 | R&D Systems | BBA34 | |
| FITC Mouse IgG1 κ Isotype Control | BD Bioscience | 555748 | |
| Anti-SLeX /CD15s Ab, Clone: 5F18 | Santa Cruz | SC70545 | |
| FITC Conjugated | Santa Cruz | SC70545 | |
| Normal Mouse IgM-FITC Isotype Control | Santa Cruz | SC2859 | |
| PE Mouse Anti-Human CD162, Clone: KPL-1 | BD Pharmingen | 556055 | |
| PE Mouse IgG1 k Isotype Control | BD Pharmingen | 550617 | |
| Anti-P-Selectin Ab (AK4) | Santa Cruz | SC19996 | |
| Anti-E-Selectin Ab, Clone P2H3 | Millipore | MAB2150 | |
| Mouse IgG1 Isotype Control | Santa Cruz | SC3877 | |
| Other Reagents | |||
| Recombinant Human TNF-alpha | PeproTech | 300-01A | |
| Cell Trace CFSE Cell Proliferation Kit - For Flow Cytometry | Invitrogen | C34554 | |
| Human P-selectin-FC recombinant protein | R&D Systems | 137-PS-050 | |
| Human E-selectin-FC recombinant protein | R&D Systems | 724-ES-100 | |
| Fibronectin Human, Plasma | Invitrogen | 33016-015 | |
| Equipment | |||
| Bioflux 1000 | Fluxion Biosciences | Bioflux Montage was the software used to run the experiments and analyze the data | |
| BioFlux 48-well plates | Fluxion Biosciences | ||
| BD Accuri C6 Flow Cytometer | BD Bioscience | CFlow Plus was the software used to run the experiments and analyze the data | |
| Nikon Eclipse Ti-S | Nikon | ||
| CoolSnap HQ2 CCD camera | Photometrics | ||
参考文献
- Conant, C. G., et al. Well plate microfluidic system for investigation of dynamic platelet behavior under variable shear loads. Biotechnol. Bioeng. 108, 2978-2987 (2011).
- Conant, C. G., Schwartz, M. A., Ionescu-Zanetti, C. Well plate-coupled microfluidic devices designed for facile image-based cell adhesion and transmigration assays. J. Biomol. Screen. 15, 102-106 (2010).
- Ankrum, J., Karp, J. M. Mesenchymal stem cell therapy: Two steps forward, one step back. Trends Mol. Med. 16, 203-209 (2010).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4, 206-216 (2009).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Ley, K. The role of selectins in inflammation and disease. Trends Mol. Med. 9, 263-268 (2003).
- Sperandio, M., Pickard, J., Unnikrishnan, S., Acton, S. T., Ley, K. Analysis of leukocyte rolling in vivo and in vitro. Methods Enzymol. 416 (06), 346-371 (2006).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunol. 2, 9(2001).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Conant, C. G., Schwartz, M. A., Nevill, T., Ionescu-Zanetti, C. Platelet adhesion and aggregation under flow using microfluidic flow cells. J. Vis. Exp. (10), e1644(2009).
- Furie, B., Furie, B. C. Role of platelet P-selectin and microparticle PSGL-1 in thrombus formation. Trends Mol. Med. 10, 171-178 (2004).
- Tchernychev, B., Furie, B., Furie, B. C. Peritoneal macrophages express both P-selectin and PSGL-1. J. Cell Biol. 163, 1145-1155 (2003).
- Conant, C. G., et al. Using well-plate microfluidic devices to conduct shear-based thrombosis assays. J Lab Autom. 16, 148-152 (2011).
- Larsen, G. R., et al. P-selectin and E-selectin. Distinct but overlapping leukocyte ligand specificities. J. Biol. Chem. 267, 11104-11110 (1992).
- Varki, A. Selectin ligands: will the real ones please stand up. J. Clin. Invest. 100, S31-S35 (1997).
- Bohnsack, J. F., Chang, J. Activation of beta 1 integrin fibronectin receptors on HL60 cells after granulocytic differentiation. Blood. 83, 543-552 (1994).
- Lawrence, M. B., Kansas, G. S., Kunkel, E. J., Ley, K. Threshold levels of fluid shear promote leukocyte adhesion through selectins (CD62L,P,E). J. Cell Biol. 136, 717-727 (1997).
- Moore, K. L., et al. P-selectin glycoprotein ligand-1 mediates rolling of human neutrophils on P-selectin. J. Cell Biol. 128, 661-671 (1995).
- Lawrence, M. B., Springer, T. A. Neutrophils roll on E-selectin. J Immunol. 151, 6338-6346 (1993).
- Yao, L., et al. Divergent inducible expression of P-selectin and E-selectin in mice and primates. Blood. 94, 3820-3828 (1999).
- Sackstein, R. Glycoengineering of HCELL, the human bone marrow homing receptor: sweetly programming cell migration. Ann. Biomed. Eng. 40, 766-776 (2012).
- Wiese, G., Barthel, S. R., Dimitroff, C. J. Analysis of physiologic E-selectin-mediated leukocyte rolling on microvascular endothelium. J. Vis. Exp. , e1009(2009).
- Muller, W. A., Luscinskas, F. W. Assays of transendothelial migration in vitro. Methods Enzymol. 443, 155-176 (2008).
- Bakker, D. P., vander Plaats, A., Verkerke, G. J., Busscher, H. J., vander Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Appl. Environ. Microbiol. 69, 6280-6287 (2003).
- Benoit, M. R., Conant, C. G., Ionescu-Zanetti, C., Schwartz, M., Matin, A. New device for high-throughput viability screening of flow biofilms. Appl. Environ. Microbiol. 76, 4136-4142 (2010).
- Varki, A. Selectin ligands. Proc. Natl. Acad. Sci. U.S.A. 91, 7390-7397 (1994).
- Ramos, C. L., et al. Direct demonstration of P-selectin- and VCAM-1-dependent mononuclear cell rolling in early atherosclerotic lesions of apolipoprotein E-deficient mice. Circ. Res. 84, 1237-1244 (1999).
- Yago, T., et al. Core 1-derived O-glycans are essential E-selectin ligands on neutrophils. Proc. Natl. Acad. Sci. U.S.A. 107, (2010).
- Yago, T., et al. E-selectin engages PSGL-1 and CD44 through a common signaling pathway to induce integrin alphaLbeta2-mediated slow leukocyte rolling. Blood. 116, 485-494 (2010).
- Simone, G., et al. Cell rolling and adhesion on surfaces in shear flow. A model for an antibody-based microfluidic screening system. Microelectronic Eng. 98, 668-671 (2012).
- Perozziello, G., et al. Microfluidic devices modulate tumor cell line susceptibility to NK cell recognition. Small. 8, 2886-2894 (2012).
- Perozziello, G., et al. Microfluidic biofunctionalisation protocols to form multivalent interactions for cell rolling and phenotype modification investigations. Electrophoresis. , (2013).
- Simone, G., et al. A facile in situ microfluidic method for creating multivalent surfaces: toward functional glycomics. Lab Chip. 12, 1500-1507 (2012).
- Sarkar, D., et al. Engineered cell homing. Blood. 118, e184-e191 (2011).
- Cheng, Z., et al. Targeted Migration of Mesenchymal Stem Cells Modified With CXCR4 Gene to Infarcted Myocardium Improves Cardiac Performance. Mol. Ther. 16, 571-579 (2008).
- Enoki, C., et al. Enhanced mesenchymal cell engraftment by IGF-1 improves left ventricular function in rats undergoing myocardial infarction. Int. J. Cardiol. 138, 9-18 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。