Method Article
Выделение и анализ поражений дуги аорты и корней на модели атеросклеротической мыши
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол предоставляет всестороннюю методологию количественного анализа атеросклеротических бляшек, чтобы способствовать более глубокому исследованию механизмов и прогрессирования атеросклероза.
Аннотация
Атеросклероз, являющийся основной причиной сердечно-сосудистых заболеваний, требует детального обследования развития и прогрессирования поражения. В этом исследовании представлен комплексный протокол для выделения и гистологического анализа поражений дуги аорты и корня у широко используемой модели атеросклеротической мыши с нокаутом рецептора липопротеинов низкой плотности (Ldlr-/-). Дуга и корень аорты являются ключевыми местами для атеросклеротических поражений, и их исследование имеет решающее значение для оценки начала, прогрессирования или регрессии атеросклероза, прогнозирования рисков сердечно-сосудистых событий и определения потенциальных терапевтических целей. В этом протоколе описаны методы количественной оценки атеросклеротической нагрузки в дуге и корне аорты, включая выделение тканей, фиксацию, окрашивание Oil Red O, секцию корня аорты, окрашивание гематоксилином и эозином (HE), окрашивание по методу Верхуффа-Ван Гисона (VVG) и анализ изображений. Окрашивание Oil Red O измеряет площадь бляшки в дуге аорты, оценивая тяжесть атеросклероза, в то время как окрашивание корня аорты методом HE выявляет компоненты бляшки, такие как липидное ядро и фиброзный колпачок, облегчая оценку стабильности бляшки и риска разрыва. Окрашивание VVG может окрашивать коллагеновые волокна в тканях, что дает дополнительное представление о составе бляшек и связанной с этим информации. Этот тщательный анализ дает ценную информацию о механизмах развития поражения и может помочь в создании новых терапевтических стратегий для профилактики и лечения атеросклероза.
Введение
Сердечно-сосудистые заболевания, особенно атеросклероз, стали серьезным бременем для здоровья и основной причинойсмерти во всем мире1,2. Атеросклероз является хроническим прогрессирующим воспалительным заболеванием, характеризующимся постепенным накоплением липидов и образованием бляшек в артериальной стенке, что в конечном итоге приводит к сужению просвета артерии и, возможно, к разрыву бляшек, провоцируя острые сердечно-сосудистые события, такие как инфаркт миокарда и инсульт 1,2,3. Учитывая его глубокое влияние на здоровье человека, существует острая необходимость в понимании механизмов, лежащих в основе атеросклероза, и разработке эффективных терапевтических стратегий.
В последние годы животные модели сыграли решающую роль в углублении нашего понимания атеросклероза. Среди различных видов мыши стали предпочтительной моделью из-за их быстрого размножения, низких затрат на обслуживание и доступностипередовых методов генетических манипуляций. В частности, мыши с нокаутом рецептора ЛПНП (Ldlr-/-) и мыши ApoE-/- широко использовались для имитации атеросклероза человека, поскольку они демонстрируют сходные патофизиологические характеристики 4,5,6,7,8,9.
Атеросклеротические поражения у мышей могут возникать в различных местах аорты, но они особенно склонны развиваться в областях, тесно связанных с гемодинамикой, таких как корень аорты, дуга аорты и брахиоцефальный ствол, в то время как нисходящая аорта поражается относительно меньше. Для точной оценки нагрузки атеросклеротического поражения на мышиных моделях, оценки наличия, размера и стадии бляшек и, таким образом, изучения влияния различных лекарств или факторов на возникновение, прогрессирование и регрессию атеросклерозанеобходимо сочетание методов гистологического окрашивания и анализа визуализации. Окрашивание маслом Red O, хорошо зарекомендовавший себя метод, в частности, окрашивает нейтральные липиды и липопротеины12, обеспечивая прямую визуализацию образования бляшек в дуге аорты13. Между тем, окрашивание корня аорты гематоксилин-эозином (ПЭ) не только очерчивает область бляшки, но и обеспечивает детальные структурные особенности, такие как фиброзный колпачок и липидное некротическое ядро. Эти детали имеют решающее значение для оценки стабильности бляшки и прогнозирования риска разрыва бляшки11. Вместе эти методы способствуют всесторонней оценке тяжести и прогрессирования атеросклеротического поражения.
В качестве примера в этом протоколе использовались мыши C57BL6/J Ldlr-/- , которых кормили диетой Чоу и западной диетой, с целью предоставить подробное пошаговое руководство по оценке нагрузки атеросклеротического поражения у мышей с использованием окрашивания дуги аорты Oil Red O и окрашивания HE залитых парафином участков корня аорты с последующим анализом изображений. Протокол охватывает все аспекты изоляции и фиксации аорты, встраивания и секции парафина, процедур окрашивания и анализа изображений, включая операционные детали и соображения по ключевым этапам, обеспечивая воспроизводимость и надежность результатов. Следуя этому протоколу, исследователи могут точно и эффективно оценить эффективность терапевтических вмешательств и получить представление о механизмах, лежащих в основе атеросклероза.
протокол
Все протоколы на животных, использованные в этом исследовании, были одобрены Комитетом по этике экспериментов на животных Шанхайского университета спорта.
1. Приготовление реагентов и инструментов для вскрытия
- Заранее простерилизуйте инструменты для препарирования, включая тонкие ножницы, прямые щипцы, изогнутые щипцы, пружинные ножницы и булавки, автоклавом.
- 75% этанола: Смешайте 75 мл безводного этанола с 25 мл ddH2O.
- 1x Фосфатно-солевой буфер (PBS): Растворите 0,01 М порошка PBS в 2 л ddH2O.
- 4% раствор параформальдегида (PFA): Нагрейте 800 мл 1x PBS примерно до 60 °C на магнитной мешалке в вытяжном шкафу. Медленно добавьте 40 г порошка параформальдегида, непрерывно помешивая. Титруйте 1N NaOH до полного растворения. Охладите до комнатной температуры, отрегулируйте объем до 1 л с помощью 1x PBS, отфильтруйте и отрегулируйте pH до 7,2-7,4.
ВНИМАНИЕ: PFA является опасным химическим веществом, требующим осторожного обращения и строгого соблюдения протоколов безопасности. - Запасной раствор Oil Red O: Растворите 2,5 г порошка Oil Red O в 500 мл 100% изопропанола, запечатайте в коричневый флакон и уберите в холодильник при температуре 4 °C для длительного хранения.
ВНИМАНИЕ: Изопропанол является токсичным и вредным химическим веществом; Поэтому для обеспечения здоровья и безопасности важно носить необходимые средства индивидуальной защиты (СИЗ), включая перчатки. - Рабочий раствор масла красного О: Смешайте раствор чулок и стерильный ддН2О в соотношении 3:2. Приготовьте свежий раствор для каждого использования и отфильтруйте раствор с помощью стерильного шприцевого фильтра 0,22 мкм или большой фильтровальной бумаги.
- Раствор для окрашивания Victoria Blue'B: Растворите 0,5 г Victoria Blue'B в 100 мл 70% этанола.
2. Изоляция аорты и сердца
- Содержать всех мышей по 3-5 животных в клетке с 12-часовым циклом свет/темнота в среде с контролируемой температурой и кормить либо стандартной диетой чау (чоу), либо диетой западного типа (WTD), содержащей 0,2% холестерина и 21,2% жира. Выберите самцов мышей C57BL6/J LDLr-/- в возрасте 12 недель и весом от 25 до 30 г. Принесите мышей в жертву в камере сCO2 .
- Перед вскрытием поместите мышей в положение лежа на спине (брюшной стороной вверх) на поролоновую доску, покрытую 1-2 слоями впитывающей бумаги, и зафиксируйте конечности булавками.
- Распылите 75% этанол на брюшную полость мышей, чтобы очистить и увлажнить шерсть.
- Используйте щипцы, чтобы захватить брюшную кожу мышей, и используйте тонкие ножницы, чтобы разрезать кожу от основания живота до верхней части шеи.
- Откройте брюшную стенку, затем с помощью щипцов поднимите грудину и разрежьте диафрагму и ребра, чтобы обнажить грудную полость.
- Удалите пищевод и трахею, что облегчит очистку сонных артерий. Удалите органы, включая печень, легкие, селезенку, желудочно-кишечный тракт и поджелудочную железу, сохранив при этом почки, расположенные за брюшиной и брюшную аорту рядом с позвоночником. При рассечении брыжеечных артерий обязательно приподнимайте кишечник и делайте разрезы в сторону от аорты, чтобы не повредить брюшную аорту.
- Чтобы обеспечить четкое поле наблюдения, поместите мышей под стереомикроскоп и совместите источник холодного света с областью рассечения.
- Медленно введите шприц объемом 10 мл, наполненный PBS, иглой RWLB 0,45 x 15 (II) в верхушку левого желудочка и наблюдайте за расширением аорты.
- Аккуратно сотрите кровь и жидкость в области рассечения папиросной бумагой, чтобы полностью обнажить поле зрения.
- Грудная аорта легко обнажается. Используйте это как прорыв, используя щипцы для захвата диафрагмального сегмента, прикрепленного к концу грудной аорты, и пружинные ножницы, чтобы разрезать соединительную ткань между аортой и стенкой грудной мышцы.
- Аккуратно подтяните сердце щипцами и приподнимите грудную аорту, наблюдая за ветвями дуги аорты, и рассеките адвентициальный жир и соединительную ткань вокруг дуги аорты и ее ветвей вверх по грудной аорте.
ПРИМЕЧАНИЕ: Будьте осторожны, сохраняйте аорту в целости, избегайте ее разрыва или травмирования, а также тщательно удаляйте окружающий жир и соединительную ткань. Этот шаг требует многократной практики для достижения мастерства в манипуляциях. - Рассеките брюшную аорту и общие подвздошные артерии вниз по грудному отделу аорты.
- Перережьте общие подвздошные артерии на 1-2 мм ниже их раздвоения, обрежьте небольшие ветви аорты вдоль позвоночника, чтобы освободить его, отсоедините почечные артерии возле почек, отрежьте три сосуда на шее от их дистальных концов и, наконец, перережьте восходящую аорту возле сердца.
- Перед рассечением дуги аорты поместите небольшую прокладку темного цвета с высоким контрастом к кровеносным сосудам под ней и сфотографируйте область дуги аорты.
- Обрежьте сердечную ткань и разрежьте нижнюю половину сердца по плоскости, параллельной предсердиям. Зафиксируйте обрезанное сердечко (рисунок 1А).
3. Фиксация и предварительное лечение дуги аорты
- Заранее приготовьте 1 мл 4% раствора PFA в центрифужной пробирке объемом 1,5 мл.
- Поместите аорту в трубку и зафиксируйте ее не менее чем на 24 часа при комнатной температуре.
ПРИМЕЧАНИЕ: Аорта может быть сохранена в 4% PFA в течение 1 месяца, не влияя на качество окрашивания Oil Red O. Чтобы сохранить нормальную конфигурацию, подходящим вариантом может быть помещение ткани на резину перед фиксацией. - Перенесите аорту в чашку Петри, содержащую PBS, чтобы предотвратить ее высыхание. Под стереомикроскопом с помощью щипцов и пружинных ножниц осторожно удалите оставшийся адвентициальный жир, который не был полностью удален во время диссекции, чтобы уменьшить помехи при количественном определении бляшек в аорте.
- С помощью пружинных ножниц аккуратно разрежьте аорту по ее внутренней продольной оси, а затем последовательно разрежьте три ветви дуги аорты вдоль боковой стороны до уровня кривизны дуги аорты, позволяя ей полностью развернуться (рисунок 1В).
- На этом этапе либо используйте для окрашивания маслом красный O, либо храните с 4% PFA.
4. Масляное красное O окрашивание дуги аорты
- Поместите разрезанную аорту в 12-луночную пластину. Добавьте по 1 мл стерильного ддН2О в каждую лунку и умывайтесь в течение 5 минут на шейкере, повторите 2 раза.
- Поместите 12-луночный планшет с удаленным раствором в вытяжной шкаф и высушите на воздухе в течение 20 минут, пока не исчезнут видимые водяные знаки.
- Добавьте в каждую лунку по 1 мл свежеприготовленного рабочего раствора Oil Red O и встряхивайте в течение 20 минут на шейкере, затем удалите рабочий раствор Oil Red O.
- Добавьте по 2 мл стерильного ддН2О в каждую лунку и умывайтесь в течение 5 минут, повторите этот шаг 3 раза. После этого держите аорту в состоянии ddH2O.
- Поместите аорту на предметное стекло и разложите его под стереомикроскопом. Чтобы повысить контрастность, поместите черную резиновую прокладку под предметное стекло.
- Поместите слайд на белую бумагу для дальнейшего повышения контрастности, положите рядом с ним линейку и сделайте снимок с помощью камеры. Чтобы аорта оставалась влажной, храните обработанную аорту в центрифужной пробирке объемом 1,5 мл, содержащей 1 мл PBS.
5. Анализ изображений дуги аорты
- Откройте снятое изображение аорты на компьютере, оснащенном программным обеспечением Image J.
- Выберите область с прямоугольным прямоугольником, например 450 x 900 пикселей, которая содержит всю аорту, и сохраните ее как новый .tiff рисунок.
- Откройте только что сохраненное изображение .tiff в Image J. Нажмите Edit > Invert, затем выберите Изображение и нажмите Type > RGB Stack.
- Перейдите в раздел «Изображение», нажмите «Стопка» > «Стопка в изображения», а затем выберите зеленую с наилучшим контрастом.
- Перейдите в Изображение, нажмите Настроить > Яркость/Контрастность. Измените минимальное значение примерно на 200, сверните фон, сохранив аналогичный фон для каждого изображения, а затем нажмите «Применить».
- Перейдите в раздел «Анализ» и выберите «Установить измерение». Выберите «Площадь», «Доля площади», «Предел порогового значения» и «Отобразить метку», затем нажмите «ОК».
- Перейдите в раздел Анализ, выберите Измерение и скопируйте результат в таблицу.
- Перейдите в раздел «Анализ», нажмите «Инструмент» > «Менеджер ROI», затем выберите арочную часть аорты с прямоугольным прямоугольником. Перейдите в Диспетчер окупаемости инвестиций и выберите Добавить [t] , а затем Измерить. Скопируйте результаты измерений в таблицу.
- Проанализируйте измеренную площадь в группах мышей на основе тестирования нормальности. P < 0,05 указывает на то, что разница статистически значима.
ПРИМЕЧАНИЕ: Выберите подходящий статистический метод в соответствии с планом эксперимента.
6. Парафиновое встраивание сердца
- Удалите верхушку сердца и убедитесь, что разрез прямой и выровнен по направлению корня клапана (рисунок 1B).
- Поместите каждый образец сердца по отдельности в коробку для заделки парафина и отметьте коробку карандашом.
- В вытяжной шкаф поместите залитую парафином кассету с салфеткой в пустую емкость и промойте закладную коробку проточной водой в течение 3 минут.
- Проводят обезвоживание тканей с использованием этанола с возрастающими градиентами концентрации следующим образом: 50% этанол в течение 2 ч, 75% этанол в течение 30 мин, 85% этанол в течение 30 мин, 95% этанол в течение 30 мин и 100% этанол в течение 10 мин. Повторяйте шаги, меняя этанол на каждом этапе.
- Выполните просвечивание тканей ксилолом следующим образом: смесь ксилола и этанола 1:1 в течение 20 мин, ксилол в течение 15 мин, повторите это 1 раз, меняя ксилол.
- Предварительно растопите парафин в духовке при температуре 60 °C. Обрабатывайте образцы смесью ксилола и парафина в течение 30 минут, затем мягкий парафин в течение 2 часов, а затем твердый парафин в течение 1 часа.
ВНИМАНИЕ: Этанол является легковоспламеняющимся и летучим органическим растворителем. Ксилол умеренно токсичен и требует защиты при использовании. - Заделка парафина
- Выберите форму подходящего размера, включите ее и предварительно прогрейте закладочную машину.
- После добавления расплавленного парафина в форму извлеките ткань из закладной кассеты и расположите ее разрезанной поверхностью вниз на центральном дне формы с помощью предварительно нагретых щипцов.
- После того как форма остынет на морозильном столе и парафин внутри застынет, поместите указанную крышку кассеты для закладки поверх формы и заполните ее необходимым количеством парафина.
- Как только парафин остынет и застынет, извлеките блок из формы и храните его в холодильнике при температуре 4 °C (рисунок 1D).
7. Парафиновые срезы корня аорты
- Очистите излишки парафина вокруг крышки закладной кассеты, а затем надежно прикрепите парафиновый блок к гнезду зажима, расположенному на головке парафиновой слайсера. Отрегулируйте блок в положение со смещением от места, где будет разрезан ломтик, убедившись, что участок ткани внутри парафинового блока параллелен режущей кромке лезвия. Для первого среза установите толщину среза на 10 мкм, чтобы выявить расположение ткани.
- Когда под микроскопом будет обнаружен первый разрез, отрегулируйте толщину среза до 6 мкм и выполните серийное срезирование. Режьте, нарезайте и выбирайте срезы в срезе до тех пор, пока под микроскопом не станут видны три неповрежденных аортальных клапана, после чего начинается подготовка к срезам. Оставьте один срез с интервалом 6 мкм для каждой мыши и разместите разные положения срезов на разных стеклянных носителях, например, на участке 1-11-21-31, чтобы получить правильный обзор.
- Поместите пряди на разбрасыватель с температурой 37 °C теплой воды, чтобы разложить ткань на плоской поверхности, а затем поднимите салфетку с помощью ползуна. Дождавшись, пока вода высохнет, поместите ломтики на тостер, установленный на 42 °C, на ночь.
- Средняя площадь бляшки этих 8 участков представляет собой величину площади бляшки корня аорты у каждой мыши. После окрашивания этих участков измерьте среднюю площадь бляшки и площадь бляшки.
8. Окрашивание гематоксилином эозином
- Поместите ломтики в сушилку при температуре 60 °C на 30 минут. В вытяжном шкафу с помощью решетки для окрашивания поместите срезы последовательно в ксилол на 10 мин (повторите этот шаг один раз, меняя ксилол), 100% этанол на 5 мин (повторите этот шаг, меняя этанол), 95% этанол на 5 мин, 85% этанол на 5 мин и 75% этанол на 5 мин.
- Смыть проточной водой в течение 5 минут. Погрузите срезы в гематоксилиновую краску на 8 минут и промойте под проточной водой.
- Дифференцируйте срезы с помощью 1% спирта соляной кислоты в течение нескольких секунд и промойте проточной водой и наблюдайте, чтобы срезы стали сине-фиолетовыми под микроскопом.
- Погрузите срезы в раствор для окрашивания эозина на 5 минут. Поместите секции в 95% этанол на 7 погружений, а затем в 100% этанол на 30 секунд.
- Очистить в ксилоле не менее 30 с. Запечатайте предметные стекла с помощью нейтральной резинки, сфотографируйте под микроскопом и сохраните изображения с высоким разрешением, желательно в .tiff формате.
9. Окрашивание по методу Верхуффа-ван Гисона (VVG)
- Выполните рутинную депарафинизацию и регидратацию парафиновых срезов, выполнив те же действия, что описаны в разделах 8.1 и 8.2.
- После кратковременного промывки в 70% этаноле погрузите участки в раствор для окрашивания Victoria Blue'B на 15 минут.
- Дифференцируйте секции в течение нескольких секунд в 95% этаноле. Промойте секции 2 раза дистиллированной водой.
- Закрасьте срезы раствором для окрашивания Понсо в течение 5 минут капельным путем. Дифференцируйте и обезвоживайте секции с помощью 100% этанола.
ПРИМЕЧАНИЕ: После окрашивания по Понсо избегайте любого контакта с водой. - Очистить в ксилоле не менее 30 с. Закрепите предметные стекла с нейтральной резинкой и сфотографируйте их под микроскопом.
10. Анализ изображения бляшки корня аорты
- Откройте изображение на компьютере, оснащенном программным обеспечением Image J. Выберите любой инструмент для упаковки таблички.
- Перейдите в раздел «Изображение», нажмите «Наложение» > «Добавить выделение», затем «Измерить », чтобы измерить площадь бляшки. Скопируйте результаты измерений в таблицу.
- Проанализируйте измеренную площадь в группах мышей на основе тестирования нормальности. P < 0,05 указывает на то, что разница статистически значима.
Результаты
Репрезентативные результаты демонстрируют применение метода выделения и анализа повреждений дуги аорты и корня в модели атеросклеротической мыши. Эти результаты являются четким доказательством способности метода идентифицировать и характеризовать атеросклеротические поражения. Например, гистологические изображения со специфическими окрасками (например, Oil Red O) указывают на накопление липидов, в то время как окрашивание гематоксилином и эозином (H&E) выявляет общую морфологию атеросклеротических поражений, включая структуру артериальной стенки, наличие липидных ядер и участки некроза. Анализируя окрашенные H&E срезы, мы можем оценить степень развития поражения и структурных изменений в аорте, обеспечивая обзор прогрессирования бляшки и ремоделирования тканей.
В этом протоколе мы проанализировали степень атеросклеротических поражений у 12-недельных мышей с нокаутом C57 Ldlr, которых кормили диетой западного типа (WTD) в течение 4 месяцев, и мышей Ldlr-/- на диете Chow в качестве контрольной группы.
После 12 недель диеты Чоу и кормления на западной диете у мышей с нокаутом Ldlr в группе западной диеты наблюдалась значительно повышенная масса тела по сравнению с контрольной группой. Кроме того, уровни липидов в группе западной диеты также были изменены, при этом значительно повысились уровни триглицеридов плазмы (ТГ) и общего холестерина (ТС), где ТГ и ТС были обнаружены с помощью иммуноферментного анализа, взятого из хвостовой крови мышей (Рисунок 2).
Результаты окрашивания масла аорты Red O у мышей с нокаутом Ldlr, которых кормили западной диетой, у которых наблюдалось сильное накопление липидов и атеросклеротические поражения по сравнению с мышами, получавшими диету чау, указывают на то, что большее количество отложений липидов на артериях соответствует более тяжелым атеросклеротическим поражениям (рис. 3).
При срезах корня аорты большая площадь бляшки и некротических ядер предполагает более тяжелое атеросклеротическое поражение. Здесь было показано, что площадь поражения корня аорты и некротическое ядро намного больше у западных мышей, которых кормили диетой, чем у мышей, которых кормили диетой Чоу (рис. 4A). Окрашивание парафиновыми срезами корня аорты с помощью ВВГ проводили для оценки пораженного участка корня аорты; Эластические волокна были голубовато-фиолетовыми, а коллагеновые волокна обычно разрастались, образуя волокнистую шапочку и выглядели красными. Окрашивание VVG помогает нам увидеть, происходит ли разрушение или уменьшение эластичных волокон, утолщение стенки сосуда и отложение аномальных коллагеновых волокон, что может быть признаком воспаления или патологического ремоделирования. Здесь были показаны тенденции увеличения коллагеновых волокон в фиброзном колпачке в корне аорты у западных мышей, которых кормили диетой, по сравнению с мышами, которых кормили диетой Чоу (рис. 4B). Количественная оценка области поражения корня аорты и некротической области показала, что западная диета ухудшает атеросклеротический статус у мышей с нокаутом Ldlr (рис. 4C).

Рисунок 1: Этапы изоляции и анализа поражений дуги аорты и корня. (A) Изоляция аорты и сердца. (Б) Подготовка корня аорты. Сердечная ткань между двумя пунктирными линиями была разрезана. (В) Фиксация и предварительная обработка дуги аорты. (Г) Парафиновое встраивание сердца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Изменения массы тела и уровня липидов в крови у мышей контрольной группы и мышей группы WTD, которых кормили в течение 12 недель. (A) Кривая массы тела при кормлении CD и WTD. (В) Триглицериды плазмы (ТГ). (C) Общий холестерин (TC) (n=4). Результаты выражены в виде среднего значения ± SEM, значимость оценивалась с помощью t-критерия Стьюдента. p < 0,001, **** p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
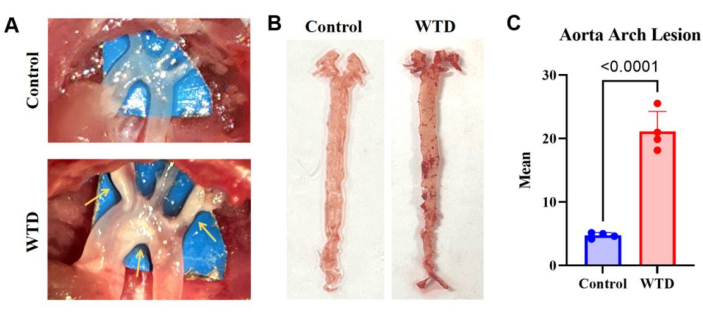
Рисунок 3: Дуга аорты и ее окрашивание и анализ масляного красного O. (A) Репрезентативные изображения атеросклеротических бляшек в дуге аорты. Дуги аорты у мышей Ldlr-/-, которых кормили диетой Cow, наблюдались под микроскопом без видимых бляшек, в то время как дуги аорты у мышей Ldlr-/-, которых кормили западной диетой, наблюдались под микроскопом с видимыми бляшками. (B) Репрезентативные изображения окрашивания аортального масла в красный цвет O. Целая аорта мышей Ldlr-/- на диете Chow без накопления липидов и целая аорта у мышей Ldlr-/- на западной диете в течение 4 месяцев были видны бляшки в дуге аорты (n=4). (C) Среднее число поражений дуги аорты. Результаты выражались в виде среднего значения ± SEM, а значимость оценивалась с помощью t-критерия Стьюдента. p < 0,001, **** p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
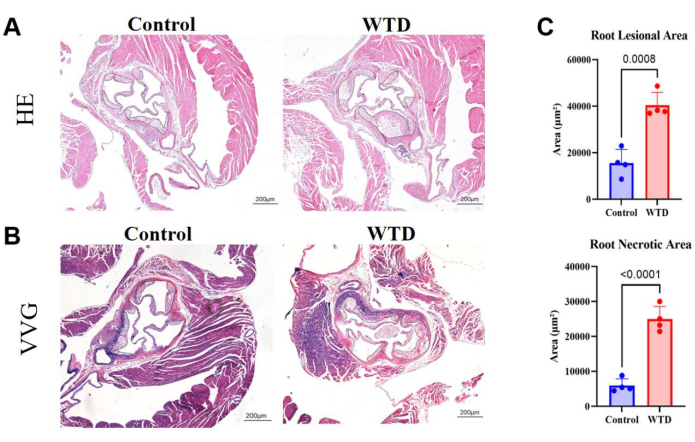
Рисунок 4: Срезы корня аорты, окрашенные HE и VVG, с количественной оценкой площади бляшки и площади некрота. (А) Репрезентативные участки корня аорты, окрашенные гематоксилином и эозином. Аортальные корни мышей Ldlr-/- подвергались диете Чоу и западным диетическим вмешательствам соответственно. (B) Репрезентативные отделы корня аорты, окрашенные по методу Верхуфф-Ван Гизона. Корни аорты у мышей Ldlr-/- , подвергшихся диете Чоу и западным диетическим вмешательствам, соответственно, обведены черным цветом и представляют собой атеросклеротические поражения у мышей. (C) Количественная оценка площади поражения корня аорты и площади некротического заболевания (n=4). Результаты выражались в виде среднего значения ± SEM, а значимость оценивалась с помощью t-критерия Стьюдента. p < 0,001, **** p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Здесь мы предоставляем подробную информацию о методах забора аорты у мышей с нокаутом Ldlr и количественном анализе бляшек.
Точность процедуры диссекции является самой большой технической проблемой для стриппинга аорты in vivo на мышиной модели атеросклероза. Основываясь на нашем опыте, ключевые моменты заключаются в следующем: (1) используйте PBS для вымывания всей крови в артерии, чтобы увеличить сравнение между ветвями дуги аорты и периваскулярным жиром. (2) Будьте терпеливы. Из-за небольшого размера аорты мыши процедуру необходимо проводить под микроскопом тела и с использованием высококачественных микроскопических машинок для стрижки и щипцов для минимизации ошибок в операции. (3) Крайне важно гарантировать, что вскрышные работы будут начаты точно и в правильном направлении, чтобы предотвратить любые порезы или повреждения судна.
Что касается окрашивания масла аорты красным O у мышей, периферический жир изолированной аорты мыши должен быть удален микроскопически перед формальным окрашиванием, и целостность ткани должна быть сохранена, чтобы избежать влияния на результаты окрашивания. Процесс масляно-красного окрашивания требует точного контроля над временем окрашивания; Как чрезмерная, так и недостаточная продолжительность могут нарушить эффект окрашивания, что приведет к неточным результатам.
При встраивании корней аорты мыши необходимо контролировать время обезвоживания ткани, чтобы избежать растрескивания ткани во время разрезания. Участки корня аорты должны быть одинаковой толщины, чтобы обеспечить равномерное окрашивание, а слишком тонкие или слишком толстые участки могут мешать наблюдению. При этом необходимо точно определить, где появляется трехстворчатый клапан при рассмотрении под микроскопом. Процесс окрашивания гематоксилином эозином требует точного контроля времени окрашивания и концентрации окрашивающего раствора, чтобы избежать неспецифического окрашивания.
По сравнению с существующими превосходными методами оценки атеросклероза, этот протокол предоставил пошаговые детали для рассечения как дуги аорты, так и корня, что может помочь всесторонне оценить атеросклеротический статус11,13 Как окрашивание гематоксилин-эозином, так и окрашивание VVG могут помочь оценить область поражения корня аорты, что повышает точность количественной оценки атеросклероза.
Тем не менее, все еще существуют некоторые ограничения окрашивания масла аорты в красный О. Например, масляно-красное окрашивание в основном используется для обнаружения липидов, но имеет низкую специфичность для других типов клеточных или тканевых компонентов11, что может привести к неправильной классификации. С другой стороны, процесс фиксации и диссекции образца может привести к потере липидов, тем самым влияя на достоверность результатов окрашивания. Что касается окрашивания корня аорты гематоксилин-эозином, то оно ограничено в дифференцировке клеточных компонентов и может быть затруднено с идентификацией конкретных участков поражения в случаях сложной структуры ткани. При проведении количественного анализа на статистические результаты области пятна также может влиять субъективное суждение наблюдателя. Кроме того, окрашивание гематоксилин-эозином дает в первую очередь морфологическую информацию и не дает понимания клеточной функции или молекулярной характеристики.
Помимо стандартного масляно-красного окрашивания и гематоксилин-эозинного окрашивания, другие методы анализа атеросклеротических бляшек включают окрашивание по Массону, иммуногистохимическое окрашивание на различные антигены и другие методы, которые могут быть использованы для изучения состава и размеров бляшки. Окрашивание срезов корня аорты масляным красным цветом также широко используется для анализа отложения липидов в корне аорты14. Окрашивание Alizarin Red S является широко используемым морилкой для обнаружения отложений кальция; Он образует красный комплекс с ионами кальция, что делает его идеальным для визуализации отложений кальция15. Кроме того, метаболизм липидов может быть выведен из биохимических маркеров сыворотки крови, таких как уровни липопротеинов высокой плотности (ЛПВП), липопротеинов низкой плотности (ЛПНП), общего холестерина (ХС) и общего триацилглицерина (ТГ). Одним из ключевых факторов, способствующих развитию атеросклероза, является аномальный липидный обмен, в частности, взаимосвязь между атеросклерозом и сердечно-сосудистыми заболеваниями (ASCVD) и уровнем холестерина липопротеинов низкой плотности (ЛПНП).
По мере углубления исследований атеросклероза дальнейшее развитие методов количественного анализа будет становиться все более точным и диверсифицированным. Во-первых, интеграция передовых технологий визуализации, таких как МРТ с высоким разрешением, оптическая когерентная томография (ОКТ) и ультразвуковая визуализация, сделает количественный анализ атеросклероза более точным, что позволит осуществлять динамический мониторинг живых мышей. Это поможет в режиме реального времени оценить прогрессирование бляшек, стабильность и реакцию на лечение. С развитием технологий молекулярной визуализации количественный анализ позволит проводить углубленный анализ воспалительных реакций, накопления липидов и клеточных компонентов в бляшках, обеспечивая более полные данные для ранней диагностики и лечения атеросклероза.
Раскрытие информации
Декларировать нечего.
Благодарности
Эта работа была поддержана Шанхайской научно-исследовательской базой физических упражнений и метаболического здоровья, исследовательской программой физических упражнений и общественного здравоохранения (0831) в Шанхайском университете спорта, Шанхайской программой финансирования подготовки молодых учителей высшего образования (A2-0213-22-0058-5) и Планом выдающихся академических лидеров Шанхайского муниципального комитета по науке и технологиям Шанхая (21XD1403200) для Лунхуа Лю.
Материалы
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides(25×75mm) | CITOTEST | Cat# 80312-3161 | |
| Embedding cassette | CITOTEST | Cat# 80106-1100-16 | |
| Eosin Staining Solution | Beyotime | Cat# C0109 | |
| Ethanol | Sinopharm Chemical Reagent Co. | Cat# 10009218 | |
| Hematoxylin Staining Solution | Beyotime | Cat# C0107 | |
| Low-profile disposable blades | Leica | Cat# 14035838925 | |
| Microscope cover glass(24×50mm) | CITOTEST | Cat# 10212450C | |
| Neutral Balsam Mounting Medium | Sango Biotech | Cat# E675007-0100 | |
| Oil red o powder | Sigma-Aldrich | Cat# 1320-06-5 | |
| paraffin with ceresin | Sinopharm Chemical Reagent Co. | Cat# 69019461 | |
| Paraformaldehyde | Servicebio | Cat# G1101 | |
| Phosphate Buffered Saline (PBS, Powder) | Servicebio | Cat# G0002-2L | |
| Ponceau S Staining Solution | EveryLab | Cat# FM024 | |
| Victoria Blue’B | Aladdin | Cat# 2580-56-5 | |
| Xylene | Sigma-Aldrich | Cat# 104-81-4 |
Ссылки
- Libby, P., et al. Atherosclerosis. Nat Rev Dis Primers. 5 (1), 56 (2019).
- Herrington, W., Lacey, B., Sherliker, P., Armitage, J., Lewington, S. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease. Circ Res. 118 (4), 535-546 (2016).
- Frostegård, J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 11, 117 (2013).
- Gisterå, A., Ketelhuth, D. F. J., Malin, S. G., Hansson, G. K. Animal models of atherosclerosis-supportive notes and tricks of the trade. Circ Res. 130 (12), 1869-1887 (2022).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 32 (5), 1104-1115 (2012).
- Ilyas, I., et al. Mouse models of atherosclerosis in translational research. Trends Pharmacol Sci. 43 (11), 920-939 (2022).
- Liu, L., Chan, M., Yu, L., Wang, W., Qiang, L. Adipsin deficiency does not impact atherosclerosis development in ldlr(-/-) mice. Am J Physiol Endocrinol Metab. 320 (1), E87-E92 (2021).
- Liu, L., et al. Pparγ deacetylation confers the antiatherogenic effect and improves endothelial function in diabetes treatment. Diabetes. 69 (8), 1793-1803 (2020).
- Zahr, T., et al. Pparγ (peroxisome proliferator-activated receptor γ) deacetylation suppresses aging-associated atherosclerosis and hypercholesterolemia. Arterioscler Thromb Vasc Biol. 43 (1), 30-44 (2023).
- Tang, C., et al. Endothelial ccrl2 induced by disturbed flow promotes atherosclerosis via chemerin-dependent β2 integrin activation in monocytes. Cardiovasc Res. 119 (9), 1811-1824 (2023).
- Andrés-Manzano, M. J., Andrés, V., Dorado, B. Oil red o and hematoxylin and eosin staining for quantification of atherosclerosis burden in mouse aorta and aortic root. Methods Mol Biol. 1339, 85-99 (2015).
- Mehlem, A., Hagberg, C. E., Muhl, L., Eriksson, U., Falkevall, A. Imaging of neutral lipids by oil red o for analyzing the metabolic status in health and disease. Nat Protoc. 8 (6), 1149-1154 (2013).
- Chen, P. Y., Qin, L., Simons, M. Imaging and analysis of oil red o-stained whole aorta lesions in an aneurysm hyperlipidemia mouse model. J Vis Exp. (183), e61277 (2022).
- Lin, Y., et al. Practical assessment of the quantification of atherosclerotic lesions in apoe-/- mice. Mol Med Rep. 12 (4), 5298-5306 (2015).
- Bozycki, L., Łukasiewicz, K., Matryba, P., Pikula, S. Whole-body clearing, staining and screening of calcium deposits in the mdx mouse model of duchenne muscular dystrophy. Skelet Muscle. 8 (1), 21 (2018).
- Glaudemans, A. W., et al. Molecular imaging in atherosclerosis. Eur J Nucl Med Mol Imaging. 37 (12), 2381-2397 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены