Method Article
Aislamiento y análisis de lesiones del arco aórtico y la raíz en un modelo de ratón aterosclerótico
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo proporciona una metodología integral para el análisis cuantitativo de las placas ateroscleróticas para facilitar una investigación más profunda sobre los mecanismos y la progresión de la aterosclerosis.
Resumen
La aterosclerosis, una de las principales causas de enfermedades cardiovasculares, requiere un examen detallado del desarrollo y la progresión de la lesión. Este estudio presenta un protocolo completo para el aislamiento y el análisis histológico de las lesiones del arco aórtico y la raíz en un modelo de ratón aterosclerótico ampliamente utilizado, ratones knock-out del receptor de lipoproteínas de baja densidad (Ldlr-/-). El arco aórtico y la raíz son sitios clave para las lesiones ateroscleróticas, y su examen es fundamental para evaluar el inicio, la progresión o la regresión de la aterosclerosis, predecir los riesgos de eventos cardiovasculares e identificar posibles dianas terapéuticas. Este protocolo describe los métodos para cuantificar la carga aterosclerótica en el arco aórtico y la raíz, incluido el aislamiento de tejidos, la fijación, la tinción de Oil Red O, el corte de la raíz aórtica, la tinción de hematoxilina y eosina (HE), la tinción de Verhoeff-Van Gieson (VVG) y el análisis de imágenes. La tinción Oil Red O mide el área de la placa en el arco aórtico, evaluando la gravedad de la aterosclerosis, mientras que la tinción HE de la raíz aórtica revela los componentes de la placa, como el núcleo lipídico y la capa fibrosa, lo que facilita la evaluación de la estabilidad de la placa y el riesgo de ruptura. La tinción con VVG puede teñir las fibras de colágeno dentro de los tejidos, lo que proporciona más información sobre la composición de la placa e información relacionada. Este análisis exhaustivo ofrece información valiosa sobre los mecanismos de desarrollo de lesiones y puede guiar la creación de nuevas estrategias terapéuticas para prevenir y tratar la aterosclerosis.
Introducción
Las enfermedades cardiovasculares, en particular la aterosclerosis, se han convertido en una importante carga para la salud y una de las principales causas de muerte en todo el mundo 1,2. La aterosclerosis es una enfermedad inflamatoria crónica progresiva caracterizada por la acumulación gradual de lípidos y la formación de placas en la pared arterial, lo que finalmente conduce al estrechamiento de la luz arterial y potencialmente a la ruptura de placas, desencadenando eventos cardiovasculares agudos como infarto de miocardio y accidente cerebrovascular 1,2,3. Dado su profundo impacto en la salud humana, existe una necesidad apremiante de comprender los mecanismos subyacentes a la aterosclerosis y desarrollar estrategias terapéuticas efectivas.
En los últimos años, los modelos animales han desempeñado un papel crucial en el avance de nuestra comprensión de la aterosclerosis. Entre varias especies, los ratones se han convertido en un modelo preferido debido a su rápida reproducción, bajos costos de mantenimiento y la disponibilidad de técnicas avanzadas de manipulación genética 4,5. En particular, los ratones knockout del receptor LDL (Ldlr-/-) y los ratones ApoE-/- se han utilizado ampliamente para imitar la aterosclerosis humana, ya que exhiben características fisiopatológicas similares 4,5,6,7,8,9.
Las lesiones ateroscleróticas en ratones pueden ocurrir en varias localizaciones de la aorta, pero son particularmente propensas a desarrollarse en áreas estrechamente asociadas con la hemodinámica, como la raíz aórtica, el arco aórtico y el tronco braquiocefálico, mientras que la aorta descendente está relativamente menos afectada10. Para evaluar con precisión la carga de lesiones ateroscleróticas en modelos de ratón, evaluar la presencia, el tamaño y el estadio de las placas y, por lo tanto, investigar el impacto de diferentes fármacos o factores en el inicio, la progresión y la regresión de la aterosclerosis, es esencial una combinación de técnicas de tinción histológica y análisis de imagen11. La tinción Oil Red O, un método bien establecido, tiñe específicamente los lípidos neutros y las lipoproteínas12, proporcionando una visualización directa de la formación de placa en el arco aórtico13. Mientras tanto, la tinción con hematoxilina-eosina (HE) de la raíz aórtica no solo delinea el área de la placa, sino que también proporciona características estructurales detalladas, como el capuchón fibroso y el núcleo necrótico lipídico. Estos detalles son cruciales para evaluar la estabilidad de la placa y predecir el riesgo de rotura de la placa11. Juntas, estas técnicas facilitan una evaluación integral de la gravedad y progresión de las lesiones ateroscleróticas.
Este protocolo tomó como ejemplos a ratones C57BL6/J Ldlr-/- alimentados con la dieta Chow y la dieta occidental, con el objetivo de proporcionar una guía detallada paso a paso para evaluar la carga de lesiones ateroscleróticas en ratones utilizando la tinción con Oil Red O del arco aórtico y la tinción HE de secciones de raíces aórticas incluidas en parafina, seguidas de un análisis de imágenes. El protocolo cubre todos los aspectos del aislamiento y la fijación aórtica, la inclusión y el corte de parafina, los procedimientos de tinción y el análisis de imágenes, al tiempo que incorpora detalles operativos y consideraciones para los pasos clave, lo que garantiza la reproducibilidad y la fiabilidad de los resultados. Al seguir este protocolo, los investigadores pueden evaluar de manera precisa y eficiente la eficacia de las intervenciones terapéuticas y obtener información sobre los mecanismos subyacentes a la aterosclerosis.
Protocolo
Todos los protocolos animales utilizados en este estudio fueron aprobados por el Comité de Revisión Ética para la Experimentación Animal de la Universidad del Deporte de Shanghai.
1. Preparación de reactivos y herramientas de disección
- Esterilice las herramientas de disección, incluidas las tijeras finas, las pinzas rectas, las pinzas curvas, las tijeras de resorte y los clavos, en autoclave con anticipación.
- Etanol al 75%: Mezclar 75 mL de etanol anhidro con 25 mL de ddH2O.
- 1x Solución salina tamponada con fosfato (PBS): Disuelva 0,01 M de polvo de PBS en 2 L de ddH2O.
- Solución de paraformaldehído (PFA) al 4%: Calentar 800 mL de 1x PBS a aproximadamente 60 °C en un agitador magnético en una campana extractora. Agregue lentamente 40 g de polvo de paraformaldehído, revolviendo continuamente. Valore con 1N NaOH hasta que se disuelva por completo. Deje enfriar a temperatura ambiente, ajuste el volumen a 1 L con 1x PBS, filtro y ajuste el pH a 7.2-7.4.
PRECAUCIÓN: El PFA es un producto químico peligroso que requiere un manejo cuidadoso y un estricto cumplimiento de los protocolos de seguridad. - Solución de almacenamiento de Oil Red O: Disuelva 2,5 g de polvo de Oil Red O en 500 mL de isopropanol al 100%, selle en una botella marrón y almacene en un refrigerador a 4 °C para almacenamiento a largo plazo.
PRECAUCIÓN: El isopropanol es un producto químico tóxico y dañino; por lo tanto, para garantizar la salud y la seguridad, es esencial usar el equipo de protección personal (EPI) necesario, incluidos guantes. - Solución de trabajo de Oil Red O: Mezclar la solución de almacenamiento y el ddH2O estéril en una proporción de 3:2. Prepárese fresco para cada uso y filtre la solución con un filtro de jeringa estéril de 0,22 μm o papel de filtro grande.
- Solución de tinción Victoria Blue'B: Disuelva 0,5 g de Victoria Blue'B en 100 ml de etanol al 70%.
2. Aislamiento de la aorta y el corazón
- Aloje a todos los ratones en 3-5 animales por jaula, con un ciclo de luz/oscuridad de 12 horas, en un entorno con temperatura controlada y aliméntelos con una dieta estándar de comida (chow) o una dieta de tipo occidental (WTD) que contenga 0,2% de colesterol y 21,2% de grasa. Seleccione ratones macho C57BL6/J LDLr-/- que tengan 12 semanas de edad y pesen entre 25 y 30 g. Sacrifica ratones en una cámara de CO2 .
- Antes de la disección, coloque los ratones en posición supina (con el lado ventral hacia arriba) sobre una tabla de espuma cubierta con 1-2 capas de papel absorbente y fije las extremidades con alfileres.
- Rocíe etanol al 75% sobre el abdomen de los ratones para limpiar y humedecer el pelaje.
- Use pinzas para agarrar la piel ventral de los ratones y use tijeras finas para cortar la piel desde la base del abdomen hasta la parte superior del cuello.
- Abra la pared abdominal, luego use fórceps para levantar el esternón y corte a través del diafragma y las costillas para exponer la cavidad torácica.
- Extirpar el esófago y la tráquea, lo que permitirá una limpieza más fácil de las arterias carótidas. Extirpar órganos, como el hígado, el pulmón, el bazo, el tracto gastrointestinal y el páncreas, preservando los riñones situados detrás del peritoneo y la aorta abdominal junto a la columna vertebral. Al diseccionar las arterias mesentéricas, asegúrese de levantar los intestinos y hacer incisiones lejos de la aorta para evitar dañar la aorta abdominal.
- Para proporcionar un campo de observación claro, coloque a los ratones bajo un microscopio estereoscópico y alinee la fuente de luz fría con el área de disección.
- Inyecte lentamente una jeringa de 10 mL llena de PBS con una aguja RWLB de 0,45 x 15 (II) en el ápex del ventrículo izquierdo y observe la dilatación de la aorta.
- Limpie suavemente la sangre y el líquido en el área de disección con papel de seda para exponer completamente el campo de visión.
- La aorta torácica es fácil de exponer. Úselo como un avance mediante el uso de pinzas para agarrar el segmento diafragmático unido al extremo de la aorta torácica y tijeras de resorte para cortar el tejido conectivo entre la aorta y la pared muscular torácica.
- Tire suavemente del corazón con fórceps y levante la aorta torácica, observando las ramas del arco aórtico, y diseccione la grasa adventicial y el tejido conectivo alrededor del arco aórtico y sus ramas hacia arriba a lo largo de la aorta torácica.
NOTA: Tenga cuidado, mantenga la aorta intacta, evite desgarrarla o lesionarla y elimine completamente la grasa circundante y el tejido conectivo. Este paso requiere práctica repetida para lograr una manipulación competente. - Diseccionar la aorta abdominal y las arterias ilíacas comunes hacia abajo a lo largo de la aorta torácica.
- Corte las arterias ilíacas comunes 1-2 mm por debajo de su bifurcación, recorte las pequeñas ramas de la aorta a lo largo de la columna vertebral para liberarla, separe las arterias renales cerca de los riñones, corte los tres vasos ramificados del cuello desde sus extremos distales y, finalmente, corte la aorta ascendente cerca del corazón.
- Antes de diseccionar el arco aórtico, coloque una junta pequeña de color oscuro con alto contraste con los vasos sanguíneos debajo de ella y fotografíe el área del arco aórtico.
- Recorte el tejido cardíaco y corte la mitad inferior del corazón a lo largo de un plano paralelo a las aurículas. Fije el corazón recortado (Figura 1A).
3. Fijación y pretratamiento del arco aórtico
- Prepare 1 mL de solución de PFA al 4% en un tubo de centrífuga de 1.5 mL con anticipación.
- Coloque la aorta en la sonda y fíjela durante al menos 24 horas a temperatura ambiente.
NOTA: La aorta se puede conservar en 4% PFA hasta por 1 mes sin afectar la calidad de la tinción de Oil Red O. Para mantener su configuración normal, colocar el tejido sobre una goma antes de la fijación puede ser una opción adecuada. - Transfiera la aorta a una placa de Petri que contenga PBS para evitar que se seque. Bajo un microscopio estereoscópico, use fórceps y tijeras de resorte para eliminar cuidadosamente cualquier resto de grasa advential que no se haya eliminado por completo durante la disección para reducir la interferencia con la cuantificación de placas dentro de la aorta.
- Utilice unas tijeras de resorte para abrir cuidadosamente la aorta a lo largo de su eje longitudinal interno y luego corte secuencialmente las tres ramas del arco aórtico a lo largo del lado lateral hasta el nivel de la curvatura del arco aórtico, permitiendo que se extienda completamente (Figura 1C).
- En esta etapa, úselo para la tinción de aceite rojo O o almacene en PFA al 4%.
4. Tinción de O rojo aceite del arco aórtico
- Coloque la aorta abierta en una placa de 12 pocillos. Añadir 1 mL de ddH2O estéril a cada pocillo, y lavar durante 5 min en una coctelera, repetir 2 veces.
- Coloque la placa de 12 pocillos con la solución extraída en una campana extractora y seque al aire durante 20 minutos hasta que no haya marcas de agua visibles.
- Añada 1 ml de solución de trabajo Oil Red O recién preparada a cada pocillo y agite durante 20 min en el agitador, luego retire la solución de trabajo Oil Red O.
- Agregue 2 mL de ddH2O estéril a cada pocillo y lave durante 5 min, repita este paso 3 veces. Después de eso, mantenga la aorta en ddH2O.
- Coloque la aorta en un portaobjetos y extiéndala bajo un microscopio estereoscópico. Para mejorar el contraste, coloque una almohadilla de goma negra debajo de la corredera.
- Coloque la diapositiva sobre un papel blanco para mejorar aún más el contraste, con una regla colocada al lado, y tome una foto con una cámara. Para mantener la aorta húmeda, almacene la aorta tratada en un tubo de centrífuga de 1,5 mL que contenga 1 mL de PBS.
5. Análisis imagenológico del arco aórtico
- Abra la imagen aórtica capturada en una computadora equipada con el software Image J.
- Seleccione el área con un cuadro rectangular, como 450 píxeles x 900 píxeles, que contiene toda la aorta, y guárdela como una nueva imagen .tiff.
- Abra la imagen .tiff recién guardada en Imagen J. Haga clic en Editar > Invertir, seleccione Imagen y haga clic en Tipo > pila RGB.
- Vaya a Imagen, haga clic en Pilas > Apilar a imágenes y, a continuación, elija la verde con el mejor contraste.
- Ve a Imagen, haz clic en Ajustar > Brillo/Contraste. Cambie el valor mínimo a aproximadamente 200, minimice el fondo manteniendo fondos similares para cada imagen y, a continuación, haga clic en Aplicar.
- Vaya a Analizar y seleccione Establecer medición. Seleccione Área, Fracción de área, Límite a umbral y Etiqueta de visualización y, a continuación, haga clic en Aceptar.
- Vaya a Analizar, seleccione Medición y copie el resultado en una hoja de cálculo.
- Vaya a Analizar, haga clic en Herramienta > Administrador de ROI, luego elija la parte del arco de la aorta con un cuadro rectangular. Vaya a Administrador de ROI y seleccione Agregar [t] y luego Medir. Copie los resultados medidos en una hoja de cálculo.
- Analice el área medida en los grupos de ratones en función de las pruebas de normalidad. Un p < 0,05 indica que la diferencia es estadísticamente significativa.
NOTA: Seleccione el método estadístico apropiado de acuerdo con el diseño del experimento.
6. Incrustación de parafina en el corazón
- Retire el ápice del corazón y asegúrese de que la incisión esté recta y alineada con la dirección de la raíz de la válvula (Figura 1B).
- Coloque cada muestra de corazón individualmente en una caja de inclusión de parafina y marque la caja con un lápiz.
- En la campana extractora, coloque el casete con pañuelo de papel incrustado en parafina en un recipiente vacío y enjuague la caja de inclusión con agua corriente durante 3 minutos.
- Realice la deshidratación de tejidos utilizando etanol con gradientes de concentración crecientes de la siguiente manera: 50% de etanol durante 2 h, 75% de etanol durante 30 min, 85% de etanol durante 30 min, 95% de etanol durante 30 min, y 100% de etanol durante 10 min. Repita los pasos cambiando el etanol en cada paso.
- Realice la transparencia del tejido con xileno de la siguiente manera: mezcla 1:1 de xileno y etanol durante 20 min, xileno durante 15 min, repita esto 1x cambiando el xileno.
- Derretir la cera de parafina en el horno a 60 °C de antemano. Trate las muestras con una mezcla de xileno y parafina durante 30 minutos, seguido de cera blanda de parafina durante 2 h y luego cera dura de parafina durante 1 h.
PRECAUCIÓN: El etanol es un solvente orgánico inflamable y volátil. El xileno es moderadamente tóxico y requiere protección cuando se usa. - Inclusión en parafina
- Seleccione el molde del tamaño adecuado, enciéndalo y caliente la máquina de incrustación de antemano.
- Después de añadir cera de parafina fundida al molde, extraiga el tejido del casete de inclusión y colóquelo, con la superficie de corte hacia abajo, en la parte inferior central del molde con pinzas calentadas previamente.
- Después de que el molde se haya enfriado en una mesa de congelación y la parafina se haya solidificado, coloque la tapa del casete de inclusión indicada encima del molde y llénelo con la cantidad necesaria de parafina.
- Una vez que la cera de parafina se haya enfriado y fraguado, retire el bloque del molde y manténgalo en un refrigerador a 4 °C (Figura 1D).
7. Secciones de parafina de la raíz aórtica
- Limpie cualquier exceso de parafina que rodee la tapa del casete de incrustación y, a continuación, fije de forma segura el bloque de parafina al asiento de la abrazadera situado en la cabeza de la cortadora de parafina. Ajuste el bloque a una posición ligeramente desplazada desde donde se cortará la rebanada, asegurándose de que la sección de tejido dentro del bloque de parafina esté paralela al borde de corte de la cuchilla. Para la primera sección, ajuste el grosor del corte a 10 μm para revelar la ubicación del tejido.
- Cuando se encuentre la primera incisión bajo el microscopio, ajuste el grosor del corte a 6 μm y realice un corte en serie. Cortar, rebanar y recoger secciones en la rebanadora hasta que tres válvulas aórticas intactas sean visibles bajo el microscopio, momento en el que comienza la preparación para el seccionamiento. Deje un corte a intervalos de 6 μm para cada ratón y coloque diferentes posiciones de corte en diferentes soportes de vidrio, por ejemplo, sección 1-11-21-31, para obtener una visión general adecuada.
- Flote las secciones en un esparcidor que contenga agua tibia a 37 °C para extender el tejido hasta que quede plano y luego recoja el tejido con un portaobjetos. Después de esperar a que el agua se seque, coloque las rodajas en una tostadora a 42 °C durante la noche.
- El área media de la placa de estas 8 secciones representa el valor del área de la placa de la raíz aórtica en cada ratón. Después de teñir estas secciones, mida el área media de la placa y el área de la placa.
8. Tinción de hematoxilina eosina
- Coloque las rodajas en una secadora a 60 °C durante 30 min. En una campana extractora, utilizando una rejilla de tinción, coloque secciones secuencialmente en xileno durante 10 minutos (repita este paso una vez, cambiando el xileno), etanol al 100% durante 5 minutos (repita este paso, cambiando el etanol), etanol al 95% durante 5 minutos, etanol al 85% durante 5 minutos y etanol al 75% durante 5 minutos.
- Enjuague con agua corriente durante 5 min. Sumerja las secciones en la tinción de hematoxilina durante 8 minutos y enjuague con agua corriente.
- Diferencie las secciones con alcohol de ácido clorhídrico al 1% durante unos segundos y enjuague con agua corriente y observe que las secciones se vuelven de color azul púrpura bajo el microscopio.
- Sumerja las secciones en una solución de tinción de eosina durante 5 min. Coloque las secciones en etanol al 95% durante 7 inmersiones y luego en etanol al 100% durante 30 s.
- Transparente en xileno durante al menos 30 s. Selle los portaobjetos con goma neutra, fotografíe bajo un microscopio y guarde imágenes de alta resolución, preferiblemente en formato .tiff.
9. Tinción de Verhoeff-Van Gieson (VVG)
- Realice la desparafinación y rehidratación rutinarias en las secciones de parafina, siguiendo los mismos pasos que se describen en las secciones 8.1 y 8.2.
- Después de enjuagar brevemente con etanol al 70%, sumerja las secciones en la solución de tinción Victoria Blue'B durante 15 minutos.
- Diferenciar las secciones durante unos segundos en etanol al 95%. Lave las secciones 2 veces con agua destilada.
- Teñir las secciones con solución de tinción Ponceau durante 5 min mediante la aplicación por gotas. Diferenciar y deshidratar las secciones utilizando etanol 100%.
NOTA: Después de la tinción de Ponceau, evite cualquier contacto con el agua. - Transparente en xileno durante al menos 30 s. Monta los portaobjetos con goma neutra y fotografíalos bajo un microscopio.
10. Análisis imagenológico de la placa de la raíz aórtica
- Abra la imagen en una computadora equipada con el software Image J. Seleccione cualquier herramienta de caja para colocar la placa en la caja.
- Ve a Imagen, haz clic en Superposición > Agregar selección, luego en Medir para medir el área de la placa. Copie los resultados medidos en una hoja de cálculo.
- Analice el área medida en los grupos de ratones en función de las pruebas de normalidad. Un p < 0,05 indica que la diferencia es estadísticamente significativa.
Resultados
Los resultados representativos demuestran la aplicación de la técnica de aislamiento y análisis de las lesiones del arco aórtico y la raíz en un modelo de ratón aterosclerótico. Estos resultados proporcionan una clara evidencia de la capacidad de la técnica para identificar y caracterizar las lesiones ateroscleróticas. Por ejemplo, las imágenes histológicas con tinciones específicas (p. ej., Oil Red O) resaltan la acumulación de lípidos, mientras que la tinción con hematoxilina y eosina (H&E) revela la morfología general de las lesiones ateroscleróticas, incluida la estructura de la pared arterial, la presencia de núcleos lipídicos y áreas de necrosis. Mediante el análisis de las secciones teñidas con H&E, podemos evaluar el grado de desarrollo de la lesión y los cambios estructurales en la aorta, proporcionando una visión general de la progresión de la placa y la remodelación del tejido.
En este protocolo, analizamos la extensión de las lesiones ateroscleróticas en ratones knockout C57 Ldlr de 12 semanas de edad alimentados con una dieta de estilo occidental (WTD) durante 4 meses y ratones Ldlr-/- alimentados con una dieta Chow como controles.
Después de 12 semanas de dieta Chow y alimentación con dieta occidental, los ratones knockout Ldlr en el grupo de dieta occidental tenían pesos corporales significativamente elevados en comparación con el grupo de control. Además, los niveles de lípidos en el grupo de dieta occidental también cambiaron, con niveles significativamente más altos de triglicéridos plasmáticos (TG) y colesterol total (TC), donde TG y TC se detectaron mediante un ensayo de inmunoabsorción enzimática tomado de la sangre de la cola de los ratones (Figura 2).
Los resultados de la tinción aórtica de Aceite Rojo O en ratones knockout con Ldlr alimentados con la dieta occidental, que mostraron una acumulación severa de lípidos y lesiones ateroscleróticas en comparación con los ratones alimentados con la dieta chow, indican que más depósitos de lípidos en las arterias corresponden a lesiones ateroscleróticas más severas (Figura 3).
En los cortes de raíces aórticas, una mayor área de placa y núcleos necróticos implica una lesión aterosclerótica más grave. Aquí, se demostró que el área lesional de la raíz aórtica y el núcleo necrótico son mucho más grandes en los ratones occidentales alimentados con dieta que en los ratones alimentados con dieta Chow (Figura 4A). Se realizó tinción VVG de secciones de parafina de la raíz aórtica para evaluar el área enferma de la raíz aórtica; Las fibras elásticas eran de color púrpura azulado, y las fibras de colágeno generalmente proliferaban para formar una capa fibrosa y aparecían rojas. La tinción con VVG nos ayuda a ver si hay destrucción o reducción de las fibras elásticas, engrosamiento de la pared del vaso y deposición de fibras de colágeno anormales, lo que puede ser un signo de inflamación o remodelación patológica. Aquí, mostró las tendencias de aumento de las fibras de colágeno en la capa fibrosa en la raíz aórtica de ratones occidentales alimentados con dieta en comparación con los ratones alimentados con dieta Chow (Figura 4B). La cuantificación del área lesional de la raíz aórtica y el área necrótica mostró que la dieta occidental empeora el estado aterosclerótico en ratones knockout Ldlr (Figura 4C).

Figura 1: Pasos para el aislamiento y análisis de las lesiones del arco aórtico y la raíz. (A) Aislamiento de la aorta y el corazón. (B) Preparación de la raíz aórtica. Se cortó el tejido cardíaco entre las dos líneas punteadas. (C) Fijación y pretratamiento del arco aórtico. (D) Incrustación de parafina en el corazón. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cambios en el peso corporal y los niveles de lípidos en sangre de ratones del grupo Control y WTD alimentados durante 12 semanas. (A) Curva de peso corporal en la alimentación con CD y WTD. (B) Triglicéridos plasmáticos (TG). (C) Colesterol total (CT) (n=4). Los resultados se expresan como media ± SEM, la significancia se evaluó mediante la prueba t de Student. p < 0,001, **** p < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
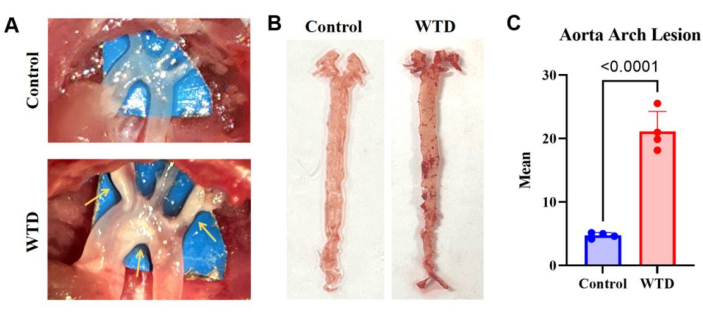
Figura 3: El arco aórtico y su tinción y análisis de Oil Red O. (A) Imágenes representativas de placas ateroscleróticas en el arco aórtico. Los arcos aórticos de los ratones Ldlr-/- alimentados con una dieta Chow se observaron microscópicamente sin placas visibles, mientras que los arcos aórticos de los ratones Ldlr-/- alimentados con una dieta occidental se observaron microscópicamente con placas visibles. (B) Imágenes representativas de tinción de aceite aórtico rojo O. La aorta completa de los ratones Ldlr-/- alimentados con una dieta Chow sin acumulación de lípidos, y la aorta completa de los ratones Ldlr-/- alimentados con una dieta occidental durante 4 meses tenían placas visibles en el arco aórtico (n=4). (C) Número medio de lesiones del arco aorta. Los resultados se expresan como media ± SEM, y la significancia se evaluó mediante la prueba t de Student. p < 0,001, **** p < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
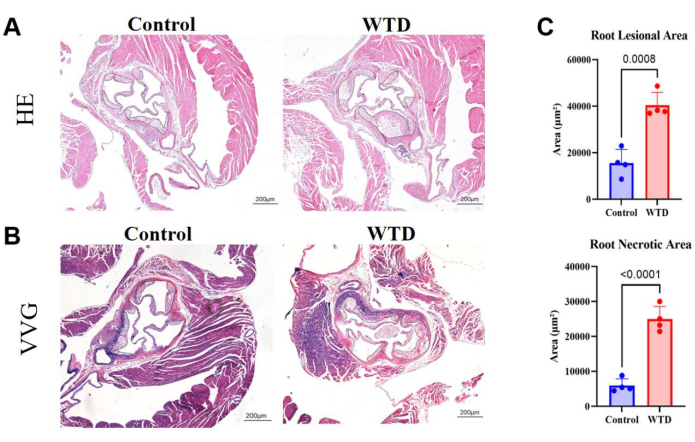
Figura 4: Cortes de raíz aórtica teñidos con HE y VVG, con cuantificación de área de placa y área necrótica. (A) Secciones representativas de la raíz aórtica teñidas con hematoxilina y eosina. Raíces aórticas de ratones Ldlr-/- sometidos a intervenciones con la dieta Chow y la dieta occidental, respectivamente. (B) Secciones representativas de la raíz aórtica teñidas con Verhoeff-Van Gieson. Las raíces aórticas de los ratones Ldlr-/- sometidos a intervenciones con la dieta Chow y la dieta occidental, respectivamente, están rodeadas por un círculo negro y son lesiones ateroscleróticas en los ratones. (C) La cuantificación del área lesional de la raíz aórtica y el área necrótica (n=4). Los resultados se expresan como media ± SEM, y la significancia se evaluó mediante la prueba t de Student. p < 0,001, **** p < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, proporcionamos información detallada sobre los métodos de muestreo aórtico en ratones knockout Ldlr y el análisis cuantitativo de las placas.
La precisión del procedimiento de disección es el mayor desafío técnico para la extracción aórtica in vivo en el modelo murino de aterosclerosis. Según nuestra experiencia, los puntos clave son los siguientes: (1) utilizar PBS para lavar toda la sangre de la arteria y aumentar la comparación entre las ramas del arco aórtico y la grasa perivascular. (2) Sé paciente. Debido al pequeño tamaño de la aorta del ratón, el procedimiento debe realizarse bajo un microscopio corporal y utilizando maquinillas y pinzas microscópicas de alta calidad para minimizar los errores en la operación. (3) Es imperativo garantizar que el desmontaje se inicie con precisión y en la dirección correcta para evitar cortes o daños en el recipiente.
Con respecto a la tinción de O rojo de aceite aórtico en ratones, la grasa periférica de la aorta aislada del ratón debe eliminarse microscópicamente antes de la tinción formal, y se debe mantener la integridad del tejido para evitar afectar los resultados de la tinción. El proceso de teñido rojo aceite exige un control preciso sobre el tiempo de teñido; Tanto las duraciones excesivas como las insuficientes pueden comprometer el efecto del teñido, lo que da lugar a resultados inexactos.
En la inclusión de raíces aórticas de ratón, el tiempo de deshidratación del tejido debe controlarse para evitar el agrietamiento del tejido durante el corte. Las secciones de la raíz aórtica deben tener un grosor uniforme para garantizar una tinción uniforme, y las secciones que son demasiado delgadas o demasiado gruesas pueden interferir con la observación. Al mismo tiempo, es necesario determinar con precisión dónde aparece la válvula tricúspide cuando se observa bajo el microscopio. El proceso de tinción con eosina de hematoxilina requiere un control preciso del tiempo de tinción y de la concentración de la solución de tinción para evitar la tinción inespecífica.
En comparación con los excelentes métodos existentes para evaluar la aterosclerosis, este protocolo proporcionó detalles paso a paso para diseccionar tanto el arco aórtico como la raíz, lo que puede ayudar a evaluar de manera integral el estado aterosclerótico11,13 Tanto la tinción de hematoxilina-eosina como la tinción VVG pueden ayudar a evaluar el área lesional de la raíz aórtica, lo que aumenta la precisión de la cuantificación de la aterosclerosis.
Sin embargo, todavía existen algunas limitaciones de la tinción de aceite rojo O aórtico. Por ejemplo, la tinción con rojo aceite se utiliza principalmente para detectar lípidos, pero tiene poca especificidad para otros tipos de componentes celulares o tisulares11, lo que puede llevar a una clasificación errónea. Por otro lado, el proceso de fijación y disección de la muestra puede conducir a la pérdida de lípidos, lo que afecta la fiabilidad de los resultados de la tinción. En cuanto a la tinción de hematoxilina-eosina de la raíz aórtica, es limitada en la diferenciación de componentes celulares y puede ser difícil identificar áreas específicas de la lesión en casos de estructura tisular compleja. Al realizar análisis cuantitativos, los resultados estadísticos del área del parche también pueden verse influenciados por el juicio subjetivo del observador. Además, la tinción con hematoxilina-eosina proporciona principalmente información morfológica y no proporciona información sobre la función celular ni la caracterización molecular.
Además de la tinción estándar de rojo de aceite y la tinción de hematoxilina-eosina, otras técnicas para analizar placas ateroscleróticas incluyen la tinción de Masson, la tinción inmunohistoquímica para varios antígenos y otros métodos que se pueden emplear para examinar la composición y las dimensiones de la placa. La tinción de O rojo aceite de secciones de raíz aórtica también se usa ampliamente para analizar la deposición de lípidos en la raíz aórtica14. La tinción con rojo de alizarina S es una tinción comúnmente utilizada para detectar depósitos de calcio; Forma un complejo rojo con iones de calcio, por lo que es ideal para visualizar los depósitos de calcio15. Además, el metabolismo de los lípidos se puede inferir a partir de marcadores bioquímicos séricos como los niveles de lipoproteínas de alta densidad (HDL), lipoproteínas de baja densidad (LDL), colesterol total (TC) y triacilglicerol total (TG). Uno de los factores clave que contribuyen al desarrollo de la aterosclerosis es el metabolismo anormal de los lípidos, en particular la relación entre la aterosclerosis y la enfermedad cardiovascular (ASCVD) y los niveles de colesterol de lipoproteínas de baja densidad (LDL).
A medida que se profundice la investigación sobre la aterosclerosis, el desarrollo futuro de los métodos de análisis cuantitativo será más preciso y diversificado. En primer lugar, la integración de tecnologías de imagen avanzadas, como la resonancia magnética de alta resolución, la tomografía de coherencia óptica (OCT) y las imágenes de ultrasonido, hará que el análisis cuantitativo de la aterosclerosis sea más preciso, lo que permitirá el seguimiento dinámico de ratones vivos. Esto ayudará en la evaluación en tiempo real de la progresión, la estabilidad y la respuesta al tratamiento de la placa. Con el avance de las tecnologías de imagen molecular, el análisis cuantitativo permitirá un análisis en profundidad de las respuestas inflamatorias, la acumulación de lípidos y los componentes celulares dentro de las placas, proporcionando datos más completos para el diagnóstico temprano y el tratamiento de la aterosclerosis16.
Divulgaciones
Nada que declarar.
Agradecimientos
Este trabajo fue apoyado por la Base de Investigación de Ciencia de Shanghai Frontiers de Ejercicio y Salud Metabólica, el programa de investigación de ejercicio y salud pública (0831) en la Universidad del Deporte de Shanghai, el programa de financiación de capacitación de jóvenes maestros de educación superior de Shanghai (A2-0213-22-0058-5) y el Comité Municipal de Ciencia y Tecnología de Shanghai del plan de líderes académicos destacados (21XD1403200) para Longhua Liu.
Materiales
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides(25×75mm) | CITOTEST | Cat# 80312-3161 | |
| Embedding cassette | CITOTEST | Cat# 80106-1100-16 | |
| Eosin Staining Solution | Beyotime | Cat# C0109 | |
| Ethanol | Sinopharm Chemical Reagent Co. | Cat# 10009218 | |
| Hematoxylin Staining Solution | Beyotime | Cat# C0107 | |
| Low-profile disposable blades | Leica | Cat# 14035838925 | |
| Microscope cover glass(24×50mm) | CITOTEST | Cat# 10212450C | |
| Neutral Balsam Mounting Medium | Sango Biotech | Cat# E675007-0100 | |
| Oil red o powder | Sigma-Aldrich | Cat# 1320-06-5 | |
| paraffin with ceresin | Sinopharm Chemical Reagent Co. | Cat# 69019461 | |
| Paraformaldehyde | Servicebio | Cat# G1101 | |
| Phosphate Buffered Saline (PBS, Powder) | Servicebio | Cat# G0002-2L | |
| Ponceau S Staining Solution | EveryLab | Cat# FM024 | |
| Victoria Blue’B | Aladdin | Cat# 2580-56-5 | |
| Xylene | Sigma-Aldrich | Cat# 104-81-4 |
Referencias
- Libby, P., et al. Atherosclerosis. Nat Rev Dis Primers. 5 (1), 56 (2019).
- Herrington, W., Lacey, B., Sherliker, P., Armitage, J., Lewington, S. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease. Circ Res. 118 (4), 535-546 (2016).
- Frostegård, J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 11, 117 (2013).
- Gisterå, A., Ketelhuth, D. F. J., Malin, S. G., Hansson, G. K. Animal models of atherosclerosis-supportive notes and tricks of the trade. Circ Res. 130 (12), 1869-1887 (2022).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 32 (5), 1104-1115 (2012).
- Ilyas, I., et al. Mouse models of atherosclerosis in translational research. Trends Pharmacol Sci. 43 (11), 920-939 (2022).
- Liu, L., Chan, M., Yu, L., Wang, W., Qiang, L. Adipsin deficiency does not impact atherosclerosis development in ldlr(-/-) mice. Am J Physiol Endocrinol Metab. 320 (1), E87-E92 (2021).
- Liu, L., et al. Pparγ deacetylation confers the antiatherogenic effect and improves endothelial function in diabetes treatment. Diabetes. 69 (8), 1793-1803 (2020).
- Zahr, T., et al. Pparγ (peroxisome proliferator-activated receptor γ) deacetylation suppresses aging-associated atherosclerosis and hypercholesterolemia. Arterioscler Thromb Vasc Biol. 43 (1), 30-44 (2023).
- Tang, C., et al. Endothelial ccrl2 induced by disturbed flow promotes atherosclerosis via chemerin-dependent β2 integrin activation in monocytes. Cardiovasc Res. 119 (9), 1811-1824 (2023).
- Andrés-Manzano, M. J., Andrés, V., Dorado, B. Oil red o and hematoxylin and eosin staining for quantification of atherosclerosis burden in mouse aorta and aortic root. Methods Mol Biol. 1339, 85-99 (2015).
- Mehlem, A., Hagberg, C. E., Muhl, L., Eriksson, U., Falkevall, A. Imaging of neutral lipids by oil red o for analyzing the metabolic status in health and disease. Nat Protoc. 8 (6), 1149-1154 (2013).
- Chen, P. Y., Qin, L., Simons, M. Imaging and analysis of oil red o-stained whole aorta lesions in an aneurysm hyperlipidemia mouse model. J Vis Exp. (183), e61277 (2022).
- Lin, Y., et al. Practical assessment of the quantification of atherosclerotic lesions in apoe-/- mice. Mol Med Rep. 12 (4), 5298-5306 (2015).
- Bozycki, L., Łukasiewicz, K., Matryba, P., Pikula, S. Whole-body clearing, staining and screening of calcium deposits in the mdx mouse model of duchenne muscular dystrophy. Skelet Muscle. 8 (1), 21 (2018).
- Glaudemans, A. W., et al. Molecular imaging in atherosclerosis. Eur J Nucl Med Mol Imaging. 37 (12), 2381-2397 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados