Method Article
Isolement et analyse de lésions de l’arc aortique et de la racine dans un modèle murin athérosclérotique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole fournit une méthodologie complète pour l’analyse quantitative des plaques d’athérosclérose afin de faciliter des recherches plus approfondies sur les mécanismes et la progression de l’athérosclérose.
Résumé
L’athérosclérose, l’une des principales causes de maladies cardiovasculaires, nécessite un examen détaillé du développement et de la progression des lésions. Cette étude introduit un protocole complet pour l’isolement et l’analyse histologique des lésions de l’arc aortique et des racines dans un modèle de souris athéroscléreuses largement utilisé, les souris Ldlr-/-) à faible densité des récepteurs des lipoprotéines de basse densité. L’arc aortique et la racine sont des sites clés pour les lésions athérosclérotiques, et leur examen est essentiel pour évaluer l’apparition, la progression ou la régression de l’athérosclérose, prédire les risques d’événements cardiovasculaires et identifier des cibles thérapeutiques potentielles. Ce protocole décrit les méthodes de quantification de la charge athéroscléreuse dans l’arc aortique et la racine, y compris l’isolement des tissus, la fixation, la coloration au rouge d’huile, le sectionnement de la racine aortique, la coloration à l’hématoxyline et à l’éosine (HE), la coloration Verhoeff-Van Gieson (VVG) et l’analyse d’images. La coloration Oil Red O mesure la surface de la plaque dans l’arc aortique, évaluant la gravité de l’athérosclérose, tandis que la coloration HE de la racine aortique révèle les composants de la plaque tels que le noyau lipidique et la coiffe fibreuse, facilitant l’évaluation de la stabilité de la plaque et du risque de rupture. La coloration VVG peut colorer les fibres de collagène dans les tissus, fournissant des informations supplémentaires sur la composition de la plaque et des informations connexes. Cette analyse approfondie offre des informations précieuses sur les mécanismes de développement des lésions et peut guider la création de nouvelles stratégies thérapeutiques pour prévenir et traiter l’athérosclérose.
Introduction
Les maladies cardiovasculaires, en particulier l’athérosclérose, sont devenues un fardeau important pour la santé et une cause principale de décès dans le monde 1,2. L’athérosclérose est une maladie inflammatoire chronique progressive caractérisée par l’accumulation progressive de lipides et la formation de plaques dans la paroi artérielle, conduisant finalement au rétrécissement de la lumière artérielle et potentiellement à la rupture des plaques, déclenchant des événements cardiovasculaires aigus tels que l’infarctus du myocarde et les accidents vasculaires cérébraux 1,2,3. Compte tenu de son impact profond sur la santé humaine, il est urgent de comprendre les mécanismes sous-jacents à l’athérosclérose et de développer des stratégies thérapeutiques efficaces.
Ces dernières années, les modèles animaux ont joué un rôle crucial dans l’avancement de notre compréhension de l’athérosclérose. Parmi diverses espèces, les souris sont devenues un modèle privilégié en raison de leur reproduction rapide, de leurs faibles coûts d’entretien et de la disponibilité de techniques de manipulation génétique avancées 4,5. En particulier, les souris Ldlr-//- et les souris ApoE-/- ont été largement utilisées pour imiter l’athérosclérose humaine, car elles présentent des caractéristiques physiopathologiques similaires 4,5,6,7,8,9.
Les lésions athéroscléreuses chez la souris peuvent survenir à divers endroits de l’aorte, mais elles sont particulièrement susceptibles de se développer dans des zones étroitement associées à l’hémodynamique, telles que la racine aortique, l’arc aortique et le tronc brachiocéphale, tandis que l’aorte descendante est relativement moins touchée10. Pour évaluer avec précision la charge des lésions athéroscléreuses dans des modèles murins, évaluer la présence, la taille et le stade des plaques, et ainsi étudier l’impact de différents médicaments ou facteurs sur l’apparition, la progression et la régression de l’athérosclérose, une combinaison de techniques de coloration histologique et d’analyse d’imagerie est essentielle11. La coloration Oil Red O, une méthode bien établie, colore spécifiquement les lipides neutres et les lipoprotéines12, fournissant une visualisation directe de la formation de plaque dans l’arc aortique13. Pendant ce temps, la coloration à l’hématoxyline-éosine (HE) de la racine aortique délimite non seulement la zone de la plaque, mais fournit également des caractéristiques structurelles détaillées, telles que la coiffe fibreuse et le noyau nécrotique lipidique. Ces détails sont cruciaux pour évaluer la stabilité de la plaque et prédire le risque de rupture de la plaque11. Ensemble, ces techniques permettent une évaluation complète de la gravité et de la progression des lésions athérosclérotiques.
Ce protocole a pris comme exemples des souris C57BL6/J Ldlr-/- nourries avec le régime Chow et le régime occidental, dans le but de fournir un guide détaillé, étape par étape, pour évaluer la charge des lésions athéroscléreuses chez les souris en utilisant la coloration Oil Red O de l’arc aortique et la coloration HE des sections de racine aortique incluses dans la paraffine, suivie d’une analyse d’image. Le protocole couvre tous les aspects de l’isolement et de la fixation de l’aorte, de l’intégration et de la coupe de la paraffine, des procédures de coloration et de l’analyse d’images, tout en intégrant des détails opérationnels et des considérations pour les étapes clés, garantissant la reproductibilité et la fiabilité des résultats. En suivant ce protocole, les chercheurs peuvent évaluer avec précision et efficacité l’efficacité des interventions thérapeutiques et mieux comprendre les mécanismes sous-jacents à l’athérosclérose.
Protocole
Tous les protocoles sur les animaux utilisés dans cette étude ont été approuvés par le Comité d’éthique de l’expérimentation animale de l’Université des sports de Shanghai.
1. Préparation des réactifs et des outils de dissection
- Stérilisez à l’avance les outils de dissection, y compris les ciseaux fins, les pinces droites, les pinces courbes, les ciseaux à ressort et les goupilles, à l’autoclave.
- Éthanol à 75 % : Mélanger 75 mL d’éthanol anhydre avec 25 mL de ddH2O.
- 1x Saline tamponnée au phosphate (PBS) : Dissoudre 0,01 M de poudre de PBS dans 2 L de ddH2O.
- Solution de paraformaldéhyde à 4 % (PFA) : Chauffer 800 mL de 1x PBS à environ 60 °C sur un agitateur magnétique dans une hotte. Ajouter lentement 40 g de poudre de paraformaldéhyde en remuant continuellement. Titrer avec du NaOH 1N jusqu’à dissolution complète. Refroidir à température ambiante, régler le volume à 1 L avec 1x PBS, filtrer et ajuster le pH à 7,2-7,4.
ATTENTION : Le PFA est un produit chimique dangereux qui nécessite une manipulation soigneuse et le strict respect des protocoles de sécurité. - Solution de stockage d’Oil Red O : Dissoudre 2,5 g de poudre Oil Red O dans 500 mL d’isopropanol à 100 %, sceller dans une bouteille brune et conserver au réfrigérateur à 4 °C pour un stockage à long terme.
ATTENTION : L’isopropanol est un produit chimique toxique et nocif ; par conséquent, pour assurer la santé et la sécurité, il est essentiel de porter l’équipement de protection individuelle (EPI) nécessaire, y compris des gants. - Solution de travail d’Oil Red O : Mélanger la solution de stockage et le ddH2O stérile dans un rapport de 3:2. Préparez la solution fraîche pour chaque utilisation et filtrez la solution avec un filtre à seringue stérile de 0,22 μm ou un grand papier filtre.
- Solution de coloration Victoria Blue’B : Dissoudre 0,5 g de Victoria Blue’B dans 100 ml d’éthanol à 70 %.
2. Isolement de l’aorte et du cœur
- Hébergez toutes les souris à raison de 3 à 5 animaux par cage, avec un cycle lumière/obscurité de 12 heures, dans un environnement à température contrôlée et nourrissez-les avec un régime alimentaire standard (chow) ou un régime de type occidental (WTD) contenant 0,2 % de cholestérol et 21,2 % de matières grasses. Sélectionnez des souris mâles C57BL6/J LDLr-/- âgées de 12 semaines et pesant entre 25 et 30 g. Sacrifiez des souris dans une chambre de CO2 .
- Avant la dissection, placez les souris en position couchée (face ventrale vers le haut) sur une planche de mousse recouverte de 1 à 2 couches de papier absorbant et fixez les membres avec des épingles.
- Vaporisez de l’éthanol à 75 % sur l’abdomen des souris pour nettoyer et humidifier la fourrure.
- Utilisez des pinces pour saisir la peau ventrale des souris et utilisez des ciseaux fins pour couper la peau de la base de l’abdomen jusqu’au haut du cou.
- Ouvrez la paroi abdominale, puis utilisez une pince pour soulever le sternum et coupez à travers le diaphragme et les côtes pour exposer la cavité thoracique.
- Retirez l’œsophage et la trachée, ce qui permettra un nettoyage plus facile des artères carotides. Enlever des organes, y compris le foie, les poumons, la rate, le tractus gastro-intestinal et le pancréas, tout en préservant les reins situés derrière le péritoine et l’aorte abdominale à côté de la colonne vertébrale. Lors de la dissection des artères mésentériques, assurez-vous de soulever les intestins et de faire des incisions en s’éloignant de l’aorte pour éviter d’endommager l’aorte abdominale.
- Pour fournir un champ d’observation dégagé, placez les souris sous un stéréomicroscope et alignez la source de lumière froide avec la zone de dissection.
- Injectez lentement une seringue de 10 mL remplie de PBS avec une aiguille RWLB de 0,45 x 15 (II) dans l’apex ventriculaire gauche et observez la dilatation de l’aorte.
- Essuyez doucement le sang et le liquide dans la zone de dissection avec du papier de soie pour exposer complètement le champ de vision.
- L’aorte thoracique est facile à exposer. Utilisez-le comme une percée en utilisant des pinces pour saisir le segment diaphragmatique attaché à l’extrémité de l’aorte thoracique et des ciseaux à ressort pour couper le tissu conjonctif entre l’aorte et la paroi musculaire thoracique.
- Tirez doucement le cœur avec des pinces et soulevez l’aorte thoracique, en observant les branches de l’arc aortique, et disséquez la graisse adventice et le tissu conjonctif autour de l’arc aortique et ses branches vers le haut le long de l’aorte thoracique.
REMARQUE : Soyez prudent, gardez l’aorte intacte, évitez de la déchirer ou de la blesser, et retirez soigneusement la graisse environnante et le tissu conjonctif. Cette étape nécessite une pratique répétée pour obtenir une manipulation efficace. - Disséquez l’aorte abdominale et les artères iliaques communes vers le bas le long de l’aorte thoracique.
- Coupez les artères iliaques communes de 1 à 2 mm sous leur bifurcation, coupez les petites branches de l’aorte le long de la colonne vertébrale pour la libérer, détachez les artères rénales près des reins, coupez les trois vaisseaux ramifiés du cou de leurs extrémités distales et enfin coupez l’aorte ascendante près du cœur.
- Avant de disséquer l’arc aortique, placez un petit joint de couleur foncée avec un contraste élevé avec les vaisseaux sanguins en dessous et photographiez la zone de l’arc aortique.
- Coupez le tissu cardiaque et coupez la moitié inférieure du cœur le long d’un plan parallèle aux oreillettes. Fixez le cœur coupé (Figure 1A).
3. Fixation et prétraitement de l’arc aortique
- Préparez à l’avance 1 mL de solution de PFA à 4 % dans un tube à centrifuger de 1,5 mL.
- Placez l’aorte dans le tube et fixez-la pendant au moins 24 h à température ambiante.
REMARQUE : L’aorte peut être conservée dans 4 % de PFA jusqu’à 1 mois sans affecter la qualité de la coloration Oil Red O. Pour maintenir sa configuration normale, placer le tissu sur un caoutchouc avant la fixation peut être une option appropriée. - Transférez l’aorte dans une boîte de Pétri contenant du PBS pour éviter qu’elle ne se dessèche. Sous un stéréomicroscope, utilisez des pinces et des ciseaux à ressort pour retirer soigneusement toute graisse adventice restante qui n’a pas été complètement éliminée lors de la dissection afin de réduire l’interférence avec la quantification des plaques dans l’aorte.
- À l’aide de ciseaux à ressort, ouvrez soigneusement l’aorte le long de son axe longitudinal interne, puis coupez séquentiellement les trois branches de l’arc aortique le long du côté latéral jusqu’au niveau de la courbure de l’arc aortique, ce qui lui permet de s’étendre complètement (Figure 1C).
- À ce stade, utilisez soit pour la coloration rouge à l’huile, soit stockez-le dans 4 % de PFA.
4. Coloration en O rouge à l’huile de l’arc aortique
- Placez l’aorte ouverte dans une plaque à 12 puits. Ajouter 1 mL de ddH2O stérile dans chaque puits et laver pendant 5 minutes sur un agitateur, répéter 2 fois.
- Placez la plaque à 12 puits avec la solution retirée dans une hotte et faites sécher à l’air libre pendant 20 minutes jusqu’à ce qu’il n’y ait plus de filigranes visibles.
- Ajouter 1 ml de solution de travail Oil Red O fraîchement préparée dans chaque puits et agiter pendant 20 minutes sur le shaker, puis retirer la solution de travail Oil Red O.
- Ajouter 2 mL de ddH2O stérile dans chaque puits et laver pendant 5 min, répéter cette étape 3 fois. Après cela, gardez l’aorte en ddH2O.
- Placez l’aorte sur une lame et étalez-la sous un stéréomicroscope. Pour améliorer le contraste, placez un tampon en caoutchouc noir sous la glissière.
- Placez la diapositive sur un papier blanc pour améliorer encore le contraste, avec une règle placée à côté, et prenez une photo à l’aide d’un appareil photo. Pour garder l’aorte humide, conservez l’aorte traitée dans un tube à centrifuger de 1,5 mL contenant 1 mL de PBS.
5. Analyse d’images de l’arc aortique
- Ouvrez l’image de l’aorte capturée sur un ordinateur équipé du logiciel Image J.
- Sélectionnez la zone avec une boîte rectangulaire, par exemple 450 pixels x 900 pixels, qui contient l’ensemble de l’aorte, et enregistrez-la en tant que nouvelle image .tiff.
- Ouvrez l’image .tiff nouvellement enregistrée dans l’image J. Cliquez sur Modifier > Inverser, puis sélectionnez Image et cliquez sur Tapez > pile RVB.
- Allez dans Image, cliquez sur Piles > Empiler sur Images, puis choisissez le vert avec le meilleur contraste.
- Allez dans Image, cliquez sur Ajuster > luminosité/contraste. Définissez la valeur minimale sur environ 200, réduisez l’arrière-plan tout en conservant des arrière-plans similaires pour chaque image, puis cliquez sur Appliquer.
- Allez dans Analyser et sélectionnez Définir la mesure. Sélectionnez Zone, Fraction de surface, Limiter au seuil et Étiquette d’affichage, puis cliquez sur OK.
- Allez dans Analyser, sélectionnez Mesure et copiez le résultat dans une feuille de calcul.
- Allez dans Analyser, cliquez sur Outil > Gestionnaire de retour sur investissement, puis choisissez la partie Arcade de l’aorte avec une boîte rectangulaire. Accédez au Gestionnaire de retour sur investissement et sélectionnez Ajouter [t], puis Mesurer. Copiez les résultats mesurés dans une feuille de calcul.
- Analysez la surface mesurée dans les groupes de souris sur la base de tests de normalité. Un p < 0,05 indique que la différence est statistiquement significative.
REMARQUE : Sélectionnez la méthode statistique appropriée en fonction du plan de l’expérience.
6. Incorporation de paraffine du cœur
- Retirez l’apex du cœur et assurez-vous que l’incision est droite et alignée avec la direction de la racine de la valve (figure 1B).
- Placez chaque échantillon de cœur individuellement dans une boîte d’enrobage de paraffine et marquez la boîte avec un crayon.
- Dans la hotte, placez la cassette contenant du papier en paraffine avec le mouchoir dans un récipient vide et rincez la boîte d’enrobage à l’eau courante pendant 3 min.
- Effectuer la déshydratation tissulaire à l’aide d’éthanol avec des gradients de concentration croissants comme suit : 50 % d’éthanol pendant 2 h, 75 % d’éthanol pendant 30 min, 85 % d’éthanol pendant 30 min, 95 % d’éthanol pendant 30 min et 100 % d’éthanol pendant 10 min. Répétez les étapes en changeant d’éthanol à chaque étape.
- Effectuez la transparence tissulaire avec du xylène comme suit : mélange 1:1 de xylène et d’éthanol pendant 20 min, xylène pendant 15 min, répétez cette opération 1x en changeant le xylène.
- Faites fondre la cire de paraffine au four à 60 °C à l’avance. Traitez les échantillons avec un mélange de xylène et de paraffine pendant 30 min, suivi de cire molle de paraffine pendant 2 h, puis de cire dure de paraffine pendant 1 h.
ATTENTION : L’éthanol est un solvant organique inflammable et volatil. Le xylène est modérément toxique et nécessite une protection lorsqu’il est utilisé. - Enrobage de paraffine
- Sélectionnez le moule de la taille appropriée, allumez-le et réchauffez la machine d’enrobage au préalable.
- Après avoir ajouté de la cire de paraffine fondue dans le moule, extrayez le tissu de la cassette d’enrobage et positionnez-le, avec sa surface coupée vers le bas, au fond central du moule à l’aide d’une pince préalablement chauffée.
- Une fois que le moule a refroidi sur une table de congélation et que la paraffine à l’intérieur s’est solidifiée, placez le couvercle de la cassette d’enrobage indiqué sur le dessus du moule et remplissez-le avec la quantité nécessaire de paraffine.
- Une fois que la cire de paraffine a refroidi et pris, retirez le bloc du moule et conservez-le au réfrigérateur à 4 °C (Figure 1D).
7. Coupes en paraffine de la racine aortique
- Nettoyez tout excès de paraffine entourant le couvercle de la cassette d’enrobage, puis fixez solidement le bloc de paraffine au siège de la pince situé sur la tête de la trancheuse à paraffine. Ajustez le bloc à une position légèrement décalée à partir de l’endroit où la tranche sera coupée, en vous assurant que la section du tissu à l’intérieur du bloc de paraffine est parallèle au tranchant de la lame. Pour la première section, réglez l’épaisseur de la tranche à 10 μm afin de révéler l’emplacement du tissu.
- Lorsque la première incision est trouvée au microscope, ajustez l’épaisseur de la tranche à 6 μm et effectuez une section en série. Coupez, coupez et choisissez des sections dans la trancheuse jusqu’à ce que trois valves aortiques intactes soient visibles au microscope, moment où la préparation pour la section commence. Laissez une tranche à des intervalles de 6 μm pour chaque souris et placez différentes positions de tranche sur différents supports en verre, par exemple, la section 1-11-21-31, pour obtenir une vue d’ensemble correcte.
- Faites flotter les sections sur un épandeur contenant de l’eau tiède à 37 °C pour étaler le tissu à plat, puis prélevez le tissu à l’aide d’une lame. Après avoir attendu que l’eau sèche, placez les tranches sur un grille-pain réglé à 42 °C pendant la nuit.
- La surface moyenne de la plaque de ces 8 sections représente la valeur de la surface de la plaque de la racine aortique chez chaque souris. Après avoir coloré ces sections, mesurez la surface moyenne de la plaque et la surface de la plaque.
8. Coloration à l’hématoxyline et à l’éosine
- Placez les tranches dans un séchoir à 60 °C pendant 30 min. Dans une hotte, à l’aide d’une grille de coloration, placez séquentiellement des sections dans du xylène pendant 10 min (répétez cette étape une fois, en changeant le xylène), 100 % d’éthanol pendant 5 min (répétez cette étape, en changeant l’éthanol), 95 % d’éthanol pendant 5 min, 85 % d’éthanol pendant 5 min et 75 % d’éthanol pendant 5 min.
- Rincer à l’eau courante pendant 5 min. Immergez les sections dans la teinture à l’hématoxyline pendant 8 min et rincez à l’eau courante.
- Différenciez les sections avec de l’alcool à 1 % d’acide chlorhydrique pendant quelques secondes et rincez à l’eau courante et observez que les sections deviennent bleu-violet au microscope.
- Immergez les sections dans une solution de coloration à l’éosine pendant 5 min. Placez les sections dans de l’éthanol à 95 % pendant 7 trempages puis dans de l’éthanol à 100 % pendant 30 s.
- Transparent dans le xylène pendant au moins 30 s. Scellez les lames à l’aide d’une gomme neutre, photographiez au microscope et enregistrez des images haute résolution, de préférence dans un format .tiff.
9. Coloration Verhoeff-Van Gieson (VVG)
- Effectuez le déparaffinage et la réhydratation habituels sur les sections de paraffine, en suivant les mêmes étapes que celles décrites aux sections 8.1 et 8.2.
- Après un bref rinçage à l’éthanol à 70 %, immergez les sections dans la solution de coloration Victoria Blue’B pendant 15 min.
- Différenciez les sections pendant quelques secondes en éthanol à 95 %. Lavez les sections 2x avec de l’eau distillée.
- Teindre les sections avec la solution de coloration Ponceau pendant 5 min par gouttelettes. Différencier et déshydrater les sections à l’aide d’éthanol à 100 %.
REMARQUE : Après la coloration Ponceau, évitez tout contact avec l’eau. - Transparent dans le xylène pendant au moins 30 s. Fixez les lames avec de la gomme neutre et photographiez-les au microscope.
10. Analyse d’images de la plaque de la racine aortique
- Ouvrez l’image sur un ordinateur équipé du logiciel Image J. Sélectionnez n’importe quel outil de boîte pour encadrer la plaque.
- Accédez à Image, cliquez sur Superposition > Ajouter une sélection, puis sur Mesurer pour mesurer la surface de la plaque. Copiez les résultats mesurés dans une feuille de calcul.
- Analysez la surface mesurée dans les groupes de souris sur la base de tests de normalité. Un p < 0,05 indique que la différence est statistiquement significative.
Résultats
Les résultats représentatifs démontrent l’application de la technique d’isolement et d’analyse des lésions de l’arc aortique et des racines dans un modèle murin athérosclérotique. Ces résultats mettent clairement en évidence la capacité de la technique à identifier et à caractériser les lésions athérosclérotiques. Par exemple, les images histologiques avec des colorations spécifiques (par exemple, Oil Red O) mettent en évidence l’accumulation de lipides, tandis que la coloration à l’hématoxyline et à l’éosine (H&E) révèle la morphologie globale des lésions athérosclérotiques, y compris la structure de la paroi artérielle, la présence de noyaux lipidiques et les zones de nécrose. En analysant les coupes colorées par H&E, nous pouvons évaluer l’étendue du développement des lésions et des changements structurels dans l’aorte, fournissant un aperçu de la progression de la plaque et du remodelage tissulaire.
Dans ce protocole, nous avons analysé l’étendue des lésions athéroscléreuses chez des souris C57 Ldlr knockout âgées de 12 semaines nourries avec un régime de style occidental (WTD) pendant 4 mois et des souris Ldlr-/- nourries avec un régime Chow comme témoins.
Après 12 semaines de régime Chow et d’alimentation au régime occidental, les souris Ldlr knock-out du groupe de régime occidental avaient un poids corporel significativement plus élevé par rapport au groupe témoin. De plus, les taux de lipides dans le groupe de régime occidental ont également été modifiés, avec des taux significativement plus élevés de triglycérides plasmatiques (TG) et de cholestérol total (CT), où TG et TC ont été détectés par un test immuno-enzymatique prélevé dans le sang de la queue des souris (Figure 2).
Les résultats de la coloration de l’aorte Oil Red O chez des souris knock-out Ldlr nourries avec le régime occidental, qui présentaient une accumulation sévère de lipides et des lésions athéroscléreuses par rapport aux souris nourries avec le régime chow, indiquent que plus de dépôts lipidiques sur les artères correspondent à des lésions athéroscléreuses plus graves (Figure 3).
Dans les sections de racines aortiques, une plus grande surface de plaque et de noyaux nécrotiques implique une lésion athéroscléreuse plus sévère. Ici, il a été montré que la zone lésionnelle de la racine aortique et le noyau nécrotique sont beaucoup plus grands chez les souris nourries au régime occidental que chez les souris nourries au régime Chow (Figure 4A). Une coloration VVG des sections de paraffine de la racine aortique a été réalisée pour évaluer la zone malade de la racine aortique ; Les fibres élastiques étaient bleu-violet, et les fibres de collagène proliféraient généralement pour former une coiffe fibreuse et apparaissaient rouges. La coloration VVG nous aide à voir s’il y a destruction ou réduction des fibres élastiques, épaississement de la paroi du vaisseau et dépôt de fibres de collagène anormales, ce qui peut être un signe d’inflammation ou de remodelage pathologique. Ici, il a montré les tendances de l’augmentation des fibres de collagène dans la coiffe fibreuse de la racine aortique des souris nourries au régime occidental par rapport à celle des souris nourries au régime Chow (Figure 4B). La quantification de la zone lésionnelle de la racine aortique et de la zone nécrotique a montré que le régime occidental aggrave le statut athérosclérotique chez les souris knock-out Ldlr (Figure 4C).

Figure 1 : Étapes de l’isolement et de l’analyse des lésions de l’arc aortique et des racines. (A) Isolement de l’aorte et du cœur. (B) Préparation de la racine aortique. Le tissu cardiaque entre les deux lignes pointillées a été tranché. (C) Fixation et prétraitement de l’arc aortique. (D) Incorporation de paraffine dans le cœur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Changements dans le poids corporel et les taux de lipides sanguins chez les souris du groupe témoin et du groupe WTD nourries pendant 12 semaines. (A) Courbe du poids corporel sur l’alimentation CD et WTD. (B) Triglycérides plasmatiques (TG). (C) Cholestérol total (CT) (n = 4). Les résultats sont exprimés en moyenne ± SEM, la signification a été évaluée par le test t de Student. p < 0,001, **** p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
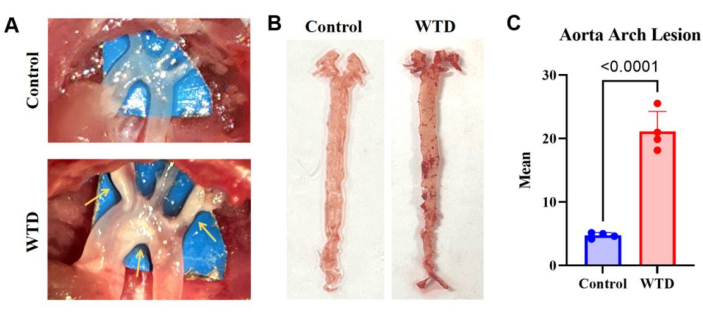
Figure 3 : L’arc aortique et sa coloration et son O rouge huile. (A) Images représentatives de plaques d’athérosclérose dans l’arc aortique. Les arcs aortiques des souris Ldlr-/- nourries avec un régime Chow ont été observés au microscope sans plaques visibles, tandis que les arcs aortiques des souris Ldlr-/- nourries avec un régime occidental ont été observés au microscope avec des plaques visibles. (B) Images représentatives de la coloration O rouge d’huile de l’aorte. L’aorte entière de souris Ldlr-/- nourries avec un régime Chow sans accumulation de lipides, et l’aorte entière de souris nourries avec un régime occidental pendant 4 mois présentaient des plaques visibles dans l’arc aortique (n = 4). (C) Nombre moyen de lésions de l’arc de l’aorte. Les résultats sont exprimés en moyenne ± MEB, et la signification a été évaluée par le test t de Student. p < 0,001, **** p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
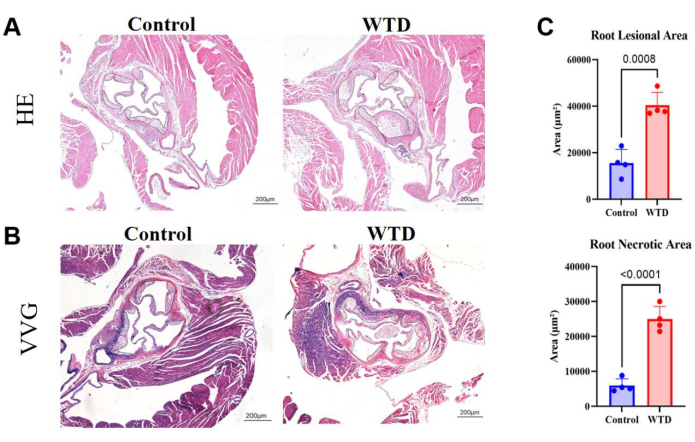
Figure 4 : Coupes de racines aortiques colorées à l’HE et au VVG, avec quantification de la surface de la plaque et de la zone nécrotique. (A) Coupes représentatives de la racine aortique colorées à l’hématoxyline et à l’éosine. Racines aortiques de souris Ldlr-/- soumises respectivement au régime Chow et au régime occidental. (B) Coupes représentatives de racines aortiques colorées par Verhoeff-Van Gieson. Les racines aortiques des souris Ldlr-/- soumises aux interventions du régime Chow et du régime occidental, respectivement, sont entourées de noir et sont des lésions athéroscléreuses chez les souris. (C) La quantification de la zone lésionnelle de la racine aortique et de la zone nécrotique (n = 4). Les résultats sont exprimés en moyenne ± MEB, et la signification a été évaluée par le test t de Student. p < 0,001, **** p < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Nous fournissons ici des informations détaillées sur les méthodes d’échantillonnage de l’aorte chez les souris knock-out Ldlr et l’analyse quantitative des plaques.
La précision de la procédure de dissection est le plus grand défi technique du stripping aortique in vivo dans le modèle murin de l’athérosclérose. D’après notre expérience, les points clés sont les suivants : (1) utiliser le PBS pour laver tout le sang dans l’artère afin d’augmenter la comparaison entre les branches de l’arc aortique et la graisse périvasculaire. (2) Soyez patient. En raison de la petite taille de l’aorte de la souris, la procédure doit être effectuée sous un microscope corporel et à l’aide d’une tondeuse et d’une pince microscopiques de haute qualité pour minimiser les erreurs dans l’opération. (3) Il est impératif de garantir que le décapage est initié avec précision et dans le bon sens afin d’éviter toute coupure ou dommage au navire.
En ce qui concerne la coloration aortique en rouge d’huile O chez la souris, la graisse périphérique de l’aorte isolée de la souris doit être éliminée au microscope avant la coloration formelle, et l’intégrité du tissu doit être maintenue pour éviter d’affecter les résultats de la coloration. Le processus de teinture rouge huile exige un contrôle précis du temps de teinture ; Des durées excessives et insuffisantes peuvent compromettre l’effet de teinture, ce qui entraîne des résultats inexacts.
Lors de l’encastrement des racines aortiques de souris, le temps de déshydratation du tissu doit être contrôlé pour éviter la fissuration des tissus lors de la section. Les sections de la racine aortique doivent être d’épaisseur uniforme pour assurer une coloration uniforme, et les sections trop minces ou trop épaisses peuvent interférer avec l’observation. Dans le même temps, il est nécessaire de déterminer avec précision où la valve tricuspide apparaît lorsqu’elle est observée au microscope. Le processus de coloration à l’hématoxyline à l’éosine nécessite un contrôle précis du temps de coloration et de la concentration de la solution de coloration afin d’éviter les colorations non spécifiques.
Par rapport aux excellentes méthodes existantes d’évaluation de l’athérosclérose, ce protocole a fourni des détails étape par étape pour disséquer à la fois l’arc aortique et la racine, ce qui peut aider à évaluer de manière exhaustive l’état de l’athérosclérose11,13 La coloration à l’hématoxyline-éosine et la coloration VVG peuvent aider à évaluer la zone lésionnelle de la racine aortique, ce qui augmente la précision de quantification de l’athérosclérose.
Cependant, il existe encore certaines limites de la coloration Aortique en rouge O. Par exemple, la coloration rouge à l’huile est principalement utilisée pour détecter les lipides, mais sa spécificité est faible pour d’autres types de composants cellulaires ou tissulaires11, ce qui peut conduire à des erreurs de classification. D’autre part, le processus de fixation et de dissection de l’échantillon peut entraîner une perte de lipides, affectant ainsi la fiabilité des résultats de coloration. Quant à la coloration à l’hématoxyline-éosine de la racine aortique, elle est limitée dans la différenciation des composants cellulaires et peut être difficile à identifier des zones spécifiques de la lésion dans les cas de structure tissulaire complexe. Lors de la réalisation d’analyses quantitatives, les résultats statistiques de la zone de la parcelle peuvent également être influencés par le jugement subjectif de l’observateur. De plus, la coloration à l’hématoxyline-éosine fournit principalement des informations morphologiques et ne donne pas d’aperçu de la fonction cellulaire ou de la caractérisation moléculaire.
Outre la coloration rouge à l’huile standard et la coloration à l’hématoxyline-éosine, d’autres techniques d’analyse des plaques d’athérosclérose comprennent la coloration Masson, la coloration immunohistochimique pour divers antigènes et d’autres méthodes qui peuvent être utilisées pour examiner la composition et les dimensions de la plaque. La coloration en O rouge d’huile des sections de la racine aortique est également largement utilisée pour analyser le dépôt de lipides dans la racine aortique14. La coloration au rouge d’alizarine S est une coloration couramment utilisée pour détecter les dépôts de calcium ; Il forme un complexe rouge avec des ions calcium, ce qui le rend idéal pour visualiser les dépôts de calcium15. De plus, le métabolisme des lipides peut être déduit des marqueurs biochimiques sériques tels que les niveaux de lipoprotéines de haute densité (HDL), de lipoprotéines de basse densité (LDL), de cholestérol total (TC) et de triacylglycérol total (TG). L’un des principaux facteurs contribuant au développement de l’athérosclérose est le métabolisme anormal des lipides, en particulier la relation entre l’athérosclérose et les maladies cardiovasculaires (ASCVD) et les taux de cholestérol des lipoprotéines de basse densité (LDL).
Au fur et à mesure que la recherche sur l’athérosclérose s’approfondit, le développement futur des méthodes d’analyse quantitative deviendra plus précis et plus diversifié. Tout d’abord, l’intégration de technologies d’imagerie avancées, telles que l’IRM à haute résolution, la tomographie par cohérence optique (OCT) et l’imagerie par ultrasons, rendra l’analyse quantitative de l’athérosclérose plus précise, permettant une surveillance dynamique des souris vivantes. Cela aidera à évaluer en temps réel la progression, la stabilité et la réponse de la plaque au traitement. Avec les progrès des technologies d’imagerie moléculaire, l’analyse quantitative permettra une analyse approfondie des réponses inflammatoires, de l’accumulation de lipides et des composants cellulaires dans les plaques, fournissant ainsi des données plus complètes pour le diagnostic précoce et le traitement de l’athérosclérose16.
Déclarations de divulgation
Rien à déclarer.
Remerciements
Ce travail a été soutenu par la base de recherche scientifique de Shanghai Frontiers sur l’exercice et la santé métabolique, le programme de recherche sur l’exercice et la santé publique (0831) de l’Université des sports de Shanghai, le programme de financement de la formation des jeunes enseignants de l’enseignement supérieur de Shanghai (A2-0213-22-0058-5) et le plan des leaders académiques exceptionnels du Comité municipal des sciences et de la technologie de Shanghai de Shanghai (21XD1403200) pour Longhua Liu.
matériels
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides(25×75mm) | CITOTEST | Cat# 80312-3161 | |
| Embedding cassette | CITOTEST | Cat# 80106-1100-16 | |
| Eosin Staining Solution | Beyotime | Cat# C0109 | |
| Ethanol | Sinopharm Chemical Reagent Co. | Cat# 10009218 | |
| Hematoxylin Staining Solution | Beyotime | Cat# C0107 | |
| Low-profile disposable blades | Leica | Cat# 14035838925 | |
| Microscope cover glass(24×50mm) | CITOTEST | Cat# 10212450C | |
| Neutral Balsam Mounting Medium | Sango Biotech | Cat# E675007-0100 | |
| Oil red o powder | Sigma-Aldrich | Cat# 1320-06-5 | |
| paraffin with ceresin | Sinopharm Chemical Reagent Co. | Cat# 69019461 | |
| Paraformaldehyde | Servicebio | Cat# G1101 | |
| Phosphate Buffered Saline (PBS, Powder) | Servicebio | Cat# G0002-2L | |
| Ponceau S Staining Solution | EveryLab | Cat# FM024 | |
| Victoria Blue’B | Aladdin | Cat# 2580-56-5 | |
| Xylene | Sigma-Aldrich | Cat# 104-81-4 |
Références
- Libby, P., et al. Atherosclerosis. Nat Rev Dis Primers. 5 (1), 56 (2019).
- Herrington, W., Lacey, B., Sherliker, P., Armitage, J., Lewington, S. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease. Circ Res. 118 (4), 535-546 (2016).
- Frostegård, J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 11, 117 (2013).
- Gisterå, A., Ketelhuth, D. F. J., Malin, S. G., Hansson, G. K. Animal models of atherosclerosis-supportive notes and tricks of the trade. Circ Res. 130 (12), 1869-1887 (2022).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 32 (5), 1104-1115 (2012).
- Ilyas, I., et al. Mouse models of atherosclerosis in translational research. Trends Pharmacol Sci. 43 (11), 920-939 (2022).
- Liu, L., Chan, M., Yu, L., Wang, W., Qiang, L. Adipsin deficiency does not impact atherosclerosis development in ldlr(-/-) mice. Am J Physiol Endocrinol Metab. 320 (1), E87-E92 (2021).
- Liu, L., et al. Pparγ deacetylation confers the antiatherogenic effect and improves endothelial function in diabetes treatment. Diabetes. 69 (8), 1793-1803 (2020).
- Zahr, T., et al. Pparγ (peroxisome proliferator-activated receptor γ) deacetylation suppresses aging-associated atherosclerosis and hypercholesterolemia. Arterioscler Thromb Vasc Biol. 43 (1), 30-44 (2023).
- Tang, C., et al. Endothelial ccrl2 induced by disturbed flow promotes atherosclerosis via chemerin-dependent β2 integrin activation in monocytes. Cardiovasc Res. 119 (9), 1811-1824 (2023).
- Andrés-Manzano, M. J., Andrés, V., Dorado, B. Oil red o and hematoxylin and eosin staining for quantification of atherosclerosis burden in mouse aorta and aortic root. Methods Mol Biol. 1339, 85-99 (2015).
- Mehlem, A., Hagberg, C. E., Muhl, L., Eriksson, U., Falkevall, A. Imaging of neutral lipids by oil red o for analyzing the metabolic status in health and disease. Nat Protoc. 8 (6), 1149-1154 (2013).
- Chen, P. Y., Qin, L., Simons, M. Imaging and analysis of oil red o-stained whole aorta lesions in an aneurysm hyperlipidemia mouse model. J Vis Exp. (183), e61277 (2022).
- Lin, Y., et al. Practical assessment of the quantification of atherosclerotic lesions in apoe-/- mice. Mol Med Rep. 12 (4), 5298-5306 (2015).
- Bozycki, L., Łukasiewicz, K., Matryba, P., Pikula, S. Whole-body clearing, staining and screening of calcium deposits in the mdx mouse model of duchenne muscular dystrophy. Skelet Muscle. 8 (1), 21 (2018).
- Glaudemans, A. W., et al. Molecular imaging in atherosclerosis. Eur J Nucl Med Mol Imaging. 37 (12), 2381-2397 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon