Method Article
عزل وتحليل قوس الأبهر وآفات الجذر في نموذج فأر تصلب الشرايين
* These authors contributed equally
In This Article
Summary
يوفر هذا البروتوكول منهجية شاملة للتحليل الكمي لويحات تصلب الشرايين لتسهيل المزيد من البحث المتعمق في آليات وتطور تصلب الشرايين.
Abstract
يتطلب تصلب الشرايين ، وهو سبب رئيسي لأمراض القلب والأوعية الدموية ، فحصا مفصلا لتطور الآفة وتطورها. تقدم هذه الدراسة بروتوكولا شاملا للعزل والتحليل النسيجي لقوس الأبهر وآفات الجذر في نموذج فأر تصلب الشرايين المستخدم على نطاق واسع ، والفئران منخفضة الكثافة لمستقبلات البروتين الدهني (Ldlr-/-). يعد قوس الأبهر والجذر من المواقع الرئيسية لآفات تصلب الشرايين ، وفحصها أمر بالغ الأهمية لتقييم ظهور أو تطور أو انحدار تصلب الشرايين ، والتنبؤ بمخاطر أحداث القلب والأوعية الدموية ، وتحديد الأهداف العلاجية المحتملة. يحدد هذا البروتوكول طرق تحديد عبء تصلب الشرايين في قوس الأبهر والجذر ، بما في ذلك عزل الأنسجة ، والتثبيت ، وتلوين الزيت الأحمر O ، وتقطيع جذر الأبهر ، وتلوين الهيماتوكسيلين والإيوسين (HE) ، وتلوين Verhoeff-Van Gieson (VVG) ، وتحليل الصور. يقيس تلطيخ الزيت الأحمر O منطقة البلاك في قوس الأبهر ، ويقيم شدة تصلب الشرايين ، بينما يكشف تلطيخ جذر الأبهر عن مكونات البلاك مثل لب الدهون والغطاء الليفي ، مما يسهل تقييم استقرار البلاك وخطر التمزق. يمكن أن يؤدي تلطيخ VVG إلى تلطيخ ألياف الكولاجين داخل الأنسجة ، مما يوفر مزيدا من الأفكار حول تكوين البلاك والمعلومات ذات الصلة. يقدم هذا التحليل الشامل رؤى قيمة حول آليات تطور الآفة وقد يوجه إنشاء استراتيجيات علاجية جديدة للوقاية من تصلب الشرايين وعلاجه.
Introduction
ظهرت أمراض القلب والأوعية الدموية ، وخاصة تصلب الشرايين ، كعبء صحي كبير وسبب رئيسي للوفاة في جميع أنحاء العالم1،2. تصلب الشرايين هو مرض التهابي تدريجي مزمن يتميز بالتراكم التدريجي للدهون وتشكيل لويحات في جدار الشرايين ، مما يؤدي في النهاية إلى تضييق تجويف الشرايين وربما تمزق اللويحات ، مما يؤدي إلى أحداث القلب والأوعية الدموية الحادة مثل احتشاء عضلة القلب والسكتة الدماغية1،2،3. نظرا لتأثيره العميق على صحة الإنسان ، هناك حاجة ملحة لفهم الآليات الكامنة وراء تصلب الشرايين وتطوير استراتيجيات علاجية فعالة.
في السنوات الأخيرة ، لعبت النماذج الحيوانية دورا مهما في تعزيز فهمنا لتصلب الشرايين. من بين الأنواع المختلفة ، برزت الفئران كنموذج مفضل بسبب تكاثرها السريع ، وتكاليف الصيانة المنخفضة ، وتوافر تقنيات التلاعب الجيني المتقدمة4،5. على وجه الخصوص ، تم استخدام الفئران بالضربة القاضية لمستقبلات LDL (Ldlr- /-) وفئران ApoE - / - على نطاق واسع لتقليد تصلب الشرايين البشري ، حيث تظهر خصائص فيزيولوجية مرضية مماثلة4،5،6،7،8،9.
يمكن أن تحدث آفات تصلب الشرايين في الفئران في مواقع مختلفة من الشريان الأورطي ، لكنها معرضة بشكل خاص للتطور في المناطق المرتبطة ارتباطا وثيقا بديناميكا الدم ، مثل جذر الأبهر ، والقوس الأبهري ، والجذع العضدي الرأسي ، في حين أن الشريان الأورطي الهابط أقل تأثرا نسبيا10. لتقييم عبء آفة تصلب الشرايين بدقة في نماذج الفئران ، وتقييم وجود اللويحات وحجمها ومرحلتها ، وبالتالي التحقيق في تأثير الأدوية أو العوامل المختلفة على بداية تصلب الشرايين وتطوره وانحداره ، من الضروري الجمع بين تقنيات التلوين النسيجي وتحليل التصوير11. تلطيخ الزيت الأحمر O ، وهي طريقة راسخة ، تلطخ على وجه التحديد الدهون المحايدة والبروتينات الدهنية12 ، مما يوفر تصورا مباشرا لتكوين البلاك في قوس الأبهر13. وفي الوقت نفسه ، فإن تلطيخ Hematoxylin-Eosin (HE) لجذر الأبهر لا يحدد منطقة البلاك فحسب ، بل يوفر أيضا ميزات هيكلية مفصلة ، مثل الغطاء الليفي واللب النخر الدهني. هذه التفاصيل ضرورية لتقييم استقرار البلاك والتنبؤ بخطر تمزق البلاك11. تسهل هذه التقنيات معا تقييما شاملا لشدة آفة تصلب الشرايين وتطورها.
أخذ هذا البروتوكول الفئران C57BL6 / J Ldlr - / - التي تغذت على نظام تشاو الغذائي والنظام الغذائي الغربي كأمثلة ، بهدف تقديم دليل مفصل خطوة بخطوة لتقييم عبء آفة تصلب الشرايين في الفئران باستخدام تلطيخ الزيت الأحمر O لقوس الأبهر وتلوين HE لأقسام جذر الأبهر المضمنة في البارافين ، متبوعا بتحليل الصور. يغطي البروتوكول جميع جوانب عزل الأبهر وتثبيته ، وتضمين البارافين وتقسيمها ، وإجراءات التلوين ، وتحليل الصور مع دمج التفاصيل التشغيلية والاعتبارات للخطوات الرئيسية ، مما يضمن قابلية تكرار النتائج وموثوقيتها. باتباع هذا البروتوكول ، يمكن للباحثين تقييم فعالية التدخلات العلاجية بدقة وكفاءة واكتساب رؤى حول الآليات الكامنة وراء تصلب الشرايين.
Protocol
تمت الموافقة على جميع البروتوكولات الحيوانية المستخدمة في هذه الدراسة من قبل لجنة مراجعة الأخلاقيات للتجارب على بجامعة شنغهاي للرياضة.
1. تحضير الكواشف وأدوات التشريح
- قم بتعقيم أدوات التشريح ، بما في ذلك المقص الدقيق ، والملقط المستقيم ، والملقط المنحني ، والمقص الزنبركي ، والدبابيس ، عن طريق الأوتوكلاف مسبقا.
- 75٪ إيثانول: امزج 75 مل من الإيثانول اللامائي مع 25 مل من ddH2O.
- 1x محلول ملحي مخزن بالفوسفات (PBS): قم بإذابة 0.01 M مسحوق PBS في 2 لتر من ddH2O.
- محلول بارافورمالدهيد (PFA) بنسبة 4٪: قم بتسخين 800 مل من 1x PBS إلى 60 درجة مئوية تقريبا على محرك مغناطيسي في غطاء الدخان. أضف ببطء 40 جم من مسحوق بارافورمالدهيد مع التحريك المستمر. قم بمعايرة 1N هيدروكسيد الصوديوم حتى تذوب تماما. قم بتبريدها إلى درجة حرارة الغرفة ، واضبط مستوى الصوت على 1 لتر باستخدام 1x PBS ، وقم بالفلتر ، واضبط الرقم الهيدروجيني على 7.2-7.4.
تنبيه: PFA مادة كيميائية خطرة تتطلب معالجة دقيقة والتزاما صارما ببروتوكولات السلامة. - محلول تخزين الزيت الأحمر O: قم بإذابة 2.5 جم من مسحوق الزيت الأحمر O في 500 مل من الأيزوبروبانول بنسبة 100٪ ، وأغلقه في زجاجة بنية اللون ، واحفظه في الثلاجة على حرارة 4 درجات مئوية للتخزين طويل الأجل.
تنبيه: الأيزوبروبانول مادة كيميائية سامة وضارة. لذلك ، لضمان الصحة والسلامة ، من الضروري ارتداء معدات الحماية الشخصية اللازمة (PPE) ، بما في ذلك القفازات. - محلول العمل من Oil Red O: امزج محلول التخزين والمعقم ddH2O بنسبة 3: 2. قم بالتحضير الطازج لكل استخدام وقم بتصفية المحلول باستخدام فلتر حقنة معقم 0.22 ميكرومتر أو ورق ترشيح كبير.
- محلول تلطيخ فيكتوريا بلو بي: قم بإذابة 0.5 جم من فيكتوريا بلو بي في 100 مل من 70٪ إيثانول.
2. عزل الشريان الأورطي والقلب
- ضع جميع الفئران في 3-5 لكل قفص ، مع دورة إضاءة / ظلام مدتها 12 ساعة ، في بيئة يتم التحكم في درجة حرارتها وإطعام إما نظاما غذائيا قياسيا (تشاو) أو نظاما غذائيا من النوع الغربي (WTD) يحتوي على 0.2٪ كوليسترول و 21.2٪ دهون. حدد C57BL6 / J LDLr - / - ذكور الفئران التي يبلغ عمرها 12 أسبوعا وتزن ما بين 25 و 30 جراما. التضحية بالفئران في غرفة ثاني أكسيد الكربون2 .
- قبل التشريح ، ضع الفئران في وضع ضعيف (الجانب البطني لأعلى) على لوح رغوي مغطى ب 1-2 طبقات من الورق الماص وقم بإصلاح الأطراف بدبابيس.
- رش 75٪ إيثانول على بطن الفئران لتنظيف وترطيب الفراء.
- استخدم الملقط للإمساك بالجلد البطني للفئران واستخدم مقصا دقيقا لقطع الجلد من قاعدة البطن إلى أعلى الرقبة.
- افتح جدار البطن ، ثم استخدم الملقط لرفع عظم القص وقطع كل من الحجاب الحاجز والأضلاع لكشف التجويف الصدري.
- قم بإزالة المريء والقصبة الهوائية ، مما سيمكن من تنظيف الشرايين السباتية بشكل أسهل. قم بإزالة الأعضاء ، بما في ذلك الكبد والرئة والطحال والجهاز الهضمي والبنكرياس ، مع الحفاظ على الكلى الموجودة خلف الصفاق والشريان الأورطي البطني بجانب العمود الفقري. عند تشريح الشرايين المساريقية ، تأكد من رفع الأمعاء وعمل شقوق بعيدا عن الشريان الأورطي لتجنب إتلاف الشريان الأورطي البطني.
- لتوفير مجال مراقبة واضح ، ضع الفئران تحت مجهر مجسم وقم بمحاذاة مصدر الضوء البارد مع منطقة التشريح.
- قم بحقن حقنة سعة 10 مل ببطء مملوءة ب PBS بإبرة RWLB 0.45 × 15 (II) في قمة البطين الأيسر ولاحظ تمدد الشريان الأورطي.
- امسح الدم والسوائل في منطقة التشريح برفق باستخدام المناديل الورقية لكشف مجال الرؤية بالكامل.
- الشريان الأورطي الصدري سهل التعريض. استخدمه كاختراق باستخدام الملقط لإمساك الجزء الحجابي المتصل بنهاية الشريان الأورطي الصدري والمقص الزنبركي لقطع النسيج الضام بين الشريان الأورطي وجدار العضلات الصدرية
- اسحب القلب برفق باستخدام ملقط وارفع الشريان الأورطي الصدري ، مع مراقبة فروع قوس الأبهر ، وتشريح الدهون العرضية والأنسجة الضامة حول قوس الأبهر وفروعه لأعلى على طول الشريان الأورطي الصدري.
ملاحظة: كن حذرا ، وحافظ على الشريان الأورطي سليما ، وتجنب تمزقه أو إصابته ، وقم بإزالة الدهون المحيطة والأنسجة الضامة تماما. تتطلب هذه الخطوة ممارسة متكررة لتحقيق التلاعب بكفاءة. - تشريح الشريان الأورطي البطني والشرايين الحرقفية المشتركة لأسفل على طول الشريان الأورطي الصدري.
- قم بقص الشرايين الحرقفية المشتركة بمقدار 1-2 مم تحت تشعبها ، وقم بقص الفروع الصغيرة للشريان الأورطي على طول العمود الفقري لتحريره ، وافصل الشرايين الكلوية بالقرب من الكلى ، وقطع الأوعية الفرعية الثلاثة في الرقبة من نهاياتها البعيدة ، وأخيرا قطع الشريان الأورطي الصاعد بالقرب من القلب.
- قبل تشريح قوس الأبهر ، ضع حشية صغيرة داكنة اللون مع تباين عال مع الأوعية الدموية تحتها وقم بتصوير منطقة قوس الأبهر.
- تقليم أنسجة القلب وقطع النصف السفلي من القلب على طول مستوى مواز للأذينين. إصلاح القلب المشذب (الشكل 1 أ).
3. تثبيت ومعالجة قوس الأبهر
- قم بإعداد 1 مل من محلول PFA 4٪ في أنبوب طرد مركزي سعة 1.5 مل مسبقا.
- ضع الشريان الأورطي في الأنبوب وثبته لمدة 24 ساعة على الأقل في درجة حرارة الغرفة.
ملاحظة: يمكن الحفاظ على الشريان الأورطي في 4٪ PFA لمدة تصل إلى شهر واحد دون التأثير على جودة تلطيخ الزيت الأحمر O. للحفاظ على تكوينه الطبيعي ، يمكن أن يكون وضع الأنسجة على المطاط قبل التثبيت خيارا مناسبا. - انقل الشريان الأورطي إلى طبق بتري يحتوي على PBS لمنعه من الجفاف. تحت المجهر المجسم ، استخدم الملقط والمقص الزنبركي لإزالة أي دهون عرضية متبقية لم يتم تجريدها تماما أثناء التشريح بعناية من أجل تقليل التداخل مع القياس الكمي للويحات داخل الشريان الأورطي.
- استخدم مقص زنبركي لفتح الشريان الأورطي بعناية على طول محوره الطولي الداخلي ثم قم بقطع الفروع الثلاثة للقوس الأبهري بالتتابع على طول الجانب الجانبي إلى مستوى انحناء القوس الأبهري ، مما يسمح له بالانتشار بالكامل (الشكل 1 ج).
- في هذه المرحلة إما أن تستخدم لتلوين الزيت الأحمر O أو تخزينها في 4٪ PFA.
4. الزيت الأحمر O تلطيخ قوس الأبهر
- ضع الشريان الأورطي المفتوح في طبق مكون من 12 بئرا. أضف 1 مل من ddH2O المعقم إلى كل بئر ، واغسله لمدة 5 دقائق على شاكر ، كرر 2x.
- ضع اللوحة المكونة من 12 بئرا مع المحلول الذي تمت إزالته في غطاء الدخان وجففها في الهواء لمدة 20 دقيقة حتى تختفي العلامات المائية المرئية.
- أضف 1 مل من محلول عمل Oil Red O الطازج إلى كل بئر ورجه لمدة 20 دقيقة على الخلاط ، ثم قم بإزالة محلول العمل Oil Red O.
- أضف 2 مل من ddH2O المعقم إلى كل بئر واغسلها لمدة 5 دقائق ، كرر هذه الخطوة 3x. بعد ذلك ، احتفظ بالشريان الأورطي في ddH2O.
- ضع الشريان الأورطي على شريحة وانشره تحت مجهر مجسم. لتحسين التباين ، ضع وسادة مطاطية سوداء أسفل الشريحة.
- ضع الشريحة على ورقة بيضاء لتحسين التباين بشكل أكبر ، مع وضع مسطرة بجانبها ، والتقط صورة باستخدام الكاميرا. للحفاظ على رطوبة الشريان الأورطي ، قم بتخزين الشريان الأورطي المعالج في أنبوب طرد مركزي سعة 1.5 مل يحتوي على 1 مل من PBS.
5. تحليل صورة قوس الأبهر
- افتح صورة الأبهر الملتقطة على جهاز كمبيوتر مزود ببرنامج Image J.
- حدد المنطقة التي تحتوي على مربع مستطيل، مثل 450 بكسل × 900 بكسل، والتي تحتوي على الشريان الأورطي بالكامل، واحفظها كصورة .tiff جديدة.
- افتح الصورة .tiff المحفوظة حديثا في الصورة J. انقر على تحرير > عكس، ثم حدد صورة وانقر على Type > RGB Stack.
- انتقل إلى صورة، وانقر فوق Stacks > Stack to Images، ثم اختر اللون الأخضر بأفضل تباين.
- انتقل إلى صورة، وانقر فوق ضبط > السطوع/التباين. قم بتغيير الحد الأدنى للقيمة إلى حوالي 200، وقم بتصغير الخلفية مع الحفاظ على خلفيات متشابهة لكل صورة، ثم انقر فوق تطبيق.
- انتقل إلى تحليل وحدد تعيين القياس. حدد المنطقة وكسر المنطقة والحد إلى الحد وعرض التسمية، ثم انقر فوق موافق.
- انتقل إلى تحليل، وحدد القياس وانسخ النتيجة إلى جدول بيانات.
- انتقل إلى تحليل، وانقر على أداة > مدير عائد الاستثمار، ثم اختر جزء القوس من الشريان الأورطي بمربع مستطيل. انتقل إلى مدير عائد الاستثمار وحدد إضافة [t] ثم قياس. انسخ النتائج المقاسة في جدول بيانات.
- تحليل المنطقة المقاسة في مجموعات الفئران بناء على اختبار الحالة الطبيعية. تشير قيمة p < 0.05 إلى أن الفرق ذو دلالة إحصائية.
ملاحظة: حدد الطريقة الإحصائية المناسبة وفقا لتصميم التجربة.
6. تضمين البارافين للقلب
- قم بإزالة قمة القلب وتأكد من أن الشق مستقيم ومحاذاة مع اتجاه جذر الصمام (الشكل 1 ب).
- ضع كل عينة قلب على حدة في صندوق تضمين البارافين وقم بتمييز الصندوق بقلم رصاص.
- في غطاء الدخان ، ضع الكاسيت المدمج في البارافين مع منديل ورقي في وعاء فارغ واشطف صندوق التضمين بالماء الجاري لمدة 3 دقائق.
- قم بإجراء تجفيف الأنسجة باستخدام الإيثانول مع زيادة تدرجات التركيز على النحو التالي: 50٪ إيثانول لمدة ساعتين ، 75٪ إيثانول لمدة 30 دقيقة ، 85٪ إيثانول لمدة 30 دقيقة ، 95٪ إيثانول لمدة 30 دقيقة ، و 100٪ إيثانول لمدة 10 دقائق. كرر الخطوات عن طريق تغيير الإيثانول في كل خطوة.
- قم بإجراء شفافية الأنسجة باستخدام الزيلين على النحو التالي: خليط 1: 1 من الزيلين والإيثانول لمدة 20 دقيقة ، الزيلين لمدة 15 دقيقة ، كرر هذا 1x عن طريق تغيير الزيلين.
- قم بإذابة شمع البارافين في الفرن على حرارة 60 درجة مئوية مقدما. عالج العينات بمزيج من الزيلين والبارافين لمدة 30 دقيقة ، متبوعا بشمع البارافين الناعم لمدة ساعتين ثم شمع البارافين الصلب لمدة 1 ساعة.
تنبيه: الإيثانول مذيب عضوي قابل للاشتعال ومتطاير. الزيلين سام بشكل معتدل ويتطلب الحماية عند استخدامه. - تضمين البارافين
- حدد القالب بالحجم المناسب ، وقم بتشغيله ، وقم بتسخين آلة التضمين مسبقا.
- بعد إضافة شمع البارافين المنصهر إلى القالب ، قم باستخراج الأنسجة من كاسيت التضمين وضعها ، بحيث يكون سطحها المقطوع متجها لأسفل ، في الجزء السفلي المركزي من القالب باستخدام ملقط تم تسخينه مسبقا.
- بعد أن يبرد القالب على طاولة الفريزر ويتصلب البارافين بداخله ، ضع غطاء كاسيت التضمين المشار إليه أعلى القالب واملأه بالكمية اللازمة من البارافين.
- بمجرد أن يبرد شمع البارافين ويتماسك ، قم بإزالة الكتلة من القالب واحتفظ بها في الثلاجة عند 4 درجات مئوية (الشكل 1 د).
7. أقسام البارافين من جذر الأبهر
- نظف أي بارافين زائد يحيط بغطاء كاسيت التضمين ، ثم قم بتثبيت كتلة البارافين بإحكام على مقعد المشبك الموجود على رأس قطاعة البارافين. اضبط الكتلة على وضع إزاحة قليلا من حيث سيتم قطع الشريحة ، مع التأكد من أن قسم الأنسجة داخل كتلة البارافين مواز لحافة قطع الشفرة. بالنسبة للقسم الأول ، اضبط سمك الشريحة على 10 ميكرومتر للكشف عن موقع الأنسجة.
- عندما يتم العثور على الشق الأول تحت المجهر ، اضبط سمك الشريحة على 6 ميكرومتر وقم بإجراء التقسيم التسلسلي. قم بقص الأقسام وتقطيعها واختيارها في القطاعة حتى تظهر ثلاثة صمامات أورطي سليمة تحت المجهر ، وعند هذه النقطة يبدأ التحضير للتقسيم. اترك شريحة واحدة على فترات 6 ميكرومتر لكل فأرة ، وضع مواضع شرائح مختلفة على حاملات زجاجية مختلفة ، على سبيل المثال ، القسم 1-11-21-31 ، للحصول على نظرة عامة مناسبة.
- قم بتعويم الأقسام على مفرشة تحتوي على 37 درجة مئوية من الماء الدافئ لنشر الأنسجة بشكل مسطح ثم التقط المنديل بشريحة. بعد انتظار جفاف الماء ، ضع الشرائح على محمصة على 42 درجة مئوية طوال الليل.
- يمثل متوسط مساحة البلاك لهذه الأقسام الثمانية قيمة منطقة لويحات جذر الأبهر في كل فأر. بعد تلطيخ هذه الأقسام ، قم بقياس متوسط مساحة البلاك ومنطقة البلاك.
8. تلطيخ الهيماتوكسيلين إيوسين
- ضع الشرائح في مجفف على حرارة 60 درجة مئوية لمدة 30 دقيقة. في غطاء الدخان ، باستخدام رف تلطيخ ، ضع الأقسام بالتتابع في الزيلين لمدة 10 دقائق (كرر هذه الخطوة مرة واحدة ، وتغيير الزيلين) ، و 100٪ إيثانول لمدة 5 دقائق (كرر هذه الخطوة ، وتغيير الإيثانول) ، و 95٪ إيثانول لمدة 5 دقائق ، و 85٪ إيثانول لمدة 5 دقائق و 75٪ إيثانول لمدة 5 دقائق.
- اشطفها بالماء الجاري لمدة 5 دقائق. اغمر الأقسام في بقعة الهيماتوكسيلين لمدة 8 دقائق ثم اشطفها تحت الماء الجاري.
- ميز الأقسام بكحول حمض الهيدروكلوريك بنسبة 1٪ لبضع ثوان واشطفها بالماء الجاري ولاحظ أن الأقسام تتحول إلى اللون الأزرق الأرجواني تحت المجهر.
- اغمر الأقسام في محلول تلطيخ اليوزين لمدة 5 دقائق. ضع الأقسام في 95٪ إيثانول لمدة 7 غمس ثم في 100٪ إيثانول لمدة 30 ثانية.
- صافية في الزيلين لمدة 30 ثانية على الأقل. أغلق الشرائح باستخدام علكة محايدة ، وصور تحت المجهر ، واحفظ الصور عالية الدقة ، ويفضل أن يكون ذلك بتنسيق .tiff.
9. تلطيخ Verhoeff-Van Gieson (VVG)
- قم بإجراء إزالة الشمع وإعادة الترطيب الروتيني على أقسام البارافين ، باتباع نفس الخطوات الموضحة في القسمين 8.1 و 8.2.
- بعد الشطف لفترة وجيزة في 70٪ من الإيثانول ، اغمر الأقسام في محلول تلطيخ فيكتوريا بلو بي لمدة 15 دقيقة.
- ميز الأقسام لبضع ثوان في 95٪ من الإيثانول. اغسل الأقسام 2x بالماء المقطر.
- تلطيخ الأقسام بمحلول تلطيخ Ponceau لمدة 5 دقائق عن طريق تطبيق القطرات. قم بتمييز وتجفيف الأقسام باستخدام الإيثانول بنسبة 100٪.
ملاحظة: بعد تلطيخ بونسو ، تجنب أي ملامسة للماء. - صافية في الزيلين لمدة 30 ثانية على الأقل. قم بتركيب الشرائح باللثة المحايدة وقم بتصويرها تحت المجهر.
10. تحليل صورة لويحات جذر الأبهر
- افتح الصورة على جهاز كمبيوتر مزود ببرنامج Image J. حدد أي أداة مربعة لصندوق اللوحة.
- انتقل إلى صورة، وانقر على تراكب > إضافة تحديد، ثم قياس لقياس مساحة اللوحة. انسخ النتائج المقاسة في جدول بيانات.
- تحليل المنطقة المقاسة في مجموعات الفئران بناء على اختبار الحالة الطبيعية. تشير قيمة p < 0.05 إلى أن الفرق ذو دلالة إحصائية.
النتائج
توضح النتائج التمثيلية تطبيق تقنية العزل والتحليل لقوس الأبهر وآفات الجذر في نموذج فأر تصلب الشرايين. تقدم هذه النتائج دليلا واضحا على قدرة هذه التقنية على تحديد وتوصيف آفات تصلب الشرايين. على سبيل المثال ، تسلط الصور النسيجية ذات البقع المحددة (على سبيل المثال ، Oil Red O) الضوء على تراكم الدهون ، بينما يكشف تلطيخ الهيماتوكسيلين واليوزين (H & E) عن التشكل العام لآفات تصلب الشرايين ، بما في ذلك بنية جدار الشرايين ، ووجود النوى الدهنية ، ومناطق النخر. من خلال تحليل الأقسام الملطخة ب H & E ، يمكننا تقييم مدى تطور الآفة والتغيرات الهيكلية في الشريان الأورطي ، وتقديم نظرة عامة على تطور البلاك وإعادة تشكيل الأنسجة.
في هذا البروتوكول ، قمنا بتحليل مدى آفات تصلب الشرايين في الفئران القاضية C57 Ldlr البالغة من العمر 12 أسبوعا والتي تغذت على نظام غذائي على الطراز الغربي (WTD) لمدة 4 أشهر وتغذت الفئران Ldlr / - على نظام غذائي تشاو كضوابط.
بعد 12 أسبوعا من نظام تشاو الغذائي والتغذية الغربية ، كان لدى الفئران بالضربة القاضية LDLR في مجموعة النظام الغذائي الغربي أوزان الجسم مرتفعة بشكل ملحوظ مقارنة بالمجموعة الضابطة. بالإضافة إلى ذلك ، تم أيضا تغيير مستويات الدهون في مجموعة النظام الغذائي الغربي ، مع ارتفاع مستويات الدهون الثلاثية في البلازما (TG) والكوليسترول الكلي (TC) ، حيث تم اكتشاف TG و TC عن طريق فحص الممتز المناعي المرتبط بالإنزيم المأخوذ من دم الذيل للفئران (الشكل 2).
تشير نتائج تلطيخ زيت الأبهر الأحمر O في الفئران بالضربة القاضية Ldlr التي تتغذى على النظام الغذائي الغربي ، والتي أظهرت تراكما شديدا للدهون وآفات تصلب الشرايين مقارنة بالفئران التي تتغذى على نظام تشاو الغذائي ، إلى أن المزيد من الرواسب الدهنية على الشرايين تتوافق مع آفات تصلب الشرايين الأكثر حدة (الشكل 3).
في أقسام جذر الأبهر ، تشير مساحة أكبر من البلاك والنوى النخرية إلى آفة تصلب الشرايين الأكثر حدة. هنا ، تبين أن منطقة آفة جذر الأبهر واللب النخر أكبر بكثير في الفئران التي تتغذى على النظام الغذائي الغربي مقارنة بالفئران التي تتغذى على نظام تشاو الغذائي (الشكل 4 أ). تم إجراء تلطيخ VVG لأقسام البارافين من جذر الأبهر لتقييم المنطقة المريضة من جذر الأبهر. كانت الألياف المرنة أرجوانية مزرقة ، وعادة ما تتكاثر ألياف الكولاجين لتشكيل غطاء ليفي وتظهر باللون الأحمر. يساعد تلطيخ VVG على مساعدتنا في معرفة ما إذا كان هناك تدمير أو تقليل للألياف المرنة ، وسماكة جدار الوعاء الدموي ، وترسب ألياف الكولاجين غير الطبيعية ، والتي قد تكون علامة على الالتهاب أو إعادة التشكيل المرضي. هنا ، أظهر اتجاهات زيادة ألياف الكولاجين في الغطاء الليفي في جذر الأبهر للفئران التي تتغذى على النظام الغذائي الغربي مقارنة بتلك الموجودة في الفئران التي تتغذى على نظام تشاو الغذائي (الشكل 4 ب). أظهر القياس الكمي لمنطقة آفة جذر الأبهر والمنطقة النخرية أن النظام الغذائي الغربي يؤدي إلى تفاقم حالة تصلب الشرايين في الفئران بالضربة القاضية Ldlr (الشكل 4 ج).

الشكل 1: خطوات عزل وتحليل قوس الأبهر وآفات الجذر. (أ) عزل الشريان الأورطي والقلب. (ب) تحضير جذر الأبهر. تم تقطيع أنسجة القلب بين الخطين المنقطين. (ج) تثبيت ومعالجة القوس الأبهري المسبق. (د) تضمين البارافين في القلب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التغيرات في وزن الجسم ومستويات الدهون في الدم للفئران في مجموعة التحكم ويوم النزيف العالمي للتنمية التي تم تغذيتها لمدة 12 أسبوعا. (أ) منحنى وزن الجسم عند تغذية CD و WTD. (ب) الدهون الثلاثية في البلازما (TG). (ج) الكوليسترول الكلي (TC) (ن = 4). يتم التعبير عن النتائج بمتوسط ± SEM ، وتم تقييم الدلالة بواسطة اختبار الطالب t. ص < 0.001 ، **** ص < 0.0001. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
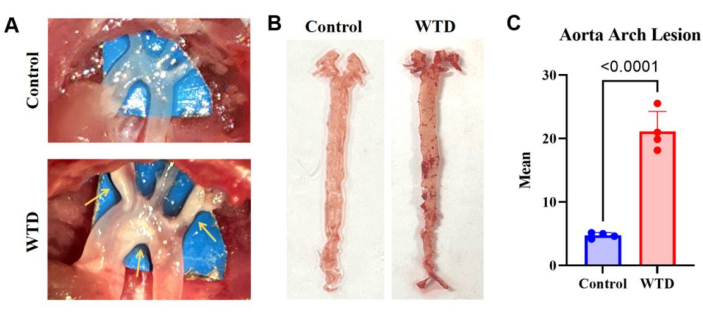
الشكل 3: قوس الأبهر وتلوينها وتحليله باللون الأحمر الزيتي. (أ) صور تمثيلية لويحات تصلب الشرايين في قوس الأبهر. لوحظت أقواس الأبهر للفئران Ldlr - / - التي تغذت على نظام تشاو الغذائي مجهريا بدون لويحات مرئية ، في حين لوحظت أقواس الأبهر للفئران Ldlr - / - التي تتغذى على نظام غذائي غربي مجهريا مع لويحات مرئية. (ب) صور تمثيلية لزيت الأبهر الأحمر O تلطيخ. الشريان الأورطي الكامل من Ldlr - / - تغذت الفئران على نظام غذائي تشاو دون تراكم الدهون ، والشريان الأورطي الكامل من الفئران Ldlr - / - التي تغذت على نظام غذائي غربي لمدة 4 أشهر كانت لويحات مرئية في قوس الأبهر. (ن = 4). (ج) متوسط عدد آفات قوس الشريان الأورطي. يتم التعبير عن النتائج كمتوسط ± SEM ، وتم تقييم الأهمية بواسطة اختبار الطالب t. ص < 0.001 ، **** ص < 0.0001. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
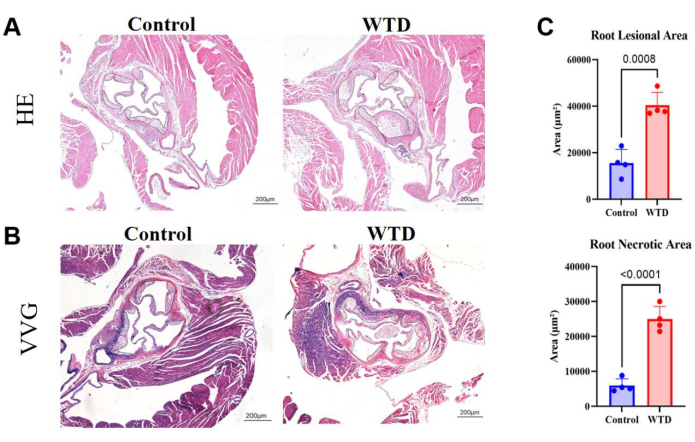
الشكل 4: أقسام جذر الأبهر ملطخة ب HE و VVG ، مع تحديد منطقة البلاك والمنطقة النخرية. (أ) أقسام جذر الأبهر الممثلة للهيماتوكسيلين واليوزين. جذور الأبهر لفئران Ldlr-/- التي تعرضت لنظام تشاو الغذائي وتدخلات النظام الغذائي الغربي ، على التوالي. (ب) أقسام جذر الأبهر الملطخة بالممثل فيرهوف فان جيسون. جذور الأبهر للفئران Ldlr-/- التي تخضع لنظام تشاو الغذائي وتدخلات النظام الغذائي الغربي ، على التوالي ، محاطة بدائرة سوداء وهي آفات تصلب الشرايين في الفئران. (ج) القياس الكمي لمنطقة آفة جذر الأبهر والمنطقة النخرية (ن = 4). يتم التعبير عن النتائج كمتوسط ± SEM ، وتم تقييم الأهمية بواسطة اختبار الطالب t. ص < 0.001 ، **** ص < 0.0001. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا ، نقدم معلومات مفصلة عن طرق أخذ عينات الأبهر في الفئران بالضربة القاضية LDLR والتحليل الكمي للويحات.
تعد دقة إجراء التشريح أكبر تحد تقني لتجريد الأبهر في الجسم الحي في نموذج الفأر لتصلب الشرايين. بناء على تجربتنا ، فإن النقاط الرئيسية هي كما يلي: (1) استخدم PBS لغسل كل الدم في الشريان لزيادة المقارنة بين فروع قوس الأبهر والدهون حول الأوعية الدموية. (2) كن صبورا. نظرا لصغر حجم الشريان الأورطي للفأر ، يجب تنفيذ الإجراء تحت مجهر الجسم وباستخدام مقصات ملقط وملقط مجهرية عالية الجودة لتقليل الأخطاء في العملية. (3) لا بد من ضمان بدء التجريد بدقة وفي الاتجاه الصحيح لمنع أي جروح أو تلف للسفينة.
فيما يتعلق بزيت الأبهر الأحمر O تلطيخ في الفئران ، يجب إزالة الدهون الطرفية لشريان أورطي الفأر المعزول مجهريا قبل التلوين الرسمي ، ويجب الحفاظ على سلامة الأنسجة لتجنب التأثير على نتائج التلوين. تتطلب عملية الصباغة الزيتية الحمراء تحكما دقيقا في وقت الصباغة. يمكن أن تؤدي الفترات المفرطة وغير الكافية إلى الإضرار بتأثير الصباغة ، مما يؤدي إلى نتائج غير دقيقة.
في تضمين جذور الأبهر الفأر ، يجب التحكم في وقت جفاف الأنسجة لتجنب تشقق الأنسجة أثناء التقسيم. يجب أن تكون أقسام جذر الأبهر ذات سمك موحد لضمان تلطيخ موحد ، ويمكن أن تتداخل الأقسام الرقيقة جدا أو السميكة جدا مع المراقبة. في الوقت نفسه ، من الضروري تحديد مكان ظهور الصمام ثلاثي الشرف بدقة عند عرضه تحت المجهر. تتطلب عملية تلطيخ الهيماتوكسيلين يوزين تحكما دقيقا في وقت التلوين وتركيز محلول التلوين لتجنب التلوين غير المحدد.
بالمقارنة مع الطرق الممتازة الحالية لتقييم تصلب الشرايين ، قدم هذا البروتوكول تفاصيل خطوة بخطوة لتشريح كل من قوس الأبهر والجذر ، والتي يمكن أن تساعد في تقييم حالة تصلب الشرايين بشكل شامل11،13يمكن أن يساعد كل من تلطيخ الهيماتوكسيلين يوزين وتلوين VVG في تقييم منطقة آفة جذر الأبهر ، مما يزيد من دقة القياس الكمي لتصلب الشرايين.
ومع ذلك ، لا تزال هناك بعض القيود على تلطيخ زيت الأبهر الأحمر O. على سبيل المثال ، يستخدم تلطيخ الزيت الأحمر بشكل أساسي للكشف عن الدهون ولكن له خصوصية ضعيفة لأنواع أخرى من مكونات الخلايا أوالأنسجة 11 ، مما قد يؤدي إلى تصنيف خاطئ. من ناحية أخرى ، قد تؤدي عملية تثبيت العينة وتشريحها إلى فقدان الدهون ، مما يؤثر على موثوقية نتائج التلوين. أما بالنسبة لتلوين الهيماتوكسيلين - اليوزين لجذر الأبهر ، فهو محدود في التمييز بين المكونات الخلوية وقد يكون من الصعب تحديد مناطق معينة من الآفة في حالات بنية الأنسجة المعقدة. عند إجراء التحليلات الكمية ، قد تتأثر النتائج الإحصائية لمنطقة التصحيح أيضا بالحكم الذاتي للمراقب. بالإضافة إلى ذلك ، يوفر تلطيخ الهيماتوكسيلين - اليوزين معلومات مورفولوجية في المقام الأول ولا يوفر نظرة ثاقبة للوظيفة الخلوية أو التوصيف الجزيئي.
بصرف النظر عن تلطيخ الزيت الأحمر القياسي وتلوين الهيماتوكسيلين يوزين ، تشمل التقنيات الأخرى لتحليل لويحات تصلب الشرايين تلطيخ ماسون ، والتلوين الكيميائي المناعي لمستضدات مختلفة ، وطرق أخرى يمكن استخدامها لفحص تكوين البلاك وأبعاده. يستخدم تلطيخ الزيت الأحمر O لأقسام جذر الأبهر أيضا على نطاق واسع لتحليل ترسب الدهون في جذر الأبهر14. تلطيخ Alizarin Red S هو وصمة عار شائعة الاستخدام للكشف عن رواسب الكالسيوم. يشكل مركبا أحمر مع أيونات الكالسيوم ، مما يجعله مثاليا لتصور رواسب الكالسيوم15. علاوة على ذلك ، يمكن استنتاج استقلاب الدهون من المؤشرات الكيميائية الحيوية في الدم مثل مستويات البروتين الدهني عالي الكثافة (HDL) والبروتين الدهني منخفض الكثافة (LDL) والكوليسترول الكلي (TC) وثلاثي الجلسرين الكلي (TG). أحد العوامل الرئيسية المساهمة في تطوير تصلب الشرايين هو التمثيل الغذائي غير الطبيعي للدهون, لا سيما العلاقة بين تصلب الشرايين وأمراض القلب والأوعية الدموية (ASCVD) ومستويات الكولسترول في البروتين الدهني منخفض الكثافة (LDL).
مع تعمق البحث عن تصلب الشرايين ، سيصبح التطوير المستقبلي لطرق التحليل الكمي أكثر دقة وتنوعا. أولا ، سيؤدي دمج تقنيات التصوير المتقدمة ، مثل التصوير بالرنين المغناطيسي عالي الدقة ، والتصوير المقطعي للتماسك البصري (OCT) ، والتصوير بالموجات فوق الصوتية ، إلى جعل التحليل الكمي لتصلب الشرايين أكثر دقة ، مما يتيح المراقبة الديناميكية للفئران الحية. سيساعد هذا في التقييم في الوقت الفعلي لتطور البلاك واستقراره والاستجابة للعلاج. مع تقدم تقنيات التصوير الجزيئي ، سيسمح التحليل الكمي بتحليل متعمق للاستجابات الالتهابية وتراكم الدهون والمكونات الخلوية داخل اللويحات ، مما يوفر بيانات أكثر شمولا للتشخيص المبكر والعلاج لتصلب الشرايين16.
Disclosures
لا شيء للإعلان.
Acknowledgements
تم دعم هذا العمل من قبل قاعدة أبحاث علوم شنغهاي فرونترز للتمرين والصحة الأيضية ، والبرنامج البحثي للتمرين والصحة العامة (0831) في جامعة شنغهاي للرياضة ، وبرنامج تمويل تدريب المعلمين الشباب للتعليم العالي في شنغهاي (A2-0213-22-0058-5) ، ولجنة شنغهاي للعلوم والتكنولوجيا في شنغهاي خطة القادة الأكاديميين المتميزين (21XD1403200) ل Longhua Liu.
Materials
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides(25×75mm) | CITOTEST | Cat# 80312-3161 | |
| Embedding cassette | CITOTEST | Cat# 80106-1100-16 | |
| Eosin Staining Solution | Beyotime | Cat# C0109 | |
| Ethanol | Sinopharm Chemical Reagent Co. | Cat# 10009218 | |
| Hematoxylin Staining Solution | Beyotime | Cat# C0107 | |
| Low-profile disposable blades | Leica | Cat# 14035838925 | |
| Microscope cover glass(24×50mm) | CITOTEST | Cat# 10212450C | |
| Neutral Balsam Mounting Medium | Sango Biotech | Cat# E675007-0100 | |
| Oil red o powder | Sigma-Aldrich | Cat# 1320-06-5 | |
| paraffin with ceresin | Sinopharm Chemical Reagent Co. | Cat# 69019461 | |
| Paraformaldehyde | Servicebio | Cat# G1101 | |
| Phosphate Buffered Saline (PBS, Powder) | Servicebio | Cat# G0002-2L | |
| Ponceau S Staining Solution | EveryLab | Cat# FM024 | |
| Victoria Blue’B | Aladdin | Cat# 2580-56-5 | |
| Xylene | Sigma-Aldrich | Cat# 104-81-4 |
References
- Libby, P., et al. Atherosclerosis. Nat Rev Dis Primers. 5 (1), 56 (2019).
- Herrington, W., Lacey, B., Sherliker, P., Armitage, J., Lewington, S. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease. Circ Res. 118 (4), 535-546 (2016).
- Frostegård, J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 11, 117 (2013).
- Gisterå, A., Ketelhuth, D. F. J., Malin, S. G., Hansson, G. K. Animal models of atherosclerosis-supportive notes and tricks of the trade. Circ Res. 130 (12), 1869-1887 (2022).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 32 (5), 1104-1115 (2012).
- Ilyas, I., et al. Mouse models of atherosclerosis in translational research. Trends Pharmacol Sci. 43 (11), 920-939 (2022).
- Liu, L., Chan, M., Yu, L., Wang, W., Qiang, L. Adipsin deficiency does not impact atherosclerosis development in ldlr(-/-) mice. Am J Physiol Endocrinol Metab. 320 (1), E87-E92 (2021).
- Liu, L., et al. Pparγ deacetylation confers the antiatherogenic effect and improves endothelial function in diabetes treatment. Diabetes. 69 (8), 1793-1803 (2020).
- Zahr, T., et al. Pparγ (peroxisome proliferator-activated receptor γ) deacetylation suppresses aging-associated atherosclerosis and hypercholesterolemia. Arterioscler Thromb Vasc Biol. 43 (1), 30-44 (2023).
- Tang, C., et al. Endothelial ccrl2 induced by disturbed flow promotes atherosclerosis via chemerin-dependent β2 integrin activation in monocytes. Cardiovasc Res. 119 (9), 1811-1824 (2023).
- Andrés-Manzano, M. J., Andrés, V., Dorado, B. Oil red o and hematoxylin and eosin staining for quantification of atherosclerosis burden in mouse aorta and aortic root. Methods Mol Biol. 1339, 85-99 (2015).
- Mehlem, A., Hagberg, C. E., Muhl, L., Eriksson, U., Falkevall, A. Imaging of neutral lipids by oil red o for analyzing the metabolic status in health and disease. Nat Protoc. 8 (6), 1149-1154 (2013).
- Chen, P. Y., Qin, L., Simons, M. Imaging and analysis of oil red o-stained whole aorta lesions in an aneurysm hyperlipidemia mouse model. J Vis Exp. (183), e61277 (2022).
- Lin, Y., et al. Practical assessment of the quantification of atherosclerotic lesions in apoe-/- mice. Mol Med Rep. 12 (4), 5298-5306 (2015).
- Bozycki, L., Łukasiewicz, K., Matryba, P., Pikula, S. Whole-body clearing, staining and screening of calcium deposits in the mdx mouse model of duchenne muscular dystrophy. Skelet Muscle. 8 (1), 21 (2018).
- Glaudemans, A. W., et al. Molecular imaging in atherosclerosis. Eur J Nucl Med Mol Imaging. 37 (12), 2381-2397 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved