Method Article
בידוד וניתוח של נגעי קשת אבי העורקים ושורש במודל עכבר טרשת עורקים
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מספק מתודולוגיה מקיפה לניתוח כמותי של פלאק טרשת עורקים כדי להקל על מחקר מעמיק יותר על המנגנונים וההתקדמות של טרשת עורקים.
Abstract
טרשת עורקים, גורם מוביל למחלות לב וכלי דם, מחייבת בדיקה מפורטת של התפתחות הנגע והתקדמותו. מחקר זה מציג פרוטוקול מקיף לבידוד וניתוח היסטולוגי של נגעי קשת אבי העורקים והשורש במודל עכברים טרשת עורקים בשימוש נרחב, עכברי נוק-אאוט של קולטן ליפופרוטאין בצפיפות נמוכה (Ldlr-/-). קשת אבי העורקים והשורש הם אתרי מפתח לנגעים טרשת עורקים, ובדיקתם קריטית להערכת הופעתה, התקדמותה או נסיגתה של טרשת עורקים, חיזוי סיכונים לאירועים קרדיווסקולריים וזיהוי מטרות טיפוליות פוטנציאליות. פרוטוקול זה מתאר שיטות לכימות עומס טרשת עורקים בקשת אבי העורקים ובשורש, כולל בידוד רקמות, קיבוע, צביעת שמן אדום O, חתך שורש אבי העורקים, צביעת המטוקסילין ואאוזין (HE), צביעת Verhoeff-Van Gieson (VVG) וניתוח תמונה. צביעת שמן אדום O מודדת את שטח הפלאק בקשת אבי העורקים, ומעריכה את חומרת טרשת העורקים, בעוד צביעת HE של שורש אבי העורקים חושפת מרכיבי פלאק כגון ליבת השומנים והכובע הסיבי, מה שמקל על הערכת יציבות הפלאק והסיכון לקרע. צביעת VVG עלולה להכתים סיבי קולגן בתוך רקמות, ולספק תובנות נוספות לגבי הרכב הפלאק ומידע קשור. ניתוח יסודי זה מציע תובנות חשובות לגבי מנגנוני התפתחות הנגעים ועשוי להנחות את יצירת אסטרטגיות טיפוליות חדשות למניעה וטיפול בטרשת עורקים.
Introduction
מחלות לב וכלי דם, במיוחד טרשת עורקים, התגלו כנטל בריאותי משמעותי וגורם מוות עיקרי ברחבי העולם 1,2. טרשת עורקים היא מחלה דלקתית כרונית מתקדמת המאופיינת בהצטברות הדרגתית של שומנים והיווצרות פלאק בדופן העורק, מה שמוביל בסופו של דבר להיצרות לומן העורקי ועלול לקרע של פלאק, מה שמעורר אירועים קרדיווסקולריים חריפים כגון אוטם שריר הלב ושבץ מוחי 1,2,3. בהתחשב בהשפעתו העמוקה על בריאות האדם, יש צורך דחוף להבין את המנגנונים העומדים בבסיס טרשת עורקים ולפתח אסטרטגיות טיפוליות יעילות.
בשנים האחרונות, מודלים של בעלי חיים מילאו תפקיד מכריע בקידום ההבנה שלנו לגבי טרשת עורקים. בקרב מינים שונים, עכברים התגלו כמודל מועדף בשל הרבייה המהירה שלהם, עלויות התחזוקה הנמוכות והזמינות של טכניקות מניפולציה גנטיות מתקדמות 4,5. בפרט, עכברי נוקאאוט של קולטן LDL (Ldlr-/-) ועכברי ApoE-/- שימשו באופן נרחב לחיקוי טרשת עורקים אנושית, מכיוון שהם מציגים מאפיינים פתופיזיולוגיים דומים 4,5,6,7,8,9.
נגעים טרשת עורקים בעכברים יכולים להופיע במקומות שונים של אבי העורקים, אך הם נוטים במיוחד להתפתח באזורים הקשורים קשר הדוק להמודינמיקה, כגון שורש אבי העורקים, קשת אבי העורקים והגזע הברכיוצפלי, בעוד שאבי העורקים היורד מושפע פחות באופן יחסי10. כדי להעריך במדויק את עומס הנגעים הטרשת במודלים של עכברים, להעריך את נוכחותם, גודלם ושלב הפלאק, ובכך לחקור את ההשפעה של תרופות או גורמים שונים על הופעתה, התקדמותה ורגרסיה של טרשת עורקים, שילוב של טכניקות צביעה היסטולוגיות וניתוח הדמיה הוא חיוני11. צביעת שמן אדום O, שיטה מבוססת היטב, צובעת באופן ספציפי שומנים וליפופרוטאינים ניטרליים12, ומספקת הדמיה ישירה של היווצרות פלאק בקשת אבי העורקים13. בינתיים, צביעת המטוקסילין-אאוזין (HE) של שורש אבי העורקים לא רק תוחמת את אזור הפלאק אלא גם מספקת מאפיינים מבניים מפורטים, כגון הכובע הסיבי והליבה הנמקית של השומנים. פרטים אלה חיוניים להערכת יציבות הפלאק ולניבוי הסיכון לקרע בפלאק11. יחד, טכניקות אלו מאפשרות הערכה מקיפה של חומרת הנגע הטרשת והתקדמותו.
פרוטוקול זה לקח כדוגמאות עכברי C57BL6/J Ldlr-/- שניזונו מדיאטת צ'או ותזונה מערבית, במטרה לספק מדריך מפורט שלב אחר שלב להערכת נטל הנגעים הטרשת בעכברים באמצעות צביעת שמן אדום O של קשת אבי העורקים וצביעה HE של קטעי שורש אבי העורקים המשובצים בפרפין, ולאחר מכן ניתוח תמונה. הפרוטוקול מכסה את כל ההיבטים של בידוד וקיבוע אבי העורקים, הטמעה וחתך של פרפין, הליכי צביעה וניתוח תמונה תוך שילוב פרטים תפעוליים ושיקולים לשלבי מפתח, מה שמבטיח את יכולת השחזור והאמינות של התוצאות. על ידי ביצוע פרוטוקול זה, חוקרים יכולים להעריך בצורה מדויקת ויעילה את היעילות של התערבויות טיפוליות ולקבל תובנות לגבי המנגנונים העומדים בבסיס טרשת עורקים.
Protocol
כל הפרוטוקולים בבעלי חיים ששימשו במחקר זה אושרו על ידי ועדת האתיקה לניסויים בבעלי חיים של אוניברסיטת שנחאי לספורט.
1. הכנת ריאגנטים וכלי דיסקציה
- עיקור כלי חיתוך, כולל מספריים עדינים, מלקחיים ישרים, מלקחיים מעוקלים, מספריים קפיציים וסיכות, על ידי חיטוי מראש.
- 75% אתנול: מערבבים 75 מ"ל של אתנול נטול מים עם 25 מ"ל של ddH2O.
- 1x תמיסת מלח חוצצת פוספט (PBS): ממיסים 0.01 M אבקת PBS ב-2 ליטר של ddH2O.
- תמיסת 4% פרפורמלדהיד (PFA): מחממים 800 מ"ל של 1x PBS עד כ-60 מעלות צלזיוס על מערבל מגנטי במכסה אדים. מוסיפים לאט לאט 40 גרם אבקת פרפורמלדהיד תוך ערבוב מתמיד. יש לטטר עם 1N NaOH עד להמסה מלאה. מצננים לטמפרטורת החדר, מכוונים את עוצמת הקול ל-1 ליטר עם 1x PBS, מסננים וכווננו את ה-pH ל-7.2-7.4.
זהירות: PFA הוא כימיקל מסוכן הדורש טיפול זהיר והקפדה על פרוטוקולי בטיחות. - תמיסת גרב של שמן אדום O: ממיסים 2.5 גרם אבקת שמן אדום O ב-500 מ"ל של 100% איזופרופנול, אוטמים בבקבוק חום ושומרים במקרר בטמפרטורה של 4 מעלות צלזיוס לאחסון לטווח ארוך.
זהירות: איזופרופנול הוא כימיקל רעיל ומזיק; לכן, כדי להבטיח בריאות ובטיחות, חיוני ללבוש את ציוד המגן האישי הדרוש (PPE), כולל כפפות. - פתרון עבודה של שמן אדום O: מערבבים את תמיסת הגרב וסטרילי ddH2O ביחס של 3:2. הכן טרי לכל שימוש וסנן את התמיסה עם מסנן מזרק סטרילי של 0.22 מיקרומטר או נייר סינון גדול.
- תמיסת צביעה של Victoria Blue'B: ממיסים 0.5 גרם Victoria Blue'B ב-100 מ"ל של 70% אתנול.
2. בידוד אבי העורקים והלב
- יש לשכן את כל העכברים ב-3-5 בעלי חיים בכלוב, עם מחזור אור/חושך של 12 שעות, בסביבה מבוקרת טמפרטורה ולהאכיל דיאטת צ'או סטנדרטית (צ'או) או דיאטה מערבית (WTD) המכילה 0.2% כולסטרול ו-21.2% שומן. בחר עכברים זכרים C57BL6/J LDLr-/- בני 12 שבועות ומשקלם בין 25 ל-30 גרם. להקריב עכברים בתא CO2 .
- לפני הדיסקציה, הניחו את העכברים במצב שכיבה (צד הגחון כלפי מעלה) על לוח קצף מכוסה ב 1-2 שכבות של נייר סופג וקבעו את הגפיים בעזרת סיכות.
- ריססו 75% אתנול על בטן העכברים כדי לנקות ולהרטיב את הפרווה.
- השתמש במלקחיים כדי לתפוס את עור הגחון של העכברים והשתמש במספריים עדינים כדי לחתוך את העור מבסיס הבטן ועד לחלק העליון של הצוואר.
- פתח את דופן הבטן, ולאחר מכן השתמש במלקחיים כדי להרים את עצם החזה ולחתוך את הסרעפת והצלעות כדי לחשוף את חלל בית החזה.
- הסר את הוושט וקנה הנשימה, מה שיאפשר ניקוי קל יותר של עורקי הצוואר. הסר איברים, כולל הכבד, הריאות, הטחול, מערכת העיכול והלבלב, תוך שמירה על הכליות הממוקמות מאחורי הצפק ואבי העורקים הבטני לצד עמוד השדרה. בעת ניתוח העורקים המזנטריים, הקפד להרים את המעיים ולבצע חתכים הרחק מאבי העורקים כדי למנוע פגיעה באבי העורקים הבטני.
- כדי לספק שדה תצפית ברור, הנח את העכברים מתחת לסטריאומיקרוסקופ ויישר את מקור האור הקר עם אזור הדיסקציה.
- הזרקו לאט מזרק של 10 מ"ל מלא ב-PBS עם מחט RWLB בגודל 0.45 x 15 (II) לקודקוד החדר השמאלי והתבוננו בהתרחבות אבי העורקים.
- נגב בעדינות את הדם והנוזל באזור החיתוך עם נייר טישו כדי לחשוף את שדה הראייה במלואו.
- קל לחשוף את אבי העורקים החזי. השתמש בו כפריצת דרך על ידי שימוש במלקחיים כדי לתפוס את המקטע הסרעפתי המחובר לקצה אבי העורקים החזי ומספריים קפיציים כדי לחתוך את רקמת החיבור בין אבי העורקים לדופן שריר בית החזה.
- משוך בעדינות את הלב בעזרת מלקחיים והרם את אבי העורקים החזי, תוך התבוננות בענפי קשת אבי העורקים, ונתח את השומן ההרפתקני ורקמת החיבור סביב קשת אבי העורקים וענפיו כלפי מעלה לאורך אבי העורקים החזי.
הערה: היזהר, שמור על אבי העורקים שלם, הימנע מקריעה או פציעה שלו והסר ביסודיות את השומן ורקמת החיבור שמסביב. שלב זה דורש תרגול חוזר כדי להשיג מניפולציה מיומנת. - נתח את אבי העורקים הבטני ועורקי הכסל הנפוצים כלפי מטה לאורך אבי העורקים החזי.
- חותכים את עורקי הכסל הנפוצים 1-2 מ"מ מתחת להתפצלותם, חותכים את הענפים הקטנים של אבי העורקים לאורך עמוד השדרה כדי לשחרר אותו, מנתקים את עורקי הכליה ליד הכליות, חותכים את שלושת כלי הענפים בצוואר מהקצוות הדיסטליים שלהם, ולבסוף חותכים את אבי העורקים העולה ליד הלב.
- לפני ניתוח קשת אבי העורקים, הניחו אטם קטן בצבע כהה עם ניגודיות גבוהה לכלי הדם שמתחתיו וצלמו את אזור קשת אבי העורקים.
- חתוך את רקמת הלב וחתוך את החצי התחתון של הלב לאורך מישור מקביל לפרוזדורים. תקן את הלב הקצוץ (איור 1A).
3. קיבוע וטיפול מקדים בקשת אבי העורקים
- הכן מראש 1 מ"ל של תמיסת PFA 4% בצינור צנטריפוגה של 1.5 מ"ל.
- הכניסו את אבי העורקים לתוך הצינור וקבעו אותו לפחות 24 שעות בטמפרטורת החדר.
הערה: ניתן לשמר את אבי העורקים ב-4% PFA עד חודש מבלי להשפיע על איכות צביעת Oil Red O. כדי לשמור על התצורה הרגילה שלה, הנחת הרקמה על גומי לפני הקיבוע יכולה להיות אפשרות מתאימה. - מעבירים את אבי העורקים לצלחת פטרי המכילה PBS כדי למנוע את התייבשותו. תחת סטריאומיקרוסקופ, השתמש במלקחיים ובמספריים קפיציים כדי להסיר בזהירות את כל השומן האדוונטיציאלי שנותר שלא הופשט לחלוטין במהלך הדיסקציה על מנת להפחית את ההפרעה לכימות הפלאק בתוך אבי העורקים.
- השתמשו במספריים קפיציים כדי לחתוך בזהירות את אבי העורקים לאורך ציר האורך הפנימי שלו, ולאחר מכן חתכו ברצף את שלושת הענפים של קשת אבי העורקים לאורך הצד הצדדי עד לרמת העקמומיות של קשת אבי העורקים, מה שמאפשר לה להתפשט במלואה (איור 1C).
- בשלב זה יש להשתמש בצבע O אדום שמן או לאחסן ב-4% PFA.
4. שמן אדום O מכתים את קשת אבי העורקים
- מניחים את אבי העורקים החתוך לצלחת של 12 בארות. יש להוסיף 1 מ"ל של ddH2O סטרילי לכל באר, ולשטוף במשך 5 דקות על שייקר, לחזור על הפעולה פעמיים.
- הנח את צלחת 12 הבארות עם התמיסה שהוסרה במכסה אדים וייבש באוויר למשך 20 דקות עד שאין סימני מים גלויים.
- הוסף 1 מ"ל של תמיסת עבודה Oil Red O שהוכנה טרייה לכל באר ונער במשך 20 דקות על השייקר, ולאחר מכן הסר את תמיסת העבודה Oil Red O.
- הוסף 2 מ"ל של ddH2O סטרילי לכל באר ושטוף במשך 5 דקות, חזור על שלב זה 3x. לאחר מכן, שמור את אבי העורקים ב-ddH2O.
- הנח את אבי העורקים על שקופית ופזר אותו מתחת לסטריאומיקרוסקופ. כדי לשפר את הניגודיות, הנח כרית גומי שחורה מתחת לשקופית.
- הנח את השקופית על נייר לבן כדי לשפר עוד יותר את הניגודיות, עם סרגל לצידו, וצלם תמונה באמצעות מצלמה. כדי לשמור על לחות אבי העורקים, אחסן את אבי העורקים המטופל בצינור צנטריפוגה של 1.5 מ"ל המכיל 1 מ"ל PBS.
5. ניתוח תמונה של קשת אבי העורקים
- פתח את תמונת אבי העורקים שצולמה במחשב המצויד בתוכנת Image J.
- בחר את האזור עם תיבה מלבנית, כגון 450 פיקסלים x 900 פיקסלים, המכיל את אבי העורקים כולו, ושמור אותו כתמונת .tiff חדשה.
- פתח את תמונת .tiff החדשה שנשמרה בתמונה J. לחץ על ערוך > הפוך, ולאחר מכן בחר תמונה ולחץ על הקלד > מחסנית RGB.
- עבור אל תמונה, לחץ על ערימות > ערימה לתמונות ולאחר מכן בחר את הירוק עם הניגודיות הטובה ביותר.
- עבור אל תמונה, לחץ על התאם > בהירות/ניגודיות. שנה את הערך המינימלי לכ- 200, מזער את הרקע תוך שמירה על רקעים דומים עבור כל תמונה ולאחר מכן לחץ על החל.
- עבור אל ניתוח ובחר הגדר מדידה. בחר/י ״אזור״, ״שבר שטח״, ״הגבל לסף ״ ו״ תווית תצוגה״ ולאחר מכן לחץ/י על ״אישור״.
- עבור אל ניתוח, בחר מדידה והעתק את התוצאה לגיליון אלקטרוני.
- עבור אל ניתוח, לחץ על כלי > מנהל החזר ROI ולאחר מכן בחר את חלק הקשת של אבי העורקים עם תיבה מלבנית. עבור אל מנהל החזר ההשקעה ובחר הוסף [t] ולאחר מכן מדוד. העתק את התוצאות הנמדדות לגיליון אלקטרוני.
- לנתח את השטח שנמדד בקבוצות העכברים על סמך בדיקות נורמליות. p < 0.05 מצביע על כך שההבדל מובהק סטטיסטית.
הערה: בחר את השיטה הסטטיסטית המתאימה בהתאם לתכנון הניסוי.
6. הטמעת פרפין של הלב
- הסר את קודקוד הלב וודא שהחתך ישר ומיושר עם כיוון שורש המסתם (איור 1B).
- הניחו כל דגימת לב בנפרד בקופסת הטמעת פרפין וסמנו את הקופסה בעיפרון.
- במכסה האדים, הניחו את הקסטה המוטמעת בפרפין עם טישו בכלי ריק ושטפו את קופסת ההטבעה במים זורמים למשך 3 דקות.
- בצע התייבשות רקמות באמצעות אתנול עם שיפועי ריכוז הולכים וגדלים כדלקמן: 50% אתנול למשך שעתיים, 75% אתנול למשך 30 דקות, 85% אתנול למשך 30 דקות, 95% אתנול למשך 30 דקות ו-100% אתנול למשך 10 דקות. חזור על השלבים על ידי החלפת אתנול בכל שלב.
- בצע שקיפות רקמות עם קסילן באופן הבא: תערובת 1:1 של קסילן ואתנול למשך 20 דקות, קסילן למשך 15 דקות, חזור על זה 1x על ידי שינוי הקסילן.
- ממיסים מראש את שעוות הפרפין בתנור בחום של 60 מעלות. טפל בדגימות בתערובת של קסילן ופרפין למשך 30 דקות, ולאחר מכן שעווה רכה של פרפין למשך שעתיים ולאחר מכן שעווה קשה של פרפין למשך שעה.
זהירות: אתנול הוא ממס אורגני דליק ונדיף. קסילן רעיל במידה בינונית ודורש הגנה בעת השימוש. - הטמעת פרפין
- בחר את התבנית בגודל המתאים, הפעל אותה וחמם את מכונת ההטבעה מראש.
- לאחר הוספת שעוות פרפין מותכת לתבנית, חלצו את הרקמה מקלטת ההטבעה ומקמו אותה, כשפני השטח החתוכים שלה פונים כלפי מטה, בתחתית המרכזית של התבנית באמצעות מלקחיים שחוממו מראש.
- לאחר שהתבנית התקררה על שולחן מקפיא והפרפין שבתוכו התמצק, הניחו את מכסה קלטת ההטבעה המצוין על גבי התבנית ומלאו אותו בכמות הפרפין הדרושה.
- לאחר ששעוות הפרפין התקררה והתייצבה, הוציאו את הבלוק מהתבנית ושמרו אותו במקרר בטמפרטורה של 4 מעלות צלזיוס (איור 1D).
7. קטעי פרפין של שורש אבי העורקים
- נקה את כל עודפי הפרפין המקיפים את מכסה קלטת ההטבעה, ולאחר מכן הצמידו היטב את גוש הפרפין ל-clamp מושב הממוקם על ראש פורס הפרפין. כוונן את הבלוק למצב מעט מקוזז מהמקום שבו תיחתך הפרוסה, וודא שקטע הרקמה בתוך גוש הפרפין מקביל לקצה החיתוך של הלהב. עבור החתך הראשון, הגדר את עובי הפרוסה ל-10 מיקרומטר על מנת לחשוף את מיקום הרקמה.
- כאשר החתך הראשון נמצא מתחת למיקרוסקופ, כוונן את עובי הפרוסה ל-6 מיקרומטר ובצע חתך סדרתי. חותכים, פורסים וקטפים קטעים בפורס עד ששלושה שסתומי אבי העורקים השלמים נראים מתחת למיקרוסקופ, ובשלב זה מתחילה ההכנה לחתך. השאירו פרוסה אחת במרווחים של 6 מיקרומטר לכל עכבר, והניחו מיקומי פרוסות שונים על מנשאי זכוכית שונים, למשלample, סעיף 1-11-21-31, כדי לקבל סקירה נכונה.
- צף את החלקים על מפזר המכיל מים חמים של 37 מעלות צלזיוס כדי לפזר את הרקמה שטוחה ולאחר מכן הרם את הטישו בעזרת שקופית. לאחר המתנה לייבוש המים, מניחים את הפרוסות על טוסטר המכוון ל-42 מעלות למשך הלילה.
- שטח הפלאק הממוצע של 8 החלקים הללו מייצג את הערך של שטח רובד השורש של אבי העורקים בכל עכבר. לאחר צביעת קטעים אלה, מדוד את שטח הפלאק הממוצע ואת שטח הפלאק.
8. מכתים המטוקסילין אאוזין
- מניחים את הפרוסות במייבש בחום של 60 מעלות למשך 30 דקות. במכסה אדים, בעזרת מתלה מכתים, הניחו חלקים ברצף בקסילן למשך 10 דקות (חזרו על שלב זה פעם אחת, החליפו את הקסילן), 100% אתנול למשך 5 דקות (חזרו על שלב זה, החליפו את האתנול), 95% אתנול למשך 5 דקות, 85% אתנול למשך 5 דקות ו-75% אתנול למשך 5 דקות.
- שוטפים במים זורמים למשך 5 דקות. טבלו את החלקים בכתם המטוקסילין למשך 8 דקות ושטפו תחת מים זורמים.
- הבדיל בין החלקים עם אלכוהול חומצה הידרוכלורית 1% למשך מספר שניות ושטוף במים זורמים ושים לב שהחלקים הופכים לסגולים כחולים מתחת למיקרוסקופ.
- טבלו את החלקים בתמיסת מכתים של אאוזין למשך 5 דקות. מניחים את החלקים ב-95% אתנול למשך 7 מטבלים ולאחר מכן ב-100% אתנול למשך 30 שניות.
- נקה בקסילן למשך 30 שניות לפחות. אטמו את השקופיות באמצעות מסטיק ניטרלי, צלמו תחת מיקרוסקופ ושמרו תמונות ברזולוציה גבוהה, רצוי בפורמט .tiff.
9. מכתים של ורהוף-ואן גיסון (VVG).
- בצע הסרת שעווה והתייבשות שגרתית על חלקי הפרפין, בצע את אותם השלבים המתוארים בסעיפים 8.1 ו-8.2.
- לאחר שטיפה קצרה ב-70% אתנול, טבלו את החלקים בתמיסת צביעה של Victoria Blue'B למשך 15 דקות.
- הבדיל בין החלקים לכמה שניות באתנול 95%. שוטפים את החלקים פי 2 במים מזוקקים.
- מכתים את החלקים בתמיסת מכתים של Ponceau למשך 5 דקות על ידי מריחת טיפות. הבדיל וייבש את החלקים באמצעות 100% אתנול.
הערה: לאחר צביעת פונסו, הימנע מכל מגע עם מים. - נקה בקסילן למשך 30 שניות לפחות. הרכיבו את השקופיות עם מסטיק ניטרלי וצלמו אותן תחת מיקרוסקופ.
10. ניתוח תמונה של רובד השורש של אבי העורקים
- פתח את התמונה במחשב המצויד בתוכנת Image J. בחר אחד מכלי התיבה כדי להוסיף את הלוחית.
- עבור אל תמונה, לחץ על שכבת-על > הוסף בחירה ולאחר מכן על מדידה כדי למדוד את שטח הלוח. העתק את התוצאות הנמדדות לגיליון אלקטרוני.
- לנתח את השטח שנמדד בקבוצות העכברים על סמך בדיקות נורמליות. p < 0.05 מצביע על כך שההבדל מובהק סטטיסטית.
תוצאות
התוצאות המייצגות מדגימות את היישום של טכניקת הבידוד והניתוח עבור נגעי קשת אבי העורקים והשורש במודל עכבר טרשת עורקים. תוצאות אלו מספקות ראיות ברורות ליכולתה של הטכניקה לזהות ולאפיין נגעים טרשת עורקים. לדוגמה, תמונות היסטולוגיות עם כתמים ספציפיים (למשל, שמן אדום O) מדגישות הצטברות שומנים, בעוד צביעת המטוקסילין ואאוזין (H&E) חושפת את המורפולוגיה הכוללת של הנגעים הטרשתיים, כולל מבנה דופן העורק, נוכחות ליבות שומנים ואזורי נמק. על ידי ניתוח חתכים מוכתמים ב-H&E, אנו יכולים להעריך את היקף התפתחות הנגעים והשינויים המבניים באבי העורקים, ולספק סקירה כללית של התקדמות הפלאק ועיצוב מחדש של הרקמות.
בפרוטוקול זה, ניתחנו את היקף הנגעים הטרשת בעכברי נוקאאוט C57 Ldlr בני 12 שבועות שהוזנו בדיאטה בסגנון מערבי (WTD) במשך 4 חודשים ועכברי Ldlr-/- שהוזנו בדיאטת צ'או כביקורת.
לאחר 12 שבועות של דיאטת צ'או והאכלה בדיאטה מערבית, עכברי נוקאאוט LDLR בקבוצת הדיאטה המערבית היו בעלי משקל גוף גבוה משמעותית בהשוואה לקבוצת הביקורת. נוסף על כך, רמות השומנים בקבוצת התזונה המערבית השתנו גם הן, עם רמות גבוהות משמעותית של טריגליצרידים בפלזמה (TG) וכולסטרול כולל (TC), כאשר TG ו-TC זוהו על ידי בדיקת אימונוסורבנט מקושרת לאנזים שנלקחה מדם הזנב של העכברים (איור 2).
התוצאות של צביעת שמן אבי העורקים בעכברי נוקאאוט LDLR שהוזנו בתזונה המערבית, שהראו הצטברות שומנים חמורה ונגעים טרשת עורקים בהשוואה לעכברים שניזונו בדיאטת צ'או, מצביעות על כך שיותר משקעי שומנים בעורקים תואמים לנגעים טרשת עורקים חמורים יותר (איור 3).
בקטעי שורש אבי העורקים, שטח גדול יותר של רובד וגרעינים נמקיים מרמז על נגע טרשת עורקים חמור יותר. כאן, הוכח שאזור הנגע בשורש אבי העורקים והליבה הנמקית גדולים בהרבה בעכברים שניזונו מתזונה מערבית מאשר בעכברים שניזונו מדיאטת צ'או (איור 4A). צביעת VVG של קטעי פרפין בשורש אבי העורקים בוצעה כדי להעריך את האזור החולה של שורש אבי העורקים; סיבים אלסטיים היו כחלחלים-סגולים, וסיבי קולגן בדרך כלל התרבו ליצירת כובע סיבי ונראו אדומים. צביעת VVG עוזרת לנו לראות אם יש הרס או הפחתה של סיבים אלסטיים, עיבוי דופן כלי הדם ושקיעה של סיבי קולגן לא תקינים, שעשויים להיות סימן לדלקת או שיפוץ פתולוגי. כאן, הוא הראה את המגמות של עלייה בסיבי הקולגן בכובע הסיבי בשורש אבי העורקים של עכברים שניזונו מתזונה מערבית בהשוואה לעכברים שניזונו מדיאטת צ'או (איור 4B). הכימות של אזור הנגע בשורש אבי העורקים והאזור הנמק אכן הראה שהתזונה המערבית מחמירה את המצב הטרשת בעכברי נוקאאוט LDLR (איור 4C).

איור 1: שלבים לבידוד וניתוח נגעים בקשת אבי העורקים ובשורש. (A) בידוד אבי העורקים והלב. (B) הכנת שורש אבי העורקים. רקמת הלב בין שני הקווים המקווקוים נחתכה. (C) קיבוע וטיפול מקדים בקשת אבי העורקים. (D) הטמעת פרפין של הלב. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: שינויים במשקל הגוף וברמות השומנים בדם של עכברי קבוצת ביקורת ו-WTD שהוזנו במשך 12 שבועות. (A) עקומת משקל גוף בהאכלת CD ו-WTD. (B) טריגליצרידים בפלזמה (TG). (C) כולסטרול כולל (TC) (n=4). התוצאות מבוטאות כממוצע ± SEM, המובהקות הוערכה על ידי מבחן t של סטודנט. עמ' < 0.001, **** עמ' < 0.0001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
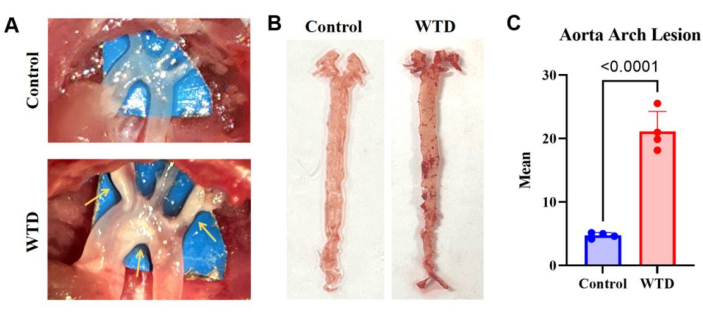
איור 3: קשת אבי העורקים והצביעה והניתוח שלה בצבע אדום שמן. (A) תמונות מייצגות של פלאקים טרשת עורקים בקשת אבי העורקים. קשתות אבי העורקים של עכברי Ldlr-/- שהוזנו בדיאטת צ'או נצפו במיקרוסקופ ללא פלאק גלוי לעין, בעוד שקשתות אבי העורקים של עכברי Ldlr-/- שהוזנו בתזונה מערבית נצפו במיקרוסקופ עם פלאק גלוי לעין. (B) תמונות מייצגות של שמן אבי העורקים בצבע אדום O. אבי העורקים השלם מעכברי Ldlr-/- שניזונו מתזונה של צ'או ללא הצטברות שומנים, ואבי העורקים השלם מ-Ldlr-/- לעכברים שהוזנו בתזונה מערבית במשך 4 חודשים היו פלאקים גלויים בקשת אבי העורקים (n=4). (C) מספר ממוצע עבור נגעים בקשת אבי העורקים. התוצאות מבוטאות כממוצע ± SEM, והמובהקות הוערכה על ידי מבחן t של סטודנט. עמ' < 0.001, **** עמ' < 0.0001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
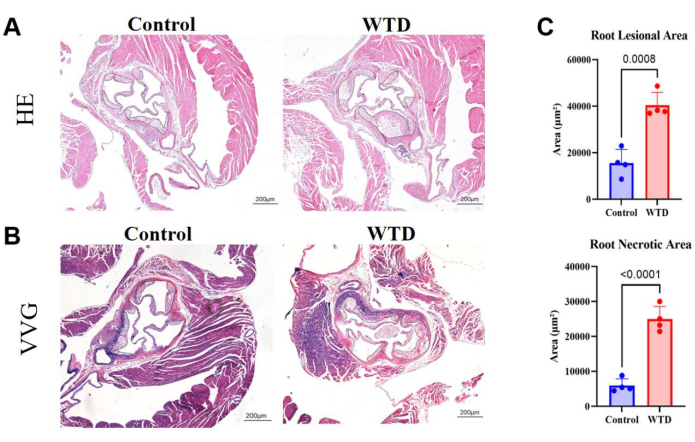
איור 4: קטעי שורש אבי העורקים מוכתמים ב-HE ו-VVG, עם כימות של שטח הפלאק והשטח הנמק. (A) קטעי שורש אבי העורקים המוכתמים בהמטוקסילין ואאוזין. שורשי אבי העורקים של עכברי Ldlr-/- הנתונים לדיאטת צ'או והתערבויות בתזונה המערבית, בהתאמה. (ב) קטעי שורש אבי העורקים המוכתמים על ידי ורהוף-ואן גיסון. שורשי אבי העורקים של עכברי Ldlr-/- הנתונים לדיאטת צ'או והתערבויות בתזונה המערבית, בהתאמה, מוקפים בשחור ומהווים נגעים טרשת עורקים בעכברים. (C) כימות של אזור הנגע בשורש אבי העורקים והאזור הנמק (n=4). התוצאות מבוטאות כממוצע ± SEM, והמובהקות הוערכה על ידי מבחן t של סטודנט. עמ' < 0.001, **** עמ' < 0.0001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
כאן, אנו מספקים מידע מפורט על שיטות הדגימה של אבי העורקים בעכברי נוקאאוט Ldlr וניתוח כמותי של פלאק.
הדיוק של הליך הדיסקציה הוא האתגר הטכני הגדול ביותר להפשטת אבי העורקים in vivo במודל העכבר של טרשת עורקים. בהתבסס על הניסיון שלנו, נקודות המפתח הן כדלקמן: (1) השתמש ב-PBS כדי לשטוף את כל הדם בעורק כדי להגביר את ההשוואה בין ענפי קשת אבי העורקים לשומן סביב כלי הדם. (2) היו סבלניים. בשל גודלו הקטן של אבי העורקים של העכבר, יש לבצע את ההליך תחת מיקרוסקופ גוף ובאמצעות קוצץ ומלקחיים מיקרוסקופיים איכותיים כדי למזער טעויות בפעולה. (3) חובה להבטיח שההפשטה תתחיל בצורה מדויקת ובכיוון הנכון כדי למנוע כל חתך או נזק לכלי השיט.
לגבי צביעת O אדום של שמן אבי העורקים בעכברים, יש להסיר את השומן ההיקפי של אבי העורקים המבודד של העכבר באופן מיקרוסקופי לפני הצביעה הרשמית, ולשמור על שלמות הרקמה כדי למנוע השפעה על תוצאות הצביעה. תהליך הצביעה באדום שמן דורש שליטה מדויקת על זמן הצביעה; משכי זמן מוגזמים ולא מספיקים עלולים לפגוע באפקט הצביעה, וכתוצאה מכך לתוצאות לא מדויקות.
בהטמעה של שורשי אבי העורקים של עכבר, יש לשלוט על זמן ההתייבשות של הרקמה כדי למנוע סדקים ברקמות במהלך החיתוך. חלקים של שורש אבי העורקים צריכים להיות בעובי אחיד כדי להבטיח צביעה אחידה, וחלקים דקים מדי או עבים מדי עלולים להפריע לתצפית. יחד עם זאת, יש צורך לקבוע במדויק היכן מופיע המסתם התלת-שפתי כאשר מסתכלים עליו במיקרוסקופ. תהליך צביעת המטוקסילין אאוזין דורש בקרה מדויקת על זמן הצביעה וריכוז תמיסת הצביעה על מנת למנוע צביעה לא ספציפית.
בהשוואה לשיטות המצוינות הקיימות להערכת טרשת עורקים, פרוטוקול זה סיפק פרטים שלב אחר שלב לניתוח קשת אבי העורקים והשורש, מה שיכול לעזור להעריך באופן מקיף את מצב טרשת העורקים11,13 גם צביעת המטוקסילין-אאוזין וגם צביעת VVG יכולים לעזור להעריך את אזור הנגע בשורש אבי העורקים, מה שמגביר את דיוק הכימות של טרשת עורקים.
עם זאת, עדיין יש כמה מגבלות של צביעת O אדום שמן אבי העורקים. לדוגמה, צביעה אדומה בשמן משמשת בעיקר לאיתור שומנים, אך יש לה ספציפיות ירודה עבור סוגים אחרים של רכיבי תאים או רקמות11, מה שעלול להוביל לסיווג שגוי. מצד שני, תהליך קיבוע ודיסקציה של הדגימה עלול להוביל לאובדן שומנים, ובכך להשפיע על אמינות תוצאות הצביעה. באשר לצביעה של המטוקסילין-אאוזין של שורש אבי העורקים, הוא מוגבל בהבחנה בין רכיבים תאיים ועשוי להיות קשה לזהות אזורים ספציפיים של הנגע במקרים של מבנה רקמה מורכב. בעת ביצוע ניתוחים כמותיים, התוצאות הסטטיסטיות של אזור התיקון עשויות להיות מושפעות גם משיפוט סובייקטיבי של הצופה. בנוסף, צביעת המטוקסילין-אאוזין מספקת בעיקר מידע מורפולוגי ואינה מספקת תובנה לגבי תפקוד התא או אפיון מולקולרי.
מלבד צביעה סטנדרטית בשמן אדום וצביעה המטוקסילין-אאוזין, טכניקות אחרות לניתוח פלאק טרשת עורקים כוללות צביעת מאסון, צביעה אימונוהיסטוכימית לאנטיגנים שונים, ושיטות אחרות שניתן להשתמש בהן כדי לבחון את הרכב הפלאק ומידותיו. צבע O אדום שמן של קטעי שורש אבי העורקים נמצא בשימוש נרחב גם לניתוח שקיעת השומנים בשורש אבי העורקים14. צביעת Alizarin Red S היא כתם נפוץ לאיתור מרבצי סידן; הוא יוצר קומפלקס אדום עם יוני סידן, מה שהופך אותו לאידיאלי להדמיית מרבצי סידן15. יתר על כן, ניתן להסיק מטבוליזם של שומנים מסמנים ביוכימיים בסרום כגון רמות של ליפופרוטאין בצפיפות גבוהה (HDL), ליפופרוטאין בצפיפות נמוכה (LDL), כולסטרול כולל (TC) וטריאציל גליצרול כולל (TG). אחד הגורמים העיקריים התורמים להתפתחות טרשת עורקים הוא חילוף חומרים לא תקין של שומנים, במיוחד הקשר בין טרשת עורקים ומחלות לב וכלי דם (ASCVD) ורמות כולסטרול ליפופרוטאין בצפיפות נמוכה (LDL).
ככל שהמחקר על טרשת עורקים יעמיק, הפיתוח העתידי של שיטות ניתוח כמותי יהפוך למדויק ומגוון יותר. ראשית, שילוב טכנולוגיות הדמיה מתקדמות, כגון MRI ברזולוציה גבוהה, טומוגרפיה קוהרנטית אופטית (OCT) והדמיית אולטרסאונד, יהפוך את הניתוח הכמותי של טרשת עורקים למדויק יותר, ויאפשר ניטור דינמי של עכברים חיים. זה יעזור בהערכה בזמן אמת של התקדמות הפלאק, היציבות והתגובה לטיפול. עם התקדמות טכנולוגיות ההדמיה המולקולרית, ניתוח כמותי יאפשר ניתוח מעמיק של תגובות דלקתיות, הצטברות שומנים ורכיבים תאיים בתוך פלאק, ויספק נתונים מקיפים יותר לאבחון מוקדם וטיפול בטרשת עורקים16.
Disclosures
אין מה להצהיר.
Acknowledgements
עבודה זו נתמכה על ידי בסיס המחקר המדעי של שנחאי פרונטירס לפעילות גופנית ובריאות מטבולית, תוכנית המחקר של פעילות גופנית ובריאות הציבור (0831) באוניברסיטת שנחאי לספורט, תוכנית מימון הכשרת מורים צעירים להשכלה גבוהה בשנחאי (A2-0213-22-0058-5), ותוכנית המנהיגים האקדמיים המצטיינים של ועדת המדע והטכנולוגיה העירונית של שנחאי (21XD1403200) עבור Longhua Liu.
Materials
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides(25×75mm) | CITOTEST | Cat# 80312-3161 | |
| Embedding cassette | CITOTEST | Cat# 80106-1100-16 | |
| Eosin Staining Solution | Beyotime | Cat# C0109 | |
| Ethanol | Sinopharm Chemical Reagent Co. | Cat# 10009218 | |
| Hematoxylin Staining Solution | Beyotime | Cat# C0107 | |
| Low-profile disposable blades | Leica | Cat# 14035838925 | |
| Microscope cover glass(24×50mm) | CITOTEST | Cat# 10212450C | |
| Neutral Balsam Mounting Medium | Sango Biotech | Cat# E675007-0100 | |
| Oil red o powder | Sigma-Aldrich | Cat# 1320-06-5 | |
| paraffin with ceresin | Sinopharm Chemical Reagent Co. | Cat# 69019461 | |
| Paraformaldehyde | Servicebio | Cat# G1101 | |
| Phosphate Buffered Saline (PBS, Powder) | Servicebio | Cat# G0002-2L | |
| Ponceau S Staining Solution | EveryLab | Cat# FM024 | |
| Victoria Blue’B | Aladdin | Cat# 2580-56-5 | |
| Xylene | Sigma-Aldrich | Cat# 104-81-4 |
References
- Libby, P., et al. Atherosclerosis. Nat Rev Dis Primers. 5 (1), 56 (2019).
- Herrington, W., Lacey, B., Sherliker, P., Armitage, J., Lewington, S. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease. Circ Res. 118 (4), 535-546 (2016).
- Frostegård, J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 11, 117 (2013).
- Gisterå, A., Ketelhuth, D. F. J., Malin, S. G., Hansson, G. K. Animal models of atherosclerosis-supportive notes and tricks of the trade. Circ Res. 130 (12), 1869-1887 (2022).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 32 (5), 1104-1115 (2012).
- Ilyas, I., et al. Mouse models of atherosclerosis in translational research. Trends Pharmacol Sci. 43 (11), 920-939 (2022).
- Liu, L., Chan, M., Yu, L., Wang, W., Qiang, L. Adipsin deficiency does not impact atherosclerosis development in ldlr(-/-) mice. Am J Physiol Endocrinol Metab. 320 (1), E87-E92 (2021).
- Liu, L., et al. Pparγ deacetylation confers the antiatherogenic effect and improves endothelial function in diabetes treatment. Diabetes. 69 (8), 1793-1803 (2020).
- Zahr, T., et al. Pparγ (peroxisome proliferator-activated receptor γ) deacetylation suppresses aging-associated atherosclerosis and hypercholesterolemia. Arterioscler Thromb Vasc Biol. 43 (1), 30-44 (2023).
- Tang, C., et al. Endothelial ccrl2 induced by disturbed flow promotes atherosclerosis via chemerin-dependent β2 integrin activation in monocytes. Cardiovasc Res. 119 (9), 1811-1824 (2023).
- Andrés-Manzano, M. J., Andrés, V., Dorado, B. Oil red o and hematoxylin and eosin staining for quantification of atherosclerosis burden in mouse aorta and aortic root. Methods Mol Biol. 1339, 85-99 (2015).
- Mehlem, A., Hagberg, C. E., Muhl, L., Eriksson, U., Falkevall, A. Imaging of neutral lipids by oil red o for analyzing the metabolic status in health and disease. Nat Protoc. 8 (6), 1149-1154 (2013).
- Chen, P. Y., Qin, L., Simons, M. Imaging and analysis of oil red o-stained whole aorta lesions in an aneurysm hyperlipidemia mouse model. J Vis Exp. (183), e61277 (2022).
- Lin, Y., et al. Practical assessment of the quantification of atherosclerotic lesions in apoe-/- mice. Mol Med Rep. 12 (4), 5298-5306 (2015).
- Bozycki, L., Łukasiewicz, K., Matryba, P., Pikula, S. Whole-body clearing, staining and screening of calcium deposits in the mdx mouse model of duchenne muscular dystrophy. Skelet Muscle. 8 (1), 21 (2018).
- Glaudemans, A. W., et al. Molecular imaging in atherosclerosis. Eur J Nucl Med Mol Imaging. 37 (12), 2381-2397 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved