Method Article
Isolamento e analisi delle lesioni dell'arco aortico e della radice in un modello murino aterosclerotico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo fornisce una metodologia completa per l'analisi quantitativa delle placche aterosclerotiche per facilitare una ricerca più approfondita sui meccanismi e la progressione dell'aterosclerosi.
Abstract
L'aterosclerosi, una delle principali cause di malattie cardiovascolari, richiede un esame dettagliato dello sviluppo e della progressione delle lesioni. Questo studio introduce un protocollo completo per l'isolamento e l'analisi istologica delle lesioni dell'arco aortico e della radice in un modello murino aterosclerotico ampiamente utilizzato, topi knock-out per il recettore delle lipoproteine a bassa densità (Ldlr-/-). L'arco aortico e la radice sono siti chiave per le lesioni aterosclerotiche e il loro esame è fondamentale per valutare l'insorgenza, la progressione o la regressione dell'aterosclerosi, prevedere i rischi di eventi cardiovascolari e identificare potenziali bersagli terapeutici. Questo protocollo delinea i metodi per quantificare il carico aterosclerotico nell'arco aortico e nella radice, tra cui l'isolamento dei tessuti, la fissazione, la colorazione Oil Red O, la sezione della radice aortica, la colorazione con ematossilina ed eosina (HE), la colorazione Verhoeff-Van Gieson (VVG) e l'analisi delle immagini. La colorazione Oil Red O misura l'area della placca nell'arco aortico, valutando la gravità dell'aterosclerosi, mentre la colorazione HE della radice aortica rivela componenti della placca come il nucleo lipidico e il cappuccio fibroso, facilitando la valutazione della stabilità della placca e del rischio di rottura. La colorazione VVG può colorare le fibre di collagene all'interno dei tessuti, fornendo ulteriori informazioni sulla composizione della placca e sulle informazioni correlate. Questa analisi approfondita offre preziose informazioni sui meccanismi di sviluppo delle lesioni e può guidare la creazione di nuove strategie terapeutiche per la prevenzione e il trattamento dell'aterosclerosi.
Introduzione
Le malattie cardiovascolari, in particolare l'aterosclerosi, sono emerse come un onere sanitario significativo e una delle principali cause di morte in tutto il mondo 1,2. L'aterosclerosi è una malattia infiammatoria cronica progressiva caratterizzata dal graduale accumulo di lipidi e dalla formazione di placche nella parete arteriosa, che porta infine al restringimento del lume arterioso e potenzialmente alla rottura delle placche, innescando eventi cardiovascolari acuti come l'infarto del miocardio e l'ictus 1,2,3. Dato il suo profondo impatto sulla salute umana, vi è un urgente bisogno di comprendere i meccanismi alla base dell'aterosclerosi e sviluppare strategie terapeutiche efficaci.
Negli ultimi anni, i modelli animali hanno svolto un ruolo cruciale nel far progredire la nostra comprensione dell'aterosclerosi. Tra le varie specie, i topi sono emersi come modello preferito grazie alla loro rapida riproduzione, ai bassi costi di manutenzione e alla disponibilità di tecniche avanzate di manipolazione genetica 4,5. In particolare, i topi knockout per il recettore LDL (Ldlr-/-) e i topi ApoE-/- sono stati ampiamente utilizzati per imitare l'aterosclerosi umana, poiché presentano caratteristiche fisiopatologiche simili 4,5,6,7,8,9.
Le lesioni aterosclerotiche nei topi possono verificarsi in varie sedi dell'aorta, ma sono particolarmente inclini a svilupparsi in aree strettamente associate all'emodinamica, come la radice aortica, l'arco aortico e il tronco brachiocefalico, mentre l'aorta discendente è relativamente meno colpita10. Per valutare con precisione il carico di lesioni aterosclerotiche nei modelli murini, valutare la presenza, le dimensioni e lo stadio delle placche e quindi indagare l'impatto di diversi farmaci o fattori sull'insorgenza, la progressione e la regressione dell'aterosclerosi, è essenziale una combinazione di tecniche di colorazione istologica e analisi di imaging11. La colorazione Oil Red O, un metodo ben consolidato, colora specificamente i lipidi neutri e le lipoproteine12, fornendo una visualizzazione diretta della formazione della placca nell'arco aortico13. Nel frattempo, la colorazione con ematossilina-eosina (HE) della radice aortica non solo delinea l'area della placca, ma fornisce anche caratteristiche strutturali dettagliate, come il cappuccio fibroso e il nucleo necrotico lipidico. Questi dettagli sono fondamentali per valutare la stabilità della placca e prevedere il rischio di rottura della placca11. Insieme, queste tecniche facilitano una valutazione completa della gravità e della progressione della lesione aterosclerotica.
Questo protocollo ha preso come esempi i topi C57BL6/J Ldlr-/- alimentati con dieta Chow e dieta occidentale, con l'obiettivo di fornire una guida dettagliata passo dopo passo per valutare il carico di lesioni aterosclerotiche nei topi utilizzando la colorazione Oil Red O dell'arco aortico e la colorazione HE delle sezioni della radice aortica incluse in paraffina, seguita dall'analisi delle immagini. Il protocollo copre tutti gli aspetti dell'isolamento e della fissazione aortica, dell'inclusione e del sezionamento della paraffina, delle procedure di colorazione e dell'analisi delle immagini, incorporando dettagli operativi e considerazioni per i passaggi chiave, garantendo la riproducibilità e l'affidabilità dei risultati. Seguendo questo protocollo, i ricercatori possono valutare in modo accurato ed efficiente l'efficacia degli interventi terapeutici e ottenere informazioni sui meccanismi alla base dell'aterosclerosi.
Protocollo
Tutti i protocolli sugli animali utilizzati in questo studio sono stati approvati dal Comitato di revisione etica per la sperimentazione animale dell'Università dello Sport di Shanghai.
1. Preparazione dei reagenti e degli strumenti di dissezione
- Sterilizzare in anticipo gli strumenti di dissezione, tra cui forbici fini, pinze diritte, pinze curve, forbici a molla e perni, in autoclave.
- Etanolo al 75%: Miscelare 75 mL di etanolo anidro con 25 mL di ddH2O.
- 1x soluzione salina tamponata con fosfato (PBS): sciogliere 0,01 M di polvere di PBS in 2 L di ddH2O.
- Soluzione di paraformaldeide (PFA) al 4%: riscaldare 800 mL di 1x PBS a circa 60 °C su un agitatore magnetico in una cappa aspirante. Aggiungere lentamente 40 g di polvere di paraformaldeide, mescolando continuamente. Titolare con 1N NaOH fino a completa dissoluzione. Raffreddare a temperatura ambiente, regolare il volume a 1 L con 1x PBS, filtrare e regolare il pH a 7,2-7,4.
ATTENZIONE: Il PFA è una sostanza chimica pericolosa che richiede un'attenta manipolazione e il rigoroso rispetto dei protocolli di sicurezza. - Soluzione di stoccaggio di Oil Red O: Sciogliere 2,5 g di polvere di Oil Red O in 500 ml di isopropanolo al 100%, sigillare in una bottiglia marrone e conservare in frigorifero a 4 °C per la conservazione a lungo termine.
ATTENZIONE: L'isopropanolo è una sostanza chimica tossica e nociva; pertanto, per garantire la salute e la sicurezza, è essenziale indossare i dispositivi di protezione individuale (DPI) necessari, compresi i guanti. - Soluzione di lavoro di Olio Rosso O: Miscelare la soluzione di calza e il ddH2O sterile in un rapporto di 3:2. Preparare fresco per ogni utilizzo e filtrare la soluzione con un filtro per siringa sterile da 0,22 μm o carta da filtro grande.
- Soluzione colorante Victoria Blue'B: Sciogliere 0,5 g di Victoria Blue'B in 100 ml di etanolo al 70%.
2. Isolamento dell'aorta e del cuore
- Alloggiare tutti i topi a 3-5 animali per gabbia, con un ciclo luce/buio di 12 ore, in un ambiente a temperatura controllata e alimentarli con una dieta standard (chow) o una dieta di tipo occidentale (WTD) contenente lo 0,2% di colesterolo e il 21,2% di grassi. Seleziona topi maschi LDLr-/- C57BL6/J di 12 settimane e con un peso compreso tra 25 e 30 g. Sacrifica i topi in una camera di CO2 .
- Prima della dissezione, posizionare i topi in posizione supina (lato ventrale rivolto verso l'alto) su un pannello di schiuma ricoperto da 1-2 strati di carta assorbente e fissare gli arti con degli spilli.
- Spruzzare etanolo al 75% sull'addome dei topi per pulire e inumidire il pelo.
- Usa il forcipe per afferrare la pelle ventrale dei topi e usa le forbici sottili per tagliare la pelle dalla base dell'addome alla parte superiore del collo.
- Apri la parete addominale, quindi usa una pinza per sollevare lo sterno e taglia sia il diaframma che le costole per esporre la cavità toracica.
- Rimuovere l'esofago e la trachea, il che consentirà una più facile pulizia delle arterie carotidi. Rimuovere gli organi, tra cui fegato, polmone, milza, tratto gastrointestinale e pancreas, preservando i reni situati dietro il peritoneo e l'aorta addominale accanto alla colonna vertebrale. Quando si sezionano le arterie mesenteriche, assicurarsi di sollevare l'intestino e praticare incisioni lontano dall'aorta per evitare di danneggiare l'aorta addominale.
- Per fornire un campo di osservazione chiaro, posizionare i topi sotto uno stereomicroscopio e allineare la sorgente di luce fredda con l'area di dissezione.
- Iniettare lentamente una siringa da 10 ml riempita di PBS con un ago RWLB 0,45 x 15 (II) nell'apice ventricolare sinistro e osservare la dilatazione dell'aorta.
- Asciugare delicatamente il sangue e il liquido nell'area di dissezione con carta velina per esporre completamente il campo visivo.
- L'aorta toracica è facile da esporre. Usalo come svolta usando una pinza per afferrare il segmento diaframmatico attaccato all'estremità dell'aorta toracica e le forbici a molla per tagliare il tessuto connettivo tra l'aorta e la parete muscolare toracica.
- Tirare delicatamente il cuore con una pinza e sollevare l'aorta toracica, osservando i rami dell'arco aortico, e sezionare il grasso avventiziale e il tessuto connettivo attorno all'arco aortico e i suoi rami verso l'alto lungo l'aorta toracica.
NOTA: Prestare attenzione, mantenere intatta l'aorta, evitare di strapparla o ferirla e rimuovere accuratamente il grasso circostante e il tessuto connettivo. Questo passaggio richiede una pratica ripetuta per ottenere una manipolazione competente. - Sezionare l'aorta addominale e le arterie iliache comuni verso il basso lungo l'aorta toracica.
- Tagliare le arterie iliache comuni 1-2 mm sotto la loro biforcazione, tagliare i piccoli rami dell'aorta lungo la colonna vertebrale per liberarla, staccare le arterie renali vicino ai reni, tagliare i tre vasi ramificati nel collo dalle loro estremità distali e infine tagliare l'aorta ascendente vicino al cuore.
- Prima di sezionare l'arco aortico, posizionare una piccola guarnizione di colore scuro con un alto contrasto con i vasi sanguigni sottostanti e fotografare l'area dell'arco aortico.
- Tagliare il tessuto cardiaco e tagliare la metà inferiore del cuore lungo un piano parallelo agli atri. Fissare il cuore tagliato (Figura 1A).
3. Fissazione e pretrattamento dell'arco aortico
- Preparare in anticipo 1 mL di soluzione di PFA al 4% in una provetta da centrifuga da 1,5 mL.
- Posizionare l'aorta nel tubo e fissarla per almeno 24 ore a temperatura ambiente.
NOTA: L'aorta può essere conservata in PFA al 4% per un massimo di 1 mese senza compromettere la qualità della colorazione Oil Red O. Per mantenere la sua configurazione normale, posizionare il tessuto su una gomma prima della fissazione può essere un'opzione adatta. - Trasferisci l'aorta in una capsula di Petri contenente PBS per evitare che si secchi. Sotto uno stereomicroscopio, utilizzare una pinza e le forbici a molla per rimuovere con cura il grasso avventiziale rimanente che non è stato completamente rimosso durante la dissezione, al fine di ridurre l'interferenza con la quantificazione delle placche all'interno dell'aorta.
- Utilizzare le forbici a molla per aprire con cura l'aorta lungo il suo asse longitudinale interno e quindi tagliare in sequenza i tre rami dell'arco aortico lungo il lato laterale fino al livello della curvatura dell'arco aortico, consentendogli di allargarsi completamente (Figura 1C).
- In questa fase utilizzare per la colorazione O rosso olio o conservare in PFA al 4%.
4. Colorazione O rosso olio dell'arco aortico
- Posizionare l'aorta tagliata in una piastra a 12 pozzetti. Aggiungere 1 mL di ddH2O sterile a ciascun pozzetto e lavare per 5 minuti su uno shaker, ripetere 2 volte.
- Posizionare la piastra a 12 pozzetti con la soluzione rimossa in una cappa aspirante e asciugare all'aria per 20 minuti fino a quando non ci sono filigrane visibili.
- Aggiungere 1 mL di soluzione di lavoro Oil Red O appena preparata in ogni pozzetto e agitare per 20 minuti sullo shaker, quindi rimuovere la soluzione di lavoro Oil Red O.
- Aggiungere 2 mL di ddH2O sterile a ciascun pozzetto e lavare per 5 minuti, ripetendo questo passaggio 3 volte. Dopodiché, mantieni l'aorta in ddH2O.
- Posizionare l'aorta su un vetrino e stenderla sotto uno stereomicroscopio. Per migliorare il contrasto, posiziona un cuscinetto di gomma nera sotto il carrello.
- Posiziona la diapositiva su un foglio bianco per migliorare ulteriormente il contrasto, con un righello posizionato accanto ad essa, e scatta una foto utilizzando una fotocamera. Per mantenere l'aorta umida, conservare l'aorta trattata in una provetta da centrifuga da 1,5 ml contenente 1 ml di PBS.
5. Analisi delle immagini dell'arco aortico
- Aprire l'immagine aortica acquisita su un computer dotato del software Image J.
- Selezionare l'area con un riquadro rettangolare, ad esempio 450 pixel x 900 pixel, che contiene l'intera aorta, e salvarla come nuova immagine .tiff.
- Apri l'immagine .tiff appena salvata in Immagine J. Fai clic su Modifica > Inverti, quindi seleziona Immagine e fai clic su Tipo > stack RGB.
- Vai su Immagine, fai clic su Pile > Pile su Immagini, quindi scegli quella verde con il miglior contrasto.
- Vai su Immagine, fai clic su Regola > luminosità/contrasto. Modificare il valore minimo a circa 200, ridurre a icona lo sfondo mantenendo sfondi simili per ogni immagine, quindi fare clic su Applica.
- Vai su Analizza e seleziona Imposta misurazione. Selezionare Area, Frazione area, Limita alla soglia e Visualizza etichetta, quindi fare clic su OK.
- Vai su Analizza, seleziona Misurazione e copia il risultato in un foglio di calcolo.
- Vai su Analizza, fai clic su Strumento > ROI Manager, quindi scegli la parte dell'arco dell'aorta con una casella rettangolare. Vai su ROI Manager e seleziona Aggiungi [t], quindi Misura. Copia i risultati misurati in un foglio di calcolo.
- Analizzare l'area misurata nei gruppi di topi in base al test di normalità. Un p < 0,05 indica che la differenza è statisticamente significativa.
NOTA: Selezionare il metodo statistico appropriato in base al disegno dell'esperimento.
6. Inclusione di paraffina del cuore
- Rimuovere l'apice del cuore e assicurarsi che l'incisione sia diritta e allineata con la direzione della radice della valvola (Figura 1B).
- Metti ogni campione di cuore singolarmente in una scatola di paraffina e segna la scatola con una matita.
- Nella cappa aspirante, posizionare la cassetta con il fazzoletto incorporato in paraffina in un contenitore vuoto e sciacquare la scatola di inclusione con acqua corrente per 3 minuti.
- Eseguire la disidratazione dei tessuti utilizzando etanolo con gradienti di concentrazione crescenti come segue: etanolo al 50% per 2 ore, etanolo al 75% per 30 minuti, etanolo all'85% per 30 minuti, etanolo al 95% per 30 minuti ed etanolo al 100% per 10 minuti. Ripetere i passaggi cambiando l'etanolo ad ogni passaggio.
- Eseguire la trasparenza dei tessuti con lo xilene come segue: miscela 1:1 di xilene ed etanolo per 20 minuti, xilene per 15 minuti, ripetere l'operazione 1 volta cambiando lo xilene.
- Sciogliere la cera di paraffina in forno a 60 °C in anticipo. Trattare i campioni con una miscela di xilene e paraffina per 30 minuti, seguita da cera morbida di paraffina per 2 ore e poi cera dura di paraffina per 1 ora.
ATTENZIONE: L'etanolo è un solvente organico infiammabile e volatile. Lo xilene è moderatamente tossico e richiede protezione quando viene utilizzato. - Inclusione di paraffina
- Seleziona lo stampo di dimensioni appropriate, accendilo e riscalda preventivamente la macchina per l'inclusione.
- Dopo aver aggiunto la cera di paraffina fusa allo stampo, estrarre il tessuto dalla cassetta di inclusione e posizionarlo, con la superficie di taglio rivolta verso il basso, nella parte inferiore centrale dello stampo utilizzando una pinza precedentemente riscaldata.
- Dopo che lo stampo si è raffreddato su un tavolo da congelatore e la paraffina all'interno si è solidificata, posizionare il coperchio della cassetta di inclusione indicato sopra lo stampo e riempirlo con la quantità necessaria di paraffina.
- Una volta che la cera di paraffina si è raffreddata e solidificata, rimuovere il blocco dallo stampo e conservarlo in frigorifero a 4 °C (Figura 1D).
7. Sezioni di paraffina della radice aortica
- Pulire l'eccesso di paraffina che circonda il coperchio della cassetta di inclusione, quindi fissare saldamente il blocco di paraffina al clamp sede situato sulla testa dell'affettatrice per paraffina. Regolare il blocco in una posizione leggermente sfalsata rispetto al punto in cui verrà tagliata la fetta, assicurandosi che la sezione di tessuto all'interno del blocco di paraffina sia parallela al tagliente della lama. Per il primo sezionamento, impostare lo spessore della fetta a 10 μm in modo da rivelare la posizione del tessuto.
- Quando la prima incisione viene rilevata al microscopio, regolare lo spessore della fetta a 6 μm ed eseguire il sezionamento seriale. Tagliare, affettare e prelevare le sezioni nell'affettatrice fino a quando tre valvole aortiche intatte sono visibili al microscopio, a quel punto inizia la preparazione per il sezionamento. Lasciare una fetta a intervalli di 6 μm per ogni mouse e posizionare diverse posizioni della fetta su diversi supporti di vetro, ad esempio la sezione 1-11-21-31, per ottenere una panoramica corretta.
- Far galleggiare le sezioni su uno spandiconcime contenente acqua tiepida a 37 °C per stendere il tessuto in piano e quindi prelevare il tessuto con un vetrino. Dopo aver atteso che l'acqua si asciughi, adagiare le fette su un tostapane a 42 °C per una notte.
- L'area media della placca di queste 8 sezioni rappresenta il valore dell'area della placca radicolare aortica in ciascun topo. Dopo aver colorato queste sezioni, misurare l'area media della placca e l'area della placca.
8. Colorazione con ematossilina eosina
- Mettere le fette in un essiccatore a 60 °C per 30 min. In una cappa aspirante, utilizzando una rastrelliera per colorare, posizionare le sezioni in sequenza nello xilene per 10 minuti (ripetere questo passaggio una volta, cambiando lo xilene), in etanolo al 100% per 5 minuti (ripetere questo passaggio, cambiando l'etanolo), nell'etanolo al 95% per 5 minuti, nell'etanolo all'85% per 5 minuti e nell'etanolo al 75% per 5 minuti.
- Risciacquare con acqua corrente per 5 min. Immergere le sezioni nella macchia di ematossilina per 8 minuti e sciacquare sotto l'acqua corrente.
- Differenziare le sezioni con alcool acido cloridrico all'1% per alcuni secondi e risciacquare con acqua corrente e osservare che le sezioni diventano blu viola al microscopio.
- Immergere le sezioni in una soluzione colorante di eosina per 5 minuti. Mettere le sezioni in etanolo al 95% per 7 tuffi e poi in etanolo al 100% per 30 s.
- Chiarificare in xilene per almeno 30 s. Sigillare i vetrini con gomma neutra, fotografare al microscopio e salvare immagini ad alta risoluzione, preferibilmente in formato .tiff.
9. Colorazione Verhoeff-Van Gieson (VVG)
- Eseguire la deceratura e la reidratazione di routine sulle sezioni di paraffina, seguendo gli stessi passaggi descritti nelle sezioni 8.1 e 8.2.
- Dopo aver risciacquato brevemente in etanolo al 70%, immergere le sezioni nella soluzione colorante Victoria Blue'B per 15 minuti.
- Differenziare le sezioni per alcuni secondi in etanolo al 95%. Lavare le sezioni 2 volte con acqua distillata.
- Colorare le sezioni con la soluzione colorante Ponceau per 5 minuti mediante applicazione di goccioline. Differenziare e disidratare le sezioni utilizzando etanolo al 100%.
NOTA: Dopo la colorazione del Ponceau, evitare qualsiasi contatto con l'acqua. - Chiarificare in xilene per almeno 30 s. Monta i vetrini con gomma neutra e fotografali al microscopio.
10. Analisi dell'immagine della placca radicolare aortica
- Aprire l'immagine su un computer dotato del software Image J. Seleziona uno strumento casella per inscatolare la targa.
- Vai su Immagine, fai clic su Sovrapponi > Aggiungi selezione, quindi su Misura per misurare l'area della targa. Copia i risultati misurati in un foglio di calcolo.
- Analizzare l'area misurata nei gruppi di topi in base al test di normalità. Un p < 0,05 indica che la differenza è statisticamente significativa.
Risultati
I risultati rappresentativi dimostrano l'applicazione della tecnica di isolamento e analisi per le lesioni dell'arco aortico e della radice in un modello murino aterosclerotico. Questi risultati forniscono una chiara evidenza della capacità della tecnica di identificare e caratterizzare le lesioni aterosclerotiche. Ad esempio, le immagini istologiche con colorazioni specifiche (ad esempio, Oil Red O) evidenziano l'accumulo di lipidi, mentre la colorazione con ematossilina ed eosina (H&E) rivela la morfologia complessiva delle lesioni aterosclerotiche, compresa la struttura della parete arteriosa, la presenza di nuclei lipidici e le aree di necrosi. Analizzando le sezioni colorate con H&E, possiamo valutare l'entità dello sviluppo della lesione e i cambiamenti strutturali nell'aorta, fornendo una panoramica della progressione della placca e del rimodellamento tissutale.
In questo protocollo, abbiamo analizzato l'estensione delle lesioni aterosclerotiche in topi knockout per C57 Ldlr di 12 settimane alimentati con una dieta di tipo occidentale (WTD) per 4 mesi e in topi Ldlr-/- alimentati con una dieta Chow come controlli.
Dopo 12 settimane di dieta Chow e dieta occidentale, i topi knockout per Ldlr nel gruppo della dieta occidentale avevano un peso corporeo significativamente elevato rispetto al gruppo di controllo. Inoltre, anche i livelli lipidici nel gruppo della dieta occidentale sono stati modificati, con livelli significativamente più elevati di trigliceridi plasmatici (TG) e colesterolo totale (TC), dove TG e TC sono stati rilevati mediante saggio di immunoassorbimento enzimatico prelevato dal sangue della coda dei topi (Figura 2).
I risultati della colorazione con O rosso dell'olio aortico nei topi knockout per Ldlr alimentati con la dieta occidentale, che hanno mostrato un grave accumulo di lipidi e lesioni aterosclerotiche rispetto ai topi alimentati con la dieta chow, indicano che più depositi lipidici sulle arterie corrispondono a lesioni aterosclerotiche più gravi (Figura 3).
Nelle sezioni radicolari aortiche, un'area più ampia di placca e nuclei necrotici implica una lesione aterosclerotica più grave. Qui, è stato dimostrato che l'area lesionale della radice aortica e il nucleo necrotico sono molto più grandi nei topi alimentati con dieta occidentale rispetto ai topi alimentati con dieta Chow (Figura 4A). La colorazione VVG delle sezioni di paraffina della radice aortica è stata eseguita per valutare l'area malata della radice aortica; Le fibre elastiche erano bluastre-violacee e le fibre di collagene di solito proliferavano per formare un cappuccio fibroso e apparivano rosse. La colorazione VVG aiuta a vedere se c'è distruzione o riduzione delle fibre elastiche, ispessimento della parete del vaso e deposito di fibre di collagene anormali, che possono essere un segno di infiammazione o rimodellamento patologico. Qui, ha mostrato le tendenze dell'aumento delle fibre di collagene nel cappuccio fibroso nella radice aortica dei topi alimentati con dieta occidentale rispetto a quello dei topi alimentati con dieta Chow (Figura 4B). La quantificazione dell'area lesionale della radice aortica e dell'area necrotica ha dimostrato che la dieta occidentale peggiora lo stato aterosclerotico nei topi knockout per Ldlr (Figura 4C).

Figura 1: Fasi per l'isolamento e l'analisi delle lesioni dell'arco aortico e della radice. (A) Isolamento dell'aorta e del cuore. (B) Preparazione della radice aortica. Il tessuto cardiaco tra le due linee tratteggiate è stato tagliato. (C) Fissazione e pretrattamento dell'arco aortico. (D) Inclusione di paraffina del cuore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Variazioni del peso corporeo e dei livelli di lipidi nel sangue di topi del gruppo di controllo e WTD alimentati per 12 settimane. (A) Curva del peso corporeo durante l'alimentazione con CD e WTD. (B) Trigliceridi plasmatici (TG). (C) Colesterolo totale (TC) (n=4). I risultati sono espressi come media ± SEM, la significatività è stata valutata mediante t-test di Student. p < 0,001, **** p < 0,0001. Clicca qui per visualizzare una versione più grande di questa figura.
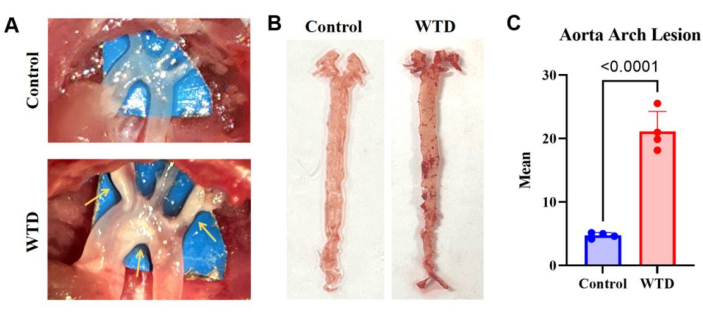
Figura 3: L'arco aortico e la sua colorazione e analisi Oil Red O. (A) Immagini rappresentative delle placche aterosclerotiche nell'arco aortico. Gli archi aortici dei topi Ldlr-/- alimentati con una dieta Chow sono stati osservati al microscopio senza placche visibili, mentre gli archi aortici dei topi Ldlr-/- alimentati con una dieta occidentale sono stati osservati al microscopio con placche visibili. (B) Immagini rappresentative della colorazione con O rosso dell'olio aortico. L'intera aorta di topi Ldlr-/- alimentati con una dieta Chow senza accumulo di lipidi, e l'intera aorta di topi Ldlr-/- alimentati con una dieta occidentale per 4 mesi presentava placche visibili nell'arco aortico (n=4). (C) Numero medio di lesioni dell'arco aortico. I risultati sono espressi come media ± SEM e la significatività è stata valutata mediante il t-test di Student. p < 0,001, **** p < 0,0001. Clicca qui per visualizzare una versione più grande di questa figura.
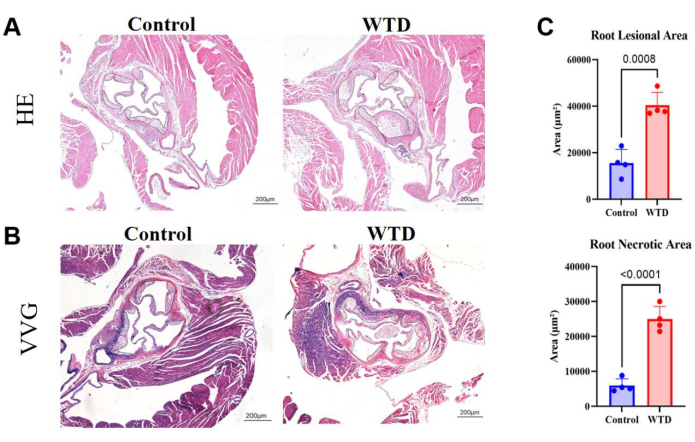
Figura 4: Sezioni di radice aortica colorate con HE e VVG, con quantificazione dell'area della placca e dell'area necrotica. (A) Sezioni rappresentative di ematossilina e radice aortica colorate con eosina. Radici aortiche di topi Ldlr-/- sottoposti rispettivamente a interventi di dieta Chow e dieta occidentale. (B) Sezioni di radice aortica colorate con Verhoeff-Van Gieson. Le radici aortiche dei topi Ldlr-/- sottoposti rispettivamente a interventi di dieta Chow e dieta occidentale, sono cerchiate in nero e sono lesioni aterosclerotiche nei topi. (C) La quantificazione dell'area lesionale della radice aortica e dell'area necrotica (n=4). I risultati sono espressi come media ± SEM e la significatività è stata valutata mediante il t-test di Student. p < 0,001, **** p < 0,0001. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Qui, forniamo informazioni dettagliate sui metodi di campionamento aortico nei topi knockout Ldlr e sull'analisi quantitativa delle placche.
La precisione della procedura di dissezione è la più grande sfida tecnica per lo stripping aortico in vivo nel modello murino di aterosclerosi. Sulla base della nostra esperienza, i punti chiave sono i seguenti: (1) utilizzare il PBS per lavare via tutto il sangue nell'arteria per aumentare il confronto tra i rami dell'arco aortico e il grasso perivascolare. (2) Sii paziente. A causa delle piccole dimensioni dell'aorta di topo, la procedura deve essere eseguita al microscopio corporeo e utilizzando tosatrici e pinze microscopiche di alta qualità per ridurre al minimo gli errori nell'operazione. (3) È imperativo garantire che lo strippaggio sia iniziato con precisione e nella giusta direzione per evitare tagli o danni alla nave.
Per quanto riguarda la colorazione con O rosso dell'olio aortico nei topi, il grasso periferico dell'aorta di topo isolata deve essere rimosso al microscopio prima della colorazione formale e l'integrità del tessuto deve essere mantenuta per evitare di influenzare i risultati della colorazione. Il processo di tintura rosso olio richiede un controllo preciso sul tempo di tintura; Sia durate eccessive che insufficienti possono compromettere l'effetto tintorio, con conseguenti risultati imprecisi.
Nell'inclusione delle radici aortiche di topo, il tempo di disidratazione del tessuto deve essere controllato per evitare la rottura dei tessuti durante il sezionamento. Le sezioni della radice aortica devono essere di spessore uniforme per garantire una colorazione uniforme e sezioni troppo sottili o troppo spesse possono interferire con l'osservazione. Allo stesso tempo, è necessario determinare con precisione dove appare la valvola tricuspide quando viene osservata al microscopio. Il processo di colorazione con ematossilina eosina richiede un controllo preciso del tempo di colorazione e della concentrazione della soluzione colorante al fine di evitare colorazioni aspecifiche.
Rispetto agli eccellenti metodi esistenti per valutare l'aterosclerosi, questo protocollo ha fornito dettagli passo-passo per sezionare sia l'arco aortico che la radice, che possono aiutare a valutare in modo completo lo stato aterosclerotico11,13 Sia la colorazione ematossilina-eosina che la colorazione VVG possono aiutare a valutare l'area lesionale della radice aortica, aumentando l'accuratezza della quantificazione dell'aterosclerosi.
Tuttavia, ci sono ancora alcune limitazioni della colorazione con O rosso dell'olio aortico. Ad esempio, la colorazione rosso olio viene utilizzata principalmente per rilevare i lipidi, ma ha una scarsa specificità per altri tipi di componenti cellulari o tissutali11, il che può portare a una classificazione errata. D'altra parte, il processo di fissazione e dissezione del campione può portare alla perdita di lipidi, compromettendo così l'affidabilità dei risultati della colorazione. Per quanto riguarda la colorazione ematossilina-eosina della radice aortica, è limitata nella differenziazione delle componenti cellulari e può essere difficile identificare aree specifiche della lesione nei casi di struttura tissutale complessa. Quando si eseguono analisi quantitative, i risultati statistici dell'area del cerotto possono anche essere influenzati dal giudizio soggettivo dell'osservatore. Inoltre, la colorazione con ematossilina-eosina fornisce principalmente informazioni morfologiche e non fornisce informazioni sulla funzione cellulare o sulla caratterizzazione molecolare.
Oltre alla colorazione standard con rosso olio e alla colorazione con ematossilina-eosina, altre tecniche per l'analisi delle placche aterosclerotiche includono la colorazione di Masson, la colorazione immunoistochimica per vari antigeni e altri metodi che possono essere impiegati per esaminare la composizione e le dimensioni della placca. La colorazione O rosso olio delle sezioni della radice aortica è anche ampiamente utilizzata per analizzare la deposizione di lipidi nella radice aortica14. La colorazione Alizarin Red S è un colorante comunemente usato per rilevare i depositi di calcio; Forma un complesso rosso con ioni calcio, rendendolo ideale per visualizzare i depositi di calcio15. Inoltre, il metabolismo dei lipidi può essere dedotto da marcatori biochimici sierici come i livelli di lipoproteine ad alta densità (HDL), lipoproteine a bassa densità (LDL), colesterolo totale (TC) e triacilglicerolo totale (TG). Uno dei fattori chiave che contribuiscono allo sviluppo dell'aterosclerosi è l'anormale metabolismo dei lipidi, in particolare la relazione tra aterosclerosi e malattie cardiovascolari (ASCVD) e i livelli di colesterolo LDL (lipoproteine a bassa densità).
Con l'approfondimento della ricerca sull'aterosclerosi, lo sviluppo futuro dei metodi di analisi quantitativa diventerà più preciso e diversificato. In primo luogo, l'integrazione di tecnologie di imaging avanzate, come la risonanza magnetica ad alta risoluzione, la tomografia a coerenza ottica (OCT) e l'imaging a ultrasuoni, renderà l'analisi quantitativa dell'aterosclerosi più accurata, consentendo il monitoraggio dinamico di topi vivi. Ciò contribuirà alla valutazione in tempo reale della progressione della placca, della stabilità e della risposta al trattamento. Con il progresso delle tecnologie di imaging molecolare, l'analisi quantitativa consentirà un'analisi approfondita delle risposte infiammatorie, dell'accumulo di lipidi e dei componenti cellulari all'interno delle placche, fornendo dati più completi per la diagnosi precoce e il trattamento dell'aterosclerosi16.
Divulgazioni
Nulla da dichiarare.
Riconoscimenti
Questo lavoro è stato supportato dalla Shanghai Frontiers Science Research Base of Exercise and Metabolic Health, dal programma di ricerca sull'esercizio fisico e la salute pubblica (0831) presso l'Università dello Sport di Shanghai, dal programma di finanziamento per la formazione di giovani insegnanti dell'istruzione superiore di Shanghai (A2-0213-22-0058-5) e dal piano per i leader accademici eccezionali del Comitato municipale di Shanghai per la scienza e la tecnologia di Shanghai (21XD1403200) per Longhua Liu.
Materiali
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides(25×75mm) | CITOTEST | Cat# 80312-3161 | |
| Embedding cassette | CITOTEST | Cat# 80106-1100-16 | |
| Eosin Staining Solution | Beyotime | Cat# C0109 | |
| Ethanol | Sinopharm Chemical Reagent Co. | Cat# 10009218 | |
| Hematoxylin Staining Solution | Beyotime | Cat# C0107 | |
| Low-profile disposable blades | Leica | Cat# 14035838925 | |
| Microscope cover glass(24×50mm) | CITOTEST | Cat# 10212450C | |
| Neutral Balsam Mounting Medium | Sango Biotech | Cat# E675007-0100 | |
| Oil red o powder | Sigma-Aldrich | Cat# 1320-06-5 | |
| paraffin with ceresin | Sinopharm Chemical Reagent Co. | Cat# 69019461 | |
| Paraformaldehyde | Servicebio | Cat# G1101 | |
| Phosphate Buffered Saline (PBS, Powder) | Servicebio | Cat# G0002-2L | |
| Ponceau S Staining Solution | EveryLab | Cat# FM024 | |
| Victoria Blue’B | Aladdin | Cat# 2580-56-5 | |
| Xylene | Sigma-Aldrich | Cat# 104-81-4 |
Riferimenti
- Libby, P., et al. Atherosclerosis. Nat Rev Dis Primers. 5 (1), 56 (2019).
- Herrington, W., Lacey, B., Sherliker, P., Armitage, J., Lewington, S. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease. Circ Res. 118 (4), 535-546 (2016).
- Frostegård, J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 11, 117 (2013).
- Gisterå, A., Ketelhuth, D. F. J., Malin, S. G., Hansson, G. K. Animal models of atherosclerosis-supportive notes and tricks of the trade. Circ Res. 130 (12), 1869-1887 (2022).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 32 (5), 1104-1115 (2012).
- Ilyas, I., et al. Mouse models of atherosclerosis in translational research. Trends Pharmacol Sci. 43 (11), 920-939 (2022).
- Liu, L., Chan, M., Yu, L., Wang, W., Qiang, L. Adipsin deficiency does not impact atherosclerosis development in ldlr(-/-) mice. Am J Physiol Endocrinol Metab. 320 (1), E87-E92 (2021).
- Liu, L., et al. Pparγ deacetylation confers the antiatherogenic effect and improves endothelial function in diabetes treatment. Diabetes. 69 (8), 1793-1803 (2020).
- Zahr, T., et al. Pparγ (peroxisome proliferator-activated receptor γ) deacetylation suppresses aging-associated atherosclerosis and hypercholesterolemia. Arterioscler Thromb Vasc Biol. 43 (1), 30-44 (2023).
- Tang, C., et al. Endothelial ccrl2 induced by disturbed flow promotes atherosclerosis via chemerin-dependent β2 integrin activation in monocytes. Cardiovasc Res. 119 (9), 1811-1824 (2023).
- Andrés-Manzano, M. J., Andrés, V., Dorado, B. Oil red o and hematoxylin and eosin staining for quantification of atherosclerosis burden in mouse aorta and aortic root. Methods Mol Biol. 1339, 85-99 (2015).
- Mehlem, A., Hagberg, C. E., Muhl, L., Eriksson, U., Falkevall, A. Imaging of neutral lipids by oil red o for analyzing the metabolic status in health and disease. Nat Protoc. 8 (6), 1149-1154 (2013).
- Chen, P. Y., Qin, L., Simons, M. Imaging and analysis of oil red o-stained whole aorta lesions in an aneurysm hyperlipidemia mouse model. J Vis Exp. (183), e61277 (2022).
- Lin, Y., et al. Practical assessment of the quantification of atherosclerotic lesions in apoe-/- mice. Mol Med Rep. 12 (4), 5298-5306 (2015).
- Bozycki, L., Łukasiewicz, K., Matryba, P., Pikula, S. Whole-body clearing, staining and screening of calcium deposits in the mdx mouse model of duchenne muscular dystrophy. Skelet Muscle. 8 (1), 21 (2018).
- Glaudemans, A. W., et al. Molecular imaging in atherosclerosis. Eur J Nucl Med Mol Imaging. 37 (12), 2381-2397 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon