Method Article
动脉粥样硬化小鼠模型中主动脉弓和根部病变的分离和分析
摘要
该方案为动脉粥样硬化斑块的定量分析提供了一种全面的方法,以促进对动脉粥样硬化的机制和进展的更深入研究。
摘要
动脉粥样硬化是心血管疾病的主要原因,需要详细检查病变的发展和进展。本研究介绍了一种全面的方案,用于分离和组织学分析广泛使用的动脉粥样硬化小鼠模型,即低密度脂蛋白受体敲除 (Ldlr-/-) 小鼠的主动脉弓和根部病变。主动脉弓和根部是动脉粥样硬化病变的关键部位,它们的检查对于评估动脉粥样硬化的发生、进展或消退、预测心血管事件风险和确定潜在的治疗靶点至关重要。该方案概述了量化主动脉弓和根部动脉粥样硬化负荷的方法,包括组织分离、固定、油红 O 染色、主动脉根部切片、苏木精和伊红 (HE) 染色、Verhoeff-Van Gieson (VVG) 染色和图像分析。油红 O 染色测量主动脉弓中的斑块区域,评估动脉粥样硬化的严重程度,而主动脉根部的 HE 染色显示脂质核心和纤维帽等斑块成分,有助于评估斑块稳定性和破裂风险。VVG 染色可以对组织内的胶原纤维进行染色,从而进一步了解斑块组成和相关信息。这种全面的分析为病变发展的机制提供了有价值的见解,并可能指导制定预防和治疗动脉粥样硬化的新型治疗策略。
引言
心血管疾病,尤其是动脉粥样硬化,已成为全球重大的健康负担和主要死亡原因 1,2。动脉粥样硬化是一种慢性进行性炎症性疾病,其特征是脂质逐渐积累并在动脉壁中形成斑块,最终导致动脉腔变窄,并可能导致斑块破裂,引发急性心血管事件,如心肌梗塞和中风 1,2,3.鉴于动脉粥样硬化对人类健康的深远影响,迫切需要了解动脉粥样硬化的潜在机制并制定有效的治疗策略。
近年来,动物模型在促进我们对动脉粥样硬化的理解方面发挥了至关重要的作用。在各种物种中,小鼠因其快速繁殖、维护成本低以及先进的遗传作技术的可用性而成为首选模型 4,5。特别是,LDL 受体敲除 (Ldlr-/-) 小鼠和 ApoE-/- 小鼠已被广泛用于模拟人类动脉粥样硬化,因为它们表现出相似的病理生理学特征 4,5,6,7,8,9。
小鼠的动脉粥样硬化病变可发生在主动脉的不同位置,但它们特别容易发生在与血流动力学密切相关的区域,例如主动脉根部、主动脉弓和头臂干,而降主动脉受到的影响相对较小10。为了准确评估小鼠模型中的动脉粥样硬化病变负荷,评估斑块的存在、大小和阶段,从而研究不同药物或因素对动脉粥样硬化发生、进展和消退的影响,组织学染色技术和影像学分析的结合是必不可少的11。油红 O 染色是一种行之有效的方法,专门对中性脂质和脂蛋白12 进行染色,直接显示主动脉弓中斑块的形成13。同时,主动脉根部的苏木精-曙红 (HE) 染色不仅描绘了斑块区域,还提供了详细的结构特征,例如纤维帽和脂质坏死核心。这些细节对于评估斑块稳定性和预测斑块破裂的风险至关重要11。这些技术共同促进了动脉粥样硬化病变严重程度和进展的全面评估。
该方案以 C57BL6/J Ldlr - /- 小鼠喂养 Chow 饮食和西方饮食为例,旨在为使用主动脉弓油红 O 染色和石蜡包埋的主动脉根部切片 HE 染色评估小鼠动脉粥样硬化病变负荷提供详细的分步指南,然后进行图像分析。该方案涵盖了主动脉分离和固定、石蜡包埋和切片、染色程序和图像分析的所有方面,同时结合了关键步骤的作细节和注意事项,确保结果的可重复性和可靠性。通过遵循该方案,研究人员可以准确有效地评估治疗干预的疗效,并深入了解动脉粥样硬化的潜在机制。
研究方案
本研究中使用的所有动物方案均已获得上海体育学院动物实验伦理审查委员会的批准。
1. 试剂和解剖工具的制备
- 提前通过高压灭菌器对解剖工具进行消毒,包括细剪刀、直镊子、弯曲镊子、弹簧剪刀和销钉。
- 75% 乙醇:将 75 mL 无水乙醇与 25 mL ddH2O 混合。
- 1x 磷酸盐缓冲盐水 (PBS):将 0.01 M PBS 粉末溶解在 2 L ddH2O 中。
- 4% 多聚甲醛 (PFA) 溶液:在通风橱中的磁力搅拌器上将 800 mL 1x PBS 加热至约 60 °C。缓慢加入 40 g 多聚甲醛粉,不断搅拌。用 1N NaOH 滴定直至完全溶解。冷却至室温,用 1x PBS 将体积调节至 1 L,过滤,并将 pH 值调节至 7.2-7.4。
注意:PFA 是一种危险化学品,需要小心处理并严格遵守安全规程。 - 油红O贮藏液:将2.5 g油红O粉溶于500 mL 100%异丙醇中,密封在棕色瓶中,并储存在4°C的冰箱中长期储存。
注意:异丙醇是一种有毒有害的化学物质;因此,为了确保健康和安全,必须佩戴必要的个人防护设备 (PPE),包括手套。 - 油红 O 的工作溶液:将储备液和无菌 ddH2O 以 3:2 的比例混合。每次使用时准备新鲜的溶液,并用 0.22 μm 无菌注射器过滤器或大滤纸过滤溶液。
- Victoria Blue'B 染色液:将 0.5 g Victoria Blue'B 溶于 100 mL 70% 乙醇中。
2. 主动脉和心脏的隔离
- 在温度控制的环境中,以每个笼子 3-5 只动物的方式饲养所有小鼠,光照/黑暗循环 12 小时,并喂养含有 0.2% 胆固醇和 21.2% 脂肪的标准食物 (食物) 或西式饮食 (WTD)。选择 C57BL6/J LDLr-/-雄性小鼠,这些小鼠年龄为 12 周龄,体重在 25 至 30 g 之间。在 CO2 室中处死小鼠。
- 解剖前,将小鼠仰卧位(腹侧朝上)放在覆盖有 1-2 层吸水纸的泡沫板上,并用别针固定四肢。
- 将 75% 乙醇喷洒在小鼠的腹部,以清洁和润湿皮毛。
- 用镊子抓住小鼠的腹侧皮肤,用细剪刀从腹部底部剪下皮肤到颈部顶部。
- 打开腹壁,然后用镊子抬起胸骨,切开横膈膜和肋骨,露出胸腔。
- 切除食道和气管,这将更容易清洁颈动脉。切除器官,包括肝脏、肺、脾脏、胃肠道和胰腺,同时保留位于腹膜后面的肾脏和脊柱旁边的腹主动脉。解剖肠系膜动脉时,一定要抬起肠道并在远离主动脉的地方切开,以免损坏腹主动脉。
- 为了提供清晰的观察区域,将小鼠置于立体显微镜下,并将冷光源对准解剖区域。
- 用 0.45 x 15 (II) RWLB 针头将装有 PBS 的 10 mL 注射器缓慢注入左心室心尖,观察主动脉扩张情况。
- 用薄纸轻轻擦去解剖区域的血液和液体,以充分暴露视野。
- 胸主动脉很容易暴露。以此为突破口,用镊子抓住附着在胸主动脉末端的膈段,用弹簧剪刀切开主动脉和胸肌壁之间的结缔组织。
- 用镊子轻轻拉动心脏并提起胸主动脉,观察主动脉弓的分支,并沿胸主动脉向上解剖主动脉弓及其分支周围的外膜脂肪和结缔组织。
注意:小心,保持主动脉完整,避免撕裂或受伤,并彻底去除周围的脂肪和结缔组织。此步骤需要反复练习才能熟练作。 - 沿胸主动脉向下解剖腹主动脉和髂总动脉。
- 切开髂总动脉分叉处以下 1-2 mm,沿脊柱修剪主动脉的小分支以释放它,分离肾脏附近的肾动脉,从远端切断颈部的三个分支血管,最后切开心脏附近的升主动脉。
- 在解剖主动脉弓之前,放置一个与下方血管形成鲜明对比的深色小垫圈,并拍摄主动脉弓区域。
- 修剪心脏组织,并沿平行于心房的平面切开心脏的下半部分。修复修剪的心(图 1A)。
3. 主动脉弓的固定和预处理
- 提前在 1.5 mL 离心管中制备 1 mL 4% PFA 溶液。
- 将主动脉放入管中并在室温下固定至少 24 小时。
注:主动脉可在 4% PFA 中保存长达 1 个月,而不会影响油红 O 染色的质量。为了保持其正常配置,在固定前将组织放在橡胶上可能是一个合适的选择。 - 将主动脉转移到含有 PBS 的培养皿中,以防止其变干。在立体显微镜下,使用镊子和弹簧剪刀小心地去除在解剖过程中未完全剥离的任何残留外膜脂肪,以减少对主动脉内斑块定量的干扰。
- 用弹簧剪刀沿其内纵轴小心地切开主动脉,然后沿外侧依次切开主动脉弓的三个分支,直至主动脉弓的曲率水平,使其完全展开(图 1C)。
- 在此阶段,用于油红 O 染色或储存在 4% PFA 中。
4. 主动脉弓油红 O 染色
- 将切开的主动脉放入 12 孔板中。向每个孔中加入 1 mL 无菌 ddH2O,并在振荡器上洗涤 5 分钟,重复 2 次。
- 将装有去除溶液的 12 孔板放入通风橱中,风干 20 分钟,直到没有可见的水印。
- 向每个孔中加入 1 mL 新鲜制备的 Oil Red O 工作溶液,在摇床上摇动 20 分钟,然后取出 Oil Red O 工作溶液。
- 向每个孔中加入 2 mL 无菌 ddH2O 并洗涤 5 分钟,重复此步骤 3 次。之后,将主动脉保持在 ddH2O 中。
- 将主动脉放在载玻片上,并在立体显微镜下展开。为了增强对比度,请在载玻片下方放置一个黑色橡胶垫。
- 将幻灯片放在白纸上以进一步增强对比度,并在其旁边放置一把尺子,然后使用相机拍摄照片。为了保持主动脉湿润,将处理过的主动脉储存在含有 1 mL PBS 的 1.5 mL 离心管中。
5. 主动脉弓的图像分析
- 在配备 Image J 软件的计算机上打开捕获的主动脉图像。
- 选择包含整个主动脉的带有矩形框的区域,例如 450 像素 x 900 像素,并将其另存为新的.tiff图片。
- 在图像 J 中打开新保存的 .tiff 图片。单击 编辑>反转,然后选择图像并单击 类型 > RGB 堆栈。
- 前往 图片,点击 堆栈 > 堆栈到图像,然后选择 绿色 对比度最好的。
- 前往 图片,点击 调整>亮度/对比度.将最小值更改为大约 200,最小化背景,同时保持每个图像的相似背景,然后单击 Apply。
- 转到 Analyze(分析),然后选择 Set Measurement(设置测量)。选择 面积(Area)、面积分数(Area Fraction)、限制为阈值(Limit to Threshold) 和 显示标签(Display Label),然后单击 确定(OK)。
- 转到 Analyze(分析),选择 Measurement(测量 )并将结果复制到电子表格中。
- 转到 Analyze(分析),单击 Tool > ROI Manager(ROI 管理器),然后选择带有矩形框的主动脉的 Arch(拱形)部分。转到 ROI Manager 并选择 Add [t] ,然后选择 Measure。将测量结果复制到电子表格中。
- 根据正常性测试分析小鼠组中测量的面积。p < 0.05 表示差异在统计意义上显著。
注意:根据实验设计选择合适的统计方法。
6. 心脏石蜡包埋
- 去除心脏的心尖,确保切口是直的,并与瓣膜根部的方向对齐(图 1B)。
- 将每个心脏样本单独放入石蜡包埋盒中,并用铅笔在盒子上做标记。
- 在通风橱中,将石蜡包埋盒和纸巾放入空容器中,然后用流水冲洗包埋盒 3 分钟。
- 使用乙醇进行组织脱水,浓度梯度增加如下:50% 乙醇 2 小时,75% 乙醇 30 分钟,85% 乙醇 30 分钟,95% 乙醇 30 分钟,100% 乙醇 10 分钟。通过在每个步骤中更换乙醇来重复步骤。
- 用二甲苯进行组织透明化,如下所示:二甲苯和乙醇的 1:1 混合物 20 分钟,二甲苯 15 分钟,通过更换二甲苯重复 1 次。
- 提前在 60 °C 的烘箱中熔化石蜡。用二甲苯和石蜡的混合物处理样品 30 分钟,然后石蜡软蜡处理 2 小时,然后石蜡硬蜡处理 1 小时。
注意:乙醇是一种易燃易挥发的有机溶剂。二甲苯具有中等毒性,使用时需要保护。 - 石蜡包埋
- 选择合适尺寸的模具,打开模具,然后预先加热包埋机。
- 将熔融的石蜡添加到模具中后,从包埋盒中取出组织,并使用事先加热的镊子将其切割面朝下放置在模具的中央底部。
- 当模具在冷冻台上冷却并且其中的石蜡凝固后,将指示的包埋盒盖放在模具顶部,并填充必要量的石蜡。
- 石蜡冷却并凝固后,从模具中取出块并将其保存在 4 °C 的冰箱中(图 1D)。
7. 主动脉根部石蜡切片
- 清除包埋盒盖周围多余的石蜡,然后将石蜡块牢固地固定在石蜡切片机头部的夹座上。将块调整到与切片要切割的位置略微偏移的位置,确保石蜡块内的组织切片与刀片的切割边缘平行。对于第一次切片,将切片厚度设置为 10 μm,以显示组织位置。
- 当在显微镜下发现第一个切口时,将切片厚度调整为 6 μm 并进行连续切片。在切片机中切割、切片和挑取切片,直到在显微镜下可以看到三个完整的主动脉瓣,此时开始准备切片。为每只鼠标以 6 μm 的间隔留下一个切片,并将不同的切片位置放在不同的玻璃载体上,例如,第 1-11-21-31 节,以获得正确的概述。
- 将切片漂浮在含有 37 °C 温水的撒布机上,使组织平铺,然后用载玻片拾取组织。等待水干燥后,将切片放在设置为 42 °C 的烤面包机上过夜。
- 这 8 个部分的平均斑块面积代表每只小鼠的主动脉根部斑块面积的值。对这些切片染色后,测量平均斑块面积和斑块面积。
8. 苏木精曙红染色
- 将切片放入 60 °C 的干燥机中 30 分钟。在通风橱中,使用染色架,将切片依次置于二甲苯中 10 分钟(重复此步骤一次,更换二甲苯),100% 乙醇 5 分钟(重复此步骤,更换乙醇),95% 乙醇 5 分钟,85% 乙醇 5 分钟和 75% 乙醇 5 分钟。
- 用流水冲洗 5 分钟。将切片浸入苏木精染色剂中 8 分钟,然后在流水下冲洗。
- 用 1% 盐酸醇区分切片几秒钟,然后用流水冲洗,观察切片在显微镜下变成蓝紫色。
- 将切片浸入伊红染色溶液中 5 分钟。将切片放入 95% 乙醇中浸泡 7 次,然后在 100% 乙醇中浸泡 30 秒。
- 在二甲苯中澄清至少 30 秒。使用中性胶密封载玻片,在显微镜下拍照,并保存高分辨率图像,最好是 .tiff 格式。
9. Verhoeff-Van Gieson (VVG) 染色
- 按照第 8.1 节和第 8.2 节中概述的相同步骤,对石蜡切片进行常规脱蜡和再水化。
- 在 70% 乙醇中短暂冲洗后,将切片浸入 Victoria Blue'B 染色溶液中 15 分钟。
- 在 95% 乙醇中区分切片几秒钟。用蒸馏水清洗切片 2 次。
- 通过液滴应用,用丽春红染色溶液对切片染色 5 分钟。使用 100% 乙醇区分和脱水切片。
注意:丽春红染色后,避免与水接触。 - 在二甲苯中澄清至少 30 秒。用中性胶安装载玻片并在显微镜下拍摄。
10. 主动脉根部斑块的图像分析
- 在装有Image J软件的计算机上打开图像。选择任何方框工具以框住板块。
- 转到图像,单击 叠加 > 添加选择,然后单击 测量 测量斑块的面积。将测量结果复制到电子表格中。
- 根据正态性检验分析小鼠组中测量的面积。p < 0.05 表示差异在统计意义上显著。
结果
代表性结果证明了分离和分析技术在动脉粥样硬化小鼠模型中主动脉弓和根部病变的应用。这些结果为该技术识别和表征动脉粥样硬化病变的能力提供了明确的证据。例如,具有特定染色剂(例如油红 O)的组织学图像突出了脂质积累,而苏木精和伊红 (H&E) 染色揭示了动脉粥样硬化病变的整体形态,包括动脉壁的结构、脂质核心的存在和坏死区域。通过分析 H&E 染色切片,我们可以评估主动脉病变发展的程度和结构变化,提供斑块进展和组织重塑的概述。
在该方案中,我们分析了 12 周龄 C57 Ldlr 敲除小鼠喂养西式饮食 (WTD) 4 个月和喂食 Chow 饮食作为对照的 Ldlr - / - 小鼠的动脉粥样硬化病变的范围。
在 Chow 饮食和西方饮食喂养 12 周后,与对照组相比,西方饮食组的 Ldlr 敲除小鼠体重显著升高。此外,西方饮食组的脂质水平也发生了变化,血浆甘油三酯 (TG) 和总胆固醇 (TC) 水平显着升高,其中 TG 和 TC 是通过从小鼠尾血中提取的酶联免疫吸附测定法检测到的(图 2)。
与用食物喂养的小鼠相比,用西方饮食喂养的 Ldlr 敲除小鼠的主动脉油红 O 染色结果显示严重的脂质积累和动脉粥样硬化病变,表明动脉上更多的脂质沉积对应于更严重的动脉粥样硬化病变(图 3)。
在主动脉根部切片中,较大面积的斑块和坏死核心意味着更严重的动脉粥样硬化病变。在这里,结果表明,西方饮食喂养的小鼠的主动脉根部病变面积和坏死核心比食物喂养的小鼠大得多(图 4A)。对主动脉根部的石蜡切片进行 VVG 染色,以评估主动脉根部的病变区域;弹性纤维呈蓝紫色,胶原纤维通常增殖形成纤维帽并呈红色。VVG 染色有助于帮助我们查看弹性纤维是否有破坏或减少、血管壁增厚和异常胶原纤维沉积,这可能是炎症或病理重塑的迹象。在这里,它显示了与 Chow 饮食喂养的小鼠相比,西方饮食喂养的小鼠主动脉根部纤维帽中胶原纤维增加的趋势(图 4B)。主动脉根部病变面积和坏死面积的量化确实表明,西方饮食使 Ldlr 敲除小鼠的动脉粥样硬化状态恶化(图 4C)。

图 1:分离和分析主动脉弓和根部病变的步骤。 (A) 主动脉和心脏的分离。(B) 主动脉根部的制备。将两条虚线之间的心脏组织切片。(C) 主动脉弓的固定和预处理。(D) 心脏的石蜡包埋。 请单击此处查看此图的较大版本。

图 2:对照组和 WTD 组小鼠饲喂 12 周的体重和血脂水平的变化。 (A) CD 和 WTD 饲喂的体重曲线。(B) 血浆甘油三酯 (TG)。(C) 总胆固醇 (TC) (n=4)。结果表示为 SEM ±平均值,通过学生 t 检验评估显着性。p < 0.001,**** p < 0.0001。 请单击此处查看此图的较大版本。
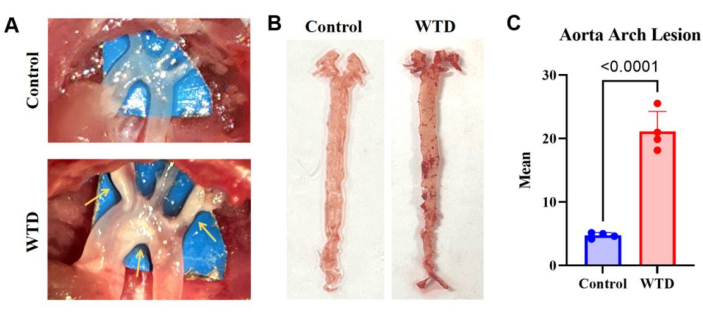
图 3:主动脉弓及其油红 O 染色和分析。 (A) 主动脉弓动脉粥样硬化斑块的代表性图像。在显微镜下观察到喂食 Chow Diet 的 Ldlr-/- 小鼠的主动脉弓,没有可见的斑块,而喂食西方饮食的 Ldlr-/- 小鼠的主动脉弓在显微镜下观察到可见斑块。(B) 主动脉油红 O 染色的代表性图像。来自 Ldlr-/- 小鼠的全主动脉喂食 Chow 饮食而没有脂质积累,来自 Ldlr-/- 小鼠喂食西方饮食 4 个月的全主动脉在主动脉弓中可见斑块。(C) 主动脉弓病变的平均数量。结果表示为 SEM ±平均值,并通过学生 t 检验评估显着性。p < 0.001,**** p < 0.0001。 请单击此处查看此图的较大版本。
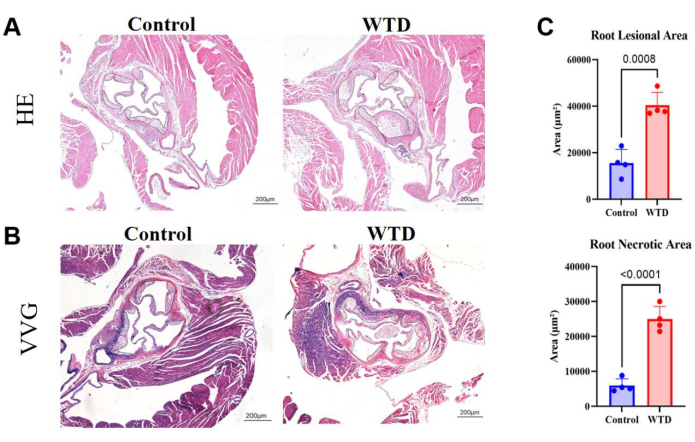
图 4:HE 和 VVG 染色的主动脉根部切片,斑块面积和坏死面积的量化。 (A) 代表性的苏木精和伊红染色的主动脉根部切片。分别接受 Chow 饮食和西方饮食干预的 Ldlr-/- 小鼠的主动脉根部。(B) 代表性 Verhoeff-Van Gieson 染色的主动脉根部切片。分别接受 Chow 饮食和西方饮食干预的 Ldlr - / - 小鼠的主动脉根部用黑色圈出,是小鼠的动脉粥样硬化病变。(C) 主动脉根部病变面积和坏死面积的量化 (n=4)。结果表示为 SEM ±平均值,并通过学生 t 检验评估显着性。p < 0.001,**** p < 0.0001。 请单击此处查看此图的较大版本。
讨论
在这里,我们提供了有关 Ldlr 敲除小鼠主动脉取样方法和斑块定量分析的详细信息。
解剖程序的精确性是动脉粥样硬化小鼠模型中体内主动脉剥离的最大技术挑战。根据我们的经验,关键点如下:(1) 用 PBS 洗掉动脉中的所有血液,以增加主动脉弓分支与血管周围脂肪的比较。(2) 要有耐心。由于小鼠主动脉体积小,手术必须在人体显微镜下进行,并使用高质量的显微剪刀和镊子,以尽量减少手术中的错误。(3) 必须保证汽提是在正确的方向上精确启动的,以防止对容器造成任何割伤或损坏。
关于小鼠主动脉油红O染色,正式染色前应先显微镜下去除离体小鼠主动脉的外周脂肪,并保持组织的完整性,以免影响染色结果。油红染色工艺需要精确控制染色时间;持续时间过长和不足都会损害染色效果,导致结果不准确。
在小鼠主动脉根部的包埋中,需要控制组织的脱水时间,以避免在切片过程中组织开裂。主动脉根部的切片需要具有均匀的厚度以确保均匀染色,太薄或太厚的切片会干扰观察。同时,有必要准确确定在显微镜下观察时三尖瓣出现的位置。苏木精伊红染色过程需要精确控制染色时间和染色液的浓度,以避免非特异性染色。
与现有的评估动脉粥样硬化的优秀方法相比,该方案提供了解剖主动脉弓和根部的分步细节,这有助于全面评估动脉粥样硬化状态11,13 苏木精-伊红染色和 VVG 染色都可以帮助评估主动脉根部病变区域,从而提高动脉粥样硬化的量化准确性。
然而,主动脉油红 O 染色仍然存在一些局限性。例如,油红染色主要用于检测脂质,但对其他类型的细胞或组织成分的特异性较差11,这可能导致错误分类。另一方面,样品固定和解剖的过程可能会导致脂质损失,从而影响染色结果的可靠性。至于主动脉根部的苏木精-伊红染色,它在区分细胞成分方面受到限制,并且在组织结构复杂的情况下可能难以识别病变的特定区域。在进行定量分析时,斑块区域的统计结果也可能受到观察者主观判断的影响。此外,苏木精-伊红染色主要提供形态学信息,不能深入了解细胞功能或分子特征。
除了标准的油红染色和苏木精-伊红染色外,其他分析动脉粥样硬化斑块的技术包括 Masson 染色、各种抗原的免疫组织化学染色以及可用于检查斑块成分和尺寸的其他方法。主动脉根部切片的油红 O 染色也广泛用于分析主动脉根部中的脂质沉积14。茜素红 S 染色是检测钙沉积物的常用染色剂;它与钙离子形成红色络合物,非常适合观察钙沉积物 15。此外,脂质代谢可以从血清生化标志物中推断出来,例如高密度脂蛋白 (HDL)、低密度脂蛋白 (LDL)、总胆固醇 (TC) 和总三酰甘油 (TG) 的水平。动脉粥样硬化发展的关键因素之一是脂质代谢异常,尤其是动脉粥样硬化与心血管疾病 (ASCVD) 与低密度脂蛋白胆固醇 (LDL) 水平之间的关系。
随着动脉粥样硬化研究的深入,定量分析方法的未来发展将更加精确和多样化。首先,高分辨率 MRI、光学相干断层扫描 (OCT) 和超声成像等先进成像技术的集成将使动脉粥样硬化的定量分析更加准确,从而能够对活体小鼠进行动态监测。这将有助于实时评估斑块的进展、稳定性和对治疗的反应。随着分子成像技术的进步,定量分析将允许对炎症反应、脂质积累和斑块内的细胞成分进行深入分析,为动脉粥样硬化的早期诊断和治疗提供更全面的数据16。
披露声明
没什么好宣布的。
致谢
这项工作得到了上海市运动与代谢健康前沿科学研究基地、上海体育大学运动与公共卫生研究计划(0831)、上海市高等教育青年教师培养资助计划(A2-0213-22-0058-5)和上海市科学技术委员会上海市优秀学术带头人计划(21XD1403200)的支持刘龙华。
材料
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides(25×75mm) | CITOTEST | Cat# 80312-3161 | |
| Embedding cassette | CITOTEST | Cat# 80106-1100-16 | |
| Eosin Staining Solution | Beyotime | Cat# C0109 | |
| Ethanol | Sinopharm Chemical Reagent Co. | Cat# 10009218 | |
| Hematoxylin Staining Solution | Beyotime | Cat# C0107 | |
| Low-profile disposable blades | Leica | Cat# 14035838925 | |
| Microscope cover glass(24×50mm) | CITOTEST | Cat# 10212450C | |
| Neutral Balsam Mounting Medium | Sango Biotech | Cat# E675007-0100 | |
| Oil red o powder | Sigma-Aldrich | Cat# 1320-06-5 | |
| paraffin with ceresin | Sinopharm Chemical Reagent Co. | Cat# 69019461 | |
| Paraformaldehyde | Servicebio | Cat# G1101 | |
| Phosphate Buffered Saline (PBS, Powder) | Servicebio | Cat# G0002-2L | |
| Ponceau S Staining Solution | EveryLab | Cat# FM024 | |
| Victoria Blue’B | Aladdin | Cat# 2580-56-5 | |
| Xylene | Sigma-Aldrich | Cat# 104-81-4 |
参考文献
- Libby, P., et al. Atherosclerosis. Nat Rev Dis Primers. 5 (1), 56 (2019).
- Herrington, W., Lacey, B., Sherliker, P., Armitage, J., Lewington, S. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease. Circ Res. 118 (4), 535-546 (2016).
- Frostegård, J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 11, 117 (2013).
- Gisterå, A., Ketelhuth, D. F. J., Malin, S. G., Hansson, G. K. Animal models of atherosclerosis-supportive notes and tricks of the trade. Circ Res. 130 (12), 1869-1887 (2022).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 32 (5), 1104-1115 (2012).
- Ilyas, I., et al. Mouse models of atherosclerosis in translational research. Trends Pharmacol Sci. 43 (11), 920-939 (2022).
- Liu, L., Chan, M., Yu, L., Wang, W., Qiang, L. Adipsin deficiency does not impact atherosclerosis development in ldlr(-/-) mice. Am J Physiol Endocrinol Metab. 320 (1), E87-E92 (2021).
- Liu, L., et al. Pparγ deacetylation confers the antiatherogenic effect and improves endothelial function in diabetes treatment. Diabetes. 69 (8), 1793-1803 (2020).
- Zahr, T., et al. Pparγ (peroxisome proliferator-activated receptor γ) deacetylation suppresses aging-associated atherosclerosis and hypercholesterolemia. Arterioscler Thromb Vasc Biol. 43 (1), 30-44 (2023).
- Tang, C., et al. Endothelial ccrl2 induced by disturbed flow promotes atherosclerosis via chemerin-dependent β2 integrin activation in monocytes. Cardiovasc Res. 119 (9), 1811-1824 (2023).
- Andrés-Manzano, M. J., Andrés, V., Dorado, B. Oil red o and hematoxylin and eosin staining for quantification of atherosclerosis burden in mouse aorta and aortic root. Methods Mol Biol. 1339, 85-99 (2015).
- Mehlem, A., Hagberg, C. E., Muhl, L., Eriksson, U., Falkevall, A. Imaging of neutral lipids by oil red o for analyzing the metabolic status in health and disease. Nat Protoc. 8 (6), 1149-1154 (2013).
- Chen, P. Y., Qin, L., Simons, M. Imaging and analysis of oil red o-stained whole aorta lesions in an aneurysm hyperlipidemia mouse model. J Vis Exp. (183), e61277 (2022).
- Lin, Y., et al. Practical assessment of the quantification of atherosclerotic lesions in apoe-/- mice. Mol Med Rep. 12 (4), 5298-5306 (2015).
- Bozycki, L., Łukasiewicz, K., Matryba, P., Pikula, S. Whole-body clearing, staining and screening of calcium deposits in the mdx mouse model of duchenne muscular dystrophy. Skelet Muscle. 8 (1), 21 (2018).
- Glaudemans, A. W., et al. Molecular imaging in atherosclerosis. Eur J Nucl Med Mol Imaging. 37 (12), 2381-2397 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。