Method Article
Генерация трехмерных сфероидов/органоидов из двумерных клеточных культур с использованием нового штампового устройства
В этой статье
Резюме
В данном исследовании представлена экономически эффективная и эффективная методология создания 3D-ячеечных структур с использованием штамповой системы для создания микролунок в агарозных формах. Система способствует образованию однородных сфероидов/органоидов, тем самым улучшая клеточные взаимодействия. Этот подход снижает экспериментальную вариативность и поддерживает приложения в тестировании лекарств и тканевой инженерии.
Аннотация
Трехмерные (3D) клеточные культуры обеспечивают более точное представление микроокружения in vivo , чем обычные двумерные (2D) культуры, поскольку они способствуют усилению взаимодействия между клетками и внеклеточным матриксом. Целью данного исследования была разработка эффективной, экономичной и воспроизводимой методологии создания 3D-клеточных структур (сфероидов/органоидов) с использованием инновационной системы на основе штампов для создания микролунок в агарозных формах. Новый штамп был использован для производства 663 микролунок на лунку 6-луночного планшета, что обеспечило идеальную среду для агрегации клеток. Первичные островковые клетки поджелудочной железы свиней были посажены в эти микролунки, где они агрегировались с образованием сфероидов/органоидов. Культуры инкубировали при 37 °C при 5%CO2, а среду заменяли каждые 3 дня. Формирование сфероидов периодически контролировалось, и отбирались образцы для характеризации. Метод успешно сгенерировал однородные и высококачественные сфероиды, снизив экспериментальную изменчивость, минимизировав манипуляции и усилив клеточные взаимодействия. Использование пресс-форм на основе агарозы с микроузорами обеспечило упрощенную, контролируемую среду для 3D-культур, предлагая стандартизированное и экономичное решение. Эта методология поддерживает приложения для тестирования лекарств и тканевой инженерии, предлагая практичную и масштабируемую платформу для 3D-моделей клеточных культур, которые могут быть легко реализованы в различных лабораторных условиях.
Введение
За последние 50 лет многочисленные исследования в области клеточной биологии показали, что двумерные (2D) культуры не могут точно воспроизвести условия in vivo, наблюдаемые наживотных моделях. Структурно двухмерные клеточные культуры не позволяют клеткам организовываться трехмерно и воспроизводить ситуацию, наблюдаемую в системах in vivo. Кроме того, клеточные сигнальные пути изменены в 2D-культурах по сравнению с трехмерными (3D) культурами, что, вероятно, может объяснить, почему определенные типы скрининга наркотиков с использованием 2D-культур так отличаются друг отдруга. Значительный прогресс в методах культивирования клеток произошел с внедрением систем 3D-культивирования. 3D-системы значительно различаются по сложности в зависимости от клеточного состава и цитоархитектуры. Как правило, образуются два типа структур, а именно: сфероиды и органоиды. Сфероиды описываются как простые скопления клеток, полученных из нормальных или опухолевых тканей, эмбриоидных тел и клеточных линий. На формирование 3D-структур влияют различные факторы, в том числе межклеточные взаимодействия и сигнальные пути, опосредованные компонентами внеклеточного матрикса (ВКМ), которые обеспечивают структурную поддержку и биохимические сигналы. Эти элементы регулируют взаимодействия, которые способствуют организации и функционированию тканей3. Система сфероидных культур была впервые описана в начале 1970-х годов с использованием клеточных линий легких китайского хомяка V79 в качестве модели узловых карцином, растущих в неадгезивных условиях и образующих идеальныесферы. Органоиды описываются как кластеры органоспецифичных типов клеток, полученных из стволовых или прогениторных клеток, которые самоорганизуются посредством таких процессов, как сортировка клеток и спецификация родословной, в пространственно ограниченном виде, отражаяразвитие in vivo.
Существует несколько доступных методов и материалов для культивирования клеток в 3D-условиях. Основными методами, используемыми в настоящее время для создания 3D-культур, являются: 1) висячие капли; 2) вращающиеся клеточные культуры и пластики с низкой адгезией; 3) пирамидальные плиты, содержащие конические колодцы; 4) макропористые каркасы; 5) магнитные бусины; и 6) гидрогели без скаффолда.
Висячие капли — это метод, используемый для получения 3D-культур без каркасов. Этот метод имеет определенные ограничения, в том числе необходимость обширной обработки, низкую эффективность производства, сферическую геометрию и воздействие высоких сил сдвига. Кроме того, специфические процедуры, такие как замена среды или добавление компаунда, могут быть сложными и могут привести к потерям материала. Кроме того, в литературных источниках указано, что некоторые клеточные линии не могут продуцировать плотно упакованные сфероиды при использованииэтого подхода6.
Вращающиеся клеточные культуры и пластики с низким уровнем прикрепления используются для предотвращения прикрепления клеток к субстрату, в результате чего они агрегируются и образуют сфероиды. Этот процесс требует специальных колб и/или перемешивания/вращения. Хотя это один из самых простых подходов к крупномасштабному производству сфероидов или органоидов, он не лишен недостатков, таких как потребность в специальном оборудовании, низкая продолжительность жизни культур, изменение размеров сфероидов, механические повреждения клеток инизкая эффективность.
Пирамидальные пластины, содержащие конические колодцы, являются коммерчески доступными пластинами, влияющими на стоимость, в дополнение к тому факту, что некоторые манипуляции могут препятствовать образованию сфероидов/органоидов7.
Макропористые каркасы также используются для 3D-культивирования; Однако основное препятствие заключается в достижении эффективного посева клеток и равномерного распределения. Эта проблема возникает из-за того, что размеры пор могут быть либо слишком малы для проникновения в клетки, либо слишком велики для надежного удержания клеток. Для решения этой проблемы былоизучено несколько стратегий8, которые напрямую влияют на сложность и стоимость этого метода.
Методология магнитных шариков генерирует небольшое количество сфероидов/органоидов, имеет высокую стоимость и может оставлять остатки наночастиц внутри клеток9.
Среди систем для культивирования сфероидов доступны неадгезивные агарозные гидрогели, представляющие собой гидрогель без скаффолда. Этот подход дает заметные преимущества, такие как точный контроль над размерами 3D-структур и возможность создания значительного количества этих структур на пластине. При этом методе клетки вводятся в гидрогель с предварительно сформированными лунками, в которых они погружаются и самособираются в 3D сфероиды10.
В этом исследовании мы представляем устройство и методологию для создания агарозных микролунок с использованием микрошаблонной формы простым, эффективным, воспроизводимым и недорогим способом.
Использование этого штампа в качестве пресс-формы для создания микролунок в агарозе, с помощью силы тяжести, направлено на улучшение взаимодействия клеток внутри микролунки и клеточной организации, создание 3D-структур (сфероидов/органоидов) in vitro простым, эффективным, воспроизводимым и недорогим способом, тем самым экономя время исследований и лабораторные ресурсы.
протокол
Этот протокол соответствует рекомендациям Комитета по этике исследований человека нашего учреждения CEUA-FMUSP: 1699/2021, утвержденному 8 сентября 2021 года - «Выделение и инкапсуляция островков поджелудочной железы свиней» и является частью тематического проекта нашей группы клеточной и молекулярной терапии NUCEL (www.usp.br/nucel), грант FAPESP No 2016/05311-2 под названием: «Регенеративная медицина, направленная на терапию хронических дегенеративных заболеваний (рака и диабета)».
1. Изготовление штемпельного устройства
ПРИМЕЧАНИЕ: Эта марка изготовлена по индивидуальному заказу группой NUCEL (https://w3nucel.webhostusp.sti.usp.br/). Штемпельное устройство было разработано с использованием программного обеспечения, широко известного своей точностью и передовыми возможностями трехмерного моделирования.
- Убедитесь, что спроектированные прототипы имеют 663 микроконтакта, расположенных таким образом, чтобы можно было генерировать эквивалентное количество трехмерных культур, таких как сфероиды или органоиды. Чтобы обеспечить устойчивость штампа на поверхностях лотка T6, стратегически расположите пять опорных точек по окружности устройства.
- Убедитесь, что микроконтакты имеют коническую конструкцию с регулируемыми размерами, варьирующимися от 1 до 3 мм в длину. Диаметр основания конуса варьируется от 0,7 до 1,5 мм, а угол конуса колеблется от 5° до 10°.
- Убедитесь, что «стоповая» структура устройства, определяющая глубину микроконтактов, имеет регулируемую длину от 10 до 19 мм и диаметр от 20 до 40 мм, при этом микроконтакты равномерно распределены по его поверхности.
- Кроме того, спроектируйте устройство так, чтобы оно имело эргономичную ручку, подходящую для работы одной рукой, чтобы повысить практичность и точность во время использования.
ПРИМЕЧАНИЕ: Для облегчения крупномасштабного производства устройства предоставляется цифровой файл в формате .stl, который необходим для процесса 3D-печати. - Просто нарежьте его с помощью соответствующего программного обеспечения и распечатайте на совместимом 3D-принтере. Используйте следующие печатные размеры: Х - 68 мм; Y - 120 мм; Z - 150 мм, обеспечивая идеальный баланс между функциональностью и качеством конструкции.
- Для изготовления устройства используйте фотоотверждаемый 3D-принтер, совместимый с УФ-отверждаемой полимерной смолой, которая должна иметь высокое разрешение и однородную поверхность поверхности, необходимые для оптимальной работы устройства.
- Нарежьте цифровую модель для печати с помощью программного обеспечения, совместимого с выбранным 3D-принтером.
2. Подготовка агарозных микролунок
- Приготовьте раствор агарозы.
- Взвесьте чистый порошок агарозы и растворите его в 1x фосфатно-солевом буфере (PBS) до достижения конечной концентрации 1-2% (w/v).
- Нагрейте раствор в микроволновой печи или на водяной бане до полного растворения, убедившись, что он однородный и прозрачный.
ПРИМЕЧАНИЕ: Избегайте перегрева или чрезмерного повторного нагрева, так как это может привести к ухудшению качества агарозы. Не стоит готовить большие объемы исходного раствора. - Дайте раствору остыть до ~40 °C, идеальной температуры для пипетирования.
- Подготовьте штамп на заказ.
- Промойте штамп губкой с мягкой щетиной и дистиллированной водой, чтобы удалить остатки.
- Подвергните очищенный штамп воздействию ультрафиолетового излучения на 5-10 минут, чтобы обеспечить стерильность.
- Сформируйте микролунки.
- Налейте ~3 мл 40 °C агарозного раствора в каждую лунку 6-луночного планшета, обеспечивая равномерную глубину 2-3 мм.
- Поместите изготовленный на заказ штамп в центр лунки, пока агароза еще теплая.
ПРИМЕЧАНИЕ: Штамп имеет боковые опоры, которые обеспечивают выравнивание и устойчивость, устраняя необходимость в ручной поддержке. Каждый штамп создает ~663 микролунки (~2 мм в высоту) на лунку. Убедитесь, что на микроконтактах нет пузырей; Если образовались пузыри, аккуратно переместите штамп, чтобы устранить их. - Дайте агарозе застыть в течение 5-10 минут при комнатной температуре, не перемещая пластину.
ПРИМЕЧАНИЕ: Не тревожьте агарозу во время застывания, чтобы избежать изменений в структуре микролунок. - Удалите штамп легкими движениями вперед-назад, чтобы выпустить вакуум, не повреждая микролунки.
ПРИМЕЧАНИЕ: Этот механизм облегчает поступление воздуха, обеспечивая плавное удаление штампа без деформации геля. Микролунки должны оставаться неповрежденными. - Промойте микролунки 3 раза раствором PBS для удаления остатков.
- Подвергните пластину воздействию ультрафиолетового излучения в течение 10 минут, чтобы устранить микробное загрязнение.
- Добавьте 3 мл питательной среды и инкубируйте планшет в инкубаторе сCO2 при температуре 37 °C в течение ночи.
ПРИМЕЧАНИЕ: Эта инкубация проверяет отсутствие загрязнения перед посевом клеток.
3. Посев клеток в микролунки
- Приготовьте клеточную суспензию.
- Соберите клетки с помощью трипсинизации или другого метода диссоциации для получения однородной суспензии.
- Подсчитайте ячейки и отрегулируйте концентрацию в соответствии с желаемым числом на микролунку.
Примечание: Для посева 5000 клеток на микролунку в 663 микролунки приготовьте суспензию, содержащую не менее 3,315 × 106 клеток. Оптимизируйте концентрацию клеток для предотвращения центрального некроза и обеспечения адекватной диффузии питательных веществ и кислорода.
- Засейте клетки.
- Пипеткой нанесите ~3 мл приготовленной клеточной суспензии на микролунки, обеспечивая равномерное распределение, аккуратно вращая планшет.
- Дайте клеткам осесть под действием силы тяжести (~10-15 минут) или выполните щадящее центрифугирование при 100 × г в течение 5 минут.
ПРИМЕЧАНИЕ: Центрифугирование может быть использовано для обеспечения концентрации ячеек в микролунках. - Перенесите планшет в инкубатор сCO2 при температуре 37 °C с увлажненной атмосферой.
4. Уход за 3D культурами клеток
- Замените питательную среду.
- Меняйте среду каждые 2-3 дня, удаляя 50% старой среды и добавляя свежую среду.
ПРИМЕЧАНИЕ: Убедитесь, что микролунки остаются погруженными в воду в течение всего периода культивирования, чтобы предотвратить обезвоживание.
- Меняйте среду каждые 2-3 дня, удаляя 50% старой среды и добавляя свежую среду.
- Следите за формированием 3D культур.
- Продолжайте культивирование до тех пор, пока 3D-структуры полностью не сформируются и не уплотнятся (например, 2-3 дня для первичных культур островков поджелудочной железы).
ПРИМЕЧАНИЕ: Для культур, требующих более длительного времени формирования, проводите частичную смену среды каждые 2-3 дня.
- Продолжайте культивирование до тех пор, пока 3D-структуры полностью не сформируются и не уплотнятся (например, 2-3 дня для первичных культур островков поджелудочной железы).
5. Сбор и определение характеристик 3D конструкций
- Соберите сфероиды/органоиды.
- Удалите старую среду и соберите 3D-структуры с помощью энергичного пипетирования с помощью наконечника пипетки большого диаметра или отрезанного наконечника для предотвращения сжатия или разукрупнения.
ПРИМЕЧАНИЕ: Необходимо контролировать энергичное пипетирование, чтобы вытеснить агрегаты без их деформации.
- Удалите старую среду и соберите 3D-структуры с помощью энергичного пипетирования с помощью наконечника пипетки большого диаметра или отрезанного наконечника для предотвращения сжатия или разукрупнения.
- Подготовьтесь к анализу.
- Используйте собранные сфероиды/органоиды сразу или зафиксируйте их для будущего анализа.
Примечание: Ассоциация и стабильность сфероидов зависят от типа клеток, времени формирования и условий культивирования. Необходимо соблюдать осторожность, чтобы избежать диссоциации.
- Используйте собранные сфероиды/органоиды сразу или зафиксируйте их для будущего анализа.
Результаты
Клеточная культура, использованная в этом исследовании, была получена из островков поджелудочной железы свиней. Островковый препарат, использованный в этом исследовании, имел чистоту 80 ± 5% на основе окрашивания дитизоном и жизнеспособность островковых клеток >80% на основе обнаружения флуоресцеина диацетата в живых клетках или йодида пропидиума в мертвых клетках (флуоресцентный метод «живые/мертвые»). Убедитесь, что препарат островков поджелудочной железы свиней имеет чистоту не менее 80% (например, путем окрашивания дитизоном) и жизнеспособность на >80%. После выделения поддерживающие адгезивные культуры в среде CMRL 1066 с добавлением 1 мМ L-глутамина, 0,2% ципрофлоксацина и 10% эмбриональной телячьей сыворотки (FCS) при 37 °C и 5%CO2, как описано ранее11,12.
В настоящем исследовании была всесторонне оценена эффективность системы на основе штампов для создания микролунок в агарозных формах (рис. 1). Конструкция штампа, показанная на рисунке 2, демонстрирует точность микроконтактов и их размещение, что способствует равномерному выравниванию и обращению в процессе формирования микролунок. Это обеспечило равномерный рисунок микролунок по всему планшету, что является критически важным фактором для получения воспроизводимых 3D-культур клеток.
Процесс формирования микролунок с помощью штампа подробно описан на рисунке 3, на котором визуализирована способность штампа создавать однородные микроскважины. Результаты подтверждают, что несколько штампов можно использовать одновременно, что оптимизирует процесс подготовки. Микроскопический анализ агарозных форм выявил вогнутые, стандартизированные формы микролунок, что является решающим фактором в контроле агрегации клеток в 3D-структуры. Однородность микролунок в значительной степени способствует надежности и воспроизводимости формирования 3D-культур, о чем свидетельствуют согласованные результаты, полученные в различных экспериментах.
На рисунке 4 показано нестационарное развитие 3D-структур с момента инокуляции клеток (0 ч) в течение нескольких временных точек (6 ч, 24 ч, 48 ч и 72 ч). Уплотнение ячеек в агрегированные/компактные 3D-структуры происходило постепенно, со значительной агрегацией, наблюдаемой к отметке 48 часов. Этот временной шкала может варьироваться в зависимости от типа клеток, о чем свидетельствует использование в данном исследовании первичных островков поджелудочной железы свиней, которые формировали компактные и функциональные 3D-структуры в течение 48 ч. Это демонстрирует эффективность протокола в создании организованных 3D-культур.
На рисунке 5 показана стабильность и жизнеспособность 3D-структур после их извлечения из агарозных микролунок. 3D-структуры сохранили свою конформацию после удаления (рис. 5A), что подтверждает надежность методологии. Кроме того, анализ живых/мертвых (рис. 5B, C) показал, что клетки внутри структур остаются жизнеспособными, о чем свидетельствует зеленое окрашивание живых клеток. Этот вывод подтверждает, что протокол не только способствует формированию хорошо организованных 3D-структур, но и сохраняет жизнеспособность клеток, что делает его надежным и эффективным подходом для применения в 3D-культурах клеток.
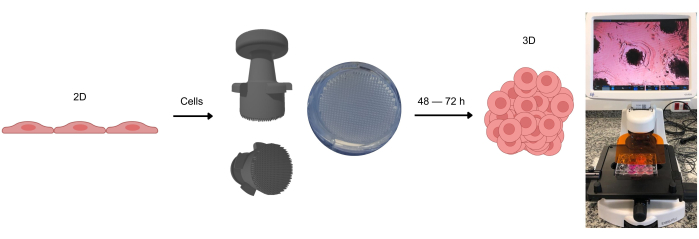
Рисунок 1: Процесс формирования 3D клеточных культур. Клетки, первоначально культивируемые в 2D, отделяют от адгезивной поверхности и помещают в агарозные микролунки. Эти агарозные микролунки создаются с помощью штампового устройства, которое позволяет формировать эти микролунки после застывания агарозного геля при комнатной температуре. При наблюдении с помощью оптической микроскопии можно увидеть, как клетки равномерно распределяются по микролункам. Примерно через 2-3 дня (в зависимости от типа клеток) может наблюдаться образование сфероидов или органоидов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Штемпельное устройство. Репрезентативные изображения штемпельного устройства из (A-C) с трех различных точек зрения, иллюстрирующие его основные особенности, а именно: 663 микробулавки, опоры для пластин и поддержка ручной обработки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Пошаговое представление процесса производства формы с микролунками. (А) Устройство для печати штампов; (В) расположение штемпельного устройства в центре лунки, содержащей жидкую агарозу; (В) агарозная полимеризация; (D) агарозные микроколодцы, отлитые с помощью штампового устройства; (E) демонстрация производства с использованием трех штемпельных устройств на одной и той же пластине (P6); (F) оптические микроскопические изображения микролунок при 4-кратном увеличении (масштабная линейка = 1 000 мкм); (G) оптические микроскопические изображения микролунок при 10-кратном увеличении (масштабная линейка = 400 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Изображения с помощью оптической микроскопии первичной культуры свиней на островках поджелудочной железы. Изображения с увеличением 2x (масштабная линейка = 2 000 μm), 4x (масштабная линейка = 1 000 μm) и 10x (масштабная линейка = 400 μm) в следующие временные точки: 0 часов, 6 часов, 24 часа, 48 часов, 72 часа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Анализ живых/мертвых веществ. Репрезентативные изображения, демонстрирующие жизнеспособность сфероидов из первичных культур островковых клеток поджелудочной железы свиней, которые были получены в агарозных микролунках и собраны через 72 ч (3 дня) 3D-культивирования с использованием усовершенствованного устройства штамповки. Получены изображения с помощью флуоресцентной оптической микроскопии. Зеленое окрашивание представляет жизнеспособные клетки, меченные флуоресцеиновым диацетатом, в то время как красное окрашивание указывает на нежизнеспособные клетки, меченные йодидом пропидия. Снимки подтверждают, что сфероидальная структура 3D-культуры сохраняется и остается жизнеспособной после удаления из микролунок. Масштабная линейка = 400 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Несмотря на то, что в литературе существуют различные протоколы 3D-культивирования, в исследовании, проведенном Wassmer et al.13 , было проверено несколько методологий создания 3D-структур с использованием островков поджелудочной железы. Авторы отметили, что нативные островки и самоагрегирующиеся сфероиды демонстрируют значительную гетерогенность по размеру и форме и являются крупнее, чем те, которые были получены другими методами. Основываясь на своих выводах, они пришли к выводу, что сфероиды могут быть получены с использованием различных методов, каждый из которых имеет свои преимущества и недостатки. Для агрегации островковых клеток рекомендуются методы висячих капель, агарозные микролуночные планшеты или сферическая пластина 5D.
В литературе успешно применяются устройства для генерации агарозных микролунок. Например, Stuart et al.14 показали многообещающие результаты с использованием устройства, но у него были определенные недостатки, которые необходимо устранить. К ним относятся ограниченное количество микролунок, которые он может производить, уменьшенный рабочий объем из-за небольшой площади пресс-формы и его конструкция в виде отрицательной формы, что усложняет обращение и увеличивает риск поломки и деформации микролунок.
Похожее на штамп устройство для генерации сфероидов было разработано Чарелли и его коллегами15 с использованием технологии 3D-печати. Способное производить до 4716 сфероидов на 6-луночный планшет, устройство было создано с помощью стереолитографии с фотоотверждаемой смолой. Получившееся устройство имело цилиндрические микроконтакты, каждый 1,3 мм в высоту и 650 мкм в ширину. Этот метод позволил быстро сформировать однородные сфероиды, в том числе совместно культивируемые сфероиды, с постоянной формой и размером. Несмотря на его преимущества, необходимо решить несколько проблем, чтобы повысить удобство использования и производительность. Существенной проблемой является отсутствие ручной поддержки, что делает устройство сложным в обращении и подверженным нестабильности в процессе формирования пресс-формы. Эта нестабильность часто приводит к поломке или растрескиванию агарозного геля, нарушая его структурную целостность. Кроме того, устройство страдает от отсутствия поддержки пластины, что означает, что оно не может быть надежно закреплено на пластине колодца. В результате штамп необходимо вручную подвешивать до тех пор, пока агароза не застынет, внося изменчивость и влияя на равномерность формирования микролунок. Эти ограничения снижают воспроизводимость и общее качество получаемых сфероидов.
Наш усовершенствованный штамп/протокол позволяет использовать эффективный и недорогой метод, генерирующий 3D-сфероиды и органоиды в агарозных микролунках, отличающийся простотой и воспроизводимостью. Вдохновленная работой Декарлии его коллег, наша группа использовала методологию неадгезивного агарозного гидрогеля для разработки нового устройства для штамповки. В результате мы решили такие проблемы, как трудности с обработкой и несоответствия при формировании микроскважин. Марка, разработанная по нашей методологии, включает в себя эти улучшения, что делает ее более удобной для пользователя, эффективной и воспроизводимой.
Что касается модификаций, плотность клеток может быть скорректирована для различных типов клеток и экспериментальных целей. Более высокая плотность посева клеток может потребоваться для клеток с низкими скоростями пролиферации или ограниченным взаимодействием клеток, в то время как более низкая плотность может способствовать лучшей структурной организации для определенных типов клеток. Если возникают проблемы с формированием сфероидов, небольшие модификации, такие как быстрое центрифугирование планшетов, могут помочь клеткам правильно осесть на дне микролунок.
Одним из важнейших этапов протокола является точный и равномерный посев клеток в микролунки. Однородное распределение клеток имеет важное значение для обеспечения того, чтобы сформированные структуры имели постоянные размеры и однородные свойства, что напрямую влияет на качество результатов. Сбор 3D-культур – еще один важный момент. Этот этап требует особой осторожности, чтобы избежать разрушения структур во время извлечения, что требует соответствующих методов пипетирования для сохранения целостности сфероидов и органоидов.
Размер сфероида будет варьироваться в зависимости от типа используемой ячейки. Кроме того, количество клеток на сфероид также варьируется и должно быть оптимизировано в зависимости от конкретной клеточной линии или первичных клеток. Важно отметить, что было показано, что чрезмерно высокая плотность клеток внутри сфероида вызывает развитие некротического ядра, о чем сообщается в литературе. Это некротическое ядро является результатом недостаточной диффузии кислорода и питательных веществ к самым внутренним клеткам, что может поставить под угрозу общую жизнеспособность и функцию сфероида17.
Несмотря на преимущества простоты и низкой стоимости, существенным ограничением метода является потенциальная вариативность при сборе сфероидов, особенно в экспериментах, требующих более крупных и сложных структур. В таких случаях может потребоваться использование более специализированных инструментов сбора или даже методологических адаптаций для оптимизации процесса и сокращения потерь материала. Получение очень маленьких сфероидов также может усложнить манипуляции и сбор, требуя строгого протокольного контроля.
Ассоциация и диссоциация сфероидов/органоидов значительно варьируют в зависимости от типа используемых клеток, а также от количества дней, необходимых для формирования структуры, используемой питательной среды и потребности в возможном перемешивании. Эти факторы присущи специфическим характеристикам каждого типа клеток. Тем не менее, чтобы свести к минимуму диссоциацию клеток, важно строго следовать мерам предосторожности, изложенным в методологии, таким как бережное обращение при смене среды и надлежащее поддержание условий культивирования.
По сравнению с другими методами, такими как ротационные культуры или магнитные шарики, этот протокол отличается большей простотой, устраняющей необходимость в специализированном оборудовании и обеспечивающей более воспроизводимое производство 3D-сфероидов и органоидов, что делает его практичной альтернативой для широкого спектра исследовательских целей. Согласно ранее описанным в литературерезультатам 13, агарозные микролунки способствуют генерации трехмерных сфероидальных структур инсулин-продуцирующих клеток с более высокой жизнеспособностью и скоростью секреции инсулина по сравнению с другими коммерческими моделями, такими как Sphericalplate 5D.
Универсальность этого метода в сочетании с его низкой стоимостью делает его идеальным для различных областей исследований, таких как клеточная биология, онкология, исследования по разработке лекарств и токсикология. Он предлагает эффективное решение для 3D-моделирования in vitro , способствуя более точным исследованиям клеточного поведения, взаимодействия клеток, реакции на лекарства и разработки терапии.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Мы особенно благодарны за прекрасную техническую помощь, предоставленную Зизи де Мендонса (Школа медицины Университета Сан-Паулу, Бразилия). Эта работа была поддержана грантами следующих бразильских исследовательских агентств: BNDES 09.2.1066.1, CAPES (номер процесса PVE 88881.068070/2014-01), CNPq (номера грантов 457601/2013-2, 401430/2013-8 и INCT-Regenera номер 465656/2014-5), FAPESP (тематический проект No 2016/05311-2), FINEP 01.08.06.05 и Министерства науки и технологий (MCTI) и здравоохранения (MS-DECIT).
Материалы
| Name | Company | Catalog Number | Comments |
| 31L Microwave | Electrolux | 78965840 6699 9 | Equipment used to heat the agarose solution, facilitating its dissolution and ensuring greater homogeneity. It allows the solution to reach the ideal liquid state for the formation of the wells. |
| 3DFila Gray Opaque Photosensitive 3D Resin | UV-curable polymer resin | ||
| 3D Printer - Creality Halot One | Creality | N/A | 3D printer used for printing the stamp device |
| Agarose | UNISCIENCE | UNI-R10111 | To form the gel, dissolve 1 to 2% in Saline Phosphate Buffer (PBS) or appropriate medium. |
| Autodesk Fusion 360 | 3D modeling | ||
| BB15 CO2 Incubator | Thermo Fisher | 51023121 | Equipment used to incubate cultured cells in a suitable and controlled environment. |
| Chitubox | Chitubox | N/A | Software used for slicing the part for printing |
| Class II Biological Safety Cabinet | Grupo VECO | N/A | Ensures a sterile environment for performing cell culture within established parameters and protocols. |
| Culture medium | USBiological/Life Sciences | C5900-03A | Contains additives for proper cell cultivation. |
| Culture plates (P6) | SARSTEDT | 1023221 | Used to shape the agarose and culture the cells. |
| Erlenmeyer Flask (25 mL) | Laborglas | 91 216 14 | A container used for dissolving 1–2% agarose in Phosphate Buffered Saline (PBS) or another suitable medium, typically heated in a microwave. |
| Falcon 15 mL Polystyrene Centrifuge Tube | Corning | 352099 | Used to keep cells in suspension and perform possible dilutions. |
| Fetal bovine serum (FBS) | Vitrocell Embriolife | 005/19 | Additive for culture medium. |
| PBS solution (Saline Phosphate Buffer) | Lab made | N/A | Diluted 1x with MiliQ ultrapure water. Used to dissolve agarose 1 to 2% and to wash wells already produced. |
| Reagent bottle with blue cap - Schott | Laborglas | 21801545 | Used for preparing and storing culture medium. |
| Stamp device | NUCEL Group | N/A | Link- This link provides access to the .stl file of the stamp device. Simply slice it using appropriate software and print it with a compatible 3D printer. https://drive.google.com/drive/folders/1gTYComnJWzHpN6ZKOyK EChKS3Qns0rOA?usp=sharing |
| Treated culture flask with filter 25 cm² | Corning | 430639 | Used for the cultivation and maintenance of adherent cells. |
| Trypsin | Merck | 07-07-9002 | For dissociation of cells before seeding. |
| Ultra violet light (UV) | N/A | N/A | Used to sterilize the stamp and plates. |
Ссылки
- Lian, J., Yue, Y., Yu, W., Zhang, Y. Immunosenescence: a key player in cancer development. J Hematol Oncol. 13 (1), 151 (2020).
- Wang, F., et al. Reciprocal interactions between beta1-integrin and epidermal growth factor receptor in three-dimensional basement membrane breast cultures: a different perspective in epithelial biology. Proc Natl Acad Sci USA. 95 (25), 14821-14826 (1998).
- Dzobo, K., Dandara, C. The extracellular matrix: its composition, function, remodeling, and role in tumorigenesis. Biomimetics. 8 (2), 146 (2023).
- Sutherland, R. M., McCredie, J. A., Inch, W. R. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. J Natl Cancer Inst. 46 (1), 113-120 (1971).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Bialkowska, K., Komorowski, P., Bryszewska, M., Milowska, K. Spheroids as a type of three-dimensional cell cultures-examples of methods of preparation and the most important application. Int J Mol Sci. 21 (17), 6225 (2020).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. J Vis Exp. (81), e50665 (2013).
- Andersen, T., Auk-Emblem, P., Dornish, M. 3D Cell culture in alginate hydrogels. Microarrays (Basel). 4 (2), 133-161 (2015).
- Hou, S., et al. Advanced development of primary pancreatic organoid tumor models for high-throughput phenotypic drug screening. SLAS Discov. 23 (6), 574-584 (2018).
- Napolitano, A. P., et al. Scaffold-free three-dimensional cell culture utilizing micromolded nonadhesive hydrogels. Biotechniques. 43 (4), 494-500 (2007).
- Maria-Engler, S. S., et al. Co-localization of nestin and insulin and expression of islet cell markers in long-term human pancreatic nestin-positive cell cultures. J Endocrinol. 183 (3), 455-467 (2004).
- Mantovani, M. C., et al. Immobilization of primary cultures of insulin-releasing human pancreatic cells. Islets. 1 (3), 224-231 (2009).
- Wassmer, C. H., et al. Engineering of primary pancreatic islet cell spheroids for three-dimensional culture or transplantation: a methodological comparative study. Cell Transplant. 29, 963689720937292 (2020).
- Stuart, M. P., et al. Successful low-cost scaffold-free cartilage tissue engineering using human cartilage progenitor cell spheroids formed by micromolded nonadhesive hydrogel. Stem Cells Int. 2017, 7053465 (2017).
- Charelli, L. E., Dernowsek, J. A., Balbino, T. A. Generation of tissue spheroids via a 3D printed stamp-like device. J Vis Exp. (188), e63814 (2022).
- Decarli, M. C. Micromold for the production of cellular spheroids and use. , (2019).
- Riffle, S., Pandey, R. N., Albert, M., Hegde, R. S. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids. BMC Cancer. 17, 338 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены