Method Article
使用新型 Stamp 装置从二维细胞培养物中生成三维球状体/类器官
摘要
本研究提出了一种经济高效且高效的方法,使用基于邮票的系统在琼脂糖模具中创建微孔来生成 3D 细胞结构。该系统促进均匀球状体/类器官的形成,从而改善细胞相互作用。这种方法减少了实验的可变性,并支持药物检测和组织工程中的应用。
摘要
与传统的二维 (2D) 培养相比,三维 (3D) 细胞培养物可以更准确地表示 体内 微环境,因为它们促进了细胞与细胞外基质之间的相互作用增强。本研究旨在开发一种高效、经济且可重复的方法,使用基于邮票的创新系统在琼脂糖模具中创建微孔来生成 3D 细胞结构(球状体/类器官)。使用一种新型邮票在 6 孔板的每孔中产生 663 个微孔,为细胞聚集提供了理想的环境。将原代猪胰岛细胞接种到这些微孔中,在那里它们聚集形成球状体/类器官。将培养物在 37 °C 下在 5% CO2 下孵育,每 3 天更换一次培养基。定期监测球状体的形成,并收集样品进行表征。该方法成功生成了均匀和高质量的球状体,减少了实验变异性,最大限度地减少了作,并增强了细胞相互作用。基于琼脂糖的微图案模具的使用为 3D 培养提供了一个简化、受控的环境,提供了标准化且具有成本效益的解决方案。该方法支持药物检测和组织工程应用,为 3D 细胞培养模型提供了一个实用且可扩展的平台,可以在各种实验室环境中轻松实施。
引言
在过去的 50 年里,大量细胞生物学研究表明,二维 (2D) 培养物无法准确复制在动物模型中观察到的 体内 条件1。在结构上,2D 细胞培养物不允许细胞进行三维组织并复制在 体内 系统中观察到的情况。此外,与 3D (3D) 培养物相比,2D 培养物中的细胞信号转导通路发生了改变,这可能解释了为什么使用 2D 培养物进行某些类型的药物筛选如此差异2。随着 3D 培养系统的引入,细胞培养技术取得了重大进步。3D 系统的复杂程度差异很大,具体取决于细胞组成和细胞结构。通常,会产生两种类型的结构,即:球状体和类器官。球状体被描述为从正常或肿瘤组织、胚状体和细胞系获得的简单细胞簇。3D 结构的形成受多种因素影响,包括细胞间相互作用和细胞外基质 (ECM) 成分介导的信号通路,这些成分提供结构支持和生化线索。这些元素调节有助于组织组织和功能的相互作用3.球状体培养系统于 1970 年代初首次被描述,使用 V79 中国仓鼠肺细胞系作为结节癌的模型,在非粘附条件下生长并形成完美的球体4。类器官被描述为源自干细胞或祖细胞的器官特异性细胞类型的簇,它们通过细胞分选和谱系规范等过程以空间受限的方式进行自我组织,反映了 体内 发育5。
有几种可用的方法和材料可用于在 3D 条件下培养细胞。目前用于生成 3D 培养物的主要方法是:1) 悬滴;2) 旋转细胞培养和低附着塑料;3) 包含锥形孔的金字塔板;4) 大孔支架;5) 磁珠;6) 无支架水凝胶。
悬滴是用于获得无支架 3D 培养物的方法。这种方法存在一定的局限性,包括需要大量处理、生产效率低、球形几何形状和承受高剪切力。此外,特定的程序(例如培养基更换或化合物添加)可能具有挑战性,并可能导致材料损失。此外,文献报告表明,使用这种方法时,一些细胞系无法产生紧密堆积的球体6。
旋转细胞培养物和低附着塑料塑料片用于防止细胞附着在基质上,导致它们聚集并形成球状体。此过程需要特定的培养瓶和/或搅拌/旋转。虽然这是大规模球状体或类器官生产最直接的方法之一,但它并非没有缺点,例如需要特定设备、培养寿命短、球状体的大小变化、对细胞的机械损伤和效率低6。
含有锥形孔的金字塔板是市售的板,除了一些作可能会阻碍球状体/类器官的形成之外,还会影响成本7。
大孔支架也用于 3D 培养;然而,一个主要障碍在于实现有效的细胞接种和均匀分布。出现此问题的原因是孔径可能太小而无法穿透细胞,或者太大而无法牢固地保留细胞。为了解决这个问题,已经探索了几种策略8,这些策略直接影响该技术的复杂性和成本。
磁珠方法会产生少量的球状体/类器官,成本高,并且可能在细胞内留下纳米颗粒残基9。
在用于培养球体的系统中,可以使用非粘附性琼脂糖水凝胶,代表无支架水凝胶。这种方法具有显著的优势,例如精确控制 3D 结构的尺寸,以及每块板能够生成大量此类结构。在这种方法中,将细胞引入带有预制孔的水凝胶中,在水凝胶中,它们下沉并自组装成 3D 球体10。
在这项研究中,我们提出了一种使用微模式模具以简单、高效、可重复和低成本的方式生成琼脂糖微孔的设备和方法。
使用该印章作为模具在琼脂糖中生成微孔,在重力的帮助下,旨在增强微孔内的细胞相互作用和细胞组织,以简单、高效、可重复和低成本的方式 在体外 生成 3D 结构(球状体/类器官),从而节省研究时间和实验室资源。
研究方案
该协议遵循我们机构人类研究伦理委员会 CEUA-FMUSP:1699/2021 的指导方针,于 2021 年 9 月 8 日批准 - “猪胰岛的分离和封装”,是我们细胞和分子治疗 NUCEL 小组 (www.usp.br/nucel) 主题项目的一部分,FAPESP 资助号 2016/05311-2,标题为:“旨在治疗慢性退行性疾病(癌症和糖尿病)的再生医学”。
1. 印章装置的制作
注:此邮票由 NUCEL 集团 (https://w3nucel.webhostusp.sti.usp.br/) 定制。该印章装置是使用参考软件开发的,该软件因其精度和先进的三维建模功能而得到广泛认可。
- 确保设计的原型具有 663 个微针,这些微针的排列能够产生相同数量的三维培养物,例如球状体或类器官。为确保 T6 托盘表面印记的稳定性,请沿设备的圆周战略性地放置五个支撑点。
- 确保微销采用锥形设计,尺寸可调,长度从 1 到 3 mm 不等。锥体的基直径在 0.7 到 1.5 mm 之间变化,而锥角范围从 5° 到 10°。
- 确保设备的“停止”结构(定义微销的深度)具有 10 至 19 毫米的可调长度和 20 至 40 毫米的直径,微销均匀分布在其表面上。
- 此外,将设备设计为具有符合人体工程学的手柄,适合单手作,以提高使用过程中的实用性和精度。
注意:为了促进设备的大规模生产,提供了 .stl 格式的数字文件,这对于 3D 打印过程至关重要。 - 只需使用适当的软件对其进行切片,然后使用兼容的 3D 打印机打印即可。使用以下打印尺寸:X - 68 毫米;Y - 120 毫米;Z - 150 mm,确保功能和结构质量之间的理想平衡。
- 对于设备的制造,请使用可光固化的 3D 打印机,该打印机与可 UV 固化聚合物树脂兼容,该树脂必须具有高分辨率和均匀的表面光洁度,这是实现最佳设备性能的基本特性。
- 使用与所选 3D 打印机兼容的软件对数字模型进行切片以进行打印。
2. 琼脂糖微孔的制备
- 准备琼脂糖溶液。
- 称取纯琼脂糖粉末并将其溶解在 1x 磷酸盐缓冲盐水 (PBS) 中,以达到 1-2% (w/v) 的最终浓度。
- 在微波炉或水浴中加热溶液直至完全溶解,确保其均匀透明。
注:避免过热或过度再加热,因为这会降解琼脂糖。不要准备大量储备液。 - 让溶液冷却至 ~40 °C,这是移液的理想温度。
- 准备定制的印章。
- 用软毛海绵和蒸馏水清洗邮票以去除残留物。
- 将清洁后的印章暴露在紫外线下 5-10 分钟以确保无菌。
- 形成微孔。
- 将 ~3 mL 的 40 °C 琼脂糖溶液倒入/移液到 6 孔板的每个孔中,确保 2-3 mm 的均匀深度。
- 将定制的邮票放在孔的中心,同时琼脂糖仍然温暖。
注意:邮票具有确保对齐和稳定性的横向支撑,无需手动支撑。每个印章每孔产生 ~663 个微孔(~2 mm 高)。确保 micropin 上没有气泡;如果形成气泡,请轻轻移动邮票以消除气泡。 - 让琼脂糖在室温下固化 5-10 分钟,不要移动板。
注:在凝固过程中不要干扰琼脂糖,以避免微孔结构发生变化。 - 轻轻地来回移动去除印章,以释放真空而不会损坏微孔。
注:这种运动有助于空气进入,从而可以顺利去除印记而不会使凝胶变形。微孔必须保持完整。 - 用 PBS 溶液洗涤微孔 3 次以去除残留物。
- 将板暴露在紫外线下 10 分钟以消除微生物污染。
- 加入 3 mL 培养基,并将板在 CO2 培养箱中于 37 °C 孵育过夜。
注:该孵育在细胞接种前验证是否存在污染。
3. 在微孔中接种细胞
- 准备细胞悬液。
- 通过胰蛋白酶消化或其他解离方法收集细胞以获得均匀的悬浮液。
- 计数细胞并根据每个微孔的所需数量调整浓度。
注:要在 663 个微孔中每个微孔接种 5,000 个细胞,请制备至少含有 3.315 × 10个 6 个细胞的悬浮液。优化细胞浓度以防止中枢坏死并确保足够的营养和氧气扩散。
- 为细胞接种。
- 将 ~3 mL 制备好的细胞悬液移液移液到微孔上,轻轻旋转板以确保均匀分布。
- 让细胞通过重力沉降(~10-15 分钟)或以 100 × g 温和离心 5 分钟。
注:离心可用于确保细胞在微孔中浓缩。 - 将板转移到 37 °C 且具有加湿气氛的 CO2 培养箱中。
4. 3D 细胞培养物的维护
- 更换培养基。
- 每 2-3 天更换一次培养基,去除 50% 的旧培养基并加入新鲜培养基。
注意:确保微孔在整个培养期间保持浸没状态,以防止脱水。
- 每 2-3 天更换一次培养基,去除 50% 的旧培养基并加入新鲜培养基。
- 监测 3D 培养物的形成。
- 继续培养,直到 3D 结构完全形成和紧凑(例如,原代胰岛培养需要 2-3 天)。
注:对于需要较长形成时间的培养物,每 2-3 天更换一次部分培养基。
- 继续培养,直到 3D 结构完全形成和紧凑(例如,原代胰岛培养需要 2-3 天)。
5. 3D 结构的收集和表征
- 收集球状体/类器官。
- 去除旧培养基,并使用大口径或切割移液器吸头通过剧烈移液收集 3D 结构,以防止压缩或解聚。
注意:必须控制剧烈的移液以去除聚集体而不会使它们变形。
- 去除旧培养基,并使用大口径或切割移液器吸头通过剧烈移液收集 3D 结构,以防止压缩或解聚。
- 准备分析。
- 立即使用收集的球状体/类器官或修复它们以备将来分析。
注:球体的结合和稳定性取决于细胞类型、形成时间和培养条件。小心以避免分离。
- 立即使用收集的球状体/类器官或修复它们以备将来分析。
结果
本研究中使用的细胞培养物来源于猪胰岛。本研究中使用的胰岛制剂具有 80 ± 5% 纯度(基于二硫腙染料染色)和 >80% 胰岛细胞活力(基于活细胞中荧光素二乙酸酯或死细胞中碘化丙啶的检测)(活/死荧光法)。确保猪胰岛制剂的纯度至少为 80%(例如,通过二硫腙染色)和 >80% 的存活率。分离后,在 CMRL 1066 培养基中维持贴壁培养物,补充有 1 mM L-谷氨酰胺、0.2% 环丙沙星和 10% 胎牛血清 (FCS),在 37 °C 和 5% CO2 下,如前所述11,12。
在本研究中,彻底评估了基于 stamp 的系统在琼脂糖模具中生成微孔的有效性(图 1)。 图 2 所示的印章设计展示了微探针的精度及其放置,有助于在微孔形成过程中保持一致的对齐和处理。这确保了整个板的微孔模式一致,这是实现可重复 3D 细胞培养的关键特征。
图 3 详细介绍了使用印章形成微孔的过程,其中可视化了印章创建均匀微孔的能力。结果证实,可以同时使用多个邮票,从而简化准备过程。琼脂糖模具的显微分析揭示了凹面、标准化的微孔形状,这是控制细胞聚集成 3D 结构的关键因素。微孔的均匀性显著有助于 3D 培养物形成的可靠性和可重复性,在各种实验中获得的一致结果证明了这一点。
图 4 说明了从细胞接种时间 (0 h) 到几个时间点 (6 h、24 h、48 h 和 72 h) 的 3D 结构的时间依赖性发育。细胞压实成聚集/紧凑的 3D 结构逐渐发生,在 48 小时标记处观察到显着的聚集。该时间表可能因细胞类型而异,本研究中使用原代猪胰岛证明了这一点,它在 48 小时内形成了紧凑而实用的 3D 结构。这证明了该方案在生成有组织的 3D 培养物方面的有效性。
图 5 突出显示了从琼脂糖微孔中取出 3D 结构后的稳定性和活力。3D 结构在去除后保留了它们的构象(图 5A),证实了该方法的稳健性。此外,活/死测定(图 5B、C)表明结构内的细胞仍然有活力,如活细胞的绿色染色所示。这一发现证实,该方案不仅有助于形成组织良好的 3D 结构,而且还保留了细胞活力,使其成为 3D 细胞培养应用的可靠和有效的方法。
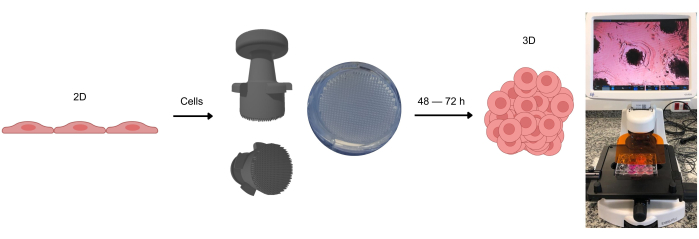
图 1:形成 3D 细胞培养物的过程。 最初以 2D 形式培养的细胞从贴壁表面分离并置于琼脂糖微孔中。这些琼脂糖微孔是使用 stamp 装置制备的,该装置允许在琼脂糖凝胶在室温下固化后形成这些微孔。在光学显微镜下观察时,可以看到细胞均匀分布在微孔中。大约 2-3 天后(取决于细胞类型),可以观察到球状体或类器官的形成。 请单击此处查看此图的较大版本。

图 2:Stamp 设备。 从 (A-C) 从三个不同角度拍摄的印章装置的代表性图像,说明了其主要特征,即:663 个微销、印版支撑和手动处理支撑。 请单击此处查看此图的较大版本。

图 3:微井模生产过程的分步表示。 (A) 印章装置;(B) 将 stamp 装置定位在含有液体琼脂糖的孔的中心;(C) 琼脂糖聚合;(D) 由 stamp 装置成型的琼脂糖微孔;(E) 在同一印版中使用三个印章装置的生产演示 (P6);(F) 微孔在 4 倍放大倍率下的光学显微镜图像(比例尺 = 1,000 μm);(G) 微孔在 10 倍放大倍率(比例尺 = 400 μm)下的光学显微镜图像。 请单击此处查看此图的较大版本。

图 4:原代胰岛猪培养物的光学显微镜图像。 在以下时间点以 2 倍(比例尺 = 2,000 μm)、4 倍(比例尺 = 1,000 μm)和 10 倍(比例尺 = 400 μm)放大的图像:0 小时、6 小时、24 小时、48 小时、72 小时。 请单击此处查看此图的较大版本。

图 5:活/死测定。 代表性图像显示了猪胰岛细胞原代培养物的球体活力,这些球体在琼脂糖微孔中产生,并在 3D 培养 72 小时(3 天)后使用改进的 stamp 装置收集。获得荧光光学显微镜图像。绿色染色表示用荧光素二乙酸酯标记的活细胞,而红色染色表示用碘化丙啶标记的非活细胞。图像证实,3D 培养物的球状结构在从微孔中取出后保持不变并保持活力。比例尺 = 400 μm。 请点击此处查看此图的较大版本。
讨论
尽管文献中存在各种 3D 培养方案,但 Wassmer 等人进行的一项研究13 测试了使用胰岛生成 3D 结构的几种方法。作者观察到,天然胰岛和自聚集球体在大小和形状方面表现出相当大的异质性,并且比使用其他方法获得的球体更大。根据他们的发现,他们得出结论,球体可以使用不同的技术生成,每种技术都有自己的优点和缺点。对于胰岛细胞聚集,推荐的方法是悬滴技术、琼脂糖微孔板或 Sphericalplate 5D。
文献中已成功使用用于生成琼脂糖微孔的装置。例如,Stuart 等人14 使用设备显示出有希望的结果,但它存在一些需要解决的缺点。这些特点包括它可以生产的微孔数量有限,由于模具面积小而减少了工作体积,以及它的设计为负模,这使得处理复杂化,并增加了微孔破损和变形的风险。
Charelli 及其同事15 使用 3D 打印技术开发了一种用于生成球体的类似邮票的装置。该装置能够为每个 6 孔板产生多达 4,716 个球体,它是通过使用光固化树脂的立体光固化技术制造的。由此产生的器件具有圆柱形微引脚,每个微引脚高 1.3 mm,宽 650 μm。这种方法能够快速形成形状和大小一致的均匀球体,包括共培养的球体。尽管具有优势,但必须解决一些挑战才能提高其可用性和性能。一个重要的问题是缺乏人工支持,这使得设备难以作并且在模具形成过程中容易不稳定。这种不稳定性通常会导致琼脂糖凝胶破裂或开裂,从而损害其结构完整性。此外,该设备缺乏板支撑,这意味着它无法牢固地固定在孔板上。因此,必须手动悬浮印记,直到琼脂糖凝固,从而引入可变性并影响微孔形成的均匀性。这些限制降低了所得微球的可重复性和整体质量。
我们改进的标记/方案允许一种高效且低成本的方法,在琼脂糖微孔中生成 3D 球状体和类器官,以其简单性和可重复性而著称。受 Decarli 及其同事16 工作的启发,我们小组使用非粘附性琼脂糖水凝胶方法开发了一种新的邮票装置。因此,我们解决了微井形成中的处理困难和不一致等问题。通过我们的方法开发的邮票融合了这些改进,使其更加用户友好、高效且高度可重复。
关于修饰,可以针对不同的细胞类型和实验目的调整细胞密度。对于增殖率低或细胞相互作用有限的细胞,可能需要较高的细胞接种密度,而对于某些细胞类型,较低的密度可能有利于更好的结构组织。如果球状体形成出现问题,小的修改(例如快速离心板)可能有助于细胞在微孔底部正确沉淀。
该方案的关键步骤之一是将细胞准确均匀地接种到微孔中。均匀的细胞分布对于确保形成的结构具有一致的尺寸和均匀的特性至关重要,这直接影响结果的质量。3D 培养物的收集是另一个关键点。此步骤需要格外小心,以避免在检索过程中破坏结构,需要适当的移液技术来保持球状体和类器官的完整性。
球体的大小将根据所使用的单元类型而变化。此外,每个球状体的细胞数量也各不相同,必须根据所使用的特定细胞系或原代细胞进行优化。值得注意的是,正如文献报道的那样,球状体内过高的细胞密度已被证明会导致坏死核心的发展。这种坏死的核心是由于氧气和营养物质扩散到最内层细胞不足造成的,这可能会损害球体的整体活力和功能17。
尽管该方法具有简单和低成本的优点,但该方法的一个重大局限性是球体收集的潜在可变性,尤其是在需要更大和更复杂结构的实验中。在这种情况下,可能需要使用更专业的采集工具,甚至需要对方法进行调整,以优化流程并减少材料损失。获得非常小的球体也可能使作和收集复杂化,需要严格的协议控制。
球状体/类器官的结合和解离差异很大,具体取决于所使用的细胞类型、结构形成所需的天数、使用的培养基以及可能的搅拌需求。这些因素是每种细胞类型的特定特征所固有的。然而,为了尽量减少细胞解离,必须严格遵循方法中概述的预防措施,例如在培养基更换期间轻柔处理和适当维护培养条件。
与其他方法(如旋转培养或磁珠)相比,该方案因其更简单而突出,无需专用设备并确保 3D 球体和类器官的生产更具可重复性,使其成为广泛研究目的的实用替代方案。根据文献13 中先前描述的结果,与其他商业模型(如 Sphericalplate 5D)相比,琼脂糖微孔有助于产生胰岛素的细胞产生 3D 球状体结构,具有更高的活力和胰岛素分泌率。
该方法的多功能性与低成本相结合,使其成为各种研究领域的理想选择,例如细胞生物学、肿瘤学、药物开发研究和毒理学。它为体外 3D 建模提供了有效的 解决方案 ,有助于对细胞行为、细胞相互作用、药物反应和疗法开发进行更精确的研究。
披露声明
作者声明他们没有利益冲突。
致谢
我们特别感谢 Zizi de Mendonça(巴西圣保罗大学医学院)提供的出色技术援助。这项工作得到了以下巴西研究机构的资助:BNDES 09.2.1066.1、CAPES(PVE 流程编号 88881.068070/2014-01)、CNPq(资助编号 457601/2013-2、401430/2013-8 和 INCT-Regenera 编号 465656/2014-5)、FAPESP(主题项目编号 2016/05311-2)、FINEP 01.08.06.05 以及科学技术部 (MCTI) 和卫生部 (MS-DECIT)。
材料
| Name | Company | Catalog Number | Comments |
| 31L Microwave | Electrolux | 78965840 6699 9 | Equipment used to heat the agarose solution, facilitating its dissolution and ensuring greater homogeneity. It allows the solution to reach the ideal liquid state for the formation of the wells. |
| 3DFila Gray Opaque Photosensitive 3D Resin | UV-curable polymer resin | ||
| 3D Printer - Creality Halot One | Creality | N/A | 3D printer used for printing the stamp device |
| Agarose | UNISCIENCE | UNI-R10111 | To form the gel, dissolve 1 to 2% in Saline Phosphate Buffer (PBS) or appropriate medium. |
| Autodesk Fusion 360 | 3D modeling | ||
| BB15 CO2 Incubator | Thermo Fisher | 51023121 | Equipment used to incubate cultured cells in a suitable and controlled environment. |
| Chitubox | Chitubox | N/A | Software used for slicing the part for printing |
| Class II Biological Safety Cabinet | Grupo VECO | N/A | Ensures a sterile environment for performing cell culture within established parameters and protocols. |
| Culture medium | USBiological/Life Sciences | C5900-03A | Contains additives for proper cell cultivation. |
| Culture plates (P6) | SARSTEDT | 1023221 | Used to shape the agarose and culture the cells. |
| Erlenmeyer Flask (25 mL) | Laborglas | 91 216 14 | A container used for dissolving 1–2% agarose in Phosphate Buffered Saline (PBS) or another suitable medium, typically heated in a microwave. |
| Falcon 15 mL Polystyrene Centrifuge Tube | Corning | 352099 | Used to keep cells in suspension and perform possible dilutions. |
| Fetal bovine serum (FBS) | Vitrocell Embriolife | 005/19 | Additive for culture medium. |
| PBS solution (Saline Phosphate Buffer) | Lab made | N/A | Diluted 1x with MiliQ ultrapure water. Used to dissolve agarose 1 to 2% and to wash wells already produced. |
| Reagent bottle with blue cap - Schott | Laborglas | 21801545 | Used for preparing and storing culture medium. |
| Stamp device | NUCEL Group | N/A | Link- This link provides access to the .stl file of the stamp device. Simply slice it using appropriate software and print it with a compatible 3D printer. https://drive.google.com/drive/folders/1gTYComnJWzHpN6ZKOyK EChKS3Qns0rOA?usp=sharing |
| Treated culture flask with filter 25 cm² | Corning | 430639 | Used for the cultivation and maintenance of adherent cells. |
| Trypsin | Merck | 07-07-9002 | For dissociation of cells before seeding. |
| Ultra violet light (UV) | N/A | N/A | Used to sterilize the stamp and plates. |
参考文献
- Lian, J., Yue, Y., Yu, W., Zhang, Y. Immunosenescence: a key player in cancer development. J Hematol Oncol. 13 (1), 151 (2020).
- Wang, F., et al. Reciprocal interactions between beta1-integrin and epidermal growth factor receptor in three-dimensional basement membrane breast cultures: a different perspective in epithelial biology. Proc Natl Acad Sci USA. 95 (25), 14821-14826 (1998).
- Dzobo, K., Dandara, C. The extracellular matrix: its composition, function, remodeling, and role in tumorigenesis. Biomimetics. 8 (2), 146 (2023).
- Sutherland, R. M., McCredie, J. A., Inch, W. R. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. J Natl Cancer Inst. 46 (1), 113-120 (1971).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Bialkowska, K., Komorowski, P., Bryszewska, M., Milowska, K. Spheroids as a type of three-dimensional cell cultures-examples of methods of preparation and the most important application. Int J Mol Sci. 21 (17), 6225 (2020).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. J Vis Exp. (81), e50665 (2013).
- Andersen, T., Auk-Emblem, P., Dornish, M. 3D Cell culture in alginate hydrogels. Microarrays (Basel). 4 (2), 133-161 (2015).
- Hou, S., et al. Advanced development of primary pancreatic organoid tumor models for high-throughput phenotypic drug screening. SLAS Discov. 23 (6), 574-584 (2018).
- Napolitano, A. P., et al. Scaffold-free three-dimensional cell culture utilizing micromolded nonadhesive hydrogels. Biotechniques. 43 (4), 494-500 (2007).
- Maria-Engler, S. S., et al. Co-localization of nestin and insulin and expression of islet cell markers in long-term human pancreatic nestin-positive cell cultures. J Endocrinol. 183 (3), 455-467 (2004).
- Mantovani, M. C., et al. Immobilization of primary cultures of insulin-releasing human pancreatic cells. Islets. 1 (3), 224-231 (2009).
- Wassmer, C. H., et al. Engineering of primary pancreatic islet cell spheroids for three-dimensional culture or transplantation: a methodological comparative study. Cell Transplant. 29, 963689720937292 (2020).
- Stuart, M. P., et al. Successful low-cost scaffold-free cartilage tissue engineering using human cartilage progenitor cell spheroids formed by micromolded nonadhesive hydrogel. Stem Cells Int. 2017, 7053465 (2017).
- Charelli, L. E., Dernowsek, J. A., Balbino, T. A. Generation of tissue spheroids via a 3D printed stamp-like device. J Vis Exp. (188), e63814 (2022).
- Decarli, M. C. Micromold for the production of cellular spheroids and use. , (2019).
- Riffle, S., Pandey, R. N., Albert, M., Hegde, R. S. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids. BMC Cancer. 17, 338 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。