Method Article
Erzeugung von dreidimensionalen Sphäroiden/Organoiden aus zweidimensionalen Zellkulturen mit Hilfe eines neuartigen Stempelgeräts
In diesem Artikel
Zusammenfassung
In dieser Studie wird eine kostengünstige und effiziente Methodik zur Generierung von 3D-Zellstrukturen unter Verwendung eines stempelbasierten Systems zur Erstellung von Mikrovertiefungen in Agaroseformen vorgestellt. Das System fördert die Bildung einheitlicher Sphäroide/Organoide und verbessert so die Zellinteraktionen. Dieser Ansatz reduziert die experimentelle Variabilität und unterstützt Anwendungen in der Wirkstoffdiagnostik und im Tissue Engineering.
Zusammenfassung
Dreidimensionale (3D) Zellkulturen bieten eine genauere Darstellung der in vivo Mikroumgebung als herkömmliche zweidimensionale (2D) Kulturen, da sie verbesserte Interaktionen zwischen Zellen und der extrazellulären Matrix fördern. Ziel dieser Studie war es, eine effiziente, kostengünstige und reproduzierbare Methodik zur Erzeugung von 3D-Zellstrukturen (Sphäroide/Organoide) unter Verwendung eines innovativen stempelbasierten Systems zur Herstellung von Mikrovertiefungen in Agaroseformen zu entwickeln. Ein neuartiger Stempel wurde verwendet, um 663 Mikrowells pro Well einer 6-Well-Platte herzustellen, was eine ideale Umgebung für die Zellaggregation bietet. Primäre Pankreas-Inselzellen des Schweins wurden in diese Mikrovertiefungen ausgesät, wo sie sich zu Sphäroiden/Organoiden zusammenballten. Die Kulturen wurden bei 37 °C unter 5 % CO2 inkubiert, und das Medium wurde alle 3 Tage ausgetauscht. Die Sphäroidbildung wurde periodisch überwacht und Proben zur Charakterisierung entnommen. Die Methode erzeugte erfolgreich einheitliche und qualitativ hochwertige Sphäroide, wodurch die experimentelle Variabilität reduziert, Manipulationen minimiert und Zellinteraktionen verbessert wurden. Die Verwendung von Mikromusterformen auf Agarosebasis bot eine vereinfachte, kontrollierte Umgebung für 3D-Kulturen und bot eine standardisierte und kostengünstige Lösung. Diese Methodik unterstützt Anwendungen für Wirkstofftests und Tissue Engineering und bietet eine praktische und skalierbare Plattform für 3D-Zellkulturmodelle, die einfach in verschiedenen Laborumgebungen implementiert werden können.
Einleitung
In den letzten 50 Jahren haben zahlreiche zellbiologische Untersuchungen gezeigt, dass zweidimensionale (2D) Kulturen die in vivo Bedingungen, die in Tiermodellen beobachtet wurden, nicht genau replizierenkönnen 1. Strukturell erlauben 2D-Zellkulturen es den Zellen nicht, sich dreidimensional zu organisieren und die in In-vivo-Systemen beobachtete Situation zu replizieren. Darüber hinaus sind zelluläre Signalwege in 2D-Kulturen im Vergleich zu dreidimensionalen (3D) Kulturen verändert, was wahrscheinlich erklären könnte, warum bestimmte Arten des Wirkstoffscreenings mit 2D-Kulturen so unterschiedlich sind2. Ein bedeutender Fortschritt in der Zellkulturtechnik entstand mit der Einführung von 3D-Kultursystemen. 3D-Systeme variieren in ihrer Komplexität je nach zellulärer Zusammensetzung und Zytoarchitektur erheblich. Im Allgemeinen werden zwei Arten von Strukturen erzeugt, nämlich: Sphäroide und Organoide. Sphäroide werden als einfache Ansammlungen von Zellen beschrieben, die aus normalem oder Tumorgewebe, Embryoidkörpern und Zelllinien gewonnen werden. Die Bildung von 3D-Strukturen wird von verschiedenen Faktoren beeinflusst, darunter Zell-Zell-Interaktionen und Signalwege, die durch Komponenten der extrazellulären Matrix (ECM) vermittelt werden, die strukturelle Unterstützung und biochemische Signale bieten. Diese Elemente regulieren Wechselwirkungen, die zur Organisation und Funktion des Gewebes beitragen3. Das Sphäroidkultursystem wurde erstmals in den frühen 1970er Jahren beschrieben, wobei V79-Lungenzelllinien des chinesischen Hamsters als Modell für knotige Karzinome verwendet wurden, die unter nicht adhärenten Bedingungen wachsen und perfekte Kugeln bilden4. Organoide werden als Cluster organspezifischer Zelltypen beschrieben, die von Stamm- oder Vorläuferzellen abgeleitet sind und sich durch Prozesse wie Zellsortierung und Abstammungsspezifikation räumlich begrenzt selbst organisieren, was die in vivo-Entwicklung widerspiegelt5.
Für die Kultivierung von Zellen unter 3D-Bedingungen stehen mehrere verfügbare Methoden und Materialien zur Verfügung. Die wichtigsten Methoden, die derzeit zur Erzeugung von 3D-Kulturen verwendet werden, sind: 1) hängende Tropfen; 2) rotierende Zellkultur und Kunststoffe mit geringer Anhaftung; 3) Pyramidenplatten mit konischen Vertiefungen; 4) makroporöse Gerüste; 5) magnetische Kügelchen; und 6) gerüstfreie Hydrogele.
Hängende Tropfen sind die Methode, mit der gerüstfreie 3D-Kulturen erhalten werden. Dieses Verfahren weist gewisse Einschränkungen auf, darunter die Notwendigkeit einer umfangreichen Handhabung, eine geringe Produktionseffizienz, eine sphärische Geometrie und die Exposition gegenüber hohen Scherkräften. Darüber hinaus können bestimmte Verfahren, wie z. B. der Ersatz des Mediums oder die Zugabe von Verbindungen, eine Herausforderung darstellen und zu Materialverlusten führen. Darüber hinaus deuten Literaturberichte darauf hin, dass einige Zelllinien bei Verwendung dieses Ansatzes keine dicht gepackten Sphäroide produzieren6.
Rotierende Zellkulturen und Kunststoffe mit geringer Bindung werden verwendet, um zu verhindern, dass sich Zellen an das Substrat anheften, wodurch sie sich zusammenlagern und Sphäroide bilden. Dieser Prozess erfordert spezielle Kolben und/oder Rühren/Drehen. Obwohl dies einer der einfachsten Ansätze für die großtechnische Produktion von Sphäroiden oder Organoiden ist, ist er nicht ohne Nachteile, wie z. B. die Notwendigkeit einer speziellen Ausrüstung, eine geringe Langlebigkeit der Kultur, Größenunterschiede bei Sphäroiden, mechanische Schädigung der Zellen und eine geringe Effizienz6.
Pyramidenplatten mit konischen Vertiefungen sind kommerziell erhältliche Platten, die sich auf die Kosten auswirken, zusätzlich zu der Tatsache, dass einige Manipulationen die Bildung von Sphäroiden/Organoiden behindern können7.
Makroporöse Gerüste werden auch für die 3D-Kultivierung eingesetzt. Ein großes Hindernis liegt jedoch darin, ein effektives Cell Seeding und eine gleichmäßige Verteilung zu erreichen. Dieses Problem tritt auf, weil die Porengrößen entweder zu klein für die Zellpenetration oder zu groß sein können, um die Zellen sicher zu halten. Um dieses Problem anzugehen, wurden mehrere Strategien untersucht8, die sich direkt auf die Komplexität und die Kosten dieser Technik auswirken.
Die Methode der magnetischen Beads erzeugt eine kleine Anzahl von Sphäroiden/Organoiden, ist mit hohen Kosten verbunden und kann Nanopartikelrückstände in den Zellen hinterlassen9.
Unter den Systemen zur Kultivierung von Sphäroiden stehen nicht-adhäsive Agarose-Hydrogele zur Verfügung, die ein gerüstfreies Hydrogel darstellen. Dieser Ansatz bietet bemerkenswerte Vorteile, wie z. B. eine präzise Kontrolle über die Größe der 3D-Strukturen und die Möglichkeit, eine beträchtliche Anzahl dieser Strukturen pro Platte zu erzeugen. Bei diesem Verfahren werden Zellen in ein Hydrogel mit vorgeformten Vertiefungen eingebracht, in dem sie absinken und sich selbst zu 3D-Sphäroiden10 zusammensetzen.
In dieser Studie stellen wir ein Gerät und eine Methodik zur einfachen, effizienten, reproduzierbaren und kostengünstigen Erzeugung von Agarose-Mikrovertiefungen unter Verwendung einer Mikromusterform vor.
Die Verwendung dieses Stempels als Form zur Erzeugung von Mikrovertiefungen in Agarose mit Hilfe der Schwerkraft zielt darauf ab, die Zellinteraktion innerhalb der Mikrotiter- und Zellorganisation zu verbessern, indem 3D-Strukturen (Sphäroide/Organoide) in vitro auf einfache, effiziente, reproduzierbare und kostengünstige Weise erzeugt werden, wodurch Forschungszeit und Laborressourcen gespart werden.
Protokoll
Dieses Protokoll folgt den Richtlinien der Ethikkommission für Humanforschung unserer Institution CEUA-FMUSP: 1699/2021, genehmigt am 8. September 2021 - "Isolierung und Verkapselung von porcinen Pankreasinseln" und ist Teil des thematischen Projekts unserer Zell- und Molekulartherapie NUCEL Group (www.usp.br/nucel), FAPESP Grant Nr. 2016/05311-2, mit dem Titel: "Regenerative Medizin mit dem Ziel der Therapie chronisch-degenerativer Erkrankungen (Krebs und Diabetes)".
1. Herstellung der Stempelvorrichtung
HINWEIS: Dieser Stempel wird von der NUCEL-Gruppe (https://w3nucel.webhostusp.sti.usp.br/) nach Maß gefertigt. Das Stempelgerät wurde unter Verwendung der referenzierten Software entwickelt, die weithin für ihre Präzision und fortschrittlichen dreidimensionalen Modellierungsfähigkeiten anerkannt ist.
- Stellen Sie sicher, dass die entworfenen Prototypen über 663 Mikropins verfügen, die so angeordnet sind, dass eine entsprechende Anzahl dreidimensionaler Kulturen, wie z. B. Sphäroide oder Organoide, erzeugt werden kann. Um die Stabilität des Stempels auf den Oberflächen des T6-Tabletts zu gewährleisten, positionieren Sie fünf Stützpunkte strategisch entlang des Umfangs des Geräts.
- Achten Sie darauf, dass die Mikropins ein konisches Design mit einstellbaren Abmessungen von 1 bis 3 mm Länge haben. Der Basisdurchmesser des Konus variiert zwischen 0,7 und 1,5 mm, während der Kegelwinkel zwischen 5° und 10° liegt.
- Achten Sie darauf, dass die "Stopp"-Struktur des Geräts, die die Tiefe der Mikrostifte definiert, eine einstellbare Länge von 10 bis 19 mm und einen Durchmesser von 20 bis 40 mm hat, wobei die Mikrostifte gleichmäßig über die Oberfläche verteilt sind.
- Darüber hinaus sollte das Gerät mit einem ergonomischen Griff ausgestattet sein, der für die Einhandbedienung geeignet ist, um die Praktikabilität und Präzision während des Gebrauchs zu verbessern.
HINWEIS: Um die Großserienproduktion des Geräts zu erleichtern, wird die digitale Datei im .stl-Format bereitgestellt, die für den 3D-Druckprozess unerlässlich ist. - Schneiden Sie es einfach mit einer geeigneten Software in Scheiben und drucken Sie es mit einem kompatiblen 3D-Drucker. Verwenden Sie folgende Druckmaße: X - 68 mm; Y - 120 mm; Z - 150 mm, um ein ideales Gleichgewicht zwischen Funktionalität und struktureller Qualität zu gewährleisten.
- Verwenden Sie für die Herstellung des Geräts einen lichthärtenden 3D-Drucker, der mit dem UV-härtenden Polymerharz kompatibel ist, das eine hohe Auflösung und eine gleichmäßige Oberflächenbeschaffenheit aufweisen muss, wesentliche Eigenschaften für eine optimale Leistung des Geräts.
- Schneiden Sie das digitale Modell für den Druck mit einer Software auf, die mit dem ausgewählten 3D-Drucker kompatibel ist.
2. Vorbereitung von Agarose-Mikrovertiefungen
- Bereiten Sie die Agaroselösung vor.
- Wiegen Sie das reine Agarosepulver und lösen Sie es in 1x phosphatgepufferter Kochsalzlösung (PBS) auf, um eine Endkonzentration von 1-2% (w/v) zu erreichen.
- Erhitzen Sie die Lösung in der Mikrowelle oder im Wasserbad, bis sie sich vollständig aufgelöst hat, um sicherzustellen, dass sie homogen und transparent ist.
HINWEIS: Vermeiden Sie Überhitzung oder übermäßiges Erhitzen, da dies die Agarose beschädigen kann. Bereiten Sie keine großen Mengen der Stammlösung vor. - Lassen Sie die Lösung auf ~40 °C abkühlen, die ideale Temperatur zum Pipettieren.
- Bereiten Sie den individuell angefertigten Stempel vor.
- Waschen Sie den Stempel mit einem Schwamm mit weichen Borsten und destilliertem Wasser, um Rückstände zu entfernen.
- Setzen Sie den gereinigten Stempel 5-10 Minuten lang UV-Licht aus, um die Sterilität zu gewährleisten.
- Bilden Sie die Mikrovertiefungen.
- Gießen/pipettieren Sie ~3 mL der 40 °C heißen Agaroselösung in jede Vertiefung einer 6-Well-Platte, wobei eine gleichmäßige Tiefe von 2-3 mm sichergestellt wird.
- Positionieren Sie den speziell angefertigten Stempel in der Mitte der Vertiefung, solange die Agarose noch warm ist.
HINWEIS: Der Stempel verfügt über seitliche Stützen, die eine Ausrichtung und Stabilität gewährleisten, so dass keine manuelle Unterstützung erforderlich ist. Jeder Stempel erzeugt ~663 Mikrowells (~2 mm Höhe) pro Well. Stellen Sie sicher, dass sich keine Blasen auf den Mikropins befinden. Wenn sich Blasen bilden, bewegen Sie den Stempel vorsichtig, um sie zu entfernen. - Lassen Sie die Agarose 5-10 min bei Raumtemperatur erstarren, ohne die Platte zu bewegen.
HINWEIS: Stören Sie die Agarose während der Erstarrung nicht, um Schwankungen in der Mikrotiterstruktur zu vermeiden. - Entfernen Sie den Stempel mit sanften Hin- und Herbewegungen, um das Vakuum zu lösen, ohne die Mikrowells zu beschädigen.
HINWEIS: Diese Bewegung erleichtert den Lufteintritt und ermöglicht ein reibungsloses Entfernen des Stempels, ohne das Gel zu verformen. Die Mikrovertiefungen müssen intakt bleiben. - Waschen Sie die Mikrovertiefungen 3x mit PBS-Lösung, um Rückstände zu entfernen.
- Setzen Sie die Platte 10 Minuten lang UV-Licht aus, um eine mikrobielle Kontamination zu vermeiden.
- Geben Sie 3 ml Nährmedium hinzu und inkubieren Sie die Platte über Nacht in einem CO2 - Inkubator bei 37 °C.
HINWEIS: Bei dieser Inkubation wird vor der Aussaat der Zellen überprüft, ob keine Kontamination vorliegt.
3. Zellaussaat in Mikrovertiefungen
- Bereiten Sie die Zellsuspension vor.
- Sammeln Sie die Zellen durch Trypsinisierung oder eine andere Dissoziationsmethode, um eine homogene Suspension zu erhalten.
- Zählen Sie die Zellen und passen Sie die Konzentration entsprechend der gewünschten Anzahl pro Mikrotiterplatte an.
HINWEIS: Um 5.000 Zellen pro Mikrotiterplatte in 663 Mikrovertiefungen zu säen, bereiten Sie eine Suspension vor, die mindestens 3.315 × insgesamt 106 Zellen enthält. Optimieren Sie die Zellkonzentration, um zentrale Nekrosen zu verhindern und eine ausreichende Nährstoff- und Sauerstoffdiffusion zu gewährleisten.
- Säen Sie die Zellen aus.
- Pipettieren Sie ~3 mL der vorbereiteten Zellsuspension über die Mikrowells und sorgen Sie für eine gleichmäßige Verteilung, indem Sie die Platte vorsichtig schwenken.
- Lassen Sie die Zellen durch die Schwerkraft absetzen (~10-15 min) oder führen Sie eine sanfte Zentrifugation bei 100 × g für 5 min durch.
HINWEIS: Eine Zentrifugation kann verwendet werden, um sicherzustellen, dass sich die Zellen in den Mikrovertiefungen konzentrieren. - Die Platte wird in einen CO2 -Inkubator bei 37 °C und befeuchteter Atmosphäre überführt.
4. Pflege von 3D-Zellkulturen
- Tauschen Sie das Nährmedium aus.
- Wechseln Sie das Medium alle 2-3 Tage, entfernen Sie 50 % des alten Mediums und fügen Sie frisches Medium hinzu.
HINWEIS: Stellen Sie sicher, dass die Mikrovertiefungen während des gesamten Kulturzeitraums untergetaucht bleiben, um ein Austrocknen zu verhindern.
- Wechseln Sie das Medium alle 2-3 Tage, entfernen Sie 50 % des alten Mediums und fügen Sie frisches Medium hinzu.
- Überwachen Sie die Bildung von 3D-Kulturen.
- Fahren Sie mit der Kultivierung fort, bis die 3D-Strukturen vollständig ausgebildet und kompakt sind (z. B. 2-3 Tage für primäre Pankreas-Inselkulturen).
HINWEIS: Bei Kulturen, die eine längere Formationszeit erfordern, alle 2-3 Tage einen teilweisen Mediumwechsel durchführen.
- Fahren Sie mit der Kultivierung fort, bis die 3D-Strukturen vollständig ausgebildet und kompakt sind (z. B. 2-3 Tage für primäre Pankreas-Inselkulturen).
5. Sammlung und Charakterisierung von 3D-Strukturen
- Sammle die Sphäroide/Organoide.
- Entfernen Sie das alte Medium und sammeln Sie die 3D-Strukturen durch kräftiges Pipettieren mit einer Pipettenspitze mit großem Durchmesser oder abgeschnitten, um eine Kompression oder Disaggregation zu verhindern.
HINWEIS: Durch kräftiges Pipettieren muss kontrolliert werden, um die Aggregate zu lösen, ohne sie zu verformen.
- Entfernen Sie das alte Medium und sammeln Sie die 3D-Strukturen durch kräftiges Pipettieren mit einer Pipettenspitze mit großem Durchmesser oder abgeschnitten, um eine Kompression oder Disaggregation zu verhindern.
- Bereiten Sie sich auf die Analyse vor.
- Verwenden Sie die gesammelten Sphäroide/Organoide sofort oder fixieren Sie sie für zukünftige Analysen.
HINWEIS: Die Assoziation und Stabilität von Sphäroiden hängt vom Zelltyp, der Entstehungszeit und den Kulturbedingungen ab. Vorsicht ist wichtig, um Dissoziation zu vermeiden.
- Verwenden Sie die gesammelten Sphäroide/Organoide sofort oder fixieren Sie sie für zukünftige Analysen.
Ergebnisse
Die in dieser Studie verwendete Zellkultur wurde aus Pankreasinseln von Schweinen gewonnen. Das in dieser Studie verwendete Inselpräparat hatte eine Reinheit von 80 ± 5 % basierend auf der Dithizon-Färbung und eine Lebensfähigkeit von >80 % der Inselzellen basierend auf dem Nachweis von Fluoresceindiacetat in lebenden Zellen oder Propidiumiodid in toten Zellen (die Lebend/Tot-Fluoreszenzmethode). Es ist sicherzustellen, dass die Präparation der Pankreasinsel des Schweins zu mindestens 80 % rein (z. B. durch Dithizon-Färbung) und zu >80 % lebensfähig ist. Nach der Isolierung sind die adhärenten Kulturen in CMRL 1066-Medium, ergänzt mit 1 mM L-Glutamin, 0,2 % Ciprofloxacin und 10 % fötalem Kälberserum (FCS), bei 37 °C und 5 % CO2 zu halten, wie zuvor beschrieben11,12.
In der vorliegenden Studie wurde die Wirksamkeit eines stempelbasierten Systems zur Erzeugung von Mikrovertiefungen in Agaroseformen eingehend untersucht (Abbildung 1). Das in Abbildung 2 gezeigte Stempeldesign demonstriert die Präzision der Mikropins und ihrer Platzierung und erleichtert so eine konsistente Ausrichtung und Handhabung während des Mikrotiterbildungsprozesses. Dies gewährleistete einheitliche Mikrotitermuster über die gesamte Platte, ein entscheidendes Merkmal für die Erzielung reproduzierbarer 3D-Zellkulturen.
Der Prozess der Mikrotiterbildung mit dem Stempel ist in Abbildung 3 dargestellt, in der die Fähigkeit des Stempels, gleichmäßige Mikrovertiefungen zu erzeugen, visualisiert wird. Die Ergebnisse bestätigen, dass mehrere Stempel gleichzeitig verwendet werden können, was den Vorbereitungsprozess rationalisiert. Die mikroskopische Analyse der Agarose-Formen zeigt konkave, standardisierte Mikrotiterformen, ein entscheidender Faktor bei der Steuerung der Aggregation von Zellen zu 3D-Strukturen. Die Gleichmäßigkeit der Mikrovertiefungen trägt wesentlich zur Zuverlässigkeit und Reproduzierbarkeit der 3D-Kulturbildung bei, wie die konsistenten Ergebnisse verschiedener Experimente zeigen.
Abbildung 4 veranschaulicht die zeitabhängige Entwicklung von 3D-Strukturen ab dem Zeitpunkt der Zellinokulation (0 h) über mehrere Zeitpunkte (6 h, 24 h, 48 h und 72 h). Die Zellverdichtung in aggregierte/kompakte 3D-Strukturen erfolgte allmählich, wobei nach 48 Stunden eine signifikante Aggregation beobachtet wurde. Dieser Zeitplan kann je nach Zelltyp variieren, wie die Verwendung von primären Pankreasinseln des Schweins in dieser Studie zeigt, die innerhalb von 48 Stunden kompakte und funktionelle 3D-Strukturen bildeten. Dies zeigt die Wirksamkeit des Protokolls bei der Generierung organisierter 3D-Kulturen.
Abbildung 5 zeigt die Stabilität und Lebensfähigkeit der 3D-Strukturen nach der Entnahme aus den Agarose-Mikrovertiefungen. Die 3D-Strukturen behielten nach der Entfernung ihre Konformation bei (Abbildung 5A), was die Robustheit der Methodik bestätigt. Darüber hinaus zeigte der Lebend/Tot-Assay (Abbildung 5B,C), dass die Zellen innerhalb der Strukturen lebensfähig blieben, wie die grüne Färbung lebender Zellen zeigt. Diese Erkenntnis bestätigt, dass das Protokoll nicht nur die Bildung gut organisierter 3D-Strukturen erleichtert, sondern auch die Lebensfähigkeit der Zellen bewahrt, was es zu einem zuverlässigen und effizienten Ansatz für 3D-Zellkulturanwendungen macht.
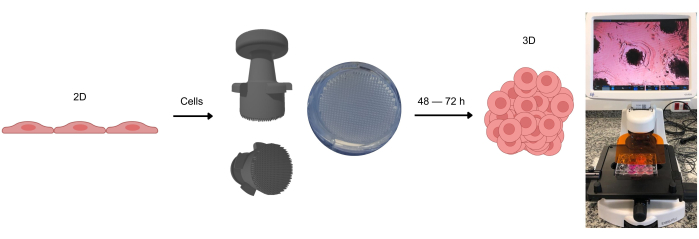
Abbildung 1: Der Prozess der Bildung von 3D-Zellkulturen. Zellen, die zunächst in 2D kultiviert werden, werden von der adhärenten Oberfläche gelöst und in Agarose-Mikrovertiefungen gelegt. Diese Agarose-Mikrowells werden mit einer Stempelvorrichtung hergestellt, die die Bildung dieser Mikrowells ermöglicht, nachdem das Agarose-Gel bei Raumtemperatur erstarrt ist. Unter optischer Mikroskopie kann man sehen, wie sich die Zellen homogen über die Mikrovertiefungen verteilen. Nach ca. 2-3 Tagen (je nach Zelltyp) kann die Bildung von Sphäroiden oder Organoiden beobachtet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Stempelgerät. Repräsentative Bilder der Stempelvorrichtung von (A-C) aus drei verschiedenen Perspektiven, die ihre Hauptmerkmale veranschaulichen, nämlich: 663 Mikropins, Plattenhalterungen und Unterstützung bei der manuellen Handhabung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Schritt-für-Schritt-Darstellung des Herstellungsprozesses von Mikrotiterwerkzeugen. (A) Stempelvorrichtung; (B) Positionierung der Stempelvorrichtung in der Mitte der Vertiefung, die flüssige Agarose enthält; (C) Agarose-Polymerisation; (D) Agarose-Mikrovertiefungen, die von der Stempelvorrichtung geformt wurden; E) Demonstration der Herstellung mit drei Stempelvorrichtungen in ein und derselben Platte (P6); (F) optische Mikroskopie-Aufnahmen der Mikrovertiefungen bei 4-facher Vergrößerung (Maßstabsbalken = 1.000 μm); (G) Optische Mikroskopie-Aufnahmen der Mikrowells bei 10-facher Vergrößerung (Maßstabsbalken = 400 μm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Optische Mikroskopie-Bilder der primären Schweinekultur der Pankreasinsel. Bilder mit 2-facher (Maßstabsbalken = 2.000 μm), 4-facher (Maßstabsbalken = 1.000 μm) und 10-facher (Maßstabsbalken = 400 μm) Vergrößerung zu den folgenden Zeitpunkten: 0 h, 6 h, 24 h, 48 h, 72 h. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Lebend-/Tot-Assay. Repräsentative Bilder, die die Lebensfähigkeit von Sphäroiden aus Primärkulturen von Pankreas-Inselzellen von Schweinen zeigen, die in Agarose-Mikrovertiefungen erzeugt und nach 72 h (3 Tagen) 3D-Kultivierung mit dem verbesserten Stempelgerät gesammelt wurden. Es wurden Fluoreszenz-Optikmikroskopie-Aufnahmen gemacht. Die grüne Färbung steht für lebensfähige Zellen, die mit Fluoresceindiacetat markiert sind, während die rote Färbung für nicht lebensfähige Zellen steht, die mit Propidiumiodid markiert sind. Die Bilder bestätigen, dass die sphäroidale Struktur der 3D-Kultur erhalten bleibt und auch nach der Entnahme aus den Mikrovertiefungen lebensfähig bleibt. Maßstabsleiste = 400 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Obwohl es in der Literatur verschiedene 3D-Kulturprotokolle gibt, wurden in einer Studie von Wassmer et al.13 verschiedene Methoden zur Erzeugung von 3D-Strukturen unter Verwendung von Pankreasinseln getestet. Die Autoren beobachteten, dass einheimische Inselzellen und selbstaggregierte Sphäroide eine beträchtliche Heterogenität in Bezug auf Größe und Form aufwiesen und größer waren als solche, die mit anderen Methoden gewonnen wurden. Basierend auf ihren Erkenntnissen kamen sie zu dem Schluss, dass Sphäroide mit unterschiedlichen Techniken erzeugt werden können, die jeweils ihre eigenen Vor- und Nachteile haben. Für die Aggregation von Inselzellen werden die Hanging-Drop-Technik, Agarose-Mikrotiterplatten oder die Sphericalplate 5D empfohlen.
Es gibt Vorrichtungen zur Erzeugung von Agarose-Mikrovertiefungen, die in der Literatur erfolgreich eingesetzt wurden. Zum Beispiel zeigten Stuart et al.14 vielversprechende Ergebnisse mit einem Gerät, aber es wies bestimmte Nachteile auf, die behoben werden müssen. Dazu gehören die begrenzte Anzahl von Mikrowells, die es produzieren kann, ein reduziertes Arbeitsvolumen aufgrund des kleinen Werkzeugbereichs und seine Konstruktion als Negativform, was die Handhabung erschwert und das Risiko von Bruch und Verformung der Mikrowells erhöht.
Ein stempelähnliches Gerät zur Erzeugung von Sphäroiden wurde von Charelli und Kollegen15 mit Hilfe der 3D-Drucktechnologie entwickelt. Der Baustein ist in der Lage, bis zu 4.716 Sphäroide pro 6-Well-Platte herzustellen und wurde durch Stereolithographie mit lichthärtendem Harz hergestellt. Das resultierende Gerät bestand aus zylindrischen Mikropins mit einer Höhe von jeweils 1,3 mm und einer Breite von 650 μm. Diese Methode ermöglichte die schnelle Bildung einheitlicher Sphäroide, einschließlich co-kultivierter Sphäroide, mit gleichbleibender Form und Größe. Trotz seiner Vorteile müssen mehrere Herausforderungen bewältigt werden, um die Benutzerfreundlichkeit und Leistung zu verbessern. Ein wesentliches Problem ist die fehlende manuelle Unterstützung, die das Gerät schwer zu handhaben und anfällig für Instabilität während des Formbildungsprozesses macht. Diese Instabilität führt oft zum Bruch oder zur Rissbildung des Agarosegels, wodurch seine strukturelle Integrität beeinträchtigt wird. Darüber hinaus leidet das Gerät unter der fehlenden Plattenstütze, was bedeutet, dass es nicht sicher an der Well-Platte verankert werden kann. Infolgedessen muss der Stempel manuell suspendiert werden, bis die Agarose erstarrt, was zu Variabilität führt und die Gleichmäßigkeit der Mikrotiterbildung beeinträchtigt. Diese Einschränkungen verringern die Reproduzierbarkeit und Gesamtqualität der resultierenden Sphäroide.
Unser verbessertes Stempel-/Protokollierungsprotokoll ermöglicht eine effiziente und kostengünstige Methode zur Erzeugung von 3D-Sphäroiden und Organoiden in Agarose-Mikrovertiefungen, die sich durch ihre Einfachheit und Reproduzierbarkeit auszeichnet. Inspiriert von der Arbeit von Decarli und Kollegen16 nutzte unsere Gruppe die nicht-adhäsive Agarose-Hydrogel-Methode, um ein neues Stempelgerät zu entwickeln. Infolgedessen haben wir uns mit Problemen wie Handhabungsschwierigkeiten und Inkonsistenzen bei der Mikrotiterbildung befasst. Der Stempel, der mit unserer Methodik entwickelt wurde, berücksichtigt diese Verbesserungen und macht ihn benutzerfreundlicher, effizienter und hochgradig reproduzierbar.
Was die Modifikationen betrifft, so kann die Zelldichte für verschiedene Zelltypen und experimentelle Zwecke angepasst werden. Für Zellen mit niedrigen Proliferationsraten oder begrenzter Zellinteraktion kann eine höhere Zellaussaatdichte erforderlich sein, während eine niedrigere Dichte eine bessere strukturelle Organisation für bestimmte Zelltypen begünstigen könnte. Wenn Probleme mit der Sphäroidbildung auftreten, können kleine Modifikationen wie eine schnelle Zentrifugation der Platten dazu beitragen, dass sich die Zellen richtig am Boden der Mikrowells absetzen.
Einer der kritischen Schritte des Protokolls ist die genaue und gleichmäßige Aussaat der Zellen in die Mikrovertiefungen. Eine homogene Zellverteilung ist unerlässlich, um sicherzustellen, dass die gebildeten Strukturen konsistente Größen und einheitliche Eigenschaften aufweisen, was sich direkt auf die Qualität der Ergebnisse auswirkt. Die Sammlung von 3D-Kulturen ist ein weiterer entscheidender Punkt. Dieser Schritt erfordert äußerste Sorgfalt, um eine Zerstörung der Strukturen während der Entnahme zu vermeiden, und erfordert geeignete Pipettiertechniken, um die Integrität der Sphäroide und Organoide zu erhalten.
Die Größe des Sphäroids variiert je nach verwendetem Zelltyp. Darüber hinaus variiert auch die Anzahl der Zellen pro Sphäroid und muss auf der Grundlage der verwendeten Zelllinie oder Primärzellen optimiert werden. Es ist wichtig zu beachten, dass eine zu hohe Zelldichte innerhalb eines Sphäroids nachweislich die Entwicklung eines nekrotischen Kerns verursacht, wie in der Literatur berichtet wird. Dieser nekrotische Kern resultiert aus einer unzureichenden Sauerstoff- und Nährstoffdiffusion in die innersten Zellen, was die allgemeine Lebensfähigkeit und Funktion des Sphäroidsbeeinträchtigen kann 17.
Trotz der Vorteile der Einfachheit und der geringen Kosten ist eine wesentliche Einschränkung der Methode die potenzielle Variabilität bei der Sphäroidsammlung, insbesondere bei Experimenten, die größere und komplexere Strukturen erfordern. In solchen Fällen kann der Einsatz speziellerer Sammelwerkzeuge oder sogar methodische Anpassungen erforderlich sein, um den Prozess zu optimieren und Materialverluste zu reduzieren. Die Gewinnung sehr kleiner Sphäroide kann auch die Manipulation und Entnahme erschweren und eine strenge Protokollkontrolle erfordern.
Die Assoziation und Dissoziation von Sphäroiden/Organoiden variiert erheblich je nach verwendetem Zelltyp sowie der Anzahl der Tage, die für die Strukturbildung benötigt werden, dem verwendeten Kulturmedium und der Notwendigkeit einer möglichen Bewegung. Diese Faktoren sind intrinsisch für die spezifischen Eigenschaften jedes Zelltyps. Um die Zelldissoziation zu minimieren, ist es jedoch wichtig, die in der Methodik beschriebenen Vorsichtsmaßnahmen strikt zu befolgen, wie z. B. eine schonende Handhabung beim Mediumwechsel und die ordnungsgemäße Aufrechterhaltung der Kulturbedingungen.
Im Vergleich zu anderen Methoden, wie z. B. Rotationskulturen oder magnetischen Kügelchen, zeichnet sich dieses Protokoll durch eine größere Einfachheit aus, die spezielle Geräte überflüssig macht und eine reproduzierbarere Produktion von 3D-Sphäroiden und Organoiden gewährleistet, was es zu einer praktischen Alternative für eine Vielzahl von Forschungszwecken macht. Gemäß den zuvor in der Literaturbeschriebenen Ergebnissen 13 erleichtern Agarose-Mikrovertiefungen die Erzeugung von 3D-Sphäroidstrukturen insulinproduzierender Zellen mit höherer Lebensfähigkeit und Insulinsekretionsraten im Vergleich zu anderen kommerziellen Modellen, wie z. B. der Sphericalplate 5D.
Die Vielseitigkeit dieser Methode, kombiniert mit ihren geringen Kosten, macht sie ideal für verschiedene Forschungsbereiche wie Zellbiologie, Onkologie, Arzneimittelentwicklungsstudien und Toxikologie. Es bietet eine effektive Lösung für die In-vitro-3D-Modellierung und ermöglicht genauere Studien zum Zellverhalten, zur Zellinteraktion, zum Ansprechen auf Medikamente und zur Therapieentwicklung.
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Wir sind besonders dankbar für die hervorragende technische Unterstützung durch Zizi de Mendonça (Medizinische Fakultät, Universität von São Paulo, Brasilien). Diese Arbeit wurde durch Zuschüsse der folgenden brasilianischen Forschungsagenturen unterstützt: BNDES 09.2.1066.1, CAPES (PVE-Prozessnummer 88881.068070/2014-01), CNPq (Fördernummern 457601/2013-2, 401430/2013-8 und INCT-Regenera Nummer 465656/2014-5), FAPESP (Thematische Projektnummer 2016/05311-2), FINEP 01.08.06.05 und die Ministerien für Wissenschaft und Technologie (MCTI) und Gesundheit (MS-DECIT).
Materialien
| Name | Company | Catalog Number | Comments |
| 31L Microwave | Electrolux | 78965840 6699 9 | Equipment used to heat the agarose solution, facilitating its dissolution and ensuring greater homogeneity. It allows the solution to reach the ideal liquid state for the formation of the wells. |
| 3DFila Gray Opaque Photosensitive 3D Resin | UV-curable polymer resin | ||
| 3D Printer - Creality Halot One | Creality | N/A | 3D printer used for printing the stamp device |
| Agarose | UNISCIENCE | UNI-R10111 | To form the gel, dissolve 1 to 2% in Saline Phosphate Buffer (PBS) or appropriate medium. |
| Autodesk Fusion 360 | 3D modeling | ||
| BB15 CO2 Incubator | Thermo Fisher | 51023121 | Equipment used to incubate cultured cells in a suitable and controlled environment. |
| Chitubox | Chitubox | N/A | Software used for slicing the part for printing |
| Class II Biological Safety Cabinet | Grupo VECO | N/A | Ensures a sterile environment for performing cell culture within established parameters and protocols. |
| Culture medium | USBiological/Life Sciences | C5900-03A | Contains additives for proper cell cultivation. |
| Culture plates (P6) | SARSTEDT | 1023221 | Used to shape the agarose and culture the cells. |
| Erlenmeyer Flask (25 mL) | Laborglas | 91 216 14 | A container used for dissolving 1–2% agarose in Phosphate Buffered Saline (PBS) or another suitable medium, typically heated in a microwave. |
| Falcon 15 mL Polystyrene Centrifuge Tube | Corning | 352099 | Used to keep cells in suspension and perform possible dilutions. |
| Fetal bovine serum (FBS) | Vitrocell Embriolife | 005/19 | Additive for culture medium. |
| PBS solution (Saline Phosphate Buffer) | Lab made | N/A | Diluted 1x with MiliQ ultrapure water. Used to dissolve agarose 1 to 2% and to wash wells already produced. |
| Reagent bottle with blue cap - Schott | Laborglas | 21801545 | Used for preparing and storing culture medium. |
| Stamp device | NUCEL Group | N/A | Link- This link provides access to the .stl file of the stamp device. Simply slice it using appropriate software and print it with a compatible 3D printer. https://drive.google.com/drive/folders/1gTYComnJWzHpN6ZKOyK EChKS3Qns0rOA?usp=sharing |
| Treated culture flask with filter 25 cm² | Corning | 430639 | Used for the cultivation and maintenance of adherent cells. |
| Trypsin | Merck | 07-07-9002 | For dissociation of cells before seeding. |
| Ultra violet light (UV) | N/A | N/A | Used to sterilize the stamp and plates. |
Referenzen
- Lian, J., Yue, Y., Yu, W., Zhang, Y. Immunosenescence: a key player in cancer development. J Hematol Oncol. 13 (1), 151 (2020).
- Wang, F., et al. Reciprocal interactions between beta1-integrin and epidermal growth factor receptor in three-dimensional basement membrane breast cultures: a different perspective in epithelial biology. Proc Natl Acad Sci USA. 95 (25), 14821-14826 (1998).
- Dzobo, K., Dandara, C. The extracellular matrix: its composition, function, remodeling, and role in tumorigenesis. Biomimetics. 8 (2), 146 (2023).
- Sutherland, R. M., McCredie, J. A., Inch, W. R. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. J Natl Cancer Inst. 46 (1), 113-120 (1971).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Bialkowska, K., Komorowski, P., Bryszewska, M., Milowska, K. Spheroids as a type of three-dimensional cell cultures-examples of methods of preparation and the most important application. Int J Mol Sci. 21 (17), 6225 (2020).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. J Vis Exp. (81), e50665 (2013).
- Andersen, T., Auk-Emblem, P., Dornish, M. 3D Cell culture in alginate hydrogels. Microarrays (Basel). 4 (2), 133-161 (2015).
- Hou, S., et al. Advanced development of primary pancreatic organoid tumor models for high-throughput phenotypic drug screening. SLAS Discov. 23 (6), 574-584 (2018).
- Napolitano, A. P., et al. Scaffold-free three-dimensional cell culture utilizing micromolded nonadhesive hydrogels. Biotechniques. 43 (4), 494-500 (2007).
- Maria-Engler, S. S., et al. Co-localization of nestin and insulin and expression of islet cell markers in long-term human pancreatic nestin-positive cell cultures. J Endocrinol. 183 (3), 455-467 (2004).
- Mantovani, M. C., et al. Immobilization of primary cultures of insulin-releasing human pancreatic cells. Islets. 1 (3), 224-231 (2009).
- Wassmer, C. H., et al. Engineering of primary pancreatic islet cell spheroids for three-dimensional culture or transplantation: a methodological comparative study. Cell Transplant. 29, 963689720937292 (2020).
- Stuart, M. P., et al. Successful low-cost scaffold-free cartilage tissue engineering using human cartilage progenitor cell spheroids formed by micromolded nonadhesive hydrogel. Stem Cells Int. 2017, 7053465 (2017).
- Charelli, L. E., Dernowsek, J. A., Balbino, T. A. Generation of tissue spheroids via a 3D printed stamp-like device. J Vis Exp. (188), e63814 (2022).
- Decarli, M. C. Micromold for the production of cellular spheroids and use. , (2019).
- Riffle, S., Pandey, R. N., Albert, M., Hegde, R. S. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids. BMC Cancer. 17, 338 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten