Method Article
יצירת ספרואידים/אורגנואידים תלת מימדיים מתרביות תאים דו-ממדיות באמצעות מכשיר חותמת חדשני
In This Article
Summary
מחקר זה מציג מתודולוגיה חסכונית ויעילה ליצירת מבני תאים תלת מימדיים באמצעות מערכת מבוססת חותמת ליצירת מיקרו-בארות בתבניות אגרוז. המערכת מקדמת היווצרות של ספרואידים/אורגנואידים אחידים, ובכך משפרת את האינטראקציות בין התאים. גישה זו מפחיתה את השונות הניסויית ותומכת ביישומים בבדיקות תרופות והנדסת רקמות.
Abstract
תרביות תאים תלת מימדיות (3D) מספקות ייצוג מדויק יותר של המיקרו-סביבה in vivo מאשר תרבויות דו-ממדיות (2D) קונבנציונליות, מכיוון שהן מקדמות אינטראקציות משופרות בין התאים והמטריצה החוץ-תאית. מחקר זה נועד לפתח מתודולוגיה יעילה, חסכונית וניתנת לשחזור ליצירת מבני תאים תלת מימדיים (ספרואידים/אורגנואידים) באמצעות מערכת חדשנית מבוססת חותמת ליצירת מיקרו-בארות בתבניות אגרוז. חותמת חדשה שימשה לייצור 663 מיקרו-בארות לבאר של צלחת של 6 בארות, מה שמספק סביבה אידיאלית לצבירת תאים. תאי אי לבלב חזיריים ראשוניים נזרעו לתוך המיקרובארות הללו, שם הם הצטברו ליצירת ספרואידים/אורגנואידים. התרביות הודגרו בטמפרטורה של 37 מעלות צלזיוס מתחת ל-5% CO2, והמדיום הוחלף כל 3 ימים. היווצרות הספרואידים נוטרה מעת לעת, ונאספו דגימות לאפיון. השיטה ייצרה בהצלחה ספרואידים אחידים ואיכותיים, הפחיתה את השונות הניסיונית, מזערה את המניפולציה ושיפרה את האינטראקציות בין התאים. השימוש בתבניות מיקרו-דפוס מבוססות אגרוז סיפק סביבה פשוטה ומבוקרת לתרבויות תלת מימד, והציע פתרון סטנדרטי וחסכוני. מתודולוגיה זו תומכת ביישומים לבדיקת תרופות והנדסת רקמות, ומציעה פלטפורמה מעשית וניתנת להרחבה למודלים של תרביות תאים תלת מימדיות הניתנות ליישום בקלות במסגרות מעבדה שונות.
Introduction
במהלך 50 השנים האחרונות, מחקרים רבים בביולוגיה של התא הראו כי תרביות דו-ממדיות (2D) אינן מצליחות לשכפל במדויק את תנאי ה-in vivo שנצפו במודלים של בעלי חיים1. מבחינה מבנית, תרביות תאים דו-ממדיות אינן מאפשרות לתאים להתארגן באופן תלת מימדי ולשכפל את המצב שנצפה במערכות in vivo . יתר על כן, מסלולי איתות תאיים משתנים בתרביות דו-ממדיות בהשוואה לתרביות תלת-ממדיות (תלת-ממדיות), מה שעשוי להסביר מדוע סוגים מסוימים של בדיקת תרופות באמצעות תרביות דו-ממדיות הם כה שונים2. התקדמות משמעותית בטכניקות תרבית תאים התגלתה עם כניסתן של מערכות תרבית תלת מימדיות. מערכות תלת מימד משתנות במידה ניכרת במורכבותן בהתאם להרכב התא ולארכיטקטורה הציטולוגית. בדרך כלל נוצרים שני סוגים של מבנים, כלומר: ספרואידים ואורגנואידים. ספרואידים מתוארים כאשכולות פשוטים של תאים המתקבלים מרקמות רגילות או גידוליות, גופים עובריים וקווי תאים. היווצרותם של מבנים תלת מימדיים מושפעת מגורמים שונים, כולל אינטראקציות תא-תא ומסלולי איתות המתווכים על ידי רכיבים של המטריצה החוץ-תאית (ECM), המספקים תמיכה מבנית ורמזים ביוכימיים. אלמנטים אלה מווסתים אינטראקציות התורמות לארגון ותפקוד הרקמות3. מערכת התרבית הספרואידית תוארה לראשונה בתחילת שנות ה-70, תוך שימוש בקווי תאי ריאה של אוגר סיני V79 כמודל לקרצינומות נודולריות, הגדלות בתנאים לא נצמדים ויוצרות כדורים מושלמים4. אורגנואידים מתוארים כאשכולות של סוגי תאים ספציפיים לאיברים שמקורם בתאי גזע או אב, המתארגנים בעצמם באמצעות תהליכים, כגון מיון תאים ומפרט שושלת, באופן מוגבל מרחבית, המשקף את ההתפתחות in vivo 5.
מספר שיטות וחומרים זמינים לתרבית תאים בתנאים תלת מימדיים. השיטות העיקריות המשמשות כיום ליצירת תרבויות תלת מימד הן: 1) טיפות תלויות; 2) תרבית תאים מסתובבת ופלסטיק בעל חיבור נמוך; 3) לוחות פירמידה המכילים בארות חרוטיות; 4) פיגומים מקרו-נקבוביים; 5) חרוזים מגנטיים; ו-6) הידרוג'לים ללא פיגומים.
טיפות תלויות היא השיטה המשמשת להשגת תרביות תלת מימד ללא פיגומים. שיטה זו מציגה מגבלות מסוימות, כולל הצורך בטיפול נרחב, יעילות ייצור נמוכה, גיאומטריה כדורית וחשיפה לכוחות גזירה גבוהים. יתרה מכך, הליכים ספציפיים, כגון החלפת מדיום או תוספת מורכבת, יכולים להיות מאתגרים ועלולים לגרום לאובדן חומר. יתר על כן, דיווחי ספרות מצביעים על כך שחלק מקווי התאים אינם מצליחים לייצר ספרואידים ארוזים היטב בעת שימוש בגישה זו6.
תרבית תאים מסתובבת ופלסטיק בעל חיבור נמוך משמשים למניעת היצמדות תאים למצע, מה שגורם להם להצטבר וליצור ספרואידים. תהליך זה דורש צלוחיות ספציפיות ו/או תסיסה/סיבוב. למרות שזו אחת הגישות הפשוטות ביותר לייצור ספרואידים או אורגנואידים בקנה מידה גדול, היא אינה חפה מחסרונות, כגון הצורך בציוד ספציפי, אורך חיים נמוך של תרבית, שונות בגודל בספרואידים, נזק מכני לתאים ויעילות נמוכה6.
לוחות פירמידה המכילים בארות חרוטיות הם לוחות זמינים מסחרית המשפיעים על העלויות, בנוסף לעובדה שמניפולציות מסוימות עלולות לעכב את היווצרותם של ספרואידים/אורגנואידים7.
פיגומים מקרו-נקבוביים משמשים גם לתרבית תלת מימדית; עם זאת, מכשול מרכזי טמון בהשגת זריעה יעילה של תאים ופיזור אחיד. בעיה זו מתעוררת מכיוון שגודל הנקבוביות עשוי להיות קטן מדי לחדירת תאים או גדול מכדי לשמור על התאים בצורה מאובטחת. כדי לטפל בבעיה זו, נבחנו מספר אסטרטגיות8, המשפיעות ישירות על המורכבות והעלות של טכניקה זו.
מתודולוגיית החרוזים המגנטיים מייצרת מספר קטן של ספרואידים/אורגנואידים, יש לה עלות גבוהה ועלולה להשאיר שאריות ננו-חלקיקים בתוך התאים9.
בין המערכות לגידול ספרואידים, ניתן להשיג הידרוג'ל אגרוז שאינו דביק, המייצג הידרוג'ל ללא פיגומים. גישה זו מציעה יתרונות בולטים, כגון שליטה מדויקת על גודל המבנים התלת מימדיים והיכולת לייצר מספר ניכר של מבנים אלה לכל לוח. בשיטה זו מוחדרים תאים להידרוג'ל עם בארות מוכנות מראש, בהן הם שוקעים ומתאספים בעצמם לספרואידים תלת מימדיים10.
במחקר זה אנו מציגים מכשיר ומתודולוגיה ליצירת מיקרו-בארות אגרוז באמצעות תבנית מיקרו-דפוס בצורה פשוטה, יעילה, ניתנת לשחזור ובעלות נמוכה.
השימוש בחותמת זו כתבנית ליצירת מיקרו-בארות באגרוז, בסיוע כוח הכבידה, נועד לשפר את האינטראקציה התאית בתוך המיקרובאר והארגון התאי, וליצור מבנים תלת מימדיים (ספרואידים/אורגנואידים) במבחנה בצורה פשוטה, יעילה, ניתנת לשחזור ובעלות נמוכה, ובכך לחסוך זמן מחקר ומשאבי מעבדה.
Protocol
פרוטוקול זה עוקב אחר הנחיות ועדת האתיקה למחקר בבני אדם של המוסד שלנו CEUA-FMUSP: 1699/2021, שאושר ב-8 בספטמבר 2021 - "בידוד ואנקפסולציה של איי לבלב חזיריים" והוא חלק מהפרויקט הנושאי של קבוצת NUCEL לטיפול תאי ומולקולרי (www.usp.br/nucel), מענק FAPESP מס' 2016/05311-2, שכותרתו: "רפואה רגנרטיבית שמטרתה טיפול במחלות כרוניות-ניווניות (סרטן וסוכרת)".
1. ייצור מכשיר החותמת
הערה: חותמת זו מיוצרת בהתאמה אישית על ידי קבוצת NUCEL (https://w3nucel.webhostusp.sti.usp.br/). מכשיר החותמת פותח באמצעות התוכנה המוזכרת, המוכרת באופן נרחב בזכות הדיוק ויכולות המידול התלת מימדיות המתקדמות שלה.
- ודא שאבות הטיפוס המתוכננים כוללים 663 מיקרו-פינים המסודרים כדי לאפשר יצירת מספר שווה של תרביות תלת מימדיות, כגון ספרואידים או אורגנואידים. כדי להבטיח את יציבות החותמת על משטחי מגש T6, מקם חמש נקודות תמיכה באופן אסטרטגי לאורך היקף המכשיר.
- ודא שלמיקרו-פינים יש עיצוב חרוטי עם מידות מתכווננות, הנעות בין 1 ל-3 מ"מ אורך. קוטר הבסיס של החרוט נע בין 0.7 ל-1.5 מ"מ, בעוד שזווית ההתחדדות נעה בין 5° ל-10°.
- ודא שמבנה ה"עצירה" של המכשיר, המגדיר את עומק המיקרו-פינים, הוא בעל אורך מתכוונן של 10 עד 19 מ"מ וקוטר של 20 עד 40 מ"מ, כאשר מיקרו-פינים מפוזרים באופן אחיד על פני השטח שלו.
- בנוסף, תכנן את המכשיר כך שתהיה לו ידית ארגונומית, המתאימה להפעלה ביד אחת, כדי לשפר את הפרקטיות והדיוק במהלך השימוש.
הערה: כדי להקל על ייצור בקנה מידה גדול של המכשיר, מסופק הקובץ הדיגיטלי בפורמט .stl, בהיותו חיוני לתהליך הדפסת התלת מימד. - כל שעליך לעשות הוא לפרוס אותו באמצעות תוכנה מתאימה ולהדפיס אותו במדפסת תלת מימד תואמת. השתמש במידות ההדפסה הבאות: X - 68 מ"מ; Y - 120 מ"מ; Z - 150 מ"מ, מה שמבטיח איזון אידיאלי בין פונקציונליות לאיכות מבנית.
- לייצור המכשיר, השתמש במדפסת תלת מימד הניתנת לצילום, התואמת לשרף הפולימרי הניתן לריפוי UV שחייב להיות בעל רזולוציה גבוהה וגימור משטח אחיד, מאפיינים חיוניים לביצועי מכשיר מיטביים.
- פרסו את הדגם הדיגיטלי להדפסה באמצעות תוכנה התואמת למדפסת התלת-ממד שנבחרה.
2. הכנת מיקרו-בארות אגרוז
- הכן את תמיסת האגרוז.
- שקלו את אבקת האגרוז הטהורה והמיסו אותה בתמיסת מלח חוצצת פוספט 1x (PBS) כדי להשיג ריכוז סופי של 1-2% (w/v).
- מחממים את התמיסה במיקרוגל או באמבט מים עד להמסה מלאה, ומוודאים שהיא הומוגנית ושקופה.
הערה: הימנע מהתחממות יתר או חימום יתר, מכיוון שהדבר עלול לפגוע באגרוז. אין להכין כמויות גדולות של תמיסת מלאי. - הניחו לתמיסה להתקרר ל-~40 מעלות צלזיוס, הטמפרטורה האידיאלית לפיפטינג.
- הכן את החותמת בהתאמה אישית.
- שטפו את החותמת עם ספוג בעל זיפים רכים ומים מזוקקים להסרת שאריות.
- חשוף את ה-stamp הנקי לאור UV למשך 5-10 דקות כדי להבטיח סטריליות.
- יוצרים את המיקרו-בארות.
- יוצקים/פיפטה ~3 מ"ל מתמיסת האגרוז של 40 מעלות צלזיוס לכל באר של צלחת של 6 בארות, ומבטיחים עומק אחיד של 2-3 מ"מ.
- מקם את החותמת בהתאמה אישית במרכז הבאר כשהאגרוז עדיין חם.
הערה: לחותמת יש תומכים רוחביים המבטיחים יישור ויציבות, ומבטלים את הצורך בתמיכה ידנית. כל חותמת יוצרת ~663 מיקרו-בארות (~2 מ"מ גובה) לבאר. ודא שאין בועות על המיקרו-פינים; אם נוצרות בועות, הזז בעדינות את החותמת כדי לחסל אותן. - הניחו לאגרוז להתמצק במשך 5-10 דקות בטמפרטורת החדר מבלי להזיז את הצלחת.
הערה: אל תפריע לאגרוז במהלך ההתמצקות כדי למנוע שינויים במבנה המיקרובאר. - הסר את ה-stamp בתנועות עדינות קדימה ואחורה כדי לשחרר את הוואקום מבלי לפגוע במיקרו-בארות.
הערה: תנועה זו מקלה על כניסת אוויר, ומאפשרת הסרת חותמת חלקה מבלי לעוות את הג'ל. המיקרו-בארות חייבות להישאר שלמות. - שטפו את המיקרו-בארות פי 3 עם תמיסת PBS להסרת שאריות.
- חשוף את הצלחת לאור UV למשך 10 דקות כדי למנוע זיהום מיקרוביאלי.
- מוסיפים 3 מ"ל של מדיום תרבית ודוגרים את הצלחת בחממת CO2 בטמפרטורה של 37 מעלות צלזיוס למשך הלילה.
הערה: דגירה זו מאמתת את היעדר הזיהום לפני זריעת התאים.
3. זריעת תאים במיקרו-בארות
- הכן את מתלה התאים.
- אסוף את התאים באמצעות טריפסיניזציה או שיטת דיסוציאציה אחרת כדי לקבל תרחיף הומוגני.
- ספרו את התאים והתאימו את הריכוז לפי המספר הרצוי למיקרווול.
הערה: כדי לזרוע 5,000 תאים למיקרווול ב-663 מיקרו-בארות, הכינו תרחיף המכיל לפחות 3.315 ×-10 6 תאיםבסך הכל . מטב את ריכוז התאים כדי למנוע נמק מרכזי וכדי להבטיח דיפוזיה מספקת של חומרים מזינים וחמצן.
- זרעו את התאים.
- פיפטה ~ 3 מ"ל של תרחיף התאים המוכן מעל המיקרו-בארות, מה שמבטיח פיזור אחיד על ידי סיבוב עדין של הצלחת.
- אפשר לתאים להתיישב על ידי כוח הכבידה (~10-15 דקות) או בצע צנטריפוגה עדינה ב-100 × גרם למשך 5 דקות.
הערה: ניתן להשתמש בצנטריפוגה כדי להבטיח שהתאים יתרכזו במיקרו-בארות. - העבירו את הצלחת לחממת CO2 בטמפרטורה של 37 מעלות צלזיוס עם אווירה לחה.
4. תחזוקה של תרביות תאים תלת מימדיות
- החלף את מדיום התרבות.
- החלף את המדיום כל 2-3 ימים, הסר 50% מהמדיום הישן והוסף מדיום טרי.
הערה: ודא שהמיקרו-בארות נשארות שקועות לאורך כל תקופת התרבות כדי למנוע התייבשות.
- החלף את המדיום כל 2-3 ימים, הסר 50% מהמדיום הישן והוסף מדיום טרי.
- עקוב אחר היווצרותן של תרבויות תלת מימד.
- המשך בתרבות עד שהמבנים התלת-ממדיים נוצרים במלואם וקומפקטיים (למשל, 2-3 ימים עבור תרביות ראשוניות של איי הלבלב).
הערה: עבור תרביות הדורשות זמן היווצרות ארוך יותר, בצע החלפת מדיום חלקית כל 2-3 ימים.
- המשך בתרבות עד שהמבנים התלת-ממדיים נוצרים במלואם וקומפקטיים (למשל, 2-3 ימים עבור תרביות ראשוניות של איי הלבלב).
5. איסוף ואפיון מבנים תלת מימדיים
- אסוף את הספרואידים/אורגנואידים.
- הסר את המדיום הישן ואסוף את המבנים התלת מימדיים באמצעות פיפטינג נמרץ באמצעות קצה פיפטה בקוטר רחב או חתוך כדי למנוע דחיסה או פירוק.
הערה: יש לשלוט בפיפטינג נמרץ כדי לעקור את האגרגטים מבלי לעוות אותם.
- הסר את המדיום הישן ואסוף את המבנים התלת מימדיים באמצעות פיפטינג נמרץ באמצעות קצה פיפטה בקוטר רחב או חתוך כדי למנוע דחיסה או פירוק.
- התכוננו לניתוח.
- השתמש מיד בספרואידים/אורגנואידים שנאספו או תקן אותם לניתוח עתידי.
הערה: האסוציאציה והיציבות של ספרואידים תלויים בסוג התא, זמן היווצרות ותנאי התרבית. זהירות חיונית כדי למנוע דיסוציאציה.
- השתמש מיד בספרואידים/אורגנואידים שנאספו או תקן אותם לניתוח עתידי.
תוצאות
תרבית התאים ששימשה במחקר זה נגזרה מאיי לבלב חזיריים. לתכשיר האי ששימש במחקר זה היה טוהר של 80 ± 5% בהתבסס על צביעה דיתזון, ו->80% כדאיות תאי איים בהתבסס על זיהוי פלואורסצאין דיאצטט בתאים חיים או פרופידיום יודיד בתאים מתים (שיטת הפלואורסצנט חי/מת). ודא שהכנת אי הלבלב החזירי היא לפחות 80% טהורה (למשל, על ידי צביעת דיתזון) ו->80% בת קיימא. לאחר הבידוד, שמור על תרביות דבקות במדיום CMRL 1066, בתוספת 1 מ"מ L-גלוטמין, 0.2% ציפרופלוקסצין ו-10% סרום עגל עוברי (FCS), ב-37 מעלות צלזיוס ו-5% CO2, כפי שתואר קודם לכן11,12.
במחקר הנוכחי הוערכה ביסודיות היעילות של מערכת מבוססת חותמת ליצירת מיקרו-בארות בתבניות אגרוז (איור 1). עיצוב החותמת, המוצג באיור 2, מדגים את הדיוק של המיקרו-פינים ומיקומם, מה שמקל על יישור וטיפול עקביים במהלך תהליך היווצרות המיקרו-באר. זה הבטיח דפוסי מיקרובאר אחידים על פני כל הצלחת, תכונה קריטית להשגת תרביות תאים תלת מימדיות הניתנות לשחזור.
תהליך היווצרות המיקרובאר באמצעות החותמת מפורט באיור 3, בו מודגמת יכולתה של החותמת ליצור מיקרו-בארות אחידות. התוצאות מאשרות שניתן להשתמש במספר חותמות בו זמנית, מה שמייעל את תהליך ההכנה. ניתוח מיקרוסקופי של תבניות האגרוז חושף צורות מיקרובאר קעורות וסטנדרטיות, גורם מכריע בשליטה על צבירת תאים למבנים תלת מימדיים. האחידות של המיקרו-בארות תורמת באופן משמעותי לאמינות ולשחזור של היווצרות תרבית תלת מימדית, כפי שמודגם על ידי התוצאות העקביות שהתקבלו בניסויים שונים.
איור 4 ממחיש את ההתפתחות תלוית הזמן של מבנים תלת-ממדיים מרגע חיסון התאים (0 שעות) לאורך מספר נקודות זמן (6 שעות, 24 שעות, 48 שעות ו-72 שעות). דחיסת תאים למבנים תלת מימדיים מצטברים/קומפקטיים התרחשה בהדרגה, עם צבירה משמעותית שנצפתה בסימן 48 שעות. ציר זמן זה עשוי להשתנות בהתאם לסוג התא, כפי שמעיד השימוש באיי לבלב חזיריים ראשוניים במחקר זה, שיצרו מבנים תלת מימדיים קומפקטיים ופונקציונליים תוך 48 שעות. זה מדגים את היעילות של הפרוטוקול ביצירת תרבויות תלת מימד מאורגנות.
איור 5 מדגיש את היציבות והכדאיות של המבנים התלת-ממדיים לאחר הוצאתם מהמיקרו-בארות של אגרוז. המבנים התלת-ממדיים שמרו על הקונפורמציה שלהם לאחר ההסרה (איור 5A), מה שמאשר את החוסן של המתודולוגיה. יתר על כן, הבדיקה של חיים/מתים (איור 5B,C) הצביעה על כך שהתאים בתוך המבנים נשארו ברי קיימא, כפי שמוצג על ידי הצביעה הירוקה של תאים חיים. ממצא זה מאשר כי הפרוטוקול לא רק מקל על היווצרותם של מבנים תלת מימדיים מאורגנים היטב, אלא גם שומר על כדאיות התאים, מה שהופך אותו לגישה אמינה ויעילה ליישומי תרבית תאים תלת מימדית.
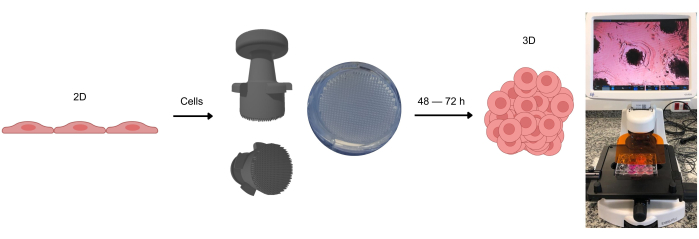
איור 1: תהליך היווצרות תרביות תאים תלת-ממדיות. תאים שטופחו בתחילה בדו-ממד מנותקים מהמשטח הדבק ומונחים במיקרו-בארות אגרוז. מיקרו-בארות אגרוז אלו נוצרות באמצעות מכשיר חותמת, המאפשר היווצרות מיקרו-בארות אלו לאחר שג'ל האגרוז מתמצק בטמפרטורת החדר. כאשר נצפים במיקרוסקופיה אופטית, ניתן לראות את התאים מתפלגים בצורה הומוגנית על פני המיקרו-בארות. לאחר כ 2-3 ימים (תלוי בסוג התא) ניתן להבחין בהיווצרות ספרואידים או אורגנואידים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: התקן חותמת. תמונות מייצגות של מכשיר החותמת מ-(A-C) משלוש נקודות מבט שונות, הממחישות את המאפיינים העיקריים שלו, כלומר: 663 מיקרו-פינים, תומכי צלחות ותמיכה בטיפול ידני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: ייצוג צעד-אחר-צעד של תהליך ייצור תבניות המיקרו-באר. (א) מכשיר בולים; (ב) מיקום מכשיר החותמת במרכז הבאר המכילה אגרוז נוזלי; (C) פילמור אגרוז; (D) מיקרו-בארות אגרוז שעוצבו על ידי מכשיר החותמת; (ה) הדגמת הייצור באמצעות שלושה מכשירי בולים באותה לוחית (ת/6); (F) תמונות מיקרוסקופיה אופטית של המיקרו-בארות בהגדלה פי 4 (סרגל קנה מידה = 1,000 מיקרומטר); (G) תמונות מיקרוסקופיה אופטית של המיקרו-בארות בהגדלה של פי 10 (סרגל קנה מידה = 400 מיקרומטר). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: תמונות מיקרוסקופיה אופטית של תרבית חזירים ראשונית באי הלבלב. תמונות בהגדלה של פי 2 (סרגל קנה מידה = 2,000 מיקרומטר), פי 4 (סרגל קנה מידה = 1,000 מיקרומטר) ו-10x (סרגל קנה מידה = 400 מיקרומטר), בנקודות הזמן הבאות: 0 שעות, 6 שעות, 24 שעות, 48 שעות, 72 שעות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: מבחן חי/מת. תמונות מייצגות המציגות את הכדאיות של ספרואידים מתרביות ראשוניות של תאי איי לבלב חזירים שנוצרו במיקרו-בארות אגרוז ונאספו לאחר 72 שעות (3 ימים) של גידול תלת מימד באמצעות מכשיר החותמת המשופר. התקבלו תמונות מיקרוסקופיה אופטית פלואורסצנטית. צביעה ירוקה מייצגת תאים ברי קיימא המסומנים בפלואורסצאין דיאצטט, בעוד צביעה אדומה מצביעה על תאים שאינם ברי קיימא המסומנים בפרופידיום יודיד. התמונות מאשרות שהמבנה הכדורי של התרבית התלת-ממדית נשמר ונשאר בר-קיימא לאחר הוצאתו מהמיקרו-בארות. סרגל קנה מידה = 400 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
למרות שקיימים פרוטוקולים שונים של תרבית תלת מימד בספרות, מחקר שנערך על ידי Wassmer et al.13 בדק מספר מתודולוגיות ליצירת מבנים תלת מימדיים באמצעות איי לבלב. המחברים הבחינו כי איים מקומיים וספרואידים שהצטברו בעצמם הפגינו הטרוגניות ניכרת ביחס לגודל וצורה והיו גדולים יותר מאלה שהושגו בשיטות אחרות. בהתבסס על ממצאיהם, הם הגיעו למסקנה שניתן לייצר ספרואידים באמצעות טכניקות שונות, שלכל אחת מהן יתרונות וחסרונות משלה. עבור צבירת תאי אי, השיטות המומלצות הן טכניקת הטיפה התלויה, לוחות מיקרובאר אגרוז או הלוח הכדורי 5D.
ישנם מכשירים ליצירת מיקרו-בארות אגרוז שהופעלו בהצלחה בספרות. לדוגמה, Stuart et al.14 הראו תוצאות מבטיחות בשימוש במכשיר, אך הוא הציג חסרונות מסוימים שיש לטפל בהם. אלה כוללים את המספר המוגבל של מיקרו-בארות שהוא יכול לייצר, נפח עבודה מופחת עקב שטח העובש הקטן, ועיצובו כתבנית שלילית, מה שמסבך את הטיפול ומגביר את הסיכון לשבירה ועיוות של המיקרו-בארות.
מכשיר דמוי בול ליצירת ספרואידים פותח על ידי צ'רלי ועמיתיו15 באמצעות טכנולוגיית הדפסת תלת מימד. המכשיר מסוגל לייצר עד 4,716 ספרואידים לכל צלחת של 6 בארות, ונוצר באמצעות סטריאוליתוגרפיה עם שרף הניתן לצילום. ההתקן שהתקבל כלל מיקרו-פינים גליליים, כל אחד בגובה 1.3 מ"מ ורוחב 650 מיקרומטר. שיטה זו אפשרה היווצרות מהירה של ספרואידים אחידים, כולל ספרואידים מתורבתים, בעלי צורה וגודל עקביים. למרות יתרונותיו, יש לטפל במספר אתגרים כדי לשפר את השימושיות והביצועים שלו. נושא משמעותי הוא היעדר תמיכה ידנית, מה שמקשה על הטיפול במכשיר ונוטה לחוסר יציבות בתהליך היווצרות התבנית. חוסר יציבות זה מוביל לרוב לשבירה או סדק של ג'ל האגרוז, מה שפוגע בשלמות המבנית שלו. בנוסף, המכשיר סובל מהיעדר תמיכת צלחת, כלומר לא ניתן לעגן אותו היטב לצלחת הבאר. כתוצאה מכך, יש להשעות את החותמת באופן ידני עד שהאגרוז מתמצק, מה שמכניס שונות ומשפיע על אחידות היווצרות המיקרו-באר. מגבלות אלו מפחיתות את יכולת השחזור והאיכות הכוללת של הספרואידים המתקבלים.
החותמת/פרוטוקול המשופר שלנו מאפשר שיטה יעילה ובעלות נמוכה, יצירת ספרואידים ואורגנואידים תלת מימדיים במיקרו-בארות אגרוז, ובולט בפשטותו וביכולת השחזור שלו. בהשראת עבודתם של דקארלי ועמיתיו16, הקבוצה שלנו השתמשה במתודולוגיית הידרוג'ל אגרוז שאינה דביקה כדי לפתח מכשיר חותמת חדש. כתוצאה מכך, טיפלנו בנושאים כמו טיפול בקשיים וחוסר עקביות ביצירת מיקרו-בארות. החותמת שפותחה באמצעות המתודולוגיה שלנו משלבת את השיפורים הללו, מה שהופך אותה לידידותית יותר למשתמש, יעילה וניתנת לשחזור רב.
לגבי שינויים, ניתן להתאים את צפיפות התאים לסוגי תאים שונים ולמטרות ניסוי. צפיפות זריעת תאים גבוהה יותר עשויה להידרש לתאים עם שיעורי התפשטות נמוכים או אינטראקציה מוגבלת בין תאים, בעוד שצפיפות נמוכה יותר עשויה להעדיף ארגון מבני טוב יותר עבור סוגי תאים מסוימים. אם מתעוררות בעיות עם היווצרות ספרואידים, שינויים קטנים כגון צנטריפוגה מהירה של הלוחות עשויים לעזור לתאים להתיישב כראוי בתחתית המיקרו-בארות.
אחד השלבים הקריטיים של הפרוטוקול הוא זריעה מדויקת ואחידה של תאים לתוך המיקרו-בארות. התפלגות תאים הומוגנית חיונית כדי להבטיח שלמבנים הנוצרים יש גדלים עקביים ותכונות אחידות, המשפיעים ישירות על איכות התוצאות. אוסף התרבויות התלת-ממדיות הוא נקודה מכרעת נוספת. שלב זה דורש זהירות יתרה כדי להימנע מהרס המבנים במהלך השליפה, הדורש טכניקות פיפטינג מתאימות כדי לשמור על שלמות הספרואידים והאורגנואידים.
גודל הספרואיד ישתנה בהתאם לסוג התא בו נעשה שימוש. בנוסף, מספר התאים לכל ספרואיד משתנה גם הוא ויש לבצע אופטימיזציה על סמך קו התאים הספציפי או התאים הראשוניים בהם נעשה שימוש. חשוב לציין כי צפיפות תאים גבוהה מדי בתוך ספרואיד הוכחה כגורמת להתפתחות ליבה נמקית, כפי שדווח בספרות. ליבה נמקית זו נובעת מחוסר חמצן ודיפוזיה תזונתית לתאים הפנימיים ביותר, מה שעלול לפגוע בכדאיות ובתפקוד הכללי של הספרואיד17.
למרות היתרונות של פשטות ועלות נמוכה, מגבלה משמעותית של השיטה היא השונות הפוטנציאלית באיסוף הספרואידים, במיוחד בניסויים הדורשים מבנים גדולים ומורכבים יותר. במקרים כאלה, ייתכן שיהיה צורך בשימוש בכלי איסוף מיוחדים יותר או אפילו התאמות מתודולוגיות כדי לייעל את התהליך ולהפחית את אובדן החומר. השגת ספרואידים קטנים מאוד עלולה גם לסבך את המניפולציה והאיסוף, ודורשת בקרת פרוטוקול קפדנית.
האסוציאציה והדיסוציאציה של ספרואידים/אורגנואידים משתנים באופן משמעותי בהתאם לסוג התא בו נעשה שימוש, כמו גם מספר הימים הנדרשים להיווצרות המבנה, מדיום התרבית המופעל והצורך בתסיסה אפשרית. גורמים אלה הם מהותיים למאפיינים הספציפיים של כל סוג תא. עם זאת, כדי למזער דיסוציאציה של תאים, חיוני להקפיד על אמצעי הזהירות המפורטים במתודולוגיה, כגון טיפול עדין במהלך שינויים בינוניים ותחזוקה נכונה של תנאי התרבית.
בהשוואה לשיטות אחרות, כגון תרביות סיבוביות או חרוזים מגנטיים, פרוטוקול זה בולט בפשטותו הגדולה יותר, מבטל את הצורך בציוד מיוחד ומבטיח ייצור ניתן לשחזור יותר של ספרואידים ואורגנואידים תלת מימדיים, מה שהופך אותו לחלופה מעשית למגוון רחב של מטרות מחקר. על פי התוצאות שתוארו בעבר בספרות13, מיקרו-בארות אגרוז מאפשרות יצירת מבנים ספרואידים תלת מימדיים של תאים מייצרי אינסולין עם כדאיות גבוהה יותר ושיעורי הפרשת אינסולין בהשוואה למודלים מסחריים אחרים, כגון ה-Sphericalplate 5D.
הרבגוניות של שיטה זו, בשילוב עם עלותה הנמוכה, הופכים אותה לאידיאלית עבור תחומי מחקר שונים, כגון ביולוגיה של התא, אונקולוגיה, מחקרי פיתוח תרופות וטוקסיקולוגיה. הוא מציע פתרון יעיל למודלים תלת מימדיים במבחנה , המאפשר מחקרים מדויקים יותר על התנהגות תאים, אינטראקציה בין תאים, תגובה לתרופות ופיתוח טיפול.
Disclosures
המחברים מצהירים שאין להם ניגודי אינטרסים.
Acknowledgements
אנו אסירי תודה במיוחד על הסיוע הטכני המצוין שמספק Zizi de Mendonça (בית הספר לרפואה, אוניברסיטת סאו פאולו, ברזיל). עבודה זו נתמכה על ידי מענקים מסוכנויות המחקר הברזילאיות הבאות: BNDES 09.2.1066.1, CAPES (מספר תהליך PVE 88881.068070/2014-01), CNPq (מספרי מענק 457601/2013-2, 401430/2013-8, ומספר INCT-Regenera 465656/2014-5), FAPESP (מספר פרויקט נושאי 2016/05311-2), FINEP 01.08.06.05 ומשרדי המדע והטכנולוגיה (MCTI) והבריאות (MS-DECIT).
Materials
| Name | Company | Catalog Number | Comments |
| 31L Microwave | Electrolux | 78965840 6699 9 | Equipment used to heat the agarose solution, facilitating its dissolution and ensuring greater homogeneity. It allows the solution to reach the ideal liquid state for the formation of the wells. |
| 3DFila Gray Opaque Photosensitive 3D Resin | UV-curable polymer resin | ||
| 3D Printer - Creality Halot One | Creality | N/A | 3D printer used for printing the stamp device |
| Agarose | UNISCIENCE | UNI-R10111 | To form the gel, dissolve 1 to 2% in Saline Phosphate Buffer (PBS) or appropriate medium. |
| Autodesk Fusion 360 | 3D modeling | ||
| BB15 CO2 Incubator | Thermo Fisher | 51023121 | Equipment used to incubate cultured cells in a suitable and controlled environment. |
| Chitubox | Chitubox | N/A | Software used for slicing the part for printing |
| Class II Biological Safety Cabinet | Grupo VECO | N/A | Ensures a sterile environment for performing cell culture within established parameters and protocols. |
| Culture medium | USBiological/Life Sciences | C5900-03A | Contains additives for proper cell cultivation. |
| Culture plates (P6) | SARSTEDT | 1023221 | Used to shape the agarose and culture the cells. |
| Erlenmeyer Flask (25 mL) | Laborglas | 91 216 14 | A container used for dissolving 1–2% agarose in Phosphate Buffered Saline (PBS) or another suitable medium, typically heated in a microwave. |
| Falcon 15 mL Polystyrene Centrifuge Tube | Corning | 352099 | Used to keep cells in suspension and perform possible dilutions. |
| Fetal bovine serum (FBS) | Vitrocell Embriolife | 005/19 | Additive for culture medium. |
| PBS solution (Saline Phosphate Buffer) | Lab made | N/A | Diluted 1x with MiliQ ultrapure water. Used to dissolve agarose 1 to 2% and to wash wells already produced. |
| Reagent bottle with blue cap - Schott | Laborglas | 21801545 | Used for preparing and storing culture medium. |
| Stamp device | NUCEL Group | N/A | Link- This link provides access to the .stl file of the stamp device. Simply slice it using appropriate software and print it with a compatible 3D printer. https://drive.google.com/drive/folders/1gTYComnJWzHpN6ZKOyK EChKS3Qns0rOA?usp=sharing |
| Treated culture flask with filter 25 cm² | Corning | 430639 | Used for the cultivation and maintenance of adherent cells. |
| Trypsin | Merck | 07-07-9002 | For dissociation of cells before seeding. |
| Ultra violet light (UV) | N/A | N/A | Used to sterilize the stamp and plates. |
References
- Lian, J., Yue, Y., Yu, W., Zhang, Y. Immunosenescence: a key player in cancer development. J Hematol Oncol. 13 (1), 151 (2020).
- Wang, F., et al. Reciprocal interactions between beta1-integrin and epidermal growth factor receptor in three-dimensional basement membrane breast cultures: a different perspective in epithelial biology. Proc Natl Acad Sci USA. 95 (25), 14821-14826 (1998).
- Dzobo, K., Dandara, C. The extracellular matrix: its composition, function, remodeling, and role in tumorigenesis. Biomimetics. 8 (2), 146 (2023).
- Sutherland, R. M., McCredie, J. A., Inch, W. R. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. J Natl Cancer Inst. 46 (1), 113-120 (1971).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Bialkowska, K., Komorowski, P., Bryszewska, M., Milowska, K. Spheroids as a type of three-dimensional cell cultures-examples of methods of preparation and the most important application. Int J Mol Sci. 21 (17), 6225 (2020).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. J Vis Exp. (81), e50665 (2013).
- Andersen, T., Auk-Emblem, P., Dornish, M. 3D Cell culture in alginate hydrogels. Microarrays (Basel). 4 (2), 133-161 (2015).
- Hou, S., et al. Advanced development of primary pancreatic organoid tumor models for high-throughput phenotypic drug screening. SLAS Discov. 23 (6), 574-584 (2018).
- Napolitano, A. P., et al. Scaffold-free three-dimensional cell culture utilizing micromolded nonadhesive hydrogels. Biotechniques. 43 (4), 494-500 (2007).
- Maria-Engler, S. S., et al. Co-localization of nestin and insulin and expression of islet cell markers in long-term human pancreatic nestin-positive cell cultures. J Endocrinol. 183 (3), 455-467 (2004).
- Mantovani, M. C., et al. Immobilization of primary cultures of insulin-releasing human pancreatic cells. Islets. 1 (3), 224-231 (2009).
- Wassmer, C. H., et al. Engineering of primary pancreatic islet cell spheroids for three-dimensional culture or transplantation: a methodological comparative study. Cell Transplant. 29, 963689720937292 (2020).
- Stuart, M. P., et al. Successful low-cost scaffold-free cartilage tissue engineering using human cartilage progenitor cell spheroids formed by micromolded nonadhesive hydrogel. Stem Cells Int. 2017, 7053465 (2017).
- Charelli, L. E., Dernowsek, J. A., Balbino, T. A. Generation of tissue spheroids via a 3D printed stamp-like device. J Vis Exp. (188), e63814 (2022).
- Decarli, M. C. Micromold for the production of cellular spheroids and use. , (2019).
- Riffle, S., Pandey, R. N., Albert, M., Hegde, R. S. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids. BMC Cancer. 17, 338 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved