Method Article
新規スタンプデバイスを用いた二次元細胞培養からの三次元スフェロイド/オルガノイドの作製
要約
この研究では、アガロース型にマイクロウェルを作製するためのスタンプベースのシステムを使用して、3D細胞構造を生成するための費用対効果が高く効率的な方法論を提示します。このシステムは、均一なスフェロイド/オルガノイドの形成を促進し、細胞相互作用を改善します。このアプローチは、実験のばらつきを減らし、薬物試験や組織工学への応用をサポートします。
要約
三次元(3D)細胞培養は、細胞と細胞外マトリックスとの間の相互作用の促進を促進するため、従来の二次元(2D)培養物よりもin vivo 微小環境をより正確に表現できます。この研究は、革新的なスタンプベースのシステムを使用して3D細胞構造(スフェロイド/オルガノイド)を生成し、アガロース型にマイクロウェルを作成するための効率的で費用対効果が高く、再現性のある方法論を開発することを目的としています。新しいスタンプを使用して、6ウェルプレートのウェルあたり663マイクロウェルを生成し、細胞凝集に理想的な環境を提供しました。初代ブタ膵島細胞をこれらのマイクロウェルに播種し、そこで凝集してスフェロイド/オルガノイドを形成しました。培養物を37°Cで5%CO2未満でインキュベートし、培地を3日ごとに交換しました。スフェロイド形成を定期的にモニタリングし、特性評価のためにサンプルを収集しました。この分析法により、均一で高品質なスフェロイドを作製し、実験のばらつきを減らし、操作を最小限に抑え、細胞間相互作用を強化することに成功しました。アガロースベースのマイクロパターンモールドを使用することで、3D培養のための簡素化された制御された環境が提供され、標準化された費用対効果の高いソリューションが提供されました。この方法論は、薬物試験や組織工学のアプリケーションをサポートし、さまざまな実験室環境で簡単に実装できる3D細胞培養モデル用の実用的でスケーラブルなプラットフォームを提供します。
概要
過去50年間にわたり、数多くの細胞生物学研究により、二次元(2D)培養では、動物モデルで観察されたin vivo条件を正確に再現できないことが実証されています1。構造的には、2D細胞培養では、細胞が3次元的に組織化し、in vivoシステムで観察された状況を再現することはできません。さらに、2D培養では、3次元(3D)培養と比較して細胞シグナル伝達経路が変化するため、2D培養を使用した特定のタイプの薬物スクリーニングが非常に矛盾している理由を説明している可能性があります2。細胞培養技術の大幅な進歩は、3D培養システムの導入により明らかになりました。3Dシステムは、細胞の組成や細胞構造によって複雑さが大きく異なります。一般に、スフェロイドとオルガノイドの2種類の構造が生成されます。スフェロイドは、正常組織または腫瘍組織、胚様体、および細胞株から得られた細胞の単純なクラスターとして説明されています。3D構造の形成は、細胞間相互作用や細胞外マトリックス(ECM)の成分によって媒介されるシグナル伝達経路など、さまざまな要因の影響を受けます。これらは、構造的なサポートと生化学的な手がかりを提供します。これらの要素は、組織の組織化と機能に寄与する相互作用を調節します3。スフェロイド培養システムは、1970年代初頭に初めて報告され、結節性がんのモデルとしてV79チャイニーズハムスター肺細胞株を使用し、非接着条件下で増殖し、完全な球を形成しました4。オルガノイドは、幹細胞または前駆細胞に由来する臓器特異的な細胞型のクラスターとして説明され、細胞選別や系統指定などのプロセスを通じて空間的に限定された方法で自己組織化し、in vivo開発5を反映しています。
3D条件下で細胞を培養するために、いくつかの利用可能な方法と材料が利用可能です。現在、3D培養物の生成に採用されている主な方法は、1)液滴を吊るす。2)回転細胞培養と低付着プラスチック。3)円錐形の井戸を含むピラミッドプレート。4)マクロ多孔質の足場。5)磁気ビーズ;6)足場のないハイドロゲル。
吊り下げ式ドロップは、足場のない3D培養物を得るために使用される方法です。この方法には、広範な取り扱い、低い生産効率、球面形状、高いせん断力への曝露など、特定の制限があります。さらに、培地の置換やコンパウンドの添加などの特定の手順は困難であり、材料の損失につながる可能性があります。さらに、文献報告によると、一部の細胞株は、このアプローチを採用すると密集したスフェロイドを産生できないことが示されています6。
回転式細胞培養と低接着プラスチックを使用して、細胞が基質に付着して細胞が凝集してスフェロイドを形成するのを防ぎます。このプロセスには、特定のフラスコおよび/または攪拌/回転が必要です。これは、大規模なスフェロイドやオルガノイドの作製に最も簡単な方法の1つですが、特定の機器が必要である、培養寿命が短い、スフェロイドのサイズのばらつき、細胞への機械的損傷、効率の低さなどの欠点がないわけではありません6。
円錐形のウェルを含むピラミッドプレートは、一部の操作がスフェロイド/オルガノイドの形成を妨げる可能性があるという事実に加えて、コストに影響を与える市販のプレートです7。
マクロ多孔質の足場は、3D培養にも使用されます。しかし、効果的な細胞播種と均一な分布を実現するには、大きな障害があります。この問題は、細孔サイズが細胞の浸透には小さすぎるか、細胞をしっかりと保持するには大きすぎる可能性があるために発生します。この問題に対処するために、この手法の複雑さとコストに直接影響を与えるいくつかの戦略が検討され8てきました。
磁気ビーズ法は、少数のスフェロイド/オルガノイドを生成し、コストが高く、細胞内にナノ粒子の残留物を残す可能性がある9。
スフェロイドを培養するシステムの中には、足場のないハイドロゲルである非接着性のアガロースハイドロゲルがあります。このアプローチには、3D構造のサイズを正確に制御し、プレートごとに大量のこれらの構造を生成する能力など、注目すべき利点があります。この方法では、細胞を予め形成されたウェルを有するハイドロゲルに導入し、そこで細胞を沈めて3Dスフェロイド10に自己組織化する。
本研究では、マイクロパターンモールドを用いて、アガロースマイクロウェルを簡便、効率的、再現性、低コストで作製するための装置と方法論を紹介します。
このスタンプを重力の助けを借りてアガロース中にマイクロウェルを生成するための型として使用することで、マイクロウェルと細胞組織内での細胞相互作用を強化し、3D構造(スフェロイド/オルガノイド)を in vitro でシンプル、効率的、再現性、低コストで生成し、研究時間と実験室のリソースを節約することを目的としています。
プロトコル
このプロトコルは、2021年9月8日に承認されたCEUA-FMUSP:1699/2021のヒト研究倫理委員会のガイドラインに従っており、2021年9月8日に承認された「ブタ膵島の分離とカプセル化」であり、細胞分子治療NUCELグループ(www.usp.br/nucel、FAPESP助成金番号2016/05311-2、「慢性変性疾患(がんおよび糖尿病)の治療を目指す再生医療」と題されたテーマ別プロジェクトの一部です。
1. スタンプ装置の製作
注:このスタンプは、NUCELグループ(https://w3nucel.webhostusp.sti.usp.br/)によってカスタムメイドされています。スタンプデバイスは、その精度と高度な3次元モデリング機能で広く認められている参照ソフトウェアを使用して開発されました。
- 設計されたプロトタイプには、スフェロイドやオルガノイドなどの3次元培養物を同数生成できるように配置された663個のマイクロピンが備わっていることを確認してください。T6トレイ表面のスタンプの安定性を確保するには、デバイスの円周に沿って5つのサポートポイントを戦略的に配置します。
- マイクロピンが円錐形のデザインで、寸法が1mmから3mmの範囲であることを確認してください。円錐形の底面の直径は0.7〜1.5mmの間で変化し、テーパー角度は5°〜10°の範囲です。
- マイクロピンの深さを定義するデバイスの「ストップ」構造が、長さが10〜19 mm、直径が20〜40 mmで、マイクロピンが表面全体に均一に分布していることを確認してください。
- さらに、片手での操作に適した人間工学に基づいたハンドルを持つようにデバイスを設計して、使用中の実用性と精度を向上させます。
注:デバイスの大規模生産を容易にするために、3D印刷プロセスに不可欠な.stl形式のデジタルファイルが提供されます。 - 適切なソフトウェアを使用してスライスし、互換性のある3Dプリンターで印刷するだけです。次の印刷寸法を使用してください:X-68 mm;Y-120ミリメートル;Z - 150 mm、機能性と構造品質の理想的なバランスを確保します。
- デバイスの製作には、デバイスの性能を最適化するための必須特性である高分解能と均一な表面仕上げが求められるUV硬化型ポリマー樹脂と互換性のある光硬化型3Dプリンタを使用します。
- 選択した3Dプリンターと互換性のあるソフトウェアを使用して、印刷用のデジタルモデルをスライスします。
2. アガロースマイクロウェルの調製
- アガロース溶液を調製します。
- 純粋なアガロース粉末を秤量し、1xリン酸緩衝生理食塩水(PBS)に溶解して、最終濃度1〜2%(w / v)を達成します。
- 溶液を電子レンジまたはウォーターバスで完全に溶解するまで加熱し、均一で透明であることを確認します。
注意: 過熱や過度の再加熱は、アガロースを劣化させる可能性があるため、避けてください。大量の原液を調製しないでください。 - 溶液をピペッティングに理想的な温度である~40°Cまで冷却します。
- 特注スタンプを用意します。
- スタンプを柔らかい毛のスポンジと蒸留水で洗い、残留物を取り除きます。
- 洗浄したスタンプをUVライトに5〜10分間さらして、無菌性を確保します。
- マイクロウェルを形成します。
- 40 °C のアガロース溶液を ~3 mL を 6 ウェルプレートの各ウェルに注ぎ、2 〜 3 mm の均一な深さを確保します。
- アガロースがまだ温かいうちに、カスタムメイドのスタンプをウェルの中央に配置します。
注意: スタンプには、位置合わせと安定性を確保する横方向のサポートがあり、手動サポートの必要性を排除します。各スタンプは、ウェルごとに~663マイクロウェル(高さ~2mm)を作成します。マイクロピンに気泡がないことを確認してください。気泡が発生した場合は、スタンプをそっと動かして泡を消します。 - プレートを動かさずに、アガロースを室温で5〜10分間固化させます。
注:凝固中にアガロースを乱さないでください、マイクロウェル構造のばらつきを避けるために。 - マイクロウェルを傷つけずに真空を解放するために、穏やかに前後に動かしてスタンプを取り外してください。
注:この動きにより空気の侵入が容易になり、ゲルを変形させることなくスタンプをスムーズに取り外すことができます。マイクロウェルは無傷のままでなければなりません。 - マイクロウェルをPBS溶液で3回洗浄し、残留物を除去します。
- プレートをUVライトに10分間さらして、微生物汚染を排除します。
- 3 mLの培地を加え、プレートをCO2 インキュベーターで37°Cで一晩インキュベートします。
注:このインキュベーションでは、細胞播種前に汚染がないことを確認します。
3. マイクロウェルでの細胞播種
- 細胞懸濁液を準備します。
- トリプシン処理または別の解離法によって細胞を採取し、均質な懸濁液を得る。
- 細胞をカウントし、マイクロウェルごとに必要な数に応じて濃度を調整します。
注:663マイクロウェルにマイクロウェルあたり5,000個の細胞を播種するには、少なくとも3.315個の×10個の6 個の細胞を含む懸濁液を調製します。細胞濃度を最適化して、中枢性壊死を予防し、適切な栄養素と酸素の拡散を確保します。
- 細胞を播種します。
- 調製した細胞懸濁液を~3 mLをマイクロウェル上にピペットで移動させ、プレートを穏やかに撫でることで均一な分布を確保します。
- 細胞を重力(~10~15分)で沈降させるか、100 × g で5分間穏やかに遠心分離を行います。
注:遠心分離は、細胞がマイクロウェルに集中することを確認するために使用できます。 - プレートを加湿雰囲気のある37°CのCO2 インキュベーターに移します。
4. 3次元細胞培養の維持
- 培地を交換してください。
- 2〜3日ごとに培地を交換し、古い培地の50%を取り除き、新しい培地を追加します。
注:脱水症を防ぐために、培養期間中はマイクロウェルが水没していることを確認してください。
- 2〜3日ごとに培地を交換し、古い培地の50%を取り除き、新しい培地を追加します。
- 3D培養の形成を監視します。
- 3D構造が完全に形成され、コンパクトになるまで培養を続けます(例えば、一次膵島培養の場合は2〜3日)。
注:より長い形成時間を必要とする培養物の場合は、2〜3日ごとに部分的な培地交換を行います。
- 3D構造が完全に形成され、コンパクトになるまで培養を続けます(例えば、一次膵島培養の場合は2〜3日)。
5. 3D構造の収集と特性評価
- スフェロイド/オルガノイドを収集します。
- 古い培地を取り出し、広径またはカットされたピペットチップを使用して激しいピペッティングで3D構造を回収し、圧縮や分解を防ぎます。
注:骨材を変形させずに骨材を取り除くために、激しいピペッティングを制御する必要があります。
- 古い培地を取り出し、広径またはカットされたピペットチップを使用して激しいピペッティングで3D構造を回収し、圧縮や分解を防ぎます。
- 解析の準備をします。
- 採取したスフェロイド/オルガノイドはすぐに使用するか、将来の分析のために修正してください。
注:スフェロイドの関連と安定性は、細胞の種類、形成時間、および培養条件によって異なります。解離を避けるためには注意が必要です。
- 採取したスフェロイド/オルガノイドはすぐに使用するか、将来の分析のために修正してください。
結果
この研究で使用された細胞培養は、ブタの膵島に由来しました。この研究で使用した膵島調製物は、ジチゾン染色に基づく純度は80±5%、生細胞中のフルオレセインジアセテートの検出または死細胞中のヨウ化プロピジウムの検出に基づく膵島細胞の生存率は>80%でした(Live/Dead蛍光法)。ブタ膵島製剤が少なくとも80%の純度(例:.、ジチゾン染色による)および>80%の生存可能であることを確認してください。.単離後、1 mM L-グルタミン、0.2%シプロフロキサシン、および10%ウシ胎児血清(FCS)を添加したCMRL 1066培地で、前述の11,12と同様に、37°Cおよび5%CO2で接着培養物を維持します。
本研究では、アガロース型にマイクロウェルを生成するためのスタンプベースのシステムの有効性を徹底的に評価しました(図1)。 図2に示すスタンプ設計は、マイクロピンとその配置の精度を示しており、マイクロウェル形成プロセス中の一貫したアライメントと取り扱いを容易にします。これにより、プレート全体で均一なマイクロウェルパターンが確保され、再現性のある3D細胞培養を達成するための重要な特徴となりました。
スタンプを使用したマイクロウェル形成のプロセスを 図3に詳しく説明し、均一なマイクロウェルを作成するスタンプの能力を視覚化します。その結果、複数のスタンプを同時に使用できることが確認され、準備プロセスが効率化されました。アガロース型を顕微鏡で分析すると、細胞の3D構造への凝集を制御する重要な要素である、凹型の標準化されたマイクロウェル形状が明らかになります。マイクロウェルの均一性は、さまざまな実験で得られた一貫した結果によって実証されているように、3D培養形成の信頼性と再現性に大きく貢献します。
図4は、細胞接種時(0時間)からいくつかの時点(6時間、24時間、48時間、72時間)までの3D構造の時間依存的な発達を示しています。細胞の凝集/コンパクトな3D構造への圧縮は徐々に起こり、48時間マークまでに有意な凝集が観察されました。このタイムラインは、細胞の種類によって異なる可能性があり、この研究では、48時間以内にコンパクトで機能的な3D構造を形成した初代ブタ膵島の使用によって証明されています。これは、組織化された3D培養物の生成におけるプロトコルの有効性を示しています。
図5は、アガロースマイクロウェルから除去された後の3D構造の安定性と生存率を示しています。3D構造は、除去後もコンフォメーションを保持し(図5A)、この方法論の堅牢性が確認されました。さらに、生/死アッセイ(図5B、C)は、生細胞の緑色染色によって示されるように、構造内の細胞が生存していることを示しました。この知見は、このプロトコールがよく組織化された3D構造の形成を促進するだけでなく、細胞生存率を維持することを裏付けており、3D細胞培養アプリケーションに対する信頼性と効率性に優れたアプローチとなっています。
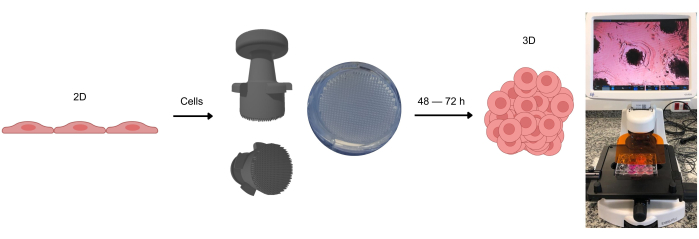
図1:3D細胞培養物の形成プロセス。 最初に2Dで培養した細胞は、接着面から剥離し、アガロースマイクロウェルに入れます。これらのアガロースマイクロウェルは、アガロースゲルが室温で固化した後にこれらのマイクロウェルを形成することができるスタンプデバイスを使用して作成されます。光学顕微鏡で観察すると、細胞がマイクロウェル全体に均一に分布しているのがわかります。約2〜3日後(細胞の種類によって異なります)、スフェロイドまたはオルガノイドの形成が観察されます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:スタンプデバイス。 (A-C)のスタンプ装置の代表的なイメージを、663マイクロピン、プレートサポート、マニュアルハンドリングサポートの3つの視点から示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:マイクロウェルモールド製造プロセスの段階的な表現。 (A)スタンプ装置。(b)液体アガロースを含有するウェルの中央におけるスタンプ装置の配置と、(c)アガロース重合;(d)スタンプ装置により成形されたアガロースマイクロウェルと、(E)同じプレート(P6)内の3つのスタンプデバイスを使用した生産のデモンストレーション。(F)4倍の倍率(スケールバー= 1,000μm)でのマイクロウェルの光学顕微鏡画像;(G)10倍倍率(スケールバー=400μm)でのマイクロウェルの光学顕微鏡画像。 この図の拡大版を表示するには、ここをクリックしてください。

図4:一次膵島ブタ培養の光学顕微鏡画像。 2倍(スケールバー= 2,000μm)、4倍(スケールバー= 1,000μm)、および10倍(スケールバー= 400μm)の倍率で、次の時点での画像:0時間、6時間、24時間、48時間、72時間。 この 図の拡大版を表示するには、ここをクリックしてください。

図5:Live/Deadアッセイ。 アガロースマイクロウェルで作製し、改良されたスタンプデバイスを用いて72時間(3日)後に採取したブタ膵島細胞の初代培養から得られたスフェロイドの生存率を示す代表的な画像。蛍光光学顕微鏡画像が得られました。緑色の染色はフルオレセインジアセテートで標識された生細胞を表し、赤色の染色はヨウ化プロピジウムで標識された非生存細胞を示します。この画像は、3D培養物の回転楕円体構造が維持され、マイクロウェルから除去した後も生存可能であることを確認しています。スケールバー = 400 μm. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
文献にはさまざまな3D培養プロトコルが存在しますが、Wassmerらが実施した研究では13 、膵島を使用して3D構造を生成するためのいくつかの方法論がテストされました。その結果、在来の膵島と自己凝集したスフェロイドは、サイズと形状に関してかなりの不均一性を示し、他の方法を用いて得られたものよりも大きいことが観察された。彼らの発見に基づいて、彼らはスフェロイドは異なる技術を使用して生成でき、それぞれに独自の長所と短所があると結論付けました。膵島細胞の凝集には、ハンギングドロップ法、アガロースマイクロウェルプレート、またはSphericalplate 5Dが推奨されます。
アガロースマイクロウェルを生成するためのデバイスがあり、文献で成功裏に採用されています。例えば、Stuart et al.14 は、デバイスを使用して有望な結果を示しましたが、対処が必要な特定の欠点を示しました。例えば、製造できるマイクロウェルの数が限られていること、モールド面積が小さいことによる作業量の減少、ネガティブモールドとしての設計がマイクロウェルの破損や歪みのリスクを高めることなどです。
スフェロイドを生成するためのスタンプのようなデバイスは、3D印刷技術を使用してCharelliと同僚15 によって開発されました。6ウェルプレートあたり最大4,716個のスフェロイドを製造できるこのデバイスは、光硬化性樹脂を使用した光造形によって作成されました。その結果、高さ1.3mm、幅650μmの円筒形マイクロピンが特徴となりました。この方法により、共培養されたスフェロイドを含む、一貫した形状とサイズの均一なスフェロイドを迅速に形成することができました。その利点にもかかわらず、使いやすさとパフォーマンスを向上させるには、いくつかの課題に対処する必要があります。重大な問題は、手動サポートがないため、デバイスの取り扱いが難しく、金型形成プロセス中に不安定になりやすいことです。この不安定性は、しばしばアガロースゲルの破損や亀裂につながり、その構造的完全性を損なう。さらに、このデバイスはプレートサポートが不足しているため、ウェルプレートにしっかりと固定できません。その結果、アガロースが固化するまでスタンプを手動で吊り下げる必要があり、ばらつきが生じ、マイクロウェル形成の均一性に影響を与えます。これらの制限により、得られるスフェロイドの再現性と全体的な品質が低下します。
当社の改良されたスタンプ/プロトコールは、効率的で低コストの方法を可能にし、アガロースマイクロウェルで3Dスフェロイドとオルガノイドを生成することができ、そのシンプルさと再現性が注目に値します。Decarliと同僚の研究に触発されて16、私たちのグループは、非粘着性のアガロースヒドロゲル法を使用して、新しいスタンプデバイスを開発しました。その結果、マイクロウェル形成における取り扱いの難しさや不整合などの課題に取り組みました。当社の方法論によって開発されたスタンプは、これらの改善を取り入れ、より使いやすく、効率的で、再現性の高いスタンプとなっています。
修飾に関しては、細胞密度はさまざまな細胞タイプや実験目的に合わせて調整できます。増殖速度が低い細胞や細胞相互作用が限られている細胞には、より高い細胞播種密度が必要になるかもしれませんが、密度が低いと、特定の細胞タイプに対してより良い構造構成が有利になる可能性があります。スフェロイド形成に問題が発生した場合、プレートの迅速な遠心分離などの小さな修飾により、細胞がマイクロウェルの底に適切に沈殿するのに役立つ可能性があります。
このプロトコールの重要なステップの1つは、細胞をマイクロウェルに正確かつ均一に播種することです。均一な細胞分布は、形成された構造が一貫したサイズと均一な特性を持つようにするために不可欠であり、結果の品質に直接影響します。3Dカルチャーのコレクションも重要なポイントです。このステップでは、回収中に構造が破壊されないように細心の注意が必要であり、スフェロイドとオルガノイドの完全性を維持するための適切なピペッティング技術が必要です。
スフェロイドのサイズは、使用する細胞の種類によって異なります。さらに、スフェロイドあたりの細胞数も異なるため、使用する特定の細胞株または初代細胞に基づいて最適化する必要があります。文献で報告されているように、スフェロイド内の細胞密度が過度に高いと壊死性コアの発達を引き起こすことが示されていることに注意することが重要です。この壊死性コアは、酸素と栄養素の拡散が不十分で、最も内側の細胞に生じるため、スフェロイド17の全体的な生存能力と機能が損なわれる可能性がある。
簡便で低コストであるという利点があるにもかかわらず、この方法の大きな制限は、特により大きく複雑な構造を必要とする実験において、スフェロイドコレクションの潜在的なばらつきです。このような場合、プロセスを最適化し、材料の損失を減らすために、より専門的な収集ツールの使用や方法論的な適応が必要になるかもしれません。非常に小さなスフェロイドを取得すると、操作や収集が複雑になる可能性があり、厳密なプロトコル制御が必要になります。
スフェロイド/オルガノイドの会合と解離は、使用する細胞の種類、構造形成に必要な日数、使用する培地、および可能な攪拌の必要性によって大きく異なります。これらの要因は、各細胞タイプの特定の特性に固有のものです。ただし、細胞の解離を最小限に抑えるには、培地交換時の穏やかな取り扱いや培養条件の適切な維持など、方法論で概説されている予防措置に厳密に従うことが不可欠です。
回転培養や磁気ビーズなどの他の方法と比較して、このプロトコルは、特殊な機器の必要性を排除し、3Dスフェロイドやオルガノイドのより再現性の高い生産を保証する、そのシンプルさが際立っており、幅広い研究目的のための実用的な代替手段となっています。文献13に前述した結果によれば、アガロースマイクロウェルは、Sphericalplate 5Dなどの他の市販モデルと比較して、より高い生存率およびインスリン分泌速度で、インスリン産生細胞の3Dスフェロイド構造の生成を促進する。
この方法の汎用性と低コスト性により、細胞生物学、腫瘍学、医薬品開発研究、毒物学などのさまざまな研究分野に最適です。 これは、in vitro 3Dモデリングに効果的なソリューションを提供し、細胞の挙動、細胞相互作用、薬物応答、および治療法の開発に関するより正確な研究を促進します。
開示事項
著者は、利益相反がないことを宣言します。
謝辞
特に、Zizi de Mendonça氏(ブラジル、サンパウロ大学医学部)の優れた技術支援に感謝しています。この研究は、BNDES 09.2.1066.1、CAPES(PVEプロセス番号88881.068070/2014-01)、CNPq(助成金番号457601/2013-2、401430/2013-8、INCT-Regenera番号465656/2014-5)、FAPESP(テーマ別プロジェクト番号2016/05311-2)、FINEP 01.08.06.05、科学技術省(MCTI)および保健省(MS-DECIT)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 31L Microwave | Electrolux | 78965840 6699 9 | Equipment used to heat the agarose solution, facilitating its dissolution and ensuring greater homogeneity. It allows the solution to reach the ideal liquid state for the formation of the wells. |
| 3DFila Gray Opaque Photosensitive 3D Resin | UV-curable polymer resin | ||
| 3D Printer - Creality Halot One | Creality | N/A | 3D printer used for printing the stamp device |
| Agarose | UNISCIENCE | UNI-R10111 | To form the gel, dissolve 1 to 2% in Saline Phosphate Buffer (PBS) or appropriate medium. |
| Autodesk Fusion 360 | 3D modeling | ||
| BB15 CO2 Incubator | Thermo Fisher | 51023121 | Equipment used to incubate cultured cells in a suitable and controlled environment. |
| Chitubox | Chitubox | N/A | Software used for slicing the part for printing |
| Class II Biological Safety Cabinet | Grupo VECO | N/A | Ensures a sterile environment for performing cell culture within established parameters and protocols. |
| Culture medium | USBiological/Life Sciences | C5900-03A | Contains additives for proper cell cultivation. |
| Culture plates (P6) | SARSTEDT | 1023221 | Used to shape the agarose and culture the cells. |
| Erlenmeyer Flask (25 mL) | Laborglas | 91 216 14 | A container used for dissolving 1–2% agarose in Phosphate Buffered Saline (PBS) or another suitable medium, typically heated in a microwave. |
| Falcon 15 mL Polystyrene Centrifuge Tube | Corning | 352099 | Used to keep cells in suspension and perform possible dilutions. |
| Fetal bovine serum (FBS) | Vitrocell Embriolife | 005/19 | Additive for culture medium. |
| PBS solution (Saline Phosphate Buffer) | Lab made | N/A | Diluted 1x with MiliQ ultrapure water. Used to dissolve agarose 1 to 2% and to wash wells already produced. |
| Reagent bottle with blue cap - Schott | Laborglas | 21801545 | Used for preparing and storing culture medium. |
| Stamp device | NUCEL Group | N/A | Link- This link provides access to the .stl file of the stamp device. Simply slice it using appropriate software and print it with a compatible 3D printer. https://drive.google.com/drive/folders/1gTYComnJWzHpN6ZKOyK EChKS3Qns0rOA?usp=sharing |
| Treated culture flask with filter 25 cm² | Corning | 430639 | Used for the cultivation and maintenance of adherent cells. |
| Trypsin | Merck | 07-07-9002 | For dissociation of cells before seeding. |
| Ultra violet light (UV) | N/A | N/A | Used to sterilize the stamp and plates. |
参考文献
- Lian, J., Yue, Y., Yu, W., Zhang, Y. Immunosenescence: a key player in cancer development. J Hematol Oncol. 13 (1), 151 (2020).
- Wang, F., et al. Reciprocal interactions between beta1-integrin and epidermal growth factor receptor in three-dimensional basement membrane breast cultures: a different perspective in epithelial biology. Proc Natl Acad Sci USA. 95 (25), 14821-14826 (1998).
- Dzobo, K., Dandara, C. The extracellular matrix: its composition, function, remodeling, and role in tumorigenesis. Biomimetics. 8 (2), 146 (2023).
- Sutherland, R. M., McCredie, J. A., Inch, W. R. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. J Natl Cancer Inst. 46 (1), 113-120 (1971).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Bialkowska, K., Komorowski, P., Bryszewska, M., Milowska, K. Spheroids as a type of three-dimensional cell cultures-examples of methods of preparation and the most important application. Int J Mol Sci. 21 (17), 6225 (2020).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. J Vis Exp. (81), e50665 (2013).
- Andersen, T., Auk-Emblem, P., Dornish, M. 3D Cell culture in alginate hydrogels. Microarrays (Basel). 4 (2), 133-161 (2015).
- Hou, S., et al. Advanced development of primary pancreatic organoid tumor models for high-throughput phenotypic drug screening. SLAS Discov. 23 (6), 574-584 (2018).
- Napolitano, A. P., et al. Scaffold-free three-dimensional cell culture utilizing micromolded nonadhesive hydrogels. Biotechniques. 43 (4), 494-500 (2007).
- Maria-Engler, S. S., et al. Co-localization of nestin and insulin and expression of islet cell markers in long-term human pancreatic nestin-positive cell cultures. J Endocrinol. 183 (3), 455-467 (2004).
- Mantovani, M. C., et al. Immobilization of primary cultures of insulin-releasing human pancreatic cells. Islets. 1 (3), 224-231 (2009).
- Wassmer, C. H., et al. Engineering of primary pancreatic islet cell spheroids for three-dimensional culture or transplantation: a methodological comparative study. Cell Transplant. 29, 963689720937292 (2020).
- Stuart, M. P., et al. Successful low-cost scaffold-free cartilage tissue engineering using human cartilage progenitor cell spheroids formed by micromolded nonadhesive hydrogel. Stem Cells Int. 2017, 7053465 (2017).
- Charelli, L. E., Dernowsek, J. A., Balbino, T. A. Generation of tissue spheroids via a 3D printed stamp-like device. J Vis Exp. (188), e63814 (2022).
- Decarli, M. C. Micromold for the production of cellular spheroids and use. , (2019).
- Riffle, S., Pandey, R. N., Albert, M., Hegde, R. S. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids. BMC Cancer. 17, 338 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2578-2614
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。