Method Article
Novel Stamp Device를 사용한 2차원 세포 배양에서 3차원 스페로이드/오가노이드 생성
요약
이 연구는 스탬프 기반 시스템을 사용하여 아가로스 주형에 마이크로웰을 생성함으로써 3D 세포 구조를 생성하는 비용 효율적이고 효율적인 방법론을 제시합니다. 이 시스템은 균일한 스페로이드/오가노이드의 형성을 촉진하여 세포 상호 작용을 개선합니다. 이 접근 방식은 실험 변동성을 줄이고 약물 테스트 및 조직 공학의 응용 분야를 지원합니다.
초록
3차원(3D) 세포 배양은 세포와 세포외 기질 간의 향상된 상호 작용을 촉진하기 때문에 기존의 2차원(2D) 배양보다 생체 내 미세환경을 더 정확하게 표현합니다. 이 연구는 혁신적인 스탬프 기반 시스템을 사용하여 아가로스 주형에 마이크로웰을 생성함으로써 3D 세포 구조(스페로이드/오가노이드)를 생성하는 효율적이고 비용 효율적이며 재현 가능한 방법론을 개발하는 것을 목표로 했습니다. 새로운 스탬프를 사용하여 6웰 플레이트의 웰당 663개의 마이크로웰을 생성하여 세포 응집을 위한 이상적인 환경을 제공했습니다. 1차 돼지 췌장 섬 세포를 이러한 마이크로웰에 파종하여 응집하여 스페로이드/오가노이드를 형성했습니다. 배양물을 37°C에서 5%CO2 이하로 배양하고, 배지를 3일마다 교체하였다. 스페로이드 형성을 주기적으로 모니터링하고 특성화를 위해 샘플을 수집했습니다. 이 방법은 균일하고 고품질의 스페로이드를 성공적으로 생성하여 실험 변동성을 줄이고 조작을 최소화하며 세포 상호 작용을 향상시켰습니다. 아가로스 기반 마이크로패턴 몰드를 사용하여 3D 배양을 위한 단순화되고 제어된 환경을 제공하여 표준화되고 비용 효율적인 솔루션을 제공했습니다. 이 방법론은 약물 검사 및 조직 공학 응용 분야를 지원하며, 다양한 실험실 환경에서 쉽게 구현할 수 있는 3D 세포 배양 모델을 위한 실용적이고 확장 가능한 플랫폼을 제공합니다.
서문
지난 50년 동안 수많은 세포 생물학 연구에서 2차원(2D) 배양이 동물 모델에서 관찰된 생체 내 조건을 정확하게 재현하지 못한다는 사실이 입증되었습니다1. 구조적으로 2D 세포 배양은 세포가 3차원으로 조직하고 생체 내 시스템에서 관찰된 상황을 복제하는 것을 허용하지 않습니다. 또한, 3차원(3D) 배양에 비해 2D 배양에서는 세포 신호 전달 경로가 변경되는데, 이는 2D 배양을 사용한 특정 유형의 약물 스크리닝이 왜 그렇게 모순되는지를 설명할 수 있습니다2. 세포 배양 기술의 상당한 발전은 3D 배양 시스템의 도입으로 나타났습니다. 3D 시스템은 세포 구성과 세포 구조에 따라 복잡성이 상당히 다릅니다. 일반적으로 두 가지 유형의 구조, 즉 스페로이드와 오가노이드가 생성됩니다. 스페로이드는 정상 또는 종양 조직, 배아체 및 세포주에서 얻은 세포의 단순한 클러스터로 설명됩니다. 3D 구조의 형성은 구조적 지원과 생화학적 단서를 제공하는 세포외 기질(ECM)의 구성 요소에 의해 매개되는 세포-세포 상호 작용 및 신호 경로를 포함한 다양한 요인의 영향을 받습니다. 이러한 요소는 조직 조직과 기능에 기여하는 상호 작용을 조절합니다3. 스페로이드 배양 시스템은 1970년대 초에 처음으로 기술되었으며, V79 중국 햄스터 폐 세포주를 결절성 암종의 모델로 사용하여 비부착 조건에서 성장하고 완벽한 구체를 형성했습니다4. 오가노이드(organoid)는 줄기세포(stem-cell) 또는 전구세포(progenitor cell)에서 유래한 장기 특이적 세포 유형의 클러스터(cluster)로 설명되며, 세포 분류 및 계통 지정과 같은 과정을 통해 공간적으로 제한된 방식으로 자체 조직화되며, 이는 생체 내 발달(in vivo development)을 반영합니다5.
3D 조건에서 세포를 배양하는 데 사용할 수 있는 여러 가지 방법과 재료를 사용할 수 있습니다. 현재 3D 배양을 생성하기 위해 사용되는 주요 방법은 다음과 같습니다 : 1) 행잉 드롭; 2) 회전 세포 배양 및 부착성이 낮은 플라스틱; 3) 원뿔형 우물을 포함하는 피라미드 판; 4) 거대 다공성 골격; 5) 자석 구슬; 및 6) 스캐폴드가 없는 하이드로겔.
행잉 드롭은 스캐폴드가 없는 3D 배양을 얻는 데 사용되는 방법입니다. 이 방법은 광범위한 취급의 필요성, 낮은 생산 효율, 구형 형상 및 높은 전단력에 대한 노출을 포함하여 특정 제한 사항을 제시합니다. 또한 배지 교체 또는 화합물 첨가와 같은 특정 절차는 까다로울 수 있으며 재료 손실이 발생할 수 있습니다. 또한, 문헌 보고서에 따르면 일부 세포주는 이 접근법을 사용할 때 단단히 채워진 스페로이드를 생성하지 못합니다6.
회전식 세포 배양과 부착성이 낮은 플라스틱을 사용하여 세포가 기질에 부착되어 응집되어 스페로이드를 형성하는 것을 방지합니다. 이 프로세스에는 특정 플라스크 및/또는 교반/회전이 필요합니다. 이는 대규모 스페로이드 또는 오가노이드 생산을 위한 가장 간단한 접근 방식 중 하나이지만, 특정 장비의 필요성, 낮은 배양 수명, 스페로이드의 크기 변화, 세포의 기계적 손상 및 낮은 효율과 같은 단점이 없는 것은 아닙니다6.
원뿔형 웰을 포함하는 피라미드 플레이트는 상업적으로 이용 가능한 플레이트로서 비용에 영향을 미치며, 일부 조작이 스페로이드/오가노이드의 형성을 방해할 수 있다는 사실7.
거대 다공성 골격은 3D 배양에도 사용됩니다. 그러나 효과적인 세포 파종(cell seeding)과 균일한 분포를 달성하는 데 큰 장애물이 있습니다. 이 문제는 공극 크기가 너무 작아 세포가 침투할 수 없거나 너무 커서 세포를 안전하게 유지할 수 없기 때문에 발생합니다. 이 문제를 해결하기 위해 이 기술의 복잡성과 비용에 직접적인 영향을 미치는 몇 가지 전략이 검토되었습니다8.
마그네틱 비드 방법론은 적은 수의 스페로이드/오가노이드를 생성하고, 비용이 많이 들며, 세포 내부에 나노 입자 잔류물을 남길 수 있습니다9.
스페로이드를 배양하기 위한 시스템 중 비접착 아가로스 하이드로겔을 사용할 수 있으며, 이는 스캐폴드가 없는 하이드로겔을 나타냅니다. 이 접근 방식은 3D 구조의 크기를 정밀하게 제어하고 플레이트당 상당한 수의 이러한 구조를 생성할 수 있는 용량과 같은 주목할만한 이점을 제공합니다. 이 방법에서는 세포가 미리 형성된 웰이 있는 하이드로겔에 도입되어 3D 스페로이드10로 가라앉고 자체 조립됩니다.
본 연구에서는 마이크로패턴 몰드를 이용하여 간단하고 효율적이며 재현 가능하고 저렴한 방식으로 아가로스 마이크로웰을 생성하는 장치와 방법론을 제시한다.
이 스탬프를 중력의 도움을 받아 아가로스에서 마이크로웰을 생성하는 금형으로 사용하면 마이크로웰과 세포 조직 내에서 세포 상호 작용을 향상시켜 간단하고 효율적이며 재현 가능하고 저렴한 방식으로 체외에서 3D 구조(스페로이드/오가노이드)를 생성하여 연구 시간과 실험실 자원을 절약하는 것을 목표로 합니다.
프로토콜
이 프로토콜은 2021년 9월 8일에 승인된 우리 기관 CEUA-FMUSP: 1699/2021의 인간 연구 윤리 위원회의 지침을 따르며, "돼지 췌장 섬의 격리 및 캡슐화"를 따르며, 세포 및 분자 치료 NUCEL 그룹(www.usp.br/nucel)의 주제 프로젝트, FAPESP 보조금 번호 2016/05311-2, "만성 퇴행성 질환(암 및 당뇨병) 치료를 목표로 하는 재생 의학"의 일부입니다.
1. 스탬프 장치의 제작
참고: 이 스탬프는 NUCEL 그룹(https://w3nucel.webhostusp.sti.usp.br/)에서 맞춤 제작했습니다. 스탬프 장치는 정밀도와 고급 3차원 모델링 기능으로 널리 알려진 참조 소프트웨어를 사용하여 개발되었습니다.
- 설계된 프로토타입에 스페로이드 또는 오가노이드와 같은 동일한 수의 3차원 배양을 생성할 수 있도록 배열된 663개의 마이크로핀이 있는지 확인합니다. T6 트레이 표면에 있는 스탬프의 안정성을 보장하려면 장치 둘레를 따라 5개의 지지점을 전략적으로 배치하십시오.
- 마이크로핀이 길이가 1mm에서 3mm까지 조정 가능한 치수의 원뿔형 디자인인지 확인합니다. 원뿔의 기본 직경은 0.7mm에서 1.5mm 사이이며 테이퍼 각도는 5°에서 10° 사이입니다.
- 마이크로핀의 깊이를 정의하는 장치의 "정지" 구조가 조정 가능한 길이가 10-19mm이고 직경이 20-40mm이며 표면 전체에 마이크로핀이 균일하게 분포되어 있는지 확인합니다.
- 또한 한 손 조작에 적합한 인체공학적 손잡이를 갖도록 장치를 설계하여 사용 중 실용성과 정밀도를 향상시킵니다.
참고: 장치의 대규모 생산을 용이하게 하기 위해 3D 프린팅 프로세스에 필수적인 .stl 형식의 디지털 파일이 제공됩니다. - 적절한 소프트웨어를 사용하여 슬라이스하고 호환되는 3D 프린터로 인쇄하기만 하면 됩니다. 다음 인쇄 치수를 사용하십시오 : X - 68 mm; Y - 120 밀리미터; Z - 150mm로 기능과 구조적 품질 간의 이상적인 균형을 보장합니다.
- 장치 제작을 위해 최적의 장치 성능을 위한 필수 특성인 고해상도와 균일한 표면 마감이 필요한 UV 경화 고분자 수지와 호환되는 광경화 3D 프린터를 사용하십시오.
- 선택한 3D 프린터와 호환되는 소프트웨어를 사용하여 인쇄하기 위해 디지털 모델을 슬라이스합니다.
2. 아가로스 마이크로웰의 준비
- 아가로스 용액을 준비합니다.
- 순수한 아가로스 분말의 무게를 측정하고 1x 인산염 완충 식염수(PBS)에 용해시켜 1-2%(w/v)의 최종 농도를 달성합니다.
- 용액이 완전히 용해될 때까지 전자레인지나 수조에서 가열하여 균일하고 투명한지 확인합니다.
알림: 과열이나 과도한 재가열은 아가로스를 저하시킬 수 있으므로 피하십시오. 많은 양의 원액을 준비하지 마십시오. - 용액을 피펫팅에 이상적인 온도인 ~40 °C로 냉각시킵니다.
- 주문 제작 스탬프를 준비합니다.
- 부드러운 강모 스폰지와 증류수로 스탬프를 씻어 잔여물을 제거합니다.
- 청소한 스탬프를 자외선에 5-10분 동안 노출시켜 무균 상태를 확인하십시오.
- 마이크로웰을 형성합니다.
- 40°C 아가로스 용액 ~3mL를 6웰 플레이트의 각 웰에 붓거나 피펫팅하여 2-3mm의 균일한 깊이를 보장합니다.
- 아가로스가 아직 따뜻할 때 우물 중앙에 맞춤형 스탬프를 놓습니다.
참고: 스탬프에는 정렬과 안정성을 보장하는 측면 지지대가 있어 수동 지원이 필요하지 않습니다. 각 스탬프는 웰당 ~663개의 마이크로웰(높이 ~2mm)을 생성합니다. 마이크로핀에 기포가 없는지 확인하십시오. 기포가 형성되면 스탬프를 부드럽게 움직여 제거합니다. - 플레이트를 움직이지 않고 실온에서 5-10분 동안 아가로스가 응고되도록 합니다.
참고: 마이크로웰 구조의 변화를 피하기 위해 응고 중에 아가로스를 방해하지 마십시오. - 스탬프를 제거하십시오.amp부드러운 앞뒤로 움직여 마이크로웰을 손상시키지 않고 진공을 해제합니다.
참고: 이 움직임은 공기 유입을 용이하게 하여 젤을 변형시키지 않고 부드러운 스탬프 제거를 가능하게 합니다. 마이크로웰은 손상되지 않은 상태로 유지되어야 합니다. - 마이크로웰을 PBS 용액으로 3회 세척하여 잔여물을 제거합니다.
- 미생물 오염을 방지하기 위해 플레이트를 10분 동안 자외선에 노출시킵니다.
- 3mL의 배양 배지를 추가하고 37°C의 CO2 인큐베이터에서 플레이트를 밤새 배양합니다.
참고: 이 배양은 세포 파종 전에 오염이 없는지 확인합니다.
3. 마이크로웰에서 세포 파종
- 세포 현탁액을 준비합니다.
- 균일한 현탁액을 얻기 위해 트립신화(trypsinization) 또는 다른 해리 방법을 통해 세포를 수집합니다.
- 세포를 세고 마이크로웰당 원하는 수에 따라 농도를 조정합니다.
참고: 663개의 마이크로웰에서 마이크로웰당 5,000개의 세포를 시딩하려면 총 세포 10개 × 3.315개 이상을 포함하는 현탁액을 준비합니다. 세포 농도를 최적화하여 중심 괴사를 방지하고 적절한 영양분 및 산소 확산을 보장합니다.
- 세포에 씨를 뿌립니다.
- 준비된 세포 현탁액 ~3mL를 마이크로웰 위에 피펫팅하여 플레이트를 부드럽게 소용돌이쳐 균일한 분포를 보장합니다.
- 세포가 중력(~10-15분)에 의해 정착하도록 하거나 100×g에서 5 분 동안 부드러운 원심분리를 수행합니다.
참고: 원심분리는 세포가 마이크로웰에 집중되도록 하는 데 사용할 수 있습니다. - 플레이트를 가습 분위기에서 37°C의 CO2 인큐베이터로 옮깁니다.
4. 3D 세포 배양 유지
- 배양 배지를 교체하십시오.
- 2-3일마다 배지를 교체하여 기존 배지의 50%를 제거하고 새 배지를 추가합니다.
알림: 탈수를 방지하기 위해 배양 기간 동안 마이크로웰이 물에 잠긴 상태로 유지되도록 하십시오.
- 2-3일마다 배지를 교체하여 기존 배지의 50%를 제거하고 새 배지를 추가합니다.
- 3D 배양의 형성을 모니터링합니다.
- 3D 구조가 완전히 형성되고 조밀해질 때까지 배양을 계속합니다(예: 1차 췌장 섬 배양의 경우 2-3일).
참고: 더 긴 형성 시간이 필요한 배양의 경우 2-3일마다 부분적인 배지 변경을 수행합니다.
- 3D 구조가 완전히 형성되고 조밀해질 때까지 배양을 계속합니다(예: 1차 췌장 섬 배양의 경우 2-3일).
5. 3D 구조의 수집 및 특성화
- 스페로이드/오가노이드를 수집합니다.
- 오래된 매체를 제거하고 압축 또는 분해를 방지하기 위해 직경이 넓거나 절단된 피펫 팁을 사용하여 격렬한 피펫팅을 통해 3D 구조를 수집합니다.
참고: 응집체를 변형시키지 않고 제거하기 위해 격렬한 피펫팅을 제어해야 합니다.
- 오래된 매체를 제거하고 압축 또는 분해를 방지하기 위해 직경이 넓거나 절단된 피펫 팁을 사용하여 격렬한 피펫팅을 통해 3D 구조를 수집합니다.
- 분석을 준비합니다.
- 수집된 스페로이드/오가노이드를 즉시 사용하거나 향후 분석을 위해 고정합니다.
참고: 스페로이드의 연관성과 안정성은 세포 유형, 형성 시간 및 배양 조건에 따라 다릅니다. 해리를 피하기 위해 주의가 필수적입니다.
- 수집된 스페로이드/오가노이드를 즉시 사용하거나 향후 분석을 위해 고정합니다.
결과
이 연구에 사용된 세포 배양은 돼지 췌장 섬에서 파생되었습니다. 이 연구에 사용된 섬 제제는 디티존 염색에 따라 80 ± 5%의 순도를 가졌고, 살아있는 세포에서 플루오레세인 디아세테이트 또는 죽은 세포에서 프로피듐 요오드화물(Live/Dead 형광법)의 검출에 따라 >80%의 섬 세포 생존율을 가졌습니다. 돼지 췌장 섬 제제가 최소 80% 순수하고(예: 디티존 염색에 의해) >80% 생존 가능한지 확인하십시오. 분리 시, 앞서 설명한 바와 같이 37°C 및 5% CO2에서 1mM L-글루타민, 0.2% 시프로플록사신 및 10% 태아 송아지 혈청(FCS)이 보충된 CMRL 1066 배지에서 부착 배양을 유지합니다11,12.
본 연구에서는 아가로스 주형에서 마이크로웰을 생성하기 위한 스탬프 기반 시스템의 효과를 철저히 평가했습니다(그림 1). 그림 2에 표시된 스탬프 디자인은 마이크로핀의 정밀도와 그 배치를 보여주며, 마이크로웰 형성 과정에서 일관된 정렬 및 처리를 용이하게 합니다. 이를 통해 전체 플레이트에 걸쳐 균일한 마이크로웰 패턴을 보장했으며, 이는 재현 가능한 3D 세포 배양을 달성하기 위한 중요한 기능입니다.
스탬프를 사용한 마이크로웰 형성 과정은 그림 3에 자세히 설명되어 있으며, 여기서 균일한 마이크로웰을 생성하는 스탬프의 능력이 시각화되어 있습니다. 그 결과 여러 스탬프를 동시에 사용할 수 있어 준비 과정이 간소화된다는 것을 확인할 수 있습니다. 아가로스 주형의 현미경 분석은 오목하고 표준화된 마이크로웰 모양을 보여주며, 이는 세포를 3D 구조로 응집하는 것을 제어하는 데 중요한 요소입니다. 마이크로웰의 균일성은 다양한 실험에서 얻은 일관된 결과에서 입증된 바와 같이 3D 배양 형성의 신뢰성과 재현성에 크게 기여합니다.
그림 4는 세포 접종 시간(0시간)부터 여러 시점(6시간, 24시간, 48시간 및 72시간)에 걸쳐 3D 구조의 시간 의존적 발달을 보여줍니다. 응집된/조밀한 3D 구조로의 세포 압축은 점진적으로 이루어졌으며 48시간 표시에서 상당한 응집이 관찰되었습니다. 이 타임라인은 세포 유형에 따라 달라질 수 있으며, 이 연구에서 48시간 이내에 작고 기능적인 3D 구조를 형성한 1차 돼지 췌장섬을 사용한 것으로 입증되었습니다. 이는 조직화된 3D 배양을 생성하는 데 있어 프로토콜의 효과를 보여줍니다.
그림 5는 아가로스 마이크로웰에서 제거된 후 3D 구조의 안정성과 생존 가능성을 강조합니다. 3D 구조는 제거 후에도 형태를 유지하여(그림 5A) 방법론의 견고성을 확인했습니다. 또한, 살아있는/죽은 분석(그림 5B, C)은 살아있는 세포의 녹색 염색에서 알 수 있듯이 구조 내의 세포가 생존 가능한 상태로 남아 있음을 나타냅니다. 이 발견은 프로토콜이 잘 조직된 3D 구조의 형성을 촉진할 뿐만 아니라 세포 생존력을 보존하여 3D 세포 배양 응용 분야를 위한 신뢰할 수 있고 효율적인 접근 방식을 제공한다는 것을 확인합니다.
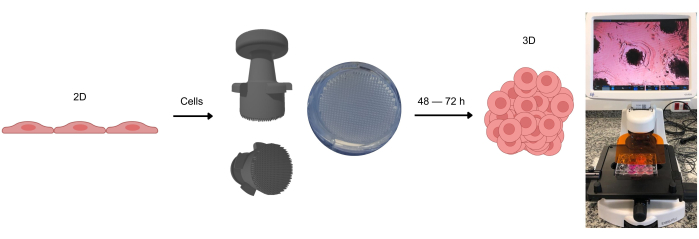
그림 1: 3D 세포 배양 형성 과정. 처음에 2D로 배양한 세포는 접착 표면에서 분리되어 아가로스 마이크로웰에 배치됩니다. 이러한 아가로스 마이크로웰은 스탬프 장치를 사용하여 생성되며, 이를 통해 아가로스 겔이 실온에서 응고된 후 이러한 마이크로웰을 형성할 수 있습니다. 광학 현미경으로 관찰할 때 세포가 마이크로웰 전체에 균일하게 분포하는 것을 볼 수 있습니다. 약 2-3일 후(세포 유형에 따라 다름) 스페로이드 또는 오가노이드의 형성을 관찰할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 스탬프 장치. (A-C)의 스탬프 장치를 세 가지 다른 관점에서 본 대표 이미지로, 주요 기능, 즉 663개의 마이크로핀, 플레이트 지지대 및 수동 취급 지원을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 마이크로웰 금형 생산 공정의 단계별 표현. (A) 스탬프 장치; (B) 액체 아가로스를 포함하는 우물의 중앙에 스탬프 장치의 위치; (C) 아가로스 중합; (D) 스탬프 장치에 의해 성형된 아가로스 마이크로웰; (E) 동일한 플레이트(P6)에 3개의 스탬프 장치를 사용하여 제작을 시연하는 단계; (F) 4배 배율(스케일 바 = 1,000μm)에서 마이크로웰의 광학 현미경 이미지; (G) 10배 배율(스케일 바 = 400μm)에서 마이크로웰의 광학 현미경 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 1차 췌장섬 돼지 배양의 광학 현미경 이미지. 다음 시점에서: 0시간, 6시간, 24시간, 48시간, 72시간에서 2배(축척 막대 = 2,000μm), 4배(축척 막대 = 400μm) 배율의 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: Live/Dead 분석. 아가로스 마이크로웰에서 생성되어 개선된 스탬프 장치를 사용하여 3D 배양 72시간(3일) 후에 수집된 돼지 췌장섬 세포의 1차 배양에서 스페로이드의 생존력을 보여주는 대표적인 이미지. 형광 광학 현미경 이미지를 얻었습니다. 녹색 염색은 플루오레세인 디아세테이트로 표지된 생존 가능한 세포를 나타내고, 빨간색 염색은 프로피듐 요오드화물로 표지된 생존 불가능한 세포를 나타냅니다. 이 이미지는 3D 배양의 타원체 구조가 유지되고 마이크로웰에서 제거된 후에도 생존 가능한 상태로 유지됨을 확인합니다. 스케일 바 = 400μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
문헌에는 다양한 3D 배양 프로토콜이 존재하지만, Wassmer 등[13 ]이 수행한 연구에서는 췌장섬을 사용하여 3D 구조를 생성하기 위한 몇 가지 방법론을 테스트했습니다. 저자들은 토착 섬과 자체 응집된 스페로이드가 크기와 모양에 대해 상당한 이질성을 보였으며 다른 방법을 사용하여 얻은 것보다 더 크다는 것을 관찰했습니다. 연구 결과를 바탕으로 그들은 스페로이드가 각각 고유한 장점과 단점이 있는 다양한 기술을 사용하여 생성될 수 있다는 결론을 내렸습니다. Islet cell Aggregation의 경우 권장되는 방법은 행잉 드롭 기법, 아가로스 마이크로웰 플레이트 또는 Sphericalplate 5D입니다.
문헌에서 성공적으로 채택된 아가로스 마이크로웰을 생성하는 장치가 있습니다. 예를 들어, Stuart et al.14 은 장치를 사용하여 유망한 결과를 보여주었지만 해결해야 할 몇 가지 단점이 있었습니다. 여기에는 생산할 수 있는 마이크로웰의 수가 제한되어 있고, 금형 면적이 작아 작업량이 감소하고, 조작이 복잡하고 마이크로웰의 파손 및 뒤틀림 위험이 증가하는 네거티브 몰드로 설계되는 것이 포함됩니다.
스페로이드를 생성하기 위한 스탬프 모양의 장치는 Charelli와 동료15 가 3D 프린팅 기술을 사용하여 개발했습니다. 6웰 플레이트당 최대 4,716개의 스페로이드를 생산할 수 있는 이 장치는 광경화성 수지를 사용한 광조형을 통해 만들어졌습니다. 그 결과 각각 높이가 1.3mm, 너비가 650μm인 원통형 마이크로핀이 사용되었습니다. 이 방법을 통해 공동 배양된 스페로이드를 포함하여 일관된 모양과 크기를 가진 균일한 스페로이드를 빠르게 형성할 수 있었습니다. 장점에도 불구하고 사용성과 성능을 개선하기 위해 몇 가지 문제를 해결해야 합니다. 중요한 문제는 수동 지원이 부족하여 장치를 다루기 어렵고 금형 형성 과정에서 불안정해지기 쉽다는 것입니다. 이러한 불안정성은 종종 아가로스 겔의 파손 또는 균열로 이어져 구조적 무결성을 손상시킵니다. 또한 이 장치는 플레이트 지지대가 부족하여 웰 플레이트에 단단히 고정할 수 없습니다. 결과적으로, 아가로스가 응고될 때까지 스탬프를 수동으로 중단해야 하며, 이로 인해 변동성이 발생하고 마이크로웰 형성의 균일성에 영향을 미칩니다. 이러한 한계는 생성된 스페로이드의 재현성과 전반적인 품질을 감소시킵니다.
당사의 개선된 스탬프/프로토콜은 효율적이고 저렴한 방법을 가능하게 하여 아가로스 마이크로웰에서 3D 스페로이드 및 오가노이드를 생성하며, 단순성과 재현성으로 유명합니다. Decarli와 동료들16의 연구에서 영감을 받은 우리 그룹은 비접착 아가로스 하이드로겔 방법론을 사용하여 새로운 스탬프 장치를 개발했습니다. 그 결과, 우리는 마이크로웰 형성의 어려움 및 불일치를 처리하는 것과 같은 문제를 해결했습니다. 우리의 방법론을 통해 개발된 스탬프는 이러한 개선 사항을 통합하여 보다 사용자 친화적이고 효율적이며 재현성이 높습니다.
변형과 관련하여 세포 밀도는 다양한 세포 유형 및 실험 목적으로 조정될 수 있습니다. 증식 속도가 낮거나 세포 상호 작용이 제한된 세포에는 더 높은 세포 시딩 밀도가 필요할 수 있으며, 특정 세포 유형에 대해 더 낮은 밀도는 더 나은 구조 조직에 유리할 수 있습니다. 스페로이드 형성에 문제가 발생하는 경우, 플레이트의 신속한 원심분리와 같은 작은 변형은 세포가 마이크로웰 바닥에 적절하게 정착하는 데 도움이 될 수 있습니다.
프로토콜의 중요한 단계 중 하나는 세포를 마이크로웰에 정확하고 균일하게 파종하는 것입니다. 균질한 세포 분포는 형성된 구조가 일관된 크기와 균일한 특성을 갖도록 하여 결과의 품질에 직접적인 영향을 미치는 데 필수적입니다. 3D 문화의 수집은 또 다른 중요한 포인트입니다. 이 단계에서는 회수 중 구조가 파괴되지 않도록 각별한 주의가 필요하며, 스페로이드 및 오가노이드의 무결성을 보존하기 위해 적절한 피펫팅 기술이 필요합니다.
스페로이드의 크기는 사용된 세포 유형에 따라 다릅니다. 또한 스페로이드당 세포 수도 다양하며 사용된 특정 세포주 또는 일차 세포에 따라 최적화해야 합니다. 스페로이드 내의 과도하게 높은 세포 밀도는 문헌에 보고된 바와 같이 괴사 코어의 발달을 유발하는 것으로 나타났습니다. 이 괴사 코어는 가장 안쪽 세포로의 부적절한 산소 및 영양분 확산으로 인해 발생하며, 이는 스페로이드의 전반적인 생존력과 기능을 손상시킬 수 있습니다17.
단순성과 저렴한 비용의 장점에도 불구하고 이 방법의 중요한 한계는 특히 더 크고 복잡한 구조를 필요로 하는 실험에서 스페로이드 수집의 잠재적인 가변성입니다. 이러한 경우 프로세스를 최적화하고 재료 손실을 줄이기 위해 보다 전문화된 수집 도구를 사용하거나 방법론적 조정이 필요할 수 있습니다. 매우 작은 스페로이드를 얻는 것은 조작 및 수집을 복잡하게 만들 수 있으므로 엄격한 프로토콜 제어가 필요할 수 있습니다.
스페로이드/오가노이드의 연관성 및 해리는 사용된 세포 유형뿐만 아니라 구조 형성에 필요한 일수, 사용된 배양 배지 및 가능한 교반의 필요성에 따라 크게 다릅니다. 이러한 요인은 각 세포 유형의 특정 특성에 내재되어 있습니다. 그러나 세포 해리를 최소화하려면 배지 변경 시 부드러운 취급 및 배양 조건의 적절한 유지와 같은 방법론에 설명된 예방 조치를 엄격하게 따르는 것이 중요합니다.
회전 배양 또는 마그네틱 비드와 같은 다른 방법과 비교할 때 이 프로토콜은 더 단순하고 특수 장비의 필요성을 없애고 3D 스페로이드 및 오가노이드의 재현성 있는 생산을 보장하여 광범위한 연구 목적을 위한 실용적인 대안이 된다는 점에서 두드러집니다. 문헌13에 이전에 기술된 결과에 따르면, 아가로스 마이크로웰은 Sphericalplate 5D와 같은 다른 상용 모델에 비해 더 높은 생존율 및 인슐린 분비율로 인슐린 생산 세포의 3D 스페로이드 구조의 생성을 촉진합니다.
이 방법의 다양성과 저렴한 비용이 결합되어 세포 생물학, 종양학, 약물 개발 연구 및 독성학과 같은 다양한 연구 분야에 이상적입니다. 체외 3D 모델링을 위한 효과적인 솔루션을 제공하여 세포 거동, 세포 상호 작용, 약물 반응 및 치료제 개발에 대한 보다 정확한 연구를 촉진합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
특히 Zizi de Mendonça(브라질 상파울루 대학교 의과대학)가 제공한 탁월한 기술 지원에 감사드립니다. 이 작업은 BNDES 09.2.1066.1, CAPES(PVE 프로세스 번호 88881.068070/2014-01), CNPq(보조금 번호 457601/2013-2, 401430/2013-8 및 INCT-Regenera 번호 465656/2014-5), FAPSP(주제별 프로젝트 번호 2016/05311-2), FINEP 01.08.06.05 및 과학기술부(MCTI) 및 보건부(MS-DECIT)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 31L Microwave | Electrolux | 78965840 6699 9 | Equipment used to heat the agarose solution, facilitating its dissolution and ensuring greater homogeneity. It allows the solution to reach the ideal liquid state for the formation of the wells. |
| 3DFila Gray Opaque Photosensitive 3D Resin | UV-curable polymer resin | ||
| 3D Printer - Creality Halot One | Creality | N/A | 3D printer used for printing the stamp device |
| Agarose | UNISCIENCE | UNI-R10111 | To form the gel, dissolve 1 to 2% in Saline Phosphate Buffer (PBS) or appropriate medium. |
| Autodesk Fusion 360 | 3D modeling | ||
| BB15 CO2 Incubator | Thermo Fisher | 51023121 | Equipment used to incubate cultured cells in a suitable and controlled environment. |
| Chitubox | Chitubox | N/A | Software used for slicing the part for printing |
| Class II Biological Safety Cabinet | Grupo VECO | N/A | Ensures a sterile environment for performing cell culture within established parameters and protocols. |
| Culture medium | USBiological/Life Sciences | C5900-03A | Contains additives for proper cell cultivation. |
| Culture plates (P6) | SARSTEDT | 1023221 | Used to shape the agarose and culture the cells. |
| Erlenmeyer Flask (25 mL) | Laborglas | 91 216 14 | A container used for dissolving 1–2% agarose in Phosphate Buffered Saline (PBS) or another suitable medium, typically heated in a microwave. |
| Falcon 15 mL Polystyrene Centrifuge Tube | Corning | 352099 | Used to keep cells in suspension and perform possible dilutions. |
| Fetal bovine serum (FBS) | Vitrocell Embriolife | 005/19 | Additive for culture medium. |
| PBS solution (Saline Phosphate Buffer) | Lab made | N/A | Diluted 1x with MiliQ ultrapure water. Used to dissolve agarose 1 to 2% and to wash wells already produced. |
| Reagent bottle with blue cap - Schott | Laborglas | 21801545 | Used for preparing and storing culture medium. |
| Stamp device | NUCEL Group | N/A | Link- This link provides access to the .stl file of the stamp device. Simply slice it using appropriate software and print it with a compatible 3D printer. https://drive.google.com/drive/folders/1gTYComnJWzHpN6ZKOyK EChKS3Qns0rOA?usp=sharing |
| Treated culture flask with filter 25 cm² | Corning | 430639 | Used for the cultivation and maintenance of adherent cells. |
| Trypsin | Merck | 07-07-9002 | For dissociation of cells before seeding. |
| Ultra violet light (UV) | N/A | N/A | Used to sterilize the stamp and plates. |
참고문헌
- Lian, J., Yue, Y., Yu, W., Zhang, Y. Immunosenescence: a key player in cancer development. J Hematol Oncol. 13 (1), 151(2020).
- Wang, F., et al. Reciprocal interactions between beta1-integrin and epidermal growth factor receptor in three-dimensional basement membrane breast cultures: a different perspective in epithelial biology. Proc Natl Acad Sci USA. 95 (25), 14821-14826 (1998).
- Dzobo, K., Dandara, C. The extracellular matrix: its composition, function, remodeling, and role in tumorigenesis. Biomimetics. 8 (2), 146(2023).
- Sutherland, R. M., McCredie, J. A., Inch, W. R. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. J Natl Cancer Inst. 46 (1), 113-120 (1971).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Bialkowska, K., Komorowski, P., Bryszewska, M., Milowska, K. Spheroids as a type of three-dimensional cell cultures-examples of methods of preparation and the most important application. Int J Mol Sci. 21 (17), 6225(2020).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. J Vis Exp. (81), e50665(2013).
- Andersen, T., Auk-Emblem, P., Dornish, M. 3D Cell culture in alginate hydrogels. Microarrays (Basel). 4 (2), 133-161 (2015).
- Hou, S., et al. Advanced development of primary pancreatic organoid tumor models for high-throughput phenotypic drug screening. SLAS Discov. 23 (6), 574-584 (2018).
- Napolitano, A. P., et al. Scaffold-free three-dimensional cell culture utilizing micromolded nonadhesive hydrogels. Biotechniques. 43 (4), 494-500 (2007).
- Maria-Engler, S. S., et al. Co-localization of nestin and insulin and expression of islet cell markers in long-term human pancreatic nestin-positive cell cultures. J Endocrinol. 183 (3), 455-467 (2004).
- Mantovani, M. C., et al. Immobilization of primary cultures of insulin-releasing human pancreatic cells. Islets. 1 (3), 224-231 (2009).
- Wassmer, C. H., et al. Engineering of primary pancreatic islet cell spheroids for three-dimensional culture or transplantation: a methodological comparative study. Cell Transplant. 29, 963689720937292(2020).
- Stuart, M. P., et al. Successful low-cost scaffold-free cartilage tissue engineering using human cartilage progenitor cell spheroids formed by micromolded nonadhesive hydrogel. Stem Cells Int. 2017, 7053465(2017).
- Charelli, L. E., Dernowsek, J. A., Balbino, T. A. Generation of tissue spheroids via a 3D printed stamp-like device. J Vis Exp. (188), e63814(2022).
- Micromold for the production of cellular spheroids and use. , Patent BR 10 2019 027360 7 A2 (2019).
- Riffle, S., Pandey, R. N., Albert, M., Hegde, R. S. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids. BMC Cancer. 17, 338(2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유