Method Article
Geração de esferoides/organoides tridimensionais a partir de culturas de células bidimensionais usando um novo dispositivo de carimbo
Neste Artigo
Resumo
Este estudo apresenta uma metodologia econômica e eficiente para gerar estruturas celulares 3D usando um sistema baseado em carimbos para criar micropoços em moldes de agarose. O sistema promove a formação de esferóides/organoides uniformes, melhorando assim as interações celulares. Essa abordagem reduz a variabilidade experimental e oferece suporte a aplicações em testes de medicamentos e engenharia de tecidos.
Resumo
As culturas de células tridimensionais (3D) fornecem uma representação mais precisa do microambiente in vivo do que as culturas bidimensionais (2D) convencionais, uma vez que promovem interações aprimoradas entre as células e a matriz extracelular. Este estudo teve como objetivo desenvolver uma metodologia eficiente, econômica e reprodutível para gerar estruturas celulares 3D (esferoides/organoides) usando um sistema inovador baseado em carimbos para criar micropoços em moldes de agarose. Um novo selo foi usado para produzir 663 micropoços por poço de uma placa de 6 poços, proporcionando um ambiente ideal para a agregação celular. Células primárias de ilhotas pancreáticas suínas foram semeadas nesses micropoços, onde se agregaram para formar esferóides / organoides. As culturas foram incubadas a 37 °C sob 5% de CO2, e o meio foi substituído a cada 3 dias. A formação de esferoides foi monitorada periodicamente e amostras foram coletadas para caracterização. O método gerou com sucesso esferoides uniformes e de alta qualidade, reduzindo a variabilidade experimental, minimizando a manipulação e aprimorando as interações celulares. O uso de moldes de micropadrão à base de agarose forneceu um ambiente simplificado e controlado para culturas 3D, oferecendo uma solução padronizada e econômica. Essa metodologia oferece suporte a aplicações para testes de medicamentos e engenharia de tecidos, oferecendo uma plataforma prática e escalável para modelos de cultura de células 3D que podem ser facilmente implementados em vários ambientes de laboratório.
Introdução
Nos últimos 50 anos, inúmeras investigações de biologia celular demonstraram que as culturas bidimensionais (2D) não conseguem replicar com precisão as condições in vivo observadas em modelos animais1. Estruturalmente, as culturas de células 2D não permitem que as células se organizem tridimensionalmente e repliquem a situação observada em sistemas in vivo . Além disso, as vias de sinalização celular são alteradas em culturas 2D em comparação com culturas tridimensionais (3D), o que provavelmente poderia explicar por que certos tipos de triagem de drogas usando culturas 2D são tão discrepantes2. Um avanço significativo nas técnicas de cultura de células surgiu com a introdução de sistemas de cultura 3D. Os sistemas 3D variam consideravelmente em complexidade, dependendo da composição celular e da citoarquitetura. Geralmente, dois tipos de estruturas são gerados, a saber: esferóides e organoides. Os esferoides são descritos como simples aglomerados de células obtidas de tecidos normais ou tumorais, corpos embrióides e linhagens celulares. A formação de estruturas 3D é influenciada por vários fatores, incluindo interações célula-célula e vias de sinalização mediadas por componentes da matriz extracelular (MEC), que fornecem suporte estrutural e pistas bioquímicas. Esses elementos regulam as interações que contribuem para a organização e função do tecido3. O sistema de cultura esferóide foi descrito pela primeira vez no início da década de 1970, usando linhagens celulares de pulmão de hamster chinês V79 como modelo de carcinomas nodulares, crescendo em condições não aderentes e formando esferas perfeitas4. Os organoides são descritos como aglomerados de tipos de células específicas de órgãos derivados de células-tronco ou progenitoras, que se auto-organizam por meio de processos, como classificação de células e especificação de linhagem, de maneira espacialmente confinada, espelhando o desenvolvimento in vivo 5.
Vários métodos e materiais disponíveis estão disponíveis para cultivar células em condições 3D. Os principais métodos atualmente empregados para gerar culturas 3D são: 1) gotas suspensas; 2) cultura de células rotativas e plásticos de baixa fixação; 3) placas piramidais contendo poços cônicos; 4) andaimes macroporosos; 5) grânulos magnéticos; e 6) hidrogéis livres de andaimes.
Pendurar gotas é o método usado para obter culturas 3D livres de andaimes. Este método apresenta certas limitações, incluindo a necessidade de manuseio extensivo, baixa eficiência de produção, geometria esférica e exposição a altas forças de cisalhamento. Além disso, procedimentos específicos, como substituição de meio ou adição de compostos, podem ser desafiadores e resultar em perda de material. Além disso, relatos da literatura indicam que algumas linhagens celulares não conseguem produzir esferoides compactados ao empregar essa abordagem6.
A cultura de células rotativas e os plásticos de baixa fixação são usados para evitar que as células se liguem ao substrato, fazendo com que se agreguem e formem esferoides. Este processo requer frascos específicos e/ou agitação/rotação. Embora esta seja uma das abordagens mais diretas para a produção de esferoides ou organoides em larga escala, ela não é isenta de desvantagens, como a necessidade de equipamentos específicos, baixa longevidade da cultura, variação de tamanho em esferoides, danos mecânicos às células e baixa eficiência6.
Placas piramidais contendo poços cônicos são placas disponíveis comercialmente impactando os custos, além do fato de que algumas manipulações podem dificultar a formação de esferoides/organoides7.
Andaimes macroporosos também são empregados para cultura 3D; no entanto, um grande obstáculo reside em alcançar uma semeadura celular eficaz e uma distribuição uniforme. Esse problema surge porque os tamanhos dos poros podem ser muito pequenos para a penetração celular ou muito grandes para reter as células com segurança. Para resolver essa questão, várias estratégias têm sido exploradas8, que impactam diretamente na complexidade e no custo dessa técnica.
A metodologia de esferas magnéticas gera um pequeno número de esferoides/organoides, tem um custo elevado e pode deixar resíduos de nanopartículas no interior das células9.
Entre os sistemas de cultivo de esferoides, estão disponíveis hidrogéis de agarose não adesivos, representando um hidrogel livre de andaimes. Essa abordagem oferece benefícios notáveis, como o controle preciso sobre o tamanho das estruturas 3D e a capacidade de gerar um número substancial dessas estruturas por placa. Nesse método, as células são introduzidas em um hidrogel com poços pré-formados, nos quais afundam e se automontam em esferoides 3D10.
Neste estudo, apresentamos um dispositivo e metodologia para geração de micropoços de agarose utilizando um molde de micropadrão de forma simples, eficiente, reprodutível e de baixo custo.
A utilização deste selo como molde para geração de micropoços em agarose, auxiliada pela gravidade, visa potencializar a interação celular dentro do micropoço e da organização celular, gerando estruturas 3D (esferoides/organoides) in vitro de forma simples, eficiente, reprodutível e de baixo custo, economizando tempo de pesquisa e recursos laboratoriais.
Protocolo
Este protocolo segue as diretrizes do Comitê de Ética em Pesquisa com Seres Humanos de nossa Instituição CEUA-FMUSP: 1699/2021, aprovado em 08 de setembro de 2021 - "Isolamento e Encapsulamento de Ilhotas Pancreáticas Suínas" e faz parte do Projeto Temático do nosso Grupo NUCEL de Terapia Celular e Molecular (www.usp.br/nucel), Processo FAPESP nº 2016/05311-2, intitulado: "Medicina Regenerativa visando a terapia de doenças crônico-degenerativas (câncer e diabetes)".
1. Fabricação do dispositivo de carimbo
NOTA: Este Selo é feito sob medida pelo grupo NUCEL (https://w3nucel.webhostusp.sti.usp.br/). O dispositivo de carimbo foi desenvolvido usando o software referenciado, amplamente reconhecido por sua precisão e recursos avançados de modelagem tridimensional.
- Certifique-se de que os protótipos projetados apresentem 663 micropinos dispostos para permitir a geração de um número equivalente de culturas tridimensionais, como esferoides ou organoides. Para garantir a estabilidade do carimbo nas superfícies da bandeja T6, posicione cinco pontos de apoio estrategicamente ao longo da circunferência do dispositivo.
- Certifique-se de que os micropinos tenham um design cônico com dimensões ajustáveis, variando de 1 a 3 mm de comprimento. O diâmetro da base do cone varia entre 0,7 e 1,5 mm, enquanto o ângulo de conicidade varia de 5° a 10°.
- Certifique-se de que a estrutura de "parada" do dispositivo, que define a profundidade dos micropinos, tenha um comprimento ajustável de 10 a 19 mm e um diâmetro de 20 a 40 mm, com micropinos uniformemente distribuídos em sua superfície.
- Além disso, projete o dispositivo para ter uma alça ergonômica, adequada para operação com uma mão, para aumentar a praticidade e a precisão durante o uso.
NOTA: Para facilitar a produção em larga escala do dispositivo, é fornecido o arquivo digital em formato .stl, sendo essencial para o processo de impressão 3D. - Basta cortá-lo usando o software apropriado e imprimi-lo com uma impressora 3D compatível. Use as seguintes dimensões de impressão: X - 68 mm; Y - 120 mm; Z - 150 mm, garantindo um equilíbrio ideal entre funcionalidade e qualidade estrutural.
- Para a fabricação do dispositivo, use uma impressora 3D fotocurável, que é compatível com a resina polimérica curável por UV que deve ter alta resolução e acabamento superficial uniforme, características essenciais para o desempenho ideal do dispositivo.
- Corte o modelo digital para impressão usando um software compatível com a impressora 3D selecionada.
2. Preparação de micropoços de agarose
- Prepare a solução de agarose.
- Pese o pó de agarose puro e dissolva-o em 1x solução salina tamponada com fosfato (PBS) para atingir uma concentração final de 1-2% (p / v).
- Aqueça a solução no micro-ondas ou em banho-maria até dissolver totalmente, garantindo que fique homogênea e transparente.
NOTA: Evite superaquecimento ou reaquecimento excessivo, pois isso pode degradar a agarose. Não prepare grandes volumes de solução-mãe. - Deixe a solução esfriar até ~ 40 ° C, a temperatura ideal para pipetagem.
- Prepare o carimbo feito sob medida.
- Lave o carimbo com uma esponja de cerdas macias e água destilada para remover os resíduos.
- Exponha o carimbo limpo à luz UV por 5 a 10 minutos para garantir a esterilidade.
- Forme os micropoços.
- Despeje/pipete ~3 mL da solução de agarose a 40 °C em cada poço de uma placa de 6 poços, garantindo uma profundidade uniforme de 2-3 mm.
- Posicione o selo feito sob medida no centro do poço enquanto a agarose ainda está quente.
NOTA: O carimbo possui apoios laterais que garantem alinhamento e estabilidade, eliminando a necessidade de suporte manual. Cada selo cria ~ 663 micropoços (~ 2 mm de altura) por poço. Certifique-se de que não haja bolhas nos micropinos; Se formarem bolhas, mova suavemente o carimbo para eliminá-las. - Deixe a agarose solidificar por 5-10 min em temperatura ambiente sem mover a placa.
NOTA: Não perturbe a agarose durante a solidificação para evitar variações na estrutura do micropoço. - Remova o carimbo com movimentos suaves para frente e para trás para liberar o vácuo sem danificar os micropoços.
NOTA: Este movimento facilita a entrada de ar, permitindo a remoção suave do carimbo sem deformar o gel. Os micropoços devem permanecer intactos. - Lave os micropoços 3x com solução PBS para remover resíduos.
- Exponha a placa à luz UV por 10 min para eliminar a contaminação microbiana.
- Adicionar 3 ml de meio de cultura e incubar a placa numa incubadora de CO2 a 37 °C durante a noite.
NOTA: Esta incubação verifica a ausência de contaminação antes da semeadura celular.
3. Semeadura celular em micropoços
- Prepare a suspensão celular.
- Colete as células por tripsinização ou outro método de dissociação para obter uma suspensão homogênea.
- Conte as células e ajuste a concentração de acordo com o número desejado por micropoço.
NOTA: Para semear 5.000 células por micropoço em 663 micropoços, prepare uma suspensão contendo pelo menos 3.315 × 106 células no total. Otimize a concentração celular para evitar necrose central e garantir a difusão adequada de nutrientes e oxigênio.
- Semeie as células.
- Pipete ~ 3 mL da suspensão de células preparadas sobre os micropoços, garantindo uma distribuição uniforme girando suavemente a placa.
- Deixe as células assentarem por gravidade (~ 10-15 min) ou execute centrifugação suave a 100 × g por 5 min.
NOTA: A centrifugação pode ser usada para garantir que as células se concentrem nos micropoços. - Transferir a placa para uma incubadora de CO2 a 37 °C com uma atmosfera humidificada.
4. Manutenção de culturas de células 3D
- Substitua o meio de cultura.
- Troque o meio a cada 2-3 dias, removendo 50% do meio antigo e adicionando meio novo.
NOTA: Certifique-se de que os micropoços permaneçam submersos durante todo o período de cultura para evitar a desidratação.
- Troque o meio a cada 2-3 dias, removendo 50% do meio antigo e adicionando meio novo.
- Monitore a formação de culturas 3D.
- Continue cultivando até que as estruturas 3D estejam totalmente formadas e compactas (por exemplo, 2-3 dias para culturas primárias de ilhotas pancreáticas).
NOTA: Para culturas que requerem um tempo de formação mais longo, realize trocas parciais do meio a cada 2-3 dias.
- Continue cultivando até que as estruturas 3D estejam totalmente formadas e compactas (por exemplo, 2-3 dias para culturas primárias de ilhotas pancreáticas).
5. Coleta e caracterização de estruturas 3D
- Colete os esferóides / organoides.
- Remova o meio antigo e colete as estruturas 3D por meio de pipetagem vigorosa usando uma ponta de pipeta de diâmetro largo ou cortada para evitar compressão ou desagregação.
NOTA: A pipetagem vigorosa deve ser controlada para desalojar os agregados sem deformá-los.
- Remova o meio antigo e colete as estruturas 3D por meio de pipetagem vigorosa usando uma ponta de pipeta de diâmetro largo ou cortada para evitar compressão ou desagregação.
- Prepare-se para a análise.
- Use os esferoides/organoides coletados imediatamente ou corrija-os para análise futura.
NOTA: A associação e estabilidade dos esferoides dependem do tipo de célula, tempo de formação e condições de cultura. Tome cuidado é essencial para evitar a dissociação.
- Use os esferoides/organoides coletados imediatamente ou corrija-os para análise futura.
Resultados
A cultura de células utilizada neste estudo foi derivada de ilhotas pancreáticas suínas. A preparação de ilhotas usada neste estudo tinha uma pureza de 80 ± 5% com base na coloração com ditizona e viabilidade de células de ilhotas de >80% com base na detecção de diacetato de fluoresceína em células vivas ou iodeto de propídio em células mortas (o método fluorescente vivo / morto). Certifique-se de que a preparação das ilhotas pancreáticas suínas seja pelo menos 80% pura (por exemplo, por coloração com ditizona) e >80% viável. Após o isolamento, manter culturas aderentes em meio CMRL 1066, suplementado com 1 mM de L-glutamina, ciprofloxacino a 0,2% e 10% de soro fetal de bezerro (FCS), a 37 °C e CO2 a 5%, conforme descrito anteriormente11,12.
No presente estudo, a eficácia de um sistema baseado em carimbos para geração de micropoços em moldes de agarose foi avaliada minuciosamente (Figura 1). O design do carimbo, mostrado na Figura 2, demonstra a precisão dos micropinos e sua colocação, facilitando o alinhamento e manuseio consistentes durante o processo de formação de micropoços. Isso garantiu padrões uniformes de micropoços em toda a placa, um recurso crítico para obter culturas de células 3D reprodutíveis.
O processo de formação de micropoços usando o selo é detalhado na Figura 3, na qual é visualizada a capacidade do selo de criar micropoços uniformes. Os resultados confirmam que vários carimbos podem ser usados simultaneamente, agilizando o processo de preparação. A análise microscópica dos moldes de agarose revela formas côncavas e padronizadas de micropoços, um fator crucial no controle da agregação de células em estruturas 3D. A uniformidade dos micropoços contribui significativamente para a confiabilidade e reprodutibilidade da formação da cultura 3D, conforme demonstrado pelos resultados consistentes obtidos em vários experimentos.
A Figura 4 ilustra o desenvolvimento dependente do tempo de estruturas 3D desde o momento da inoculação celular (0 h) ao longo de vários pontos de tempo (6 h, 24 h, 48 h e 72 h). A compactação celular em estruturas 3D agregadas/compactas ocorreu gradualmente, com agregação significativa observada na marca de 48 h. Essa linha do tempo pode variar dependendo do tipo de célula, como evidenciado pelo uso de ilhotas pancreáticas suínas primárias neste estudo, que formaram estruturas 3D compactas e funcionais em 48 h. Isso demonstra a eficácia do protocolo na geração de culturas 3D organizadas.
A Figura 5 destaca a estabilidade e viabilidade das estruturas 3D após serem removidas dos micropoços de agarose. As estruturas 3D mantiveram sua conformação após a remoção (Figura 5A), confirmando a robustez da metodologia. Além disso, o ensaio vivo/morto (Figura 5B,C) indicou que as células dentro das estruturas permaneceram viáveis, como mostrado pela coloração verde das células vivas. Essa descoberta confirma que o protocolo não apenas facilita a formação de estruturas 3D bem organizadas, mas também preserva a viabilidade celular, tornando-o uma abordagem confiável e eficiente para aplicações de cultura de células 3D.
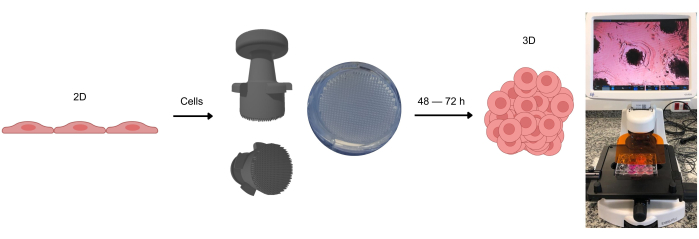
Figura 1: O processo de formação de culturas de células 3D. As células inicialmente cultivadas em 2D são destacadas da superfície aderente e colocadas em micropoços de agarose. Esses micropoços de agarose são criados usando um dispositivo de carimbo, que permite a formação desses micropoços após a solidificação do gel de agarose à temperatura ambiente. Quando observadas sob microscopia óptica, as células podem ser vistas distribuindo-se homogeneamente pelos micropoços. Após aproximadamente 2-3 dias (dependendo do tipo de célula), a formação de esferóides ou organoides pode ser observada. Clique aqui para ver uma versão maior desta figura.

Figura 2: Dispositivo de carimbo. Imagens representativas do dispositivo de carimbo de (A-C) de três perspectivas diferentes, ilustrando suas principais características, a saber: 663 micropinos, suportes de placa e suporte de manuseio manual. Clique aqui para ver uma versão maior desta figura.

Figura 3: Representação passo a passo do processo de produção de micropoços. (A) Dispositivo de carimbo; (B) posicionamento do dispositivo de carimbo no centro do poço contendo agarose líquida; (C) polimerização de agarose; (D) micropoços de agarose moldados pelo dispositivo de carimbo; (E) demonstração da produção usando três dispositivos de carimbo na mesma placa (P6); (F) imagens de microscopia óptica dos micropoços com aumento de 4x (barra de escala = 1.000 μm); (G) imagens de microscopia óptica dos micropoços com ampliação de 10x (barra de escala = 400 μm). Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagens de microscopia óptica da cultura suína primária de ilhotas pancreáticas. Imagens com ampliação de 2x (barra de escala = 2.000 μm), 4x (barra de escala = 1.000 μm) e 10x (barra de escala = 400 μm), nos seguintes pontos de tempo: 0 h, 6 h, 24 h, 48 h, 72 h. Clique aqui para ver uma versão maior desta figura.

Figura 5: Ensaio vivo/morto. Imagens representativas mostrando a viabilidade de esferoides de culturas primárias de células de ilhotas pancreáticas suínas que foram geradas em micropoços de agarose e coletadas após 72 h (3 dias) de cultivo 3D usando o dispositivo de carimbo aprimorado. Imagens de microscopia óptica de fluorescência foram obtidas. A coloração verde representa células viáveis marcadas com diacetato de fluoresceína, enquanto a coloração vermelha indica células não viáveis marcadas com iodeto de propídio. As imagens confirmam que a estrutura esferoidal da cultura 3D é mantida e permanece viável após a remoção dos micropoços. Barra de escala = 400 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Embora existam vários protocolos de cultura 3D na literatura, um estudo conduzido por Wassmer et al.13 testou várias metodologias para gerar estruturas 3D usando ilhotas pancreáticas. Os autores observaram que ilhotas nativas e esferoides auto-agregados exibiam considerável heterogeneidade em relação ao tamanho e forma e eram maiores do que aqueles obtidos usando outros métodos. Com base em suas descobertas, eles concluíram que os esferóides podem ser gerados usando diferentes técnicas, cada uma com suas próprias vantagens e desvantagens. Para a agregação de células de ilhotas, os métodos recomendados são a técnica de gota suspensa, placas de micropoços de agarose ou a placa esférica 5D.
Existem dispositivos para geração de micropoços de agarose que têm sido empregados com sucesso na literatura. Por exemplo, Stuart et al.14 mostraram resultados promissores usando um dispositivo, mas apresentaram certas desvantagens que precisam ser abordadas. Isso inclui o número limitado de micropoços que pode produzir, um volume de trabalho reduzido devido à pequena área do molde e seu design como um molde negativo, o que complica o manuseio e aumenta o risco de quebra e distorção dos micropoços.
Um dispositivo semelhante a um selo para gerar esferoides foi desenvolvido por Charelli e colegas15 usando tecnologia de impressão 3D. Capaz de produzir até 4.716 esferoides por placa de 6 poços, o dispositivo foi criado por meio de estereolitografia com resina fotocurável. O dispositivo resultante apresentava micropinos cilíndricos, cada um com 1,3 mm de altura e 650 μm de largura. Este método permitiu a rápida formação de esferóides uniformes, incluindo esferóides co-cultivados, com forma e tamanho consistentes. Apesar de suas vantagens, vários desafios devem ser enfrentados para melhorar sua usabilidade e desempenho. Um problema significativo é a falta de suporte manual, o que torna o dispositivo difícil de manusear e propenso a instabilidade durante o processo de formação do mofo. Essa instabilidade geralmente leva à quebra ou rachadura do gel de agarose, comprometendo sua integridade estrutural. Além disso, o dispositivo sofre com a falta de suporte de placa, o que significa que não pode ser ancorado com segurança à placa do poço. Como resultado, o carimbo deve ser suspenso manualmente até que a agarose se solidifique, introduzindo variabilidade e afetando a uniformidade da formação de micropoços. Essas limitações reduzem a reprodutibilidade e a qualidade geral dos esferoides resultantes.
Nosso carimbo/protocolo aprimorado permite um método eficiente e de baixo custo, gerando esferoides e organoides 3D em micropoços de agarose, destacando-se por sua simplicidade e reprodutibilidade. Inspirado no trabalho de Decarli e colegas16, nosso grupo utilizou a metodologia de hidrogel de agarose não adesiva para desenvolver um novo dispositivo de carimbo. Como resultado, abordamos questões como dificuldades de manuseio e inconsistências na formação de micropoços. O selo desenvolvido por meio de nossa metodologia incorpora essas melhorias, tornando-o mais fácil de usar, eficiente e altamente reprodutível.
Em relação às modificações, a densidade celular pode ser ajustada para diferentes tipos de células e fins experimentais. Uma densidade de semeadura celular mais alta pode ser necessária para células com baixas taxas de proliferação ou interação celular limitada, enquanto uma densidade mais baixa pode favorecer uma melhor organização estrutural para certos tipos de células. Se surgirem problemas com a formação de esferoides, pequenas modificações, como a centrifugação rápida das placas, podem ajudar as células a se estabelecerem adequadamente no fundo dos micropoços.
Uma das etapas críticas do protocolo é a semeadura precisa e uniforme das células nos micropoços. A distribuição celular homogênea é essencial para garantir que as estruturas formadas tenham tamanhos consistentes e propriedades uniformes, impactando diretamente na qualidade dos resultados. A coleção de culturas 3D é outro ponto crucial. Esta etapa requer extremo cuidado para evitar a destruição das estruturas durante a recuperação, exigindo técnicas de pipetagem apropriadas para preservar a integridade dos esferóides e organoides.
O tamanho do esferóide varia de acordo com o tipo de célula usada. Além disso, o número de células por esferóide também varia e deve ser otimizado com base na linha celular específica ou nas células primárias usadas. É importante notar que a densidade celular excessivamente alta dentro de um esferóide demonstrou causar o desenvolvimento de um núcleo necrótico, conforme relatado na literatura. Esse núcleo necrótico resulta da difusão inadequada de oxigênio e nutrientes para as células mais internas, o que pode comprometer a viabilidade e a função geral do esferóide17.
Apesar das vantagens da simplicidade e do baixo custo, uma limitação significativa do método é a potencial variabilidade na coleta de esferoides, especialmente em experimentos que requerem estruturas maiores e mais complexas. Nesses casos, o uso de ferramentas de coleta mais especializadas ou mesmo adaptações metodológicas podem ser necessárias para otimizar o processo e reduzir a perda de material. A obtenção de esferoides muito pequenos também pode complicar a manipulação e a coleta, exigindo um controle rigoroso do protocolo.
A associação e dissociação de esferoides/organoides variam significativamente dependendo do tipo de célula utilizada, bem como do número de dias necessários para a formação da estrutura, do meio de cultura empregado e da necessidade de possível agitação. Esses fatores são intrínsecos às características específicas de cada tipo de célula. No entanto, para minimizar a dissociação celular, é essencial seguir rigorosamente os cuidados descritos na metodologia, como manuseio cuidadoso durante as trocas de meio e manutenção adequada das condições de cultivo.
Comparado a outros métodos, como culturas rotativas ou esferas magnéticas, este protocolo se destaca por sua maior simplicidade, eliminando a necessidade de equipamentos especializados e garantindo uma produção mais reprodutível de esferoides e organoides 3D, tornando-o uma alternativa prática para uma ampla gama de fins de pesquisa. De acordo com os resultados descritos anteriormente na literatura13, os micropoços de agarose facilitam a geração de estruturas esferoides 3D de células produtoras de insulina com maior viabilidade e taxas de secreção de insulina em comparação com outros modelos comerciais, como a placa esférica 5D.
A versatilidade desse método, aliada ao seu baixo custo, o torna ideal para diversas áreas de pesquisa, como biologia celular, oncologia, estudos de desenvolvimento de medicamentos e toxicologia. Ele oferece uma solução eficaz para modelagem 3D in vitro , facilitando estudos mais precisos sobre comportamento celular, interação celular, resposta a medicamentos e desenvolvimento de terapia.
Divulgações
Os autores declaram não ter conflitos de interesse.
Agradecimentos
Somos especialmente gratos à excelente assistência técnica prestada por Zizi de Mendonça (Faculdade de Medicina, Universidade de São Paulo, Brasil). Este trabalho foi apoiado por bolsas das seguintes agências de pesquisa brasileiras: BNDES 09.2.1066.1, CAPES (processo PVE nº 88881.068070/2014-01), CNPq (processo nº 457601/2013-2, 401430/2013-8 e INCT-Regenera nº 465656/2014-5), FAPESP (Projeto temático nº 2016/05311-2), FINEP 01.08.06.05 e dos Ministérios da Ciência e Tecnologia (MCTI) e da Saúde (MS-DECIT).
Materiais
| Name | Company | Catalog Number | Comments |
| 31L Microwave | Electrolux | 78965840 6699 9 | Equipment used to heat the agarose solution, facilitating its dissolution and ensuring greater homogeneity. It allows the solution to reach the ideal liquid state for the formation of the wells. |
| 3DFila Gray Opaque Photosensitive 3D Resin | UV-curable polymer resin | ||
| 3D Printer - Creality Halot One | Creality | N/A | 3D printer used for printing the stamp device |
| Agarose | UNISCIENCE | UNI-R10111 | To form the gel, dissolve 1 to 2% in Saline Phosphate Buffer (PBS) or appropriate medium. |
| Autodesk Fusion 360 | 3D modeling | ||
| BB15 CO2 Incubator | Thermo Fisher | 51023121 | Equipment used to incubate cultured cells in a suitable and controlled environment. |
| Chitubox | Chitubox | N/A | Software used for slicing the part for printing |
| Class II Biological Safety Cabinet | Grupo VECO | N/A | Ensures a sterile environment for performing cell culture within established parameters and protocols. |
| Culture medium | USBiological/Life Sciences | C5900-03A | Contains additives for proper cell cultivation. |
| Culture plates (P6) | SARSTEDT | 1023221 | Used to shape the agarose and culture the cells. |
| Erlenmeyer Flask (25 mL) | Laborglas | 91 216 14 | A container used for dissolving 1–2% agarose in Phosphate Buffered Saline (PBS) or another suitable medium, typically heated in a microwave. |
| Falcon 15 mL Polystyrene Centrifuge Tube | Corning | 352099 | Used to keep cells in suspension and perform possible dilutions. |
| Fetal bovine serum (FBS) | Vitrocell Embriolife | 005/19 | Additive for culture medium. |
| PBS solution (Saline Phosphate Buffer) | Lab made | N/A | Diluted 1x with MiliQ ultrapure water. Used to dissolve agarose 1 to 2% and to wash wells already produced. |
| Reagent bottle with blue cap - Schott | Laborglas | 21801545 | Used for preparing and storing culture medium. |
| Stamp device | NUCEL Group | N/A | Link- This link provides access to the .stl file of the stamp device. Simply slice it using appropriate software and print it with a compatible 3D printer. https://drive.google.com/drive/folders/1gTYComnJWzHpN6ZKOyK EChKS3Qns0rOA?usp=sharing |
| Treated culture flask with filter 25 cm² | Corning | 430639 | Used for the cultivation and maintenance of adherent cells. |
| Trypsin | Merck | 07-07-9002 | For dissociation of cells before seeding. |
| Ultra violet light (UV) | N/A | N/A | Used to sterilize the stamp and plates. |
Referências
- Lian, J., Yue, Y., Yu, W., Zhang, Y. Immunosenescence: a key player in cancer development. J Hematol Oncol. 13 (1), 151 (2020).
- Wang, F., et al. Reciprocal interactions between beta1-integrin and epidermal growth factor receptor in three-dimensional basement membrane breast cultures: a different perspective in epithelial biology. Proc Natl Acad Sci USA. 95 (25), 14821-14826 (1998).
- Dzobo, K., Dandara, C. The extracellular matrix: its composition, function, remodeling, and role in tumorigenesis. Biomimetics. 8 (2), 146 (2023).
- Sutherland, R. M., McCredie, J. A., Inch, W. R. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. J Natl Cancer Inst. 46 (1), 113-120 (1971).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Bialkowska, K., Komorowski, P., Bryszewska, M., Milowska, K. Spheroids as a type of three-dimensional cell cultures-examples of methods of preparation and the most important application. Int J Mol Sci. 21 (17), 6225 (2020).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. J Vis Exp. (81), e50665 (2013).
- Andersen, T., Auk-Emblem, P., Dornish, M. 3D Cell culture in alginate hydrogels. Microarrays (Basel). 4 (2), 133-161 (2015).
- Hou, S., et al. Advanced development of primary pancreatic organoid tumor models for high-throughput phenotypic drug screening. SLAS Discov. 23 (6), 574-584 (2018).
- Napolitano, A. P., et al. Scaffold-free three-dimensional cell culture utilizing micromolded nonadhesive hydrogels. Biotechniques. 43 (4), 494-500 (2007).
- Maria-Engler, S. S., et al. Co-localization of nestin and insulin and expression of islet cell markers in long-term human pancreatic nestin-positive cell cultures. J Endocrinol. 183 (3), 455-467 (2004).
- Mantovani, M. C., et al. Immobilization of primary cultures of insulin-releasing human pancreatic cells. Islets. 1 (3), 224-231 (2009).
- Wassmer, C. H., et al. Engineering of primary pancreatic islet cell spheroids for three-dimensional culture or transplantation: a methodological comparative study. Cell Transplant. 29, 963689720937292 (2020).
- Stuart, M. P., et al. Successful low-cost scaffold-free cartilage tissue engineering using human cartilage progenitor cell spheroids formed by micromolded nonadhesive hydrogel. Stem Cells Int. 2017, 7053465 (2017).
- Charelli, L. E., Dernowsek, J. A., Balbino, T. A. Generation of tissue spheroids via a 3D printed stamp-like device. J Vis Exp. (188), e63814 (2022).
- Decarli, M. C. Micromold for the production of cellular spheroids and use. , (2019).
- Riffle, S., Pandey, R. N., Albert, M., Hegde, R. S. Linking hypoxia, DNA damage and proliferation in multicellular tumor spheroids. BMC Cancer. 17, 338 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados