Method Article
Получение посевного материала арбускулярного микоризного (АМ) грибного инокулюма и фенотипическая оценка симбиоза риса и АМ в условиях засоления
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье описывается протокол получения инокулята арбускулярных микоризных грибов (АМ) для исследования устойчивости риса к солевому стрессу, усиленной АМ.
Аннотация
Рис (Oryza sativa L.) является жизненно важной продовольственной культурой для более чем половины населения мира. Тем не менее, на его рост серьезно влияют засоленные почвы, которые представляют собой серьезную проблему для производства сельскохозяйственных культур во всем мире. Было показано, что арбускулярные микоризные (АМ) грибы, которые образуют мутуалистические симбиотические отношения с более чем 90% сельскохозяйственных растений и 80% наземных видов растений, повышают солеустойчивость растений риса. Грибы AM являются облигатными симбионтами, которые не могут завершить свой жизненный цикл без корня-хозяина. Таким образом, эффективное использование растений для производства грибкового инокулята AM имеет решающее значение для продвижения исследований в этой области. В этом исследовании мы представляем ряд надежных методов, которые начинаются с получения песчаного инокулюма, содержащего споры Rhizophagus irregularis, с использованием Allium tuberosum L. Эти методы включают в себя инокуляцию проростков риса с помощью песчаного инокулюта, анализ фенотипа роста микоризного риса и количественную оценку уровней колонизации грибков с помощью окрашивания трипановым синим в условиях солевого стресса. Эти подходы могут эффективно генерировать грибковый инокулюм AM для дальнейшего исследования того, как симбиоз AM повышает устойчивость риса к солености.
Введение
Засоленные почвы являются значительным препятствием для производства сельскохозяйственных культур во всем мире 1,2,3. Последние исследования показывают, что к 2050 году до 50% обрабатываемых земель будут деградированы из-за засоления4. Засоленные почвы в первую очередь вызывают токсичность для растений из-за накопления ионов натрия (Na+) и хлорида (Cl−) в тканях растений. Эти ионы, которые доминируют в засоленных почвах, также наиболее вредны для растений 5,6,7. Например, натрий подавляет активность многих цитозольных ферментов8. Солевой стресс также влияет на эффективность фотосинтеза и вызывает изменения ионной токсичности, осмотического давления и структуры клеточной стенки, что в совокупности приводит к накоплению активных форм кислорода (АФК)9,10,11,12,13.
Арбускулярный микоризный симбиоз (АМ) представляет собой эндосимбиотическую ассоциацию между грибами типа Glomeromycota и корнями растений, которая развилась примерно 400-450 миллионов лет назад с появлением ранних наземных растений14,15. Более 80% сосудистых растений могут быть колонизированы грибами AM16. Эта мутуалистическая взаимосвязь улучшает поглощение питательных веществ растениями из почвы, тем самым улучшая рост и стрессоустойчивость 17,18,19,20. Например, во время солевого стресса грибы AM могут поддерживать ионный баланс и способствовать повышению доступности воды и питательных веществ, антиоксидантной активности, эффективности фотосинтеза и производства вторичных метаболитов для растений 2,21,22,23. Кроме того, симбиоз AM предотвращает чрезмерное поглощение Na+ и его транспортировку от корней к побегам, способствуя поглощению незаменимых катионов, таких как K+, Mg2+ и Ca2+. Этот процесс увеличивает соотношение Mg2+/Na+ или K+/Na+ у растений в соленых условиях 23,24,25,26,27,28,29.
Рис (Oryza sativa L.), важнейшая продовольственная культура для более чем половины населения мира, принадлежит к семейству злаковых (Poaceae) и очень восприимчив к солевомустрессу. Исследования также подчеркнули роль грибов AM в повышении устойчивости к солевому стрессу у риса 31,32,33. Например, гриб AM Claroideoglomus etunicatum улучшает эффективность фиксации CO2 риса (Oryza sativa L. cv. Puntal) в условиях солевого стресса31. Кроме того, экспрессия ключевых генов транспортера риса, связанных с вакуолярной секвестрацией натрия и рециркуляцией Na+ от побегов к корням, усиливается у растений, колонизированных AM, в условиях солевого стресса32. Кроме того, растения горного риса, инокулированные Glomus etunicatum, демонстрируют повышенную фотосинтетическую способность, повышенную выработку осмолита, улучшенный осмотический потенциал и более высокую урожайность зерна в условиях засоления33. Наше предыдущее исследование также показало, что микоризный рис (Oryza sativaL. cv. Nipponbare) продемонстрировал лучший рост побегов и репродуктивный рост, заметно более высокое соотношение K+/Na+ в побеге и улучшенную способность поглощать активные формы кислорода (АФК) из-за симбиоза AM34. Все эти результаты демонстрируют положительное влияние симбиоза аддитивного производства на устойчивость риса к солевому стрессу с помощью феноменальных подходов. Однако экспериментальные методы не были опубликованы в видеоформате.
Грибы AM являются облигатными симбионтами, которым для завершения жизненного цикла требуется корень-хозяин, что делает использование растений для производства грибкового инокулята AM критически важнымдля прогресса в исследованиях. Производственная система на основе субстрата, в которой грибы аддитивного производства выращиваются в субстратах, таких как вермикулит или песок, а споры собираются для инокулята36, предлагает экономически эффективное решение для крупномасштабного производства грибного инокулята аддитивного производства. Эффективность производства спор зависит от совместимости и роста растений, которые влияют на колонизацию и размножение грибов37,38. Тем не менее, этот метод часто занимает много времени, при этом традиционные подходы занимают до 120 дней и дают низкое образование спор. Недавние усовершенствования позволили сократить период производства до 90 дней при использовании кукурузы в качестве основного растения в условиях светодиодного освещения39. Тем не менее, представлен надежный метод получения песчаного инокулята, содержащего споры Rhizophagus irregularis, с использованием Allium tuberosum L. в течение 10 недель. Этот песчаный инокулюм может быть использован для анализа фенотипа роста микоризного риса и количественной оценки уровней колонизации грибками с помощью окрашивания трипановым синим в условиях солевого стресса. Эти подходы эффективно генерируют грибковый инокулюм AM для дальнейшего исследования того, как симбиоз AM повышает устойчивость риса к солености.
протокол
Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Получение песчаного инокулюма, содержащего споры Rhizophagus irregularis , с использованием Allium tuberosum L.
- Промойте песок водопроводной водой и отавтоклавируйте его.
- Добавьте в горшок 2/3 песка (диаметр верха 14,7 см, диаметр дна 11,5 см, высота 13 см). Добавьте 1000 спор AM-грибов Rhizophagus irregularis. Засыпьте тонким слоем песка. Добавьте 30 семян чеснока (Allium tuberosum L.) и засыпьте семена песком.
- Выращивайте чесночный лук в камере с 16-часовым/8-часовым циклом день/ночь при температуре 23,5 °C (относительная влажность 55%). В течение первой недели (через 1 неделю после прививки) накройте чеснок бумагой из оксида алюминия, чтобы блокировать свет, и поливайте его три раза в неделю.
- Начиная с 2 wpi, удобряйте чеснок два раза в неделю 80 мл раствором Хогланда половинной концентрации, содержащим 25 мкМ KH2PO4. Удобряйте раз в неделю 80 мл воды.
- Через 10 недель заготавливайте корни чеснока для окрашивания трипановым синим, чтобы оценить уровень колонизации грибком. Если уровень заселения превышает 70%, прекратите полив чеснока до тех пор, пока песок не высохнет (около 5 недель). Поместите весь песок в полиэтиленовый пакет и храните его в холодильнике при температуре 4 °C.
2. Окрашивание трипановым синим цветом для проверки уровня колонизации грибком
- Инкубируйте кусочки корня в течение 30 минут при температуре >90 °C в 10% KOH. Снимите KOH.
- Промойте корневые кусочки двойной дистиллированной водой (ddH2O) три раза.
- Инкубируйте кусочки корня с 0,3 М HCl в течение от 15 минут до 2 часов. Удалите HCl.
- Добавьте 1 мл 0,1% трипанового синего и инкубируйте образцы в течение 8 минут при температуре >90 °C.
- Кусочки корня промыть 50% кислым глицерином. Переложите 10 кусочков корня на предметные стекла и добавьте каплю 50% кислого глицерина.
- Запечатайте покровные стекла и нанесите лак для ногтей.
- Изучите 10 полей зрения каждого корня под микроскопом, чтобы зафиксировать наличие грибковых структур. Рассчитайте уровень колонизации грибами в процентах.
ПРИМЕЧАНИЕ: 50% кислый глицерин: Приготовьте, смешав глицерин и 0,3 М HCl в соотношении 1:1. 0,1% трипанового синего: Растворите 100 мг трипанового синего в смеси молочной кислоты 2:1:1, глицерина и ddH2O.
3. Инокуляция рассады риса песчаным посевом и лечение солевого стресса
- Снимите шелуху (шелуху) с рисовых зерен.
- Стерилизуйте семена 70% этанолом (EtOH) в течение 4 минут и 30 секунд.
- Поместите семена риса в центрифужную пробирку. Добавьте 3% отбеливатель (приготовленный из стерильного dH2O) и встряхивайте в течение 30 минут.
- Удалите хлорную известь и промойте семена стерильным dH2O 3-4 раза внутри ламинарного вытяжного колпака.
- Семена выращивают в среде Мурасиге-Скуг (1/2 MS) половинной концентрации, содержащей 0,8% агар при температуре 30 °С, в темноте в течение 5 дней.
- Выращивайте рассаду риса с 12-часовым циклом день/ночь при 30/28 °C и влажности воздуха 70% в течение 2 дней.
- Переложите рассаду риса в пластиковые трубки со стерилизованным песком. Добавьте либо без инокулюма (mock), либо 5 мл песчаного инокулюма, содержащего споры Rhizophagus irregularis (Ri).
- Поливайте растения риса dH2O 7 дней в неделю в течение первой недели после прививки. Удобряйте растения каждый второй день раствором Хогланда половинной концентрации, содержащим 25 мкМ KH2PO4.
- Через 5 недель после инокуляции (wpi) обработайте одну партию 150 мМ NaCl (физиологическое состояние) и оставьте другую партию без NaCl (безфизиологическое состояние).
- Для несолевого состояния поливайте растения раствором Хогланда половинной концентрации, содержащим 25 мкМ KH2PO4, во вторник и водой до конца недели.
- Для солевого состояния поливайте растения раствором Хогланда половинной концентрации, содержащим 25 мкМ KH2PO4, во вторник — 150 мМ NaCl, а до конца недели — водой.
- При 8 wpi соберите урожай, чтобы измерить их свежий вес. Поместите растения в духовку при температуре 70 °C на 2 дня, чтобы измерить сухой вес. Проанализируйте уровень колонизации грибка с помощью окрашивания трипановым синим.
Результаты
Пошаговый рабочий процесс показан на рисунке 1. Через 10 недель после инокуляции (wpi) внутри корней чеснока были отчетливо замечены грибковые структуры, такие как везикулы и споры, характерные для поздней стадии и симбиоза AM (рис. 2A). Уровни внутрирадикальных гиф, арбускула, везикулы, экстрарадикальных гиф и спор составили 80%, 47%, 63%, 4% и 1% соответственно, что указывает на прогрессирование развития грибов внутри корней чеснока. Таким образом, общий уровень колонизации достиг 80% (рисунок 2В). Эти результаты показали, что симбиотические отношения между чесночным луком и грибами AM были успешно установлены, и что грибы AM смогли завершить свой жизненный цикл и произвести больше спор. Используя песчаный инокулюм, полученный в результате симбиоза между чесночным луком и грибами AM, растения риса были успешно колонизированы грибами AM. При 8 wpi везикулы и споры наблюдались внутри корней риса (рисунок 2D), а уровни внутрирадикальных гиф, арбускула, везикул, экстрарадикальных гиф, спор и общих грибковых структур составили 91%, 82%, 95%, 46%, 2% и 93% соответственно (рисунок 2E). Затем растения риса выращивали без (макет) или с этим песчаным инокулятом в течение 5 недель, а затем обрабатывали без или с раствором соли (150 мМ NaCl) в течение 3 недель. У микоризных растений было меньше увядших кончиков лезвий, чем у ложных растений в солевом стрессе (рис. 2F). В незасоленных условиях растения микоризного риса показали более высокую биомассу побегов, чем фиктивные (рис. 2G). В условиях солевого стресса биомасса побегов фиктивных растений сильно снижалась, в то время как микоризные растения сохраняли биомассу побегов, которая была в 1,4 раза выше, чем у фиктивных растений (рис. 2G). Симбиоз АМ не оказывал существенного влияния на биомассу корней ни при одном из этих условий (рисунок 2G). Эти результаты свидетельствуют о том, что симбиоз аддитивного производства помогает растениям риса поддерживать лучший рост побегов в условиях солевого стресса. Уровни колонизации грибами достигали 84% и 83% в несоленых и солевых условиях соответственно, что указывает на успешную колонизацию корней риса грибами AM. Кроме того, уровни экстрарадикальных гиф были выше при солевом стрессе. Не наблюдалось существенных различий в других структурах грибов между несолевыми и солевыми условиями, что позволяет предположить, что солевой стресс оказывает умеренное влияние на симбиоз АМ (Рисунок 2H).
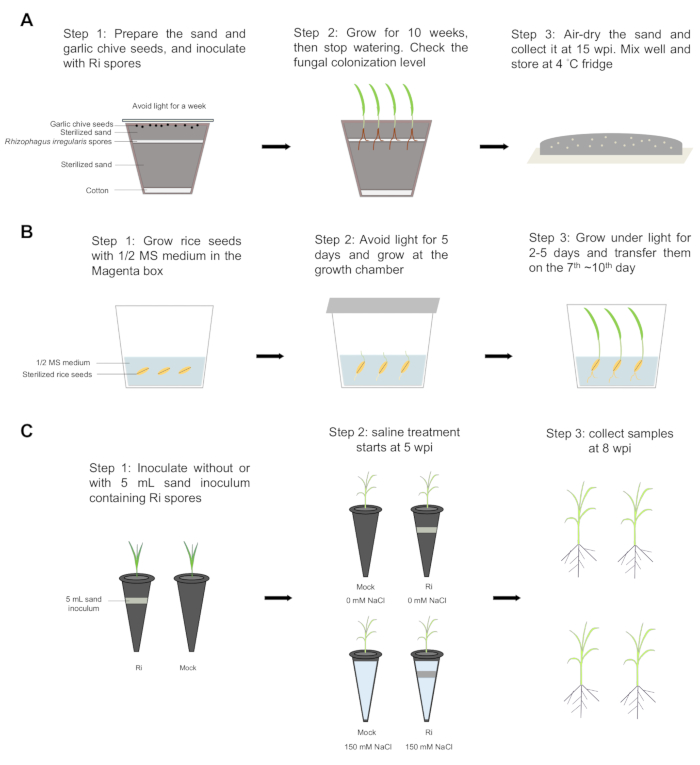
Рисунок 1: Пошаговый рабочий процесс. (А) Песчаный инокулюм был приготовлен с использованием следующих этапов: Шаг 1: На дно горшка был положен слой ваты, и в горшок была добавлена 2/3 стерилизованного песка. Около 1000-2000 спор Rhizophagus irregularis равномерно распределили с помощью срезанных кончиков, затем засыпали оставшейся 1/3 стерилизованным песком. Тридцать семян Allium tuberosum L. были равномерно распределены по поверхности песка и накрыты глиноземной бумагой, чтобы блокировать свет. Растения инкубировали при температуре 23 °C в течение недели. Шаг 2: Семена выращивали в течение 10 недель при температуре 23 °C с циклом 16/8 свет/темнота, затем прекратили полив. Проверялся уровень колонизации корней. Шаг 3: Песок был высушен на воздухе, собран через 15 недель после инокуляции (wpi), хорошо перемешан и хранился при температуре 4 °C в холодильнике. (Б) Семена риса проращивали в пурпурной коробке. Шаги 1 и 2: Семена риса стерилизовали 70% этанолом в течение 4 мин 30 с, а этанол заменили 3% перхлората натрия. Семена встряхивали в течение 30 минут, а затем пять раз промывали стерилизованной водой. Семена проращивали на среде 1/2 Мурашиге и Скуга (MS) с 0,8% агаром в течение 5 дней в темноте при 30 °C и 2 суток при освещении (12/12 ч дневного и ночного цикла при 30/28 °C). Шаг 3: Рассада риса была перенесена на7-й ~10-й день. (В) Инокуляция и лечение солевым раствором. Шаг 1: Рассада риса была пересажена в пластиковые пробирки, содержащие стерилизованный песок без (макет) или с 5 мл песчаного инокулюма, содержащего споры Rhizophagus irregularis (Ri). Растения выращивали в ростовой камере с 12-часовым циклом день/ночь при 30/28°С, причем растения выращивали два раза в неделю половинчатым раствором Хогланда, содержащим 25 мкМ фосфата (Pi). Шаг 2: При 5 wpi микоризные и ложные растения были разделены на две группы. Одну группу обрабатывали 150 мМ хлорида натрия (NaCl) (в солевом растворе), а другую группу выращивали в несолевых условиях. Шаг 3: При 8 wpi были собраны все растения, а затем отделены побеги и корни, чтобы оценить свежий вес и сухой вес. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Фенотип Allium tuberosum L. (чесночный лук), O. sativa L. japonica cv. Nipponbare (рис) и Rhizophagus irregularis (грибы AM). (А) Фотография корней микоризного чеснока при 10 wpi. (Б) Фотография микоризных растений чеснока при температуре 10 wpi. (В) Уровень колонизации грибами корней чеснока. (D) Фотография корней микоризного риса при 8 wpi. (E) Уровень колонизации грибами корней риса. (F) Фенотип фиктивных и микоризных растений риса в условиях солевого стресса. (G) Сухая масса растений фиктивного и микоризного риса при несолевом и солевом стрессе, и (H) Уровень колонизации грибами корней микоризного риса при солевом стрессе при 8 wpi. В (A-C) чесночный лук инокулировали 200 спорами грибов AM (R. irregularis, Ri), выращенных в условиях 25 мкМ фосфатов, и собирали через 10 недель после инокуляции (wpi). На панелях (D) и (E) растения риса инокулировали 5 мл песчаного инокулюма, полученного в результате симбиоза между чесночным луком и грибами AM (Rhizophagus irregularis, Ri), выращенными в условиях 25 мкМ фосфатов, и собирали урожай через 8 недель после инокуляции (wpi). На панели (F) растения риса выращивали либо без (имитация), либо с песчаным инокулюмом, содержащим грибы AM (R. irregularis, Ri) в течение 5 недель, с последующей обработкой раствором соли (150 мМ NaCl) в течение 3 недель. Корни были окрашены трипановым синим цветом на панелях (А) и (D). На этих панелях споры обозначены белыми стрелками, везикулы — белыми стрелками, а экстрарадикальные гифы — черными стрелками. Масштабные линейки: 100 мкм в панелях (A) и (D); 1 см в панели (В); и 10 см в панели (F). Сокращения: int hyphae, intraradical hyphae; наружные гифы, экстрарадикальные гифы. Стандартная ошибка была рассчитана по 3-4 биологическим репликациям. Разные буквы указывают на значимые различия между методами лечения (p < 0,05, двусторонний ANOVA с последующим апостериорным тестом с наименьшими значимыми различиями). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Есть несколько советов относительно приготовления и использования песчаного посева. Во-первых, по нашему опыту, уровень колонизации чеснока должен быть выше 70% (рисунок 2C). В противном случае, последующая инокуляция на других растениях, таких как томат и рис, не достигнет более 50% через 7 недель после инокуляции (wpi) (Рисунок 2E). Во-вторых, песок следует тщательно высушить на воздухе перед хранением и хранить в чистом полиэтиленовом пакете в холодильнике, чтобы предотвратить его повторное намокание (шаг 1.5). В противном случае качество посевного материала песка ухудшится. В-третьих, песчаный инокулюм можно без проблем хранить в холодильнике около 10 месяцев. В-четвертых, песок необходимо тщательно перемешать, встряхнув мешок для хранения, прежде чем добавить его в горшок для инокуляции других растений (шаг 3.7).
Что касается окрашивания трипановым синим, то для окрашивания корни следует разрезать на кусочки длиной около 1-1,5 см, чтобы грибковая структура могла быть равномерно окрашена трипановым синим (шаг 2.1). Чтобы точно представить уровень микоризной колонизации корня, необходимо наблюдать десять полей зрения с почти равными интервалами от одного конца корня до другого (шаг 2.7).
Что касается лечения солевого стресса на фиктивном и микоризном рисе, то время стерилизации семян риса спиртом должно быть точным; В противном случае это скажется на всхожести риса (шаг 3.2). Поскольку в качестве питательной среды используется песок, важно следить за тем, чтобы рис получал достаточное количество воды на протяжении всего процесса выращивания. В противном случае рис может столкнуться с засухой и высоким уровнем солевого стресса одновременно, что затруднит точную оценку результатов роста (шаги 3.8-3.9).
Следуя этому протоколу, можно наблюдать повышенную устойчивость к солевому стрессу у сорта риса Nipponbare. Тем не менее, неизвестно, можно ли использовать это лечение солевого стресса для наблюдения за устойчивостью к солевому стрессу, усиленной AM-увеличением у других сортов риса. Если нет, некоторые шаги можно изменить, например, использовать больше песчаного инокулюма, начать обработку солевого стресса после 5 wpi, увеличить период времени для солевого стресса или повторно поливать растения после солевого стресса.
Грибы AM являются облигатными симбионтами, которым корни хозяина необходимы для завершения их жизненного цикла, что делает производство инокулюма на растительной основе необходимымдля исследований. Системы на основе субстрата, в которых грибы растут в таких материалах, как вермикулит или песок, предлагают экономически эффективный способ производства крупномасштабного инокулюма. Тем не менее, традиционные методы могут занять до 120 дней и дать низкое количество спор 36,37,38. Благодаря недавним усовершенствованиям этот показатель был сокращен до 90 дней при использовании кукурузы под светодиодным светом39. Здесь представлен метод получения спор Rhizophagus irregularis в песке с использованием Allium tuberosum L. всего за 10 недель. Этот инокулят может быть использован для изучения роста риса, колонизации грибов и устойчивости к солености, что является эффективным инструментом для исследования симбиоза аддитивного производства.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Мы выражаем признательность Юн-Синь Чену за создание системы для исследования устойчивости риса к солевому стрессу, усиленному аддитивным производством, и Кай-Чи Чангу за создание системы для получения песчаного инокулюма. Эта работа была поддержана грантами Национального совета по науке и технике Тайваня (NSTC 113-2326-B-002 -008 -MY3).
Материалы
| Name | Company | Catalog Number | Comments |
| (NH4)6Mo7O24.4H2O | FERAK | 12054-85-2 | half-strength Hoagland solution |
| Bleach | Gaulix | Gaulix-2108 | rice sterilization |
| Ca(NO3)2.4H2O | Sigma | 13477-34-4 | half-strength Hoagland solution |
| CuSO4.5H2O | Sigma | 7758-99-8 | half-strength Hoagland solution |
| EtOH | Honeywell | 67-63-0 | rice sterilization |
| Fe-citrate | Sigma | 3522-50-7 | half-strength Hoagland solution |
| Garlic chives seeds | KNOWN-YOU SEED Co., LTD. | V-015 | Allium tuberosum L. seeds |
| Glycerol | J.T.Baker | 56-81-5 | Trypan blue staining |
| HCl | Sigma | 7647-01-0 | Trypan blue staining |
| KCl | Merck | 7447-40-7 | half-strength Hoagland solution |
| KH2PO4 | Merck | 7646-93-7 | half-strength Hoagland solution |
| KNO3 | Avantor | 7757-79-1 | half-strength Hoagland solution |
| KOH | Honeywell | 1310-58-3 | Trypan blue staining |
| Lactic acid | Sigma | 50-81-7 | Trypan blue staining |
| MgSO4.7H2O | Sigma | 10034-99-8 | half-strength Hoagland solution |
| MnSO4.H2O | Honeywell | 10034-96-5 | half-strength Hoagland solution |
| MS salts | PhytoTech | M404 | half-strength Murashige–Skoog (1/2 MS) medium |
| Na2B4O7.10H2O | Sigma | 1330-43-4 | half-strength Hoagland solution |
| NaCl | Bioshop | 7647-14-5 | salt stress treatment |
| NaOH | J.T.Baker | 1310-73-2 | half-strength Murashige–Skoog (1/2 MS) medium |
| Rhizophagus irregularis spore | Premier Tech | L-ASP-A | AM fungal spore (MycoriseASP, Premier Tech, Rivière-du-Loup, Québec, Canada ) |
| Sucrose | Bioshop | 57-50-1 | half-strength Murashige–Skoog (1/2 MS) medium |
| Trypan blue | Sigma | 72-57-1 | Trypan blue staining |
| ZnSO4.7H2O | Avantor | 7446-20-0 | half-strength Hoagland solution |
Ссылки
- Flowers, T., Yeo, 6. Breeding for salinity resistance in crop plants: Where next. Funct Plant Biol. 22 (6), 875-884 (1995).
- Porcel, R., Aroca, R., Ruiz-Lozano, J. M. Salinity stress alleviation using arbuscular mycorrhizal fungi: A review. Agron Sustain Dev. 32, 181-200 (2012).
- Mukhopadhyay, R., Sarkar, B., Jat, H. S., Sharma, P. C., Bolan, N. S. Soil salinity under climate change: Challenges for sustainable agriculture and food security. J Environ Manage. 15 (280), 111736 (2021).
- Hossain, M. S. Present scenario of global salt-affected soils, its management and importance of salinity research. Int. Res J Biol Sci. 1, 1-3 (2019).
- Hualpa-Ramirez, E., et al. Stress salinity in plants: New strategies to cope with in the foreseeable scenario. Plant Physiol Biochem. 208, 108507 (2024).
- Hussain, S., et al. Effects of salt stress on rice growth, development characteristics, and the regulating ways: A review. J Integr Agric. 16, 2357-2374 (2017).
- Tavakkoli, E., Fatehi, F., Coventry, S., Rengasamy, P., Mcdonald, G. K. Additive effects of Na+ and Cl- ions on barley growth under salinity stress. J Exp Biol. 62 (6), 2189-2203 (2011).
- Flowers, T., Troke, P., Yeo, A. The mechanism of salt tolerance in halophytes. Annu Rev Plant Physiol. 28 (1), 89-121 (1977).
- Shomer, I., Novacky, A. J., Pike, S. M., Yermiyahu, U., Kinraide, T. B. Electrical potentials of plant cell walls in response to the ionic environment. Plant Physiol. 133 (1), 411-422 (2003).
- Sudhir, P., Murthy, S. Effects of salt stress on basic processes of photosynthesis. Photosynthetica. 42 (2), 481-486 (2004).
- Sharma, P., Jha, A. B., Dubey, R. S., Pessarakli, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. J Bot. 2012, 217037 (2012).
- Singh, M., Kumar, J., Singh, V., Prasad, S. Proline and salinity tolerance in plants. Biochem. Pharmacol. 3, e170 (2014).
- Atta, K., et al. Impacts of salinity stress on crop plants: Improving salt tolerance through genetic and molecular dissection. Front. Plant Sci. 14, 1241736 (2023).
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proc Natl Acad Sci USA. 91. 91, 11841-11843 (1994).
- Redecker, D., Kodner, R., Graham, L. E. Glomalean fungi from the Ordovician. Science. 289 (5486), 1920-1921 (2000).
- Harley, J., Smith, S. . Mycorrhizal symbiosis. , (1983).
- Porras-Soriano, A., Soriano-Martin, M. L., Porras-Piedra, A., Azcon, R. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. J Plant Physiol. 166, 1350-1359 (2009).
- Kapoor, R., Evelin, H., Mathur, P., Giri, B. . Plant acclimation to environmental stress. , 359-401 (2013).
- Rivero, J., Ñlvarez, D., Flors, V., Azcón-Aguilar, C., Pozo, M. J. Root metabolic plasticity underlies functional diversity in mycorrhiza-enhanced stress tolerance in tomato. New Phytol. 220 (4), 1322-1336 (2018).
- Begum, N., et al. Role of arbuscular mycorrhizal fungi in plant growth regulation: Implications in abiotic stress tolerance. Front. Plant Sci. 19 (10), 1068 (2019).
- Evelin, H., Kapoor, R. Arbuscular mycorrhizal symbiosis modulates antioxidant response in salt-stressed Trigonella foenum-graecum plants. Mycorrhiza. 24 (3), 197-208 (2014).
- Sarwat, M., et al. Mitigation of NaCl stress by arbuscular mycorrhizal fungi through the modulation of osmolytes, antioxidants and secondary metabolites in mustard (Brassica juncea L.) plants. Front Plant Sci. 7, 869 (2016).
- Evelin, H., Devi, T. S., Gupta, S. R. K. Mitigation of salinity stress in plants by arbuscular mycorrhizal symbiosis: Current understanding and new challenges. Front Plant Sci. 12 (10), 470 (2019).
- Kapoor Giri, R., Mukerji, K. Influence of arbuscular mycorrhizal fungi and salinity on growth, biomass, and mineral nutrition of Acacia auriculiformis. Biol Fertility Soils. 38 (3), 170-175 (2003).
- Giri Mukerji, K. G. Mycorrhizal inoculant alleviates salt stress in Sesbania aegyptiaca and Sesbania grandiflora under field conditions: Evidence for reduced sodium and improved magnesium uptake. Mycorrhiza. 14 (5), 307-312 (2004).
- Colla, G., et al. Alleviation of salt stress by arbuscular mycorrhizal in zucchini plants grown at low and high phosphorus concentrations. Biol Fertility Soils. 44 (3), 501-509 (2008).
- Hammer, E. C., Nasr, H., Pallon, J., Olsson, P. A., Wallander, H. Elemental composition of arbuscular mycorrhizal fungi at high salinity. Mycorrhiza. 21, 117-129 (2011).
- Estrada, B., Aroca, R., Maathuis, F. J., Barea, J. M., Ruiz-Lozano, J. M. Arbuscular mycorrhizal fungi native from a Mediterranean saline area enhance maize tolerance to salinity through improved ion homeostasis. Plant, Cell Environ. 36, 1771-1782 (2013).
- Talaat, N. B., Shawky, B. T. Influence of arbuscular mycorrhizae on yield, nutrients, organic solutes, and antioxidant enzymes of two wheat cultivars under salt stress. J Plant Nutr Soil Sci. 174, 283-291 (2011).
- Chinnusamy, V., Jagendorf, A., Zhu, J. K. Understanding and improving salt tolerance in plants. Crop Sci. 45, 437-448 (2005).
- Porcel, R., et al. Arbuscular mycorrhizal symbiosis ameliorates the optimum quantum yield of photosystem ii and reduces non-photochemical quenching in rice plants subjected to salt stress. J. Plant Physiol. 1 (185), 75-83 (2015).
- Porcel, R., Aroca, R., Azcon, R., Ruiz-Lozano, J. Regulation of cation transporter genes by the arbuscular mycorrhizal symbiosis in rice plants subjected to salinity suggests improved salt tolerance due to reduced Na(+) root-to-shoot distribution. Mycorrhiza. 26 (7), 673-684 (2016).
- Tisarum, R., et al. Alleviation of salt stress in upland rice (Oryza sativa L. ssp. Indica cv. Leum pua) using arbuscular mycorrhizal fungi inoculation. Front Plant Sci. 11, 348 (2020).
- Hsieh, C., Chen, Y., Chang, K., Yang, S. Transcriptome analysis reveals the mechanisms for mycorrhiza-enhanced salt tolerance in rice. Front Plant Sci. 13, 1072171 (2022).
- Roth, R., Paszkowski, U. Plant carbon nourishment of arbuscular mycorrhizal fungi. Curr Opin Plant Biol. 39, 50-56 (2017).
- Ijdo, M., Cranenbrouck, S., Declerck, S. Methods for large-scale production of am fungi: Past, present, and future. Mycorrhiza. 21, 1-16 (2011).
- Genre, A., Bonfante, P. Building a mycorrhizal cell: How to reach compatibility between plants and arbuscular mycorrhizal fungi. J Plant Interact. 1, 3-13 (2005).
- Zuccaro, A., Lahrmann, U., Langen, G. Broad compatibility in fungal root symbioses. Curr Opin Plant Biol. 20, 135-145 (2014).
- Kiddee, S., et al. Improving inoculum production of arbuscular mycorrhizal fungi in Zea mays L. Using light-emitting diode (led) technology. Agronomy. 14 (10), 2342 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены