Method Article
Produktion von arbuskulärem Mykorrhiza-Pilzinokulum (AM) und phänotypische Bewertung der Symbiose von Reis und AM unter salzhaltigen Bedingungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt ein Protokoll zur Generierung von arbuskulären Mykorrhizapilzen (AM) Inokulum, um die AM-verstärkte Salzstresstoleranz in Reis zu untersuchen.
Zusammenfassung
Reis (Oryza sativa L.) ist für mehr als die Hälfte der Weltbevölkerung ein lebenswichtiges Nahrungsmittel. Ihr Wachstum wird jedoch stark durch salzhaltige Böden beeinträchtigt, die eine große Herausforderung für den Pflanzenbau weltweit darstellen. Es hat sich gezeigt, dass arbuskuläre Mykorrhizapilze (AM), die mit über 90 % der landwirtschaftlichen Pflanzen und 80 % der terrestrischen Pflanzenarten wechselseitige symbiotische Beziehungen eingehen, die Salztoleranz von Reispflanzen erhöhen. AM-Pilze sind obligate Symbionten, die ihren Lebenszyklus ohne eine Wirtswurzel nicht abschließen können. Daher ist die effektive Nutzung von Pflanzen zur Herstellung von AM-Pilzinokulum von entscheidender Bedeutung, um die Forschung auf diesem Gebiet voranzutreiben. In dieser Studie stellen wir eine Reihe robuster Methoden vor, die mit der Erzeugung von Sandinokulum beginnen, das Sporen von Rhizophagus irregularis enthält, unter Verwendung von Allium tuberosum L. Zu diesen Methoden gehören die Inokulation von Reissämlingen mit dem Sandinokulum, die Analyse des Wachstumsphänotyps von Mykorrhizareis und die Quantifizierung des Pilzbesiedlungsgrades mittels Trypanblau-Färbung unter Salzstress. Diese Ansätze können effizient AM-Pilzinokulum erzeugen, um weiter zu untersuchen, wie die AM-Symbiose die Salzgehaltstoleranz von Reis erhöht.
Einleitung
Salzhaltige Böden sind weltweit ein erhebliches Hindernis für die Pflanzenproduktion 1,2,3. Jüngste Studien deuten darauf hin, dass bis 2050 bis zu 50 % der Anbauflächen durch Versalzung degradiert seinwerden 4. Salzhaltige Böden verursachen bei Pflanzen vor allem Toxizität aufgrund der Akkumulation von Natrium- (Na+) und Chlorid- (Cl-) Ionen in pflanzlichen Geweben. Diese Ionen, die in salzhaltigen Böden dominieren, sind auch für Pflanzen am schädlichsten 5,6,7. Zum Beispiel hemmt Natrium viele zytosolische Enzymaktivitäten8. Salzstress beeinflusst auch die photosynthetische Effizienz und induziert Veränderungen der Ionentoxizität, des osmotischen Drucks und der Zellwandstruktur, was zusammen zur Akkumulation von reaktiven Sauerstoffspezies (ROS) führt9,10,11,12,13.
Die Symbiose der arbuskulären Mykorrhiza (AM) ist eine endosymbiotische Assoziation zwischen Pilzen des Stammes Glomeromycota und Pflanzenwurzeln, die sich vor etwa 400-450 Millionen Jahren mit dem Aufkommen früher Landpflanzen entwickelthat 14,15. Über 80% der Gefäßpflanzen können von AM-Pilzen besiedelt sein16. Diese mutualistische Beziehung erhöht die Nährstoffaufnahme der Pflanzen aus dem Boden und verbessert dadurch das Wachstum und die Stresstoleranz 17,18,19,20. Zum Beispiel können AM-Pilze bei Salzstress das Ionengleichgewicht aufrechterhalten und dazu beitragen, die Wasser- und Nährstoffverfügbarkeit, die antioxidative Aktivität, die photosynthetische Effizienz und die Produktion von Sekundärmetaboliten für Pflanzen zu verbessern 2,21,22,23. Darüber hinaus verhindert die AM-Symbiose eine übermäßige Aufnahme und den Transport von Na+ von den Wurzeln zu den Trieben und fördert die Absorption von essentiellen Kationen wie K+, Mg2+ und Ca2+. Dieser Prozess erhöht das Mg2+/Na+- oder K+/Na+-Verhältnis in Pflanzen unter salzhaltigen Bedingungen 23,24,25,26,27,28,29.
Reis (Oryza sativa L.), eine wichtige Nahrungspflanze für mehr als die Hälfte der Weltbevölkerung, gehört zur Familie der Gramineae (Poaceae) und ist sehr anfällig für Salzstress30. Studien haben auch die Rolle von AM-Pilzen bei der Verbesserung der Salzstresstoleranz bei Reis hervorgehoben 31,32,33. So verbessert beispielsweise der AM-Pilz Claroideoglomus etunicatum die CO2 -Fixierungseffizienz von Reis (Oryza sativa L. cv. Puntal) unter Salzstress31. Darüber hinaus ist die Expression wichtiger Reistransporter-Gene, die mit der vakuolären Natriumsequestrierung und der Na+-Rezirkulation von den Trieben zu den Wurzeln assoziiert sind, in AM-besiedelten Pflanzen unter Salzstress erhöht32. Darüber hinaus zeigen Hochlandreispflanzen, die mit Glomus etunicatum geimpft wurden, eine verbesserte Photosynthesekapazität, eine erhöhte Osmolytproduktion, ein verbessertes osmotisches Potenzial und einen höheren Kornertrag unter salzhaltigen Bedingungen33. Unsere früheren Forschungen zeigten auch, dass Mykorrhizareis (Oryza sativaL. cv. Nipponbare) ein besseres Spross- und Fortpflanzungswachstum, ein deutlich höheres K+/Na+-Verhältnis im Spross und eine verbesserte Aasfängerkapazität für reaktive Sauerstoffspezies (ROS) aufgrund der AM-Symbiose34 aufwies. All diese Ergebnisse zeigen den positiven Einfluss der AM-Symbiose auf die Salzstresstoleranz bei Reis durch phänomische Ansätze. Die experimentellen Methoden wurden jedoch nicht im Videoformat veröffentlicht.
AM-Pilze sind obligate Symbionten, die eine Wirtswurzel benötigen, um ihren Lebenszyklus zu vervollständigen, so dass die Verwendung von Pflanzen zur Herstellung von AM-Pilzinokulum für den Forschungsfortschritt von entscheidender Bedeutung ist35. Ein substratbasiertes Produktionssystem, bei dem AM-Pilze in Substraten wie Vermiculit oder Sand gezüchtet und Sporen für Inokulum36 gesammelt werden, bietet eine kostengünstige Lösung für die großflächige Produktion von AM-Pilzinokulumen. Die Effizienz der Sporenproduktion hängt von der Verträglichkeit und dem Wachstum der Pflanzen ab, die sich auf die Pilzbesiedlung und -vermehrung auswirken37,38. Diese Methode ist jedoch oft zeitaufwändig, da herkömmliche Ansätze bis zu 120 Tage dauern und zu einer geringen Sporenproduktion führen. Jüngste Verbesserungen haben die Produktionsdauer auf 90 Tage verkürzt, wobei Mais als Wirtspflanze unter LED-Lichtbedingungen verwendet wurde39. Es wird jedoch ein robustes Verfahren zur Erzeugung eines Sandinokulums vorgestellt, das Sporen von Rhizophagus irregularis enthält, unter Verwendung von Allium tuberosum L. innerhalb von 10 Wochen. Dieses Sandinokulum kann verwendet werden, um den Wachstumsphänotyp von Mykorrhizareis zu analysieren und den Grad der Pilzbesiedlung durch Trypanblau-Färbung unter Salzstress zu quantifizieren. Diese Ansätze generieren effizient AM-Pilzinokulum, um weiter zu untersuchen, wie die AM-Symbiose die Salzgehaltstoleranz von Reis erhöht.
Protokoll
Die Einzelheiten zu den Reagenzien und der Ausrüstung, die in dieser Studie verwendet wurden, sind in der Materialtabelle aufgeführt.
1. Erzeugung eines Sandinokulums, das Sporen von Rhizophagus irregularis enthält, unter Verwendung von Allium tuberosum L.
- Sand mit Leitungswasser waschen und autoklavieren.
- 2/3 des Sandes in einen Topf geben (oberer Durchmesser 14,7 cm, unterer Durchmesser 11,5 cm, Höhe 13 cm). Fügen Sie 1.000 Sporen des AM-Pilzes Rhizophagus irregularis hinzu. Mit einer dünnen Schicht Sand bedecken. 30 Samen Knoblauch-Schnittlauch (Allium tuberosum L.) dazugeben und die Kerne mit Sand bedecken.
- Den Knoblauch-Schnittlauch in der Kammer mit einem 16-h/8-stündigen Tag-/Nachtzyklus bei 23,5 °C (55 % relative Luftfeuchtigkeit) anbauen. Decken Sie den Knoblauch-Schnittlauch in der ersten Woche (1 Woche nach der Inokulation, wpi) mit Aluminiumoxidpapier ab, um das Licht abzuhalten, und gießen Sie ihn dreimal pro Woche.
- Ab 2 ppi den Knoblauch-Schnittlauch zweimal pro Woche mit 80 mL halbstarker Hoagland-Lösung mit 25 μM KH2PO4 düngen. Düngen Sie einmal pro Woche mit 80 ml Wasser.
- Ernten Sie nach 10 Wochen die Wurzeln von Knoblauchschnittlauch für die Trypanblaufärbung, um den Grad der Pilzbesiedlung zu beurteilen. Wenn der Besiedlungsgrad 70% übersteigt, hören Sie auf, den Knoblauch-Schnittlauch zu gießen, bis der Sand trocken ist (ca. 5 Wochen). Geben Sie das gesamte Sandinokulum in eine Plastiktüte und lagern Sie es im Kühlschrank bei 4 °C.
2. Trypanblau-Färbung zur Überprüfung des Grades der Pilzbesiedlung
- Wurzelstücke 30 min bei >90 °C in 10% KOH inkubieren. Entfernen Sie das KOH.
- Spülen Sie die Wurzelstücke dreimal mit doppelt destilliertem Wasser (ddH2O) ab.
- Inkubieren Sie die Wurzelstücke mit 0,3 M HCl für 15 min bis 2 h. Entfernen Sie die HCl.
- 1 ml 0,1 % Trypanblau zugeben und die Proben 8 Minuten lang bei >90 °C inkubieren.
- Waschen Sie die Wurzelstücke mit 50% saurem Glycerin. Übertragen Sie 10 Wurzelstücke auf Objektträger und fügen Sie einen Tropfen 50% saures Glycerin hinzu.
- Versiegeln Sie die Deckgläser und schieben Sie sie mit Nagellack ein.
- Untersuchen Sie 10 Sichtfelder jeder Wurzel unter einem Mikroskop, um das Vorhandensein von Pilzstrukturen zu erfassen. Berechnen Sie den Grad der Pilzbesiedlung in Prozent.
HINWEIS: 50% saures Glycerin: Bereiten Sie vor, indem Sie Glycerin und 0,3 M HCl im Verhältnis 1:1 mischen. 0,1 % Trypanblau: Lösen Sie 100 mg Trypanblau in einer Mischung aus 2:1:1 Milchsäure, Glycerin und ddH2O.
3. Beimpfung der Reissetzlinge mit Sandinokulum und Salzstressbehandlung
- Entfernen Sie die Schale (Hülse) von den Reissamen.
- Sterilisieren Sie die Samen mit 70% Ethanol (EtOH) für 4 min und 30 s.
- Gib die Reissamen in ein Zentrifugenröhrchen. 3% Bleichmittel (zubereitet mit sterilem dH2O) zugeben und 30 min schütteln.
- Entfernen Sie das Bleichmittel und waschen Sie die Samen mit sterilem dH2O 3-4 Mal in der Laminar-Flow-Haube.
- Züchten Sie die Samen in einem Medium mit halbfester Stärke Murashige-Skoog (1/2 MS) mit 0,8 % Agar bei 30 °C im Dunkeln für 5 Tage.
- Ziehen Sie die Reissetzlinge 2 Tage lang mit einem 12-stündigen Tag-Nacht-Zyklus bei 30/28 °C und 70 % Luftfeuchtigkeit an.
- Füllen Sie die Reissetzlinge in Plastikröhrchen mit sterilisiertem Sand um. Fügen Sie entweder kein Inokulum (Schein) oder 5 ml Sandinokulum hinzu, das Sporen von Rhizophagus irregularis (Ri) enthält.
- Gießen Sie die Reispflanzen in der ersten Woche nach der Inokulation an 7 Tagen in der Woche mit dH2O. Düngen Sie die Pflanzen jeden zweiten Tag mit einer halbstarken Hoagland-Lösung, die 25 μM KH2PO4 enthält.
- 5 Wochen nach der Inokulation (wpi) behandeln Sie eine Charge mit 150 mM NaCl (salzhaltiger Zustand) und belassen Sie die andere Charge ohne NaCl (nicht salzhaltiger Zustand).
- Für den nicht salzhaltigen Zustand gießen Sie die Pflanzen am Dienstag mit halbstarker Hoagland-Lösung mit 25 μM KH2PO4 und den Rest der Woche mit Wasser.
- Für den salzhaltigen Zustand gießen Sie die Pflanzen am Dienstag mit halbfester Hoagland-Lösung mit 25 μM KH2PO4, montags, mittwochs und freitags mit 150 mM NaCl und für den Rest der Woche mit Wasser.
- Ernte die Pflanzen bei 8 wpi, um ihr Frischgewicht zu messen. Stellen Sie die Pflanzen für 2 Tage in einen 70 °C Ofen, um das Trockengewicht zu messen. Analysieren Sie den Grad der Pilzbesiedlung durch Trypanblau-Färbung.
Ergebnisse
Der Schritt-für-Schritt-Workflow ist in Abbildung 1 dargestellt. 10 Wochen nach der Inokulation (wpi) wurden Pilzstrukturen wie Vesikel und Sporen, die für das Spätstadium und die AM-Symbiose charakteristisch sind, in den Wurzeln von Knoblauchschnittlauch deutlich beobachtet (Abbildung 2A). Der Gehalt an intraradikalen Hyphen, Arbuskeln, Bläschen, extraradikalen Hyphen und Sporen betrug 80 %, 47 %, 63 %, 4 % bzw. 1 %, was auf das Fortschreiten der Pilzentwicklung in den Wurzeln von Knoblauchschnittlauch hinweist. Damit erreichte der Gesamtbesiedlungsgrad 80% (Abbildung 2C). Diese Ergebnisse deuteten darauf hin, dass die symbiotische Beziehung zwischen Knoblauch-Schnittlauch und AM-Pilzen erfolgreich etabliert wurde und dass die AM-Pilze in der Lage waren, ihren Lebenszyklus zu vervollständigen und mehr Sporen zu bilden. Mit Hilfe des Sandinokulums, das aus der Symbiose zwischen Knoblauch-Schnittlauch und AM-Pilzen entstanden ist, wurden die Reispflanzen erfolgreich mit AM-Pilzen besiedelt. Bei 8 wpi wurden Vesikel und Sporen in den Reiswurzeln beobachtet (Abbildung 2D), und die Konzentrationen von intraradikalen Hyphen, Arbuskeln, Bläschen, extraradikalen Hyphen, Sporen und Gesamtpilzstrukturen betrugen 91 %, 82 %, 95 %, 46 %, 2 % bzw. 93 % (Abbildung 2E). Dann wurden Reispflanzen ohne (Mock) oder mit diesem Sandinokulum für 5 Wochen gezüchtet und dann ohne oder mit Salzlösung (150 mM NaCl) für 3 Wochen behandelt. Mykorrhizapflanzen wiesen unter Salzstress weniger welke Blattspitzen auf als Scheinpflanzen (Abbildung 2F). Unter nicht salzhaltigen Bedingungen zeigten Mykorrhiza-Reispflanzen eine höhere Sprossbiomasse als Scheinreispflanzen (Abbildung 2G). Unter Salzstress war die Sprossbiomasse von Scheinpflanzen stark reduziert, während Mykorrhizapflanzen ihre Sprossbiomasse behielten, die 1,4-mal höher war als die der Scheinpflanzen (Abbildung 2G). Die AM-Symbiose hatte unter beiden Bedingungen keinen signifikanten Einfluss auf die Wurzelbiomasse (Abbildung 2G). Diese Ergebnisse deuten darauf hin, dass die AM-Symbiose den Reispflanzen hilft, unter Salzstress ein besseres Triebwachstum aufrechtzuerhalten. Die Pilzbesiedlung erreichte 84 % bzw. 83 % unter nicht salzhaltigen und salzhaltigen Bedingungen, was auf eine erfolgreiche Besiedlung der Reiswurzeln durch AM-Pilze hinweist. Darüber hinaus waren die extraradikalen Hyphen unter Salzstress höher. Bei anderen Pilzstrukturen wurden keine signifikanten Unterschiede zwischen nicht-salzhaltigen und salzhaltigen Bedingungen beobachtet, was darauf hindeutet, dass Salzstress einen geringen Einfluss auf die AM-Symbiose hatte (Abbildung 2H).
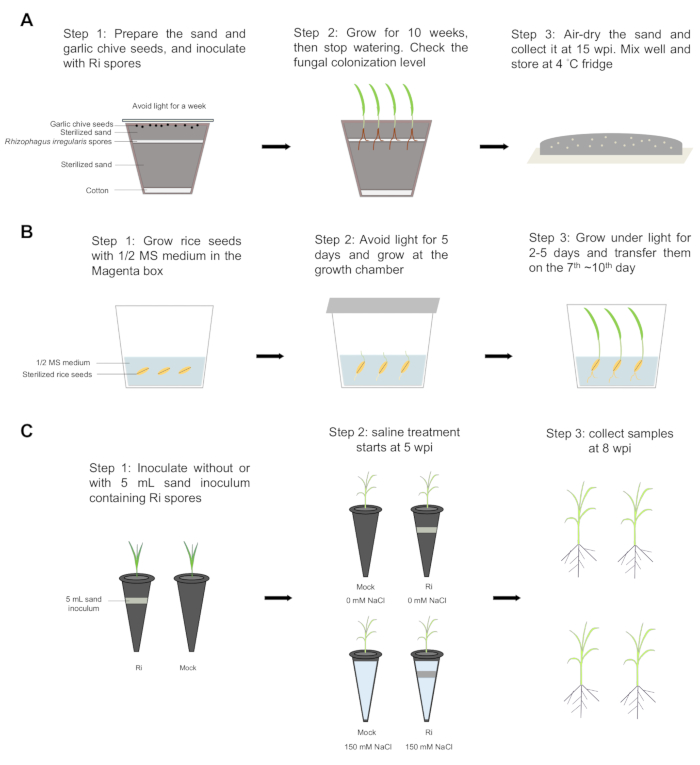
Abbildung 1: Schritt-für-Schritt-Workflow. (A) Das Sandinokulum wurde in den folgenden Schritten vorbereitet: Schritt 1: Eine Schicht Watte wurde auf den Boden des Topfes gelegt und 2/3 des sterilisierten Sandes in den Topf gegeben. Etwa 1000-2000 Rhizophagus irregularis-Sporen wurden mit abgeschnittenen Spitzen gleichmäßig verteilt und dann mit dem restlichen 1/3 sterilisiertem Sand bedeckt. Dreißig Samen von Allium tuberosum L. wurden gleichmäßig auf der Sandoberfläche verteilt und mit Aluminiumoxidpapier bedeckt, um das Licht zu blockieren. Die Pflanzen wurden eine Woche lang bei 23 °C inkubiert. Schritt 2: Die Samen wurden 10 Wochen lang bei 23 °C mit einem Hell-Dunkel-Zyklus von 16/8 gezüchtet, dann wurde die Bewässerung gestoppt. Der Besiedlungsgrad der Wurzeln wurde überprüft. Schritt 3: Der Sand wurde luftgetrocknet, 15 Wochen nach der Inokulation (wpi) gesammelt, gut gemischt und bei 4 °C Kühlschrank gelagert. (B) Die Reissamen wurden in der Magenta-Box gekeimt. Schritt 1 und 2: Die Reissamen wurden 4 min 30 s lang mit 70% Ethanol sterilisiert und Ethanol durch 3% Natriumperchlorat ersetzt. Die Samen wurden 30 Minuten lang geschüttelt und dann fünfmal mit sterilisiertem Wasser gespült. Die Samen wurden auf 1/2 Murashige und Skoog (MS) Medium mit 0,8% Agar für 5 Tage im Dunkeln bei 30 °C und 2 Tage unter Licht gekeimt (12/12 h Tag/Nacht-Zyklus bei 30/28 °C). Schritt 3: Die Reissetzlinge wurden am 7. ~10. Tag umgesiedelt. (C) Inokulation und Kochsalzlösung. Schritt 1: Die Reissetzlinge wurden in Plastikröhrchen mit sterilisiertem Sand ohne (Schein) oder mit 5 ml Sandinokulum mit Rhizophagus irregularis (Ri) Sporen transplantiert. Die Pflanzen wurden in einer Wachstumskammer mit einem 12-stündigen Tag-Nacht-Zyklus bei 30/28°C gezüchtet, und die Pflanzen wurden zweimal pro Woche mit einer Hälfte Hoagland-Lösung mit 25 μM Phosphat (Pi) angebaut. Schritt 2: Bei 5 ppi wurden die Mykorrhiza- und Scheinpflanzen in zwei Gruppen eingeteilt. Eine Gruppe wurde mit 150 mM Natriumchlorid (NaCl) (salzhaltiger Zustand) behandelt, und die andere Gruppe wurde unter nicht salzhaltigen Bedingungen gezüchtet. Schritt 3: Um 8 ppi wurden alle Pflanzen eingesammelt, und dann wurden die Triebe und Wurzeln getrennt, um das Frischgewicht und das Trockengewicht zu bestimmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Der Phänotyp von Allium tuberosum L. (Knoblauch, Schnittlauch), O. sativa, L. japonica cv., Nipponbare (Reis) und Rhizophagus irregularis (AM-Pilze). (A) Foto von Mykorrhiza-Knoblauch-Schnittlauchwurzeln bei 10 wpi. (B) Foto von Mykorrhiza-Knoblauch-Schnittlauch-Pflanzen bei 10 wpi. (C) Grad der Pilzbesiedlung von Knoblauch-Schnittlauchwurzeln. (D) Foto von Mykorrhiza-Reiswurzeln bei 8 wpi. (E) Grad der Pilzbesiedlung von Reiswurzeln. (F) Der Phänotyp von Schein- und Mykorrhiza-Reispflanzen unter Salzstress. (G) Das Trockengewicht von Schein- und Mykorrhiza-Reispflanzen unter nicht-salzhaltigem und Salzstress und (H) Pilzbesiedlungsgrad von Mykorrhiza-Reiswurzeln unter Salzstress bei 8 wpi. In (A-C) wurde Knoblauch-Schnittlauch mit 200 Sporen von AM-Pilzen (R. irregularis, Ri) geimpft, unter 25 μM Phosphatbedingungen gezüchtet und 10 Wochen nach der Inokulation (wpi) geerntet. In den Panels (D) und (E) wurden Reispflanzen mit 5 ml Sandinokulum beimpft, das aus der Symbiose zwischen Knoblauch-Schnittlauch und AM-Pilzen (Rhizophagus irregularis, Ri) stammte, unter 25 μM Phosphatbedingungen angebaut und 8 Wochen nach der Inokulation (wpi) geerntet. In Panel (F) wurden Reispflanzen entweder ohne (Schein) oder mit Sandinokulum angebaut, das AM-Pilze (R. irregularis, Ri) für 5 Wochen enthielt, gefolgt von einer Behandlung mit einer Salzlösung (150 mM NaCl) für 3 Wochen. Die Wurzeln wurden in den Feldern (A) und (D) mit Trypanblau gefärbt. In diesen Tafeln sind Sporen durch weiße Pfeilspitzen, Vesikel durch weiße Pfeile und extraradikale Hyphen durch schwarze Pfeile gekennzeichnet. Maßstabsleisten: 100 μm in den Platten (A) und (D); 1 cm in der Platte (B); und 10 cm in der Platte (F). Abkürzungen: int Hyphen, intraradikale Hyphen; ext Hyphen, extraradikale Hyphen. Der Standardfehler wurde aus 3-4 biologischen Replikaten berechnet. Unterschiedliche Buchstaben weisen auf signifikante Unterschiede zwischen den Behandlungen hin (p < 0,05, bidirektionale ANOVA, gefolgt von einem am wenigsten signifikanten Unterschied im Post-hoc-Test). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Es gibt ein paar Tipps zur Vorbereitung und Verwendung von Sandinokulum. Erstens sollte nach unserer Erfahrung der Besiedlungsgrad von Knoblauch-Schnittlauch höher als 70 % sein (Abbildung 2C). Andernfalls wird die folgende Inokulation an anderen Pflanzen, wie Tomaten und Reis, 7 Wochen nach der Inokulation (wpi) nicht erfolgreich über 50 % erreichen (Abbildung 2E). Zweitens sollte das Sandinokulum vor der Lagerung gründlich an der Luft getrocknet und in einer sauberen Plastiktüte im Kühlschrank aufbewahrt werden, damit es nicht wieder nass wird (Schritt 1.5). Andernfalls verschlechtert sich die Qualität des Sandinokulums. Drittens kann das Sandinokulum problemlos ca. 10 Monate im Kühlschrank aufbewahrt werden. Viertens muss das Sandinokulum durch Schütteln des Vorratsbeutels gründlich gemischt werden, bevor es in den Topf gegeben wird, um andere Pflanzen zu impfen (Schritt 3.7).
Bei der Trypanblau-Färbung sollten die Wurzeln zum Färben in etwa 1-1,5 cm lange Stücke geschnitten werden, damit die Pilzstruktur homogen mit Trypanblau gefärbt werden kann (Schritt 2.1). Um den Mykorrhiza-Besiedlungsgrad einer Wurzel genau darzustellen, muss man zehn Gesichtsfelder in nahezu gleichen Abständen von einem Ende der Wurzel zum anderen beobachten (Schritt 2.7).
Bei der Behandlung von Salzstress bei Schein- und Mykorrhizareis muss die Zeit für die Sterilisation von Reissamen mit Alkohol genau sein; Andernfalls wird die Keimrate des Reises beeinflusst (Schritt 3.2). Da Sand als Nährboden verwendet wird, ist es wichtig, dass der Reis während des gesamten Wachstumsprozesses genügend Wasser erhält. Andernfalls kann es zu Trockenheit und hohem Salzstress kommen, was es schwierig macht, die Wachstumsergebnisse genau zu beurteilen (Schritte 3.8-3.9).
Durch die Befolgung dieses Protokolls kann bei der Reissorte Nipponbare eine AM-verstärkte Salzstresstoleranz beobachtet werden. Ob diese Salzstressbehandlung auch zur Beobachtung einer AM-verstärkten Salzstresstoleranz bei anderen Reissorten eingesetzt werden kann, ist jedoch nicht bekannt. Wenn nicht, können einige Schritte geändert werden, wie z. B. die Verwendung von mehr Sandinokulum, der Beginn der Salzstressbehandlung nach 5 WPI, die Verlängerung des Zeitraums für Salzstress oder die erneute Bewässerung der Pflanzen nach Salzstress.
AM-Pilze sind obligate Symbionten, die Wirtswurzeln benötigen, um ihren Lebenszyklus zu vollenden, was die pflanzliche Inokulumproduktion für die Forschung unerlässlich macht35. Substratbasierte Systeme, bei denen Pilze in Materialien wie Vermiculit oder Sand wachsen, bieten eine kostengünstige Möglichkeit, großflächiges Inokulum herzustellen. Herkömmliche Methoden können jedoch bis zu 120 Tage dauern und eine geringe Sporenzahlliefern 36,37,38. Jüngste Verbesserungen haben diese Zahl auf 90 Tage reduziert, wenn Mais unter LED-Lichtverwendet wird 39. Hier wird eine Methode vorgestellt, mit der Rhizophagus irregularis-Sporen in Sand mit Hilfe von Allium tuberosum L. in nur 10 Wochen erzeugt werden können. Dieses Inokulum kann zur Untersuchung des Reiswachstums, der Pilzbesiedlung und der Salzgehaltstoleranz verwendet werden und stellt ein effizientes Werkzeug für die AM-Symbioseforschung dar.
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Wir würdigen Yun-Hsin Chen für die Etablierung des Systems zur Untersuchung der AM-verstärkten Salzstresstoleranz in Reis und Kai-Chieh Chang für die Etablierung des Systems zur Erzeugung von Sandinokulum. Diese Arbeit wurde durch Zuschüsse des National Science and Technology Council, Taiwan (NSTC 113-2326-B-002 -008 -MY3) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| (NH4)6Mo7O24.4H2O | FERAK | 12054-85-2 | half-strength Hoagland solution |
| Bleach | Gaulix | Gaulix-2108 | rice sterilization |
| Ca(NO3)2.4H2O | Sigma | 13477-34-4 | half-strength Hoagland solution |
| CuSO4.5H2O | Sigma | 7758-99-8 | half-strength Hoagland solution |
| EtOH | Honeywell | 67-63-0 | rice sterilization |
| Fe-citrate | Sigma | 3522-50-7 | half-strength Hoagland solution |
| Garlic chives seeds | KNOWN-YOU SEED Co., LTD. | V-015 | Allium tuberosum L. seeds |
| Glycerol | J.T.Baker | 56-81-5 | Trypan blue staining |
| HCl | Sigma | 7647-01-0 | Trypan blue staining |
| KCl | Merck | 7447-40-7 | half-strength Hoagland solution |
| KH2PO4 | Merck | 7646-93-7 | half-strength Hoagland solution |
| KNO3 | Avantor | 7757-79-1 | half-strength Hoagland solution |
| KOH | Honeywell | 1310-58-3 | Trypan blue staining |
| Lactic acid | Sigma | 50-81-7 | Trypan blue staining |
| MgSO4.7H2O | Sigma | 10034-99-8 | half-strength Hoagland solution |
| MnSO4.H2O | Honeywell | 10034-96-5 | half-strength Hoagland solution |
| MS salts | PhytoTech | M404 | half-strength Murashige–Skoog (1/2 MS) medium |
| Na2B4O7.10H2O | Sigma | 1330-43-4 | half-strength Hoagland solution |
| NaCl | Bioshop | 7647-14-5 | salt stress treatment |
| NaOH | J.T.Baker | 1310-73-2 | half-strength Murashige–Skoog (1/2 MS) medium |
| Rhizophagus irregularis spore | Premier Tech | L-ASP-A | AM fungal spore (MycoriseASP, Premier Tech, Rivière-du-Loup, Québec, Canada ) |
| Sucrose | Bioshop | 57-50-1 | half-strength Murashige–Skoog (1/2 MS) medium |
| Trypan blue | Sigma | 72-57-1 | Trypan blue staining |
| ZnSO4.7H2O | Avantor | 7446-20-0 | half-strength Hoagland solution |
Referenzen
- Flowers, T., Yeo, 6. Breeding for salinity resistance in crop plants: Where next. Funct Plant Biol. 22 (6), 875-884 (1995).
- Porcel, R., Aroca, R., Ruiz-Lozano, J. M. Salinity stress alleviation using arbuscular mycorrhizal fungi: A review. Agron Sustain Dev. 32, 181-200 (2012).
- Mukhopadhyay, R., Sarkar, B., Jat, H. S., Sharma, P. C., Bolan, N. S. Soil salinity under climate change: Challenges for sustainable agriculture and food security. J Environ Manage. 15 (280), 111736 (2021).
- Hossain, M. S. Present scenario of global salt-affected soils, its management and importance of salinity research. Int. Res J Biol Sci. 1, 1-3 (2019).
- Hualpa-Ramirez, E., et al. Stress salinity in plants: New strategies to cope with in the foreseeable scenario. Plant Physiol Biochem. 208, 108507 (2024).
- Hussain, S., et al. Effects of salt stress on rice growth, development characteristics, and the regulating ways: A review. J Integr Agric. 16, 2357-2374 (2017).
- Tavakkoli, E., Fatehi, F., Coventry, S., Rengasamy, P., Mcdonald, G. K. Additive effects of Na+ and Cl- ions on barley growth under salinity stress. J Exp Biol. 62 (6), 2189-2203 (2011).
- Flowers, T., Troke, P., Yeo, A. The mechanism of salt tolerance in halophytes. Annu Rev Plant Physiol. 28 (1), 89-121 (1977).
- Shomer, I., Novacky, A. J., Pike, S. M., Yermiyahu, U., Kinraide, T. B. Electrical potentials of plant cell walls in response to the ionic environment. Plant Physiol. 133 (1), 411-422 (2003).
- Sudhir, P., Murthy, S. Effects of salt stress on basic processes of photosynthesis. Photosynthetica. 42 (2), 481-486 (2004).
- Sharma, P., Jha, A. B., Dubey, R. S., Pessarakli, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. J Bot. 2012, 217037 (2012).
- Singh, M., Kumar, J., Singh, V., Prasad, S. Proline and salinity tolerance in plants. Biochem. Pharmacol. 3, e170 (2014).
- Atta, K., et al. Impacts of salinity stress on crop plants: Improving salt tolerance through genetic and molecular dissection. Front. Plant Sci. 14, 1241736 (2023).
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proc Natl Acad Sci USA. 91. 91, 11841-11843 (1994).
- Redecker, D., Kodner, R., Graham, L. E. Glomalean fungi from the Ordovician. Science. 289 (5486), 1920-1921 (2000).
- Harley, J., Smith, S. . Mycorrhizal symbiosis. , (1983).
- Porras-Soriano, A., Soriano-Martin, M. L., Porras-Piedra, A., Azcon, R. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. J Plant Physiol. 166, 1350-1359 (2009).
- Kapoor, R., Evelin, H., Mathur, P., Giri, B. . Plant acclimation to environmental stress. , 359-401 (2013).
- Rivero, J., Ñlvarez, D., Flors, V., Azcón-Aguilar, C., Pozo, M. J. Root metabolic plasticity underlies functional diversity in mycorrhiza-enhanced stress tolerance in tomato. New Phytol. 220 (4), 1322-1336 (2018).
- Begum, N., et al. Role of arbuscular mycorrhizal fungi in plant growth regulation: Implications in abiotic stress tolerance. Front. Plant Sci. 19 (10), 1068 (2019).
- Evelin, H., Kapoor, R. Arbuscular mycorrhizal symbiosis modulates antioxidant response in salt-stressed Trigonella foenum-graecum plants. Mycorrhiza. 24 (3), 197-208 (2014).
- Sarwat, M., et al. Mitigation of NaCl stress by arbuscular mycorrhizal fungi through the modulation of osmolytes, antioxidants and secondary metabolites in mustard (Brassica juncea L.) plants. Front Plant Sci. 7, 869 (2016).
- Evelin, H., Devi, T. S., Gupta, S. R. K. Mitigation of salinity stress in plants by arbuscular mycorrhizal symbiosis: Current understanding and new challenges. Front Plant Sci. 12 (10), 470 (2019).
- Kapoor Giri, R., Mukerji, K. Influence of arbuscular mycorrhizal fungi and salinity on growth, biomass, and mineral nutrition of Acacia auriculiformis. Biol Fertility Soils. 38 (3), 170-175 (2003).
- Giri Mukerji, K. G. Mycorrhizal inoculant alleviates salt stress in Sesbania aegyptiaca and Sesbania grandiflora under field conditions: Evidence for reduced sodium and improved magnesium uptake. Mycorrhiza. 14 (5), 307-312 (2004).
- Colla, G., et al. Alleviation of salt stress by arbuscular mycorrhizal in zucchini plants grown at low and high phosphorus concentrations. Biol Fertility Soils. 44 (3), 501-509 (2008).
- Hammer, E. C., Nasr, H., Pallon, J., Olsson, P. A., Wallander, H. Elemental composition of arbuscular mycorrhizal fungi at high salinity. Mycorrhiza. 21, 117-129 (2011).
- Estrada, B., Aroca, R., Maathuis, F. J., Barea, J. M., Ruiz-Lozano, J. M. Arbuscular mycorrhizal fungi native from a Mediterranean saline area enhance maize tolerance to salinity through improved ion homeostasis. Plant, Cell Environ. 36, 1771-1782 (2013).
- Talaat, N. B., Shawky, B. T. Influence of arbuscular mycorrhizae on yield, nutrients, organic solutes, and antioxidant enzymes of two wheat cultivars under salt stress. J Plant Nutr Soil Sci. 174, 283-291 (2011).
- Chinnusamy, V., Jagendorf, A., Zhu, J. K. Understanding and improving salt tolerance in plants. Crop Sci. 45, 437-448 (2005).
- Porcel, R., et al. Arbuscular mycorrhizal symbiosis ameliorates the optimum quantum yield of photosystem ii and reduces non-photochemical quenching in rice plants subjected to salt stress. J. Plant Physiol. 1 (185), 75-83 (2015).
- Porcel, R., Aroca, R., Azcon, R., Ruiz-Lozano, J. Regulation of cation transporter genes by the arbuscular mycorrhizal symbiosis in rice plants subjected to salinity suggests improved salt tolerance due to reduced Na(+) root-to-shoot distribution. Mycorrhiza. 26 (7), 673-684 (2016).
- Tisarum, R., et al. Alleviation of salt stress in upland rice (Oryza sativa L. ssp. Indica cv. Leum pua) using arbuscular mycorrhizal fungi inoculation. Front Plant Sci. 11, 348 (2020).
- Hsieh, C., Chen, Y., Chang, K., Yang, S. Transcriptome analysis reveals the mechanisms for mycorrhiza-enhanced salt tolerance in rice. Front Plant Sci. 13, 1072171 (2022).
- Roth, R., Paszkowski, U. Plant carbon nourishment of arbuscular mycorrhizal fungi. Curr Opin Plant Biol. 39, 50-56 (2017).
- Ijdo, M., Cranenbrouck, S., Declerck, S. Methods for large-scale production of am fungi: Past, present, and future. Mycorrhiza. 21, 1-16 (2011).
- Genre, A., Bonfante, P. Building a mycorrhizal cell: How to reach compatibility between plants and arbuscular mycorrhizal fungi. J Plant Interact. 1, 3-13 (2005).
- Zuccaro, A., Lahrmann, U., Langen, G. Broad compatibility in fungal root symbioses. Curr Opin Plant Biol. 20, 135-145 (2014).
- Kiddee, S., et al. Improving inoculum production of arbuscular mycorrhizal fungi in Zea mays L. Using light-emitting diode (led) technology. Agronomy. 14 (10), 2342 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten