Method Article
盐水条件下丛枝菌根 (AM) 真菌接种物的生产及水稻与 AM 共生的表型评价
摘要
本文介绍了一种生成丛枝菌根 (AM) 真菌接种物的方案,以研究 AM 增强的水稻耐盐性。
摘要
水稻 (Oryza sativa L.) 是全球一半以上人口的重要粮食作物。然而,它的生长受到盐碱土壤的严重影响,这对全球作物生产构成了重大挑战。丛枝菌根 (AM) 真菌与超过 90% 的农业植物和 80% 的陆生植物物种形成互惠共生关系,已被证明可以增强水稻植物的耐盐性。AM 真菌是专性共生体,没有宿主根就无法完成其生命周期。因此,有效利用植物生产 AM 真菌接种物对于推进该领域的研究至关重要。在这项研究中,我们提出了一系列稳健的方法,这些方法首先使用 Allium tuberosum L 生成含有不规则根瘤菌孢子的沙子接种物。这些方法包括用沙子接种物接种水稻幼苗,分析菌根稻的生长表型,以及在盐胁迫下使用台盼蓝染色量化真菌定植水平。这些方法可以有效地产生 AM 真菌接种物,以进一步研究 AM 共生如何增强水稻的耐盐性。
引言
盐渍土壤是全球作物生产的重大障碍 1,2,3。最近的研究表明,到 2050 年,由于盐碱化,高达 50% 的耕地将退化4。受盐影响的土壤主要由于钠 (Na+) 和氯离子 (Cl−) 在植物组织中积累而对植物造成毒性。这些离子在盐渍土壤中占主导地位,也是对植物最有害的离子 5,6,7。例如,钠会抑制许多胞质酶活性8。盐胁迫还会影响光合效率,并诱导离子毒性、渗透压和细胞壁结构的变化,共同导致活性氧 (ROS) 的积累9,10,11,12,13。
丛枝菌根 (AM) 共生是 Glomeromycota 门真菌与植物根之间的内共生关联,大约在 400-4.5 亿年前随着早期陆地植物的出现而进化14,15。超过 80% 的维管植物可被 AM 真菌定植16。这种互惠关系增强了植物从土壤中吸收养分,从而提高了生长和抗逆性 17,18,19,20。例如,在盐胁迫期间,AM 真菌可以维持离子平衡,并有助于提高水和养分的可用性、抗氧化活性、光合作用效率和植物的次生代谢物产生 2,21,22,23。此外,AM 共生可防止 Na+ 的过度吸收和从根部到芽的运输,促进 K+、Mg2+ 和 Ca2+ 等必需阳离子的吸收。这个过程增加了盐水条件下植物中的 Mg2+/Na+ 或 K+/Na+ 比率 23,24,25,26,27,28,29。
水稻 (Oryza sativa L.) 是全球一半以上人口的重要粮食作物,属于禾本科 (Poaceae) 科,极易受到盐胁迫30。研究还强调了 AM 真菌在增强水稻耐盐胁迫性方面的作用 31,32,33。例如,AM 真菌 Claroideoglomus etunicatum 提高了盐胁迫下水稻 (Oryza sativa L. cv. Puntal) 的 CO2 固定效率31。此外,在盐胁迫下,与 液泡钠螯合和 Na + 从芽到根再循环相关的关键水稻转运蛋白基因的表达在 AM 定植植物中增强32。此外,在盐碱条件下,接种 Glomus etunicatum 的陆地稻植物显示出增强的光合能力、更高的渗透液产生、更高的渗透潜力和更高的谷物产量33。我们之前的研究还表明,菌根稻 (Oryza sativaL. cv. Nipponbare) 表现出更好的芽和生殖生长,芽中的 K+/Na + 比率明显更高,并且由于 AM 共生34 提高了活性氧 (ROS) 清除能力。这些发现都通过表型方法证明了 AM 共生对水稻耐盐胁迫性的积极影响。然而,实验方法尚未以视频格式发布。
AM 真菌是专性共生体,需要宿主根才能完成其生命周期,这使得利用植物产生 AM 真菌接种物对研究进展至关重要35。基于基质的生产系统,其中 AM 真菌在蛭石或沙子等基质中生长,并收集孢子用于接种36,为大规模 AM 真菌接种物生产提供了一种经济高效的解决方案。孢子生产的效率取决于植物的相容性和生长,这会影响真菌的定植和繁殖37,38。然而,这种方法通常很耗时,传统方法需要长达 120 天,并且孢子产量很低。最近的改进已将生产周期缩短到 90 天,在 LED 光照条件下使用玉米作为寄主植物39。然而,提出了一种在 10 周内使用 Allium tuberosum L. 生成含有 Rhizophagus irregularis 孢子的沙子接种物的稳健方法。这种沙子接种物可用于分析菌根稻的生长表型,并在盐胁迫下使用台盼蓝染色量化真菌定植水平。这些方法有效地产生 AM 真菌接种物,用于进一步研究 AM 共生如何增强水稻的耐盐性。
研究方案
本研究中使用的试剂和设备的详细信息列在材料表中。
1. 使用 Allium tuberosum L 生成含有 Rhizophagus irregularis 孢子的沙子接种物。
- 用自来水清洗沙子并高压灭菌。
- 将 2/3 的沙子加入花盆中(顶部直径 14.7 厘米,底部直径 11.5 厘米,高度 13 厘米)。添加 1,000 个 AM 真菌 Rhizophagus irregularis 孢子。盖上一层薄薄的沙子。加入 30 颗韭菜 (Allium tuberosum L.) 种子,用沙子盖住种子。
- 在 23.5 °C(55% 相对湿度)下以 16 小时/8 小时昼夜循环在腔室中种植大蒜韭菜。在第一周(接种后 1 周,wpi),用氧化铝纸盖住韭菜以阻挡光线,并每周浇水 3 次。
- 从 2 wpi 开始,每周两次用含有 25 μM KH2PO4 的 80 mL 半强度 Hoagland 溶液给韭菜施肥。每周用 80 mL 水施肥一次。
- 10 周后,收获韭菜的根部进行台盼蓝染色,以评估真菌定植的水平。如果定植水平超过 70%,请停止给韭菜浇水,直到沙子变干(约 5 周)。将所有沙子接种物放入塑料袋中,并将其存放在 4 °C 的冰箱中。
2. 台盼蓝染色以检查真菌定植水平
- 将根块在 >90 °C 的 10% KOH 中孵育 30 分钟。去除 KOH。
- 用双蒸水 (ddH2O) 冲洗根块 3 次。
- 将根块与 0.3 M HCl 孵育 15 分钟至 2 小时。去除 HCl。
- 加入 1 mL 0.1% 台盼蓝,并将样品在 >90 °C 下孵育 8 分钟。
- 用 50% 酸性甘油清洗根块。将 10 个根块转移到载玻片上,并加入一滴 50% 酸性甘油。
- 密封盖玻片并用指甲油滑动。
- 在显微镜下检查每个根的 10 个视野,以记录真菌结构的存在。以百分比计算真菌定植水平。
注意:50% 酸性甘油:通过将甘油和 0.3 M HCl 以 1:1 的比例混合来制备。0.1% 台盼蓝:将 100 mg 台盼蓝溶于 2:1:1 乳酸、甘油和 ddH2O 的混合物中。
3. 用沙子接种和盐胁迫处理接种水稻幼苗
- 从水稻种子中取出外壳(外壳)。
- 用 70% 乙醇 (EtOH) 对种子消毒 4 分钟和 30 秒。
- 将水稻种子放入离心管中。加入 3% 漂白剂(用无菌 dH2O 制备)并摇动 30 分钟。
- 去除漂白剂,在层流罩内用无菌 dH2O 3-4 次洗涤种子。
- 将种子在含有 0.8% 琼脂的半强度 Murashige-Skoog (1/2 MS) 培养基中于 30 °C 下在黑暗中生长 5 天。
- 在 30/28 °C 和 70% 空气湿度下以 12 小时的昼夜循环种植水稻幼苗 2 天。
- 将水稻幼苗转移到装有消毒沙的塑料管中。添加无接种物 (mock) 或 5 mL 含有不 规则根瘤 菌 (Ri) 孢子的沙子接种物。
- 接种后第一周每周 7 天用 dH2O 给水稻植株浇水。每隔一天用含有 25 μM KH2PO4 的半浓度 Hoagland 溶液给植物施肥。
- 接种后 5 周 (wpi),用 150 mM 的 NaCl(盐水条件)处理一批,让另一批没有 NaCl(非盐水条件)的批次。
- 对于非盐分条件,周二用含有 25 μM KH2PO4 的半强度 Hoagland 溶液给植物浇水,并在一周的剩余时间里用水浇水。
- 对于盐水条件,周二用含有 25 μM KH2PO4 的半强度 Hoagland 溶液给植物浇水,周一、周三和周五用 150 mM NaCl 浇水,并在本周剩余时间内用水浇水。
- 在 8 wpi 时,收获植物以测量其新鲜重量。将植物置于 70 °C 的烘箱中 2 天以测量干重。通过台盼蓝染色分析真菌定植水平。
结果
分步工作流程如图 1 所示。在接种后 10 周 (wpi),在大蒜韭菜根部内清楚地观察到囊泡和孢子等真菌结构,这是晚期和 AM 共生的特征(图 2A)。根内菌丝、丛枝、囊泡、根外菌丝和孢子水平分别为 80% 、 47% 、 63% 、 4% 和 1%,表明韭菜根部内部真菌发育的进展。因此,总定植水平达到 80% (图 2C)。这些结果表明,韭菜大蒜与 AM 真菌之间的共生关系成功建立,AM 真菌能够完成其生命周期并产生更多的孢子。利用韭菜和AM真菌共生产生的沙子接种物,水稻植物成功地被AM真菌定植。在 8 wpi 时,在水稻根系内观察到囊泡和孢子(图 2D),根内菌丝、丛枝、囊泡、根外菌丝、孢子和总真菌结构的水平分别为 91%、82%、95%、46%、2% 和 93%(图 2E)。然后,将水稻植株在没有(模拟)或有这种沙子接种物的情况下生长 5 周,然后在没有或用盐溶液(150 mM NaCl)处理 3 周。在盐胁迫下,菌根植物比模拟植物表现出更少的枯萎叶尖(图 2F)。在非盐碱条件下,菌根稻植物的芽生物量高于模拟稻草(图 2G)。在盐胁迫下,模拟植物的枝条生物量严重降低,而菌根植物保持其枝条生物量,比模拟植物高 1.4 倍(图 2G)。在这两种条件下,AM 共生都没有显着影响根生物量(图 2G)。这些结果表明,AM 共生有助于水稻植物在盐胁迫下维持更好的芽生长。在非盐水和盐水条件下,真菌定植水平分别达到 84% 和 83%,表明 AM 真菌成功定植水稻根系。此外,在盐胁迫下,根外菌丝水平较高。在非盐水和盐水条件下的其他真菌结构中没有观察到显着差异,表明盐胁迫对 AM 共生有轻微影响(图 2H)。
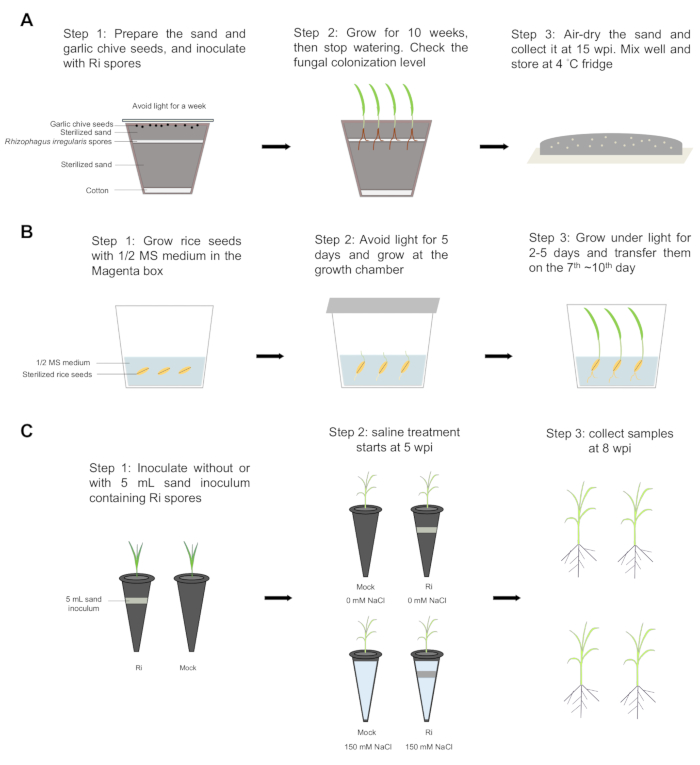
图 1:分步工作流程。 (A) 使用以下步骤制备沙子接种物: 第 1 步:在锅底放一层棉花,将 2/3 的消毒沙加入锅中。用切尖均匀分布约 1000-2000 个 Rhizophagus irregularis 孢子,然后用剩余的 1/3 灭菌沙覆盖。将 30 颗 Allium tuberosum L. 种子均匀地撒在沙面上,并用氧化铝纸覆盖以阻挡光线。将植物在 23 °C 下孵育一周。第 2 步:种子在 23 °C 下以 16/8 光照/黑暗循环生长 10 周,然后停止浇水。检查根的定植水平。第 3 步:将沙子风干,在接种后 15 周 (wpi) 收集,充分混合,并储存在 4 °C 冰箱中。(B) 水稻种子在品红色盒子中发芽。步骤 1 和 2:用水 70% 乙醇对水稻种子消毒 4 分钟 30 秒,并用 3% 的高氯酸钠代替乙醇。将种子摇动 30 分钟,然后用无菌水冲洗 5 次。将种子在含有 0.8% 琼脂的 1/2 Murashige 和 Skoog (MS) 培养基上发芽,在 30 °C 下在黑暗中放置 5 天,在光照下放置 2 天(在 30/28 °C 下昼夜循环 12/12 小时)。第 3 步:第 7~ 10天转移 水稻幼苗。(C) 接种和盐水处理。第 1 步:将水稻幼苗移植到含有无菌沙子的塑料管中,不含 (mock) 或含有 5 mL 含有 不规则根瘤菌 (Ri) 孢子的沙子接种物。植物在 30/28°C 下以 12 小时昼夜循环的生长室中生长,并且植物每周用含有 25 μM 磷酸盐 (Pi) 的一半 Hoagland 溶液生长两次。第 2 步:在 5 wpi 时,将菌根和模拟植物分为两组。一组用 150 mM 氯化钠 (NaCl) 处理(盐水条件),另一组在非盐水条件下生长。第 3 步:在 8 wpi 时,收集所有植株,然后分离芽和根,评估鲜重和干重。 请单击此处查看此图的较大版本。

图 2:Allium tuberosum L 的表型。 (大蒜韭菜)、O. sativa L. japonica cv. Nipponbare(水稻)和 Rhizophagus irregularis(AM 真菌)。 (A) 10 wpi 的菌根大蒜韭菜根的照片。(B) 菌根大蒜韭菜植株在 10 wpi 下的照片。(C) 大蒜韭菜根的真菌定植水平。(D) 菌根稻根在 8 wpi 的照片。(E) 水稻根系真菌定植水平。(F) 盐胁迫下模拟和菌根稻植物的表型。(G) 非盐胁迫下假稻和菌根稻植株的干重,以及 (H) 8 wpi 盐胁迫下菌根稻根系的真菌定植水平。在 (A-C) 中,用 200 个孢子的 AM 真菌 (R. irregularis, Ri) 接种韭菜,在 25 μM 磷酸盐条件下生长,并在接种后 10 周 (wpi) 收获。在图 (D) 和 (E) 中,用水稻植株接种 5 mL 沙子接种物,该沙子接种物来源于大蒜韭菜和 AM 真菌(Rhizophagus irregularis,Ri)之间的共生关系,在 25 μM 磷酸盐条件下生长,并在接种后 8 周收获 (wpi)。在图 (F) 中,水稻植株在没有(模拟)或含沙接种物的情况下生长 5 周,然后用盐溶液(150 mM NaCl)处理 3 周。在图 (A) 和 (D) 中用台盼蓝对根进行染色。在这些面板中,孢子用白色箭头表示,囊泡用白色箭头表示,根外菌丝用黑色箭头表示。比例尺:面板 (A) 和 (D) 中为 100 μm;面板 (B) 中 1 cm;面板 (F) 为 10 cm。缩写:int 菌丝,根内菌丝;外部菌丝,根外菌丝。标准误差由 3-4 次生物学重复计算得出。不同的字母表示处理之间的显著差异(p < 0.05,双因素方差分析后跟事后检验差异最小)。请单击此处查看此图的较大版本。
讨论
有一些关于沙子接种物的制备和使用的小贴士。首先,根据我们的经验,大蒜韭菜的定植水平应高于 70%(图 2C)。否则,对其他植物(如番茄和水稻)的以下接种在接种后 7 周 (wpi) 时将无法成功达到 50% 以上(图 2E)。其次,沙子接种物在储存前应彻底风干,并保存在冰箱的干净塑料袋中,以防止其再次变湿(步骤 1.5)。否则,砂接种物的质量会变差。第三,沙子接种物可以在冰箱中存放约 10 个月,没有任何问题。第四,在将沙子接种物加入花盆中接种其他植物之前,必须通过摇动储袋将沙子接种物充分混合(步骤 3.7)。
关于台盼蓝染色,应将根切成约 1-1.5 厘米长的块进行染色,以便可以用台盼蓝均匀地染色真菌结构(步骤 2.1)。为了准确表示根的菌根定植水平,必须以几乎相等的间隔从根的一端到另一端观察十个视野(步骤 2.7)。
关于模拟稻和菌根稻的盐胁迫处理,用酒精对稻种进行消毒的时间必须精确;否则,会影响水稻的发芽率(步骤 3.2)。由于沙子被用作栽培介质,因此确保水稻在整个生长过程中获得足够的水分非常重要。否则,水稻可能会同时经历干旱和高盐胁迫,从而难以准确评估生长结果(步骤 3.8-3.9)。
通过遵循该方案,可以在水稻品种 Nipponbare 中观察到 AM 增强的盐胁迫耐受性。然而,这种盐胁迫处理是否也可用于观察其他水稻品种的 AM 增强盐胁迫耐受性尚不清楚。如果没有,可以修改一些步骤,例如使用更多的沙子接种物,在 5 wpi 后开始盐胁迫处理,增加盐胁迫的时间段,或在盐胁迫后重新给植物浇水。
AM 真菌是专性共生体,需要宿主根来完成其生命周期,这使得植物性接种物生产对于研究至关重要35。基于基质的系统,其中真菌在蛭石或沙子等材料中生长,提供了一种经济高效的方法来生产大规模接种物。然而,传统方法可能需要长达 120 天的时间,并产生低孢子数36、37、38。最近的改进已将 LED 灯下使用玉米的 90 天缩短到 39 天。在这里,提出了一种使用 Allium tuberosum L. 在短短 10 周内在沙子中产生 Rhizophagus irregularis 孢子的方法。该接种物可用于研究水稻生长、真菌定植和耐盐性,为 AM 共生研究提供有效工具。
披露声明
作者声明他们没有利益冲突。
致谢
我们感谢 Yun-Hsin Chen 建立了研究水稻中 AM 增强盐胁迫耐受性的系统,以及 Kai-Chieh Chang 建立了产生沙子接种物的系统。这项工作得到了台湾国家科学技术委员会 (NSTC 113-2326-B-002 -008 -MY3) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| (NH4)6Mo7O24.4H2O | FERAK | 12054-85-2 | half-strength Hoagland solution |
| Bleach | Gaulix | Gaulix-2108 | rice sterilization |
| Ca(NO3)2.4H2O | Sigma | 13477-34-4 | half-strength Hoagland solution |
| CuSO4.5H2O | Sigma | 7758-99-8 | half-strength Hoagland solution |
| EtOH | Honeywell | 67-63-0 | rice sterilization |
| Fe-citrate | Sigma | 3522-50-7 | half-strength Hoagland solution |
| Garlic chives seeds | KNOWN-YOU SEED Co., LTD. | V-015 | Allium tuberosum L. seeds |
| Glycerol | J.T.Baker | 56-81-5 | Trypan blue staining |
| HCl | Sigma | 7647-01-0 | Trypan blue staining |
| KCl | Merck | 7447-40-7 | half-strength Hoagland solution |
| KH2PO4 | Merck | 7646-93-7 | half-strength Hoagland solution |
| KNO3 | Avantor | 7757-79-1 | half-strength Hoagland solution |
| KOH | Honeywell | 1310-58-3 | Trypan blue staining |
| Lactic acid | Sigma | 50-81-7 | Trypan blue staining |
| MgSO4.7H2O | Sigma | 10034-99-8 | half-strength Hoagland solution |
| MnSO4.H2O | Honeywell | 10034-96-5 | half-strength Hoagland solution |
| MS salts | PhytoTech | M404 | half-strength Murashige–Skoog (1/2 MS) medium |
| Na2B4O7.10H2O | Sigma | 1330-43-4 | half-strength Hoagland solution |
| NaCl | Bioshop | 7647-14-5 | salt stress treatment |
| NaOH | J.T.Baker | 1310-73-2 | half-strength Murashige–Skoog (1/2 MS) medium |
| Rhizophagus irregularis spore | Premier Tech | L-ASP-A | AM fungal spore (MycoriseASP, Premier Tech, Rivière-du-Loup, Québec, Canada ) |
| Sucrose | Bioshop | 57-50-1 | half-strength Murashige–Skoog (1/2 MS) medium |
| Trypan blue | Sigma | 72-57-1 | Trypan blue staining |
| ZnSO4.7H2O | Avantor | 7446-20-0 | half-strength Hoagland solution |
参考文献
- Flowers, T., Yeo, 6. Breeding for salinity resistance in crop plants: Where next. Funct Plant Biol. 22 (6), 875-884 (1995).
- Porcel, R., Aroca, R., Ruiz-Lozano, J. M. Salinity stress alleviation using arbuscular mycorrhizal fungi: A review. Agron Sustain Dev. 32, 181-200 (2012).
- Mukhopadhyay, R., Sarkar, B., Jat, H. S., Sharma, P. C., Bolan, N. S. Soil salinity under climate change: Challenges for sustainable agriculture and food security. J Environ Manage. 15 (280), 111736 (2021).
- Hossain, M. S. Present scenario of global salt-affected soils, its management and importance of salinity research. Int. Res J Biol Sci. 1, 1-3 (2019).
- Hualpa-Ramirez, E., et al. Stress salinity in plants: New strategies to cope with in the foreseeable scenario. Plant Physiol Biochem. 208, 108507 (2024).
- Hussain, S., et al. Effects of salt stress on rice growth, development characteristics, and the regulating ways: A review. J Integr Agric. 16, 2357-2374 (2017).
- Tavakkoli, E., Fatehi, F., Coventry, S., Rengasamy, P., Mcdonald, G. K. Additive effects of Na+ and Cl- ions on barley growth under salinity stress. J Exp Biol. 62 (6), 2189-2203 (2011).
- Flowers, T., Troke, P., Yeo, A. The mechanism of salt tolerance in halophytes. Annu Rev Plant Physiol. 28 (1), 89-121 (1977).
- Shomer, I., Novacky, A. J., Pike, S. M., Yermiyahu, U., Kinraide, T. B. Electrical potentials of plant cell walls in response to the ionic environment. Plant Physiol. 133 (1), 411-422 (2003).
- Sudhir, P., Murthy, S. Effects of salt stress on basic processes of photosynthesis. Photosynthetica. 42 (2), 481-486 (2004).
- Sharma, P., Jha, A. B., Dubey, R. S., Pessarakli, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. J Bot. 2012, 217037 (2012).
- Singh, M., Kumar, J., Singh, V., Prasad, S. Proline and salinity tolerance in plants. Biochem. Pharmacol. 3, e170 (2014).
- Atta, K., et al. Impacts of salinity stress on crop plants: Improving salt tolerance through genetic and molecular dissection. Front. Plant Sci. 14, 1241736 (2023).
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proc Natl Acad Sci USA. 91. 91, 11841-11843 (1994).
- Redecker, D., Kodner, R., Graham, L. E. Glomalean fungi from the Ordovician. Science. 289 (5486), 1920-1921 (2000).
- Harley, J., Smith, S. . Mycorrhizal symbiosis. , (1983).
- Porras-Soriano, A., Soriano-Martin, M. L., Porras-Piedra, A., Azcon, R. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. J Plant Physiol. 166, 1350-1359 (2009).
- Kapoor, R., Evelin, H., Mathur, P., Giri, B. . Plant acclimation to environmental stress. , 359-401 (2013).
- Rivero, J., Ñlvarez, D., Flors, V., Azcón-Aguilar, C., Pozo, M. J. Root metabolic plasticity underlies functional diversity in mycorrhiza-enhanced stress tolerance in tomato. New Phytol. 220 (4), 1322-1336 (2018).
- Begum, N., et al. Role of arbuscular mycorrhizal fungi in plant growth regulation: Implications in abiotic stress tolerance. Front. Plant Sci. 19 (10), 1068 (2019).
- Evelin, H., Kapoor, R. Arbuscular mycorrhizal symbiosis modulates antioxidant response in salt-stressed Trigonella foenum-graecum plants. Mycorrhiza. 24 (3), 197-208 (2014).
- Sarwat, M., et al. Mitigation of NaCl stress by arbuscular mycorrhizal fungi through the modulation of osmolytes, antioxidants and secondary metabolites in mustard (Brassica juncea L.) plants. Front Plant Sci. 7, 869 (2016).
- Evelin, H., Devi, T. S., Gupta, S. R. K. Mitigation of salinity stress in plants by arbuscular mycorrhizal symbiosis: Current understanding and new challenges. Front Plant Sci. 12 (10), 470 (2019).
- Kapoor Giri, R., Mukerji, K. Influence of arbuscular mycorrhizal fungi and salinity on growth, biomass, and mineral nutrition of Acacia auriculiformis. Biol Fertility Soils. 38 (3), 170-175 (2003).
- Giri Mukerji, K. G. Mycorrhizal inoculant alleviates salt stress in Sesbania aegyptiaca and Sesbania grandiflora under field conditions: Evidence for reduced sodium and improved magnesium uptake. Mycorrhiza. 14 (5), 307-312 (2004).
- Colla, G., et al. Alleviation of salt stress by arbuscular mycorrhizal in zucchini plants grown at low and high phosphorus concentrations. Biol Fertility Soils. 44 (3), 501-509 (2008).
- Hammer, E. C., Nasr, H., Pallon, J., Olsson, P. A., Wallander, H. Elemental composition of arbuscular mycorrhizal fungi at high salinity. Mycorrhiza. 21, 117-129 (2011).
- Estrada, B., Aroca, R., Maathuis, F. J., Barea, J. M., Ruiz-Lozano, J. M. Arbuscular mycorrhizal fungi native from a Mediterranean saline area enhance maize tolerance to salinity through improved ion homeostasis. Plant, Cell Environ. 36, 1771-1782 (2013).
- Talaat, N. B., Shawky, B. T. Influence of arbuscular mycorrhizae on yield, nutrients, organic solutes, and antioxidant enzymes of two wheat cultivars under salt stress. J Plant Nutr Soil Sci. 174, 283-291 (2011).
- Chinnusamy, V., Jagendorf, A., Zhu, J. K. Understanding and improving salt tolerance in plants. Crop Sci. 45, 437-448 (2005).
- Porcel, R., et al. Arbuscular mycorrhizal symbiosis ameliorates the optimum quantum yield of photosystem ii and reduces non-photochemical quenching in rice plants subjected to salt stress. J. Plant Physiol. 1 (185), 75-83 (2015).
- Porcel, R., Aroca, R., Azcon, R., Ruiz-Lozano, J. Regulation of cation transporter genes by the arbuscular mycorrhizal symbiosis in rice plants subjected to salinity suggests improved salt tolerance due to reduced Na(+) root-to-shoot distribution. Mycorrhiza. 26 (7), 673-684 (2016).
- Tisarum, R., et al. Alleviation of salt stress in upland rice (Oryza sativa L. ssp. Indica cv. Leum pua) using arbuscular mycorrhizal fungi inoculation. Front Plant Sci. 11, 348 (2020).
- Hsieh, C., Chen, Y., Chang, K., Yang, S. Transcriptome analysis reveals the mechanisms for mycorrhiza-enhanced salt tolerance in rice. Front Plant Sci. 13, 1072171 (2022).
- Roth, R., Paszkowski, U. Plant carbon nourishment of arbuscular mycorrhizal fungi. Curr Opin Plant Biol. 39, 50-56 (2017).
- Ijdo, M., Cranenbrouck, S., Declerck, S. Methods for large-scale production of am fungi: Past, present, and future. Mycorrhiza. 21, 1-16 (2011).
- Genre, A., Bonfante, P. Building a mycorrhizal cell: How to reach compatibility between plants and arbuscular mycorrhizal fungi. J Plant Interact. 1, 3-13 (2005).
- Zuccaro, A., Lahrmann, U., Langen, G. Broad compatibility in fungal root symbioses. Curr Opin Plant Biol. 20, 135-145 (2014).
- Kiddee, S., et al. Improving inoculum production of arbuscular mycorrhizal fungi in Zea mays L. Using light-emitting diode (led) technology. Agronomy. 14 (10), 2342 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。