Method Article
Producción de inóculo fúngico micorrízico arbuscular (AM) y evaluación fenotípica de la simbiosis entre arroz y MA en condiciones salinas
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo describe un protocolo para generar inóculo de hongos micorrízicos arbusculares (AM) para investigar la tolerancia al estrés salino mejorado por AM en arroz.
Resumen
El arroz (Oryza sativa L.) es un cultivo alimentario vital para más de la mitad de la población mundial. Sin embargo, su crecimiento se ve gravemente afectado por los suelos salinos, que presentan un desafío significativo para la producción de cultivos en todo el mundo. Se ha demostrado que los hongos micorrízicos arbusculares (AM), que forman relaciones simbióticas mutualistas con más del 90% de las plantas agrícolas y el 80% de las especies de plantas terrestres, mejoran la tolerancia a la sal de las plantas de arroz. Los hongos AM son simbiontes obligados que no pueden completar su ciclo de vida sin una raíz huésped. Por lo tanto, la utilización efectiva de las plantas para producir inóculo fúngico AM es crucial para avanzar en la investigación en este campo. En este estudio, presentamos una serie de métodos robustos que comienzan con la generación de inóculo de arena que contiene esporas de Rhizophagus irregularis utilizando Allium tuberosum L. Estos métodos incluyen la inoculación de plántulas de arroz con el inóculo de arena, el análisis del fenotipo de crecimiento del arroz micorrícico y la cuantificación de los niveles de colonización fúngica mediante tinción con azul de tripán bajo estrés salino. Estos enfoques pueden generar de manera eficiente inóculo fúngico de AM para futuras investigaciones sobre cómo la simbiosis de AM mejora la tolerancia a la salinidad del arroz.
Introducción
El suelo salino es un obstáculo importante para la producción de cultivos en todo el mundo 1,2,3. Estudios recientes indican que hasta el 50% de las tierras cultivadas estarán degradadas para 2050 debido a la salinización4. Los suelos afectados por la sal causan principalmente toxicidad en las plantas debido a la acumulación de iones de sodio (Na+) y cloruro (Cl-) en los tejidos de las plantas. Estos iones, que dominan los suelos salinos, son también los más dañinos para las plantas 5,6,7. Por ejemplo, el sodio inhibe muchas actividades de las enzimas citosólicas8. El estrés salino también afecta la eficiencia fotosintética e induce cambios en la toxicidad iónica, la presión osmótica y la estructura de la pared celular, lo que conduce colectivamente a la acumulación de especies reactivas de oxígeno (ROS)9,10,11,12,13.
La simbiosis micorrízica arbuscular (AM) es una asociación endosimbiótica entre hongos del filo Glomeromycota y raíces de plantas, que evolucionaron hace aproximadamente 400-450 millones de años con la aparición de las primeras plantas terrestres14,15. Más del 80% de las plantas vasculares pueden ser colonizadas por hongos AM16. Esta relación mutualista mejora la absorción de nutrientes de las plantas en el suelo, mejorando así el crecimiento y la tolerancia al estrés 17,18,19,20. Por ejemplo, durante el estrés salino, los hongos AM pueden mantener el equilibrio iónico y ayudar a mejorar la disponibilidad de agua y nutrientes, la actividad antioxidante, la eficiencia fotosintética y la producción de metabolitos secundarios para las plantas 2,21,22,23. Además, la simbiosis AM evita la absorción excesiva de Na+ y el transporte desde las raíces hasta los brotes, promoviendo la absorción de cationes esenciales como K+, Mg2+ y Ca2+. Este proceso aumenta la relación Mg2+/Na+ o K+/Na+ en plantas en condiciones salinas 23,24,25,26,27,28,29.
El arroz (Oryza sativa L.), un cultivo alimentario crucial para más de la mitad de la población mundial, pertenece a la familia de las gramíneas (Poaceae) y es muy susceptible al estrés salino30. Los estudios también han destacado el papel de los hongos AM en la mejora de la tolerancia al estrés salino en el arroz 31,32,33. Por ejemplo, el hongo AM Claroideoglomus etunicatum mejora la eficiencia de fijación deCO2 del arroz (Oryza sativa L. cv. Puntal) bajo estrés salino31. Además, la expresión de genes clave del transportador de arroz asociados con el secuestro de sodio vacuolar y la recirculación de Na+ de los brotes a las raíces se incrementa en las plantas colonizadas por AM bajo estrés salino32. Además, las plantas de arroz de tierras altas inoculadas con Glomus etunicatum muestran una mayor capacidad fotosintética, una elevada producción de osmolitos, un mayor potencial osmótico y un mayor rendimiento de grano en condiciones salinas33. Nuestra investigación previa también demostró que el arroz micorrícico (Oryza sativaL. cv. Nipponbare) exhibió un mejor crecimiento reproductivo y de brotes, una relación K+/Na+ notablemente más alta en el brote y una mejor capacidad de eliminación de especies reactivas de oxígeno (ROS) debido a la simbiosis AM34. Todos estos hallazgos demuestran el impacto positivo de la simbiosis AM en la tolerancia al estrés salino en el arroz a través de enfoques fenómicos. Sin embargo, los métodos experimentales no han sido publicados en formato de video.
Los hongos AM son simbiontes obligados que requieren una raíz huésped para completar su ciclo de vida, por lo que el uso de plantas para producir inóculo de hongos AM es crucial para el progreso de la investigación35. Un sistema de producción basado en sustratos, en el que los hongos AM se cultivan en sustratos como la vermiculita o la arena y las esporas se recogen para el inóculo36, ofrece una solución rentable para la producción a gran escala de inóculo fúngico AM. La eficiencia de la producción de esporas depende de la compatibilidad y el crecimiento de las plantas, que afectan la colonización y propagación de hongos37,38. Sin embargo, este método suele llevar mucho tiempo, ya que los enfoques tradicionales tardan hasta 120 días y producen una baja producción de esporas. Las mejoras recientes han reducido el período de producción a 90 días utilizando el maíz como planta huésped en condiciones de luz LED39. Sin embargo, se presenta un método robusto para generar inóculo de arena que contiene esporas de Rhizophagus irregularis utilizando Allium tuberosum L. en un plazo de 10 semanas. Este inóculo de arena se puede utilizar para analizar el fenotipo de crecimiento del arroz micorrícico y cuantificar los niveles de colonización fúngica mediante tinción con azul de tripán bajo estrés salino. Estos enfoques generan eficientemente inóculo fúngico AM para una mayor investigación sobre cómo la simbiosis AM mejora la tolerancia a la salinidad del arroz.
Protocolo
Los detalles de los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Generación de inóculo de arena que contiene esporas de Rhizophagus irregularis utilizando Allium tuberosum L.
- Lave la arena con agua del grifo y ábtela en autoclave.
- Agregue 2/3 de la arena a una maceta (diámetro superior 14,7 cm, diámetro inferior 11,5 cm, altura 13 cm). Añadir 1.000 esporas de hongos AM Rhizophagus irregularis. Cubrir con una fina capa de arena. Agrega 30 semillas de cebollino al ajillo (Allium tuberosum L.) y cubre las semillas con arena.
- Cultive las cebolletas de ajo en la cámara con un ciclo día/noche de 16 horas/8 horas a 23,5 °C (55% de humedad relativa). Durante la primera semana (1 semana después de la inoculación, wpi), cubra las cebolletas de ajo con papel de alúmina para bloquear la luz y riéguelas tres veces por semana.
- A partir de 2 wpi, fertilice las cebolletas de ajo dos veces por semana con 80 mL de solución de Hoagland de concentración media que contenga 25 μM KH2PO4. Fertilizar una vez a la semana con 80 mL de agua.
- Después de 10 semanas, coseche las raíces de las cebolletas de ajo para teñirlas con azul tripán para evaluar el nivel de colonización fúngica. Si el nivel de colonización supera el 70%, deje de regar las cebolletas de ajo hasta que la arena esté seca (unas 5 semanas). Coloque todo el inóculo de arena en una bolsa de plástico y guárdelo en una nevera a 4 °C.
2. Tinción con azul de tripano para comprobar el nivel de colonización de hongos
- Incubar los trozos de raíz durante 30 min a >90 °C con 10% de KOH. Retire el KOH.
- Enjuague los trozos de raíz con agua bidestilada (ddH2O) tres veces.
- Incubar los trozos de raíz con HCl 0,3 M durante 15 min a 2 h. Retire el HCl.
- Añadir 1 mL de azul de tripano al 0,1% e incubar las muestras durante 8 min a >90 °C.
- Lavar los trozos de raíz con un 50% de glicerol ácido. Transfiera 10 trozos de raíz a portaobjetos y agregue una gota de 50% de glicerol ácido.
- Selle los cubreobjetos y deslícelos con esmalte de uñas.
- Examine 10 campos de visión de cada raíz bajo un microscopio para registrar la presencia de estructuras fúngicas. Calcula el nivel de colonización fúngica como porcentaje.
NOTA: 50% de glicerol ácido: Preparar mezclando glicerol y 0,3 M de HCl en una proporción de 1:1. 0,1% azul de tripano: Disuelve 100 mg de azul de tripán en una mezcla de ácido láctico 2:1:1, glicerol y ddH2O.
3. Inoculación de plántulas de arroz con inóculo de arena y tratamiento de estrés salino
- Retire la cáscara de las semillas de arroz.
- Esterilizar las semillas con etanol (EtOH) al 70% durante 4 min y 30 s.
- Coloque las semillas de arroz en un tubo centrífugo. Añadir un 3% de lejía (preparada con dH2O estéril) y agitar durante 30 min.
- Retire la lejía y lave las semillas con dH estéril2O 3-4 veces dentro de la campana de flujo laminar.
- Cultive las semillas en un medio Murashige-Skoog (1/2 MS) de concentración media que contenga un 0,8% de agar a 30 °C en la oscuridad durante 5 días.
- Cultive las plántulas de arroz con un ciclo día/noche de 12 horas a 30/28 °C y 70% de humedad del aire durante 2 días.
- Transfiera las plántulas de arroz a tubos de plástico que contengan arena esterilizada. No añadir inóculo (simulado) o 5 mL de inóculo de arena que contenga esporas de Rhizophagus irregularis (Ri).
- Riegue las plantas de arroz con dH2O 7 días a la semana durante la primera semana después de la inoculación. Fertilice las plantas cada dos días con una solución de Hoagland de concentración media que contenga 25 μM de KH2PO4.
- A las 5 semanas después de la inoculación (wpi), trate un lote con 150 mM de NaCl (condición salina) y deje el otro lote sin NaCl (condición no salina).
- Para la condición no salina, riegue las plantas con una solución de Hoagland de concentración media que contenga 25 μM de KH2PO4 el martes y con agua durante el resto de la semana.
- Para la condición salina, riegue las plantas con una solución de Hoagland de concentración media que contenga 25 μM de KH2PO4 el martes, con 150 mM de NaCl el lunes, miércoles y viernes, y con agua durante el resto de la semana.
- A las 8 wpi, coseche las plantas para medir su peso fresco. Coloque las plantas en un horno a 70 °C durante 2 días para medir el peso seco. Analizar el nivel de colonización fúngica mediante tinción con azul de tripano.
Resultados
El flujo de trabajo paso a paso se muestra en la figura 1. A las 10 semanas después de la inoculación (wpi), se observaron claramente estructuras fúngicas como vesículas y esporas, que son características de la simbiosis de la etapa tardía y la AM, dentro de las raíces de las cebolletas de ajo (Figura 2A). Los niveles de hifas intrarradicales, arbúsculo, vesícula, hifas extraradicales y esporas fueron del 80%, 47%, 63%, 4% y 1%, respectivamente, lo que indica la progresión del desarrollo fúngico dentro de las raíces de las cebolletas de ajo. Por lo tanto, el nivel total de colonización alcanzó el 80% (Figura 2C). Estos resultados indicaron que la relación simbiótica entre el cebollino al ajo y los hongos AM se estableció con éxito y que los hongos AM pudieron completar su ciclo de vida y generar más esporas. Utilizando el inóculo de arena generado a partir de la simbiosis entre el cebollino de ajo y los hongos AM, las plantas de arroz fueron colonizadas con éxito por los hongos AM. A las 8 ppp, se observaron vesículas y esporas dentro de las raíces de arroz (Figura 2D), y los niveles de hifas intrarradicales, arbúsculo, vesícula, hifas extraradicales, esporas y estructuras fúngicas totales fueron de 91%, 82%, 95%, 46%, 2% y 93%, respectivamente (Figura 2E). Luego, las plantas de arroz se cultivaron sin (simulado) o con este inóculo de arena durante 5 semanas y luego se trataron sin o con solución salina (150 mM de NaCl) durante 3 semanas. Las plantas micorrícicas exhibieron menos puntas de hoja marchitas que las plantas simuladas bajo estrés salino (Figura 2F). En condiciones no salinas, las plantas de arroz micorrícico mostraron una mayor biomasa de brotes que las simuladas (Figura 2G). Bajo estrés salino, la biomasa de brotes de las plantas simuladas se redujo drásticamente, mientras que las plantas micorrícicas mantuvieron su biomasa de brotes, que fue 1,4 veces mayor que la de las plantas simuladas (Figura 2G). La simbiosis de AM no afectó significativamente a la biomasa radicular en ninguna de las dos condiciones (Figura 2G). Estos resultados sugieren que la simbiosis AM ayuda a las plantas de arroz a mantener un mejor crecimiento de los brotes bajo estrés salino. Los niveles de colonización fúngica alcanzaron el 84% y el 83% en condiciones no salinas y salinas, respectivamente, lo que indica una colonización exitosa de las raíces del arroz por hongos AM. Además, los niveles de hifas extraradicales fueron más altos bajo estrés salino. No se observaron diferencias significativas en otras estructuras fúngicas entre las condiciones no salinas y salinas, lo que sugiere que el estrés salino tuvo un impacto leve en la simbiosis de la MA (Figura 2H).
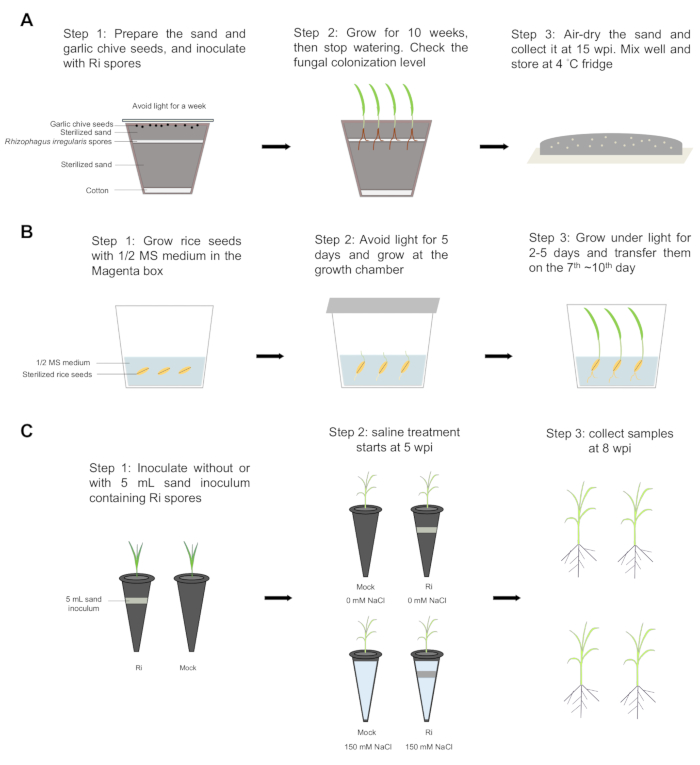
Figura 1: Flujo de trabajo paso a paso. (A) El inóculo de arena se preparó siguiendo los siguientes pasos: Paso 1: Se colocó una capa de algodón en el fondo de la olla y se agregaron 2/3 de arena esterilizada a la olla. Alrededor de 1000-2000 esporas de Rhizophagus irregularis se distribuyeron uniformemente usando puntas cortadas, luego se cubrieron con el 1/3 restante de arena esterilizada. Treinta semillas de Allium tuberosum L. se extendieron uniformemente sobre la superficie de la arena y se cubrieron con papel de alúmina para bloquear la luz. Las plantas se incubaron a 23 °C durante una semana. Paso 2: Las semillas se cultivaron durante 10 semanas a 23 °C con un ciclo de luz/oscuridad de 16/8, luego se detuvo el riego. Se comprobó el nivel de colonización de las raíces. Paso 3: Las arenas se secaron al aire, se recolectaron a las 15 semanas después de la inoculación (wpi), se mezclaron bien y se almacenaron en refrigerador a 4 °C. (B) Las semillas de arroz se germinaron en la caja Magenta. Pasos 1 y 2: Las semillas de arroz se esterilizaron con etanol al 70% durante 4 min 30 s, y el etanol se reemplazó con perclorato de sodio al 3%. Las semillas se agitaron durante 30 minutos y luego se enjuagaron con agua esterilizada cinco veces. Las semillas se germinaron en medio 1/2 Murashige y Skoog (MS) con agar 0.8% durante 5 días en oscuridad a 30 °C y 2 días bajo luz (ciclo día/noche de 12/12 h a 30/28 °C). Paso 3: Las plántulas de arroz se transfirieron el7º ~10º día. (C) Inoculación y tratamiento con solución salina. Paso 1: Las plántulas de arroz se trasplantaron a tubos de plástico que contenían arena esterilizada sin (simulado) o con inóculo de arena de 5 mL que contenía esporas de Rhizophagus irregularis (Ri). Las plantas se cultivaron en una cámara de crecimiento con un ciclo día/noche de 12 horas a 30/28 °C, y las plantas se cultivaron dos veces por semana con media solución de Hoagland con 25 μM de fosfato (Pi). Paso 2: A las 5 ppm, las plantas micorrícicas y simuladas se dividieron en dos grupos. Un grupo fue tratado con 150 mM de cloruro de sodio (NaCl) (condición salina), y el otro grupo fue cultivado en condiciones no salinas. Paso 3: A las 8 wpi, se recolectaron todas las plantas y luego se separaron los brotes y las raíces para evaluar el peso fresco y el peso seco. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Fenotipo de Allium tuberosum L. (ajo, cebollino), O. sativa, L. japonica cv. Nipponbare (arroz) y Rhizophagus irregularis (hongos AM). (A) Fotografía de raíces de cebollino con ajo micorrícico a 10 wpi. (B) Fotografía de plantas de cebollino con ajo micorrícico a 10 wpi. (C) Nivel de colonización fúngica de las raíces de cebollino al ajillo. (D) Fotografía de raíces de arroz micorrícicas a 8 wpi. (E) Nivel de colonización fúngica de las raíces de arroz. (F) El fenotipo de las plantas de arroz simuladas y micorrícicas bajo estrés salino. (G) El peso seco de las plantas de arroz simuladas y micorrícicas bajo estrés no salino y salino, y (H) el nivel de colonización fúngica de las raíces de arroz micorrícicas bajo estrés salino a 8 ppp. En (A-C), las cebolletas de ajo se inocularon con 200 esporas de hongos AM (R. irregularis, Ri), cultivadas en condiciones de fosfato de 25 μM y cosechadas a las 10 semanas después de la inoculación (wpi). En los paneles (D) y (E), las plantas de arroz se inocularon con 5 mL de inóculo de arena derivado de la simbiosis entre el cebollino de ajo y el hongo AM (Rhizophagus irregularis, Ri), cultivadas bajo condiciones de fosfato de 25 μM, y cosechadas a las 8 semanas después de la inoculación (wpi). En el panel (F), las plantas de arroz se cultivaron sin (simulado) o con inóculo de arena que contenía hongos AM (R. irregularis, Ri) durante 5 semanas, seguido de un tratamiento con una solución salina (150 mM de NaCl) durante 3 semanas. Las raíces se tiñeron con azul tripán en los paneles (A) y (D). En estos paneles, las esporas se indican con puntas de flecha blancas, las vesículas con flechas blancas y las hifas extrarradicales con flechas negras. Barras de escala: 100 μm en los paneles (A) y (D); 1 cm en el panel (B); y 10 cm en panel (F). Abreviaturas: hifas int, hifas intrarradicales; Hifas ext hifas extrarradicales. El error estándar se calculó a partir de 3-4 réplicas biológicas. Diferentes letras indican diferencias significativas entre tratamientos (p < 0,05, ANOVA de dos vías seguido de una prueba post hoc con diferencias mínimas significativas). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay algunos consejos sobre la preparación y el uso del inóculo de arena. En primer lugar, según nuestra experiencia, el nivel de colonización del cebollino al ajo debe ser superior al 70% (Figura 2C). De lo contrario, la siguiente inoculación en otras plantas, como el tomate y el arroz, no alcanzará con éxito más del 50% a las 7 semanas después de la inoculación (wpi) (Figura 2E). En segundo lugar, el inóculo de arena debe secarse completamente al aire antes de almacenarlo y guardarse dentro de una bolsa de plástico limpia en el refrigerador para evitar que se vuelva a mojar (paso 1.5). De lo contrario, la calidad del inóculo de arena se deteriorará. En tercer lugar, el inóculo de arena se puede almacenar en la nevera durante unos 10 meses sin ningún problema. En cuarto lugar, el inóculo de arena debe mezclarse bien agitando la bolsa de almacenamiento antes de agregarlo a la maceta para inocular otras plantas (paso 3.7).
Con respecto a la tinción con azul de tripano, las raíces deben cortarse en trozos de aproximadamente 1-1,5 cm de longitud para teñir, de modo que la estructura del hongo se pueda teñir homogéneamente con azul de tripán (paso 2.1). Para representar con precisión el nivel de colonización micorrícica de una raíz, se deben observar diez campos de visión a intervalos casi iguales de un extremo de la raíz al otro (paso 2.7).
En cuanto al tratamiento del estrés salino en arroz simulado y micorrícico, el tiempo para esterilizar las semillas de arroz con alcohol debe ser preciso; de lo contrario, afectará la tasa de germinación del arroz (paso 3.2). Dado que la arena se utiliza como medio de cultivo, es importante asegurarse de que el arroz reciba suficiente agua durante todo el proceso de crecimiento. De lo contrario, el arroz puede experimentar sequía y un alto estrés salino simultáneamente, lo que dificulta la evaluación precisa de los resultados del crecimiento (pasos 3.8-3.9).
Siguiendo este protocolo, se puede observar una tolerancia al estrés salino mejorada por AM en el cultivar de arroz Nipponbare. Sin embargo, no se sabe si este tratamiento de estrés salino también se puede utilizar para observar la tolerancia al estrés salino mejorada por AM en otros cultivares de arroz. De lo contrario, se pueden modificar algunos pasos, como usar más inóculo de arena, comenzar el tratamiento de estrés salino después de 5 ppp, aumentar el período de tiempo para el estrés salino o volver a regar las plantas después del estrés salino.
Los hongos AM son simbiontes obligados que necesitan raíces del huésped para completar su ciclo de vida, lo que hace que la producción de inóculo a base de plantas sea esencial para la investigación35. Los sistemas basados en sustratos, donde los hongos crecen en materiales como la vermiculita o la arena, ofrecen una forma rentable de producir inóculo a gran escala. Sin embargo, los métodos tradicionales pueden tardar hasta 120 días y producir un número bajo de esporas 36,37,38. Las mejoras recientes han reducido esto a 90 días usando maíz bajo luz LED39. En este trabajo se presenta un método para generar esporas de Rhizophagus irregularis en arena utilizando Allium tuberosum L. en tan solo 10 semanas. Este inóculo se puede utilizar para estudiar el crecimiento del arroz, la colonización fúngica y la tolerancia a la salinidad, proporcionando una herramienta eficiente para la investigación de la simbiosis de MA.
Divulgaciones
Los autores declaran que no tienen conflictos de intereses.
Agradecimientos
Reconocemos que Yun-Hsin Chen estableció el sistema para investigar la tolerancia al estrés salino mejorado por AM en el arroz, y Kai-Chieh Chang estableció el sistema para generar inóculo de arena. Este trabajo fue apoyado por subvenciones del Consejo Nacional de Ciencia y Tecnología de Taiwán (NSTC 113-2326-B-002 -008 -MY3).
Materiales
| Name | Company | Catalog Number | Comments |
| (NH4)6Mo7O24.4H2O | FERAK | 12054-85-2 | half-strength Hoagland solution |
| Bleach | Gaulix | Gaulix-2108 | rice sterilization |
| Ca(NO3)2.4H2O | Sigma | 13477-34-4 | half-strength Hoagland solution |
| CuSO4.5H2O | Sigma | 7758-99-8 | half-strength Hoagland solution |
| EtOH | Honeywell | 67-63-0 | rice sterilization |
| Fe-citrate | Sigma | 3522-50-7 | half-strength Hoagland solution |
| Garlic chives seeds | KNOWN-YOU SEED Co., LTD. | V-015 | Allium tuberosum L. seeds |
| Glycerol | J.T.Baker | 56-81-5 | Trypan blue staining |
| HCl | Sigma | 7647-01-0 | Trypan blue staining |
| KCl | Merck | 7447-40-7 | half-strength Hoagland solution |
| KH2PO4 | Merck | 7646-93-7 | half-strength Hoagland solution |
| KNO3 | Avantor | 7757-79-1 | half-strength Hoagland solution |
| KOH | Honeywell | 1310-58-3 | Trypan blue staining |
| Lactic acid | Sigma | 50-81-7 | Trypan blue staining |
| MgSO4.7H2O | Sigma | 10034-99-8 | half-strength Hoagland solution |
| MnSO4.H2O | Honeywell | 10034-96-5 | half-strength Hoagland solution |
| MS salts | PhytoTech | M404 | half-strength Murashige–Skoog (1/2 MS) medium |
| Na2B4O7.10H2O | Sigma | 1330-43-4 | half-strength Hoagland solution |
| NaCl | Bioshop | 7647-14-5 | salt stress treatment |
| NaOH | J.T.Baker | 1310-73-2 | half-strength Murashige–Skoog (1/2 MS) medium |
| Rhizophagus irregularis spore | Premier Tech | L-ASP-A | AM fungal spore (MycoriseASP, Premier Tech, Rivière-du-Loup, Québec, Canada ) |
| Sucrose | Bioshop | 57-50-1 | half-strength Murashige–Skoog (1/2 MS) medium |
| Trypan blue | Sigma | 72-57-1 | Trypan blue staining |
| ZnSO4.7H2O | Avantor | 7446-20-0 | half-strength Hoagland solution |
Referencias
- Flowers, T., Yeo, 6. Breeding for salinity resistance in crop plants: Where next. Funct Plant Biol. 22 (6), 875-884 (1995).
- Porcel, R., Aroca, R., Ruiz-Lozano, J. M. Salinity stress alleviation using arbuscular mycorrhizal fungi: A review. Agron Sustain Dev. 32, 181-200 (2012).
- Mukhopadhyay, R., Sarkar, B., Jat, H. S., Sharma, P. C., Bolan, N. S. Soil salinity under climate change: Challenges for sustainable agriculture and food security. J Environ Manage. 15 (280), 111736 (2021).
- Hossain, M. S. Present scenario of global salt-affected soils, its management and importance of salinity research. Int. Res J Biol Sci. 1, 1-3 (2019).
- Hualpa-Ramirez, E., et al. Stress salinity in plants: New strategies to cope with in the foreseeable scenario. Plant Physiol Biochem. 208, 108507 (2024).
- Hussain, S., et al. Effects of salt stress on rice growth, development characteristics, and the regulating ways: A review. J Integr Agric. 16, 2357-2374 (2017).
- Tavakkoli, E., Fatehi, F., Coventry, S., Rengasamy, P., Mcdonald, G. K. Additive effects of Na+ and Cl- ions on barley growth under salinity stress. J Exp Biol. 62 (6), 2189-2203 (2011).
- Flowers, T., Troke, P., Yeo, A. The mechanism of salt tolerance in halophytes. Annu Rev Plant Physiol. 28 (1), 89-121 (1977).
- Shomer, I., Novacky, A. J., Pike, S. M., Yermiyahu, U., Kinraide, T. B. Electrical potentials of plant cell walls in response to the ionic environment. Plant Physiol. 133 (1), 411-422 (2003).
- Sudhir, P., Murthy, S. Effects of salt stress on basic processes of photosynthesis. Photosynthetica. 42 (2), 481-486 (2004).
- Sharma, P., Jha, A. B., Dubey, R. S., Pessarakli, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. J Bot. 2012, 217037 (2012).
- Singh, M., Kumar, J., Singh, V., Prasad, S. Proline and salinity tolerance in plants. Biochem. Pharmacol. 3, e170 (2014).
- Atta, K., et al. Impacts of salinity stress on crop plants: Improving salt tolerance through genetic and molecular dissection. Front. Plant Sci. 14, 1241736 (2023).
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proc Natl Acad Sci USA. 91. 91, 11841-11843 (1994).
- Redecker, D., Kodner, R., Graham, L. E. Glomalean fungi from the Ordovician. Science. 289 (5486), 1920-1921 (2000).
- Harley, J., Smith, S. . Mycorrhizal symbiosis. , (1983).
- Porras-Soriano, A., Soriano-Martin, M. L., Porras-Piedra, A., Azcon, R. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. J Plant Physiol. 166, 1350-1359 (2009).
- Kapoor, R., Evelin, H., Mathur, P., Giri, B. . Plant acclimation to environmental stress. , 359-401 (2013).
- Rivero, J., Ñlvarez, D., Flors, V., Azcón-Aguilar, C., Pozo, M. J. Root metabolic plasticity underlies functional diversity in mycorrhiza-enhanced stress tolerance in tomato. New Phytol. 220 (4), 1322-1336 (2018).
- Begum, N., et al. Role of arbuscular mycorrhizal fungi in plant growth regulation: Implications in abiotic stress tolerance. Front. Plant Sci. 19 (10), 1068 (2019).
- Evelin, H., Kapoor, R. Arbuscular mycorrhizal symbiosis modulates antioxidant response in salt-stressed Trigonella foenum-graecum plants. Mycorrhiza. 24 (3), 197-208 (2014).
- Sarwat, M., et al. Mitigation of NaCl stress by arbuscular mycorrhizal fungi through the modulation of osmolytes, antioxidants and secondary metabolites in mustard (Brassica juncea L.) plants. Front Plant Sci. 7, 869 (2016).
- Evelin, H., Devi, T. S., Gupta, S. R. K. Mitigation of salinity stress in plants by arbuscular mycorrhizal symbiosis: Current understanding and new challenges. Front Plant Sci. 12 (10), 470 (2019).
- Kapoor Giri, R., Mukerji, K. Influence of arbuscular mycorrhizal fungi and salinity on growth, biomass, and mineral nutrition of Acacia auriculiformis. Biol Fertility Soils. 38 (3), 170-175 (2003).
- Giri Mukerji, K. G. Mycorrhizal inoculant alleviates salt stress in Sesbania aegyptiaca and Sesbania grandiflora under field conditions: Evidence for reduced sodium and improved magnesium uptake. Mycorrhiza. 14 (5), 307-312 (2004).
- Colla, G., et al. Alleviation of salt stress by arbuscular mycorrhizal in zucchini plants grown at low and high phosphorus concentrations. Biol Fertility Soils. 44 (3), 501-509 (2008).
- Hammer, E. C., Nasr, H., Pallon, J., Olsson, P. A., Wallander, H. Elemental composition of arbuscular mycorrhizal fungi at high salinity. Mycorrhiza. 21, 117-129 (2011).
- Estrada, B., Aroca, R., Maathuis, F. J., Barea, J. M., Ruiz-Lozano, J. M. Arbuscular mycorrhizal fungi native from a Mediterranean saline area enhance maize tolerance to salinity through improved ion homeostasis. Plant, Cell Environ. 36, 1771-1782 (2013).
- Talaat, N. B., Shawky, B. T. Influence of arbuscular mycorrhizae on yield, nutrients, organic solutes, and antioxidant enzymes of two wheat cultivars under salt stress. J Plant Nutr Soil Sci. 174, 283-291 (2011).
- Chinnusamy, V., Jagendorf, A., Zhu, J. K. Understanding and improving salt tolerance in plants. Crop Sci. 45, 437-448 (2005).
- Porcel, R., et al. Arbuscular mycorrhizal symbiosis ameliorates the optimum quantum yield of photosystem ii and reduces non-photochemical quenching in rice plants subjected to salt stress. J. Plant Physiol. 1 (185), 75-83 (2015).
- Porcel, R., Aroca, R., Azcon, R., Ruiz-Lozano, J. Regulation of cation transporter genes by the arbuscular mycorrhizal symbiosis in rice plants subjected to salinity suggests improved salt tolerance due to reduced Na(+) root-to-shoot distribution. Mycorrhiza. 26 (7), 673-684 (2016).
- Tisarum, R., et al. Alleviation of salt stress in upland rice (Oryza sativa L. ssp. Indica cv. Leum pua) using arbuscular mycorrhizal fungi inoculation. Front Plant Sci. 11, 348 (2020).
- Hsieh, C., Chen, Y., Chang, K., Yang, S. Transcriptome analysis reveals the mechanisms for mycorrhiza-enhanced salt tolerance in rice. Front Plant Sci. 13, 1072171 (2022).
- Roth, R., Paszkowski, U. Plant carbon nourishment of arbuscular mycorrhizal fungi. Curr Opin Plant Biol. 39, 50-56 (2017).
- Ijdo, M., Cranenbrouck, S., Declerck, S. Methods for large-scale production of am fungi: Past, present, and future. Mycorrhiza. 21, 1-16 (2011).
- Genre, A., Bonfante, P. Building a mycorrhizal cell: How to reach compatibility between plants and arbuscular mycorrhizal fungi. J Plant Interact. 1, 3-13 (2005).
- Zuccaro, A., Lahrmann, U., Langen, G. Broad compatibility in fungal root symbioses. Curr Opin Plant Biol. 20, 135-145 (2014).
- Kiddee, S., et al. Improving inoculum production of arbuscular mycorrhizal fungi in Zea mays L. Using light-emitting diode (led) technology. Agronomy. 14 (10), 2342 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados