Method Article
アーバスキュラー菌根(AM)真菌接種物の作製と生理食塩水条件下でのイネとAM共生の表現型評価
要約
この記事では、イネのAM増強塩ストレス耐性を調査するために、アーバスキュラー菌根(AM)真菌接種物を生成するためのプロトコルについて説明します。
要約
米(Oryza sativa L.)は、世界人口の半数以上にとって重要な食用作物です。しかし、その成長は塩分の多い土壌によって深刻な影響を受け、世界中の作物生産に大きな課題をもたらしています。農業植物の90%以上、陸生植物種の80%以上と共生関係を形成するアーバスキュラー菌根(AM)菌は、イネの耐塩性を高めることが示されています。AM菌類は、宿主根なしではライフサイクルを完了できない義務的な共生生物です。したがって、植物を有効活用してAM菌を作製することは、この分野の研究を進める上で非常に重要です。本研究では、Allium tuberosum Lを用いてRhizophagus irregularisの胞子を含む砂接種物を生成することから始まる一連の頑健な方法を紹介する。これらの方法には、イネの苗に砂の接種を施すこと、菌根イネの成長表現型の分析、塩ストレス下でのトリパンブルー染色を使用した真菌のコロニー形成レベルの定量化が含まれます。これらのアプローチは、AM共生がイネの塩分耐性をどのように強化するかをさらに調査するために、AM真菌接種物を効率的に生成できます。
概要
塩分の多い土壌は、世界中の作物生産にとって重大な障害となっています1,2,3。最近の研究では、2050年までに耕作地の最大50%が塩類化によって劣化することが分かっています4。塩分の影響を受けた土壌は、植物組織にナトリウム(Na+)イオンと塩化物(Cl-)イオンが蓄積するため、主に植物に毒性を引き起こします。これらのイオンは、塩分の多い土壌を支配しており、植物にとって最も有害でもあります5,6,7。例えば、ナトリウムは多くの細胞質酵素活性を阻害する8。塩ストレスはまた、光合成効率に影響を及ぼし、イオン毒性、浸透圧、および細胞壁構造の変化を誘発し、全体として活性酸素種(ROS)の蓄積につながります9,10,11,12,13。
アーバスキュラー菌根(AM)の共生は、Glomeromycota門の真菌と植物の根との間の内部共生関係であり、これは約4億〜4億5000万年前に初期の陸上植物の出現とともに進化しました14,15。維管束植物の80%以上は、AM菌によってコロニーを形成することができます16。この共生関係は、土壌からの植物栄養素の取り込みを促進し、それによって成長とストレス耐性を改善します17,18,19,20。例えば、塩ストレスの間、AM菌はイオンバランスを維持し、水と栄養素の利用可能性、抗酸化活性、光合成効率、および植物の二次代謝産物産生を向上させるのに役立ちます2,21,22,23。さらに、AM共生は、Na+の過剰な取り込みと根から新芽への輸送を防ぎ、K+、Mg2+、Ca2+などの必須カチオンの吸収を促進します。このプロセスは、生理食塩水条件下で植物におけるMg2+/Na+またはK+/Na+比を増加させる23,24,25,26,27,28,29。
イネ(Oryza sativa L.)は、世界人口の半数以上にとって重要な食用作物であり、イネ科(イネ科)に属し、塩ストレスの影響を非常に受けやすい30。研究はまた、イネの塩ストレス耐性を高める上でのAM菌の役割を強調しています31,32,33。例えば、AM菌Claroideoglomus etunicatumは、塩ストレス下でのイネ(Oryza sativa L. cv. Puntal)のCO2固定効率を改善する31。さらに、液胞ナトリウム隔離および新芽から根へのNa+再循環に関連する主要なイネトランスポーター遺伝子の発現は、塩ストレス下でAMコロニー化された植物で増強される32。さらに、Glomus etunicatumを接種した陸稲は、塩水条件下での光合成能力の向上、浸透圧生産の増加、浸透圧能の向上、および穀物収量の増加を示します33。また、本研究の先行研究では、菌根イネ(Oryza sativaL. cv. Nipponbare)が、AM共生により、新芽と生殖生長が良好であること、新芽のK+/Na+比が著しく高いこと、およびAM共生により活性酸素種(ROS)の清掃能力が向上することも示された34。これらの知見はすべて、フェノミックアプローチを通じて、AM共生がイネの塩ストレス耐性にプラスの影響を与えることを示しています。ただし、実験方法はビデオ形式で公開されていません。
AM菌類は、ライフサイクルを完了するために宿主根を必要とする必須の共生生物であり、植物を使用してAM菌種を産生することは、研究の進行にとって非常に重要です35。バーミキュライトや砂などの基質でAM菌を増殖させ、胞子を採取して接種36を行う基質ベースの生産システムは、大規模なAM菌の接種物生産に費用対効果の高いソリューションを提供します。胞子生産の効率は、植物の適合性と成長に依存し、真菌のコロニー形成と繁殖に影響を与えます37,38。ただし、この方法は時間がかかることが多く、従来のアプローチでは最大120日かかり、胞子の生成は少なくなります。最近の改良により、LED照明条件下でトウモロコシをホストプラントとして使用すると、生産期間が90日に短縮されました39。しかし、10週間以内にAllium tuberosum L.を使用してRhizophagus irregularisの胞子を含む砂接種物を生成するための堅牢な方法が提示されています。この砂接種物は、菌根イネの成長表現型を分析し、塩ストレス下でのトリパンブルー染色を使用して真菌のコロニー形成レベルを定量化するために使用できます。これらのアプローチは、AM共生がイネの塩分耐性をどのように強化するかをさらに調査するために、AM真菌接種物を効率的に生成します。
プロトコル
本試験で使用した試薬および装置の詳細は、材料表に記載されています。
1. Allium tuberosum Lを用いたRhizophagus irregularisの胞子を含む砂接種物の生成。
- 水道水で砂を洗い、オートクレーブします。
- 鍋に砂の2/3を加えます(上部の直径14.7cm、下部の直径11.5cm、高さ13cm)。AM菌 Rhizophagus irregularisの胞子を1,000個追加します。薄い砂の層で覆います。にんにくチャイブ(Allium tuberosum L.)の30種を加え、種を砂で覆います。
- にんにくチャイブをチャンバー内で、23.5°C(相対湿度55%)で16時間/8時間の昼夜サイクルで育てます。最初の1週間(接種後1週間、wpi)は、にんにくをアルミナ紙で覆って光を遮断し、週に3回水をやります。
- 2 wpiから始めて、にんにくを週に2回、25μMのKH2PO4を含む80mLの半強度のHoagland溶液で施肥します。週に一度、80mLの水で施肥します。
- 10週間後、ニンニクチャイブの根を収穫してトリパンブルー染色し、真菌のコロニー形成のレベルを評価します。コロニー形成レベルが70%を超える場合は、砂が乾くまで(約5週間)にニンニクチャイブに水をやめます。すべての砂の接種物をビニール袋に入れ、4°Cの冷蔵庫で保管します。
2. 真菌のコロニー形成レベルを確認するためのトリパンブルー染色
- 根片を10%KOH中、>90°Cで30分間インキュベートします。KOHを取り外します。
- 根片を二重蒸留水(ddH2O)で3回すすいでください。
- 根片を0.3 M HClで15分から2時間インキュベートします。HClを取り外します。
- 0.1%トリパンブルー1mLを加え、サンプルを>90°Cで8分間インキュベートします。
- 根片を50%酸性グリセロールで洗います。10個の根片をスライドに移し、50%酸性グリセロールを一滴加えます。
- カバースリップを密封し、マニキュアでスライドさせます。
- 顕微鏡で各根の10の視野を調べて、真菌構造の存在を記録します。真菌のコロニー形成レベルをパーセンテージで計算します。
注:50%酸性グリセロール:グリセロールと0.3 M HClを1:1の比率で混合して調製します。0.1%トリパンブルー:100mgのトリパンブルーを2:1:1乳酸、グリセロール、およびddH2Oの混合物に溶解します。
3. イネ苗への砂接種と塩ストレス処理
- 米の種から外皮(殻)を取り除きます。
- 種子を70%エタノール(EtOH)で4分間30秒間滅菌します。
- 米の種を遠心分離管に入れます。3%漂白剤(滅菌dH2Oで調製)を加え、30分間振とうします。
- 漂白剤を取り除き、種子を無菌dH2O 3〜4回、層流フード内で洗浄します。
- 0.8%寒天を含む半量のMurashige-Skoog培地(1/2 MS)で、30°Cの暗所で5日間種子を育てます。
- 30/28°C、湿度70%の場所で12時間の昼夜サイクルで2日間、稲の苗を育てます。
- 米の苗を滅菌した砂の入ったプラスチックチューブに移します。接種なし(模擬)または Rhizophagus irregularis (Ri)の胞子を含む5mLの砂接種液を追加します。
- 接種後の最初の週は、週7日、dH2Oで稲に水をやります。25μMのKH2PO4を含む半強度のHoagland溶液で2日おきに植物を施肥します。
- 接種後5週間(wpi)で、1つのバッチを150 mMのNaClで処理し(生理食塩水)、もう1つのバッチをNaClなしで放置します(非生理食塩水)。
- 非生理食塩水の状態では、火曜日に25μMのKH2PO4を含む半強度のHoagland溶液で植物に水をやり、残りの週は水で水をやります。
- 生理食塩水の状態では、火曜日に25 μMのKH2PO4を含む半強度のHoagland溶液で植物に水をやり、月曜日、水曜日、金曜日に150 mMのNaClで水をやり、残りの週は水で水をやります。
- 8 wpiで、植物を収穫して新鮮な重量を測定します。植物を70°Cのオーブンに2日間置き、乾燥重量を測定します。トリパンブルー染色により真菌のコロニー形成レベルを分析します。
結果
ステップ バイ ステップのワークフローを 図 1 に示します。接種後10週(wpi)には、ニンニクの根の内部に、後期とAM共生の特徴である小胞や胞子などの真菌構造がはっきりと観察されました(図2A)。根治内菌糸、アーバスキュール、小胞、根治外菌糸、胞子のレベルはそれぞれ80%、47%、63%、4%、1%であり、ニラの根の内部での真菌発生の進行を示しています。したがって、総コロニー形成レベルは80%に達しました(図2C)。これらの結果は、ニラとAM菌の共生関係が成功裏に確立され、AM菌がライフサイクルを完了し、より多くの胞子を生成することができたことを示しました。ニラとAM菌の共生から生じる砂の接種菌を用いて、イネはAM菌のコロニー形成に成功しました。8 wpiでは、イネの根の内部に小胞と胞子が観察され(図2D)、根内菌糸、アーバスキュール、小胞、根治菌糸、胞子、および全真菌構造のレベルは、それぞれ91%、82%、95%、46%、2%、および93%でした(図2E)。次に、イネをこの砂接種物なしで(模擬)またはこの砂接種物で5週間育て、次に塩溶液(150 mMのNaCl)なしでまたは3週間処理しました。菌根植物は、塩分ストレス下で模擬植物よりもしおれた刃先が少なかった(図2F)。非生理食塩水条件下では、菌根イネは模擬イネよりも高いシュートバイオマスを示しました(図2G)。塩ストレス下では、模擬植物のシュートバイオマスは大幅に減少しましたが、菌根植物はモック植物の1.4倍のシュートバイオマスを維持しました(図2G)。AM共生は、どちらの条件下でも根バイオマスに大きな影響を与えませんでした(図2G)。これらの結果は、AM共生がイネが塩分ストレス下でより良いシュート成長を維持するのを助けることを示唆しています。真菌のコロニー形成レベルは、非生理食塩水と生理食塩水の条件下でそれぞれ84%と83%に達し、AM菌によるイネの根のコロニー形成が成功したことを示しています。さらに、エクストララジカル菌糸のレベルは、塩ストレス下で高かった。非生理食塩水と生理食塩水の状態の間で他の真菌構造には有意差は観察されず、塩ストレスがAM共生に軽度の影響を与えたことが示唆されています(図2H)。
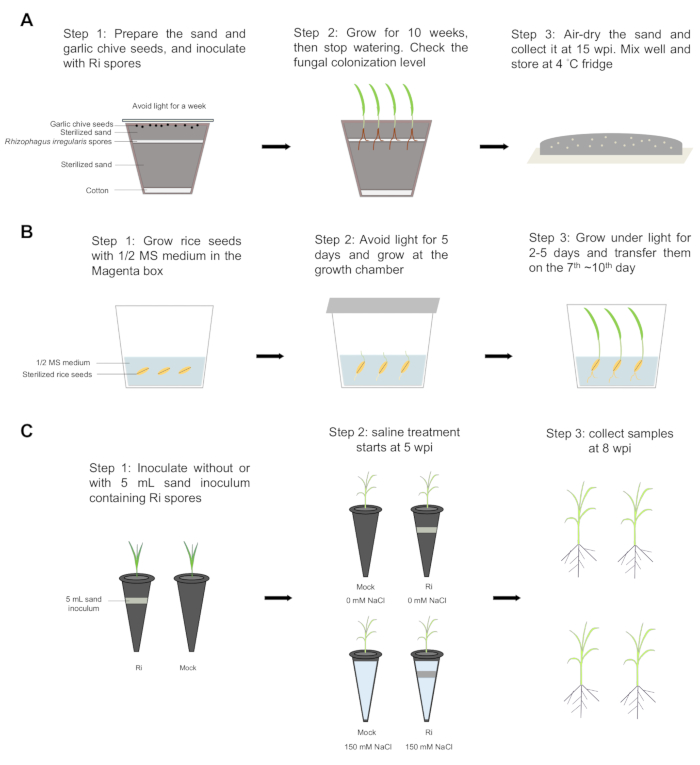
図 1: ステップバイステップのワークフロー。 (A)砂の接種物は、次の手順を使用して調製されました:ステップ1:綿の層をポットの底に置き、滅菌した砂の2/3をポットに追加しました。約1000〜2000個の Rhizophagus irregularis 胞子をカットチップを使用して均等に広げ、残りの1/3の滅菌砂で覆いました。30個の Allium tuberosum L. の種子を砂の表面に均等に広げ、光を遮断するためにアルミナ紙で覆いました。植物を23°Cで1週間インキュベートしました。ステップ2:種子を23°Cで10週間、明暗サイクル16/8で育てた後、水やりを止めました。根のコロニー形成レベルを確認しました。ステップ3:砂を風乾し、接種後15週間(wpi)に収集し、よく混合し、4°C冷蔵庫で保存しました。(B)マゼンタの箱の中でイネの種子を発芽させた。ステップ1および2:イネの種子を70%エタノールで4分30秒間滅菌し、エタノールを3%の過塩素酸ナトリウムに置き換えました。種子を30分間振とうした後、滅菌水で5回すすいだ。種子は、0.8%寒天培地を含む1/2 Murashige and Skoog (MS) mediumで、30°Cの暗所で5日間、および光の下で2日間(30/28°Cで12/12時間の昼夜サイクル)発芽しました。ステップ3:米の苗は7~ 10日目 に移されました。(C)接種と生理食塩水治療。ステップ1:イネの苗木を、滅菌砂を含まないプラスチックチューブ(模擬)または Rhizophagus irregularis (Ri)胞子を含む5mLの砂接種物に移植しました。植物は、30/28°Cで12時間の昼夜サイクルの成長チャンバーで栽培され、植物は25μMのリン酸(Pi)を含む半分のホーグランド溶液で週に2回栽培されました。ステップ2:5 wpiで、菌根植物と模擬植物を2つのグループに分けました。1つのグループは150 mMの塩化ナトリウム(NaCl)で処理し(生理食塩水の状態)、もう1つのグループは生理食塩水を含まない条件下で増殖しました。ステップ3:8 wpiで、すべての植物が収集され、次に芽と根が分離されて、新鮮な重量と乾燥した重量が評価されました。 この図の拡大版を表示するには、ここをクリックしてください。

図2:Allium tuberosum Lの表現型。 (ニンニクチャイブ)、O. sativa L. japonica cv. Nipponbare(米)、Rhizophagus irregularis(AM菌)。 (A)10 wpiの菌根ニンニクチャイブの根の写真。(B)10 wpiの菌根ニンニクチャイブ植物の写真。(C)ニンニクチャイブの根の真菌コロニー形成レベル。(D)8 wpiの菌根イネの根の写真。(E)イネの根の真菌コロニー形成レベル。(F)塩ストレス下でのモックイネと菌根イネの表現型。(G)非塩水および塩ストレス下でのモックイネおよび菌根イネの乾燥重量、および(H)塩ストレス下での菌根イネ根の真菌コロニー形成レベル(8 wpi)。(A-C)では、ニンニクチャイブにAM菌(R. irregularis, Ri)の胞子200個を接種し、25μMリン酸条件下で増殖させ、接種後10週間(wpi)で収穫した。パネル(D)と(E)では、ニラとAM菌(Rhizophagus irregularis, Ri)との共生に由来する砂接種液5mLをイネに接種し、25μMリン酸条件下で育て、接種後8週間(wpi)で収穫した。パネル(F)では、イネを無添加(模擬)またはAM菌(R. irregularis, Ri)を含む砂接種液で5週間育て、続いて塩水(150 mMのNaCl)で3週間処理した。根はパネル(A)と(D)でトリパンブルーで染色されました。これらのパネルでは、胞子は白い矢印で、小胞は白い矢印で、過激な菌糸は黒い矢印で示されます。スケールバー:パネル(A)および(D)に100μm。パネル(B)に1 cm。パネル(F)で10cm。略語:int hyphae、intraradical hyphae;ext菌糸、超ラジカル菌糸。標準誤差は、3〜4回の生物学的レプリケートから計算しました。異なる文字は、治療間の有意差を示します(p < 0.05、二元配置分散分析とそれに続く最小有意差の事後検定)。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
砂の接種物の準備と使用に関するいくつかのヒントがあります。まず、私たちの経験から、ニンニクチャイブのコロニー形成レベルは70%より高くなければなりません(図2C)。そうしないと、トマトや米などの他の植物への次の接種は、接種後7週間(wpi)で50%以上に達することはありません(図2E)。次に、砂の接種物は、保管する前に完全に風乾し、再び濡れるのを防ぐために冷蔵庫の清潔なビニール袋に入れておく必要があります(ステップ1.5)。そうしないと、砂の接種物の品質が低下します。第三に、砂の接種物は冷蔵庫で約10か月間問題なく保存できます。第四に、砂の接種物は、他の植物に接種するためにポットに追加する前に、保存袋を振って完全に混合する必要があります(ステップ3.7)。
トリパンブルー染色については、根を長さ1〜1.5cm程度に切って染色し、トリパンブルーで菌類の構造を均一に染色します(ステップ2.1)。根の菌根コロニー形成レベルを正確に表すには、根の一方の端からもう一方の端までほぼ等間隔で10の視野を観察する必要があります(ステップ2.7)。
モック米と菌根米の塩ストレス治療に関しては、米の種子をアルコールで殺菌する時間は正確でなければなりません。そうしないと、米の発芽率に影響します(ステップ3.2)。栽培培地として砂を使用するため、成長プロセス全体を通じて米に十分な水を供給することが重要です。そうしないと、米は干ばつと高い塩ストレスを同時に経験する可能性があり、成長結果を正確に評価することが困難になります(ステップ3.8-3.9)。
このプロトコルに従うことにより、AMで強化された塩ストレス耐性がイネ品種のNipponbareで観察されます。しかし、この塩ストレス処理が他のイネ品種のAM増強塩ストレス耐性の観察にも利用できるかどうかは不明です。そうでない場合は、より多くの砂接種材料を使用する、5 WPI後に塩ストレス治療を開始する、塩ストレスの期間を増やす、または塩ストレス後に植物に再水をやるなど、いくつかの手順を変更できます。
AM菌類は、ライフサイクルを完了するために宿主根を必要とする必須の共生生物であり、植物ベースの接種物生産は研究に不可欠です35。バーミキュライトや砂などの材料で菌類が増殖する基質ベースのシステムは、大規模な接種物を製造するための費用対効果の高い方法を提供します。しかし、従来の方法では最大120日かかり、胞子数が少なくなることがあります36,37,38。最近の改良により、LEDライト39の下でトウモロコシを使用してこれを90日に短縮しました。ここでは、Allium tuberosum L.を用いて砂中にRhizophagus irregularis胞子をわずか10週間で作製する方法を紹介します。この接種物は、イネの成長、真菌のコロニー形成、および塩分耐性の研究に使用でき、AM共生研究のための効率的なツールを提供します。
開示事項
著者は、利益相反がないことを宣言します。
謝辞
Yun-Hsin Chen氏がイネのAM増強塩ストレス耐性を調査するシステムを確立し、Kai-Chieh Chang氏が砂の接種材料を生成するシステムを確立したことを認めます。この研究は、台湾の国家科学技術評議会(NSTC 113-2326-B-002 -008 -MY3)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| (NH4)6Mo7O24.4H2O | FERAK | 12054-85-2 | half-strength Hoagland solution |
| Bleach | Gaulix | Gaulix-2108 | rice sterilization |
| Ca(NO3)2.4H2O | Sigma | 13477-34-4 | half-strength Hoagland solution |
| CuSO4.5H2O | Sigma | 7758-99-8 | half-strength Hoagland solution |
| EtOH | Honeywell | 67-63-0 | rice sterilization |
| Fe-citrate | Sigma | 3522-50-7 | half-strength Hoagland solution |
| Garlic chives seeds | KNOWN-YOU SEED Co., LTD. | V-015 | Allium tuberosum L. seeds |
| Glycerol | J.T.Baker | 56-81-5 | Trypan blue staining |
| HCl | Sigma | 7647-01-0 | Trypan blue staining |
| KCl | Merck | 7447-40-7 | half-strength Hoagland solution |
| KH2PO4 | Merck | 7646-93-7 | half-strength Hoagland solution |
| KNO3 | Avantor | 7757-79-1 | half-strength Hoagland solution |
| KOH | Honeywell | 1310-58-3 | Trypan blue staining |
| Lactic acid | Sigma | 50-81-7 | Trypan blue staining |
| MgSO4.7H2O | Sigma | 10034-99-8 | half-strength Hoagland solution |
| MnSO4.H2O | Honeywell | 10034-96-5 | half-strength Hoagland solution |
| MS salts | PhytoTech | M404 | half-strength Murashige–Skoog (1/2 MS) medium |
| Na2B4O7.10H2O | Sigma | 1330-43-4 | half-strength Hoagland solution |
| NaCl | Bioshop | 7647-14-5 | salt stress treatment |
| NaOH | J.T.Baker | 1310-73-2 | half-strength Murashige–Skoog (1/2 MS) medium |
| Rhizophagus irregularis spore | Premier Tech | L-ASP-A | AM fungal spore (MycoriseASP, Premier Tech, Rivière-du-Loup, Québec, Canada ) |
| Sucrose | Bioshop | 57-50-1 | half-strength Murashige–Skoog (1/2 MS) medium |
| Trypan blue | Sigma | 72-57-1 | Trypan blue staining |
| ZnSO4.7H2O | Avantor | 7446-20-0 | half-strength Hoagland solution |
参考文献
- Flowers, T., Yeo, 6. Breeding for salinity resistance in crop plants: Where next. Funct Plant Biol. 22 (6), 875-884 (1995).
- Porcel, R., Aroca, R., Ruiz-Lozano, J. M. Salinity stress alleviation using arbuscular mycorrhizal fungi: A review. Agron Sustain Dev. 32, 181-200 (2012).
- Mukhopadhyay, R., Sarkar, B., Jat, H. S., Sharma, P. C., Bolan, N. S. Soil salinity under climate change: Challenges for sustainable agriculture and food security. J Environ Manage. 15 (280), 111736 (2021).
- Hossain, M. S. Present scenario of global salt-affected soils, its management and importance of salinity research. Int. Res J Biol Sci. 1, 1-3 (2019).
- Hualpa-Ramirez, E., et al. Stress salinity in plants: New strategies to cope with in the foreseeable scenario. Plant Physiol Biochem. 208, 108507 (2024).
- Hussain, S., et al. Effects of salt stress on rice growth, development characteristics, and the regulating ways: A review. J Integr Agric. 16, 2357-2374 (2017).
- Tavakkoli, E., Fatehi, F., Coventry, S., Rengasamy, P., Mcdonald, G. K. Additive effects of Na+ and Cl- ions on barley growth under salinity stress. J Exp Biol. 62 (6), 2189-2203 (2011).
- Flowers, T., Troke, P., Yeo, A. The mechanism of salt tolerance in halophytes. Annu Rev Plant Physiol. 28 (1), 89-121 (1977).
- Shomer, I., Novacky, A. J., Pike, S. M., Yermiyahu, U., Kinraide, T. B. Electrical potentials of plant cell walls in response to the ionic environment. Plant Physiol. 133 (1), 411-422 (2003).
- Sudhir, P., Murthy, S. Effects of salt stress on basic processes of photosynthesis. Photosynthetica. 42 (2), 481-486 (2004).
- Sharma, P., Jha, A. B., Dubey, R. S., Pessarakli, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. J Bot. 2012, 217037 (2012).
- Singh, M., Kumar, J., Singh, V., Prasad, S. Proline and salinity tolerance in plants. Biochem. Pharmacol. 3, e170 (2014).
- Atta, K., et al. Impacts of salinity stress on crop plants: Improving salt tolerance through genetic and molecular dissection. Front. Plant Sci. 14, 1241736 (2023).
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proc Natl Acad Sci USA. 91. 91, 11841-11843 (1994).
- Redecker, D., Kodner, R., Graham, L. E. Glomalean fungi from the Ordovician. Science. 289 (5486), 1920-1921 (2000).
- Harley, J., Smith, S. . Mycorrhizal symbiosis. , (1983).
- Porras-Soriano, A., Soriano-Martin, M. L., Porras-Piedra, A., Azcon, R. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. J Plant Physiol. 166, 1350-1359 (2009).
- Kapoor, R., Evelin, H., Mathur, P., Giri, B. . Plant acclimation to environmental stress. , 359-401 (2013).
- Rivero, J., Ñlvarez, D., Flors, V., Azcón-Aguilar, C., Pozo, M. J. Root metabolic plasticity underlies functional diversity in mycorrhiza-enhanced stress tolerance in tomato. New Phytol. 220 (4), 1322-1336 (2018).
- Begum, N., et al. Role of arbuscular mycorrhizal fungi in plant growth regulation: Implications in abiotic stress tolerance. Front. Plant Sci. 19 (10), 1068 (2019).
- Evelin, H., Kapoor, R. Arbuscular mycorrhizal symbiosis modulates antioxidant response in salt-stressed Trigonella foenum-graecum plants. Mycorrhiza. 24 (3), 197-208 (2014).
- Sarwat, M., et al. Mitigation of NaCl stress by arbuscular mycorrhizal fungi through the modulation of osmolytes, antioxidants and secondary metabolites in mustard (Brassica juncea L.) plants. Front Plant Sci. 7, 869 (2016).
- Evelin, H., Devi, T. S., Gupta, S. R. K. Mitigation of salinity stress in plants by arbuscular mycorrhizal symbiosis: Current understanding and new challenges. Front Plant Sci. 12 (10), 470 (2019).
- Kapoor Giri, R., Mukerji, K. Influence of arbuscular mycorrhizal fungi and salinity on growth, biomass, and mineral nutrition of Acacia auriculiformis. Biol Fertility Soils. 38 (3), 170-175 (2003).
- Giri Mukerji, K. G. Mycorrhizal inoculant alleviates salt stress in Sesbania aegyptiaca and Sesbania grandiflora under field conditions: Evidence for reduced sodium and improved magnesium uptake. Mycorrhiza. 14 (5), 307-312 (2004).
- Colla, G., et al. Alleviation of salt stress by arbuscular mycorrhizal in zucchini plants grown at low and high phosphorus concentrations. Biol Fertility Soils. 44 (3), 501-509 (2008).
- Hammer, E. C., Nasr, H., Pallon, J., Olsson, P. A., Wallander, H. Elemental composition of arbuscular mycorrhizal fungi at high salinity. Mycorrhiza. 21, 117-129 (2011).
- Estrada, B., Aroca, R., Maathuis, F. J., Barea, J. M., Ruiz-Lozano, J. M. Arbuscular mycorrhizal fungi native from a Mediterranean saline area enhance maize tolerance to salinity through improved ion homeostasis. Plant, Cell Environ. 36, 1771-1782 (2013).
- Talaat, N. B., Shawky, B. T. Influence of arbuscular mycorrhizae on yield, nutrients, organic solutes, and antioxidant enzymes of two wheat cultivars under salt stress. J Plant Nutr Soil Sci. 174, 283-291 (2011).
- Chinnusamy, V., Jagendorf, A., Zhu, J. K. Understanding and improving salt tolerance in plants. Crop Sci. 45, 437-448 (2005).
- Porcel, R., et al. Arbuscular mycorrhizal symbiosis ameliorates the optimum quantum yield of photosystem ii and reduces non-photochemical quenching in rice plants subjected to salt stress. J. Plant Physiol. 1 (185), 75-83 (2015).
- Porcel, R., Aroca, R., Azcon, R., Ruiz-Lozano, J. Regulation of cation transporter genes by the arbuscular mycorrhizal symbiosis in rice plants subjected to salinity suggests improved salt tolerance due to reduced Na(+) root-to-shoot distribution. Mycorrhiza. 26 (7), 673-684 (2016).
- Tisarum, R., et al. Alleviation of salt stress in upland rice (Oryza sativa L. ssp. Indica cv. Leum pua) using arbuscular mycorrhizal fungi inoculation. Front Plant Sci. 11, 348 (2020).
- Hsieh, C., Chen, Y., Chang, K., Yang, S. Transcriptome analysis reveals the mechanisms for mycorrhiza-enhanced salt tolerance in rice. Front Plant Sci. 13, 1072171 (2022).
- Roth, R., Paszkowski, U. Plant carbon nourishment of arbuscular mycorrhizal fungi. Curr Opin Plant Biol. 39, 50-56 (2017).
- Ijdo, M., Cranenbrouck, S., Declerck, S. Methods for large-scale production of am fungi: Past, present, and future. Mycorrhiza. 21, 1-16 (2011).
- Genre, A., Bonfante, P. Building a mycorrhizal cell: How to reach compatibility between plants and arbuscular mycorrhizal fungi. J Plant Interact. 1, 3-13 (2005).
- Zuccaro, A., Lahrmann, U., Langen, G. Broad compatibility in fungal root symbioses. Curr Opin Plant Biol. 20, 135-145 (2014).
- Kiddee, S., et al. Improving inoculum production of arbuscular mycorrhizal fungi in Zea mays L. Using light-emitting diode (led) technology. Agronomy. 14 (10), 2342 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved