Method Article
수목 균근(AM) 곰팡이 접종물 생산 및 식염수 조건에서 쌀과 AM 공생의 표현형 평가
요약
이 문서에서는 벼의 AM 강화 염분 스트레스 내성을 조사하기 위해 수목 균근(AM) 곰팡이 접종물을 생성하는 프로토콜에 대해 설명합니다.
초록
쌀(Oryza sativa L.)은 전 세계 인구의 절반 이상이 차지하는 필수 식량 작물입니다. 그러나 그 성장은 염분 토양에 의해 심각한 영향을 받아 전 세계적으로 작물 생산에 심각한 도전을 제시합니다. 농작물의 90% 이상과 육상 식물 종의 80%와 상호 공생 관계를 형성하는 수목 균근(AM) 곰팡이는 벼 식물의 염분 내성을 향상시키는 것으로 나타났습니다. AM 곰팡이는 숙주 뿌리 없이는 수명 주기를 완료할 수 없는 절대 공생체입니다. 따라서 식물을 효과적으로 활용하여 AM 곰팡이 접종물을 생산하는 것은 이 분야의 연구를 발전시키는 데 매우 중요합니다. 이 연구에서는 Allium tuberosum L을 사용하여 Rhizophagus irregularis의 포자를 포함하는 모래 접종물을 생성하는 것으로 시작하는 일련의 강력한 방법을 제시합니다. 이러한 방법에는 벼 묘목에 모래 접종, 균근 벼의 성장 표현형 분석, 염분 스트레스 하에서 트리판 블루 염색을 사용하여 곰팡이 집락 수준을 정량화하는 것이 포함됩니다. 이러한 접근 방식은 AM 공생이 쌀의 염분 내성을 향상시키는 방법에 대한 추가 조사를 위해 AM 곰팡이 접종을 효율적으로 생성할 수 있습니다.
서문
염분 토양은 전 세계적으로 작물 생산에 중요한 장애물입니다 1,2,3. 최근 연구에 따르면 2050년까지 경작지의 최대 50%가 염분화로 인해 황폐화될 것이라고 합니다4. 염분의 영향을 받는 토양은 주로 식물 조직에 나트륨(Na+) 및 염화물(Cl−) 이온이 축적되어 식물에 독성을 유발합니다. 염분 토양을 지배하는 이러한 이온은 또한 식물에 가장 해롭습니다 5,6,7. 예를 들어, 나트륨은 많은 세포질 효소 활성을 억제합니다8. 염분 스트레스는 또한 광합성 효율에 영향을 미치고 이온 독성, 삼투압 및 세포벽 구조의 변화를 유도하여 총체적으로 활성 산소 종(ROS)의 축적으로 이어집니다 9,10,11,12,13.
Arbuscular mycorrhizal (AM) 공생은 Glomeromycota 문의 곰팡이와 초기 육상 식물의 출현과 함께 약 4 억-4 억 5 천만 년 전에 진화 한 식물 뿌리 사이의 내부 공생 관계입니다14,15. 관다발성 식물의 80% 이상이 AM 곰팡이16에 의해 군집화될 수 있습니다. 이러한 상호주의적 관계는 토양에서 식물의 영양 흡수를 향상시켜 성장과 스트레스 내성을 향상시킵니다 17,18,19,20. 예를 들어, 염분 스트레스 동안 AM 곰팡이는 이온 균형을 유지하고 식물의 물과 영양분 가용성, 항산화 활성, 광합성 효율 및 2차 대사 산물 생성을 향상시키는 데 도움이 될 수 있습니다 2,21,22,23. 또한 AM 공생은 과도한 Na+ 흡수와 뿌리에서 새싹으로의 이동을 방지하여 K+, Mg2+ 및 Ca2+와 같은 필수 양이온의 흡수를 촉진합니다. 이 과정은 식염수 조건 하에서 식물의 Mg2 + / Na + 또는 K + / Na + 비율을 증가시킵니다 23,24,25,26,27,28,29.
전 세계 인구의 절반 이상이 중요한 식량 작물인 쌀(Oryza sativa L.)은 Gramineae (Poaceae)과에 속하며 염분 스트레스에 매우 취약합니다30. 연구는 또한 쌀의 염분 스트레스 내성을 향상시키는 AM 곰팡이의 역할을 강조했습니다 31,32,33. 예를 들어, AM 곰팡이 Claroideoglomus etunicatum은 염분 스트레스 하에서 쌀(Oryza sativa L. cv. Puntal)의 CO2 고정 효율을 향상시킵니다31. 더욱이, 액포 나트륨 격리 및 새싹에서 뿌리로의 Na+ 재순환과 관련된 주요 쌀 수송체 유전자의 발현은 염분 스트레스 하에서 AM 집락화된 식물에서 향상됩니다32. 또한, Glomus etunicatum을 접종한 고지대 벼 식물은 염분 조건에서 향상된 광합성 능력, 높은 삼투압 생산, 향상된 삼투압 잠재력 및 더 큰 곡물 수확량을 나타냅니다33. 우리의 이전 연구는 또한 균근 벼(Oryza sativaL. cv. Nipponbare)가 더 나은 싹 및 생식 성장, 싹에서 현저하게 더 높은 K+/Na+ 비율, AM 공생34로 인해 활성 산소 종(ROS) 제거 능력을 향상시켰다는 것을 입증했습니다. 이러한 결과는 모두 현상학적 접근 방식을 통해 쌀의 소금 스트레스 내성에 대한 AM 공생의 긍정적인 영향을 보여줍니다. 그러나 실험 방법은 비디오 형식으로 발표되지 않았습니다.
AM 균류는 수명 주기를 완료하기 위해 숙주 뿌리가 필요한 절대 공생체이므로 식물을 사용하여 AM 진균 접종물을 생산하는 것은 연구 진행에 매우 중요합니다35. AM 곰팡이가 질석 또는 모래와 같은 기판에서 성장하고 접종36을 위해 포자를 수집하는 기판 기반 생산 시스템은 대규모 AM 곰팡이 접종 생산을 위한 비용 효율적인 솔루션을 제공합니다. 포자 생산의 효율성은 곰팡이 집락화와 번식에 영향을 미치는 식물 호환성과 성장에 달려 있습니다37,38. 그러나 이 방법은 시간이 많이 소요되는 경우가 많으며 기존 접근 방식은 최대 120일이 걸리고 포자 생성량이 적습니다. 최근의 개선으로 LED 조명 조건에서 옥수수를 호스트 식물로 사용하여 생산 기간을 90일로 단축했습니다39. 그러나 10주 이내에 Allium tuberosum L.을 사용하여 Rhizophagus irregularis의 포자를 포함하는 모래 접종물을 생성하기 위한 강력한 방법이 제시되어 있습니다. 이 모래 접종물은 균근 벼의 성장 표현형을 분석하고 염분 스트레스 하에서 트리판 블루 염색을 사용하여 곰팡이 집락화 수준을 정량화하는 데 사용할 수 있습니다. 이러한 접근 방식은 AM 공생이 쌀의 염분 내성을 향상시키는 방법에 대한 추가 조사를 위해 AM 곰팡이 접종을 효율적으로 생성합니다.
프로토콜
이 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. Allium tuberosum L을 사용하여 Rhizophagus irregularis의 포자를 포함하는 모래 접종물의 생성.
- 수돗물로 모래를 씻고 오토클레이브합니다.
- 냄비에 모래의 2/3를 추가합니다(상단 직경 14.7cm, 하단 직경 11.5cm, 높이 13cm). AM 곰팡이 Rhizophagus irregularis의 포자 1,000개를 추가합니다. 얇은 모래 층으로 덮으십시오. 마늘 쪽파(Allium tuberosum L.) 씨앗 30개를 넣고 씨앗을 모래로 덮습니다.
- 마늘 쪽파를 23.5 ° C (상대 습도 55 %)에서 16 시간 / 8 시간 낮 / 밤 주기로 챔버에서 재배합니다. 첫 주(접종 후 1주, wpi) 동안은 마늘 쪽파를 알루미나 종이로 덮어 빛을 차단하고 일주일에 세 번 물을 줍니다.
- 2 wpi에서 시작하여 25 μM KH2PO4를 함유 한 80 mL 절반 강도 Hoagland 용액으로 일주일에 두 번 마늘 쪽파를 비옥하게합니다. 일주일에 한 번 80mL의 물로 비료를 줍니다.
- 10주 후, 트리판 블루 염색을 위해 마늘 쪽파의 뿌리를 수확하여 곰팡이 집락 수준을 평가합니다. 집락 수준이 70%를 초과하면 모래가 마를 때까지(약 5주) 마늘 쪽파에 물을 주지 마십시오. 모래 접종물은 모두 비닐봉지에 넣고 4°C의 냉장고에 보관한다.
2. 곰팡이 집락 수준을 확인하기 위한 Trypan blue 염색
- 뿌리 조각을 >90 ° C에서 10 % KOH로 30 분 동안 배양합니다. KOH를 제거합니다.
- 뿌리 조각을 이중 증류수(ddH2O)로 세 번 헹굽니다.
- 뿌리 조각을 0.3M HCl로 15분에서 2시간 동안 배양합니다. HCl을 제거합니다.
- 0.1% 트리판 블루 1mL를 추가하고 >90°C에서 8분 동안 샘플을 배양합니다.
- 뿌리 조각을 50% 산성 글리세롤로 씻으십시오. 10개의 뿌리 조각을 슬라이드에 옮기고 50% 산성 글리세롤 한 방울을 추가합니다.
- 커버슬립을 밀봉하고 매니큐어를 바르십시오.
- 현미경으로 각 뿌리의 10개 시야를 검사하여 곰팡이 구조의 존재를 기록합니다. 곰팡이 집락 수준을 백분율로 계산합니다.
참고: 50% 산성 글리세롤: 글리세롤과 0.3M HCl을 1:1 비율로 혼합하여 준비합니다. 0.1% 트리판 블루: 트리판 블루 100mg을 2:1:1 젖산, 글리세롤 및 ddH2O의 혼합물에 녹입니다.
3. 벼 묘목에 모래 접종 및 소금 스트레스 치료 접종
- 벼 씨앗에서 껍질(껍질)을 제거합니다.
- 씨앗을 70% 에탄올(EtOH)로 4분 및 30초 동안 살균합니다.
- 쌀씨를 원심분리기 튜브에 넣습니다. 3% 표백제(멸균 dH2O로 준비)를 넣고 30분 동안 흔듭니다.
- 표백제를 제거하고 층류 후드 내부에서 멸균 dH2O 3-4 회 씨앗을 씻으십시오.
- 0.8% 한천을 함유한 절반 강도의 Murashige-Skoog(1/2MS) 배지에서 30일 동안 어둠 속에서 5일 동안 씨앗을 재배합니다.
- 30/28 ° C에서 12 시간 낮 / 밤 주기로 2 일 동안 70 % 공기 습도로 벼 묘목을 재배합니다.
- 벼 모종을 멸균 된 모래가 들어있는 플라스틱 튜브에 옮깁니다. 접종물이 없거나 Rhizophagus irregularis (Ri)의 포자가 포함된 모래 접종물 5mL를 추가합니다.
- 접종 후 첫 주 동안 일주일에 7일 동안 dH2O로 벼 식물에 물을 줍니다. 25μM의 KH2PO4를 함유 한 절반 강도의 Hoagland 용액으로 이틀에 한 번씩 식물을 비옥하게하십시오.
- 접종 후 5주(wpi)에 한 배치를 150mM의 NaCl(식염수 상태)로 처리하고 다른 배치는 NaCl(비식염수 상태)을 사용하지 않습니다.
- 비 염분 상태의 경우 화요일에 25 μM의 KH2PO4를 함유 한 절반 강도의 Hoagland 용액으로 식물에 물을 주고 나머지 주에는 물을 줍니다.
- 식염수 상태의 경우 화요일에는 25μM의 KH2PO4 를 함유 한 절반 강도의 Hoagland 용액으로, 월요일, 수요일, 금요일에는 150mM의 NaCl을 함유 한 식물에 물을 주거나 나머지 주에는 물을 공급합니다.
- 8 wpi에서 식물을 수확하여 신선한 무게를 측정합니다. 식물을 70°C 오븐에 2일 동안 넣어 건조 중량을 측정합니다. 트리판 블루 염색으로 곰팡이 집락화 수준을 분석합니다.
결과
단계별 워크플로우는 그림 1에 나와 있습니다. 접종 후 10주(wpi)에 말기 및 AM 공생의 특징인 소포 및 포자와 같은 곰팡이 구조가 마늘 쪽파의 뿌리 내부에서 명확하게 관찰되었습니다(그림 2A). 근치내 균사, 수포, 소포, 근치외 균사 및 포자의 수치는 각각 80%, 47%, 63%, 4%, 1%로 마늘 쪽파의 뿌리 내에서 곰팡이 발달이 진행되고 있음을 나타냅니다. 따라서 총 집락화 수준은 80%에 달했다(그림 2C). 이러한 결과는 마늘 쪽파와 AM 곰팡이 사이의 공생 관계가 성공적으로 확립되었으며 AM 곰팡이가 수명 주기를 완료하고 더 많은 포자를 생성할 수 있음을 나타냅니다. 마늘 부추와 AM 곰팡이 사이의 공생에서 생성된 모래 접종물을 사용하여 벼 식물은 AM 곰팡이에 의해 성공적으로 군집화되었습니다. 8 wpi에서 벼뿌리 내부에서 소포와 포자가 관찰되었으며(그림 2D), 근치내 균사, 수포, 소포, 근치외 균사, 포자 및 총 곰팡이 구조의 수준은 각각 91%, 82%, 95%, 46%, 2% 및 93%였습니다(그림 2E). 그런 다음 벼 식물을 5 주 동안 모의 또는이 모래 접종물로 재배 한 다음 3 주 동안 소금 용액 (150mM의 NaCl)없이 또는 처리했습니다. 균근 식물은 염분 스트레스를 받은 모의 식물보다 시든 잎 끝이 더 적었습니다(그림 2F). 비염분 조건에서 균근 벼 식물은 모의 벼 식물보다 더 높은 싹 바이오매스를 보였습니다(그림 2G). 염분 스트레스 하에서 모의 식물의 새싹 바이오매스는 심각하게 감소한 반면, 균근 식물은 모의 식물보다 1.4배 높은 싹 바이오매스를 유지했습니다(그림 2G). AM 공생은 두 조건 모두에서 뿌리 바이오매스에 큰 영향을 미치지 않았습니다(그림 2G). 이러한 결과는 AM 공생이 벼 식물이 염분 스트레스 하에서 더 나은 싹 성장을 유지하는 데 도움이 된다는 것을 시사합니다. 곰팡이 집락화 수준은 비식염수 및 식염수 조건에서 각각 84%와 83%에 달했으며, 이는 AM 곰팡이에 의한 벼 뿌리의 성공적인 집락화를 나타냅니다. 또한, extraradical hyphae 수치는 염분 스트레스 하에서 더 높았습니다. 비식염수와 식염수 상태 사이의 다른 곰팡이 구조에서는 유의미한 차이가 관찰되지 않았으며, 이는 염분 스트레스가 AM 공생에 가벼운 영향을 미쳤음을 시사합니다(그림 2H).
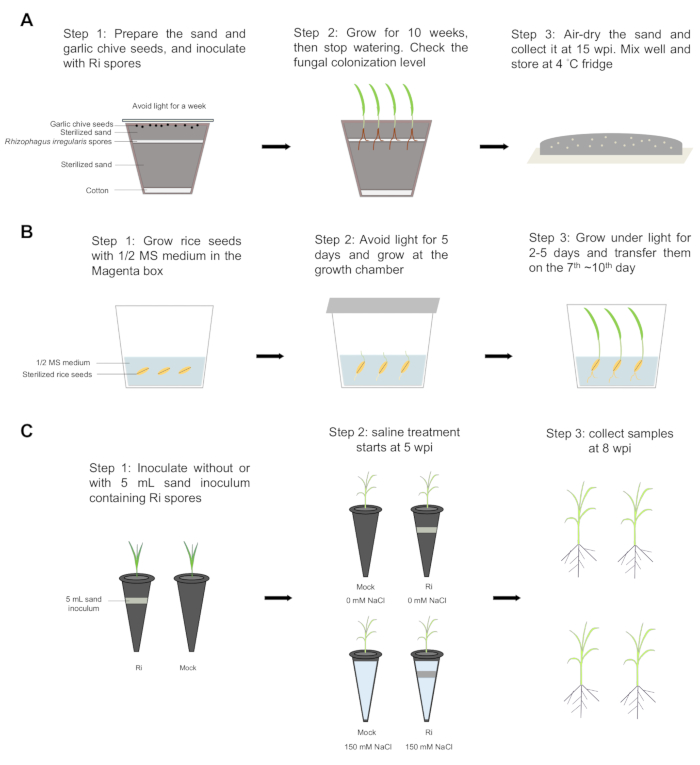
그림 1: 단계별 워크플로우. (A) 모래 접종물은 다음 단계를 사용하여 준비되었습니다 : 1 단계 : 냄비 바닥에 면층을 놓고 살균 된 모래의 2/3를 냄비에 넣었습니다. 약 1000-2000 개의 Rhizophagus irregularis 포자를 절단 팁을 사용하여 고르게 펴고 나머지 1/3의 살균 모래로 덮었습니다. 30 개의 Allium tuberosum L. 씨앗을 모래 표면에 고르게 펴고 알루미나 종이로 덮어 빛을 차단했습니다. 식물은 일주일 동안 23 ° C에서 배양 하였다. 2 단계 : 씨앗을 23 ° C에서 16/8 라이트 / 다크 사이클로 10 주 동안 성장시킨 다음 급수를 중단했습니다. 뿌리의 군집화 수준을 확인했습니다. 3단계: 모래를 공기 건조하고, 접종 후 15주(wpi)에 수집하고, 잘 혼합하고, 4°C 냉장고에 보관했습니다. (B) 쌀 씨앗은 마젠타 상자에서 발아했습니다. 1단계 및 2단계: 벼종자를 70% 에탄올로 4분 30초 동안 살균하고, 에탄올을 과염소산나트륨 3%로 대체했습니다. 씨앗을 30분 동안 흔든 다음 살균수로 5회 헹궈냈습니다. 종자는 0.8% 한천을 사용하여 1/2 Murashige 및 Skoog (MS) 배지에서 30°C의 어둠 속에서 5일, 빛 아래에서 2일 동안 발아시켰다(30/28 °C에서 12/12 h 주야간 주기). 3단계: 벼모종을 7일 ~10일째 에 옮겨 놓았다. (C) 접종 및 식염수 처리. 1단계: 벼 묘목을 (모의) 또는 Rhizophagus irregularis (Ri) 포자가 포함된 5mL 모래 접종물이 포함된 멸균된 모래가 들어 있는 플라스틱 튜브에 이식했습니다. 식물은 30/28°C에서 12시간 낮/밤 주기로 성장 챔버에서 성장하고, 식물은 25μM의 인산염(Pi)을 갖는 1/2 Hoagland 용액으로 일주일에 두 번 성장했습니다. 2단계: 5wpi에서 균근 식물과 모의 식물을 두 그룹으로 나누었습니다. 한 그룹은 150mM의 염화나트륨(NaCl)(식염수 조건)으로 처리하고, 다른 그룹은 비식염수 조건에서 성장시켰습니다. 3 단계 : 8 wpi에서 모든 식물을 수집 한 다음 새싹과 뿌리를 분리하여 신선한 무게와 건조 무게를 평가했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: Allium tuberosum L의 표현형. (마늘 부파), O. sativa L. japonica cv. Nipponbare (쌀) 및 Rhizophagus irregularis (AM 곰팡이). (A) 10wpi에서 균근 마늘 골파 뿌리의 사진. (B) 10wpi에서 균근 마늘 골파 식물의 사진. (C) 마늘 부추 뿌리의 곰팡이 집락 수준. (D) 8 wpi에서 균근 벼 뿌리의 사진. (E) 벼 뿌리의 곰팡이 집락 수준. (F) 염분 스트레스를 받는 모의 벼 및 균근 벼 식물의 표현형. (G) 비염분 및 염분 스트레스 하에서 모의 및 균근 벼 식물의 건조 중량, (H) 8wpi에서 염분 스트레스 하에서 균근 벼 뿌리의 곰팡이 집락 수준. (A-C)에서, 마늘 쪽파에 25μM 인산염 조건에서 성장한 AM 곰팡이(R. irregularis, Ri)의 포자 200개를 접종하고 접종 후 10주(wpi)에 수확했습니다. 패널 (D) 및 (E)에서, 25μM 인산염 조건에서 성장한 마늘 부추와 AM 균류(Rhizophagus irregularis, Ri)의 공생에서 유래한 5mL의 모래 접종을 논에 접종하고 접종 후 8주(wpi)에 수확했습니다. 패널 (F)에서, 벼 식물은 5 주 동안 AM 곰팡이 (R. irregularis, Ri)를 함유 한 모래 접종물 없이 (mock) 또는 재배 한 후 3 주 동안 소금 용액 (150 mM NaCl)으로 처리했습니다. 뿌리는 패널 (A)와 (D)에서 트리판 블루로 염색되었습니다. 이 패널에서 포자는 흰색 화살표로, 소포는 흰색 화살표로, 근치 외 균사는 검은 화살표로 표시됩니다. 스케일 바: 패널 (A) 및 (D)에서 100μm; 패널(B)에서 1cm; 및 패널(F)에서 10cm. 약어: int hyphae, intraradical hyphae; ext 균사, extraradical 균사. 표준 오차는 3-4개의 생물학적 복제물에서 계산되었습니다. 문자가 다르면 처리 간에 유의한 차이가 있음을 나타냅니다(p < 0.05, 양방향 분산 분석 후 사후 최소 유의한 차이가 있음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
모래 접종물의 준비 및 사용에 관한 몇 가지 팁이 있습니다. 첫째, 우리의 경험에 비추어 볼 때 마늘 부추의 집락 수준은 70% 이상이어야 합니다(그림 2C). 그렇지 않으면 토마토 및 쌀과 같은 다른 식물에 대한 다음 접종은 접종 후 7주(wpi)에 50% 이상에 성공적으로 도달하지 못할 것입니다(그림 2E). 둘째, 모래 접종물은 보관 전에 철저히 자연 건조하고 깨끗한 비닐 봉지에 넣어 냉장고에 보관하여 다시 젖지 않도록 해야 합니다(1.5단계). 그렇지 않으면 모래 접종물의 품질이 저하됩니다. 셋째, 모래 접종물은 약 10개월 동안 문제 없이 냉장고에 보관할 수 있습니다. 넷째, 모래 접종물은 다른 식물에 접종하기 위해 화분에 추가하기 전에 저장 백을 흔들어 철저히 혼합해야 합니다(3.7단계).
트리판 블루 염색과 관련하여, 뿌리는 염색을 위해 약 1-1.5cm 길이의 조각으로 잘라야 곰팡이 구조가 트리판 블루로 균일하게 염색될 수 있습니다(2.1단계). 뿌리의 균근 집락 수준을 정확하게 나타내려면 뿌리의 한쪽 끝에서 다른 쪽 끝까지 거의 동일한 간격으로 10개의 시야를 관찰해야 합니다(2.7단계).
모의 쌀과 균근 쌀에 대한 소금 스트레스 치료와 관련하여 쌀 씨앗을 알코올로 살균하는 시간은 정확해야 합니다. 그렇지 않으면 쌀의 발아율에 영향을 미칩니다(3.2단계). 모래는 재배 매체로 사용되기 때문에 전체 성장 과정에서 벼가 충분한 물을 받도록 하는 것이 중요합니다. 그렇지 않으면 벼가 가뭄과 높은 염분 스트레스를 동시에 겪을 수 있어 성장 결과를 정확하게 평가하기 어려울 수 있습니다(3.8-3.9단계).
이 프로토콜을 따르면 벼 품종 Nipponbare에서 AM이 향상된 염분 스트레스 내성을 관찰할 수 있습니다. 그러나 이 소금 스트레스 처리법이 다른 쌀 품종에서 AM으로 강화된 소금 스트레스 내성을 관찰하는 데에도 사용될 수 있는지 여부는 알려져 있지 않습니다. 그렇지 않은 경우 더 많은 모래 접종물을 사용하거나, 5wpi 후 소금 스트레스 처리를 시작하거나, 소금 스트레스 기간을 늘리거나, 소금 스트레스 후 식물에 다시 물을 주는 것과 같은 일부 단계를 수정할 수 있습니다.
AM 균류는 수명 주기를 완료하기 위해 숙주 뿌리가 필요한 절대 공생체이므로 식물 기반 접종물 생산은 연구에 필수적입니다35. 곰팡이가 질석이나 모래와 같은 물질에서 자라는 기판 기반 시스템은 대규모 접종물을 생산하는 비용 효율적인 방법을 제공합니다. 그러나 전통적인 방법은 최대 120일이 소요될 수 있으며 낮은 포자 수 36,37,38을 얻을 수 있습니다. 최근의 개선으로 LED 조명 아래에서 옥수수를 사용하여 이를 90일로 단축했습니다39. 여기에서는 Allium tuberosum L.을 사용하여 단 10주 만에 모래에서 Rhizophagus irregularis 포자를 생성하는 방법을 제시합니다. 이 접종물은 벼 성장, 곰팡이 집락화 및 염분 내성을 연구하는 데 사용할 수 있어 AM 공생 연구를 위한 효율적인 도구를 제공합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
우리는 Yun-Hsin Chen이 쌀의 AM 강화 소금 스트레스 내성을 조사하기 위한 시스템을 구축하고, Kai-Chieh Chang이 모래 접종물을 생성하는 시스템을 구축한 것을 인정합니다. 이 연구는 대만 국가과학기술위원회(National Science and Technology Council, NSTC 113-2326-B-002 -008 -MY3)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| (NH4)6Mo7O24.4H2O | FERAK | 12054-85-2 | half-strength Hoagland solution |
| Bleach | Gaulix | Gaulix-2108 | rice sterilization |
| Ca(NO3)2.4H2O | Sigma | 13477-34-4 | half-strength Hoagland solution |
| CuSO4.5H2O | Sigma | 7758-99-8 | half-strength Hoagland solution |
| EtOH | Honeywell | 67-63-0 | rice sterilization |
| Fe-citrate | Sigma | 3522-50-7 | half-strength Hoagland solution |
| Garlic chives seeds | KNOWN-YOU SEED Co., LTD. | V-015 | Allium tuberosum L. seeds |
| Glycerol | J.T.Baker | 56-81-5 | Trypan blue staining |
| HCl | Sigma | 7647-01-0 | Trypan blue staining |
| KCl | Merck | 7447-40-7 | half-strength Hoagland solution |
| KH2PO4 | Merck | 7646-93-7 | half-strength Hoagland solution |
| KNO3 | Avantor | 7757-79-1 | half-strength Hoagland solution |
| KOH | Honeywell | 1310-58-3 | Trypan blue staining |
| Lactic acid | Sigma | 50-81-7 | Trypan blue staining |
| MgSO4.7H2O | Sigma | 10034-99-8 | half-strength Hoagland solution |
| MnSO4.H2O | Honeywell | 10034-96-5 | half-strength Hoagland solution |
| MS salts | PhytoTech | M404 | half-strength Murashige–Skoog (1/2 MS) medium |
| Na2B4O7.10H2O | Sigma | 1330-43-4 | half-strength Hoagland solution |
| NaCl | Bioshop | 7647-14-5 | salt stress treatment |
| NaOH | J.T.Baker | 1310-73-2 | half-strength Murashige–Skoog (1/2 MS) medium |
| Rhizophagus irregularis spore | Premier Tech | L-ASP-A | AM fungal spore (MycoriseASP, Premier Tech, Rivière-du-Loup, Québec, Canada ) |
| Sucrose | Bioshop | 57-50-1 | half-strength Murashige–Skoog (1/2 MS) medium |
| Trypan blue | Sigma | 72-57-1 | Trypan blue staining |
| ZnSO4.7H2O | Avantor | 7446-20-0 | half-strength Hoagland solution |
참고문헌
- Flowers, T., Yeo, 6. Breeding for salinity resistance in crop plants: Where next. Funct Plant Biol. 22 (6), 875-884 (1995).
- Porcel, R., Aroca, R., Ruiz-Lozano, J. M. Salinity stress alleviation using arbuscular mycorrhizal fungi: A review. Agron Sustain Dev. 32, 181-200 (2012).
- Mukhopadhyay, R., Sarkar, B., Jat, H. S., Sharma, P. C., Bolan, N. S. Soil salinity under climate change: Challenges for sustainable agriculture and food security. J Environ Manage. 15 (280), 111736 (2021).
- Hossain, M. S. Present scenario of global salt-affected soils, its management and importance of salinity research. Int. Res J Biol Sci. 1, 1-3 (2019).
- Hualpa-Ramirez, E., et al. Stress salinity in plants: New strategies to cope with in the foreseeable scenario. Plant Physiol Biochem. 208, 108507 (2024).
- Hussain, S., et al. Effects of salt stress on rice growth, development characteristics, and the regulating ways: A review. J Integr Agric. 16, 2357-2374 (2017).
- Tavakkoli, E., Fatehi, F., Coventry, S., Rengasamy, P., Mcdonald, G. K. Additive effects of Na+ and Cl- ions on barley growth under salinity stress. J Exp Biol. 62 (6), 2189-2203 (2011).
- Flowers, T., Troke, P., Yeo, A. The mechanism of salt tolerance in halophytes. Annu Rev Plant Physiol. 28 (1), 89-121 (1977).
- Shomer, I., Novacky, A. J., Pike, S. M., Yermiyahu, U., Kinraide, T. B. Electrical potentials of plant cell walls in response to the ionic environment. Plant Physiol. 133 (1), 411-422 (2003).
- Sudhir, P., Murthy, S. Effects of salt stress on basic processes of photosynthesis. Photosynthetica. 42 (2), 481-486 (2004).
- Sharma, P., Jha, A. B., Dubey, R. S., Pessarakli, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. J Bot. 2012, 217037 (2012).
- Singh, M., Kumar, J., Singh, V., Prasad, S. Proline and salinity tolerance in plants. Biochem. Pharmacol. 3, e170 (2014).
- Atta, K., et al. Impacts of salinity stress on crop plants: Improving salt tolerance through genetic and molecular dissection. Front. Plant Sci. 14, 1241736 (2023).
- Remy, W., Taylor, T. N., Hass, H., Kerp, H. Four hundred-million-year-old vesicular arbuscular mycorrhizae. Proc Natl Acad Sci USA. 91. 91, 11841-11843 (1994).
- Redecker, D., Kodner, R., Graham, L. E. Glomalean fungi from the Ordovician. Science. 289 (5486), 1920-1921 (2000).
- Harley, J., Smith, S. . Mycorrhizal symbiosis. , (1983).
- Porras-Soriano, A., Soriano-Martin, M. L., Porras-Piedra, A., Azcon, R. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. J Plant Physiol. 166, 1350-1359 (2009).
- Kapoor, R., Evelin, H., Mathur, P., Giri, B. . Plant acclimation to environmental stress. , 359-401 (2013).
- Rivero, J., Ñlvarez, D., Flors, V., Azcón-Aguilar, C., Pozo, M. J. Root metabolic plasticity underlies functional diversity in mycorrhiza-enhanced stress tolerance in tomato. New Phytol. 220 (4), 1322-1336 (2018).
- Begum, N., et al. Role of arbuscular mycorrhizal fungi in plant growth regulation: Implications in abiotic stress tolerance. Front. Plant Sci. 19 (10), 1068 (2019).
- Evelin, H., Kapoor, R. Arbuscular mycorrhizal symbiosis modulates antioxidant response in salt-stressed Trigonella foenum-graecum plants. Mycorrhiza. 24 (3), 197-208 (2014).
- Sarwat, M., et al. Mitigation of NaCl stress by arbuscular mycorrhizal fungi through the modulation of osmolytes, antioxidants and secondary metabolites in mustard (Brassica juncea L.) plants. Front Plant Sci. 7, 869 (2016).
- Evelin, H., Devi, T. S., Gupta, S. R. K. Mitigation of salinity stress in plants by arbuscular mycorrhizal symbiosis: Current understanding and new challenges. Front Plant Sci. 12 (10), 470 (2019).
- Kapoor Giri, R., Mukerji, K. Influence of arbuscular mycorrhizal fungi and salinity on growth, biomass, and mineral nutrition of Acacia auriculiformis. Biol Fertility Soils. 38 (3), 170-175 (2003).
- Giri Mukerji, K. G. Mycorrhizal inoculant alleviates salt stress in Sesbania aegyptiaca and Sesbania grandiflora under field conditions: Evidence for reduced sodium and improved magnesium uptake. Mycorrhiza. 14 (5), 307-312 (2004).
- Colla, G., et al. Alleviation of salt stress by arbuscular mycorrhizal in zucchini plants grown at low and high phosphorus concentrations. Biol Fertility Soils. 44 (3), 501-509 (2008).
- Hammer, E. C., Nasr, H., Pallon, J., Olsson, P. A., Wallander, H. Elemental composition of arbuscular mycorrhizal fungi at high salinity. Mycorrhiza. 21, 117-129 (2011).
- Estrada, B., Aroca, R., Maathuis, F. J., Barea, J. M., Ruiz-Lozano, J. M. Arbuscular mycorrhizal fungi native from a Mediterranean saline area enhance maize tolerance to salinity through improved ion homeostasis. Plant, Cell Environ. 36, 1771-1782 (2013).
- Talaat, N. B., Shawky, B. T. Influence of arbuscular mycorrhizae on yield, nutrients, organic solutes, and antioxidant enzymes of two wheat cultivars under salt stress. J Plant Nutr Soil Sci. 174, 283-291 (2011).
- Chinnusamy, V., Jagendorf, A., Zhu, J. K. Understanding and improving salt tolerance in plants. Crop Sci. 45, 437-448 (2005).
- Porcel, R., et al. Arbuscular mycorrhizal symbiosis ameliorates the optimum quantum yield of photosystem ii and reduces non-photochemical quenching in rice plants subjected to salt stress. J. Plant Physiol. 1 (185), 75-83 (2015).
- Porcel, R., Aroca, R., Azcon, R., Ruiz-Lozano, J. Regulation of cation transporter genes by the arbuscular mycorrhizal symbiosis in rice plants subjected to salinity suggests improved salt tolerance due to reduced Na(+) root-to-shoot distribution. Mycorrhiza. 26 (7), 673-684 (2016).
- Tisarum, R., et al. Alleviation of salt stress in upland rice (Oryza sativa L. ssp. Indica cv. Leum pua) using arbuscular mycorrhizal fungi inoculation. Front Plant Sci. 11, 348 (2020).
- Hsieh, C., Chen, Y., Chang, K., Yang, S. Transcriptome analysis reveals the mechanisms for mycorrhiza-enhanced salt tolerance in rice. Front Plant Sci. 13, 1072171 (2022).
- Roth, R., Paszkowski, U. Plant carbon nourishment of arbuscular mycorrhizal fungi. Curr Opin Plant Biol. 39, 50-56 (2017).
- Ijdo, M., Cranenbrouck, S., Declerck, S. Methods for large-scale production of am fungi: Past, present, and future. Mycorrhiza. 21, 1-16 (2011).
- Genre, A., Bonfante, P. Building a mycorrhizal cell: How to reach compatibility between plants and arbuscular mycorrhizal fungi. J Plant Interact. 1, 3-13 (2005).
- Zuccaro, A., Lahrmann, U., Langen, G. Broad compatibility in fungal root symbioses. Curr Opin Plant Biol. 20, 135-145 (2014).
- Kiddee, S., et al. Improving inoculum production of arbuscular mycorrhizal fungi in Zea mays L. Using light-emitting diode (led) technology. Agronomy. 14 (10), 2342 (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유