Method Article
Пластырь-зажим для анализа одиночных эндолизосомальных везикул
В этой статье
Резюме
В этом протоколе подробно описан метод прямого измерения активности ионных каналов на внутриклеточных везикулах с использованием ручной эндолизосомальной системы патч-зажимов. Мы проиллюстрируем метод, который заключается в увеличении эндолизосом и ручном выделении этих везикул. Такой подход гарантирует, что исследователи могут точно воспроизвести и применить процедуру.
Аннотация
Эндолизосомальные ионные каналы имеют решающее значение для эндолизосомального ионного и рН-гомеостаза, регуляции мембранного потенциала и транспортировки везикул. Тем не менее, электрофизиологический доступ к этим каналам в небольших внутриклеточных везикулах был сложной задачей. Разработка эндолизосомальных методов патч-зажима сыграла важную роль в преодолении этого барьера, позволив напрямую измерять активность ионных каналов в эндолизосомальных мембранах.
По сравнению с существующими методами планарного патч-клэмпа, эндолизосомальный пластырь-зажим может одновременно регистрировать несколько клеток и легко комбинироваться с другими методами измерения. Ручное управление дает преимущество визуализации целевых везикул. В нем также рассматривается ограничение незаменимого присутствия Ca2+ на одной стороне эндолизосомальной мембраны, что повышает гибкость экспериментального дизайна. Использование эндолизосомальных методов патч-зажима позволяет напрямую измерять и анализировать активность ионных каналов в эндолизосомах.
Учитывая тесную связь между аберрантной функцией эндолизосомальных ионных каналов и такими заболеваниями, как нейродегенеративные заболевания и метаболические нарушения, исследование и модуляция этих каналов может открыть новые мишени для лекарств. Восстанавливая внутриклеточный ионный баланс, мы можем облегчить или вылечить связанные с этим заболевания. Таким образом, этот метод имеет решающее значение для открытия новых мишеней для лекарств и разработки соответствующих лекарств.
Введение
Ионные каналы играют решающую роль во многих физиологических процессах. В то время как поверхностные ионные каналы привлекают значительное внимание, важность внутриклеточных каналов, особенно в эндолизосомах, постепенно признается. Эндолизосомальная система состоит из многофункциональных, связанных с мембраной органелл, специализированных для основных клеточных функций, включая рециркуляционные эндосомы (RE), ранние эндосомы (EE), поздние эндосомы (LE), лизосомы (LY) и гибридные органеллы с эндолизосомальными и другими компартментными характеристиками, такие как фагосомы и аутофагосомы.
ЭЭ, также известные как сортирующие эндосомы (СЭ), являются одним из первых мест назначения для материалов, интернализованных из плазматической мембраны (ТЧ). ЭЭ являются важнейшими компартментами, отвечающими за сортировку груза по различным эндоцитарным путям, таким как путь созревания к LE/LY для разложения, путь быстрой рециркуляции обратно к PM и путь медленной рециркуляции, включающий отсек для рециркуляции или периферический RE. Мультивезикулярные тельца (MVB), происходящие из эндосом, представляют собой сферические компартменты, окруженные ограничивающей мембраной, которая может быть заполнена внутрипросветными везикулами (ILV)1. Для поддержания нормальной функции этих органелл им требуются мембранные ионные каналы для регулирования везикулярного pH, осмолярности и передачи сигнала. Однако измерить активность этих каналов не так просто.
Для ионных каналов, расположенных на плазматической мембране, метод патч-зажима, разработанный в 1970-х годах, долгое время был золотым стандартом метода2. Тем не менее, доступ к электрофизиологическим каналам в небольших внутриклеточных везикулах остается проблемой. Применение золотого стандарта измерения ионных каналов на плазматической мембране к стандарту измерения ионных каналов на внутриклеточных органеллах сталкивается с тремя основными проблемами. Во-первых, размер эндолизосом, как правило, очень мал (менее 1 мкм в диаметре), что затрудняет их наблюдение и выделение под микроскопом, и меньше, чем диаметр отверстия типичных стеклянных микропипеток, что делает эксперимент неработоспособным. Во-вторых, выделение эндолизосом непосредственно из клеток-мишеней при сохранении целостности органелл требует специальных навыков. В-третьих, из-за отсутствия цитоскелета во внутриклеточных органеллах формирование уплотнения на эндолизосомальной мембране в патч-пипетке и последующий его разрыв для достижения конфигурации целой эндолизосомы может быть сложной задачей, поскольку это ставит под угрозу структурную целостность органеллы3.
Для решения этих проблем было разработано несколько методов, включая запись липидного бислоя, модификацию лизосомальных целевых последовательностей и методы электрофизиологии на основе твердой мембраны (SSM или SSME). Метод записи липидных бислоев включает в себя реконструкцию синтетических фосфолипидных мембран с очищенными ионными каналами, что позволяет детально изучить электрофизиологическую функцию мембранного белка в контролируемых условиях 4,5. Модификация лизосомальных последовательностей нацеливания на ионных каналах включает перенаправление эндолизосомальных ионных каналов на плазматическую мембрану для измерения с использованием традиционных методов патч-зажима6. Методы мембранной электрофизиологии на твердой основе (SSM или SSME), также известные как эндолизосомальный метод планарного патч-зажима, используют плоские стеклянные чипы на твердой подложке с небольшими апертурами (<1 мкм в диаметре) в микроструктурированных планарных боросиликатных чипах. Эти стеклянные чипы с малой апертурой позволяют анализировать маленькие, даже нативные, эндолизосомы с использованием системы управления давлением и всасыванием (Nanion). Однако в первых двух методах ионные каналы не находятся в своей естественной физиологической среде. Попытки зарегистрировать лизосомальные каналы, экспрессируемые на плазматической мембране или реконструированные в липидные бислои, в значительной степени привели к неопределенным и противоречивым результатам.
Несмотря на то, что планарные методы использования патч-зажимов эффективно решают проблему искусственных помех и обеспечивают преимущество высокопроизводительных измерений, используемые решения также ограничены этим методом. Эндолизосомальный метод наложения пластыря-зажима, представленный в этой статье, может одновременно регистрировать несколько клеток и легко сочетаться с другими методами измерения. Ручное управление обеспечивает преимущество визуализации целевых везикул. Он также преодолевает неизбежное ограничениеCa2+ в растворе на одной стороне эндолизосомальной мембраны, увеличиваясвободу экспериментального дизайна3. В последнее время эндолизосомальные методы наложения пластырей играют ключевую роль в исследованиях по разработке лекарств. Например, при нейродегенеративных заболеваниях этот метод помог идентифицировать новые препараты, нацеленные на эндолизосомальные ионные каналы, связанныес болезнями Альцгеймера и Паркинсона. Исследователи также могут использовать этот метод для изучения роли эндолизосомальных ионных каналов в опухолевых клетках9, тем самым контролируя рост и пролиферацию опухоли. Что касается метаболических заболеваний, исследования эндолизосомального пластыря выявляют соединения, которые регулируют эндолизосомальные ионные каналы, предлагая новые подходы к лечению диабета и ожирения. Эндолизосомальная техника наложения пластыря помогает понять эндолизосомальную дисфункцию и найти потенциальные методылечения, значительно улучшая наше понимание функций эндолизосомальных ионных каналов и способствуя открытию новых мишеней для лекарств.
протокол
1. Настройка прибора
- Скобяные изделия
ПРИМЕЧАНИЕ: На рисунке 1 приведена стандартная конфигурация электрофизиологической установки.- Защитите установку от внешних помех с помощью стола и клетки Фарадея.
- Используйте инвертированный микроскоп с микроманипулятором для стабильного позиционирования микроэлектрода.
- Настройте усилитель для сбора и усиления полученных сигналов.
- Используйте дигитайзер для преобразования аналоговых сигналов в цифровые.
- Используйте программное обеспечение для сбора и анализа данных для настройки экспериментальных протоколов и извлечения значимых, поддающихся анализу результатов из собранных данных.
- Электроды
- Используйте два электрода: электрод для ванны и электрод для пипетки.
ПРИМЕЧАНИЕ: Платина и хлорид серебра обладают наилучшими поляризационными свойствами. Электроды из хлорида серебра состоят из серебряной проволоки или гранул, которые были хлорированы, таким образом, имеют слой AgCl на внешней поверхности проволоки или гранулы (Рисунок 2).
- Используйте два электрода: электрод для ванны и электрод для пипетки.
- Подготовка пипетки
- Вытягивание
- Установите капиллярную трубку в съемник.
ПРИМЕЧАНИЕ: Параметры, используемые для изготовления пипеток ниже, зависят от прибора. Инструмент, который мы использовали в этой статье, упоминается в Таблице материалов. - В экспериментальных условиях (комнатная температура 22 °C, нить нагревателя сквозной формы, боросиликатное стекло с нитью), которые не выжигают нить нагревателя, проведите испытание RAMP на съемнике, чтобы определить теплоту сгорания (HEAT), необходимую для плавления стеклянного капилляра.
- Разработайте новую программу вытягивания с шестью отдельными циклами вытягивания с использованием параметров HEAT, скорости (VEL) и времени (TIME) (Таблица 1).
ПРИМЕЧАНИЕ: HEAT относится к параметру, который нагревает нить нагревателя, позволяя стеклянной нити плавиться. Скорость указывает скорость, с которой съемник тянет нить в обоих направлениях. Время представляет собой продолжительность интервала между каждым циклом. - Нажмите зеленую кнопку Pull на клавиатуре.
- Ослабьте ручку зажима и извлеките пипетки из съемника.
- Осмотрите наконечники пипеток под окуляром микрокузницы, чтобы определить диаметр, остроту и геометрию наконечника. Убедитесь, что диаметр наконечника составляет 0,5-0,9 мкм.
ПРИМЕЧАНИЕ: По мере того, как нить используется чаще, теплота сгорания, необходимая для плавления стеклянного капилляра, будет меняться. - Если размер наконечника не соответствует ожиданиям, отрегулируйте параметры HEAT и VEL. Более высокие температуры и более высокие скорости позволяют получать более тонкие и длинные наконечники, и наоборот. Отрегулируйте НАГРЕВ с шагом 5 градусов и скорость с шагом 3.
- Установите капиллярную трубку в съемник.
- Полировка
- Поместите вытянутые патч-пипетки в держатель микрокузницы.
- Осмотрите наконечники пипеток с помощью объектива с 35-кратным увеличением (в сочетании с 15-кратным окуляром, что приводит к 525-кратному увеличению).
- С помощью микроманипулятора приблизьте пипетки пластыря к нити.
- Установите регулятор температуры на 80.
- С помощью ножного переключателя включите нагреватель и подайте короткий тепловой импульс (1 - 2 с), контролируя процесс полировки через окуляр микрокузницы.
- Повторяйте процесс до тех пор, пока все пипетки не будут отполированы.
- Поместите готовые пипетки в герметичную коробку, чтобы предотвратить попадание пыли.
ПРИМЕЧАНИЕ: Цель состоит в том, чтобы быстро расплавить наконечник, чтобы стекло изменило конечную геометрию наконечника, не делая его слишком острым. Это предотвращает проникновение пипетки через мембрану везикулы, к которой она прижимается, и эффективно способствует образованию уплотнения. После окончательной полировки внутренний путь наконечника пипетки должен быть очень узким, прямым и линейным.
Лучшие записывающие пипетки обычно имеют сопротивление 5 - 8 МОм после огневой полировки. Диаметр отверстия наконечника должен составлять 2 мкм. Идеально отполированная патч-пипетка имеет важное значение для успешного формирования гигасила, так как это один из ключевых методов, имеющих решающее значение для успеха процедуры.
- Вытягивание
2. Подготовка образцов
- Клеточная культура (на примере HEK293)
- Культивируйте клетки в стандартном увлажненном инкубаторе при температуре 37 °C с 5%CO2.
- Культивировали клетки HEK293 в DMEM с низким содержанием глюкозы с добавлением 10% инактивированной при нагревании фетальной бычьей сыворотки (FBS), 100 ЕД/мл пенициллина и 100 мг/мл стрептомицина.
- Поместите покровные стекла 12 мм с поли-L-лизиновым покрытием в 24-луночный планшет.
- Увеличение органелл
- Добавьте 1 мкМ вакуолин-1 к клеткам HEK293 в 24-луночном планшете (начиная с шага 2.1) и инкубируйте при 37 °C с 5%CO2 в течение ночи до тех пор, пока не начнут образовываться увеличенные везикулы.
Примечание: Размер увеличенных эндолизосом может достигать 1-10 мкм, в зависимости от инструмента, соединения, времени инкубации и типа клеток (Рисунок 3 и Таблица 2).
- Добавьте 1 мкМ вакуолин-1 к клеткам HEK293 в 24-луночном планшете (начиная с шага 2.1) и инкубируйте при 37 °C с 5%CO2 в течение ночи до тех пор, пока не начнут образовываться увеличенные везикулы.
- Приготовление раствора
Примечание: Приготовление стандартного раствора направлено на моделирование концентраций ионов внутри клетки и органелл. Например, стандартные решения для измерения ионных каналов на лизосомах выглядят следующим образом:- Приготовьте раствор для ванны (в мМ): 140 K-метансульфоната (MSA), 5 KOH, 4 NaCl, 0,39 CaCl2, 1 EGTA, 10 HEPES. Отрегулируйте pH до 7,2 с помощью KOH. Отрегулируйте осмолярность до 300 мосм/л с глюкозой.
- Приготовьте раствор пипетки (в мМ): 140 Na-MSA, 5 K-MSA, 2 Ca-MSA, 1 CaCl2, 10 HEPES, 10 MES. Отрегулируйте pH до 4,6 с помощью MSA. Отрегулируйте осмолярность до 310 мосм/л с глюкозой.
ПРИМЕЧАНИЕ: Пропустите раствор через фильтр 0,2 мкм, приготовьте 45 мл аликвот в конических пробирках объемом 50 мл и храните их при температуре 4 °C до 2-4 недель.
3. Выделение органелл
- Снимите покровную крышку с обработанными клетками (см. раздел 2) с 24-луночного планшета, перенесите ее в камеру микроскопа и добавьте 1 мл раствора для ванны.
ПРИМЕЧАНИЕ: Клетки не должны храниться в растворе ванны в течение >1 ч для экспериментов с цельноэндолизосомальным пластырем, которые включают выделение, герметизацию и запись эндолизосом. Через 1 ч увеличенные эндолизосомы уменьшаются, прилипают к пипетке, и их становится трудно выделить. - С помощью самодельной пластиковой иглы для наполнения изолирующей пипетки раствором для пипетки и установите пипетку на переднем конце установки патч-зажима.
- Установите угол диагонального перемещения микроманипулятора как близкий к 30° (заводское значение по умолчанию).
- Под микроскопом (объектив 40x и окуляр 10x) исследуйте клетки на предмет достаточно увеличенных эндосом или лизосом, расположенных вблизи края клеточной мембраны для выделения. Переместите изолирующую пипетку близко к выбранной ячейке.
- Опустите изолирующую пипетку с помощью микроманипулятора до тех пор, пока она не коснется края плазматической мембраны (рис. 4). Быстро переместите изолирующую пипетку горизонтально, чтобы оторвать небольшой кусочек плазматической мембраны.
- С помощью той же пипетки надавите на клетку с противоположной стороны, чтобы выдавить эндосомы/лизосомы на расстояние ~2 мкм от клетки.
ПРИМЕЧАНИЕ: Если на органелле есть остаточная клеточная мембрана, это может препятствовать образованию гигаseal. - Исследуйте выделенную эндолизосому под микроскопом.
4. Формирование Gigaseal
- Заполните только что отполированную патч-пипетку подходящим раствором для пипетки и установите пипетку на передний конец усилителя.
- Подайте на пипетку положительное давление 20 - 50 мбар (или используйте 0,03-0,05 мл из шприца объемом 1 мл для контроля давления) и поддерживайте это давление (заблокируйте клапан).
ПРИМЕЧАНИЕ: 1 мбар (миллибар) = 0,001 бар = 0,1 кПа (килопаскаль) = 1 гПа (гектопаскаль) = 1 000 дин/см2. - Переместив наконечник пипетки в раствор для ванны в центре поля зрения, убедитесь, что давление достаточно высокое, чтобы увидеть, как жидкость течет в раствор для ванны.
- Применяйте повторяющиеся импульсы тока (+5 мВ; 5 мс) для определения сопротивления пипетки, сопротивления уплотнения и последовательного сопротивления. Контролируйте размер наконечника пипетки, формирование уплотнения и создание цельноэндолизосомальной конфигурации.
- Быстро переместите пипетку близко к верхней части целевого пузырька. Подносите пипетку к пузырьку до тех пор, пока везикула не начнет двигаться или сворачиваться под действием потока жидкости из пипетки (рисунок 5).
- Отрегулируйте напряжение смещения пипетки на 0 мВ. Немедленно сбросьте положительное давление. В идеале везикула должна быть притянута к пипетке и соединена с мембраной, образуя гигауплотнение (1-20 ГОм) в течение 1 с. Обратите внимание на снижение до <10 пА амплитуды тока, вызванного импульсом напряжения 5 мВ, что указывает на успешное формирование гигауплотнения.
ПРИМЕЧАНИЕ: Стабильное положительное давление имеет важное значение для формирования гигасил. Иногда утечки в трубках могут предотвратить образование гигауплотнений. Рекомендуется использовать манометр, чтобы убедиться в отсутствии утечек. При обнаружении утечки снова прикрепите трубку или нанесите небольшое количество вазелина на швы, чтобы улучшить герметичность.
5. Измерение тока
- Разрыв мембраны
ПРИМЕЧАНИЕ: В зависимости от экспериментальных потребностей, контакт электрода с мембраной можно разделить на четыре режима: режим прикрепления к клетке, режим всей клетки, режим изнутри-наружу и режим наружу-наружу (рис. 6).- Для регистрации всего везикулы используйте высоковольтный короткий импульс (ZAP-импульс) длительностью 200 μс или 500 μс , чтобы разорвать мембрану в точке контакта между пипеткой и органеллой. Установите напряжение от -500 мВ до -1 200 мВ, уменьшая его каждый раз на 100 мВ до тех пор, пока мембрана не будет нарушена.
- Для режима «изнутри-наружу» (одноканальная запись) после формирования гигауплотнения потяните пипетку в сторону от органеллы, оторвав небольшой кусочек мембраны, обнажив сторону, которая изначально была обращена к просвету везикулы.
- Для режима «снаружи-наружу», после формирования гигасил и перехода к режиму полного везикулы, оттяните пипетку от органеллы, отрывая небольшой кусочек мембраны, сохраняя при этом небольшую везикулярную структуру.
- Текущая запись
- Запишите ток через эндолизосомальную мембрану по мере изменения входного напряжения в экспериментах с эндолизосомальным напряжением.
- Контролируйте эти напряжения с помощью ступеней напряжения или линейных изменений напряжения; использовать широкий диапазон входных напряжений (например, от -100 мВ до +100 мВ) в экспериментах с эндолизосомальными зажимами напряжения.
- Запишите ток через эндолизосомальную мембрану по мере изменения входного напряжения в экспериментах с эндолизосомальным напряжением.
Результаты
Ниже описаны современные формы, наблюдаемые во время экспериментов с эндолизосомальными пластырями. Если текущая форма не соответствует ожидаемой, это может быть связано с плохим контактом или утечкой. Плохой контакт может произойти, если электрод сравнения не полностью контактирует с раствором ванны или если электрод пипетки вот-вот сломается. Утечка может произойти, если между камерой и покровным стеклом есть зазор, позволяющий жидкости стекать на линзу объектива или предметный стол; Слишком большое или слишком малое количество раствора для пипетки также может привести к таким аномалиям.
Введение иглы в раствор/контакт иглы с поверхностью клетки/ZAP
Во время установления режима, присоединенного лизосомой (образование гигасил), реакция тока быстро уменьшается. Сопротивление уплотнения можно определить, разделив командное напряжение на низкое значение оставшегося тока (Рисунок 7).
Пандус/утечка
Многократное применение непрерывного входного напряжения в диапазоне от -100 мВ до +100 мВ позволяет регистрировать ток через эндолизосомальную мембрану с течением времени (рис. 8). При использовании стандартных растворов ионный состав внутри и снаружи органеллы отличается. Если канал проявляет селективность, точка пересечения вольт-амперной кривой не будет равна нулю из-за разной проницаемости ионов, входящих и выходящих. Эта точка пересечения называется обратным потенциалом канала, и рассчитать ее можно по следующей формуле10:
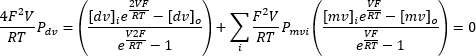
Где dv: двухвалентные ионы; MV: одновалентные ионы; i: внутренние; o: внешние; P: проницаемость мембраны для ионов S, измеряемая в м·с−1; V: трансмембранный потенциал в вольтах; F: постоянная Фарадея, равная 96 485 C·моль-1 или Дж· V−1·моль−1; R: газовая постоянная, равная 8,314 Дж· К−1·моль−1; T: абсолютная температура, измеряемая в кельвинах (= °C + 273,15).
В эндолизосомах могут присутствовать пассивные компоненты тока, связанные с проводимостью утечки и специфическими ионными каналами. Ток утечки характеризуется зависимостью линейного тока (I)-напряжения (V) с пересечением в начале координат. Токи утечки из эндолизосом, выделенных из нетрансфицированных клеток HEK293, составляют менее 50 пА при 100 мВ; Основными ионными каналами, вероятно, являются калиево-натриевые каналы проводимости и хлоридные каналы.
В случае ионных каналов, активируемых напряжением, компоненты тока утечки в измеряемом токе могут быть вычтены путем регистрации серии масштабированных импульсов напряжения до или после стимулирующих потенциал-зависимых эндолизосомальных токов. Утечка также может быть вычтена в автономном режиме. Амплитуда этих масштабированных импульсов обычно составляет одну четверть или одну пятую амплитуды экспериментального импульса, процесс, известный как вычитание утечки P/4 или P/511. Из-за очень малой величины токов утечки вычитание P/4 или P/5 обычно не используется.
Клещи напряжения
Многократное применение ступенчатых скачков входного напряжения может регистрировать ток через эндолизосомальную мембрану при изменении напряжения. Это помогает определить, является ли канал потенциал-зависимым ионным каналом12. В дополнение к электрическим клещам, также возможны токоизмерительные клещи. Одноканальная активность может быть зарегистрирована с помощью доступных конфигураций в режиме клещей напряжения12. Обычно низкая плотность эндолизосомальных ионных каналов может препятствовать процессу получения патчей, содержащих один канал. Толстостенное стекло для пипеток является оптимальным материалом для изготовления электродов с маленькими наконечниками пипеток и низкой емкостью. Покрытие стекла Sylgard или воском может уменьшить емкость пипетки.
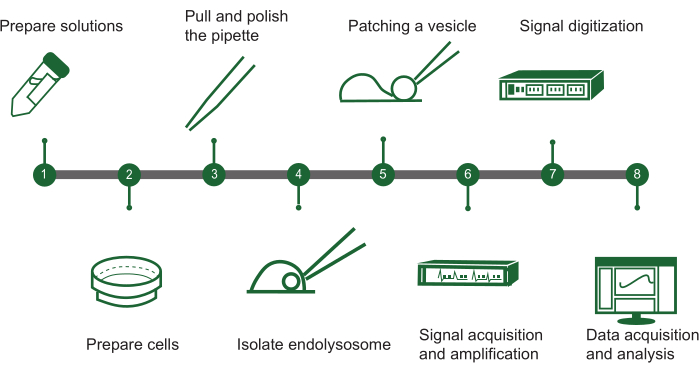
Рисунок 1: Обзор этапов эндолизосомального пластыря-зажима. Протокол оценки активности ионных каналов во внутриклеточных везикулах с использованием ручной эндолизосомальной системы пластыря-зажима может быть изложен в виде блок-схемы со следующими ключевыми этапами: (1) Приготовление раствора: Соберите все необходимые химические растворы. (2) Подготовка клеток: выращивание и подготовка клеток к эндолизосомальной экстракции. (3) Изготовление пипеток: Создайте и отполируйте пипетку с накладным зажимом для обеспечения точного использования. (4) Выделение эндолизосом: Вручную отделяйте эндолизосомы от культивируемых клеток. (5) Наложение повязки на везикулы: Прикрепите пипетку к одному эндолизосомальному пузырьку. (6) Захват сигнала: захват и усиление электрических сигналов от везикулы. (7) Оцифровка сигнала: преобразование аналоговых сигналов в цифровую форму для анализа. (8) Сбор и анализ данных: Соберите данные и интерпретируйте их для исследования функции ионного канала. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Настройка электрофизиологического оборудования. При двухэлектродных измерениях измерительный электрод контактирует с целевой мембраной, в то время как электрод сравнения помещается в раствор ванны. Разность потенциалов между ними усиливается усилителем, оцифровывается дигитайзером, а затем фиксируется компьютером. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Фармакологические инструменты, используемые для эндолизосомального анализа пластыря-зажима. Схема, показывающая диапазоны активности различных фармакологических средств для пластыря-зажима. Комбинация вортманнина и латрункулина В очень специфична для ранних эндосом, за исключением эндосом рециркуляции. YM201636 избирательно увеличивает поздние эндосомы/лизосомы. Вакуолин увеличивает ранние эндосомы, перерабатывая эндосомы, а также поздние эндосомы/лизосомы13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Выделение увеличенных органелл. Схематическая иллюстрация процесса ручной изоляции целевого везикулы от клетки. Этапы следующие: (1) Подготовка покровного стекла: Целевая клетка, содержащая целевой пузырь, помещается на покровное стекло. (2) Разрежьте плазматическую мембрану: Плазматическая мембрана клетки-мишени разрезается с помощью изоляционной пипетки. (3) Изолирующая пипетка: Изолирующая пипетка расположена так, чтобы нацеливаться на везикулу. (4) Выдавите целевой везикулу за пределы клетки: целевой везикул осторожно выдавливается за пределы клетки с помощью изолирующей пипетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Иллюстрация 5: Рекомендуемое взаимное расположение между патч-пипеткой и везикулой для формирования гигасила. После приложения положительного давления подойдите к органелле сверху с помощью патч-пипетки. Расположите наконечник примерно на одной трети пути от верхней части органеллы и медленно (режим 3-6) опускайте патч-пипетку до тех пор, пока положительное давление не заставит мембрану органеллы сдвинуться. Под микроскопом органелла должна сворачиваться или отталкиваться от кончика. В этот момент сбросьте положительное давление и подождите, пока сформируется гигауплотнение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Типы конфигураций. В зависимости от способа контакта между пипеткой и органеллой существует четыре различных режима измерения: органелла или везикула, цельная везикула, изнутри наружу и снаружи наружу. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
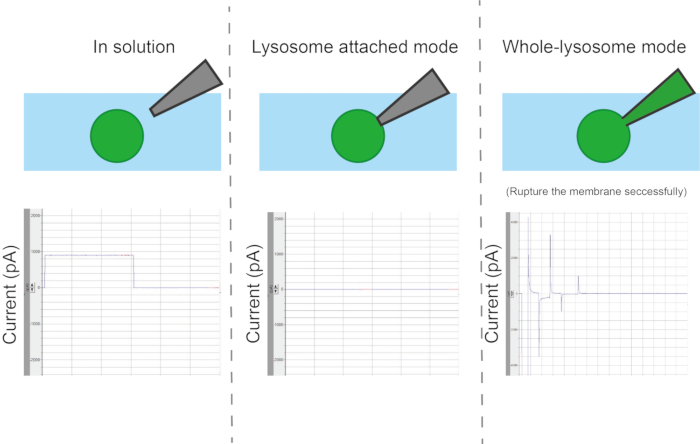
Рисунок 7: Токи для расчета сопротивления пипетки, сопротивления уплотнения, последовательного сопротивления и емкости ячейки. Записывающая пипетка помещается в раствор для ванны, и прямоугольный импульс напряжения (длительностью 5 мс, 5 мВ) создает почти прямоугольную характеристику тока. Сопротивление пипетки можно определить, разделив приложенное напряжение на измеренный ток. Поскольку гигасил формируется в режиме присоединения лизосом, реакция тока быстро уменьшается. Сопротивление уплотнения можно рассчитать, разделив напряжение на оставшийся, очень малый ток. При подаче импульса ZAP мембрана быстро разрывается, что приводит к увеличению емкостных токов, сигнализируя о переходе в цельноэндолизосомальную конфигурацию. Для сферической эндолизосомы результирующий ток следует одной экспоненциальной функции времени. Последовательное сопротивление определяется делением амплитуды емкостного тока на командное напряжение, а емкость эндолизосомы вычисляется делением постоянной времени емкостных токов на последовательное сопротивление12. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
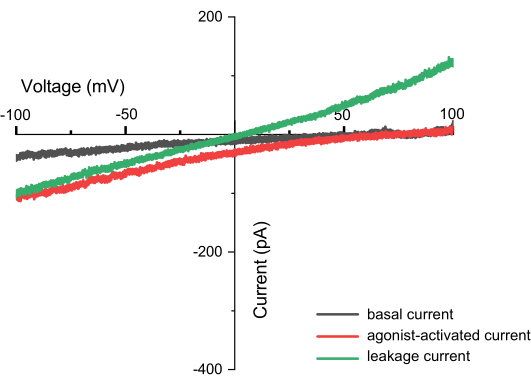
Рисунок 8: Течения, наблюдаемые во время записи линейного изменения (например, TPC2). Это график зависимости ток-напряжение (ВАХ), где ось X представляет напряжение в диапазоне от -100 до +100 мВ, а ось Y указывает на ток, генерируемый при различных напряжениях. На графике в качестве примера используются измерения из канала TPC2. Черная линия показывает результаты, полученные непосредственно после подачи импульса ZAP, красная линия представляет ток, генерируемый при активации канала TPC2 агонистом TPC2-A1N, а зеленая линия указывает на ток утечки, который может возникнуть в результате неполного уплотнения. Успешное измерение может быть определено не только по захвату формы канала, но и по отсутствию токов утечки. Если присутствуют токи утечки, то пересечение тока и оси X будет находиться в точке 0, образуя прямую линию (с разными ионами внутри и снаружи мембраны). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Пипетка для эндолизосомального пластыря | Цельноклеточный патч-пипетка | |||||||
| Цикл | ЖАРА | ТЯНУТЬ | ВЭЛ | ВРЕМЯ | ЖАРА | ТЯНУТЬ | ВЭЛ | ВРЕМЯ |
| 1 | Значение определяется протоколом линейного изменения +10 | Пустой | 30 | 150 | Значение определяется протоколом линейного изменения +10 | Пустой | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | Значение определяется протоколом рампы +25 | 18 | 150 | - | - | |||
| 6 | Значение определяется протоколом рампы +20 | 15 | 150 | - | - | |||
Таблица 1: Протокол вытягивания патч-пипетки. Сначала используйте функцию пандуса, чтобы найти подходящую температуру HEAT , затем следуйте таблице, чтобы отрегулировать шесть циклов вытягивания.
| Неспецифические эндолизосомы (вакуолин-1) / специфические LE/LY (YM201636) | Макрофаг | 1 μМ / 0,4 μМ | 1-2 ч / 1-3 ч |
| COS-1, HEK293, Hela, фибробласты и т.д. | 1 μМ / 0,4 μМ | Ночевка / Ночевка | |
| Кардиомиоциты, клетки скелетных мышц | 5 мкМ | 24-48 ч |
Таблица 2: Концентрация и продолжительность лечения, необходимые для увеличения эндолизосом в различных типах клеток с использованием фармакологических агентов. Различные типы клеток демонстрируют значительные различия в эффективности увеличения при медикаментозном лечении. Как правило, клетки с более активной эндолизосомальной системой требуют более короткого времени лечения. Тем не менее, оптимальное время лечения и концентрацию все еще необходимо определить экспериментальным путем.
Обсуждение
Электрофизиологические экспериментальные установки предъявляют четыре основных лабораторных требования: i) окружающая среда: методы сохранения образца в здоровом состоянии; ii) оптика: методы визуализации образца; iii) механика: методы стабильного позиционирования микроэлектрода; и iv) электроника: методы усиления и записи сигнала.
Для успешного проведения эндолизосомальных экспериментов с наложением пластыря и зажима решающее значение имеют несколько ключевых этапов. Во-первых, состояние клеток – клетки должны быть плотно прилегать к покровному стеклу, чтобы при использовании изоляционной пипетки для разрушения клеток вся клетка не двигалась. Важно убедиться, что клетки здоровы и хорошо распределены. Если элементы не могут оставаться на месте, может помочь переход на соответствующее покрытие на покровном листе. Кроме того, необходимо контролировать плотность клеток. Когда плотность клеток слишком высока (более 90%), эффективность лекарственного увеличения органелл снижается, что затрудняет проведение экспериментов. Во-вторых, качество патч-пипетки – наконечник патч-пипетки должен быть соответствующего размера (5-8 МОм), а стекло с обеих сторон должно быть гладким и параллельным.
В-третьих, во время формирования гигауплотнения, если оно не образуется сразу после сброса положительного давления, может помочь применение умеренного количества отрицательного давления. Однако после того, как гигасил сформирован, отрицательное давление должно быть немедленно сброшено, чтобы избежать риска всасывания всего везикулы в пипетку. Кроме того, при выполнении целоэндолизосомного патч-зажима необходимо разорвать небольшую часть мембраны. Из-за отсутствия цитоскелета в эндолизосомах они очень хрупкие и часто становятся нестабильными, из-за чего части всасываются в пипетку. В этом случае может помочь приложение легкого положительного давления для выталкивания всасываемой части. Если емкость оставшейся органеллы на кончике пипетки составляет менее 1 пФ, это указывает на то, что осталось очень мало мембраны, которая, вероятно, не содержит интересующих каналов. В таких случаях рекомендуется попробовать новую пузырьку. Наконец, при добавлении лекарств избегайте прямого удара по наконечнику пипетки, так как быстрый поток жидкости может нарушить работу гигауплотнения. Кроме того, при попадании в клетку Фарадея экспериментатор должен быть достаточно заземлен, чтобы избежать генерации чрезмерных шумовых сигналов, которые могут затруднить наблюдение за ценными результатами.
Текущие записи всей эндолизосомальной структуры представляют трудности, поскольку факторы по обе стороны эндолизосомальной мембраны могут быть потеряны, что потенциально может привести к изменению характеристик стробирования во время записи. Во-первых, зависящие от времени изменения характеристик тока могут быть результатом разбавления или потери специфических регуляторов (малых молекул или других факторов) раствором пипетки в лизосомальном просвете. Кроме того, компоненты пипетки или цитозольного раствора могут модулировать специфические пути второго посредника, которые регулируют эндолизосомальные ионные каналы. Сочетание эндолизосомно-прикрепленного режима с методами перфорированного пластыря было бы идеальным для решения конкретных проблем, возникающих на люминальной стороне эндолизосомальной мембраны.
Во-вторых, при эндолизосомальной записи пластыря-зажима, поскольку цитозольная сторона мембраны подвергается воздействию записывающего раствора (цитозольного раствора), небольшие молекулы или факторы, связанные с цитозольной стороной эндолизосомальной мембраны, могут быть смыты. Было показано, что АТФ блокирует ТПК с цитозольной стороны мембраны14. Тщательное проектирование раствора для ванны (например, обеспечение отсутствия АТФ в цитозольном растворе для записи) может свести к минимуму эту конкретную проблему. Выполнение зависящих от времени элементов управления и инициирование конкретных протоколов в течение последовательного времени после создания конфигураций полноэндолизосомальной записи также может помочь в решении этой проблемы. Другой проблемой может быть потеря регуляторных белков, связанных с эндолизосомальными ионными каналами, из-за вымывания. Если эти регуляторные факторы являются частью сигнального каскада, физиологическая регуляция эндолизосомальных каналов может быть утрачена.
С технической точки зрения, хотя эндолизосомальный пластырь-зажим в настоящее время является наиболее часто используемым электрофизиологическим методом для изучения эндолизосомальных ионных каналов, он обычно требует увеличения везикул и ручной изоляции выбранных везикул. Это ограничение присуще электрофизиологическим методикам на основе электродов капиллярного стекла. Отсутствие цитоскелета для поддержания стабильности органелл и интерференция от внутриклеточных филаментов остаются основными причинами низкого уровня успеха этих экспериментов. Помимо накопления опыта электрофизиологами, будущие достижения в области передовых оптических систем и высокоточных флуоресцентных низкомолекулярных инструментов могут позволить измерять активность ионных каналов в отдельных органеллах внутри отдельных клеток.
Раскрытие информации
Авторы не имеют конкурирующих финансовых интересов или иного конфликта интересов.
Благодарности
Национальный совет по науке и технологиям Тайваня (MOST 110-2320-B-002-022), Национальный университет Тайваня (NTU-112L7818) и Национальные научно-исследовательские институты здравоохранения Тайваня (NHRI-EX112-11119SC).
Материалы
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
Ссылки
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.