Method Article
단일 Endolysosomal 소포 분석을 위한 Patch-Clamp 기법
요약
이 프로토콜은 수동 endolysomal patch-clamp system을 사용하여 세포 내 소포의 이온 채널 활성을 직접 측정하는 방법을 자세히 설명합니다. 엔도리소좀(endolysosome)을 확대하고 이러한 소포를 수동으로 분리하는 방법을 설명합니다. 이 접근 방식을 통해 연구원은 절차를 정확하게 복제하고 적용할 수 있습니다.
초록
엔도리소좀 이온 채널은 엔도리소좀 이온 및 pH 항상성, 막 전위 조절 및 소포 이동에 매우 중요합니다. 그러나 작은 세포 내 소포체 내에서 이러한 채널에 전기생리학적으로 접근하는 것은 어려운 일이었습니다. 엔도리소좀 패치 클램프 기술의 개발은 이 장벽을 극복하는 데 중요한 역할을 했으며, 엔도리소좀 막에서 이온 채널 활성을 직접 측정할 수 있게 되었습니다.
기존의 평면 패치 클램프 기술과 비교하여 엔도리소좀 패치 클램프는 여러 세포를 동시에 기록하고 다른 측정 방법과 쉽게 결합할 수 있습니다. 수동 작동은 표적 소포를 시각화할 수 있는 이점을 제공합니다. 또한 엔도리소좀 막의 한쪽 면에 Ca2+ 가 반드시 존재하는 한계를 해결하여 실험 설계의 유연성을 높입니다. 엔도리소좀 patch-clamp 기술을 사용하면 엔도리소좀 내 이온 채널 활성을 직접 측정하고 분석할 수 있습니다.
비정상적인 엔도리소좀 이온 채널 기능과 신경퇴행성 질환 및 대사 장애와 같은 질병 사이의 밀접한 연관성을 감안할 때, 이러한 채널을 조사하고 조절하면 새로운 약물 표적을 밝힐 수 있습니다. 세포 내 이온 균형을 회복함으로써 관련 질병을 완화하거나 치료할 수 있습니다. 따라서 이 기술은 새로운 약물 표적을 발견하고 관련 약물을 개발하는 데 중추적인 역할을 합니다.
서문
이온 채널은 수많은 생리학적 과정에서 중요한 역할을 합니다. 표면 이온 채널은 상당한 주목을 받았지만, 세포 내 채널, 특히 엔도리소좀 내의 채널의 중요성은 점차 인정되고 있습니다. 엔도소좀 시스템은 재활용 엔도솜(RE), 초기 엔도솜(EE), 후기 엔도솜(LE), 리소좀(LY) 및 엔도소좀 및 식체(phagosome) 및 자가포식솜과 같은 기타 구획 특성을 모두 가진 하이브리드 소기관을 포함한 기본적인 세포 기능에 특화된 다기능 막 결합 소기관으로 구성됩니다.
분류 엔도솜(SE)이라고도 하는 EE는 원형질막(PM)에서 내재화된 물질의 초기 목적지 중 하나입니다. EE는 분해를 위해 LE/LY로 가는 성숙 경로, PM으로 돌아가는 빠른 재활용 경로, 재활용 구획 또는 주변 RE와 관련된 느린 재활용 경로와 같은 다양한 내세포 경로로 화물을 분류하는 중요한 구획입니다. 엔도솜에서 파생된 다소포체(Multivesicular body, MVB)는 제한 막(limiting membrane)으로 둘러싸인 구형 구획으로, ILV(intraluminal vesicles)로 채워질 수 있습니다1. 이러한 소기관의 정상적인 기능을 유지하려면 소포 pH, 삼투압 및 신호 전달을 조절하는 멤브레인 이온 채널이 필요합니다. 그러나 이러한 채널의 활동을 측정하는 것은 간단하지 않습니다.
원형질막에 위치한 이온 채널의 경우, 1970년대에 개발된 패치 클램프 기법은 오랫동안 황금 표준 방법2이었습니다. 그러나 작은 세포 내 소포체 내에서 전기생리학적으로 채널에 접근하는 것은 여전히 어려운 과제로 남아 있습니다. 원형질막의 이온 채널을 측정하기 위한 황금 표준을 세포 내 소기관에 적용하는 것은 세 가지 주요 과제에 직면해 있습니다. 첫째, 엔돌리소좀의 크기는 일반적으로 매우 작아서(직경 1μm 미만) 현미경으로 관찰 및 분리하기 어렵고 일반적인 유리 마이크로피펫의 개구부 직경보다 작아 실험이 작동하지 않습니다. 둘째, 세포 소기관 무결성을 유지하면서 표적 세포에서 직접 엔도리소좀을 분리하려면 특별한 기술이 필요합니다. 셋째, 세포 내 소기관에 세포골격이 없기 때문에 패치 피펫 내의 내분해체 막에 밀봉을 형성한 다음 이를 파열하여 전체 내소체 구성을 달성하는 것은 소기관의 구조적 무결성을 손상시키기 때문에 어려울 수 있습니다3.
이러한 문제를 극복하기 위해 지질 이중층 기록, 리소좀 표적 염기서열 수정, 고체 지지 막 기반 전기생리학(SSM 또는 SSME) 기술을 포함한 여러 방법이 개발되었습니다. 지질 이중층 기록 방법은 정제된 이온 채널로 합성 인지질막을 재구성하는 것을 포함하며, 이를 통해 통제된 조건 하에서 막 단백질 기능에 대한 상세한 전기생리학적 연구를 수행할 수 있습니다 4,5. 이온 채널의 리소좀 표적화 염기서열 수정에는 기존의 patch-clamp 방법6을 사용하여 측정하기 위해 엔도리소좀 이온 채널을 원형질막으로 리디렉션하는 것이 포함됩니다. 엔도리소좀 평면 패치 클램프 방법이라고도 하는 고체 지지 멤브레인 기반 전기생리학(SSM 또는 SSME) 기술은 미세 구조 평면 붕규산염 칩에 작은 구멍(직경 <1μm)이 있는 고체 기판 평면 유리 칩을 사용합니다. 이 작은 조리개 유리 칩을 사용하면 압력 흡입 제어 시스템(Nanion)을 사용하여 작고 균일한 천연 분해체를 분석할 수 있습니다. 그러나 처음 두 가지 방법에서는 이온 채널이 자연적인 생리학적 환경에 있지 않습니다. 원형질막에서 발현되거나 지질 이중층으로 재구성된 리소좀 채널을 기록하려는 시도는 대체로 불확실하고 모순적인 결과를 낳았습니다.
평면 패치 클램프 기술은 인공 간섭 문제를 효과적으로 해결하고 고처리량 측정의 이점을 제공하지만, 사용되는 솔루션도 이 방법에 의해 제한됩니다. 이 기사에서 소개한 엔도리소좀 패치 클램프 기술은 여러 세포를 동시에 기록하고 다른 측정 방법과 쉽게 결합할 수 있습니다. 수동 작업은 대상 소포를 시각화할 수 있는 이점을 제공합니다. 또한 내염색체 막의 한쪽 면에 있는 용액에서 Ca2+의 피할 수 없는 한계를 극복하여 실험 설계3의 자유도를 높입니다. 최근에는 엔도리소좀 패치 클램프 기술이 약물 개발 연구에서 핵심적인 역할을 하고 있습니다. 예를 들어, 신경 퇴행성 질환에서 이 기술은 알츠하이머병 및 파킨슨병과 관련된 엔도리소좀 이온 채널을 표적으로 하는 신약을 식별하는 데 도움이 되었습니다 7,8. 연구자들은 또한 이 기술을 사용하여 종양 세포9에서 엔도리소좀 이온 채널의 역할을 탐구하여 종양의 성장과 증식을 제어할 수 있습니다. 대사 질환과 관련하여, 엔도리소좀 패치-클램프 연구는 엔도리소좀 이온 채널을 조절하는 화합물을 밝혀내고 있으며, 당뇨병과 비만에 대한 새로운 치료 접근법을 제공하고 있습니다. 엔도리소좀 패치-클램프 기법은 엔도리소좀 기능 장애를 이해하고 잠재적인 치료법을 찾는 데 도움이 되며6, 엔도리소좀 이온 채널 기능에 대한 이해를 크게 높이고 신약 표적의 발견을 촉진합니다.
프로토콜
1. 기기 설정
- 하드웨어
알림: 표준 전기생리학 장비 설정은 그림 1 을 참조하십시오.- 테이블과 패러데이 케이지를 사용하여 외부 간섭으로부터 설정을 보호하십시오.
- 미세 전극을 안정적으로 배치하기 위해 미세 매니퓰레이터가 있는 도립 현미경을 사용하십시오.
- amp수집된 신호를 수집하고 증폭하기 위해 liifier를 설정합니다.
- 디지타이저를 사용하여 아날로그 신호를 디지털 신호로 변환합니다.
- 데이터 수집 및 분석 소프트웨어를 사용하여 실험 프로토콜을 설정하고 수집된 데이터에서 의미 있고 분석 가능한 결과를 추출합니다.
- 전극
- 두 개의 전극을 사용하십시오 : 수조 전극과 피펫 전극.
참고: 백금과 염화은은 최상의 편광 특성을 가지고 있습니다. 염화은 전극은 염화된 은 와이어 또는 펠릿으로 구성되므로 와이어 또는 펠릿의 외부 표면에 AgCl 층이 있습니다(그림 2).
- 두 개의 전극을 사용하십시오 : 수조 전극과 피펫 전극.
- 피펫 준비
- 당기
- 풀러에 모세관을 설치합니다.
참고: 아래 피펫 제작에 사용되는 매개변수는 기기에 따라 다릅니다. 이 논문에서 사용한 기기는 Table of Materials에 언급되어 있습니다. - 히터 필라멘트를 태우지 않는 실험 조건(실온 22°C, 관통형 히터 필라멘트, 필라멘트가 있는 붕규산 유리)에서 풀러에 대한 RAMP 테스트를 실행하여 유리 모세관을 녹이는 데 필요한 열값 (HEAT)을 측정합니다.
- HEAT, 속도(VEL) 및 시간(TIME) 매개변수를 사용하여 6개의 개별 풀 사이클로 새로운 풀링 프로그램을 설계합니다(표 1).
알림: HEAT 는 히터의 필라멘트를 가열하여 유리 필라멘트가 녹을 수 있도록 하는 매개변수를 나타냅니다. 속도는 풀러가 필라멘트를 양방향으로 당기는 속도를 나타냅니다. 시간은 각 주기 사이의 간격의 지속 시간을 나타냅니다. - 키패드의 녹색 당기기 버튼을 누릅니다.
- CL을 느슨하게amp손잡이를 잡고 풀러에서 피펫을 제거합니다.
- 마이크로포지의 접안렌즈 아래에 있는 피펫 팁을 검사하여 팁 직경, 선명도 및 형상을 확인합니다. 팁 직경이 0.5-0.9μm인지 확인합니다.
참고: 필라멘트가 더 자주 사용됨에 따라 유리 모세관을 녹이는 데 필요한 열 값이 변합니다. - 팁 크기가 기대에 미치지 못하면 HEAT 및 VEL 매개변수를 조정하십시오. 더 높은 온도와 더 빠른 속도는 더 미세하고 긴 팁을 생성하며 그 반대의 경우도 마찬가지입니다. HEAT를 5도 단위로 조정하고 속도를 3씩 조정합니다.
- 풀러에 모세관을 설치합니다.
- 연마
- 당겨진 패치 피펫을 마이크로포지 홀더에 넣습니다.
- 35x 대물렌즈(15x 접안렌즈와 결합하여 525x 배율)를 사용하여 피펫 팁을 검사합니다.
- 마이크로 매니퓰레이터를 사용하여 패치 피펫을 필라멘트에 가깝게 가져옵니다.
- 온도 다이얼을 80으로 설정합니다.
- 풋스위치를 사용하여 히터를 켜고 짧은 열 펄스 (1 - 2초)를 가하여 microforge 접안렌즈를 통해 연마 과정을 모니터링합니다.
- 모든 피펫이 연마될 때까지 이 과정을 반복합니다.
- 완성된 피펫을 밀봉된 상자에 넣어 먼지가 들어가지 않도록 합니다.
참고: 목표는 팁을 빠르게 녹여서 유리가 너무 날카롭게 만들지 않고 최종 팁 형상을 변형하도록 하는 것입니다. 이는 피펫이 눌려진 소포막을 관통하는 것을 방지하고 밀봉 형성을 효과적으로 촉진합니다. 최종 연마 후 피펫 팁의 내부 경로는 매우 좁고 직선이며 선형이어야 합니다.
가장 잘 기록되는 피펫은 일반적으로 화재 연마 후 5 - 8 MΩ의 저항을 갖습니다. 팁 개구부 직경은 2μm여야 합니다. 완벽하게 연마된 패치 피펫은 성공적인 기가씰 형성에 필수적이며, 이는 절차의 성공에 중요한 핵심 기술 중 하나이기 때문입니다.
- 당기
2. 시료 준비
- 세포 배양(HEK293을 예로 사용)
- 표준 가습 인큐베이터에서 37°C에서 5% CO2로 세포를 배양합니다.
- 10% 열 비활성화 소 태아 혈청(FBS), 100 U/mL 페니실린 및 100 mg/mL 스트렙토마이신이 보충된 저혈당 DMEM에서 HEK293 세포를 배양합니다.
- 폴리-L-라이신 코팅된 12mm 커버슬립을 24웰 플레이트에 놓습니다.
- 소기관 확대
- 24웰 플레이트의 HEK293 세포에 1μM vacuolin-1을 추가하고(단계 2.1에서) 비대해진 소포가 형성되기 시작할 때까지 37°C에서 5% CO2 로 하룻밤 동안 배양합니다.
참고: 확대된 엔도리소좀의 크기는 도구, 화합물, 배양 시간 및 세포 유형에 따라 1-10μm에 달할 수 있습니다(그림 3 및 표 2).
- 24웰 플레이트의 HEK293 세포에 1μM vacuolin-1을 추가하고(단계 2.1에서) 비대해진 소포가 형성되기 시작할 때까지 37°C에서 5% CO2 로 하룻밤 동안 배양합니다.
- 용액 준비
참고: 표준 용액 준비는 세포와 세포 기관 내부의 이온 농도를 시뮬레이션하는 것을 목표로 합니다. 예를 들어, 리소좀에서 이온 채널을 측정하기 위한 표준 솔루션은 다음과 같습니다.- 수조 용액 준비 (mM) : 140 K- 메탄 설포 네이트 (MSA), 5 KOH, 4 NaCl, 0.39 CaCl2, 1 EGTA, 10 HEPES. KOH로 pH를 7.2로 조정합니다. 포도당으로 삼투압을 300mosm/L로 조정합니다.
- 피펫 용액 준비 (mM) : 140 Na-MSA, 5 K-MSA, 2 Ca-MSA, 1 CaCl2, 10 Hepes, 10 MES. MSA를 사용하여 pH를 4.6으로 조정합니다. 포도당으로 삼투압을 310 mosm/L로 조정합니다.
참고: 용액을 0.2μm 필터에 통과시키고 50mL 코니컬 튜브에 45mL 부분 표본을 준비한 다음 4°C에서 최대 2-4주 동안 보관합니다.
3. 세포 기관 격리
- 24웰 플레이트에서 처리된 세포가 있는 커버슬립(섹션 2 참조)을 제거하고 현미경 챔버로 옮긴 다음 1mL의 수조 용액을 추가합니다.
참고: 세포는 내분해체 분리, 밀봉 및 기록을 포함하는 전체 내분해체 패치 클램프 실험의 경우 >1시간 동안 수조 용액에 보관해서는 안 됩니다. 1시간이 지나면 확대된 엔도리소좀이 줄어들고 피펫에 달라붙어 분리하기 어려워집니다. - 집에서 만든 플라스틱 충전 바늘을 사용하여 절연 피펫에 피펫 용액을 채우고 패치 cl의 전면 끝에 피펫을 설치합니다.amp 설정.
- micromanipulator의 대각선 이동 각도를 30°(공장 기본값)에 가깝게 설정합니다.
- 현미경(대물렌즈 40개 및 접안렌즈 10개)으로 세포를 검사하여 세포막 가장자리 근처에 위치한 충분히 확대된 엔도솜 또는 리소좀이 있는지 격리를 위해 세포를 검사합니다. 분리 피펫을 선택한 셀 가까이로 이동합니다.
- micromanipulator를 사용하여 원형질막의 가장자리에 닿을 때까지 분리 피펫을 내립니다(그림 4). 격리 피펫을 수평으로 빠르게 움직여 원형질막의 작은 조각을 떼어냅니다.
- 동일한 피펫을 사용하여 반대쪽에서 세포를 눌러 엔도솜/리소좀을 세포에서 ~2μm 거리까지 짜냅니다.
참고: 세포 소기관에 잔류 세포막이 있으면 기가씰의 형성을 방해할 수 있습니다. - 현미경으로 분리된 내분해체를 검사합니다.
4. 기가씰 형성
- 갓 광택을 낸 패치 피펫에 적절한 피펫 용액을 채우고 앰프의 앞쪽 끝에 피펫을 설치합니다.
- 피펫에 20 - 50mbar 의 양압을 가하고(또는 압력 제어를 위해 1mL 주사기에서 0.03-0.05mL 사용) 이 압력을 유지합니다(밸브 잠금).
참고: 1mbar(밀리바) = 0.001bar = 0.1kPa(킬로파스칼) = 1hPa(헥토파스칼) = 1,000dyn/cm2. - 피펫 팁을 수조 용액으로 옮기고 시야 중앙에 있는 경우 압력이 수조 용액으로 흐르는 액체를 볼 수 있을 만큼 충분히 높은지 확인합니다.
- 반복 전류 펄스 (+5 mV, 5 ms) 를 적용하여 피펫 저항, 밀봉 저항 및 직렬 저항을 측정합니다. 피펫 팁 크기, 밀봉 형성 및 전체 엔도리소좀 구성 설정을 모니터링합니다.
- 피펫을 대상 소포의 상단 가까이로 빠르게 이동합니다. 피펫의 유체 흐름으로 인해 소포가 움직이거나 굴러갈 때까지 피펫을 소포 근처로 가져옵니다(그림 5).
- 피펫의 오프셋 전압을 0mV로 조정합니다. 즉시 양압을 해제하십시오. 이상적으로는 소포가 피펫 쪽으로 당겨져 멤브레인에 연결되어 1초 이내에 기가씰(1-20GΩ)을 형성합니다.5mV의 전압 펄스에 의해 유발되는 전류 진폭의 <10pA로 감소하는 것을 확인하며, 이는 성공적인 기가씰 형성을 나타냅니다.
참고: 안정적인 양압은 기가씰 형성에 필수적입니다. 때때로 튜브의 누출로 인해 기가씰이 형성되지 않을 수 있습니다. 누출이 없는지 확인하기 위해 압력 게이지를 사용하는 것이 좋습니다. 누출이 감지되면 튜브를 다시 부착하거나 이음새에 소량의 바셀린을 바르면 밀봉이 개선됩니다.
5. 전류 측정
- 멤브레인 파손
참고: 실험 요구 사항에 따라 전극-멤브레인 접촉은 세포 부착 모드, 전체 세포 모드, 인사이드-아웃 모드 및 아웃사이드-아웃 모드의 네 가지 모드로 분류할 수 있습니다(그림 6).- 전체 소포 기록의 경우 200μs 또는 500μs 의 고전압 단락 펄스(ZAP 펄스)를 사용하여 피펫과 소기관 사이의 접촉점에서 멤브레인을 절단합니다. 전압을 -500mV 에서 -1,200mV로 설정하고 멤브레인이 중단될 때까지 매번 100mV 씩 감소합니다.
- 인사이드 아웃(단일 채널 기록) 모드의 경우, 기가씰을 형성한 후 피펫을 소기관에서 당겨 멤브레인의 작은 조각을 떼어내고 원래 소포 내강을 향하고 있던 면을 노출시킵니다.
- 아웃사이드-아웃 모드의 경우, 기가씰을 형성하고 전체 소포 모드로 전환한 후 피펫을 소기관에서 당겨 작은 소포 구조를 유지하면서 멤브레인의 작은 조각을 떼어냅니다.
- 현재 녹음 중
- endolysosomal voltage-clamp patch-clamp 실험에서 입력 전압이 변할 때 endolysosomal membrane을 통과하는 전류를 기록합니다.
- 전압 단계 또는 전압 램프로 이러한 전압을 제어합니다. 엔도리소좀 전압 클램프 실험에서 광범위한 입력 전압( 예: -100 mV 에서 +100 mV)을 사용합니다.
- endolysosomal voltage-clamp patch-clamp 실험에서 입력 전압이 변할 때 endolysosomal membrane을 통과하는 전류를 기록합니다.
결과
다음은 endolysosomal patch-clamp 실험에서 관찰된 현재 모양에 대해 설명합니다. 현재 모양이 예상과 다르면 접촉 불량 또는 누출 때문일 수 있습니다. 기준 전극이 수조 용액과 완전히 접촉하지 않거나 피펫 전극이 파손되려고 하는 경우 접촉 불량이 발생할 수 있습니다. 챔버와 커버슬립 사이에 틈이 있어 유체가 대물 렌즈 또는 스테이지로 흐를 수 있는 경우 누출이 발생할 수 있습니다. 피펫 용액이 너무 많거나 너무 적으면 이러한 이상이 발생할 수도 있습니다.
용액에 바늘 삽입/바늘과 세포 표면 접촉/ZAP
리소좀 부착 모드(gigaseal 형성)가 설정되는 동안 전류 응답이 급격히 감소합니다. 밀봉 저항은 명령 전압을 낮은 잔류 전류량으로 나누어 확인할 수 있습니다(그림 7).
램프/누출
-100mV에서 +100mV 범위의 연속 입력 전압을 반복적으로 적용하면 시간이 지남에 따라 엔도리소좀 멤브레인을 통과하는 전류를 기록할 수 있습니다(그림 8). 표준 용액을 사용하면 세포 기관 내부와 외부의 이온 조성이 다릅니다. 채널이 선택성을 나타내면 전류-전압 곡선의 교차점은 들어오고 나가는 이온의 투과성이 다르기 때문에 0이 되지 않습니다. 이 교차점을 채널의 역전위라고 하며 다음 공식10을 사용하여 계산할 수 있습니다.
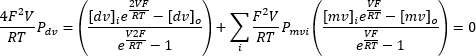
여기서 dv: 2가 이온; MV: 1가 이온; i: 내부; O: 외부; P: m·s−1로 측정된 이온 S에 대한 멤브레인의 투과성; V: 멤브레인 횡단 전위(볼트); F: 패러데이 상수, 96,485 C·mol−1 또는 J· V−1·몰−1; R: 기체 상수, 8.314 J· K−1·몰−1; T: 켈빈으로 측정된 절대 온도(= °C + 273.15).
엔도리소좀에서 누설 전도도 및 특정 이온 채널과 관련된 수동 전류 구성 요소가 있을 수 있습니다. 누설 전류는 원점에서 교차하는 선형 전류(I)-전압(V) 관계가 특징입니다. 형질 주입되지 않은 HEK293 세포에서 분리된 엔도리소좀의 누설 전류는 100mV에서 50pA 미만입니다. 기본 이온 채널은 칼륨/나트륨 전도성 채널과 염화물 채널일 가능성이 높습니다.
전압 활성화 이온 채널의 경우, 자극 전압 의존성 엔도리소좀 전류 전후에 일련의 스케일링된 전압 펄스를 기록하여 측정된 전류의 누설 전류 성분을 뺄 수 있습니다. 누출은 오프라인에서도 뺄 수 있습니다. 이러한 스케일링된 펄스의 진폭은 일반적으로 실험 펄스 진폭의 1/4 또는 1/5이며, 이는 P/4 또는 P/5 누출 감산11로 알려진 프로세스입니다. 누설 전류의 크기가 매우 작기 때문에 P/4 또는 P/5 감산은 일반적으로 사용되지 않습니다.
전압 클램프
입력 전압의 단계적 점프를 반복적으로 적용하면 전압이 변함에 따라 내분해체 막을 가로지르는 전류를 기록할 수 있습니다. 이는 채널이 전압 의존성 이온 채널12인지 여부를 결정하는 데 도움이 됩니다. 전압 클램프 외에도 전류 클램프도 가능합니다. 단일 채널 활동은 전압 클램프 모드12에서 사용 가능한 구성을 사용하여 기록할 수 있습니다. 일반적으로 엔도리소좀 이온 채널의 밀도가 낮기 때문에 단일 채널을 포함하는 패치를 얻는 과정을 방해할 수 있습니다. 두꺼운 벽의 피펫 유리는 피펫 팁이 작고 정전 용량이 낮은 전극을 생산하는 데 가장 적합한 재료입니다. 유리를 실가드 또는 왁스로 코팅하면 피펫 커패시턴스를 줄일 수 있습니다.
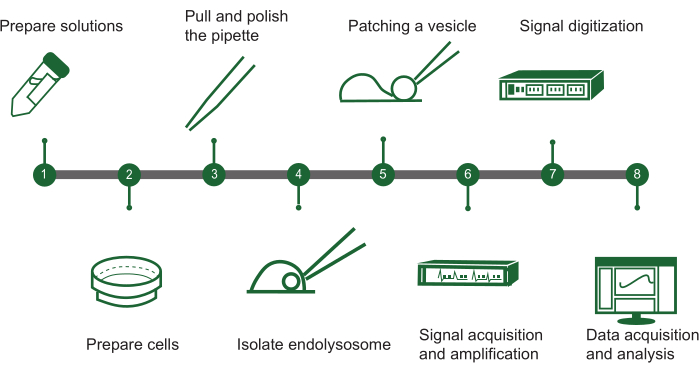
그림 1: endolysosomal patch-clamp 단계 개요. 수동 엔도리소좀 패치 클램프 시스템을 사용하여 세포 내 소포의 이온 채널 활성을 평가하기 위한 프로토콜은 다음 주요 단계가 포함된 순서도에 요약할 수 있습니다: (1) 용액 준비: 필요한 모든 화학 용액을 조립합니다. (2) 세포 준비: 세포를 성장시키고 endolysosomal 추출을 준비합니다. (3) 피펫 제작: 정확한 취급을 보장하기 위해 패치 클램프 피펫을 만들고 연마합니다. (4) 엔도리소좀 분리: 배양된 세포에서 엔도리소좀을 수동으로 분리합니다. (5) 소포 패치: 피펫을 단일 내분해체 소포에 부착합니다. (6) 신호 획득: 소포에서 전기 신호를 포착하고 증폭합니다. (7) 신호 디지털화: 분석을 위해 아날로그 신호를 디지털 형식으로 변환합니다. (8) 데이터 수집 및 분석: 데이터를 수집하고 해석하여 이온 채널 기능을 조사합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 전기생리학적 하드웨어 설정. 이중 전극 측정 중에 측정 전극은 대상 멤브레인과 접촉하고 기준 전극은 수조 용액에 배치됩니다. 둘 사이의 전위차는 증폭기에 의해 증폭되고 디지타이저에 의해 디지털화된 다음 컴퓨터에 의해 캡처됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: endolysosomal patch-clamp 분석에 사용되는 약리학적 도구. 패치 클램프에 대한 다양한 약리제의 활성 범위를 보여주는 개략도. 워트마닌(Wortmannin)과 라트룬쿨린 B(Latrunculin B)의 조합은 초기 엔도솜에 매우 특이적이며, 엔도솜 재활용은 제외됩니다. YM201636는 후기 엔도솜/리소좀을 선택적으로 확대합니다. Vacuolin은 초기 엔도솜을 확대하여 엔도솜을 재활용하며, 후기 엔도솜/리소좀을 재생한다13. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 확대된 소기관의 분리. 세포에서 표적 소포의 수동 분리 과정에 대한 개략도. 단계는 다음과 같습니다: (1) 커버슬립 준비: 타겟 소포를 포함하는 타겟 세포를 커버슬립에 배치합니다. (2) 원형질막 절단: 표적 세포의 원형질막을 격리 피펫을 사용하여 절단합니다. (3) 격리 피펫: 격리 피펫은 소포를 대상으로 배치됩니다. (4) 세포 외부로 타겟 소포를 짜내기: 격리 피펫을 사용하여 타겟 소포를 세포 외부로 조심스럽게 압착합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 기가씰 형성을 위한 패치 피펫과 소포 사이의 권장 상대 위치. 양압을 가한 후 패치 피펫으로 위에서 소기관에 접근합니다. 팁을 소기관 상단에서 약 1/3 지점에 배치하고 양압으로 인해 소기관 막이 움직일 때까지 패치 피펫을 천천히(모드 3-6) 내립니다. 현미경 아래에서 소기관은 굴러가거나 끝에서 밀려나야 합니다. 그 순간 양압을 해제하고 기가씰이 형성될 때까지 기다립니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 구성 유형. 피펫과 소기관 사이의 접촉 방법에 따라 4가지 측정 모드가 있습니다: 소기관 또는 소포 부착, 전체 소포, 인사이드-아웃 및 아웃사이드-아웃. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
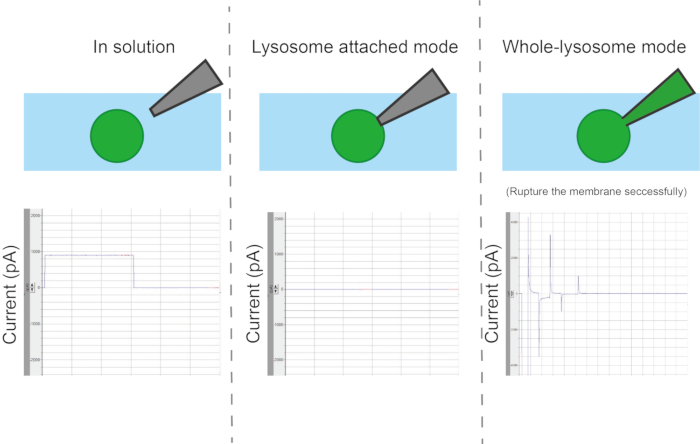
그림 7: 파이펫 저항, 밀봉 저항, 직렬 저항 및 셀 커패시턴스를 계산하기 위한 전류. 기록 피펫은 수조 용액에 배치되며 직사각형 전압 펄스(5ms 지속 시간, 5mV)는 거의 직사각형에 가까운 전류 응답을 생성합니다. 피펫의 저항은 적용된 전압을 측정된 전류로 나누어 결정할 수 있습니다. 기가씰이 리소좀 부착 모드에서 형성되기 때문에 전류 응답이 빠르게 감소합니다. 밀봉 저항은 전압을 나머지 매우 작은 전류로 나누어 계산할 수 있습니다. ZAP 펄스가 적용되면 멤브레인이 빠르게 파열되어 용량성 전류가 증가하여 전체 엔도리소좀 구성으로의 전환을 알립니다. 구형 엔도리소좀의 경우, 결과 전류는 시간의 단일 지수 함수를 따릅니다. 직렬 저항은 용량성 전류 진폭을 명령 전압으로 나누어 결정하고, 엔도리소좀의 용량값은 용량성 전류의 시간 상수를 직렬 저항12로 나누어 계산합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
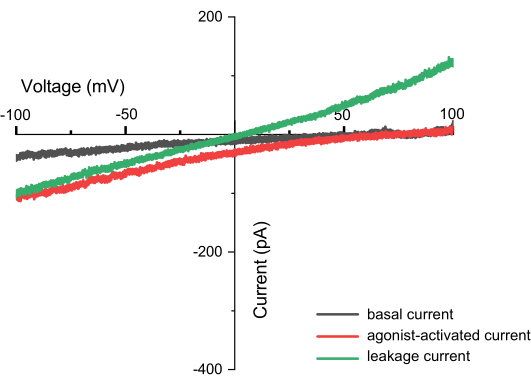
그림 8: 램프 기록 중 관찰된 전류(예: TPC2). 이것은 전류-전압(I-V) 관계 플롯으로, X축은 -100mV에서 +100mV 범위의 전압을 나타내고 Y축은 서로 다른 전압에서 생성된 전류를 나타냅니다. 이 그래프는 TPC2 채널의 측정값을 예로 사용합니다. 검은색 선은 ZAP 펄스를 적용한 직후 얻은 결과를 나타내고, 빨간색 선은 TPC2 채널이 작용제 TPC2-A1N에 의해 활성화될 때 생성되는 전류를 나타내고, 녹색 선은 불완전한 밀봉으로 인해 발생할 수 있는 누출 전류를 나타냅니다. 성공적인 측정은 채널의 모양을 캡처하는 것뿐만 아니라 누설 전류가 없는 것만으로 식별할 수 있습니다. 누설 전류가 존재하는 경우 전류와 X축의 교차점은 0이 되어 직선을 형성합니다(멤브레인 내부와 외부에 다른 이온이 있음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| Endolysosomal 패치 피펫 | 전체 세포 패치 피펫 | |||||||
| 주기 | 열 | 끌다 | 벨 | 시간 | 열 | 끌다 | 벨 | 시간 |
| 1 | 램프 프로토콜 +10에 의해 결정되는 값 | 빈 | 30 | 150 | 램프 프로토콜 +10에 의해 결정되는 값 | 빈 | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | 램프 프로토콜 +25에 의해 결정된 값 | 18 | 150 | - | - | |||
| 6 | 램프 프로토콜 +20에 의해 결정되는 값 | 15 | 150 | - | - | |||
표 1: 패치 피펫 풀링 프로토콜. 먼저 r을 사용합니다.amp 기능을 사용하여 적절한 HEAT 온도를 찾은 다음 표에 따라 6개의 당기기 주기를 조정합니다.
| 비특이적 엔도리소좀(Vacuolin-1) / 특이적 LE/LY(YM201636) | 대식세포 | 1 μM / 0.4 μM | 1-2시간 / 1-3시간 |
| COS-1, HEK293, 헬라, 섬유아세포 등 | 1 μM / 0.4 μM | 오버나이트 / 오버나이트 | |
| 심근세포, 골격근 세포 | 5 μM | 24-48 시간 |
표 2: 약리학적 제제를 사용하여 다양한 세포 유형에서 엔도리소좀을 확대하는 데 필요한 농도 및 치료 기간. 다른 세포 유형은 약물 치료에 따른 확대 효율에서 상당한 차이를 보입니다. 일반적으로 엔도리소좀 시스템이 더 활발한 세포는 더 짧은 치료 시간이 필요합니다. 그러나 최적의 처리 시간과 농도는 여전히 실험적으로 결정되어야 한다13.
토론
전기 생리학 실험 설정에는 네 가지 주요 실험실 요구 사항이 있습니다 : i) 환경 : 샘플을 건강하게 유지하는 방법; ii) 광학: 샘플을 시각화하는 방법; iii) 역학: 미세 전극을 안정적으로 배치하는 방법; 및 iv) 전자 장치: 신호를 증폭하고 기록하는 방법.
엔도리소좀 패치 클램프 실험을 성공적으로 수행하려면 몇 가지 주요 단계가 중요합니다. 첫째, 세포의 상태 - 세포는 분리 피펫을 사용하여 세포를 파괴 할 때 전체 세포가 움직이지 않도록 커버 슬립에 단단히 부착되어야합니다. 세포가 건강하고 잘 퍼져 있는지 확인하는 것이 중요합니다. 셀이 제자리에 고정된 상태를 유지할 수 없는 경우 커버슬립에 적절한 코팅으로 전환하는 것이 도움이 될 수 있습니다. 또한 세포 밀도를 모니터링해야 합니다. 세포 밀도가 너무 높으면(90% 이상) 약물 유도 소기관 확대의 효과가 감소하여 실험을 수행하기 어렵게 됩니다. 둘째, 패치 피펫의 품질 - 패치 피펫 팁은 적절한 크기 (5-8 MΩ) 여야하며 양쪽의 유리는 매끄럽고 평행해야합니다.
셋째, 기가씰이 형성되는 동안 양압을 해제한 직후 형성되지 않으면 적당한 양의 음압을 가하는 것이 도움이 될 수 있습니다. 그러나 일단 기가씰이 형성되면 전체 소포가 피펫으로 빨려 들어갈 위험을 피하기 위해 음압을 즉시 해제해야 합니다. 또한 전체 엔도리소좀 패치 클램프를 수행할 때 멤브레인의 작은 부분을 파열해야 합니다. 엔도리소좀에는 세포골격이 없기 때문에 매우 취약하고 종종 불안정해져서 부품이 피펫으로 빨려 들어갈 수 있습니다. 이 경우 흡입된 부분을 밀어내기 위해 약간의 양압을 가하면 도움이 될 수 있습니다. 피펫 팁에 남아 있는 소기관의 커패시턴스가 1pF 미만인 경우, 남아 있는 멤브레인이 매우 적으며 관심 채널을 포함하지 않을 가능성이 있음을 나타냅니다. 이러한 경우 새로운 소포를 시도하는 것이 좋습니다. 마지막으로, 약물을 추가할 때 급격한 유체 흐름으로 인해 기가씰이 중단될 수 있으므로 피펫 팁에 직접 부딪히지 마십시오. 또한 패러데이 케이지에 접근할 때 실험자는 귀중한 결과를 관찰하는 데 방해가 될 수 있는 과도한 노이즈 신호가 생성되지 않도록 적절하게 접지해야 합니다.
전체 엔도리소좀 구조를 가진 현재의 기록은 엔도리소좀 막의 양쪽에 있는 인자가 손실될 수 있기 때문에 문제가 있으며, 이는 잠재적으로 기록 중 게이팅 특성의 변화로 이어질 수 있습니다. 첫째, 전류 특성의 시간에 따른 변화는 리소좀 루멘의 피펫 용액에 의한 특정 조절자(작은 분자 또는 기타 요인)의 희석 또는 손실로 인해 발생할 수 있습니다. 또한 피펫 또는 세포질 용액의 성분은 엔도리소좀 이온 채널을 조절하는 특정 2차 전달체 경로를 조절할 수 있습니다. 엔도리소좀 부착 모드와 천공 패치 기술을 결합하면 엔도리소좀 막의 내강 측에서 발생하는 특정 문제를 해결하는 데 이상적입니다.
둘째, 엔도리소좀 패치-클램프 기록에서, 막의 세포질 측이 기록 용액(세포질 용액)에 노출되기 때문에, 내분해체 막의 세포질 측과 관련된 작은 분자 또는 인자를 씻어낼 수 있습니다. ATP는 막의 세포질 쪽에서 TPC를 차단하는 것으로 나타났습니다14. 수조 용액을 신중하게 설계하면(예: 세포질 기록 용액에 ATP가 포함되지 않도록 확인) 이 특정 문제를 최소화할 수 있습니다. 시간 종속 제어를 실행하고 전체 endolysosomal 기록 구성을 설정한 후 일관된 시간에 특정 프로토콜을 시작하는 것도 이 문제를 관리하는 데 도움이 될 수 있습니다. 또 다른 문제는 세척으로 인한 엔도리소좀 이온 채널과 관련된 조절 단백질의 손실일 수 있습니다. 이러한 조절 요인이 신호 캐스케이드의 일부인 경우, 내분해체 채널의 생리학적 조절이 손실될 수 있습니다.
기술적으로 엔도리소좀 패치 클램프는 현재 엔도리소좀 이온 채널을 연구하는 데 가장 일반적으로 사용되는 전기생리학적 기법이지만, 일반적으로 소포를 확대하고 선택한 소포를 수동으로 분리해야 합니다. 이러한 한계는 모세관 유리 전극을 기반으로 하는 전기생리학적 기술에 내재되어 있습니다. 세포 소기관 안정성을 유지하기 위한 세포골격이 부족하고 세포 내 필라멘트의 간섭이 이러한 실험의 성공률이 낮은 주된 원인으로 남아 있습니다. 전기생리학자의 축적된 경험 외에도 첨단 광학 시스템과 고정밀 형광 소분자 도구의 향후 발전으로 단일 세포 내 개별 소기관에서 이온 채널 활성을 측정할 수 있을 것입니다.
공개
저자는 경쟁하는 재정적 이해관계나 기타 이해 상충이 없습니다.
감사의 말
대만 국가과학기술위원회(MOST 110-2320-B-002-022), 대만 국립대학교(NTU-112L7818) 및 대만 국립보건연구원(NHRI-EX112-11119SC).
자료
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
참고문헌
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유