Method Article
טכניקות Patch-Clamp לניתוח שלפוחית אנדוליזוזומלית בודדת
In This Article
Summary
פרוטוקול זה מפרט שיטה למדידה ישירה של פעילות תעלות יונים על שלפוחיות תוך תאיות באמצעות מערכת מהדק טלאי אנדוליזוזומלי ידנית. אנו מדגימים את השיטה הכוללת הגדלת אנדוליזוזומים ובידוד ידני של שלפוחיות אלה. גישה זו מבטיחה שחוקרים יוכלו לשכפל וליישם במדויק את ההליך.
Abstract
תעלות יונים אנדוליזוזומליות הן קריטיות להומאוסטזיס של יונים אנדוליזוזומליים ו-pH, ויסות פוטנציאל הממברנה וסחר בשלפוחית. עם זאת, גישה אלקטרופיזיולוגית לתעלות אלה בתוך שלפוחיות תוך-תאיות קטנות הייתה אתגר. הפיתוח של טכניקות מהדק טלאי אנדוליזוזומלי היה חיוני בהתגברות על מחסום זה, ואפשר מדידה ישירה של פעילות תעלות יונים בממברנות אנדוליזוזומליות.
בהשוואה לטכניקות הקיימות, מהדק טלאי אנדוליזומלי יכול להקליט בו זמנית מספר תאים ולהשתלב בקלות עם שיטות מדידה אחרות. הפעלה ידנית מציעה את היתרון של הדמיית שלפוחיות ממוקדות. זה גם מתייחס למגבלת הנוכחות ההכרחית של Ca2+ בצד אחד של הממברנה האנדוליזוזומלית, מה שמגדיל את הגמישות של תכנון הניסוי. שימוש בטכניקות מהדק טלאי אנדוליזוזומלי מאפשר מדידה וניתוח ישירים של פעילות תעלות יונים בתוך אנדוליזוזומים.
בהתחשב בקשר ההדוק בין תפקוד תעלות יונים אנדוליזוזומלי חריג למחלות כגון מחלות ניווניות והפרעות מטבוליות, חקירה ומווסת ערוצים אלה עשויים לחשוף מטרות תרופתיות חדשות. על ידי החזרת איזון היונים התוך-תאי, אנו עשויים להקל או לרפא מחלות קשורות. לכן, טכניקה זו חיונית לגילוי מטרות תרופות חדשות ולפיתוח תרופות רלוונטיות.
Introduction
תעלות יונים ממלאות תפקיד מכריע בתהליכים פיזיולוגיים רבים. בעוד שתעלות יונים על פני השטח זכו לתשומת לב משמעותית, חשיבותם של ערוצים תוך-תאיים, במיוחד אלה שבתוך אנדוליזוזומים, מוכרת בהדרגה. המערכת האנדוליזוזומלית מורכבת מאברונים רב-תפקודיים הקשורים לממברנה המתמחים בתפקודים תאיים בסיסיים, כולל מחזור אנדוזומים (RE), אנדוזומים מוקדמים (EE), אנדוזומים מאוחרים (LE), ליזוזומים (LY) ואברונים היברידיים בעלי מאפיינים אנדוליזוזומליים ותאים אחרים, כגון פגוזומים ואוטופאגוזומים.
EE, הידוע גם בשם מיון אנדוזומים (SE), הוא אחד היעדים המוקדמים יותר לחומרים שהופנמו מממברנת הפלזמה (PM). EEs הם תאים קריטיים האחראים על מיון מטען למסלולים אנדוציטיים שונים, כגון מסלול ההתבגרות ל-LE/LY לצורך פירוק, מסלול המיחזור המהיר בחזרה ל-PM ומסלול המיחזור האיטי הכולל את תא המיחזור או ה-RE ההיקפי. גופים רב-שלפוחיתיים (MVBs) שמקורם באנדוזומים הם תאים כדוריים המוקפים בקרום מגביל, שניתן למלא בשלפוחיות תוך-לומינליות (ILVs)1. כדי לשמור על תפקודם התקין של אברונים אלה, הם דורשים תעלות יונים ממברנות כדי לווסת את ה-pH השלפוחיתי, האוסמולריות והעברת האותות. עם זאת, מדידת הפעילות של ערוצים אלה אינה פשוטה.
עבור תעלות יונים הממוקמות על קרום הפלזמה, טכניקת מהדק התיקון שפותחה בשנות ה-70 היא כבר מזמן שיטת תקן הזהב2. עם זאת, גישה לתעלות אלקטרופיזיולוגית בתוך שלפוחיות תוך תאיות קטנות נותרה אתגר. יישום תקן הזהב למדידת תעלות יונים על קרום הפלזמה לזה על אברונים תוך-תאיים עומד בפני שלושה אתגרים עיקריים. ראשית, גודלם של האנדוליזוזומים הוא בדרך כלל קטן מאוד (קוטר של פחות מ-1 מיקרומטר), מה שמקשה על התבוננות ובידוד תחת מיקרוסקופ וקטן יותר מקוטר הפתיחה של מיקרופיפטות זכוכית טיפוסיות, מה שהופך את הניסוי לבלתי ניתן לביצוע. שנית, בידוד אנדוליזוזומים ישירות מתאי המטרה תוך שמירה על שלמות האברונים דורש מיומנויות מיוחדות. שלישית, בשל היעדר שלד ציטולוגי באברונים תוך-תאיים, יצירת אטימה על הממברנה האנדוליזוזומלית בתוך פיפטת התיקון ולאחר מכן קריעתה להשגת תצורה אנדוליזוזומית שלמה יכולה להיות מאתגרת, מכיוון שהיא פוגעת בשלמות המבנית של האברון3.
פותחו מספר שיטות כדי להתגבר על בעיות אלה, כולל רישום דו-שכבתי של שומנים, שינוי רצפי מיקוד ליזוזומליים וטכניקות אלקטרופיזיולוגיה מבוססת ממברנה הנתמכת על ידי מוצק (SSM או SSME). שיטת ההקלטה הדו-שכבתית של השומנים כוללת שחזור ממברנות פוספוליפידים סינתטיות עם תעלות יונים מטוהרות, המאפשרת מחקר אלקטרופיזיולוגי מפורט של תפקוד חלבון הממברנה בתנאים מבוקרים 4,5. שינוי רצפי מיקוד ליזוזומליים בתעלות יונים כרוך בניתוב מחדש של תעלות יונים אנדוליזוזומליות לקרום הפלזמה למדידה בשיטות תיקון-מהדק קונבנציונליות6. טכניקות אלקטרופיזיולוגיה מבוססות ממברנה הנתמכות על ידי מוצק (SSM או SSME), הידועות גם בשם שיטת מהדק התיקון המישורי האנדוליזוזומלי, משתמשות בשבבי זכוכית מישוריים עם מצע מוצק עם פתחים קטנים (קוטר <1 מיקרומטר) בשבבי בורוסיליקט מישוריים מיקרו-מבניים. שבבי זכוכית צמצם קטנים אלה מאפשרים ניתוח של אנדוליזוזומים קטנים, אפילו ילידים, באמצעות מערכת בקרת יניקת לחץ (Nanion). עם זאת, בשתי השיטות הראשונות, תעלות היונים אינן נמצאות בסביבתן הפיזיולוגית הטבעית. ניסיונות לתעד תעלות ליזוזומליות המתבטאות על קרום הפלזמה או משוחזרות לשכבות דו-שכבתיות של שומנים הניבו במידה רבה תוצאות לא ודאיות וסותרות.
למרות שטכניקות מהדק טלאי מישוריות טיפלו ביעילות בנושא ההפרעות המלאכותיות ומציעות את היתרון של מדידות בתפוקה גבוהה, הפתרונות המשמשים מוגבלים גם בשיטה זו. טכניקת מהדק התיקון האנדוליזוזומלי שהוצגה במאמר זה יכולה להקליט בו זמנית מספר תאים ולהשתלב בקלות עם שיטות מדידה אחרות. הפעלה ידנית מספקת את היתרון של הדמיית שלפוחיות מטרה. הוא גם מתגבר על המגבלה הבלתי נמנעת של Ca2+ בתמיסה בצד אחד של הממברנה האנדוליזוזומלית, ומגדיל את החופש של תכנון ניסיוני3. לאחרונה, טכניקות מהדק טלאי אנדוליזוזומלי מילאו תפקיד מפתח במחקר פיתוח תרופות. לדוגמה, במחלות נוירודגנרטיביות, טכניקה זו סייעה בזיהוי תרופות חדשות המכוונות לתעלות יונים אנדוליזוזומליות הקשורות למחלות אלצהיימר ופרקינסון 7,8. חוקרים יכולים גם להשתמש בטכניקה זו כדי לחקור את תפקידן של תעלות יונים אנדוליזוזומליות בתאי גידול9, ובכך לשלוט בצמיחת הגידול והתפשטותו. בנוגע למחלות מטבוליות, מחקרי טלאי אנדוליזוזומלי חושפים תרכובות המווסתות את תעלות היונים האנדוליזוזומליות, ומציעות גישות טיפול חדשות לסוכרת והשמנת יתר. טכניקת התיקון-מהדק האנדוליזוזומלי מסייעת בהבנת תפקוד אנדוליזוזומלי ומציאת טיפולים פוטנציאליים6, משפרת משמעותית את ההבנה שלנו לגבי תפקודי תעלות היונים האנדוליזוזומליות ומקדמת גילוי מטרות תרופתיות חדשות.
Protocol
1. הגדרת מכשירים
- חומרה
הערה: ראה איור 1 להגדרת אסדת אלקטרופיזיולוגיה סטנדרטית.- הגן על ההתקנה מפני הפרעות חיצוניות באמצעות שולחן וכלוב פאראדיי.
- השתמש במיקרוסקופ הפוך עם מיקרומניפולטור למיקום יציב של המיקרואלקטרודה.
- הגדר מגבר כדי לאסוף ולהגביר את האותות שנרכשו.
- השתמש בדיגיטייזר כדי להמיר את האותות האנלוגיים לאותות דיגיטליים.
- השתמש בתוכנה לאיסוף וניתוח נתונים כדי להגדיר פרוטוקולים ניסיוניים ולחלץ תוצאות משמעותיות וניתנות לניתוח מהנתונים שנאספו.
- אלקטרודות
- השתמש בשתי אלקטרודות: אלקטרודת אמבטיה ואלקטרודת פיפטה.
הערה: לפלטינה וכסף כלוריד יש את תכונות הקיטוב הטובות ביותר. אלקטרודות כסף כלוריד מורכבות מחוטי כסף או כדוריות שעברו כלוריד, ולכן יש להן שכבת AgCl על פני השטח החיצוניים של החוט או הגלולה (איור 2).
- השתמש בשתי אלקטרודות: אלקטרודת אמבטיה ואלקטרודת פיפטה.
- הכנת פיפטה
- מושך
- התקן את הצינור הנימי לתוך המושך.
הערה: הפרמטר המשמש לייצור פיפטות להלן הוא ספציפי למכשיר. המכשיר בו השתמשנו במאמר זה מוזכר בטבלת החומרים. - בתנאים ניסיוניים (טמפרטורת החדר 22 מעלות צלזיוס, חוט חימום בצורת דרך, זכוכית בורוסיליקט עם נימה) שאינם שורפים את חוט החימום, הפעל בדיקת RAMP על המושך כדי לקבוע את ערך החום (HEAT) הנדרש להמסת נימי הזכוכית.
- תכנן תוכנית משיכה חדשה עם שישה מחזורי משיכה נפרדים תוך שימוש בפרמטרים HEAT, מהירות (VEL) וזמן (TIME) (טבלה 1).
הערה: HEAT מתייחס לפרמטר המחמם את חוט החימום, ומאפשר לחוט הזכוכית להמיס. מהירות מציינת את המהירות שבה המושך מושך את החוט לשני הכיוונים. הזמן מייצג את משך המרווח בין כל מחזור. - לחץ על כפתור המשיכה הירוק בלוח המקשים.
- שחרר את ה-clampכפתור והסר את הפיפטות מהמושך.
- בדוק את קצות הפיפטה מתחת לעינית המיקרו-פורג' כדי לקבוע את קוטר הקצה, החדות והגיאומטריה. ודא שקוטר הקצה הוא 0.5-0.9 מיקרומטר.
הערה: ככל שמשתמשים בחוט בתדירות גבוהה יותר, ערך החום הנדרש להמסת נימי הזכוכית ישתנה. - אם גודל הקצה אינו עומד בציפיות, התאם את הפרמטרים HEAT ו-VEL. טמפרטורות גבוהות יותר ומהירויות גבוהות יותר יפיקו טיפים עדינים וארוכים יותר, ולהיפך. כוונן את ה-HEAT במרווחים של 5 מעלות ואת המהירות במרווחים של 3.
- התקן את הצינור הנימי לתוך המושך.
- ליטוש
- הנח את פיפטות התיקון המשוכות לתוך מחזיק המיקרו-פורג'.
- בדוק את קצות הפיפטה באמצעות עדשת אובייקטיבית פי 35 (בשילוב עם עינית פי 15, וכתוצאה מכך הגדלה של פי 525 ).
- השתמש במיקרומניפולטור כדי לקרב את פיפטות התיקון לחוט.
- הגדר את חוגת הטמפרטורה ל-80.
- השתמש במתג הרגליים כדי להפעיל את התנור ולהפעיל דופק חום קצר (1 - 2 שניות), תוך ניטור תהליך הליטוש דרך עינית המיקרו-פורג'.
- חזור על התהליך עד שכל הפיפטות מלוטשות.
- הנח את הפיפטות שהושלמו בקופסה אטומה כדי למנוע כניסת אבק.
הערה: המטרה היא להמיס במהירות את הקצה כך שהזכוכית תשנה את גיאומטריית הקצה הסופית מבלי להפוך אותה לחדה מדי. זה מונע מהפיפטה לחדור לקרום השלפוחית עליו היא נלחצת ומקדם ביעילות היווצרות חותם. לאחר הליטוש הסופי, הנתיב הפנימי של קצה הפיפטה צריך להיות צר מאוד, ישר וליניארי.
לפיפטות ההקלטה הטובות ביותר יש בדרך כלל התנגדות של 5 - 8 MΩ לאחר ליטוש אש. קוטר פתיחת הקצה צריך להיות 2 מיקרומטר. פיפטת תיקון מלוטשת בצורה מושלמת חיונית להיווצרות מוצלחת של ג'יגה-סיל, מכיוון שזו אחת הטכניקות המרכזיות החיוניות להצלחת ההליך.
- מושך
2. הכנת מדגם
- תרבית תאים (שימוש ב-HEK293 כדוגמה)
- תרבית התאים בחממה לחה סטנדרטית ב-37 מעלות צלזיוס עם 5% CO2.
- תרבית תאי HEK293 ב-DMEM דל גלוקוז בתוספת 10% סרום בקר עוברי מומת בחום (FBS), 100 U/mL פניצילין ו-100 מ"ג/מ"ל סטרפטומיצין.
- הנח כיסויים מצופים פולי-ליזין 12 מ"מ בצלחת של 24 בארות.
- הגדלת אברון
- הוסף 1 מיקרומטר ואקואולין-1 לתאי HEK293 בצלחת 24 הבארות (משלב 2.1) ודגר בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2 למשך הלילה עד שמתחילות להיווצר שלפוחיות מוגדלות.
הערה: גודל האנדוליזוזומים המוגדלים יכול להגיע ל-1-10 מיקרומטר, תלוי בכלי, בתרכובת, בזמן הדגירה ובסוג התא (איור 3 וטבלה 2).
- הוסף 1 מיקרומטר ואקואולין-1 לתאי HEK293 בצלחת 24 הבארות (משלב 2.1) ודגר בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2 למשך הלילה עד שמתחילות להיווצר שלפוחיות מוגדלות.
- הכנת פתרון
הערה: הכנת התמיסה הסטנדרטית נועדה לדמות את הריכוזים היוניים בתוך התא והאברונים. לדוגמא, הפתרונות הסטנדרטיים למדידת תעלות יונים על ליזוזומים הם כדלקמן:- הכן תמיסת אמבטיה (במ"מ):140 K-methanesulfonate (MSA), 5 KOH, 4 NaCl, 0.39 CaCl2, 1 EGTA, 10 HEPES. התאם את ה-pH ל-7.2 עם KOH. התאם את האוסמולריות ל-300 mosm/L עם גלוקוז.
- הכן תמיסת פיפטה (במ"מ): 140 Na-MSA, 5 K-MSA, 2 Ca-MSA, 1 CaCl2, 10 HEPES, 10 MES. התאם את ה-pH ל-4.6 עם MSA. התאם את האוסמולריות ל-310 mosm/L עם גלוקוז.
הערה: העבירו את התמיסה דרך מסנן של 0.2 מיקרומטר, הכינו 45 מ"ל בצינורות חרוטיים של 50 מ"ל ואחסנו אותם בטמפרטורה של 4 מעלות צלזיוס עד 2-4 שבועות.
3. בידוד אברון
- הסר כיסוי עם תאים מטופלים (ראה סעיף 2) מצלחת 24 הבארות, העביר אותו לתא המיקרוסקופ והוסף 1 מ"ל תמיסת אמבטיה.
הערה: אסור לאחסן תאים בתמיסת האמבטיה למשך > שעה עבור ניסויי מהדק טלאי אנדוליזוזומלי שלם הכוללים בידוד, איטום ורישום. לאחר שעה, האנדוליזוזומים המוגדלים יתכווצו, יידבקו לפיפטה ויהיו קשים לבידוד. - השתמש במחט מילוי פלסטיק תוצרת בית כדי למלא את פיפטת הבידוד בתמיסת פיפטה והתקן את הפיפטה בקצה הקדמי של התיקון-clamp התקנה.
- הגדר את זווית התנועה האלכסונית של המיקרומניפולטור כך שתהיה קרובה ל-30° (ערך ברירת המחדל של היצרן).
- תחת המיקרוסקופ (אובייקטיבי פי 40 ועינית פי 10), בדוק את התאים לאיתור אנדוזומים או ליזוזומים מוגדלים מספיק הממוקמים ליד קצה קרום התא לבידוד. הזז את פיפטת הבידוד קרוב לתא שנבחר.
- הורד את פיפטת הבידוד באמצעות המיקרומניפולטור עד שהיא נוגעת בקצה קרום הפלזמה (איור 4). הזז במהירות את פיפטת הבידוד אופקית כדי לקרוע חתיכה קטנה מקרום הפלזמה.
- בעזרת אותה פיפטה, לחץ על התא מהצד הנגדי כדי לסחוט החוצה את האנדוזום/ליזוזומים למרחק של ~2 מיקרומטר מהתא.
הערה: אם יש שאריות של קרום התא על האברון זה עלול למנוע היווצרות של ג'יגה-סיל. - בדוק את האנדוליזוזום המבודד תחת המיקרוסקופ.
4. היווצרות Gigaseal
- מלאו פיפטת תיקון מלוטשת טרייה בתמיסת הפיפטה המתאימה והתקינו את הפיפטה בקצה הקדמי של המגבר.
- הפעל לחץ חיובי של 20 - 50 מבר על הפיפטה (או השתמש ב-0.03-0.05 מ"ל ממזרק של 1 מ"ל לבקרת לחץ) ושמור על לחץ זה (נעל את השסתום).
הערה: 1 mbar (millibar) = 0.001 bar = 0.1 kPa (kilopascal) = 1 hPa (hectopascal) = 1,000 dyn/cm2. - הזזת קצה הפיפטה לתמיסת האמבטיה, במרכז שדה הראייה, ודא שהלחץ גבוה מספיק כדי לראות את הנוזל זורם לתמיסת האמבטיה.
- הפעל פולסי זרם חוזרים ונשנים (+5 mV; 5 ms) כדי לקבוע את התנגדות הפיפטה, התנגדות האיטום והתנגדות הסדרה. עקוב אחר גודל קצה הפיפטה, היווצרות האיטום והקמת התצורה האנדוליזוזומלית השלמה.
- הזז במהירות את הפיפטה קרוב לחלק העליון של שלפוחית המטרה. הביאו את הפיפטה ליד השלפוחית עד שהשלפוחית זזה או מתגלגלת עקב זרימת הנוזל מהפיפטה (איור 5).
- כוונן את נפח הקיזוזtage של הפיפטה ל-0 mV. שחרר מיד את הלחץ החיובי. באופן אידיאלי, השלפוחית תימשך לכיוון הפיפטה ותתחבר לממברנה, ותיצור ג'יגה-סיל (1-20 GΩ) תוך 1 שניות.חפש ירידה ל- <10 pA של משרעת הזרם המעוררת על ידי דופק המתח של 5 mV, מה שמעיד על היווצרות ג'יגה-סיל מוצלחת.
הערה: לחץ חיובי יציב חיוני להיווצרות ג'יגה-סיל. לפעמים, נזילות בצינורות יכולות למנוע היווצרות ג'יגה-סיל. מומלץ להשתמש במד לחץ כדי לוודא שאין נזילות. אם מתגלה נזילה, חבר מחדש את הצינור או מרח כמות קטנה של ג'לי נפט על התפרים כדי לשפר את האיטום.
5. מדידה נוכחית
- שבירת קרום
הערה: בהתאם לצרכי הניסוי, ניתן לסווג את מגע האלקטרודה לממברנה לארבעה אופנים: אופן מחובר לתא, אופן תא שלם, אופן מבפנים-החוצה ואופן חוץ-החוצה (איור 6).- להקלטת שלפוחית שלמה, השתמש בדופק קצר במתח גבוה (דופק ZAP) של 200 מיקרון או 500 מיקרון כדי לשבור את הממברנה בנקודת המגע בין הפיפטה לאברון הגדר את המתח מ-500 mV ל-1,200 mV, וירד ב-100 mV בכל פעם עד שהממברנה מופרעת.
- למצב מבפנים החוצה (הקלטת ערוץ יחיד), לאחר יצירת הג'יגה-סיל, משוך את הפיפטה הרחק מהאברון, קורע חתיכה קטנה מהקרום, חושף את הצד שפונה במקור ללומן השלפוחית.
- למצב מבחוץ החוצה, לאחר יצירת הג'יגה-סיל ומעבר למצב השלפוחית כולו, משוך את הפיפטה הרחק מהאברון, קורע חתיכה קטנה מהקרום תוך שמירה על מבנה שלפוחית קטן.
- הקלטה נוכחית
- רשום את הזרם על פני הממברנה האנדוליזוזומלית מכיוון שמתח הכניסה משתנה בניסויי מתח-מהדק-מהדק מתח אנדוליזומלי.
- שלוט במתחים אלה על ידי מדרגות מתח או רמפות מתח; להשתמש במגוון רחב של מתחי כניסה (למשל, -100 mV עד +100 mV) בניסויי מהדק מתח אנדוליזוזומלי.
- רשום את הזרם על פני הממברנה האנדוליזוזומלית מכיוון שמתח הכניסה משתנה בניסויי מתח-מהדק-מהדק מתח אנדוליזומלי.
תוצאות
להלן מתאר את הצורות הנוכחיות שנצפו במהלך ניסויי מהדק טלאי אנדוליזומלי. אם הצורה הנוכחית אינה כצפוי, זה יכול להיות בגלל מגע לקוי או דליפה. מגע לקוי עלול להתרחש אם אלקטרודת הייחוס אינה במגע מלא עם תמיסת האמבטיה או אם אלקטרודת הפיפטה עומדת להישבר. דליפה יכולה להתרחש אם יש פער בין החדר לכיסוי המאפשר לנוזל לזרום אל עדשת האובייקט או על הבמה; תמיסת פיפטה רבה מדי או קטנה מדי עלולה גם לגרום לחריגות כאלה.
החדרת מחט לתמיסה/מגע מחט עם משטח התא/ZAP
במהלך הקמת המצב המחובר לליזוזום (היווצרות ג'יגה-סיל), תגובת הזרם פוחתת במהירות. ניתן לקבוע את התנגדות האיטום על ידי חלוקת מתח הפקודה בכמות הנמוכה של הזרם הנותר (איור 7).
רמפה/דליפה
הפעלה חוזרת ונשנית של מתח כניסה רציף הנע בין -100 mV עד +100 mV יכולה לרשום את הזרם על פני הממברנה האנדוליזוזומלית לאורך זמן (איור 8). באמצעות פתרונות סטנדרטיים, הרכב היונים בתוך האברון ומחוצה לו שונה. אם הערוץ מפגין סלקטיביות, נקודת החיתוך של עקומת הזרם-מתח לא תהיה באפס בגלל החדירות השונה של יונים הזורמים פנימה והחוצה. נקודת הצטלבות זו מכונה הפוטנציאל ההפוך של הערוץ, וניתן לחשב אותה באמצעות הנוסחה הבאה10:
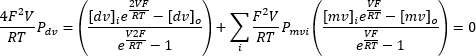
כאשר dv: יונים דו-ערכיים; mv: יונים חד-ערכיים; i: פנימי; o: חיצוני; P: חדירות הממברנה ליון S הנמדדת ב-m·s−1; V: פוטנציאל טרנסממברני בוולט; F: קבוע פאראדיי, שווה ל-96,485 C·mol−1 או J· V−1·mol−1; R: קבוע גז, שווה ל-8.314 J· K−1·mol−1; T: טמפרטורה מוחלטת, נמדדת בקלווין (= °C + 273.15).
ייתכנו רכיבי זרם פסיבי הקשורים למוליכות דליפה ותעלות יונים ספציפיות באנדוליזוזומים. זרם זליגה מאופיין ביחסי זרם ליניארי (I)-מתח (V), עם הצומת במקור. זרמי דליפה מאנדוליזוזומים שבודדו מתאי HEK293 לא מועברים הם פחות מ-50 pA ב-100 mV; תעלות היונים הבסיסיות הן ככל הנראה תעלות מוליכות אשלגן/נתרן ותעלות כלוריד.
במקרים של תעלות יונים המופעלות במתח, ניתן להפחית רכיבי זרם זליגה בזרם הנמדד על ידי רישום סדרה של פעימות מתח מוגדלות לפני או אחרי הזרמים האנדוליזוזומליים המעוררים. ניתן להפחית דליפה גם במצב לא מקוון. המשרעת של פולסים מוגדלים אלה היא בדרך כלל רבע או חמישית ממשרעת הפולסים הניסיונית, תהליך המכונה חיסור דליפה P/4 או P/511. בשל הגודל הקטן מאוד של זרמי הדליפה, בדרך כלל לא משתמשים בחיסור P/4 או P/5.
מהדק מתח
החלה חוזרת ונשנית של קפיצות מדורגות במתח הכניסה יכולה לרשום את הזרם על פני הממברנה האנדוליזוזומלית כאשר המתח משתנה. זה עוזר לקבוע אם הערוץ הוא תעלת יונים מגודרת מתח12. בנוסף למהדק מתח, מהדק זרם אפשרי גם כן. ניתן להקליט פעילות חד-ערוצית באמצעות התצורות הזמינות בכרךtagמהדק מצב12. הצפיפות הנמוכה בדרך כלל של תעלות יונים אנדוליזוזומליות עלולה לעכב את תהליך השגת טלאים המכילים תעלה אחת. זכוכית פיפטה בעלת קירות עבים היא החומר הטוב ביותר לייצור אלקטרודות עם קצות פיפטה קטנים וקיבול נמוך. ציפוי הזכוכית בסילגארד או שעווה יכול להפחית את קיבול הפיפטה.
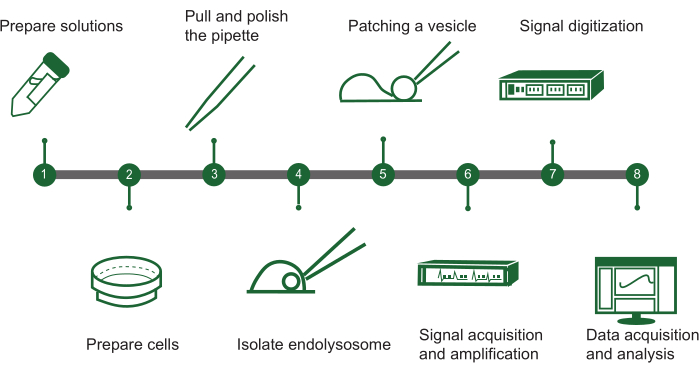
איור 1: סקירה כללית של שלבי מהדק-תיקון אנדוליזומלי. ניתן לתאר את הפרוטוקול להערכת פעילות תעלות יונים בשלפוחיות תוך תאיות באמצעות מערכת מהדק טלאי אנדוליזוזומלית ידנית בתרשים זרימה עם שלבי המפתח הבאים: (1) הכנת פתרון: הרכיבו את כל התמיסות הכימיות הנדרשות. (2) הכנת תאים: לגדל ולהכין את התאים למיצוי אנדוליזוזומלי. (3) ייצור פיפטה: צור ולטש את פיפטת מהדק התיקון כדי להבטיח טיפול מדויק. (4) בידוד אנדוליזוזום: הפרדה ידנית של אנדוליזוזומים מהתאים המתורבתים. (5) תיקון שלפוחית: חבר את הפיפטה לשלפוחית אנדוליזוזומלית אחת. (6) רכישת אותות: ללכוד ולהגביר אותות חשמליים מהשלפוחית. (7) דיגיטציה של אותות: המרת האותות האנלוגיים לצורה דיגיטלית לניתוח. (8) איסוף וניתוח נתונים: אסוף את הנתונים ופרש אותם כדי לחקור את תפקוד תעלת היונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הגדרת חומרה אלקטרופיזיולוגית. במהלך מדידות אלקטרודה כפולה, אלקטרודת המדידה יוצרת קשר עם קרום המטרה, ואילו אלקטרודת הייחוס ממוקמת בתמיסת האמבטיה. הפרש הפוטנציאל בין השניים מוגבר על ידי המגבר, עובר דיגיטציה על ידי הדיגיטייזר, ולאחר מכן נלכד על ידי המחשב. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: כלים פרמקולוגיים המשמשים לניתוח מהדק-תיקון אנדוליזומלי. סכמטי המציג את טווחי הפעילות של חומרים פרמקולוגיים שונים עבור מהדק טלאי. השילוב של וורטמנין ולטרונקולין B הוא ספציפי מאוד לאנדוזומים מוקדמים, למעט אנדוזומים ממוחזרים. YM201636 מגדיל באופן סלקטיבי אנדוזומים/ליזוזומים מאוחרים. Vacuolin מגדיל אנדוזומים מוקדמים, ממחזר אנדוזומים, כמו גם אנדוזומים/ליזוזומים מאוחרים13. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: בידוד של אברונים מוגדלים. המחשה סכמטית של תהליך הבידוד הידני של שלפוחית מטרה מהתא. השלבים הם כדלקמן: (1) הכנת כיסוי: תא המטרה המכיל את שלפוחית המטרה מונח על כיסוי. (2) חותכים את קרום הפלזמה: קרום הפלזמה של תא המטרה נחתך באמצעות פיפטת בידוד. (3) פיפטת בידוד: פיפטת הבידוד ממוקמת כדי למקד את השלפוחית. (4) סחטו את שלפוחית המטרה מחוץ לתא: שלפוחית המטרה נלחצת בזהירות מחוץ לתא באמצעות פיפטת הבידוד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: מיקום יחסי מומלץ בין פיפטת תיקון לשלפוחית עבור היווצרות ג'יגה-סיל. לאחר הפעלת לחץ חיובי, התקרב לאברון מלמעלה עם פיפטת התיקון. מקם את הקצה כשליש מהדרך מהחלק העליון של האברון ולאט לאט (מצב 3-6) הורד את פיפטת התיקון עד שהלחץ החיובי גורם לקרום האברון לנוע. תחת המיקרוסקופ, האברון חייב להתגלגל או להידחף מהקצה. באותו רגע, שחררו את הלחץ החיובי והמתינו להיווצרות הג'יגה-סיל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

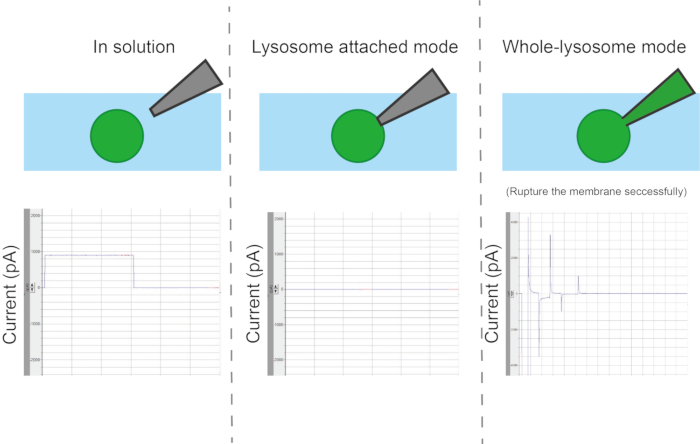
איור 6: סוגי תצורות. בהתאם לשיטת המגע בין הפיפטה לאברון ישנם ארבעה מצבי מדידה שונים: אברון או שלפוחית, שלפוחית שלמה, מבפנים החוצה ומבחוץ החוצה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 7: זרמים עבור חישוב התנגדות פיפטה, התנגדות איטום, התנגדות טורית וקיבוליות תאים. פיפטת ההקלטה ממוקמת בתמיסת האמבטיה, ודופק מתח מלבני (משך 5 אלפיות השנייה, 5 mV) מייצר תגובת זרם כמעט מלבנית. ניתן לקבוע את ההתנגדות של הפיפטה על ידי חלוקת המתח המופעל בזרם הנמדד. כאשר הג'יגה-סיל נוצר במצב מחובר לליזוזום, תגובת הזרם פוחתת במהירות. ניתן לחשב את התנגדות האיטום על ידי חלוקת המתח בזרם הנותר, הקטן מאוד. כאשר מופעל דופק ZAP, הממברנה נקרעת במהירות, מה שמוביל לעלייה בזרמים הקיבוליים, מה שמאותת על המעבר לתצורה האנדוליזוזומלית השלמה. עבור אנדוליזוזום כדורי, הזרם המתקבל עוקב אחר פונקציה מעריכית אחת של זמן. התנגדות הסדרה נקבעת על ידי חלוקת משרעת הזרם הקיבולי במתח הפקודה, והקיבול של האנדוליזוזום מחושב על ידי חלוקת קבוע הזמן של הזרמים הקיבוליים בהתנגדות הסדרה12. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
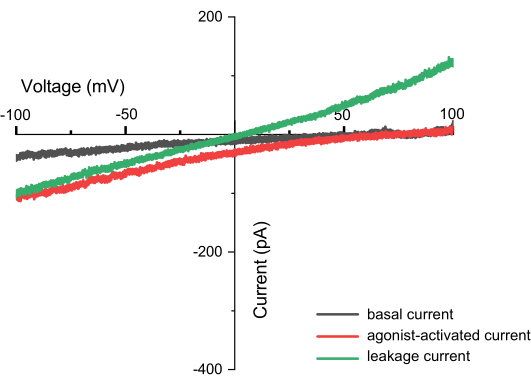
איור 8: זרמים שנצפו במהלך רישום רמפה (למשל, TPC2). זוהי עלילת יחסי זרם-מתח (I-V), כאשר ציר ה-X מייצג מתח שנע בין -100 ל-+100 mV, וציר ה-Y מציין את הזרם שנוצר במתחים שונים. הגרף משתמש במדידות מערוץ TPC2 כדוגמה. הקו השחור מציג את התוצאות המתקבלות ישירות לאחר הפעלת דופק ZAP, הקו האדום מייצג את הזרם שנוצר כאשר ערוץ TPC2 מופעל על ידי האגוניסט TPC2-A1N, והקו הירוק מציין זרם דליפה, שעלול לנבוע מאיטום לא שלם. ניתן לזהות מדידה מוצלחת לא רק על ידי לכידת צורת הערוץ אלא גם על ידי היעדר זרמי דליפה. אם קיימים זרמי דליפה, הצטלבות הזרם וציר ה-X תהיה ב-0, ויוצרת קו ישר (עם יונים שונים בתוך הממברנה ומחוצה לה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| פיפטת תיקון אנדוליזוזומלית | פיפטת תיקון תא שלם | |||||||
| מחזור | חום | משך | VEL | זמן | חום | משך | VEL | זמן |
| 1 | הערך נקבע על ידי פרוטוקול שיפוע +10 | ריק | 30 | 150 | הערך נקבע על ידי פרוטוקול שיפוע +10 | ריק | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | הערך נקבע על ידי פרוטוקול שיפוע +25 | 18 | 150 | - | - | |||
| 6 | הערך נקבע על ידי פרוטוקול שיפוע +20 | 15 | 150 | - | - | |||
טבלה 1: פרוטוקול משיכת פיפטה תיקון. ראשית, השתמש בפונקציית הרמפה כדי למצוא את טמפרטורת ה-HEAT המתאימה, ולאחר מכן עקוב אחר הטבלה כדי להתאים את ששת מחזורי המשיכה.
| אנדוליזוזומים לא ספציפיים (Vacuolin-1) / LE/LY ספציפי (YM201636) | מקרופאגים | 1 מיקרומטר / 0.4 מיקרומטר | 1-2 שעות / 1-3 שעות |
| COS-1, HEK293, Hela, פיברובלסטים וכו' | 1 מיקרומטר / 0.4 מיקרומטר | לילה / לילה | |
| קרדיומיוציטים, תאי שריר השלד | 5 מיקרומטר | 24-48 שעות |
טבלה 2: הריכוז ומשך הטיפול הנדרשים להגדלת אנדוליזוזומים בסוגי תאים שונים באמצעות חומרים פרמקולוגיים. סוגי תאים שונים מציגים הבדלים משמעותיים ביעילות ההגדלה שלהם תחת טיפול תרופתי. בדרך כלל, תאים עם מערכת אנדוליזוזומלית פעילה יותר דורשים זמני טיפול קצרים יותר. עם זאת, עדיין יש לקבוע את זמן הטיפול והריכוז האופטימליים בניסוי13.
Discussion
למערכי ניסוי אלקטרופיזיולוגיים יש ארבע דרישות מעבדה עיקריות: א) סביבה: שיטות לשמירה על בריאות הדגימה; 2) אופטיקה: שיטות להמחשת הדגימה; 3) מכניקה: שיטות למיקום יציב של המיקרואלקטרודה; ו- iv) אלקטרוניקה: שיטות להגברה והקלטת האות.
כדי לבצע בהצלחה ניסויים אנדוליזוזומליים בתיקון-מהדק, מספר שלבים מרכזיים הם קריטיים. ראשית, מצב התאים - יש להיצמד היטב לתאים כך שכאשר משתמשים בפיפטה הבידוד לשבירת התאים, התא כולו לא זז. חשוב לוודא שהתאים בריאים ומתפשטים היטב. אם התאים לא יכולים להישאר קבועים במקומם, מעבר לציפוי מתאים על הכיסוי עשוי לעזור. בנוסף, יש לנטר את צפיפות התאים. כאשר צפיפות התאים גבוהה מדי (יותר מ-90%), היעילות של הגדלת אברונים הנגרמת על ידי תרופות פוחתת, מה שמקשה על ביצוע ניסויים. שנית, איכות פיפטת התיקון - קצה פיפטת התיקון חייבת להיות בגודל מתאים (5-8 MΩ), והזכוכית משני הצדדים צריכה להיות חלקה ומקבילה.
שלישית, במהלך היווצרות ג'יגה-סיל, אם הוא לא נוצר מיד לאחר שחרור לחץ חיובי, הפעלת כמות מתונה של לחץ שלילי יכולה לעזור. עם זאת, ברגע שנוצר הג'יגה-סיל, יש לשחרר את הלחץ השלילי באופן מיידי כדי למנוע את הסיכון שכל השלפוחית תישאב לתוך הפיפטה. בנוסף, בעת ביצוע מהדק תיקון אנדוליזוזומי שלם, יש לקרוע חלק קטן מהקרום. בשל היעדר שלד ציטולוגי באנדוליזוזומים, הם שבירים מאוד ולעתים קרובות הופכים לא יציבים, מה שגורם לחלקים להישאב לתוך הפיפטה. במקרה זה, הפעלת לחץ חיובי קל כדי לדחוף את החלק הנשאב החוצה יכולה לעזור. אם הקיבול של האברון שנותר בקצה הפיפטה הוא פחות מ-1 pF, זה מצביע על כך שנותר מעט מאוד קרום, ככל הנראה לא מכיל את התעלות המעניינות. במקרים כאלה, מומלץ לנסות שלפוחית חדשה. לבסוף, בעת הוספת תרופות, הימנע מפגיעה ישירה בקצה הפיפטה, מכיוון שזרימת נוזלים מהירה עלולה לשבש את הג'יגה-סיל. בנוסף, כאשר מגיעים לכלוב פאראדיי, הנסיין צריך להיות מקורקע כראוי כדי למנוע יצירת אותות רעש מוגזמים, מה שעלול לעכב את התצפית על תוצאות יקרות ערך.
רישומים נוכחיים עם כל המבנה האנדוליזוזומלי מציבים אתגרים מכיוון שגורמים משני צידי הממברנה האנדוליזוזומלית עלולים ללכת לאיבוד, מה שעלול להוביל לשינויים במאפייני השער במהלך ההקלטות. ראשית, שינויים תלויי זמן במאפייני הזרם עשויים לנבוע מדילול או אובדן של מווסתים ספציפיים (מולקולות קטנות או גורמים אחרים) על ידי תמיסת הפיפטה בלומן הליזוזומלי. בנוסף, רכיבים של הפיפטה או התמיסה הציטוזולית יכולים לווסת מסלולי שליח שני ספציפיים המווסתים תעלות יונים אנדוליזוזומליות. שילוב המצב המחובר אנדוליזוזומלי עם טכניקות תיקון מחורר יהיה אידיאלי לטיפול בבעיות ספציפיות הנובעות מהצד הלומינלי של הממברנה האנדוליזוזומלית.
שנית, בהקלטות מהדק טלאי אנדוליזוזומלי, מכיוון שהצד הציטוזולי של הממברנה חשוף לתמיסת ההקלטה (תמיסה ציטוזולית), ניתן לשטוף מולקולות קטנות או גורמים הקשורים לצד הציטוזולי של הממברנה האנדוליזוזומלית. הוכח כי ATP חוסם TPC מהצד הציטוזולי של הממברנה14. תכנון קפדני של תמיסת האמבטיה (למשל, הבטחה שלא נכלל ATP בתמיסת ההקלטה הציטוזולית) יכול למזער את הבעיה הספציפית הזו. הפעלת בקרות תלויות זמן והתחלת פרוטוקולים ספציפיים בזמן עקבי לאחר הקמת תצורות הקלטה אנדוליזוזומליות שלמות יכולות גם הן לסייע בניהול בעיה זו. בעיה נוספת עשויה להיות אובדן חלבונים מווסתים הקשורים לתעלות יונים אנדוליזוזומליות עקב שטיפה. אם גורמים רגולטוריים אלה הם חלק ממפל איתותים, הוויסות הפיזיולוגי של התעלות האנדוליזוזומליות עלול ללכת לאיבוד.
מבחינה טכנית, למרות שמהדק טלאי אנדוליזוזומלי הוא כיום הטכניקה האלקטרופיזיולוגית הנפוצה ביותר לחקר תעלות יונים אנדוליזוזומליות, הוא בדרך כלל דורש הגדלת שלפוחיות ובידוד ידני של שלפוחיות נבחרות. מגבלה זו טבועה בטכניקות אלקטרופיזיולוגיות המבוססות על אלקטרודות זכוכית נימיות. היעדר שלד ציטולוגי לשמירה על יציבות האברונים והפרעות מחוטים תוך-תאיים נותרו הסיבות העיקריות לשיעור ההצלחה הנמוך של ניסויים אלה. מעבר לצבירת ניסיון על ידי אלקטרופיזיולוגים, התקדמות עתידית במערכות אופטיות מתקדמות וכלים פלואורסצנטיים של מולקולות קטנות ברמת דיוק גבוהה עשויים לאפשר מדידה של פעילות תעלות יונים באברונים בודדים בתוך תאים בודדים.
Disclosures
למחברים אין אינטרסים פיננסיים מתחרים או ניגודי אינטרסים אחרים.
Acknowledgements
המועצה הלאומית למדע וטכנולוגיה, טייוואן (MOST 110-2320-B-002-022), האוניברסיטה הלאומית של טייוואן (NTU-112L7818), והמכונים הלאומיים לחקר הבריאות, טייוואן (NHRI-EX112-11119SC).
Materials
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
References
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved