Method Article
Técnicas de Patch-Clamp para Análise de Vesícula Endolisossômica Única
Neste Artigo
Resumo
Este protocolo detalha um método para medir diretamente a atividade do canal iônico em vesículas intracelulares usando um sistema manual de patch-clamp endolisossomal. Ilustramos o método que envolve o aumento dos endolisossomos e o isolamento manual dessas vesículas. Essa abordagem garante que os pesquisadores possam replicar e aplicar o procedimento com precisão.
Resumo
Os canais iônicos endolisossômicos são críticos para a homeostase do íon endolisossômico e do pH, regulação do potencial de membrana e tráfego de vesículas. No entanto, o acesso eletrofisiológico a esses canais dentro de pequenas vesículas intracelulares tem sido um desafio. O desenvolvimento de técnicas de patch-clamp endolisossomal tem sido fundamental para superar essa barreira, permitindo a medição direta da atividade do canal iônico nas membranas endolisossômicas.
Em comparação com as técnicas de patch-clamp planar existentes, o patch-clamp endolisossomal pode registrar simultaneamente várias células e combinar facilmente com outros métodos de medição. A operação manual oferece a vantagem de visualizar vesículas alvo. Também aborda a limitação da presença indispensável de Ca2+ em um lado da membrana endolisossômica, aumentando a flexibilidade do planejamento experimental. A utilização de técnicas de patch-clamp endolisossômico permite a medição e análise diretas da atividade do canal iônico dentro dos endolisossomos.
Dada a estreita ligação entre a função aberrante do canal iônico endolisossômico e doenças como doenças neurodegenerativas e distúrbios metabólicos, investigar e modular esses canais pode revelar novos alvos de drogas. Ao restaurar o equilíbrio iônico intracelular, podemos aliviar ou curar doenças relacionadas. Portanto, essa técnica é fundamental para descobrir novos alvos de drogas e desenvolver medicamentos relevantes.
Introdução
Os canais iônicos desempenham um papel crucial em vários processos fisiológicos. Embora os canais iônicos de superfície tenham recebido atenção significativa, a importância dos canais intracelulares, particularmente aqueles dentro dos endolisossomos, está sendo gradualmente reconhecida. O sistema endolisossômico é composto por organelas multifuncionais ligadas à membrana, especializadas em funções celulares fundamentais, incluindo endossomos de reciclagem (RE), endossomos iniciais (EE), endosssomos tardios (LE), lisossomos (LY) e organelas híbridas com características endolisossômicas e outras características compartimentais, como fagossomos e autofagossomos.
EE, também conhecidos como endossomos de classificação (SE), são um dos primeiros destinos de materiais internalizados a partir da membrana plasmática (PM). Os EEs são compartimentos críticos responsáveis por classificar a carga em várias vias endocíticas, como a via de maturação para LE/LY para degradação, a via de reciclagem rápida de volta ao PM e a via de reciclagem lenta envolvendo o compartimento de reciclagem ou ER periférico. Os corpos multivesiculares (MVBs) derivados de endossomos são compartimentos esféricos circundados por uma membrana limitante, que pode ser preenchida com vesículas intraluminais (ILVs)1. Para manter a função normal dessas organelas, elas requerem canais de íons de membrana para regular o pH vesicular, a osmolaridade e a transdução de sinal. No entanto, medir a atividade desses canais não é simples.
Para canais iônicos localizados na membrana plasmática, a técnica patch-clamp desenvolvida na década de 1970 tem sido o método padrão-ouro2. No entanto, acessar canais eletrofisiologicamente dentro de pequenas vesículas intracelulares continua sendo um desafio. A aplicação do padrão-ouro para medir os canais iônicos na membrana plasmática às organelas intracelulares enfrenta três desafios principais. Primeiro, o tamanho dos endolisossomos é tipicamente muito pequeno (menos de 1 μm de diâmetro), tornando-os difíceis de observar e isolar ao microscópio e menores do que o diâmetro de abertura das micropipetas de vidro típicas, tornando o experimento inoperante. Em segundo lugar, isolar endolisossomos diretamente das células-alvo, mantendo a integridade das organelas, requer habilidades especiais. Em terceiro lugar, devido à ausência de um citoesqueleto nas organelas intracelulares, formar um selo na membrana endolisossômica dentro da pipeta de adesivo e, em seguida, rompê-la para obter uma configuração endolisossomal total pode ser um desafio, pois compromete a integridade estrutural da organela3.
Vários métodos foram desenvolvidos para superar esses problemas, incluindo registro de bicamada lipídica, modificação de sequências de direcionamento lisossômico e técnicas de eletrofisiologia baseada em membrana com suporte sólido (SSM ou SSME). O método de registro de bicamada lipídica envolve a reconstrução de membranas fosfolipídicas sintéticas com canais iônicos purificados, permitindo o estudo eletrofisiológico detalhado da função da proteína da membrana sob condições controladas 4,5. A modificação das sequências de direcionamento lisossômico nos canais iônicos envolve o redirecionamento dos canais iônicos endolisossômicos para a membrana plasmática para medição usando métodos convencionais de patch-clamp6. As técnicas de eletrofisiologia baseada em membrana com suporte sólido (SSM ou SSME), também conhecidas como método de patch-clamp planar endolisossomal, usam lascas de vidro planar de substrato sólido com pequenas aberturas (<1 μm de diâmetro) em lascas de borossilicato planar microestruturadas. Essas lascas de vidro de pequena abertura permitem a análise de endolisossomos pequenos, até mesmo nativos, usando um sistema de controle de pressão e sucção (Nanion). No entanto, nos dois primeiros métodos, os canais iônicos não estão em seu ambiente fisiológico natural. As tentativas de registrar canais lisossômicos expressos na membrana plasmática ou reconstituídos em bicamadas lipídicas produziram resultados incertos e contraditórios.
Embora as técnicas planares de patch-clamp tenham abordado efetivamente a questão da interferência artificial e ofereçam a vantagem de medições de alto rendimento, as soluções usadas também são limitadas por esse método. A técnica endolisossomal patch-clamp introduzida neste artigo pode registrar simultaneamente várias células e combinar facilmente com outros métodos de medição. A operação manual oferece a vantagem de visualizar as vesículas-alvo. Também supera a inevitável limitação de Ca2+ na solução em um lado da membrana endolisossômica, aumentando a liberdade de planejamento experimental3. Recentemente, as técnicas de patch-clamp endolisossomal têm desempenhado um papel fundamental na pesquisa de desenvolvimento de medicamentos. Por exemplo, em doenças neurodegenerativas, essa técnica tem ajudado a identificar novos medicamentos direcionados aos canais iônicos endolisossômicos associados às doenças de Alzheimer e Parkinson 7,8. Os pesquisadores também podem usar essa técnica para explorar o papel dos canais iônicos endolisossômicos nas células tumorais9, controlando assim o crescimento e a proliferação do tumor. Em relação às doenças metabólicas, os estudos com patch-clamp endolisossômico estão revelando compostos que regulam os canais iônicos endolisossômicos, oferecendo novas abordagens de tratamento para diabetes e obesidade. A técnica endolisossomal patch-clamp auxilia na compreensão da disfunção endolisossômica e na descoberta de possíveis terapias6, melhorando significativamente nossa compreensão das funções dos canais iônicos endolisossômicos e promovendo a descoberta de novos alvos de drogas.
Protocolo
1. Configuração do instrumento
- Hardware
NOTA: Consulte a Figura 1 para obter uma configuração padrão do equipamento de eletrofisiologia.- Proteja a configuração contra interferências externas usando uma mesa e uma gaiola de Faraday.
- Use um microscópio invertido com um micromanipulador para posicionar o microeletrodo de forma estável.
- Configure um amplificador para coletar e amplificar os sinais adquiridos.
- Use um digitalizador para converter os sinais analógicos em sinais digitais.
- Use software de aquisição e análise de dados para configurar protocolos experimentais e extrair resultados significativos e analisáveis dos dados coletados.
- Eletrodos
- Use dois eletrodos: um eletrodo de banho e um eletrodo de pipeta.
NOTA: A platina e o cloreto de prata têm as melhores propriedades de polarização. Os eletrodos de cloreto de prata consistem em fio de prata ou pellets que foram cloretados, possuindo assim uma camada de AgCl na superfície externa do fio ou pellet (Figura 2).
- Use dois eletrodos: um eletrodo de banho e um eletrodo de pipeta.
- Preparação de pipetas
- Puxando
- Instale o tubo capilar no extrator.
NOTA: Os parâmetros usados para a fabricação de pipetas abaixo são específicos do instrumento. O instrumento que utilizamos neste artigo é mencionado na Tabela de Materiais. - Em condições experimentais (temperatura ambiente de 22 °C, filamento aquecedor em forma de passagem, vidro borossilicato com filamento) que não queimam o filamento do aquecedor, execute um teste RAMP no extrator para determinar o valor calorífico (HEAT) necessário para derreter o capilar de vidro.
- Projete um novo programa de tração com seis ciclos de tração separados usando os parâmetros HEAT, velocidade (VEL) e tempo (TIME) (Tabela 1).
NOTA: HEAT refere-se ao parâmetro que aquece o filamento do aquecedor, permitindo que o filamento de vidro derreta. A velocidade indica a velocidade com que o extrator puxa o filamento em ambas as direções. O tempo representa a duração do intervalo entre cada ciclo. - Pressione o botão verde Puxar no teclado.
- Afrouxe o clampbotão e remova as pipetas do extrator.
- Inspecione as pontas da pipeta sob a ocular da microforja para determinar o diâmetro, a nitidez e a geometria da ponta. Certifique-se de que o diâmetro da ponta seja de 0,5-0,9 μm.
NOTA: À medida que o filamento é usado com mais frequência, o valor calorífico necessário para derreter o capilar de vidro mudará. - Se o tamanho da ponta não atender às expectativas, ajuste os parâmetros HEAT e VEL. Temperaturas mais altas e velocidades mais rápidas produzirão pontas mais finas e longas e vice-versa. Ajuste o HEAT em incrementos de 5 graus e a velocidade em incrementos de 3.
- Instale o tubo capilar no extrator.
- Polimento
- Coloque as pipetas puxadas no suporte da microforja.
- Inspecione as pontas da pipeta usando uma lente objetiva de 35x (combinada com uma ocular de 15x, resultando em ampliação de 525x ).
- Use o micromanipulador para aproximar as pipetas de remendo do filamento.
- Ajuste o botão de temperatura para 80.
- Use o pedal para ligar o aquecedor e aplicar um breve pulso de calor (1 - 2 s), monitorando o processo de polimento através da ocular microforge.
- Repita o processo até que todas as pipetas estejam polidas.
- Coloque as pipetas completas em uma caixa lacrada para evitar a entrada de poeira.
NOTA: O objetivo é derreter rapidamente a ponta para que o vidro reforme a geometria final da ponta sem torná-la muito afiada. Isso evita que a pipeta penetre na membrana da vesícula contra a qual é pressionada e promove efetivamente a formação de vedação. Após o polimento final, o caminho interno da ponta da pipeta deve ser muito estreito, reto e linear.
As melhores pipetas de gravação normalmente têm uma resistência de 5 a 8 MΩ após o polimento a fogo. O diâmetro de abertura da ponta deve ser de 2 μm. Uma pipeta de remendo perfeitamente polida é essencial para a formação bem-sucedida do gigaseal, pois esta é uma das principais técnicas cruciais para o sucesso do procedimento.
- Puxando
2. Preparação da amostra
- Cultura de células (usando HEK293 como exemplo)
- Cultive as células em uma incubadora umidificada padrão a 37 ° C com 5% de CO2.
- Cultive as células HEK293 em DMEM com baixo teor de glicose suplementado com 10% de soro fetal bovino inativado pelo calor (FBS), 100 U/mL de penicilina e 100 mg/mL de estreptomicina.
- Colocar lamínulas de 12 mm revestidas com poli-L-lisina numa placa de 24 poços.
- Aumento de organelas
- Adicione 1 μM de vacuolina-1 às células HEK293 na placa de 24 poços (da etapa 2.1) e incube a 37 ° C com 5% de CO2 durante a noite até que as vesículas aumentadas comecem a se formar.
NOTA: O tamanho dos endolisossomos aumentados pode atingir 1-10 μm, dependendo da ferramenta, composto, tempo de incubação e tipo de célula (Figura 3 e Tabela 2).
- Adicione 1 μM de vacuolina-1 às células HEK293 na placa de 24 poços (da etapa 2.1) e incube a 37 ° C com 5% de CO2 durante a noite até que as vesículas aumentadas comecem a se formar.
- Preparação da solução
NOTA: A preparação da solução padrão visa simular as concentrações iônicas dentro da célula e organelas. Por exemplo, as soluções padrão para medir canais iônicos em lisossomos são as seguintes:- Prepare a solução do banho (em mM): 140 K-metanossulfonato (MSA), 5 KOH, 4 NaCl, 0,39 CaCl2, 1 EGTA, 10 HEPES. Ajuste o pH para 7,2 com KOH. Ajuste a osmolaridade para 300 mosm/L com glicose.
- Prepare a solução de pipeta (em mM): 140 Na-MSA, 5 K-MSA, 2 Ca-MSA, 1 CaCl2, 10 HEPES, 10 MES. Ajuste o pH para 4,6 com MSA. Ajuste a osmolaridade para 310 mosm / L com glicose.
NOTA: Passe a solução por um filtro de 0,2 μm, prepare alíquotas de 45 mL em tubos cônicos de 50 mL e armazene-as a 4 ° C por até 2-4 semanas.
3. Isolamento de organelas
- Remova uma lamínula com células tratadas (consulte a seção 2) da placa de 24 poços, transfira-a para a câmara do microscópio e adicione 1 mL de solução de banho.
NOTA: As células não devem ser armazenadas na solução do banho por >1 h para experimentos de patch-clamp endolisossômico completo que envolvem isolamento, selamento e registro do endolisossomo. Após 1 h, os endolisossomos aumentados encolherão, aderirão à pipeta e se tornarão difíceis de isolar. - Use uma agulha de enchimento de plástico caseira para encher a pipeta de isolamento com solução de pipeta e instale a pipeta na extremidade frontal da configuração do patch-clamp.
- Defina o ângulo de movimento diagonal do micromanipulador para estar próximo de 30° (valor padrão de fábrica).
- Sob o microscópio (objetiva de 40x e ocular de 10x), examine as células em busca de endossomos ou lisossomos suficientemente aumentados localizados perto da borda da membrana celular para isolamento. Mova a pipeta de isolamento para perto da célula selecionada.
- Abaixe a pipeta de isolamento usando o micromanipulador até que ela toque a borda da membrana plasmática (Figura 4). Mova rapidamente a pipeta de isolamento horizontalmente para arrancar um pequeno pedaço da membrana plasmática.
- Usando a mesma pipeta, pressione a célula do lado oposto para espremer o endossomo/lisossomos a uma distância de ~ 2 μm da célula.
NOTA: Se houver membrana celular residual na organela, isso pode impedir a formação de um gigaseal. - Examinar o endolisossoma isolado ao microscópio.
4. Formação de Gigaseal
- Encha uma pipeta recém-polida com a solução de pipeta apropriada e instale a pipeta na extremidade frontal do amplificador.
- Aplique 20 - 50 mbar de pressão positiva na pipeta (ou use 0,03-0,05 mL de uma seringa de 1 mL para controle de pressão) e mantenha essa pressão (trave a válvula).
NOTA: 1 mbar (milibar) = 0,001 bar = 0,1 kPa (quilopascal) = 1 hPa (hectopascal) = 1.000 din/cm2. - Movendo a ponta da pipeta para a solução do banho, no centro do campo de visão, confirme se a pressão é alta o suficiente para ver o líquido fluindo para a solução do banho.
- Aplique pulsos de corrente repetidos (+5 mV; 5 ms) para determinar a resistência da pipeta, a resistência da vedação e a resistência em série. Monitore o tamanho da ponta da pipeta, a formação do selo e o estabelecimento da configuração endolisossômica total.
- Mova rapidamente a pipeta para perto do topo da vesícula alvo. Aproxime a pipeta da vesícula até que a vesícula se mova ou role devido ao fluxo de fluido da pipeta (Figura 5).
- Ajuste a tensão de deslocamento da pipeta para 0 mV. Libere imediatamente a pressão positiva. Idealmente, a vesícula será puxada em direção à pipeta e conectada à membrana, formando um gigaseal (1-20 GΩ) dentro de 1 s.Procure uma diminuição para <10 pA da amplitude da corrente evocada pelo pulso de tensão de 5 mV, o que indica a formação bem-sucedida do gigaseal.
NOTA: A pressão positiva estável é essencial para a formação do gigaseal. Às vezes, vazamentos na tubulação podem impedir a formação de gigaseal. Recomenda-se usar um manômetro para garantir que não haja vazamentos. Se for detectado um vazamento, reconecte a tubulação ou aplique uma pequena quantidade de vaselina nas costuras para melhorar a vedação.
5. Medição de corrente
- Quebra de membrana
NOTA: Dependendo das necessidades experimentais, o contato eletrodo-membrana pode ser categorizado em quatro modos: modo ligado à célula, modo de célula inteira, modo de dentro para fora e modo de fora para fora (Figura 6).- Para registro de vesículas inteiras, use um pulso curto de alta tensão (pulso ZAP) de 200 μs ou 500 μs para quebrar a membrana no ponto de contato entre a pipeta e a organela. Defina a tensão de -500 mV a -1.200 mV, diminuindo em 100 mV a cada vez até que a membrana seja rompida.
- Para o modo de dentro para fora (gravação de canal único), após formar o gigaseal, puxe a pipeta para longe da organela, arrancando um pequeno pedaço da membrana, expondo o lado que estava originalmente voltado para o lúmen da vesícula.
- Para o modo de fora para fora, depois de formar o gigaseal e fazer a transição para o modo de vesícula inteira, puxe a pipeta para longe da organela, arrancando um pequeno pedaço da membrana enquanto mantém uma pequena estrutura vesicular.
- Gravação atual
- Registre a corrente através da membrana endolisossômica à medida que a tensão de entrada varia em experimentos de grampo de grampo de tensão endolisossomal.
- Controle essas tensões por degraus de tensão ou rampas de tensão; usar uma ampla faixa de tensões de entrada (por exemplo, -100 mV a +100 mV) em experimentos de pinça de tensão endolisossomal.
- Registre a corrente através da membrana endolisossômica à medida que a tensão de entrada varia em experimentos de grampo de grampo de tensão endolisossomal.
Resultados
A seguir, descrevem-se as formas atuais observadas durante os experimentos com patch-clamp endolisossomal. Se a forma atual não for a esperada, pode ser devido a mau contato ou vazamento. Pode ocorrer mau contato se o eletrodo de referência não estiver totalmente em contato com a solução do banho ou se o eletrodo da pipeta estiver prestes a quebrar. O vazamento pode ocorrer se houver um espaço entre a câmara e a lamínula, permitindo que o fluido flua para a lente objetiva ou para a platina; Ter muita ou pouca solução de pipeta também pode resultar em tais anormalidades.
Inserção da agulha na solução/contato da agulha com a superfície celular/ZAP
Durante o estabelecimento do modo ligado ao lisossomo (formação de gigaseal), a resposta da corrente diminui rapidamente. A resistência da vedação pode ser determinada dividindo a tensão de comando pela baixa quantidade de corrente restante (Figura 7).
Rampa/vazamento
A aplicação repetida de uma tensão de entrada contínua variando de -100 mV a +100 mV pode registrar a corrente através da membrana endolisossomal ao longo do tempo (Figura 8). Usando soluções padrão, a composição de íons dentro e fora da organela difere. Se o canal exibir seletividade, o ponto de interseção da curva de corrente-tensão não estará em zero devido à permeabilidade diferente dos íons que fluem para dentro e para fora. Este ponto de interseção é chamado de potencial reverso do canal e pode ser calculado usando a seguinte fórmula10:
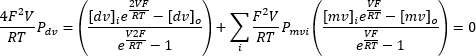
Onde dv: íons divalentes; MV: íons monovalentes; i: interno; o: externo; P: permeabilidade da membrana para o íon S medida em m·s−1; V: potencial transmembrana em volts; F: Constante de Faraday, igual a 96,485 C·mol−1 ou J· V−1·mol−1; R: constante de gás, igual a 8,314 J· K−1·mol−1; T: temperatura absoluta, medida em kelvins (= °C + 273,15).
Pode haver componentes de corrente passiva associados à condutância de fuga e canais iônicos específicos nos endolisossomos. A corrente de fuga é caracterizada por uma relação de corrente linear (I)-tensão (V), com a interseção na origem. As correntes de fuga de endolisossomos isolados de células HEK293 não transfectadas são inferiores a 50 pA a 100 mV; Os canais iônicos subjacentes são provavelmente canais de condutância de potássio / sódio e canais de cloreto.
Nos casos de canais iônicos ativados por tensão, os componentes da corrente de fuga na corrente medida podem ser subtraídos registrando uma série de pulsos de tensão escalonados antes ou depois das correntes endolisossômicas dependentes de tensão de estimulação. O vazamento também pode ser subtraído offline. A amplitude desses pulsos escalonados é tipicamente um quarto ou um quinto da amplitude do pulso experimental, um processo conhecido como subtração de vazamento P/4 ou P/511. Devido à magnitude muito pequena das correntes de fuga, a subtração P/4 ou P/5 não é normalmente usada.
Braçadeira de tensão
A aplicação repetida de saltos graduais na tensão de entrada pode registrar a corrente através da membrana endolisossomal à medida que a tensão muda. Isso ajuda a determinar se o canal é um canal iônico12 dependente de tensão. Além do grampo de tensão, o grampo de corrente também é viável. A atividade de canal único pode ser registrada usando as configurações disponíveis no modo de grampo de tensão12. A densidade tipicamente baixa dos canais iônicos endolisossômicos pode dificultar o processo de obtenção de adesivos contendo um único canal. O vidro de pipeta de parede espessa é o melhor material para a produção de eletrodos com pontas de pipeta pequenas e baixa capacitância. Revestir o vidro com Sylgard ou cera pode reduzir a capacitância da pipeta.
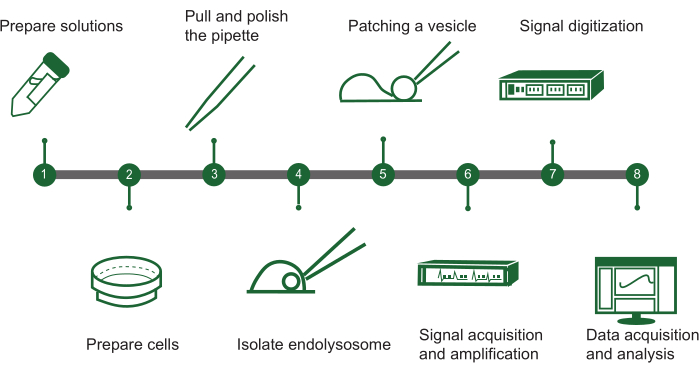
Figura 1: Visão geral das etapas do patch-clamp endolisossômico. O protocolo para avaliar a atividade do canal iônico em vesículas intracelulares usando um sistema manual de patch-clamp endolisossômico pode ser descrito em um fluxograma com as seguintes etapas principais: (1) Preparação da solução: Monte todas as soluções químicas necessárias. (2) Preparação celular: Cresça e prepare as células para extração endolisossômica. (3) Fabricação de pipetas: Crie e polir a pipeta patch-clamp para garantir um manuseio preciso. (4) Isolamento do endolisossomo: Separe manualmente os endolisossomos das células cultivadas. (5) Remendo de vesícula: Conecte a pipeta a uma única vesícula endolisossômica. (6) Aquisição de sinal: Capture e amplifice sinais elétricos da vesícula. (7) Digitalização de sinais: Converta os sinais analógicos em formato digital para análise. (8) Coleta e análise de dados: Reúna os dados e interprete-os para investigar a função do canal iônico. Clique aqui para ver uma versão maior desta figura.

Figura 2: Configuração do hardware eletrofisiológico. Durante as medições de eletrodo duplo, o eletrodo de medição entra em contato com a membrana alvo, enquanto o eletrodo de referência é colocado na solução do banho. A diferença de potencial entre os dois é amplificada pelo amplificador, digitalizada pelo digitalizador e depois capturada pelo computador. Clique aqui para ver uma versão maior desta figura.

Figura 3: Ferramentas farmacológicas usadas para análise de patch-clamp endolisossomal. Esquema mostrando as faixas de atividade de diferentes agentes farmacológicos para patch-clamp. A combinação de Wortmannin e Latrunculin B é altamente específica para endossomos precoces, excluindo endossomos de reciclagem. YM201636 aumenta seletivamente os endossomos / lisossomos tardios. A vacuolina aumenta os endossomos iniciais, reciclando endossomos, bem como endossomos/lisossomos tardios13. Clique aqui para ver uma versão maior desta figura.

Figura 4: Isolamento de organelas aumentadas. Uma ilustração esquemática do processo de isolamento manual de uma vesícula alvo de uma célula. As etapas são as seguintes: (1) Preparação da lamínula: A célula-alvo que contém a vesícula-alvo é colocada em uma lamínula. (2) Corte a membrana plasmática: A membrana plasmática da célula-alvo é cortada usando uma pipeta de isolamento. (3) Pipeta de isolamento: A pipeta de isolamento é posicionada para atingir a vesícula. (4) Aperte a vesícula alvo fora da célula: A vesícula alvo é cuidadosamente espremida fora da célula usando a pipeta de isolamento. Clique aqui para ver uma versão maior desta figura.

Figura 5: Posição relativa recomendada entre a pipeta de remendo e a vesícula para a formação de gigaseal. Depois de aplicar pressão positiva, aproxime-se da organela por cima com a pipeta de remendo. Posicione a ponta a cerca de um terço do topo da organela e abaixe lentamente (modo 3-6) a pipeta até que a pressão positiva faça com que a membrana da organela se mova. Sob o microscópio, a organela deve rolar ou ser empurrada para longe da ponta. Nesse momento, libere a pressão positiva e espere o gigaseal se formar. Clique aqui para ver uma versão maior desta figura.

Figura 6: Tipos de configurações. Dependendo do método de contato entre a pipeta e a organela, existem quatro modos de medição diferentes: organela ou vesícula fixada, vesícula inteira, de dentro para fora e de fora para fora. Clique aqui para ver uma versão maior desta figura.
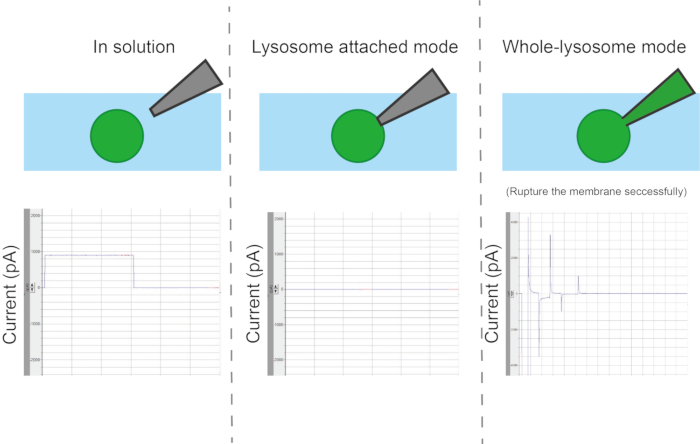
Figura 7: Correntes para calcular a resistência da pipeta, resistência de vedação, resistência em série e capacitância da célula. A pipeta de registro é posicionada na solução do banho e um pulso de tensão retangular (duração de 5 ms, 5 mV) produz uma resposta de corrente quase retangular. A resistência da pipeta pode ser determinada dividindo a tensão aplicada pela corrente medida. À medida que o gigaseal é formado durante o modo ligado ao lisossomo, a resposta atual diminui rapidamente. A resistência da vedação pode ser calculada dividindo a tensão pela corrente restante muito pequena. Quando um pulso ZAP é aplicado, a membrana se rompe rapidamente, levando a um aumento nas correntes capacitivas, sinalizando a transição para a configuração endolisossomal total. Para um endolisossomo esférico, a corrente resultante segue uma única função exponencial do tempo. A resistência em série é determinada dividindo a amplitude da corrente capacitiva pela tensão de comando, e a capacitância do endolisossomo é calculada dividindo a constante de tempo das correntes capacitivas pela resistência em série12. Clique aqui para ver uma versão maior desta figura.
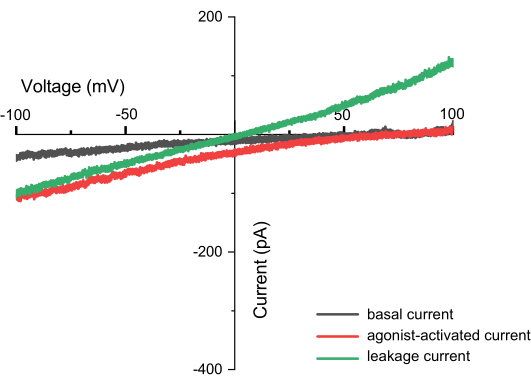
Figura 8: Correntes observadas durante a gravação em rampa (por exemplo, TPC2). Este é um gráfico de relação corrente-tensão (IV), com o eixo X representando a tensão variando de -100 a +100 mV e o eixo Y indicando a corrente gerada em diferentes tensões. O gráfico usa medições do canal TPC2 como exemplo. A linha preta mostra os resultados obtidos diretamente após a aplicação do pulso ZAP, a linha vermelha representa a corrente gerada quando o canal TPC2 é ativado pelo agonista TPC2-A1N, e a linha verde indica corrente de fuga, que pode resultar de uma vedação incompleta. Uma medição bem-sucedida pode ser identificada não apenas capturando a forma do canal, mas também pela ausência de correntes de fuga. Se houver correntes de fuga, a interseção da corrente e do eixo X estará em 0, formando uma linha reta (com diferentes íons dentro e fora da membrana). Clique aqui para ver uma versão maior desta figura.
| Pipeta de adesivo endolisossômico | Pipeta de adesivo de células inteiras | |||||||
| Ciclo | CALOR | PUXAR | VEL | HORA | CALOR | PUXAR | VEL | HORA |
| 1 | Valor determinado pelo protocolo de rampa +10 | Em branco | 30 | 150 | Valor determinado pelo protocolo de rampa +10 | Em branco | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | Valor determinado pelo protocolo de rampa +25 | 18 | 150 | - | - | |||
| 6 | Valor determinado pelo protocolo de rampa +20 | 15 | 150 | - | - | |||
Tabela 1: Protocolo de retirada de pipetas de remendo. Primeiro, use a função ramp para encontrar a temperatura de CALOR apropriada e, em seguida, siga a tabela para ajustar os seis ciclos de tração.
| Endolisossomos inespecíficos (Vacuolina-1) / LE/LY específicos (YM201636) | Macrófago | 1 μM / 0,4 μM | 1-2 h / 1-3 h |
| COS-1, HEK293, Hela, fibroblasto, etc. | 1 μM / 0,4 μM | Pernoite / Pernoite | |
| Cardiomiócitos, células musculares esqueléticas | 5 μM | 24-48 h |
Tabela 2: A concentração e a duração do tratamento necessárias para aumentar os endolisossomos em diferentes tipos de células usando agentes farmacológicos. Diferentes tipos de células exibem diferenças significativas em sua eficiência de aumento sob tratamento medicamentoso. Geralmente, as células com um sistema endolisossomal mais ativo requerem tempos de tratamento mais curtos. No entanto, o tempo e a concentração ideais de tratamento ainda precisam ser determinados experimentalmente13.
Discussão
As configurações experimentais eletrofisiológicas têm quatro requisitos laboratoriais principais: i) ambiente: métodos para manter a amostra saudável; ii) óptica: métodos para visualizar a amostra; iii) mecânica: métodos para posicionar o microeletrodo de forma estável; e iv) eletrônica: métodos para amplificar e registrar o sinal.
Para realizar com sucesso experimentos de patch clamp endolisossômico, várias etapas importantes são cruciais. Primeiro, a condição das células - as células devem estar firmemente aderidas à lamínula para que, quando a pipeta de isolamento for usada para quebrar as células, a célula inteira não se mova. Garantir que as células estejam saudáveis e bem espalhadas é importante. Se as células não puderem ficar fixas no lugar, mudar para um revestimento apropriado na lamínula pode ajudar. Além disso, a densidade celular precisa ser monitorada. Quando a densidade celular é muito alta (maior que 90%), a eficácia do aumento da organela induzida por drogas diminui, dificultando a realização de experimentos. Em segundo lugar, a qualidade da pipeta de remendo - a ponta da pipeta de remendo deve ser de tamanho apropriado (5-8 MΩ) e o vidro em ambos os lados deve ser liso e paralelo.
Terceiro, durante a formação de um gigaseal, se ele não se formar imediatamente após a liberação da pressão positiva, a aplicação de uma quantidade moderada de pressão negativa pode ajudar. No entanto, uma vez que o gigaseal se forma, a pressão negativa deve ser liberada imediatamente para evitar o risco de toda a vesícula ser sugada para dentro da pipeta. Além disso, ao realizar um patch-clamp de endolisossomo inteiro, uma pequena parte da membrana precisa ser rompida. Devido à falta de citoesqueleto nos endolisossomos, eles são muito frágeis e muitas vezes se tornam instáveis, fazendo com que as partes sejam sugadas para dentro da pipeta. Nesse caso, aplicar uma leve pressão positiva para empurrar a parte sugada para fora pode ajudar. Se a capacitância da organela restante na ponta da pipeta for inferior a 1 pF, isso indica que resta muito pouca membrana, provavelmente não contendo os canais de interesse. Nesses casos, é recomendável tentar uma nova vesícula. Por fim, ao adicionar medicamentos, evite bater diretamente na ponta da pipeta, pois o fluxo rápido de fluido pode interromper o gigaseal. Além disso, ao alcançar a gaiola de Faraday, o experimentador deve estar adequadamente aterrado para evitar a geração de sinais de ruído excessivos, o que pode dificultar a observação de resultados valiosos.
As gravações atuais com toda a estrutura endolisossômica apresentam desafios porque fatores em ambos os lados da membrana endolisossômica podem ser perdidos, potencialmente levando a alterações nas características do canal durante as gravações. Primeiro, mudanças dependentes do tempo nas características atuais podem resultar da diluição ou perda de reguladores específicos (pequenas moléculas ou outros fatores) pela solução de pipeta no lúmen lisossômico. Além disso, os componentes da pipeta ou solução citosólica podem modular vias específicas do segundo mensageiro que regulam os canais iônicos endolisossômicos. A combinação do modo de fixação endolisossômica com técnicas de remendo perfurado seria ideal para abordar questões específicas decorrentes do lado luminal da membrana endolisossômica.
Em segundo lugar, em registros de patch-clamp endolisossômico, como o lado citosólico da membrana é exposto à solução de registro (solução citosólica), pequenas moléculas ou fatores associados ao lado citosólico da membrana endolisossômica podem ser lavados. O ATP demonstrou bloquear o TPC do lado citosólico da membrana14. Projetar cuidadosamente a solução de banho (por exemplo, garantir que nenhum ATP seja incluído na solução de registro citosólico) pode minimizar esse problema específico. A execução de controles dependentes do tempo e o início de protocolos específicos em um momento consistente após o estabelecimento de configurações de registro endolisossomal completo também podem ajudar a gerenciar esse problema. Outro problema pode ser a perda de proteínas reguladoras associadas aos canais iônicos endolisossômicos devido à lavagem. Se esses fatores regulatórios fizerem parte de uma cascata de sinalização, a regulação fisiológica dos canais endolisossômicos pode ser perdida.
Tecnicamente, embora o patch-clamp endolisossômico seja atualmente a técnica eletrofisiológica mais comumente usada para estudar os canais iônicos endolisossômicos, normalmente requer o aumento das vesículas e o isolamento manual de vesículas selecionadas. Essa limitação é inerente às técnicas eletrofisiológicas baseadas em eletrodos capilares de vidro. A falta de um citoesqueleto para manter a estabilidade das organelas e a interferência dos filamentos intracelulares continuam sendo as principais razões para a baixa taxa de sucesso desses experimentos. Além do acúmulo de experiência por eletrofisiologistas, avanços futuros em sistemas ópticos avançados e ferramentas fluorescentes de moléculas pequenas de alta precisão podem permitir a medição da atividade do canal iônico em organelas individuais dentro de células individuais.
Divulgações
Os autores não têm interesses financeiros concorrentes ou outros conflitos de interesse.
Agradecimentos
Conselho Nacional de Ciência e Tecnologia, Taiwan (MOST 110-2320-B-002-022), Universidade Nacional de Taiwan (NTU-112L7818) e Institutos Nacionais de Pesquisa em Saúde, Taiwan (NHRI-EX112-11119SC).
Materiais
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
Referências
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.