Method Article
Tecniche di patch-clamp per l'analisi di singole vescicole endolisosomiali
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio un metodo per misurare direttamente l'attività dei canali ionici sulle vescicole intracellulari utilizzando un sistema manuale di patch-clamp endolisosomiale. Illustriamo il metodo che prevede l'ingrandimento degli endolisosomi e l'isolamento manuale di queste vescicole. Questo approccio garantisce che i ricercatori possano replicare e applicare accuratamente la procedura.
Abstract
I canali ionici endolisosomiali sono fondamentali per l'omeostasi degli ioni endolisosomiale e del pH, la regolazione del potenziale di membrana e il traffico delle vescicole. Tuttavia, l'accesso elettrofisiologico a questi canali all'interno di piccole vescicole intracellulari è stata una sfida. Lo sviluppo di tecniche di patch-clamp endolisosomiale è stato determinante per superare questa barriera, consentendo la misurazione diretta dell'attività dei canali ionici nelle membrane endolisosomiali.
Rispetto alle attuali tecniche di patch-clamp planare, il patch-clamp endolisosomiale può registrare contemporaneamente più cellule e combinarsi facilmente con altri metodi di misurazione. Il funzionamento manuale offre il vantaggio di visualizzare vescicole mirate. Affronta anche la limitazione dell'indispensabile presenza di Ca2+ su un lato della membrana endolisosomiale, aumentando la flessibilità del disegno sperimentale. L'utilizzo di tecniche di patch-clamp endolisosomiale consente la misurazione e l'analisi diretta dell'attività dei canali ionici all'interno degli endolisosomi.
Dato lo stretto legame tra la funzione aberrante dei canali ionici endolisosomiali e malattie come le malattie neurodegenerative e i disturbi metabolici, lo studio e la modulazione di questi canali potrebbero svelare nuovi bersagli farmacologici. Ripristinando l'equilibrio ionico intracellulare, possiamo alleviare o curare le malattie correlate. Pertanto, questa tecnica è fondamentale per scoprire nuovi bersagli farmacologici e sviluppare farmaci pertinenti.
Introduzione
I canali ionici svolgono un ruolo cruciale in numerosi processi fisiologici. Mentre i canali ionici di superficie hanno ricevuto un'attenzione significativa, l'importanza dei canali intracellulari, in particolare quelli all'interno degli endolisosomi, viene gradualmente riconosciuta. Il sistema endolisosomiale è composto da organelli multifunzionali legati alla membrana specializzati per funzioni cellulari fondamentali, tra cui endosomi di riciclo (RE), endosomi precoci (EE), endosomi tardivi (LE), lisosomi (LY) e organelli ibridi con caratteristiche sia endolisosomiali che di altro tipo, come fagosomi e autofagosomi.
Gli EE, noti anche come endosomi di smistamento (SE), sono una delle prime destinazioni per i materiali internalizzati dalla membrana plasmatica (PM). Gli EE sono compartimenti critici responsabili dello smistamento del carico in varie vie endocitiche, come la via di maturazione verso LE/LY per la degradazione, la via di riciclaggio rapido verso il PM e la via di riciclaggio lenta che coinvolge il compartimento di riciclaggio o RE periferico. I corpi multivescicolari (MVB) derivati dagli endosomi sono compartimenti sferici circondati da una membrana limitante, che può essere riempita con vescicole intraluminali (ILV)1. Per mantenere la normale funzione di questi organelli, richiedono canali ionici di membrana per regolare il pH vescicolare, l'osmolarità e la trasduzione del segnale. Tuttavia, misurare l'attività di questi canali non è semplice.
Per i canali ionici situati sulla membrana plasmatica, la tecnica patch-clamp sviluppata negli anni '70 è stata a lungo il metodo gold standard2. Tuttavia, l'accesso elettrofisiologico ai canali all'interno di piccole vescicole intracellulari è rimasto una sfida. L'applicazione del gold standard per la misurazione dei canali ionici sulla membrana plasmatica a quelli sugli organelli intracellulari deve affrontare tre sfide principali. In primo luogo, la dimensione degli endolisosomi è in genere molto piccola (meno di 1 μm di diametro), il che li rende difficili da osservare e isolare al microscopio e più piccola del diametro di apertura delle tipiche micropipette di vetro, rendendo l'esperimento inutilizzabile. In secondo luogo, isolare gli endolisosomi direttamente dalle cellule bersaglio mantenendo l'integrità degli organelli richiede abilità speciali. In terzo luogo, a causa dell'assenza di un citoscheletro negli organelli intracellulari, formare un sigillo sulla membrana endolisosomiale all'interno della pipetta patch e quindi romperla per ottenere una configurazione dell'intero endolisosoma può essere difficile, in quanto compromette l'integrità strutturale dell'organello3.
Sono stati sviluppati diversi metodi per superare questi problemi, tra cui la registrazione del doppio strato lipidico, la modifica delle sequenze di targeting lisosomiale e le tecniche di elettrofisiologia basata su membrana solida (SSM o SSME). Il metodo di registrazione del doppio strato lipidico prevede la ricostruzione di membrane fosfolipidiche sintetiche con canali ionici purificati, consentendo uno studio elettrofisiologico dettagliato della funzione delle proteine di membrana in condizioni controllate 4,5. La modifica delle sequenze di targeting lisosomiale sui canali ionici comporta il reindirizzamento dei canali ionici endolisosomiali alla membrana plasmatica per la misurazione utilizzando i metodi convenzionali di patch-clamp6. Le tecniche di elettrofisiologia basata su membrana solida (SSM o SSME), note anche come metodo di patch-clamp planare endolisosomiale, utilizzano chip di vetro planare su substrato solido con piccole aperture (<1 μm di diametro) in chip borosilicati planari microstrutturati. Questi chip di vetro a piccola apertura consentono l'analisi di endolisosomi di piccole dimensioni, anche nativi, utilizzando un sistema di controllo dell'aspirazione a pressione (Nanion). Tuttavia, nei primi due metodi, i canali ionici non si trovano nel loro ambiente fisiologico naturale. I tentativi di registrare i canali lisosomiali espressi sulla membrana plasmatica o ricostituiti in doppi strati lipidici hanno prodotto risultati in gran parte incerti e contraddittori.
Sebbene le tecniche di patch-clamp planare abbiano affrontato efficacemente il problema dell'interferenza artificiale e offrano il vantaggio di misure ad alto rendimento, anche le soluzioni utilizzate sono limitate da questo metodo. La tecnica del patch-clamp endolisosomiale introdotta in questo articolo può registrare contemporaneamente più cellule e combinarla facilmente con altri metodi di misurazione. Il funzionamento manuale offre il vantaggio di visualizzare le vescicole target. Supera anche l'inevitabile limitazione del Ca2+ nella soluzione su un lato della membrana endolisosomiale, aumentando la libertà del disegno sperimentale3. Recentemente, le tecniche di patch-clamp endolisosomiale hanno svolto un ruolo chiave nella ricerca sullo sviluppo di farmaci. Ad esempio, nelle malattie neurodegenerative, questa tecnica ha contribuito a identificare nuovi farmaci mirati ai canali ionici endolisosomiali associati alle malattie di Alzheimer e Parkinson 7,8. I ricercatori possono anche utilizzare questa tecnica per esplorare il ruolo dei canali ionici endolisosomiali nelle cellule tumorali9, controllando così la crescita e la proliferazione del tumore. Per quanto riguarda le malattie metaboliche, gli studi sul patch-clamp endolisosomiale stanno rivelando composti che regolano i canali ionici endolisosomiali, offrendo nuovi approcci terapeutici per il diabete e l'obesità. La tecnica del patch-clamp endolisosomiale aiuta a comprendere la disfunzione endolisosomiale e a trovare potenziali terapie6, migliorando significativamente la nostra comprensione delle funzioni dei canali ionici endolisosomiali e promuovendo la scoperta di nuovi bersagli farmacologici.
Protocollo
1. Configurazione dello strumento
- Hardware
NOTA: Vedere la Figura 1 per una configurazione standard del rig di elettrofisiologia.- Proteggi l'impianto dalle interferenze esterne utilizzando un tavolo e una gabbia di Faraday.
- Utilizzare un microscopio invertito con un micromanipolatore per posizionare stabilmente il microelettrodo.
- Imposta un amplificatore per raccogliere e amplificare i segnali acquisiti.
- Utilizzare un digitalizzatore per convertire i segnali analogici in segnali digitali.
- Utilizza il software di acquisizione e analisi dei dati per impostare protocolli sperimentali ed estrarre risultati significativi e analizzabili dai dati raccolti.
- Elettrodi
- Utilizzare due elettrodi: un elettrodo da bagno e un elettrodo per pipetta.
NOTA: Il platino e il cloruro d'argento hanno le migliori proprietà di polarizzazione. Gli elettrodi di cloruro d'argento sono costituiti da filo o pellet d'argento che sono stati clorurati, quindi hanno uno strato di AgCl sulla superficie esterna del filo o del pellet (Figura 2).
- Utilizzare due elettrodi: un elettrodo da bagno e un elettrodo per pipetta.
- Preparazione della pipetta
- Tirata
- Installare il tubo capillare nell'estrattore.
NOTA: I parametri utilizzati per la fabbricazione delle pipette riportati di seguito sono specifici dello strumento. Lo strumento che abbiamo usato in questo articolo è menzionato nella Tabella dei Materiali. - In condizioni sperimentali (temperatura ambiente 22 °C, filamento riscaldante di forma passante, vetro borosilicato con filamento) che non bruciano il filamento riscaldante, eseguire un test RAMP sull'estrattore per determinare il potere calorifico (HEAT) necessario per fondere il capillare di vetro.
- Progetta un nuovo programma di trazione con sei cicli di trazione separati utilizzando i parametri CALORE, velocità (VEL) e tempo (TIME) (Tabella 1).
NOTA: HEAT si riferisce al parametro che riscalda il filamento del riscaldatore, consentendo al filamento di vetro di sciogliersi. La velocità indica la velocità con cui l'estrattore tira il filamento in entrambe le direzioni. Il tempo rappresenta la durata dell'intervallo tra ogni ciclo. - Premere il pulsante verde Pull sulla tastiera.
- Allentare la manopola di serraggio e rimuovere le pipette dall'estrattore.
- Ispezionare i puntali della pipetta sotto l'oculare della microforgia per determinare il diametro, l'affilatura e la geometria del puntale. Assicurarsi che il diametro della punta sia 0,5-0,9 μm.
NOTA: Poiché il filamento viene utilizzato più frequentemente, il valore di calore richiesto per fondere il capillare di vetro cambierà. - Se la dimensione della punta non soddisfa le aspettative, regolare i parametri HEAT e VEL. Temperature più elevate e velocità più elevate produrranno punte più fini e più lunghe e viceversa. Regolare il CALORE con incrementi di 5 gradi e la velocità con incrementi di 3.
- Installare il tubo capillare nell'estrattore.
- Lucidatura
- Posizionare le pipette per cerotti estratte nel supporto per microforgia.
- Ispezionare i puntali delle pipette utilizzando una lente dell'obiettivo 35x (combinata con un oculare 15x, con conseguente ingrandimento 525x ).
- Utilizzare il micromanipolatore per avvicinare le pipette dei cerotti al filamento.
- Impostare la manopola della temperatura su 80.
- Utilizzare l'interruttore a pedale per accendere il riscaldatore e applicare un breve impulso di calore (1 - 2 s), monitorando il processo di lucidatura attraverso l'oculare della microforgia.
- Ripetere il processo fino a quando tutte le pipette non sono lucidate.
- Riporre le pipette completate in una scatola sigillata per evitare l'ingresso di polvere.
NOTA: L'obiettivo è quello di fondere rapidamente la punta in modo che il vetro riformi la geometria finale della punta senza renderla troppo affilata. Ciò impedisce alla pipetta di penetrare nella membrana della vescicola contro cui viene premuta e favorisce efficacemente la formazione della tenuta. Dopo la lucidatura finale, il percorso interno della punta della pipetta deve essere molto stretto, dritto e lineare.
Le migliori pipette di registrazione hanno in genere una resistenza di 5 - 8 MΩ dopo la lucidatura a fuoco. Il diametro dell'apertura della punta deve essere di 2 μm. Una pipetta patch perfettamente lucidata è essenziale per la corretta formazione di gigaseal, poiché questa è una delle tecniche chiave cruciali per il successo della procedura.
- Tirata
2. Preparazione del campione
- Coltura cellulare (utilizzando HEK293 come esempio)
- Coltura delle cellule in un incubatore umidificato standard a 37 °C con CO2 al 5%.
- Coltura delle cellule HEK293 in DMEM a basso contenuto di glucosio integrato con il 10% di siero fetale bovino inattivato termicamente (FBS), 100 U/mL di penicillina e 100 mg/mL di streptomicina.
- Posizionare i vetrini coprioggetti da 12 mm rivestiti in poli-L-lisina in una piastra a 24 pozzetti.
- Ingrandimento organelli
- Aggiungere 1 μM di vacuolina-1 alle cellule HEK293 nella piastra a 24 pozzetti (dal passaggio 2.1) e incubare a 37 °C con CO2 al 5% per una notte fino a quando iniziano a formarsi vescicole ingrossate.
NOTA: La dimensione degli endolisosomi ingranditi può raggiungere 1-10 μm, a seconda dello strumento, del composto, del tempo di incubazione e del tipo di cellula (Figura 3 e Tabella 2).
- Aggiungere 1 μM di vacuolina-1 alle cellule HEK293 nella piastra a 24 pozzetti (dal passaggio 2.1) e incubare a 37 °C con CO2 al 5% per una notte fino a quando iniziano a formarsi vescicole ingrossate.
- Preparazione della soluzione
NOTA: La preparazione della soluzione standard mira a simulare le concentrazioni ioniche all'interno della cellula e degli organelli. Ad esempio, le soluzioni standard per la misurazione dei canali ionici sui lisosomi sono le seguenti:- Preparare la soluzione del bagno (in mM): 140 K-metanosulfonato (MSA), 5 KOH, 4 NaCl, 0,39 CaCl2, 1 EGTA, 10 HEPES. Regolare il pH a 7,2 con KOH. Regolare l'osmolarità a 300 mosm/L con glucosio.
- Preparare la soluzione della pipetta (in mM): 140 Na-MSA, 5 K-MSA, 2 Ca-MSA, 1 CaCl2, 10 HEPES, 10 MES. Regolare il pH a 4,6 con MSA. Regolare l'osmolarità a 310 mosm/L con glucosio.
NOTA: Passare la soluzione attraverso un filtro da 0,2 μm, preparare aliquote da 45 mL in provette coniche da 50 mL e conservarle a 4 °C per un massimo di 2-4 settimane.
3. Isolamento degli organelli
- Rimuovere un vetrino coprioggetti con le cellule trattate (vedere paragrafo 2) dalla piastra a 24 pozzetti, trasferirlo nella camera del microscopio e aggiungere 1 mL di soluzione per il bagno.
NOTA: Le cellule non devono essere conservate nella soluzione del bagno per >1 ora per gli esperimenti di patch-clamp dell'intero endolisosomiale che comportano l'isolamento, la sigillatura e la registrazione dell'endolisosoma. Dopo 1 ora, gli endolisosomi ingrossati si restringono, aderiscono alla pipetta e diventano difficili da isolare. - Utilizzare un ago di riempimento in plastica fatto in casa per riempire la pipetta isolante con la soluzione per pipette e installare la pipetta all'estremità anteriore della configurazione del patch-clamp.
- Impostare l'angolo di movimento diagonale del micromanipolatore in modo che sia vicino a 30° (valore predefinito di fabbrica).
- Al microscopio (obiettivo 40x e oculare 10x), esaminare le cellule per verificare la presenza di endosomi o lisosomi sufficientemente ingranditi situati vicino al bordo della membrana cellulare per l'isolamento. Avvicinare la pipetta di isolamento alla cella selezionata.
- Abbassare la pipetta di isolamento utilizzando il micromanipolatore fino a toccare il bordo della membrana plasmatica (Figura 4). Spostare rapidamente la pipetta di isolamento orizzontalmente per strappare un piccolo pezzo della membrana plasmatica.
- Utilizzando la stessa pipetta, premere la cellula dal lato opposto per spremere l'endosoma/i lisosomi a una distanza di ~2 μm dalla cellula.
NOTA: Se c'è una membrana cellulare residua sull'organello, può impedire la formazione di un gigaseal. - Esaminare l'endolisosoma isolato al microscopio.
4. Formazione di gigaseal
- Riempire una pipetta patch appena lucidata con la soluzione appropriata e installare la pipetta all'estremità anteriore dell'amplificatore.
- Applicare 20-50 mbar di pressione positiva alla pipetta (o utilizzare 0,03-0,05 mL da una siringa da 1 mL per il controllo della pressione) e mantenere questa pressione (bloccare la valvola).
NOTA: 1 mbar (millibar) = 0,001 bar = 0,1 kPa (kilopascal) = 1 hPa (ettopascal) = 1.000 dyn/cm2. - Spostando la punta della pipetta nella soluzione del bagno, al centro del campo visivo, verificare che la pressione sia sufficientemente alta da vedere il liquido fluire nella soluzione del bagno.
- Applicare impulsi di corrente ripetuti (+5 mV; 5 ms) per determinare la resistenza della pipetta, la resistenza della tenuta e la resistenza in serie. Monitorare le dimensioni del puntale della pipetta, la formazione della guarnizione e l'instaurazione della configurazione endolisosomiale dell'intero metro.
- Spostare rapidamente la pipetta vicino alla parte superiore della vescicola target. Avvicinare la pipetta alla vescicola finché la vescicola non si muove o rotola a causa del flusso di fluido dalla pipetta (Figura 5).
- Regolare la tensione di offset della pipetta su 0 mV. Rilasciare immediatamente la pressione positiva. Idealmente, la vescicola sarà attirata verso la pipetta e collegata alla membrana, formando un gigaseal (1-20 GΩ) entro 1 s<.
NOTA: Una pressione positiva stabile è essenziale per la formazione di gigaseal. A volte, le perdite nei tubi possono prevenire la formazione di gigaseal. Si consiglia di utilizzare un manometro per assicurarsi che non vi siano perdite. Se viene rilevata una perdita, ricollegare il tubo o applicare una piccola quantità di vaselina sulle cuciture per migliorare la tenuta.
5. Misurazione della corrente
- Rottura della membrana
NOTA: A seconda delle esigenze sperimentali, il contatto elettrodo-membrana può essere classificato in quattro modalità: modalità collegata alla cella, modalità a cella intera, modalità inside-out e modalità outside-out (Figura 6).- Per la registrazione dell'intera vescicola, utilizzare un impulso corto ad alta tensione (impulso ZAP) di 200 μs o 500 μs per rompere la membrana nel punto di contatto tra la pipetta e l'organello. Impostare la tensione da -500 mV a -1.200 mV, diminuendo di 100 mV ogni volta fino a quando la membrana non viene interrotta.
- Per la modalità inside-out (registrazione a canale singolo), dopo aver formato il gigaseal, estrarre la pipetta dall'organello, strappando un piccolo pezzo di membrana, esponendo il lato che originariamente era rivolto verso il lume della vescicola.
- Per la modalità outside-out, dopo aver formato il gigaseal e essere passati alla modalità vescicola intera, estrarre la pipetta dall'organello, strappando un piccolo pezzo di membrana pur mantenendo una piccola struttura vescicolare.
- Registrazione corrente
- Registrare la corrente attraverso la membrana endolisosomiale al variare della tensione di ingresso negli esperimenti di patch-clamp di tensione endolisosomiale.
- Controllare queste tensioni tramite gradini di tensione o rampe di tensione; utilizzare un'ampia gamma di tensioni di ingresso (ad esempio, da -100 mV a +100 mV) in esperimenti di voltage-clamp endolisosomiale.
- Registrare la corrente attraverso la membrana endolisosomiale al variare della tensione di ingresso negli esperimenti di patch-clamp di tensione endolisosomiale.
Risultati
Di seguito vengono descritte le forme attuali osservate durante gli esperimenti di patch-clamp endolisosomiale. Se la forma attuale non è quella prevista, potrebbe essere dovuto a uno scarso contatto o a una perdita. Se l'elettrodo di riferimento non è completamente a contatto con la soluzione del bagno o se l'elettrodo della pipetta sta per rompersi, può verificarsi uno scarso contatto. Le perdite possono verificarsi se c'è uno spazio tra la camera e il vetrino coprioggetti che consente al fluido di fluire sulla lente dell'obiettivo o sul tavolino; Anche la presenza di una quantità eccessiva o insufficiente di soluzione pipettata potrebbe causare tali anomalie.
Inserimento dell'ago nella soluzione/contatto dell'ago con la superficie cellulare/ZAP
Durante l'instaurazione della modalità di adesione al lisosoma (formazione gigaseal), la risposta di corrente diminuisce rapidamente. La resistenza di tenuta può essere determinata dividendo la tensione di comando per la bassa quantità di corrente residua (Figura 7).
Rampa/perdita
L'applicazione ripetuta di una tensione di ingresso continua compresa tra -100 mV e +100 mV può registrare la corrente attraverso la membrana endolisosomiale nel tempo (Figura 8). Utilizzando soluzioni standard, la composizione ionica all'interno e all'esterno dell'organello differisce. Se il canale mostra selettività, il punto di intersezione della curva corrente-tensione non sarà a zero a causa della diversa permeabilità degli ioni che fluiscono dentro e fuori. Questo punto di intersezione è indicato come il potenziale inverso del canale e può essere calcolato utilizzando la seguente formula10:
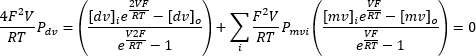
Dove dv: ioni bivalenti; MV: ioni monovalenti; i: interno; o: esterno; P: permeabilità della membrana per lo ione S misurata in m·s−1; V: potenziale transmembrana in volt; F: costante di Faraday, pari a 96.485 C·mol−1 o J· V−1·mol−1; R: costante dei gas, pari a 8,314 J· K−1·mol−1; T: temperatura assoluta, misurata in kelvin (= °C + 273,15).
Possono esserci componenti di corrente passiva associati alla conduttanza di dispersione e a specifici canali ionici negli endolisosomi. La corrente di dispersione è caratterizzata da una relazione lineare corrente (I)-tensione (V), con l'intersezione all'origine. Le correnti di dispersione dagli endolisosomi isolati da cellule HEK293 non trasfettate sono inferiori a 50 pA a 100 mV; I canali ionici sottostanti sono probabilmente canali di conduttanza potassio/sodio e canali del cloruro.
Nel caso di canali ionici attivati in tensione, le componenti della corrente di dispersione nella corrente misurata possono essere sottratte registrando una serie di impulsi di tensione scalati prima o dopo le correnti endolisosomiali stimolanti voltaggio-dipendenti. Le perdite possono anche essere sottratte offline. L'ampiezza di questi impulsi scalati è tipicamente un quarto o un quinto dell'ampiezza dell'impulso sperimentale, un processo noto come sottrazione di perdite P/4 o P/511. A causa dell'entità molto piccola delle correnti di dispersione, la sottrazione P/4 o P/5 non viene generalmente utilizzata.
Pinza di tensione
L'applicazione ripetuta di salti graduali della tensione di ingresso può registrare la corrente attraverso la membrana endolisosomiale al variare della tensione. Questo aiuta a determinare se il canale è un canale ionico12 voltaggio-dipendente. Oltre alla pinza di tensione, è possibile anche la pinza amperometrica. L'attività a canale singolo può essere registrata utilizzando le configurazioni disponibili in modalità voltage clamp12. La densità tipicamente bassa dei canali ionici endolisosomiali può ostacolare il processo di ottenimento di patch contenenti un singolo canale. Il vetro per pipette a pareti spesse è il materiale migliore per la produzione di elettrodi con punte per pipette piccole e bassa capacità. Il rivestimento del vetro con Sylgard o cera può ridurre la capacità della pipetta.
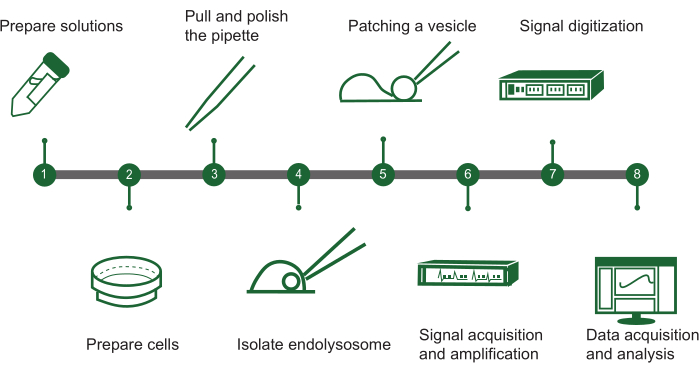
Figura 1: Panoramica delle fasi del patch-clamp endolisosomiale. Il protocollo per valutare l'attività dei canali ionici nelle vescicole intracellulari utilizzando un sistema manuale di patch-clamp endolisosomiale può essere delineato in un diagramma di flusso con i seguenti passaggi chiave: (1) Preparazione della soluzione: assemblare tutte le soluzioni chimiche necessarie. (2) Preparazione cellulare: far crescere e preparare le cellule per l'estrazione endolisosomiale. (3) Fabbricazione della pipetta: creare e lucidare la pipetta patch-clamp per garantire una manipolazione precisa. (4) Isolamento degli endolisosomi: separare manualmente gli endolisosomi dalle cellule in coltura. (5) Patch delle vescicole: collegare la pipetta a una singola vescicola endolisosomiale. (6) Acquisizione del segnale: cattura e amplifica i segnali elettrici dalla vescicola. (7) Digitalizzazione del segnale: converti i segnali analogici in forma digitale per l'analisi. (8) Raccolta e analisi dei dati: raccogliere i dati e interpretarli per studiare la funzione dei canali ionici. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Configurazione dell'hardware elettrofisiologico. Durante le misure a doppio elettrodo, l'elettrodo di misura entra in contatto con la membrana target, mentre l'elettrodo di riferimento viene posizionato nella soluzione del bagno. La differenza di potenziale tra i due viene amplificata dall'amplificatore, digitalizzata dal digitalizzatore e quindi catturata dal computer. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Strumenti farmacologici utilizzati per l'analisi del patch-clamp endolisosomiale. Schema che mostra gli intervalli di attività di diversi agenti farmacologici per patch-clamp. La combinazione di Wortmannin e Latrunculina B è altamente specifica per gli endosomi precoci, esclusi gli endosomi di riciclo. YM201636 ingrandisce selettivamente gli endosomi/lisosomi tardivi. La vacuolina ingrandisce gli endosomi precoci, riciclando gli endosomi e gli endosomi/lisosomi tardivi13. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Isolamento di organelli ingrossati. Un'illustrazione schematica del processo di isolamento manuale di una vescicola bersaglio da una cellula. Le fasi sono le seguenti: (1) Preparazione del vetrino coprioggetti: la cellula bersaglio contenente la vescicola bersaglio viene posizionata su un vetrino coprioggetti. (2) Tagliare la membrana plasmatica: la membrana plasmatica della cellula bersaglio viene tagliata utilizzando una pipetta di isolamento. (3) Pipetta di isolamento: la pipetta di isolamento è posizionata in modo da colpire la vescicola. (4) Spremere la vescicola bersaglio all'esterno della cellula: la vescicola bersaglio viene accuratamente schiacciata all'esterno della cellula utilizzando la pipetta di isolamento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Posizione relativa consigliata tra la pipetta del cerotto e la vescicola per la formazione di gigaseal. Dopo aver applicato una pressione positiva, avvicinarsi all'organello dall'alto con la pipetta per cerotto. Posizionare la punta a circa un terzo della distanza dalla parte superiore dell'organello e abbassare lentamente (modalità 3-6) la pipetta del cerotto fino a quando la pressione positiva non provoca il movimento della membrana dell'organello. Al microscopio, l'organello deve rotolare o essere spinto via dalla punta. In quel momento, rilasciare la pressione positiva e attendere che si formi il gigaseal. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Tipi di configurazioni. A seconda del metodo di contatto tra la pipetta e l'organello, esistono quattro diverse modalità di misurazione: organello o vescicola, vescicola intera, inside-out e outside-out. Clicca qui per visualizzare una versione più grande di questa figura.
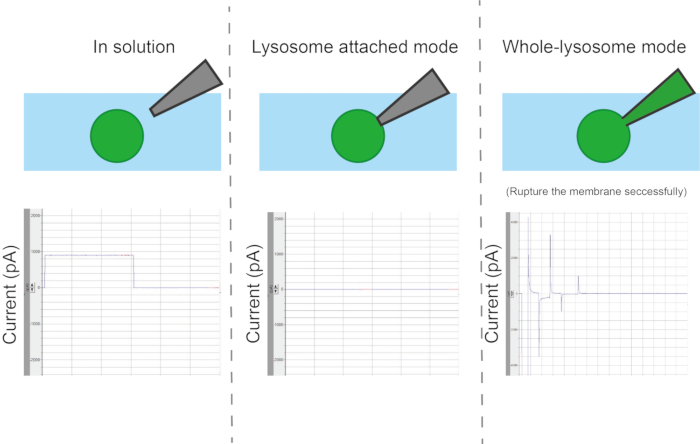
Figura 7: Correnti per il calcolo della resistenza della pipetta, della resistenza di tenuta, della resistenza in serie e della capacità della cella. La pipetta di registrazione è posizionata nella soluzione del bagno e un impulso di tensione rettangolare (durata 5 ms, 5 mV) produce una risposta di corrente quasi rettangolare. La resistenza della pipetta può essere determinata dividendo la tensione applicata per la corrente misurata. Poiché il gigaseal si forma durante la modalità attaccata al lisosoma, la risposta di corrente diminuisce rapidamente. La resistenza di tenuta può essere calcolata dividendo la tensione per la corrente residua, molto piccola. Quando viene applicato un impulso ZAP, la membrana si rompe rapidamente, portando ad un aumento delle correnti capacitive, segnalando la transizione alla configurazione endolisosomiale completa. Per un endolisosoma sferico, la corrente risultante segue una singola funzione esponenziale del tempo. La resistenza in serie è determinata dividendo l'ampiezza della corrente capacitiva per la tensione di comando e la capacità dell'endolisosoma è calcolata dividendo la costante di tempo delle correnti capacitive per la resistenza in serie12. Clicca qui per visualizzare una versione più grande di questa figura.
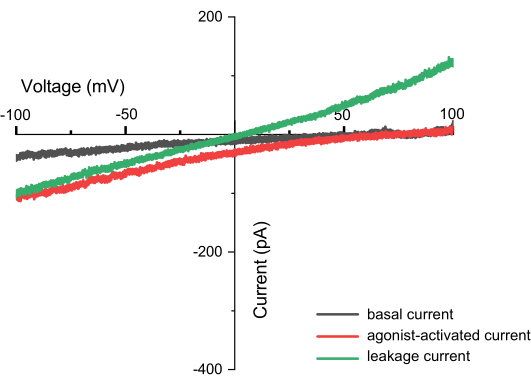
Figura 8: Correnti osservate durante la registrazione della rampa (ad esempio, TPC2). Si tratta di un grafico della relazione corrente-tensione (I-V), con l'asse X che rappresenta la tensione che va da -100 a +100 mV e l'asse Y che indica la corrente generata a tensioni diverse. Il grafico utilizza come esempio le misurazioni del canale TPC2. La linea nera mostra i risultati ottenuti direttamente dopo l'applicazione dell'impulso ZAP, la linea rossa rappresenta la corrente generata quando il canale TPC2 viene attivato dall'agonista TPC2-A1N e la linea verde indica la corrente di perdita, che può derivare da una tenuta incompleta. Una misurazione corretta può essere identificata non solo catturando la forma del canale, ma anche dall'assenza di correnti di perdita. Se sono presenti correnti di dispersione, l'intersezione della corrente e dell'asse X sarà a 0, formando una linea retta (con ioni diversi all'interno e all'esterno della membrana). Clicca qui per visualizzare una versione più grande di questa figura.
| Pipetta per cerotti endolisosomiale | Pipetta per cerotti a cellule intere | |||||||
| Ciclo | CALORE | TIRARE | VEL | ORE | CALORE | TIRARE | VEL | ORE |
| 1 | Valore determinato dal protocollo di rampa +10 | Vuoto | 30 | 150 | Valore determinato dal protocollo di rampa +10 | Vuoto | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | Valore determinato dal protocollo di rampa +25 | 18 | 150 | - | - | |||
| 6 | Valore determinato dal protocollo di rampa +20 | 15 | 150 | - | - | |||
Tabella 1: Protocollo di estrazione delle pipette per patch. Innanzitutto, utilizzare la funzione ramp per trovare la temperatura di CALORE appropriata, quindi seguire la tabella per regolare i sei cicli di trazione.
| Endolisosomi aspecifici (Vacuolina-1) / LE/LY specifici (YM201636) | Macrofago | 1 μM / 0,4 μM | 1-2 h / 1-3 h |
| COS-1, HEK293, Hela, fibroblasto, ecc | 1 μM / 0,4 μM | Pernottamento / Pernottamento | |
| Cardiomiociti, cellule muscolari scheletriche | 5 μM | 24-48 h |
Tabella 2: La concentrazione e la durata del trattamento necessarie per ingrandire gli endolisosomi in diversi tipi di cellule utilizzando agenti farmacologici. Diversi tipi di cellule mostrano differenze significative nella loro efficienza di ingrossamento durante il trattamento farmacologico. Generalmente, le cellule con un sistema endolisosomiale più attivo richiedono tempi di trattamento più brevi. Tuttavia, il tempo di trattamento e la concentrazione ottimali devono ancora essere determinati sperimentalmente13.
Discussione
Le configurazioni sperimentali elettrofisiologiche hanno quattro requisiti principali di laboratorio: i) ambiente: metodi per mantenere il campione sano; ii) ottica: metodi per visualizzare il campione; iii) meccanica: metodi per posizionare stabilmente il microelettrodo; e iv) elettronica: metodi per amplificare e registrare il segnale.
Per eseguire con successo gli esperimenti di patch-clamp endolisosomiale, sono cruciali diversi passaggi chiave. In primo luogo, le condizioni delle cellule: le cellule devono essere strettamente aderenti al vetrino coprioggetti in modo che quando la pipetta di isolamento viene utilizzata per rompere le cellule, l'intera cellula non si muova. È importante assicurarsi che le cellule siano sane e ben diffuse. Se le celle non riescono a rimanere fissate in posizione, può essere utile passare a un rivestimento appropriato sul vetrino coprioggetti. Inoltre, la densità cellulare deve essere monitorata. Quando la densità cellulare è troppo alta (superiore al 90%), l'efficacia dell'allargamento degli organelli indotto dal farmaco diminuisce, rendendo gli esperimenti difficili da condurre. In secondo luogo, la qualità della pipetta patch: la punta della pipetta patch deve essere di dimensioni adeguate (5-8 MΩ) e il vetro su entrambi i lati deve essere liscio e parallelo.
In terzo luogo, durante la formazione di un gigaseal, se non si forma immediatamente dopo aver rilasciato la pressione positiva, l'applicazione di una quantità moderata di pressione negativa può essere d'aiuto. Tuttavia, una volta che il gigaseal si forma, la pressione negativa deve essere rilasciata immediatamente per evitare il rischio che l'intera vescicola venga aspirata nella pipetta. Inoltre, quando si esegue un patch-clamp dell'intero endolisosoma, è necessario rompere una piccola parte della membrana. A causa della mancanza di citoscheletro negli endolisosomi, sono molto fragili e spesso diventano instabili, causando l'aspirazione di parti nella pipetta. In questo caso, può essere utile applicare una leggera pressione positiva per spingere fuori la parte aspirata. Se la capacità dell'organello rimanente sulla punta della pipetta è inferiore a 1 pF, indica che è rimasta pochissima membrana, probabilmente non contenente i canali di interesse. In questi casi, si consiglia di provare una nuova vescicola. Infine, quando si aggiungono farmaci, evitare di colpire direttamente la punta della pipetta, poiché un rapido flusso di fluido può interrompere il gigaseal. Inoltre, quando si raggiunge la gabbia di Faraday, lo sperimentatore deve essere adeguatamente messo a terra per evitare di generare segnali di rumore eccessivi, che possono ostacolare l'osservazione di risultati preziosi.
Le registrazioni correnti con l'intera struttura endolisosomiale presentano sfide perché i fattori su entrambi i lati della membrana endolisosomiale possono andare persi, portando potenzialmente a cambiamenti nelle caratteristiche di gating durante le registrazioni. In primo luogo, le variazioni dipendenti dal tempo delle caratteristiche attuali possono derivare dalla diluizione o dalla perdita di regolatori specifici (piccole molecole o altri fattori) da parte della soluzione della pipetta nel lume lisosomiale. Inoltre, i componenti della pipetta o della soluzione citosolica potrebbero modulare specifiche vie del secondo messaggero che regolano i canali ionici endolisosomiali. La combinazione della modalità di adesione endolisosomiale con tecniche di patch perforate sarebbe l'ideale per affrontare problemi specifici derivanti dal lato luminale della membrana endolisosomiale.
In secondo luogo, nelle registrazioni endolisosomiali di patch-clamp, poiché il lato citosolico della membrana è esposto alla soluzione di registrazione (soluzione citosolica), piccole molecole o fattori associati al lato citosolico della membrana endolisosomiale possono essere lavati via. È stato dimostrato che l'ATP blocca la TPC dal lato citosolico della membrana14. Un'attenta progettazione della soluzione del bagno (ad esempio, assicurandosi che l'ATP non sia incluso nella soluzione di registrazione citosolica) può ridurre al minimo questo particolare problema. Anche l'esecuzione di controlli dipendenti dal tempo e l'avvio di protocolli specifici in un momento coerente dopo aver stabilito le configurazioni di registrazione dell'intero endolisosomiale possono aiutare a gestire questo problema. Un altro problema potrebbe essere la perdita di proteine regolatorie associate ai canali ionici endolisosomiali a causa del dilavamento. Se questi fattori regolatori fanno parte di una cascata di segnalazione, la regolazione fisiologica dei canali endolisosomiali potrebbe andare persa.
Tecnicamente, sebbene il patch-clamp endolisosomiale sia attualmente la tecnica elettrofisiologica più comunemente utilizzata per lo studio dei canali ionici endolisosomiali, in genere richiede l'ingrandimento delle vescicole e l'isolamento manuale di vescicole selezionate. Questa limitazione è inerente alle tecniche elettrofisiologiche basate su elettrodi di vetro capillare. La mancanza di un citoscheletro per mantenere la stabilità degli organelli e l'interferenza dei filamenti intracellulari rimangono le ragioni principali del basso tasso di successo di questi esperimenti. Oltre all'accumulo di esperienza da parte degli elettrofisiologi, i futuri progressi nei sistemi ottici avanzati e negli strumenti fluorescenti ad alta precisione per piccole molecole potrebbero consentire la misurazione dell'attività dei canali ionici in singoli organelli all'interno di singole cellule.
Divulgazioni
Gli autori non hanno interessi finanziari concorrenti o altri conflitti di interesse.
Riconoscimenti
Consiglio nazionale per la scienza e la tecnologia, Taiwan (MOST 110-2320-B-002-022), Università nazionale di Taiwan (NTU-112L7818) e Istituti nazionali di ricerca sanitaria, Taiwan (NHRI-EX112-11119SC).
Materiali
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
Riferimenti
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.
