Method Article
用于单个内溶酶体囊泡分析的膜片钳技术
摘要
该协议详细介绍了一种使用手动溶酶体膜片钳系统直接测量细胞内囊泡上离子通道活性的方法。我们说明了涉及扩大内溶酶体和手动分离这些囊泡的方法。这种方法确保研究人员可以准确地复制和应用该程序。
摘要
内溶酶体离子通道对于内溶酶体离子和 pH 稳态、膜电位调节和囊泡运输至关重要。然而,通过电生理学方式访问细胞内小囊泡内的这些通道一直是一个挑战。溶酶体内溶酶体膜片钳技术的发展有助于克服这一障碍,允许直接测量内溶酶体膜中的离子通道活性。
与现有的平面膜片钳技术相比,内溶酶体膜片钳可以同时记录多个细胞,并可轻松与其他测量方法结合使用。手动作具有可视化目标囊泡的优势。它还解决了溶酶体膜一侧 Ca2+ 不可或缺的存在限制,增加了实验设计的灵活性。利用内溶酶体膜片钳技术可以直接测量和分析内溶酶体内的离子通道活性。
鉴于异常的内溶酶体离子通道功能与神经退行性疾病和代谢紊乱等疾病之间的密切联系,研究和调节这些通道可能会揭示新的药物靶点。通过恢复细胞内离子平衡,我们可以缓解或治愈相关疾病。因此,这项技术对于发现新的药物靶点和开发相关药物至关重要。
引言
离子通道在许多生理过程中起着至关重要的作用。虽然表面离子通道受到了极大的关注,但细胞内通道的重要性,尤其是内溶酶体内的通道,正逐渐得到认可。内溶酶体系统由专门用于基本细胞功能的多功能膜结合细胞器组成,包括回收内体 (RE)、早期内体 (EE)、晚期内体 (LE)、溶酶体 (LY) 以及具有内溶酶体和其他区室特征的杂交细胞器,例如吞噬体和自噬体。
EE,也称为分选内体 (SE),是从质膜 (PM) 内化的材料的早期目的地之一。EE 是负责将货物分类为各种内吞途径的关键隔室,例如到 LE/LY 进行降解的成熟途径、返回 PM 的快速回收途径以及涉及回收隔室或外周 RE 的缓慢回收途径。源自内体的多泡体 (MVB) 是被限制膜包围的球形隔室,该限制膜可以充满腔内囊泡 (ILV)1。为了维持这些细胞器的正常功能,它们需要膜离子通道来调节囊泡 pH 值、渗透压和信号转导。然而,测量这些渠道的活动并不简单。
对于位于质膜上的离子通道,1970 年代开发的膜片钳技术长期以来一直是金标准方法2。然而,在小细胞内囊泡内通过电生理途径进入通道仍然是一个挑战。将测量质膜上离子通道的金标准应用于细胞内细胞器上的离子通道面临三个主要挑战。首先,内溶酶体的大小通常非常小(直径小于 1 μm),这使得它们难以在显微镜下观察和分离,并且小于典型玻璃微量移液器的开口直径,使实验无法作。其次,直接从靶细胞中分离内溶酶体,同时保持细胞器完整性需要特殊技能。第三,由于细胞内细胞器中没有细胞骨架,在贴片移液管内的溶酶体膜上形成密封,然后将其破裂以实现全溶酶体构型可能具有挑战性,因为它会损害细胞器的结构完整性 3。
已经开发了几种方法来克服这些问题,包括脂质双层记录、修饰溶酶体靶向序列和基于实体的膜电生理学(SSM 或 SSME)技术。脂质双层记录方法涉及用纯化的离子通道重建合成磷脂膜,从而能够在受控条件下对膜蛋白功能进行详细的电生理研究 4,5。修饰离子通道上的溶酶体靶向序列涉及将溶酶体离子通道重定向到质膜,以便使用常规膜片钳方法进行测量6。基于实体的膜电生理学(SSM 或 SSME)技术,也称为溶酶体平面膜片钳方法,在微结构平面硼硅酸盐芯片中使用具有小孔径(直径 <1 μm)的固体基质平面玻璃芯片。这些小孔径玻璃芯片允许使用压力吸引控制系统 (Nanion) 分析小的、甚至天然的内溶酶体。然而,在前两种方法中,离子通道并不处于其自然生理环境中。记录在质膜上表达或重构为脂质双层的溶酶体通道的尝试在很大程度上产生了不确定和矛盾的结果。
尽管平面膜片钳技术有效地解决了人为干扰问题,并提供了高通量测量的优势,但所使用的解决方案也受到这种方法的限制。本文介绍的溶酶体膜片钳技术可以同时记录多个细胞,并可轻松与其他测量方法结合使用。手动作提供了可视化目标囊泡的优势。它还克服了内溶酶体膜一侧溶液中 Ca2+ 不可避免的限制,增加了实验设计的自由度3。最近,内溶酶体膜片钳技术在药物开发研究中发挥了关键作用。例如,在神经退行性疾病中,该技术有助于识别靶向与阿尔茨海默病和帕金森病相关的内溶酶体离子通道的新药 7,8。研究人员还可以使用这项技术来探索溶酶体内体离子通道在肿瘤细胞中的作用9,从而控制肿瘤的生长和增殖。在代谢疾病方面,内溶酶体膜片钳研究揭示了调节内溶酶体离子通道的化合物,为糖尿病和肥胖症提供了新的治疗方法。内溶酶体膜片钳技术有助于了解内溶酶体功能障碍和寻找潜在疗法6,显着增强我们对内溶酶体离子通道功能的理解,并促进新药物靶点的发现。
研究方案
1. 仪器设置
- 硬件
注意:有关标准电生理学装置设置,请参见 图 1 。- 使用工作台和法拉第笼保护装置免受外部干扰。
- 使用带有显微作器的倒置显微镜稳定定位微电极。
- 设置一个放大器来收集和放大采集的信号。
- 使用数字化器将模拟信号转换为数字信号。
- 使用数据采集和分析软件设置实验方案,并从收集的数据中提取有意义的可分析结果。
- 电极
- 使用两个电极:一个浴电极和一个移液器电极。
注:铂和氯化银具有最佳的极化特性。氯化银电极由经过氯化物处理的银丝或颗粒组成,因此在金属丝或颗粒的外表面具有 AgCl 层(图 2)。
- 使用两个电极:一个浴电极和一个移液器电极。
- 移液器制备
- 拉
- 将毛细管安装到拉拔器中。
注:以下用于移液器制造的参数是特定于仪器的。我们在本文中使用的仪器在 Table of Materials 中提到。 - 在不烧坏加热器灯丝的实验条件(室温 22 °C、通孔加热器灯丝、带灯丝的硼硅酸盐玻璃)下,对拉拔器进行 RAMP 测试,以确定熔化玻璃毛细管所需的 热值 (HEAT)。
- 使用 HEAT、速度 (VEL) 和 时间 (TIME) 参数设计一个新的拉动程序,具有六个独立的拉动循环(表 1)。
注意: HEAT 是指加热加热器灯丝,使玻璃灯丝熔化的参数。 Velocity 表示拉拔器在两个方向上拉动细丝的速度。 Time 表示每个周期之间的间隔持续时间。 - 按下键盘上的绿色 Pull 按钮。
- 松开 clamp旋钮,从拉拔器中取出移液器。
- 检查 microforge 目镜下方的移液器吸头,以确定吸头直径、锐度和几何形状。确保尖端直径为 0.5-0.9 μm。
注意:随着细丝的使用频率增加,熔化玻璃毛细管所需的热值会发生变化。 - 如果针尖尺寸不符合预期,请调整 HEAT 和 VEL 参数。更高的温度和更快的速度将产生更精细、更长的尖端,反之亦然。以 5 度为增量调整 HEAT,以 3 为增量调整速度。
- 将毛细管安装到拉拔器中。
- 抛光
- 将拉出的补片移液器放入 microforge 支架中。
- 使用 35 倍物镜检查移液器吸头(结合 15 倍目镜,产生 525 倍 放大倍率)。
- 使用显微作器将贴片移液器靠近细丝。
- 将 温度 旋钮设置为 80。
- 使用脚踏开关打开加热器并施加短暂的 热脉冲 (1 - 2 s),通过 microforge 目镜监控抛光过程。
- 重复该过程,直到所有移液器都抛光。
- 将完成的移液器放入密封盒中,以防止灰尘进入。
注意:目标是快速熔化尖端,以便玻璃改变最终的尖端几何形状,而不会使其过于尖锐。这可以防止移液器穿透它所压迫的囊泡膜,并有效地促进密封的形成。最后抛光后,移液器吸头的内路径应非常狭窄、笔直且呈线性。
最好的记录移液器在火焰抛光后通常具有 5 - 8 MΩ 的电阻。针尖开口直径应为 2 μm。完美抛光的补片移液器对于成功形成 gigaseal 至关重要,因为这是对手术成功至关重要的关键技术之一。
- 拉
2. 样品制备
- 细胞培养(以 HEK293 为例)
- 在 37 °C 和 5% CO2 的标准加湿培养箱中培养细胞。
- 在补充有 10% 热灭活胎牛血清 (FBS)、100 U/mL 青霉素和 100 mg/mL 链霉素的低葡萄糖 DMEM 中培养 HEK293 细胞。
- 将聚-L-赖氨酸包被的 12 mm 盖玻片放入 24 孔板中。
- 细胞器增大
- 向 24 孔板中的 HEK293 细胞中加入 1 μM 液泡-1(来自步骤 2.1),并在 37 °C 和 5% CO2 下孵育过夜,直到开始形成增大的囊泡。
注:扩大的内溶酶体的大小可以达到 1-10 μm,具体取决于工具、化合物、孵育时间和细胞类型(图 3 和 表 2)。
- 向 24 孔板中的 HEK293 细胞中加入 1 μM 液泡-1(来自步骤 2.1),并在 37 °C 和 5% CO2 下孵育过夜,直到开始形成增大的囊泡。
- 溶液制备
注:标准溶液制备旨在模拟细胞和细胞器内的离子浓度。例如,测量溶酶体上离子通道的标准溶液如下:- 制备浴液(以 mM 为单位):140 K-甲磺酸盐 (MSA)、5 KOH、4 NaCl、0.39 CaCl2、1 EGTA、10 HEPES。用 KOH 将 pH 值调节至 7.2。用葡萄糖将渗透压调节至 300 mosm/L。
- 制备移液器溶液(以 mM 为单位):140 Na-MSA、5 K-MSA、2 Ca-MSA、1 CaCl2、10 HEPES、10 MES。用 MSA 将 pH 值调节至 4.6。用葡萄糖将渗透压调节至 310 mosm/L。
注:将溶液通过 0.2 μm 过滤器,在 50 mL 锥形管中制备 45 mL 等分试样,并在 4 °C 下储存长达 2-4 周。
3. 细胞器分离
- 从 24 孔板中取出带有处理细胞(参见第 2 节)的盖玻片,将其转移到显微镜室中,并加入 1 mL 浴液。
注意:对于涉及内溶酶体分离、密封和记录的全内溶酶体膜片钳实验,细胞不得在浴液中储存 >1 小时。1 小时后,增大的内溶酶体会收缩,粘附在移液管上,变得难以分离。 - 使用自制的塑料填充针将移液器溶液填充到隔离移液器中,并将移液器安装在膜片钳设置的前端。
- 将 显微纵器的对角线移动角度 设置为接近 30° (出厂默认值)。
- 在显微镜(40 倍物镜和 10 倍目镜)下,检查细胞中是否存在足够增大的内体或位于细胞膜边缘附近的溶酶体以进行分离。将分离移液器移到靠近所选细胞的位置。
- 使用显微作器降低隔离移液器,直到它接触到质膜的边缘(图 4)。快速水平移动隔离移液器以撕下一小块质膜。
- 使用相同的移液管,从另一侧按压细胞,将内体/溶酶体挤出至距细胞 ~2 μm 的距离。
注意:如果细胞器上有残留的细胞膜,则可能会阻止 gigaseal 的形成。 - 在显微镜下检查分离的内溶酶体。
4. Gigaseal 形成
- 用适当的移液器溶液填充新抛光的补片移液器,并将移液器安装在放大器的前端。
- 对移液器施加 20 - 50 mbar 的正压(或使用 1 mL 注射器中的 0.03-0.05 mL 进行压力控制)并保持该压力(锁定阀门)。
注意: 1 mbar(毫巴)= 0.001 bar = 0.1 kPa(千帕)= 1 hPa(百帕)= 1,000 dyn/cm2。 - 将移液器吸头移入浴液中,在视野的中心,确认压力足够高,可以看到液体流入浴液。
- 应用重复电流脉冲 (+5 mV; 5 ms) 以确定移液器电阻、密封电阻和串联电阻。监测移液器吸头尺寸、密封形成和全内溶酶体构型的建立。
- 快速将移液器靠近目标囊泡的顶部。将移液器靠近囊泡,直到囊泡由于液体从移液器流出而移动或滚动(图 5)。
- 将移液器的偏移电压调整为 0 mV。立即释放正压。理想情况下,囊泡将被拉向移液器并连接到膜上,在 1 s 内形成 gigaseal (1-20 GΩ<)。
注:稳定的正压对于 gigaseal 的形成至关重要。有时,管路中的泄漏会阻止 gigaseal 的形成。建议使用压力表以确保没有泄漏。如果检测到泄漏,请重新连接管路或在接缝处涂抹少量凡士林以改善密封。
5. 电流测量
- 膜破裂
注意:根据实验需要,电极与膜的接触可分为四种模式:细胞附着模式、全细胞模式、由内而外模式和由外而外模式(图 6)。- 对于整个囊泡记录,使用 200 μs 或 500 μs 的高压短脉冲 (ZAP 脉冲) 在移液器和细胞器之间的接触点处破坏膜。将电压设置为 -500 mV 至 -1,200 mV,每次降低 100 mV ,直到膜被破坏。
- 对于由内而外(单通道记录)模式,形成 gigaseal 后,将移液器从细胞器中拉出,撕下一小块膜,露出原本面向囊泡腔的一侧。
- 对于由外向外模式,在形成 gigaseal 并过渡到整个囊泡模式后,将移液管从细胞器中拉出,撕下一小块膜,同时保持小囊泡结构。
- 当前记录
- 在内溶酶体电压钳膜片钳实验中,当输入电压变化时,记录通过内溶酶体膜的电流。
- 通过电压阶跃或电压斜坡控制这些电压;在内溶酶体电压钳实验中使用宽范围的输入电压(例如, -100 mV 至 +100 mV)。
- 在内溶酶体电压钳膜片钳实验中,当输入电压变化时,记录通过内溶酶体膜的电流。
结果
下面描述了在溶酶体膜片钳实验中观察到的当前形状。如果当前形状与预期不符,则可能是由于接触不良或泄漏。如果参比电极未与浴液完全接触或移液器电极即将断裂,则可能会出现接触不良。如果腔室和盖玻片之间存在间隙,允许液体流到物镜或载物台上,则可能会发生泄漏;移液器溶液过多或过少也可能导致此类异常。
针头插入溶液/针头接触细胞表面/ZAP
在溶酶体连接模式(gigaseal 形成)建立期间,电流响应迅速降低。密封电阻可以通过将指令电压除以少量剩余电流来确定(图 7)。
斜坡/泄漏
重复施加 -100 mV 至 +100 mV 的连续输入电压可以记录随着时间的推移通过内溶酶体膜的电流(图 8)。使用标准溶液时,细胞器内部和外部的离子组成不同。如果通道表现出选择性,则由于流入和流出的离子的磁导率不同,电流-电压曲线的交点不会为零。这个交点称为通道的反向电位,可以使用以下公式10 计算:
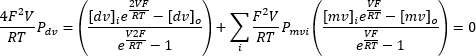
其中 dv:二价离子;mV: 一价离子;i: 内部;o: 外部;P: 离子 S 的膜渗透性,以 m·s−1 为单位;V: 跨膜电位,单位为 Volts;F: 法拉第常数,等于 96,485 C·mol−1 或 J·V-1·摩尔-1;R: 气体常数,等于 8.314 J·K−1·摩尔−1;T:绝对温度,以开尔文为单位 (= °C + 273.15)。
内溶酶体中可能存在与泄漏电导和特异性离子通道相关的无源电流成分。漏电流的特征是线性电流 (I)-电压 (V) 关系,交点位于原点。从未转染的 HEK293 细胞中分离的内溶酶体的泄漏电流在 100 mV 时小于 50 pA;潜在的离子通道可能是钾/钠电导通道和氯离子通道。
在电压激活离子通道的情况下,可以通过在刺激电压门控溶酶体电流之前或之后记录一系列缩放的电压脉冲来减去测量电流中的泄漏电流分量。也可以离线减去泄漏。这些缩放脉冲的幅度通常是实验脉冲幅度的四分之一或五分之一,这一过程称为 P/4 或 P/5 泄漏减法11。由于漏电流的大小非常小,因此通常不使用 P/4 或 P/5 减法。
电压钳
在输入电压中反复应用逐步跳变可以记录电压变化时通过内溶酶体膜的电流。这有助于确定通道是否为电压门控离子通道12。除了电压钳,电流钳也是可行的。可以使用电压钳位模式12 中的可用配置来记录单通道活动。内溶酶体离子通道的通常密度较低,可能会阻碍获得包含单个通道的贴片的过程。厚壁移液器玻璃是生产具有小移液器吸头和低电容电极的最佳材料。用 Sylgard 或蜡涂覆玻璃可以降低移液器电容。
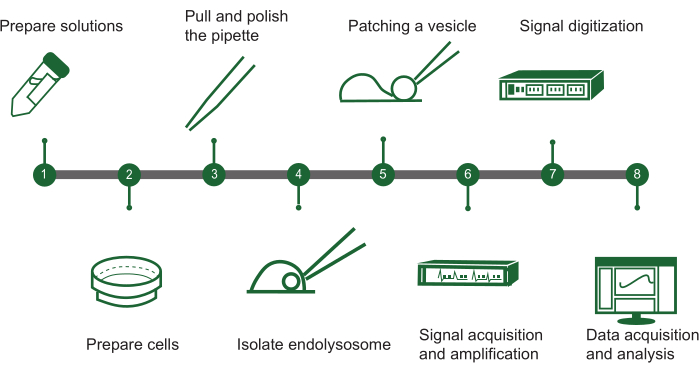
图 1:内溶酶体膜片钳步骤概述。 使用手动溶酶体膜片钳系统评估细胞内囊泡中离子通道活性的方案可以用流程图概述,其中包含以下关键步骤:(1) 溶液制备:组装所有必需的化学溶液。(2) 细胞制备:培养细胞并为内溶酶体提取做好准备。(3) 移液器制造:创建并抛光膜片钳移液器,以确保精确处理。(4) 内溶酶体分离:手动将内溶酶体与培养的细胞分离。(5) 囊泡修补:将移液管连接到单个内溶酶体囊泡上。(6) 信号采集:捕获和放大来自囊泡的电信号。(7) 信号数字化:将模拟信号转换为数字形式进行分析。(8) 数据收集与分析:收集数据并对其进行解释,以研究离子通道功能。 请单击此处查看此图的较大版本。

图 2:电生理硬件的设置。 在双电极测量过程中,测量电极接触目标膜,而参比电极置于浴液中。两者之间的电位差被放大器放大,由数字化仪数字化,然后由计算机捕获。 请单击此处查看此图的较大版本。

图 3:用于内溶酶体膜片钳分析的药理学工具。 示意图显示了膜片钳不同药物的活性范围。渥曼青霉素和拉特鲁克菌素 B 的组合对早期内体具有高度特异性,不包括回收内体。YM201636 选择性地扩增晚期内体/溶酶体。液泡蛋白增大早期内体,回收内体,以及晚期内体/溶酶体13。 请单击此处查看此图的较大版本。

图 4:扩增的细胞器的分离。 从细胞中手动分离目标囊泡过程的示意图。步骤如下:(1) 盖玻片制备:将含有目标囊泡的靶细胞置于盖玻片上。(2) 切开质膜:使用分离移液管切开靶细胞的质膜。(3) 分离移液管:分离移液管的位置以瞄准囊泡。(4) 将目标囊泡挤压到细胞外:使用分离移液管小心地将目标囊泡挤压到细胞外。 请单击此处查看此图的较大版本。

图 5:斑片移液管和囊泡之间用于 gigaseal 形成的推荐相对位置。 施加正压后,用贴剂移液管从上方接近细胞器。将尖端放置在距细胞器顶部约三分之一的位置,然后缓慢(模式 3-6)降低补片移液管,直到正压导致细胞器膜移动。在显微镜下,细胞器必须滚动或从尖端推开。此时,释放正压并等待 gigaseal 形成。 请单击此处查看此图的较大版本。

图 6:配置类型。 根据移液器和细胞器之间的接触方法,有四种不同的测量模式:细胞器或囊泡附着、整个囊泡、由内而外和由外而外。 请单击此处查看此图的较大版本。
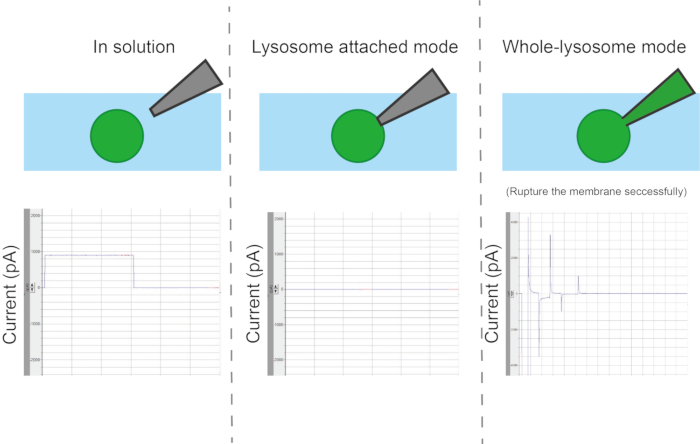
图 7:用于计算移液器电阻、密封电阻、串联电阻和电池电容的电流。 将记录移液器放置在 浴液中,矩形电压脉冲(持续时间 5 ms,5 mV)产生几乎矩形的电流响应。移液器的电阻可以通过将施加的电压除以测得的电流来确定。由于 gigaseal 是在 溶酶体连接模式下形成的,因此电流响应迅速减弱。密封电阻可以通过将电压除以剩余的非常小的电流来计算。当施加 ZAP 脉冲时,膜迅速破裂,导致电容电流增加,标志着向 全内溶酶体构型的转变。对于球形内溶酶体,产生的电流服从时间的单个指数函数。串联电阻是通过将电容电流幅度除以指令电压来确定的,内溶酶体的电容是通过将电容电流的时间常数除以串联电阻12 来计算的。 请单击此处查看此图的较大版本。
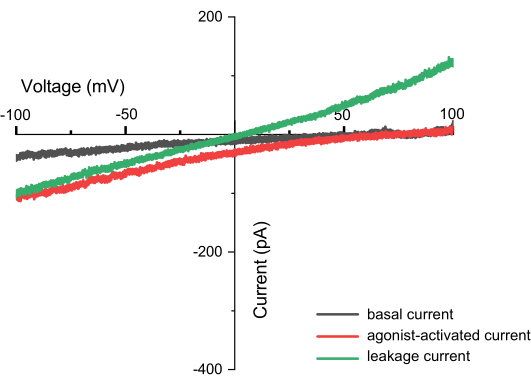
图 8:斜坡记录期间观察到的电流(例如 TPC2)。 这是一个电流-电压 (I-V) 关系图,X 轴表示 -100 至 +100 mV 的电压范围,Y 轴表示在不同电压下产生的电流。该图以 TPC2 通道的测量值为例。黑线表示施加 ZAP 脉冲后直接获得的结果,红线表示激动剂 TPC2-A1N 激活 TPC2 通道时产生的电流,绿线表示泄漏电流,这可能是由于密封不完整造成的。成功的测量不仅可以通过捕获通道的形状来识别,还可以通过没有泄漏电流来识别。如果存在泄漏电流,电流和 X 轴的交点将为 0,形成一条直线(膜内外离子不同)。 请单击此处查看此图的较大版本。
| 溶酶体内体贴剂移液器 | 全细胞贴剂移液器 | |||||||
| 周期 | 热 | 拉 | 维尔 | 时间 | 热 | 拉 | 维尔 | 时间 |
| 1 | 由 ramp 协议 +10 确定的值 | 空白 | 30 | 150 | 由 ramp 协议 +10 确定的值 | 空白 | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | 由 ramp 协议 +25 确定的值 | 18 | 150 | - | - | |||
| 6 | 由 ramp 协议 +20 确定的值 | 15 | 150 | - | - | |||
表 1:贴片移液器拉动方案。 首先,使用 ramp 函数找到合适的 HEAT 温度,然后按照表格调整六个拉动周期。
| 非特异性内溶酶体 (Vacuolin-1) / 特异性 LE/LY (YM201636) | 巨 噬 细胞 | 1 微米 / 0.4 微米 | 1-2 小时 / 1-3 小时 |
| COS-1、HEK293、Hela、成纤维细胞等 | 1 微米 / 0.4 微米 | 过夜 / 过夜 | |
| 心肌细胞、骨骼肌细胞 | 5 微米 | 24-48 小时 |
表 2:使用药物药物扩增不同细胞类型中溶酶体所需的浓度和治疗持续时间。 不同的细胞类型在药物治疗下的扩增效率表现出显着差异。通常,具有更活跃的内溶酶体系统的细胞需要更短的处理时间。然而,最佳处理时间和浓度仍需通过实验确定13。
讨论
电生理实验装置有四个主要的实验室要求:i) 环境:保持样品健康的方法;ii) 光学:可视化样品的方法;iii) 力学:稳定定位微电极的方法;iv) 电子学:放大和记录信号的方法。
为了成功进行溶酶体膜片钳实验,几个关键步骤至关重要。首先,细胞的状况 - 细胞必须紧紧粘附在盖玻片上,以便当使用分离移液器破坏细胞时,整个细胞不会移动。确保细胞健康且分布良好很重要。如果细胞不能固定到位,则在盖玻片上切换到适当的涂层可能会有所帮助。此外,还需要监测细胞密度。当细胞密度过高(大于 90%)时,药物诱导的细胞器增大的有效性会降低,使实验难以进行。其次,膜片移液管的质量——膜片移液管吸头必须具有合适的尺寸(5-8 MΩ),两侧玻璃应光滑平行。
第三,在巨印形成过程中,如果释放正压后没有立即形成,施加适量的负压会有所帮助。但是,一旦 gigaseal 形成,必须立即释放负压,以避免整个囊泡被吸入移液器的风险。此外,在进行全溶酶体膜片钳时,需要破裂一小部分膜。由于内溶酶体中缺乏细胞骨架,它们非常脆弱并且经常变得不稳定,导致部分被吸入移液器中。在这种情况下,施加轻微的正压以将吸出的部分会有所帮助。如果移液器吸头上剩余细胞器的电容小于 1 pF,则表明剩余的膜非常少,可能不包含感兴趣的通道。在这种情况下,建议尝试新的囊泡。最后,添加药物时,请避免直接撞击移液器吸头,因为快速的液体流动会破坏 gigaseal。此外,当伸手进入法拉第笼时,实验者应充分接地,以避免产生过多的噪声信号,这可能会阻碍对宝贵结果的观察。
当前具有整个内溶酶体结构的记录存在挑战,因为内溶酶体膜两侧的因子可能会丢失,这可能导致记录期间门控特性发生变化。首先,电流特性的时间依赖性变化可能是由于溶酶体管腔中移液器溶液稀释或丢失特定调节因子(小分子或其他因素)造成的。此外,移液管或胞质溶液的组分可以调节溶酶体内离子通道的特定第二信使途径。将溶酶体内附着模式与穿孔补片技术相结合,非常适合解决溶酶体内膜管腔侧出现的特定问题。
其次,在溶酶体内膜片钳记录中,由于膜的胞质侧暴露于记录溶液(胞质溶质溶液),因此与内溶酶体膜的胞质溶质侧相关的小分子或因子可以被冲走。ATP 已被证明可以阻断来自膜胞质侧的 TPC14。仔细设计浴液(例如,确保胞质记录溶液中不包含 ATP)可以最大限度地减少这一特定问题。在建立全溶酶体记录配置后,运行时间依赖性对照并在一致的时间启动特定方案也有助于管理这个问题。另一个问题可能是由于洗脱而导致与溶酶体内溶酶体离子通道相关的调节蛋白丢失。如果这些调节因子是信号级联反应的一部分,则内溶酶体通道的生理调节可能会丢失。
从技术上讲,尽管内溶酶体膜片钳是目前研究溶酶体离子通道最常用的电生理技术,但它通常需要扩大囊泡并手动分离选定的囊泡。这种限制是基于毛细管玻璃电极的电生理技术所固有的。缺乏维持细胞器稳定性的细胞骨架和细胞内细丝的干扰仍然是这些实验成功率低的主要原因。除了电生理学家积累的经验之外,先进光学系统和高精度荧光小分子工具的未来进步可能能够测量单个细胞内单个细胞器中的离子通道活性。
披露声明
作者没有竞争性的经济利益或其他利益冲突。
致谢
台湾国家科学技术委员会 (MOST 110-2320-B-002-022)、国立台湾大学 (NTU-112L7818) 和台湾国立卫生研究院 (NHRI-EX112-11119SC)。
材料
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
参考文献
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。