Method Article
تقنيات المشبك الرقعة لتحليل الحويصلة الداخلية الفردية
In This Article
Summary
يوضح هذا البروتوكول بالتفصيل طريقة لقياس نشاط القناة الأيونية مباشرة على الحويصلات داخل الخلايا باستخدام نظام مشبك التصحيح اليدوي داخل اليزوسوم. نوضح الطريقة التي تتضمن تكبير الجسيمات الداخلية وعزل هذه الحويصلات يدويا. يضمن هذا النهج أن الباحثين يمكنهم تكرار الإجراء وتطبيقه بدقة.
Abstract
تعتبر القنوات الأيونية الداخلية الجزومية ضرورية لتوازن الأيونات الداخلية ودرجة الحموضة ، وتنظيم إمكانات الغشاء ، وتهريب الحويصلات. ومع ذلك ، فإن الوصول إلى هذه القنوات من الناحية الفيزيولوجية الكهربية داخل حويصلات صغيرة داخل الخلايا كان يمثل تحديا. كان تطوير تقنيات المشبك البقعي الداخلي مفيدا في التغلب على هذا الحاجز ، مما سمح بالقياس المباشر لنشاط القناة الأيونية في الأغشية الداخلية الذكورية.
بالمقارنة مع تقنيات المشبك المستوي الحالية ، يمكن لمشبك التصحيح الداخلي تسجيل خلايا متعددة في وقت واحد والاندماج بسهولة مع طرق القياس الأخرى. يوفر التشغيل اليدوي ميزة تصور الحويصلات المستهدفة. كما أنه يعالج محدودية الوجود الذي لا غنى عنه ل Ca2+ على جانب واحد من الغشاء الداخلي ، مما يزيد من مرونة التصميم التجريبي. يتيح استخدام تقنيات مشبك الرقعة الداخلية القياس والتحليل المباشر لنشاط القناة الأيونية داخل الجسيمات الداخلية.
بالنظر إلى الارتباط الوثيق بين وظيفة القناة الأيونية الشاذة وأمراض مثل الأمراض التنكسية العصبية واضطرابات التمثيل الغذائي ، فإن التحقيق في هذه القنوات وتعديلها قد يكشف النقاب عن أهداف دوائية جديدة. من خلال استعادة توازن الأيونات داخل الخلايا ، قد نخفف من الأمراض ذات الصلة أو نعالجها. لذلك ، تعتبر هذه التقنية محورية لاكتشاف أهداف دوائية جديدة وتطوير الأدوية ذات الصلة.
Introduction
تلعب القنوات الأيونية دورا مهما في العديد من العمليات الفسيولوجية. في حين أن القنوات الأيونية السطحية قد حظيت باهتمام كبير ، إلا أن أهمية القنوات داخل الخلايا ، لا سيما تلك الموجودة داخل الجسيمات الداخلية ، يتم الاعتراف بها تدريجيا. يتكون النظام الداخلي من عضيات متعددة الوظائف مرتبطة بالغشاء متخصصة في الوظائف الخلوية الأساسية ، بما في ذلك إعادة تدوير الجسيمات الداخلية (RE) ، والجسيمات الداخلية المبكرة (EE) ، والجسيمات الداخلية المتأخرة (LE) ، والليزوسومات (LY) ، والعضيات الهجينة ذات الخصائص الداخلية وخصائص المقصورة الأخرى ، مثل البلعمة والبلعمة الذاتية.
EE ، والمعروفة أيضا باسم الفرز الداخلي (SE) ، هي واحدة من الوجهات الأولى للمواد الداخلية من غشاء البلازما (PM). EEs هي مقصورات مهمة مسؤولة عن فرز البضائع إلى مسارات داخلية مختلفة ، مثل مسار النضج إلى LE / LY للتحلل ، ومسار إعادة التدوير السريع إلى PM ، ومسار إعادة التدوير البطيء الذي يتضمن حجرة إعادة التدوير أو الطاقة المتجددة الطرفية. الأجسام متعددة الحويصلات (MVBs) المشتقة من الجسيمات الداخلية عبارة عن مقصورات كروية محاطة بغشاء محدد ، يمكن ملؤه بالحويصلات داخل اللمعة (ILVs)1. للحفاظ على الوظيفة الطبيعية لهذه العضيات ، فإنها تتطلب قنوات أيونية غشائية لتنظيم الأس الهيدروجيني الحويصلي ، والأسمولية ، ونقل الإشارة. ومع ذلك ، فإن قياس نشاط هذه القنوات ليس بالأمر السهل.
بالنسبة للقنوات الأيونية الموجودة على غشاء البلازما ، كانت تقنية مشبك التصحيح التي تم تطويرها في السبعينيات هي الطريقة القياسية الذهبية2. ومع ذلك ، ظل الوصول إلى القنوات الفيزيولوجيا الكهربية داخل حويصلات صغيرة داخل الخلايا يمثل تحديا. يواجه تطبيق المعيار الذهبي لقياس القنوات الأيونية على غشاء البلازما على تلك الموجودة على العضيات داخل الخلايا ثلاثة تحديات رئيسية. أولا ، عادة ما يكون حجم الجسيمات الداخلية صغيرا جدا (قطرها أقل من 1 ميكرومتر) ، مما يجعل من الصعب مراقبتها وعزلها تحت المجهر وأصغر من قطر فتحة الماصات الدقيقة الزجاجية النموذجية ، مما يجعل التجربة غير صالحة للعمل. ثانيا ، يتطلب عزل الجسيمات الداخلية مباشرة عن الخلايا المستهدفة مع الحفاظ على سلامة العضية مهارات خاصة. ثالثا ، نظرا لعدم وجود هيكل خلوي في العضيات داخل الخلايا ، فإن تشكيل ختم على الغشاء الداخلي داخل ماصة التصحيح ثم تمزقه لتحقيق تكوين جسيم داخلي كامل يمكن أن يكون أمرا صعبا ، لأنه يضر بالسلامة الهيكلية للعضية3.
تم تطوير عدة طرق للتغلب على هذه المشكلات ، بما في ذلك تسجيل الطبقة الدهنية الثنائية ، وتعديل تسلسل الاستهداف الليزوزومي ، وتقنيات الفيزيولوجيا الكهربية القائمة على الغشاء المدعومة بالصلب (SSM أو SSME). تتضمن طريقة تسجيل ثنائية الطبقة الدهنية إعادة بناء أغشية الفوسفوليبيد الاصطناعية باستخدام قنوات أيونية منقاة ، مما يتيح دراسة فيزيولوجية كهربية مفصلة لوظيفة بروتين الغشاء في ظل ظروف خاضعة للرقابة4،5. يتضمن تعديل تسلسلات الاستهداف الليزوزومي على القنوات الأيونية إعادة توجيه القنوات الأيونية الداخلية إلى غشاء البلازما للقياس باستخدام طرق المشبك الرقيعيةالتقليدية 6. تستخدم تقنيات الفيزيولوجيا الكهربية القائمة على الغشاء المدعومة بالصلب (SSM أو SSME) ، والمعروفة أيضا باسم طريقة المشبك المستوي الداخلي ، رقائق زجاجية مستوية صلبة ذات فتحات صغيرة (قطرها <1 ميكرومتر) في رقائق البورسليكات المستوية المجهرية. تسمح هذه الرقائق الزجاجية ذات الفتحة الصغيرة بتحليل الجسيمات الداخلية الصغيرة ، وحتى الأصلية ، باستخدام نظام التحكم في شفط الضغط (Nanion). ومع ذلك ، في الطريقتين الأوليين ، لا تكون القنوات الأيونية في بيئتها الفسيولوجية الطبيعية. أدت محاولات تسجيل القنوات الليزوزومية المعبر عنها على غشاء البلازما أو إعادة تشكيلها إلى طبقات ثنائية الدهون إلى نتائج غير مؤكدة ومتناقضة إلى حد كبير.
على الرغم من أن تقنيات المشبك التصحيحي المستوي قد عالجت بفعالية مشكلة التداخل الاصطناعي وتوفر ميزة القياسات عالية الإنتاجية ، إلا أن الحلول المستخدمة محدودة أيضا بهذه الطريقة. يمكن لتقنية المشبك الرقيع الداخلي المقدم في هذه المقالة تسجيل خلايا متعددة في وقت واحد والاندماج بسهولة مع طرق القياس الأخرى. يوفر التشغيل اليدوي ميزة تصور الحويصلات المستهدفة. كما أنه يتغلب على القيود التي لا مفر منها ل Ca2+ في المحلول على جانب واحد من الغشاء الداخلي ، مما يزيد من حرية التصميم التجريبي3. في الآونة الأخيرة ، لعبت تقنيات المشبك البقعة الداخلية الجزيزومية دورا رئيسيا في أبحاث تطوير الأدوية. على سبيل المثال ، في الأمراض التنكسية العصبية ، ساعدت هذه التقنية في تحديد الأدوية الجديدة التي تستهدف القنوات الأيونية الداخلية السوزومية المرتبطة بمرض الزهايمر ومرض باركنسون7،8. يمكن للباحثين أيضا استخدام هذه التقنية لاستكشاف دور القنوات الأيونية الداخلية في الخلايا السرطانية9 ، وبالتالي التحكم في نمو الورم وانتشاره. فيما يتعلق بأمراض التمثيل الغذائي ، تكشف دراسات المشبك الرقعة الداخلية الجزومية عن مركبات تنظم القنوات الأيونية الداخلية ، وتقدم طرقا علاجية جديدة لمرض السكري والسمنة. تساعد تقنية المشبك اللاصق الداخلي في فهم الخلل الوظيفي الداخلي وإيجاد العلاجات المحتملة6 ، مما يعزز بشكل كبير فهمنا لوظائف القناة الأيونية الداخلية السوزومية وتعزيز اكتشاف أهداف دوائية جديدة.
Protocol
1. إعداد الصك
- الاجهزه
ملاحظة: انظر الشكل 1 للحصول على إعداد جهاز الفيزيولوجيا الكهربية القياسي.- احم الإعداد من التداخل الخارجي باستخدام طاولة وقفص فاراداي.
- استخدم مجهرا مقلوبا مع معالج دقيق لوضع القطب الصغير بشكل ثابت.
- قم بإعداد مكبر للصوت لجمع وتضخيم الإشارات المكتسبة.
- استخدم محول الأرقام لتحويل الإشارات التناظرية إلى إشارات رقمية.
- استخدم برامج الحصول على البيانات وتحليلها لإعداد بروتوكولات تجريبية واستخلاص نتائج ذات مغزى وقابلة للتحليل من البيانات التي تم جمعها.
- اقطاب
- استخدم قطبين كهربائيين: قطب كهربائي للحمام وقطب كهربائي ماصة.
ملاحظة: يتمتع كلوريد البلاتين والفضة بأفضل خصائص الاستقطاب. تتكون أقطاب كلوريد الفضة من سلك فضي أو كريات تم تجميدها ، وبالتالي تحتوي على طبقة AgCl على السطح الخارجي للسلك أو الحبيبات (الشكل 2).
- استخدم قطبين كهربائيين: قطب كهربائي للحمام وقطب كهربائي ماصة.
- تحضير الماصة
- سحب
- قم بتثبيت الأنبوب الشعري في المجتذب.
ملاحظة: المعلمة المستخدمة لتصنيع الماصات أدناه خاصة بالجهاز. الأداة التي استخدمناها في هذه الورقة مذكورة في جدول المواد. - في ظل الظروف التجريبية (درجة حرارة الغرفة 22 درجة مئوية ، خيوط سخان من خلال الشكل ، زجاج البورسليكات مع خيوط) التي لا تحرق خيوط السخان ، قم بإجراء اختبار RAMP على الساحب لتحديد القيمة الحرارية (HEAT) المطلوبة لإذابة الشعيرات الدموية الزجاجية.
- صمم برنامج سحب جديد بست دورات سحب منفصلة باستخدام معلمات الحرارة والسرعة (VEL) والوقت (TIME) (الجدول 1).
ملاحظة: تشير الحرارة إلى المعلمة التي تسخن خيوط السخان ، مما يسمح للفتيل الزجاجي بالذوبان. تشير السرعة إلى السرعة التي يسحب بها المجتذب الفتيل في كلا الاتجاهين. يمثل الوقت مدة الفاصل الزمني بين كل دورة. - اضغط على زر السحب الأخضر على لوحة المفاتيح.
- قم بفك مقبض التثبيت وإزالة الماصات من المجتذب.
- افحص أطراف الماصة الموجودة أسفل عدسة الماصة الدقيقة لتحديد قطر الطرف والحدة والهندسة. تأكد من أن قطر الطرف 0.5-0.9 ميكرومتر.
ملاحظة: مع استخدام الفتيل بشكل متكرر ، ستتغير القيمة الحرارية المطلوبة لإذابة الشعيرات الدموية الزجاجية. - إذا كان حجم الطرف لا يلبي التوقعات، فاضبط معلمي HEAT وVEL. ستنتج درجات الحرارة المرتفعة والسرعات الأسرع نصائح أدق وأطول والعكس صحيح. اضبط الحرارة بزيادات قدرها 5 درجات والسرعة بزيادات قدرها 3.
- قم بتثبيت الأنبوب الشعري في المجتذب.
- تلميع
- ضع ماصات التصحيح المسحوبة في حامل التشكيل الدقيق.
- افحص أطراف الماصة باستخدام عدسة موضوعية 35x (مدمجة مع عدسة 15x، مما يؤدي إلى تكبير 525x ).
- استخدم المعالج الدقيق لتقريب ماصات التصحيح من الفتيل.
- اضبط قرص درجة الحرارة على 80.
- استخدم مفتاح القدم لتشغيل السخان وتطبيق نبضة حرارية قصيرة (1-2 ثانية) ، ومراقبة عملية التلميع من خلال عدسة microforge.
- كرر العملية حتى يتم صقل جميع الماصات.
- ضع الماصات المكتملة في صندوق محكم الغلق لمنع دخول الغبار.
ملاحظة: الهدف هو إذابة الطرف بسرعة بحيث يقوم الزجاج بإصلاح هندسة الطرف النهائي دون جعله حادا جدا. هذا يمنع الماصة من اختراق غشاء الحويصلة الذي يتم الضغط عليه ويعزز تكوين مانع التسرب بشكل فعال. بعد التلميع النهائي ، يجب أن يكون المسار الداخلي لطرف الماصة ضيقا جدا ومستقيما وخطيا.
عادة ما تتمتع أفضل ماصات التسجيل بمقاومة تتراوح من 5 إلى 8 MΩ بعد تلميع الحريق. يجب أن يكون قطر فتحة الطرف 2 ميكرومتر. تعد ماصة التصحيح المصقولة تماما ضرورية لتكوين الجيجاسيل بنجاح، حيث تعد هذه إحدى التقنيات الرئيسية الحاسمة لنجاح الإجراء.
- سحب
2. إعداد العينة
- ثقافة الخلايا (باستخدام HEK293 كمثال)
- زراعة الخلايا في حاضنة رطبة قياسية عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
- زراعة خلايا HEK293 في DMEM منخفض الجلوكوز المكمل بمصل الأبقار الجنينية المعطل بالحرارة بنسبة 10٪ ، و 100 وحدة / مل بنسلين ، و 100 مجم / مل من الستربتومايسين.
- ضع أغطية 12 مم مطلية بالبولي إل ليسين في طبق 24 بئر.
- تكبير العضية
- أضف 1 ميكرومتر من الفاكسولين -1 إلى خلايا HEK293 في الصفيحة المكونة من 24 بئرا (من الخطوة 2.1) واحتضانها عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 طوال الليل حتى تبدأ الحويصلات المتضخمة في التكون.
ملاحظة: يمكن أن يصل حجم الجسيمات الداخلية المتضخمة إلى 1-10 ميكرومتر ، اعتمادا على الأداة والمركب ووقت الحضانة ونوع الخلية (الشكل 3 والجدول 2).
- أضف 1 ميكرومتر من الفاكسولين -1 إلى خلايا HEK293 في الصفيحة المكونة من 24 بئرا (من الخطوة 2.1) واحتضانها عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 طوال الليل حتى تبدأ الحويصلات المتضخمة في التكون.
- تحضير الحل
ملاحظة: يهدف تحضير المحلول القياسي إلى محاكاة التركيزات الأيونية داخل الخلية والعضيات. على سبيل المثال ، الحلول القياسية لقياس القنوات الأيونية على الجسيمات الحالة هي كما يلي:- تحضير محلول الاستحمام (بالملليمتر): 140 K-methanesulfonate (MSA) ، 5 KOH ، 4 كلوريد الصوديوم ، 0.39 CaCl2 ، 1 EGTA ، 10 HEPES. اضبط الرقم الهيدروجيني إلى 7.2 باستخدام KOH. اضبط الأسمولية على 300 موسم/لتر مع الجلوكوز.
- تحضير محلول الماصة (بالملليمتر): 140 Na-MSA، 5 K-MSA، 2 Ca-MSA، 1 CaCl2، 10 HEPES، 10 MES. اضبط الرقم الهيدروجيني إلى 4.6 مع MSA. اضبط الأسمولية على 310 موسم / لتر مع الجلوكوز.
ملاحظة: مرر المحلول عبر مرشح 0.2 ميكرومتر ، وقم بإعداد 45 مل من الحصص في أنابيب مخروطية سعة 50 مل ، وقم بتخزينها في درجة حرارة 4 درجات مئوية لمدة تصل إلى 2-4 أسابيع.
3. عزل العضية
- قم بإزالة غطاء بالخلايا المعالجة (انظر القسم 2) من اللوحة المكونة من 24 بئرا ، وانقله إلى غرفة المجهر ، وأضف 1 مل من محلول الاستحمام.
ملاحظة: يجب عدم تخزين الخلايا في محلول الحمام لمدة >1 ساعة لتجارب مشبك التصحيح الداخلي الكامل التي تتضمن عزل الجسيم الداخلي والختم والتسجيل. بعد 1 ساعة ، سوف تتقلص الجسيمات الداخلية المتضخمة وتلتصق بالماصة ويصعب عزلها. - استخدم إبرة تعبئة بلاستيكية محلية الصنع لملء ماصة العزل بمحلول الماصة وتركيب الماصة في الطرف الأمامي لإعداد مشبك التصحيح.
- اضبط زاوية الحركة القطرية للمعالج الدقيق لتكون قريبة من 30 درجة (قيمة المصنع الافتراضية).
- تحت المجهر (40x موضوعي و 10x eye) ، افحص الخلايا بحثا عن الجسيمات الداخلية المتضخمة أو الجسيمات الحالة الموجودة بالقرب من حافة غشاء الخلية للعزل. حرك ماصة العزل بالقرب من الخلية المحددة.
- اخفض ماصة العزل باستخدام أداة المعالجة الدقيقة حتى تلامس حافة غشاء البلازما (الشكل 4). حرك ماصة العزل أفقيا بسرعة لتمزيق قطعة صغيرة من غشاء البلازما.
- باستخدام نفس الماصة ، اضغط على الخلية من الجانب الآخر للضغط على الجسيمات الداخلية / الحالة إلى مسافة ~ 2 ميكرومتر من الخلية.
ملاحظة: إذا كان هناك غشاء خلوي متبقي على العضية ، فقد يمنع تكوين جيجاسيل. - افحص الجسيم الداخلي المعزول تحت المجهر.
4. تشكيل Gigaseal
- املأ ماصة رقعة مصقولة حديثا بمحلول الماصة المناسب وقم بتركيب الماصة في الطرف الأمامي لمكبر الصوت.
- قم بتطبيق 20 - 50 ملي بار من الضغط الإيجابي على الماصة (أو استخدم 0.03-0.05 مل من حقنة 1 مل للتحكم في الضغط) وحافظ على هذا الضغط (قفل الصمام).
ملاحظة: 1 ملي بار (ملي بار) = 0.001 بار = 0.1 كيلو باسكال (كيلو باسكال) = 1 هكتوباسكال (هيكتوباسكال) = 1,000 دين/سم 2. - إن تحريك طرف الماصة إلى محلول الحمام، في وسط مجال الرؤية، يؤكد أن الضغط مرتفع بما يكفي لرؤية السائل يتدفق إلى محلول الحمام.
- قم بتطبيق نبضات التيار المتكرر (+5 مللي فولت؛ 5 مللي ثانية) لتحديد مقاومة الماصة ومقاومة مانع التسرب ومقاومة السلسلة. راقب حجم طرف الماصة وتشكيل مانع التسرب وإنشاء التكوين الداخلي للذكور الكامل.
- حرك الماصة بسرعة بالقرب من الجزء العلوي من الحويصلة المستهدفة. أحضر الماصة بالقرب من الحويصلة حتى تتحرك الحويصلة أو تتدحرج بسبب تدفق السوائل من الماصة (الشكل 5).
- اضبط جهد الإزاحة للماصة على 0 مللي فولت. حرر الضغط الإيجابي على الفور. من الناحية المثالية ، سيتم سحب الحويصلة باتجاه الماصة وتوصيلها بالغشاء ، لتشكيل جيجا سييل (1-20 GΩ) في غضون 1 ثانية ، ابحث عن انخفاض إلى <10 باسكال من السعة الحالية الناتجة عن نبضة الجهد البالغة 5 مللي فولت ، مما يشير إلى تكوين جيجاسيل ناجح.
ملاحظة: الضغط الإيجابي المستقر ضروري لتشكيل gigaseal. في بعض الأحيان ، يمكن أن تمنع التسريبات في الأنبوب تكوين gigaseal. يوصى باستخدام مقياس ضغط لضمان عدم وجود تسرب. إذا تم الكشف عن تسرب ، فأعد توصيل الأنبوب أو ضع كمية صغيرة من الفازلين على اللحامات لتحسين الختم.
5. القياس الحالي
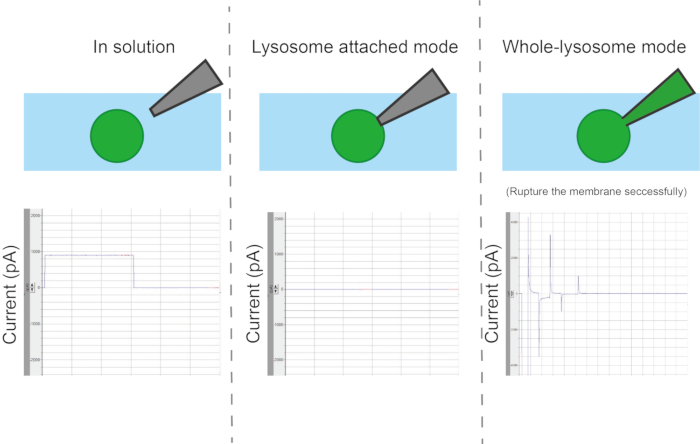
- كسر الغشاء
ملاحظة: اعتمادا على الاحتياجات التجريبية ، يمكن تصنيف التلامس من القطب إلى الغشاء إلى أربعة أوضاع: الوضع المتصل بالخلية ، ووضع الخلية بأكملها ، والوضع من الداخل إلى الخارج ، والوضع الخارجي للخارج (الشكل 6).- لتسجيل الحويصلة بأكملها، استخدم نبضة قصيرة عالية الجهد (نبضة ZAP) تبلغ 200 ميكرو ثانية أو 500 ميكرو ثانية لكسر الغشاء عند نقطة التلامس بين الماصة والعضية. اضبط الجهد من -500 مللي فولت إلى -1,200 مللي فولت ، مع تناقص بمقدار 100 مللي فولت في كل مرة حتى يتعطل الغشاء.
- بالنسبة لوضع الداخل إلى الخارج (تسجيل القناة الواحدة)، بعد تشكيل الجيجاسيل، اسحب الماصة بعيدا عن العضية، مما أدى إلى تمزيق قطعة صغيرة من الغشاء، مما يؤدي إلى تعريض الجانب الذي كان يواجه في الأصل تجويف الحويصلة.
- بالنسبة للوضع الخارجي للخارج ، بعد تشكيل الجيجاسيل والانتقال إلى وضع الحويصلة بالكامل ، اسحب الماصة بعيدا عن العضية ، وتمزيق قطعة صغيرة من الغشاء مع الحفاظ على بنية حويصلية صغيرة.
- التسجيل الحالي
- سجل التيار عبر الغشاء الداخلي الذكوري حيث يختلف جهد الدخل في تجارب مشبك التصحيح بالجهد الداخلي الزوذوي.
- التحكم في هذه الفولتية عن طريق خطوات الجهد أو منحدرات الجهد ؛ استخدم مجموعة واسعة من الفولتية المدخلة (على سبيل المثال ، -100 مللي فولت إلى +100 مللي فولت) في تجارب مشبك الجهد الداخلي اللوليزومي.
- سجل التيار عبر الغشاء الداخلي الذكوري حيث يختلف جهد الدخل في تجارب مشبك التصحيح بالجهد الداخلي الزوذوي.
النتائج
فيما يلي وصف للأشكال الحالية التي لوحظت أثناء تجارب المشبك الرقعة الداخلية السوزوذومي. إذا لم يكن الشكل الحالي كما هو متوقع ، فقد يكون ذلك بسبب ضعف الاتصال أو التسرب. قد يحدث ضعف التلامس إذا لم يكن القطب المرجعي ملامسا تماما لمحلول الحمام أو إذا كان قطب الماصة على وشك الانكسار. يمكن أن يحدث التسرب إذا كانت هناك فجوة بين الغرفة والغطاء تسمح للسائل بالتدفق إلى العدسة الموضوعية أو المسرح. يمكن أن يؤدي وجود محلول ماصة كبير جدا أو قليل جدا إلى مثل هذه التشوهات.
إدخال الإبرة في ملامسة المحلول / الإبرة مع سطح الخلية / ZAP
أثناء إنشاء الوضع المرتبط بالليزوزوم (تكوين الجيجاسيل) ، تنخفض الاستجابة الحالية بسرعة. يمكن تحديد مقاومة الختم بقسمة جهد الأمر على الكمية المنخفضة من التيار المتبقي (الشكل 7).
منحدر / تسرب
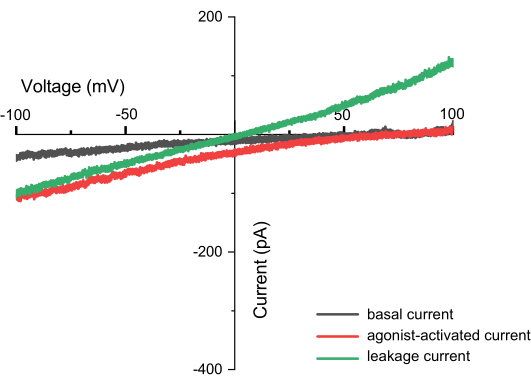
يمكن أن يؤدي التطبيق المتكرر لجهد إدخال مستمر يتراوح من -100 مللي فولت إلى +100 مللي فولت إلى تسجيل التيار عبر الغشاء الداخلي الذكوري بمرور الوقت (الشكل 8). باستخدام المحاليل القياسية ، تختلف تركيبة الأيونات داخل وخارج العضية. إذا أظهرت القناة انتقائية ، فلن تكون نقطة تقاطع منحنى الجهد الحالي عند الصفر بسبب النفاذية المختلفة للأيونات المتدفقة داخل وخارج. يشار إلى نقطة التقاطع هذه باسم الجهد العكسي للقناة ، ويمكن حسابها باستخدام الصيغةالتالية 10:
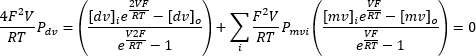
حيث dv: أيونات ثنائية التكافؤ. mv: أيونات أحادية التكافؤ. ط: داخلي. س: خارجي. P: نفاذية الغشاء للأيون S مقاسة ب m·s−1 ؛ V: إمكانات الغشاء بالفولت. F: ثابت فاراداي ، يساوي 96،485 C·mol−1 أو J· V−1·mol−1; R: ثابت الغاز ، يساوي 8.314 J · ك − 1 · مول − 1 ؛ T: درجة الحرارة المطلقة ، تقاس بالكلفن (= درجة مئوية + 273.15).
قد تكون هناك مكونات تيار سلبية مرتبطة بتوصيل التسرب وقنوات أيونية محددة في الجسيمات الداخلية. يتميز تيار التسرب بعلاقة تيار خطي (I) - الجهد (V) ، مع التقاطع عند الأصل. تيارات التسرب من الجسيمات الداخلية المعزولة من خلايا HEK293 غير المنقولة أقل من 50 باسكال عند 100 مللي فولت. من المحتمل أن تكون القنوات الأيونية الأساسية هي قنوات توصيل البوتاسيوم / الصوديوم وقنوات الكلوريد.
في حالات القنوات الأيونية التي يتم تنشيطها بالجهد ، يمكن طرح مكونات تيار التسرب في التيار المقاس عن طريق تسجيل سلسلة من نبضات الجهد المقاسة قبل أو بعد التيارات الداخلية المحفزة ذات الجهد الكهربائي. يمكن أيضا طرح التسرب في وضع عدم الاتصال. عادة ما يكون اتساع هذه النبضات المقاسة ربع أو خمس سعة النبضة التجريبية ، وهي عملية تعرف باسم طرح تسرب P / 4 أو P / 511. نظرا للحجم الصغير جدا لتيارات التسرب ، لا يتم استخدام طرح P / 4 أو P / 5 عادة.
مشبك الجهد
يمكن أن يؤدي التطبيق المتكرر للقفزات المتدرجة في جهد الدخل إلى تسجيل التيار عبر الغشاء الداخلي مع تغير الجهد. يساعد هذا في تحديد ما إذا كانت القناة عبارة عن قناة أيونية ذات بواباتجهد كهربائي 12. بالإضافة إلى مشبك الجهد ، فإن المشبك الحالي ممكن أيضا. يمكن تسجيل نشاط أحادي القناة باستخدام التكوينات المتاحة في وضع مشبك الجهد12. قد تعيق الكثافة المنخفضة عادة للقنوات الأيونية الداخلية الجزولية عملية الحصول على بقع تحتوي على قناة واحدة. زجاج الماصة ذو الجدران السميكة هو أفضل مادة لإنتاج أقطاب كهربائية ذات أطراف ماصة صغيرة وسعة منخفضة. يمكن أن يؤدي طلاء الزجاج ب Sylgard أو الشمع إلى تقليل سعة الماصة.
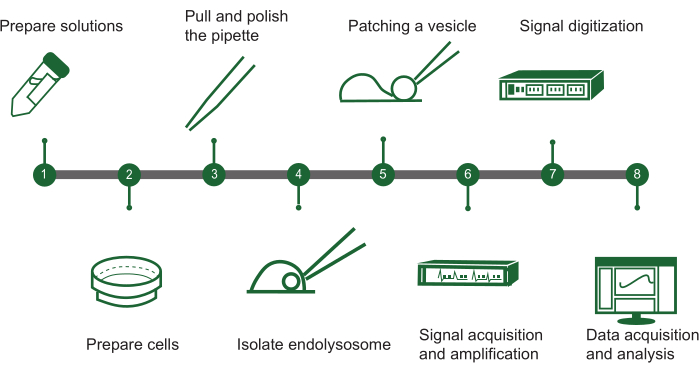
الشكل 1: نظرة عامة على خطوات المشبك الرقعة الداخلية الأذوني. يمكن تحديد بروتوكول تقييم نشاط القناة الأيونية في الحويصلات داخل الخلايا باستخدام نظام مشبك التصحيح اليدوي داخل الصبغة في مخطط انسيابي مع الخطوات الرئيسية التالية: (1) تحضير المحلول: تجميع جميع المحاليل الكيميائية المطلوبة. (2) تحضير الخلية: تنمو وجهز الخلايا للاستخراج الداخلي للزوزوزوم. (3) تصنيع الماصة: قم بإنشاء وتلميع الماصة ذات المشبك الرقعة لضمان التعامل الدقيق. (4) عزل الجسيمات الداخلية: افصل الجسيمات الداخلية يدويا عن الخلايا المستنبتة. (5) ترقيع الحويصلة: قم بتوصيل الماصة بحويصلة واحدة داخلية. (6) اكتساب الإشارة: التقاط وتضخيم الإشارات الكهربائية من الحويصلة. (7) رقمنة الإشارات: تحويل الإشارات التناظرية إلى شكل رقمي للتحليل. (8) جمع البيانات وتحليلها: جمع البيانات وتفسيرها للتحقيق في وظيفة القناة الأيونية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: إعداد الأجهزة الفيزيولوجية الكهربية. أثناء قياسات القطب المزدوج ، يتصل قطب القياس بالغشاء المستهدف ، بينما يتم وضع القطب المرجعي في محلول الحمام. يتم تضخيم فرق الجهد بين الاثنين بواسطة مكبر الصوت ، ويتم رقمنته بواسطة محول الأرقام ، ثم يتم التقاطها بواسطة الكمبيوتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الأدوات الدوائية المستخدمة لتحليل مشبك التصحيح الداخلي للذكورة. تخطيطي يوضح نطاقات نشاط العوامل الدوائية المختلفة لمشبك التصحيح. مزيج Wortmannin و Latrunculin B محدد للغاية للجسيمات الداخلية المبكرة ، باستثناء إعادة تدوير الجسيمات الداخلية. YM201636 يوسع بشكل انتقائي الجسيمات الداخلية / الجسيمات الحالة المتأخرة. يوسع الفاكيولين الجسيمات الداخلية المبكرة ، ويعيد تدوير الجسيمات الداخلية ، وكذلك الجسيمات الداخلية / الجسيمات الحالةالمتأخرة 13. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: عزل العضيات المتضخمة. رسم تخطيطي لعملية العزل اليدوي للحويصلة المستهدفة من الخلية. الخطوات هي كما يلي: (1) إعداد الغطاء: يتم وضع الخلية المستهدفة التي تحتوي على الحويصلة المستهدفة على غطاء. (2) قطع غشاء البلازما: يتم قطع غشاء البلازما للخلية المستهدفة باستخدام ماصة عزل. (3) ماصة العزل: يتم وضع ماصة العزل لاستهداف الحويصلة. (4) اضغط على الحويصلة المستهدفة خارج الخلية: يتم ضغط الحويصلة المستهدفة بعناية خارج الخلية باستخدام ماصة العزل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: الموضع النسبي الموصى به بين ماصة الرقعة والحويصلة لتكوين الجيجاسيل. بعد الضغط الإيجابي ، اقترب من العضية من الأعلى باستخدام ماصة التصحيح. ضع الطرف حوالي ثلث الطريق من أعلى العضية، وقم بخفض ماصة التصحيح ببطء (الوضع 3-6) حتى يتسبب الضغط الإيجابي في تحرك غشاء العضية. تحت المجهر ، يجب أن تتدحرج العضية أو تدفع بعيدا عن الحافة. في تلك اللحظة ، حرر الضغط الإيجابي وانتظر حتى يتشكل الجيجاسيل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: أنواع التكوينات. اعتمادا على طريقة التلامس بين الماصة والعضية، هناك أربعة أوضاع قياس مختلفة: العضية أو الحويصلة المرفقة، الحويصلة الكاملة، من الداخل إلى الخارج، ومن الخارج إلى الخارج. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 7: تيارات لحساب مقاومة الماصة ومقاومة مانع التسرب ومقاومة السلسلة وسعة الخلية. يتم وضع ماصة التسجيل في محلول الحمام، وتنتج نبضة الجهد المستطيلة (مدة 5 مللي ثانية، 5 مللي فولت) استجابة تيار مستطيلة تقريبا. يمكن تحديد مقاومة الماصة بقسمة الجهد المطبق على التيار المقاس. عندما يتشكل الجيجاسيل أثناء الوضع المتصل بالليزوسوم ، تتضاءل الاستجابة الحالية بسرعة. يمكن حساب مقاومة الختم بقسمة الجهد على التيار المتبقي الصغير جدا. عندما يتم تطبيق نبضة ZAP ، يتمزق الغشاء بسرعة ، مما يؤدي إلى زيادة التيارات السعوية ، مما يشير إلى الانتقال إلى التكوين الداخلي الكامل. بالنسبة للجسيم الداخلي الكروي ، يتبع التيار الناتج دالة أسية واحدة للوقت. يتم تحديد مقاومة السلسلة بقسمة سعة التيار السعوي على جهد القيادة ، ويتم حساب سعة الجسيم الداخلي بقسمة الثابت الزمني للتيارات السعوية على مقاومة السلسلة12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 8: التيارات التي لوحظت أثناء تسجيل المنحدر (على سبيل المثال ، TPC2). هذا مخطط علاقة تيار الجهد (IV) ، حيث يمثل المحور X الجهد الذي يتراوح من -100 إلى +100 مللي فولت ، ويشير المحور Y إلى التيار المتولد بجهد مختلف. يستخدم الرسم البياني قياسات من قناة TPC2 كمثال. يظهر الخط الأسود النتائج التي تم الحصول عليها مباشرة بعد تطبيق نبضة ZAP ، ويمثل الخط الأحمر التيار المتولد عند تنشيط قناة TPC2 بواسطة ناهض TPC2-A1N ، ويشير الخط الأخضر إلى تيار التسرب ، والذي قد ينتج عن ختم غير مكتمل. يمكن تحديد القياس الناجح ليس فقط عن طريق التقاط شكل القناة ولكن أيضا من خلال عدم وجود تيارات تسرب. في حالة وجود تيارات تسرب ، سيكون تقاطع التيار والمحور X عند 0 ، مكونا خطا مستقيما (مع أيونات مختلفة داخل وخارج الغشاء). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| ماصة التصحيح الداخلية | ماصة رقعة كاملة الخلية | |||||||
| دور | حرارة | سحب | الوقت | حرارة | سحب | الوقت | ||
| 1 | القيمة المحددة بواسطة بروتوكول المنحدر +10 | خلبي | 30 | 150 | القيمة المحددة بواسطة بروتوكول المنحدر +10 | خلبي | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | القيمة التي يحددها بروتوكول المنحدر +25 | 18 | 150 | - | - | |||
| 6 | القيمة التي يحددها بروتوكول المنحدر +20 | 15 | 150 | - | - | |||
الجدول 1: بروتوكول سحب الماصة التصحيحية. أولا ، استخدم وظيفة المنحدر للعثور على درجة حرارة الحرارة المناسبة ، ثم اتبع الجدول لضبط دورات السحب الست.
| الجسيمات الداخلية غير المحددة (Vacuolin-1) / LE/LY محددة (YM201636) | البلاعم | 1 ميكرومتر / 0.4 ميكرومتر | 1-2 ساعة / 1-3 ساعات |
| COS-1 ، HEK293 ، Hela ، الخلايا الليفية ، إلخ | 1 ميكرومتر / 0.4 ميكرومتر | بين عشية وضحاها / بين عشية وضحاها | |
| خلايا عضلة القلب ، خلايا العضلات الهيكلية | 5 ميكرومتر | 24-48 ساعة |
الجدول 2: التركيز ومدة العلاج المطلوبة لتكبير الجسيمات الداخلية في أنواع مختلفة من الخلايا باستخدام العوامل الدوائية. تظهر أنواع الخلايا المختلفة اختلافات كبيرة في كفاءتها في تضخمها تحت العلاج الدوائي. بشكل عام ، تتطلب الخلايا ذات الجهاز الداخلي الأذوني الأكثر نشاطا أوقات علاج أقصر. ومع ذلك ، لا يزال يتعين تحديد وقت العلاج والتركيز الأمثل تجريبيا13.
Discussion
تحتوي الإعدادات التجريبية الفيزيولوجية الكهربية على أربعة متطلبات معملية رئيسية: أ) البيئة: طرق الحفاظ على صحة العينة. ب) البصريات: طرق تصور العينة ؛ ج) الميكانيكا: طرق لوضع القطب الصغير بشكل مستقر ؛ و iv) الإلكترونيات: طرق تضخيم وتسجيل الإشارة.
لإجراء تجارب المشبك الرقعة البطانية بنجاح ، هناك عدة خطوات رئيسية حاسمة. أولا ، يجب أن تلتصق الخلايا بإحكام بغطاء الغطاء بحيث لا تتحرك الخلية بأكملها عند استخدام ماصة العزل لكسر الخلايا. من المهم التأكد من صحة الخلايا وانتشارها بشكل جيد. إذا لم تتمكن الخلايا من البقاء ثابتة في مكانها ، فقد يساعد التبديل إلى طلاء مناسب على الغطاء. بالإضافة إلى ذلك ، يجب مراقبة كثافة الخلايا. عندما تكون كثافة الخلايا عالية جدا (أكبر من 90٪) ، تتضاءل فعالية تضخم العضية الناجم عن الأدوية ، مما يجعل إجراء التجارب صعبة. ثانيا، يجب أن تكون جودة ماصة التصحيح - يجب أن يكون طرف ماصة التصحيح بحجم مناسب (5-8 MΩ)، ويجب أن يكون الزجاج على كلا الجانبين أملسا ومتوازيا.
ثالثا ، أثناء تكوين جيجاسيل ، إذا لم يتشكل مباشرة بعد إطلاق الضغط الإيجابي ، فإن تطبيق كمية معتدلة من الضغط السلبي يمكن أن يساعد. ومع ذلك ، بمجرد تشكل الجيجاسيل ، يجب تحرير الضغط السلبي على الفور لتجنب خطر امتصاص الحويصلة بأكملها في الماصة. بالإضافة إلى ذلك ، عند إجراء مشبك رقعة كامل ، يجب تمزق جزء صغير من الغشاء. نظرا لعدم وجود هيكل خلوي في الجسيمات الداخلية ، فهي هشة للغاية وغالبا ما تصبح غير مستقرة ، مما يتسبب في امتصاص أجزاء في الماصة. في هذه الحالة ، يمكن أن يساعد تطبيق ضغط إيجابي طفيف لدفع الجزء الممتص للخارج. إذا كانت سعة العضية المتبقية عند طرف الماصة أقل من 1 pF ، فهذا يشير إلى وجود القليل جدا من الغشاء المتبقي ، ومن المحتمل ألا يحتوي على قنوات الاهتمام. في مثل هذه الحالات ، يوصى بتجربة حوصلة جديدة. أخيرا ، عند إضافة الأدوية ، تجنب الاصطدام المباشر بطرف الماصة ، لأن تدفق السوائل السريع يمكن أن يعطل الجيجاسيل. بالإضافة إلى ذلك ، عند الوصول إلى قفص فاراداي ، يجب أن يكون المجرب مؤرضا بشكل كاف لتجنب توليد إشارات ضوضاء مفرطة ، مما قد يعيق ملاحظة النتائج القيمة.
تمثل التسجيلات الحالية مع البنية الداخلية الجزئية بأكملها تحديات لأن العوامل على جانبي الغشاء الداخلي السوزومي قد تفقد ، مما قد يؤدي إلى تغييرات في خصائص البوابات أثناء التسجيلات. أولا، قد تنجم التغيرات المعتمدة على الوقت في الخصائص الحالية عن تخفيف أو فقدان منظمات معينة (جزيئات صغيرة أو عوامل أخرى) بواسطة محلول الماصة في التجويف الليزوزومي. بالإضافة إلى ذلك ، يمكن لمكونات الماصة أو المحلول العصاري الخلوي تعديل مسارات الرسول الثاني المحددة التي تنظم القنوات الأيونية الداخلية الجزئية. سيكون الجمع بين الوضع المتصل بالبطاني الجزئي مع تقنيات التصحيح المثقوب مثاليا لمعالجة مشكلات محددة تنشأ عن الجانب اللمعي للغشاء الداخلي الذكوري.
ثانيا ، في تسجيلات المشبك الرقعة الداخلية ، نظرا لأن الجانب العصاري الخلوي من الغشاء يتعرض لمحلول التسجيل (محلول العصارة الخلوية) ، يمكن غسل الجزيئات الصغيرة أو العوامل المرتبطة بالجانب العصاري الخلوي للغشاء البطاني. لقد ثبت أن ATP يمنع TPC من الجانب العصاري الخلوي للغشاء14. يمكن أن يؤدي تصميم محلول الحمام بعناية (على سبيل المثال ، ضمان عدم تضمين ATP في محلول تسجيل العصارة الخلوية) إلى تقليل هذه المشكلة بالذات. يمكن أن يساعد تشغيل عناصر التحكم المعتمدة على الوقت وبدء بروتوكولات محددة في وقت ثابت بعد إنشاء تكوينات تسجيل داخلي كامل في إدارة هذه المشكلة. قد تكون هناك مشكلة أخرى تتمثل في فقدان البروتينات التنظيمية المرتبطة بالقنوات الأيونية الداخلية بسبب الغسيل. إذا كانت هذه العوامل التنظيمية جزءا من سلسلة إشارات ، فقد يفقد التنظيم الفسيولوجي للقنوات الداخلية الذكورية.
من الناحية الفنية ، على الرغم من أن مشبك التصحيح الداخلي هو حاليا أكثر التقنيات الفيزيولوجية الكهربية استخداما لدراسة القنوات الأيونية الداخلية ، إلا أنه يتطلب عادة تكبير الحويصلات وعزل الحويصلات المختارة يدويا. هذا القيد متأصل في تقنيات الفيزيولوجيا الكهربية القائمة على أقطاب زجاجية شعرية. يظل عدم وجود هيكل خلوي للحفاظ على استقرار العضية والتداخل من الخيوط داخل الخلايا من الأسباب الرئيسية لانخفاض معدل نجاح هذه التجارب. بالإضافة إلى تراكم الخبرة من قبل علماء الفيزيولوجيا الكهربية ، قد تمكن التطورات المستقبلية في الأنظمة البصرية المتقدمة وأدوات الجزيئات الصغيرة الفلورية عالية الدقة من قياس نشاط القناة الأيونية في العضيات الفردية داخل الخلايا المفردة.
Disclosures
وليس لدى أصحاب البلاغ مصالح مالية متنافسة أو أي تضارب في المصالح أخرى.
Acknowledgements
المجلس الوطني للعلوم والتكنولوجيا ، تايوان (MOST 110-2320-B-002-022) ، وجامعة تايوان الوطنية (NTU-112L7818) ، والمعاهد الوطنية للبحوث الصحية ، تايوان (NHRI-EX112-11119SC).
Materials
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
References
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved