Method Article
Визуализация и монтаж легких листов для ранних эмбрионов данио-рерио
* Эти авторы внесли равный вклад
В этой статье
Резюме
Описана стратегия пробоподготовки для визуализации ранних эмбрионов данио-рерио в интактном хорионе с помощью светового микроскопа. В нем анализируются различные ориентации, которые эмбрионы приобретают в хорионе на 70% стадиях эпиболии и почки, а также подробно описываются стратегии визуализации для получения клеточного разрешения по всему эмбриону с использованием системы световых листов.
Аннотация
Световая листовая микроскопия стала предпочтительной методологией для получения изображений эмбрионов рыбок данио в реальном времени в длительных временных масштабах с минимальной фототоксичностью. В частности, многовидовая система, которая позволяет вращать образец, позволяет визуализировать целые эмбрионы под разными углами. Тем не менее, в большинстве сеансов визуализации с помощью системы multiview установка образцов является хлопотным процессом, поскольку образцы обычно подготавливаются в полимерной пробирке. Чтобы помочь в этом процессе, данный протокол описывает основные стратегии крепления для визуализации раннего развития данио-рерио между 70% эпиболией и ранними стадиями сомита. В частности, в исследовании приводятся статистические данные о различных положениях, в которых эмбрионы по умолчанию находятся на 70% стадиях эпиболии и зачатков в хорионе. Кроме того, в ней обсуждается оптимальное количество углов и интервал между углами, необходимый для визуализации целых эмбрионов данио-рерио на ранних стадиях развития, чтобы можно было извлечь информацию клеточного масштаба путем объединения различных видов. Наконец, поскольку эмбрион покрывает все поле зрения камеры, что требуется для получения разрешения клеточного масштаба, этот протокол детализирует процесс использования информации о бусинах сверху или снизу эмбриона для регистрации различных видов.
Введение
Обеспечение минимальной фототоксичности является основным требованием для визуализации живых эмбрионов с высоким пространственно-временным разрешением в течение длительных периодов времени. За последнее десятилетие световая листовая микроскопия стала методологией выбора для удовлетворения этого требования 1,2,3,4,5,6,7. Вкратце, в этой методике, которая впервые была использована в 2004 году для захвата процессов развития8, два выровненных тонких листа лазера проходят через эмбрион с противоположных концов, освещая только интересующую плоскость. Объектив обнаружения размещается ортогонально, а затем одновременно собирается излучаемый флуоресцентный свет из всех освещенных точек образца. Затем получается 3D-изображение путем последовательного перемещения эмбриона через статичный световой слой.
Кроме того, в специфической форме этой методологии, называемой многоракурсной световой листовой микроскопией, образцы могут быть подвешены в полимерной трубке, которую можно вращать с помощью ротора, что позволяет визуализировать один и тот же эмбрион под разными углами 9,10,11. После визуализации изображения под разными углами объединяются на основе регистрационных маркеров, которые обычно представляют собой глобулярные флуоресцентные маркеры внутри эмбриона (например, ядра) или в пробирке (например, флуоресцентные шарики). Многоракурсная визуализация и слияние значительно улучшают осевое разрешение, обеспечивая изотропное разрешение во всех трех измерениях12. Несмотря на то, что это является большим преимуществом, основной проблемой многоракурсной методологии является монтирование образцов, при котором эмбрионы должны быть установлены и удерживаться на месте в пробирках в течение всего времени визуализации.
Для выполнения многоракурсной визуализации, чтобы удержать эмбрионы на месте и предотвратить движение во время визуализации, эмбрионы могут быть встроены в агарозу. Тем не менее, это часто приводит к вредному росту и развитию, особенно для эмбрионов данио-рериона ранних стадиях, модельная система, которая обсуждается здесь. Вторая стратегия монтажа заключается в использовании тонкой трубки, которая лишь немного больше диаметра эмбриона, где эмбрион может быть втянут в трубку вместе со средой для эмбриона, после чего дно пробирки закрывается агарозной пробкой14. В этом способе, поскольку пробирка заполнена эмбриональной средой, маркеры регистрации, такие как флуоресцентные шарики, не могут быть использованы для слияния различных видов, и поэтому регистрация зависит от маркеров внутри эмбриона. В целом, шарики действуют как лучшие маркеры регистрации, так как сигнал маркеров внутри эмбриона ухудшается при продвижении вглубь образца из-за ограничений как освещенности, так и обнаружения любого микроскопа.
Таким образом, третий подход, который будет подробно описан здесь и использован ранее 5,13,14,15,16, заключается в визуализации ранних эмбрионов данио-рерио с интактным хорионом и заполнении пробирки минимальным процентом агарозы, которая содержит гранулы в качестве регистрационных маркеров. В этом сценарии, поскольку ручное вмешательство для позиционирования эмбрионов внутри хориона невозможно, данное исследование предоставляет статистику по стандартной ориентации, в которую попадают эмбрионы ранних рыбок данио, уделяя особое внимание 70% эпиболии и стадии почки. Затем в нем обсуждается оптимальное количество просмотров, необходимое для визуализации эмбрионов на ранних стадиях в клеточном масштабе, и подробно описывается процесс слияния с помощью BigStitcher, плагина 10,17,18 на базе Фиджи. В совокупности этот протокол, в котором используется объектив 20x/1 NA, призван облегчить эмбриологам данио-рерио использование многовидовых световых листовых систем для визуализации эмбрионов с ядрами и мембранными маркерами от гаструляции до ранних стадий сомита.
протокол
Процедуры содержания и экспериментирования с рыбками данио-рерио, использованные в этом исследовании, были одобрены институциональным комитетом по этике животных, см. Reference TIFR/IAEC/2023-1 и TIFR/IAEC/2023-5. Эмбрионам, полученным путем скрещивания гетерозиготных рыб, экспрессирующих Tg(actb2:GFP-Hsa.UTRN)19, вводили мРНК H2A-mCherry (30 pg) на одноклеточной стадии. МРНК H2A-mCherry синтезировали с использованием плазмиды pCS2+ H2A-mCherry (подарок от лаборатории Оутса, EPFL) методом транскрипции in vitro . Эмбрионы, экспрессирующие оба маркера, обозначенные как Utr-GFP и H2A-mCherry, соответственно, в остальной части протокола, были визуализированы на 70% стадиях эпиболии и почки. Подробная информация о реактивах и оборудовании, использованных в исследовании, приведена в Таблице материалов.
1. Подготовка образцов для многоракурсной визуализации
- Подготовка трубок из ФЭП/ПТФЭ
- Очистите трубки из ФЭП/ПТФЭ в соответствии с ранее описанными процедурами14.
- После очистки нарежьте пробирки на длину 2-2,5 см в соответствии с требованиями и храните их в микроцентрифужных пробирках объемом 2 мл, содержащих воду двойной дистилляции. Пробирки могут храниться таким образом около месяца.
- Перед подготовкой образцов нагрейте пробирки при температуре 70-75 °C в течение примерно 25 минут, чтобы выпрямить пробирки. Избегайте переполнения в каждой микроцентрифужной пробирке, чтобы предотвратить образование комков, обеспечивая достаточное пространство для эффективного выпрямления пробирки.
ПРИМЕЧАНИЕ: Надевайте перчатки во время всей процедуры работы с пробиркой, так как любые отпечатки пальцев / частицы пыли, оставшиеся на пробирках, могут помешать визуализации.
- Приготовление агарозы
- Приготовьте буфер E3 50x стоковых растворов следующим образом:
- Запас 1 - 3,252 г Na2HPO4, 0,285 г KH2PO4, 11,933 г NaCl, 0,477 г KCl в 1 л деионизированной воды
- Запас 2 - 2,426 г CaCl2, 4,067 г MgSO4 в 1 л деионизированной воды.
- Чтобы сделать 1x буфер Е3, добавьте по 20 мл каждого из исходных растворов 1 и 2 в 960 мл деионизированной воды.
ПРИМЕЧАНИЕ: Не добавляйте метиленовый синий в буфер E3, используемый для визуализации, так как он вызывает рассеяние света. - Агарозу с низкой температурой плавления растворить в 1х Е3 путем нагревания до 70-75 °С на термоблоке с помешиванием до тех пор, пока раствор не станет прозрачным без комочков и кристаллов.
- Для многоракурсной визуализации добавьте имеющиеся в продаже флуоресцентные шарики (см. Таблицу материалов) в раствор агарозы, что позволяет регистрировать изображение во время анализа. Обработать бусины ультразвуком при комнатной температуре с частотой 40 кГц в течение 20-30 мин на водяной бане ультразвукового аппарата для дезагрегации бусин.
- После ультразвуковой обработки добавьте 1 мкл гранул к 10 мл раствора агарозы в пробирке объемом 15 мл и хорошо обработайте пробирку вихрем, чтобы обеспечить равномерное диспергирование шариков.
ПРИМЕЧАНИЕ: Объем раствора гранул, добавляемого в агарозу, зависит от исходного раствора и производителя. Попробуйте диапазон объемов и выберите концентрацию, в которой шарики выглядят хорошо диспергированными при изображении в системе световых листов. Слишком большое количество бусин может агрегироваться несмотря на ультразвук и вихрь, в то время как слишком малое количество бусин может повлиять на регистрацию изображения. - Перед приготовлением образца пробирку с добавлением шариков подержите в закрытой водяной бане при температуре 37 °C, не менее 30 минут. Это гарантирует, что температура агарозы снизится с 70 °C до 37 °C.
- Приготовьте буфер E3 50x стоковых растворов следующим образом:
- Подготовка образцов
- Расставьте рыбок попарно с разделителями вечером накануне дня визуализации. Снимите разделители примерно на 15 минут и соберите эмбрионы по стандартной процедуре20.
- Как только эмбрионы достигнут стадии подготовки образца, высыпьте все 10 мл агарозы (с гранулами), которая хранится при температуре 37 °C, на чашку Петри диаметром 6 см.
- Подождите около 2-3 минут, чтобы температура опустилась ниже 33 °C, прежде чем переносить 10-15 эмбрионов в раствор агарозы.
ПРИМЕЧАНИЕ: Это важный шаг для предотвращения любого возможного теплового шока для эмбрионов, перенесенных в агарозу. - Следите за тем, чтобы при переносе эмбрионов в раствор агарозы добавлялось как можно меньше буфера E3. Покрутите чашку Петри так, чтобы небольшой буфер, который должен был быть перенесен, хорошо рассеялся.
- Надевайте перчатки до конца процедуры подготовки образца.
- Возьмите микропипетку объемом 200 мкл с подходящим наконечником для пипетки и вставьте очищенную прямую трубку, извлеченную из микроцентрифужной трубки, в наконечник пипетки, как показано на рисунках 1A, B.
- Аспирируйте немного агарозы в пробирку, затем 2-3 эмбриона с помощью микропипетки (рис. 1C,D). Убедитесь, что эмбрионы находятся близко ко дну пробирки (рисунок 1E), что станет важным при настройке визуализации. Кроме того, убедитесь, что между различными эмбрионами есть немного агарозы (Рисунок 1E), чтобы бусины в этой области можно было использовать в качестве маркеров регистрации.
- Не сбрасывая давления с пипетки, отсоедините трубку от наконечника пипетки и поместите ее на крышку чашки Петри, заполненной E3, чтобы агароза затвердела (рис. 1F).
- Повторяйте шаги с 1.3.6 по 1.3.8 до тех пор, пока все эмбрионы в чашке Петри не будут перенесены в пробирки.
- Как только агароза затвердеет (что может занять 5-10 минут и может быть подтверждено проверкой агарозы в чашке Петри), переложите пробирки в микроцентрифужную пробирку объемом 2 мл, заполненную E3 (рис. 1G).
- Храните пробирки с эмбрионами в инкубаторе при температуре 28 °C или 33 °C, по мере необходимости, прежде чем приступать к многоракурсной визуализации.
2. Многоракурсная визуализация
ПРИМЕЧАНИЕ: На этом этапе представлена общая процедура многопроекционной визуализации эмбрионов рыбок данио на ранних стадиях их развития. Описанный ниже метод может быть легко адаптирован к любой многоракурсной системе световой листовой микроскопии.
- Определение местонахождения эмбриона
ПРИМЕЧАНИЕ: Заполните камеру образца микроскопа эмбриональной средой20 и установите температуру камеры образца на интересующую температуру не менее чем за 10 минут до получения изображения.- Соберите держатель образца так, как описано ранее21, однако, с одной модификацией. Поскольку визуализация будет выполняться через трубку, вставьте трубку с эмбрионами непосредственно в капилляр нужного диаметра таким образом, чтобы он удерживался на месте, не выталкивая агарозу наружу и не тревожа эмбрионы на дне (рисунок 1H).
ПРИМЕЧАНИЕ: Поскольку камера для образцов имеет определенную высоту, обеспечение того, чтобы эмбрионы располагались ближе к дну пробирки во время подготовки образца (как указано в шаге 1.3.7), позволит расположить эмбрион в поле зрения, не ударяясь о пол камеры. - Вставьте держатель образца в систему multiview и с помощью элементов управления x и y переместите эмбрион в центр поля зрения.
- Используйте регулятор z навигатора образцов, чтобы затем сфокусировать эмбрион.
- На этом этапе ориентация эмбриона внутри хориона будет четко видна, и если она неудовлетворительна, вставьте новую трубку и выберите эмбрион с интересующей ориентацией.
- Соберите держатель образца так, как описано ранее21, однако, с одной модификацией. Поскольку визуализация будет выполняться через трубку, вставьте трубку с эмбрионами непосредственно в капилляр нужного диаметра таким образом, чтобы он удерживался на месте, не выталкивая агарозу наружу и не тревожа эмбрионы на дне (рисунок 1H).
- Выравнивание световых листов
- Как только эмбрион будет в нужном положении, настройте все экспериментальные настройки - лазеры, световой тракт, фильтр, делитель луча и камеру.
- При настройке параметров сбора данных, если в программном обеспечении предусмотрена опция кругового сканирования, выберите ее. Шарнирное сканирование уменьшит эффект затенения, возникающий из светового листа при столкновении с любыми структурами или непрозрачными областями в образце.
- Начните сканирование образца в режиме реального времени. Установите размер бита, мощность лазера и желаемый зум, который определит толщину светового листа и, следовательно, осевое разрешение.
- Чтобы выровнять световые листы, сначала переключитесь на одностороннее освещение и последовательно измените настройки двух световых листов (левого и правого). Увеличьте масштаб в цифровом виде в той области образца, где видны четкие структуры, представляющие интерес.
Примечание: В этом исследовании для выравнивания листов использовался либо ядерный (H2A-mCherry), либо мембранный (Utr-GFP) маркер. Рекомендуется изменять настройки светового листа в программном обеспечении таким образом, чтобы в интересующей области был достигнут наиболее резкий контраст сигнала. - После того, как два световых листа будут индивидуально оптимизированы для достижения наилучшего сигнала, включите оба световых листа. Выполните второй раунд выравнивания и убедитесь, что мерцание минимально, что указывает на довольно хорошее выравнивание двух листов.
- После завершения совмещения активируйте опцию автоматического совмещения изображений, созданных двумя листами, если это разрешено программным обеспечением. В качестве альтернативы можно сначала грубо выровнять световые листы, сосредоточившись на бусинах вокруг образца, а затем точно настроить выравнивание, используя информацию из образца.
Примечание: При визуализации с помощью двух флуорофоров (таких как ядерные и мембранные маркеры) оптимальное выравнивание обычно незначительно различается для двух структур. В этом сценарии выберите параметр на основе ограничений на нисходящую обработку. Например, если границы клеток должны быть сегментированы, что является относительно более интенсивным процессом, выровняйте световые листы на основе мембранного маркера.
- Настройка многоракурсного изображения
- После выравнивания световых листов активируйте опции для выполнения z-стека, а также многоракурсного изображения.
- Начните сканирование в реальном времени и осуществляйте навигацию с помощью навигатора образцов для выбора первого вида. В этом представлении задайте интервал между срезами, за которым следуют первый и последний срезы z-стека. Добавьте эту позицию в диалоговое окно multiview, в котором учитывается информация о позиции и z-стеке для этого представления.
- Перейдите к следующему виду, изменив угол в навигаторе образцов. Настройте z-стек для второго представления и добавьте информацию в диалоговое окно multiview.
- Повторите то же самое для дополнительных просмотров.
ПРИМЕЧАНИЕ: Убедитесь, что в каждом представлении отображается определенное минимальное количество срезов, чтобы между различными видами было достаточное перекрытие, что в конечном итоге поможет зарегистрировать виды во время обработки. Минимальное количество срезов будет зависеть от коэффициента масштабирования, а также от количества ракурсов, выбранных для изображения. - После настройки всех видов сохраните эту информацию в текстовом файле (например, с именем 'embryo-positions'), который будет содержать информацию о z-стеке, координаты трубки (x, y, z), а также спецификации угла для каждого вида. После сохранения очистите все позиции в диалоговом окне multiview.
- Поскольку визуализация выполняется с неповрежденным хорионом, который относительно большой, рассмотреть бусины в пробирке с теми же настройками не представляется возможным. Таким образом, информация о шариках должна быть получена из другого положения в трубке. Для этого переведите в другую координату 'y' вдали от эмбриона, где видны бусины. Добавьте эту позицию в диалоговое окно multiview и сохраните эту позицию в текстовом файле (например, с именем 'beads-y').
ПРИМЕЧАНИЕ: Изобразите бусины как можно ближе к образцу эмбриона, чтобы свести к минимуму влияние возможных различий в кривизне пробирки в двух положениях. Поэтому, если в пробирку установлено несколько эмбрионов, важно оставить немного агарозы между пробирками для изображения бусин (как упоминалось в пункте 1.3.7). - Перейдите в папку, в которой сохранены текстовые файлы, и скопируйте файл «embryo-positions» в новый файл с именем «beads-positions». Замените y-координату для всех видов в файле 'beads-positions' на y-координату из файла 'beads-y'. Это гарантирует, что бусины будут отображаться с одинаковым количеством видов, z-стеков и x-координат, но в другой y-позиции в трубке.
- Вернитесь в программное обеспечение для обработки изображений и загрузите файл «bead-positions» в программу. Если опция временных рядов активирована, выберите один цикл и начните эксперимент. Сохраняйте изображения бусин как «бусины», которые будут использоваться для регистрации различных видов во время обработки изображений.
- После получения изображений бусин очистите позиции и загрузите исходный файл «положения эмбрионов» в программу. Установите желаемое количество циклов с подходящим временным интервалом и начните эксперимент.
3. Многоракурсный анализ изображений
ПРИМЕЧАНИЕ: Для объединения многоракурсных изображений используется плагин FIJI BigStitcher, который является последней версией плагина Multiview Reconstruction 10,17,18. Плагин можно установить, добавив плагин BigStitcher в функцию «Управление обновлениями сайтов», доступ к которой можно получить в опции «Обновить» в меню «Справка». После установки плагин появится в меню «Плагины». Общие шаги, связанные со слиянием, следующие: (1) Определение пар файлов .xml/.h5 как для бусин, так и для эмбрионов; (2) Зарегистрируйте все виды с помощью файла с бусинами; (3) Функция разброса точки извлечения (PSF) для бусин, которая может быть использована для деконволюции (рис. 2A); (4) Перенесите информацию о регистрации и PSF из файла бусин в файл эмбриона и начните многовидовую деконволюцию. Большинство из этих шагов были ранее описаны в подробностях21, а здесь описаны шаги, которые обрабатываются по-разному.
- Определение набора .xml данных
- Определите новый набор данных как для бусин, так и для эмбриона как 'beads.xml' и 'embryo.xml' соответственно, как описано ранее21.
- Обнаружение и регистрация с помощью баллов интереса
- После успешного экспорта файла beads.xml выберите виды, необходимые для регистрации, в диалоговом окне «Multiview Explorer» (рисунок 2B). Щелкните правой кнопкой мыши и выберите «Определить точки интереса». Выполните действия, как описано21.
- После обнаружения точек интереса выберите все представления, щелкните правой кнопкой мыши и выберите «Зарегистрироваться с использованием баллов интереса». Следуйте протоколу, описанномув статье 21.
- Внимательно проверьте, успешно ли сработала регистрация бусин. При успешной регистрации накладываются накладывающиеся друг на друга бусины из разных видов (Рисунок 2C). Чтобы проверить, насколько точно сработала регистрация, выберите два последовательных вида, перейдите к перекрывающейся области и переключитесь между двумя видами, чтобы увидеть, накладываются ли друг на друга бусины, изображенные под разными углами. Повторяйте это для каждого последующего просмотра.
- Если перекрытие неточное, повторите попытку регистрации, ослабив требуемую значимость для регистрации и/или допустимую ошибку перекрытия (называемую «ошибкой RANSAC» в диалоговом окне «Регистрация»).
- После успешной регистрации нажмите « Сохранить » в окне «Multiview Explorer», чтобы сохранить обновленный файл .xml.
ПРИМЕЧАНИЕ: Сохраните также файл журнала, так как он содержит более подробную информацию об эффективности регистрации. Чтобы перевести регистрационную информацию с бусин на эмбрион, выполните описанные ниже действия. - Откройте файл bead.xml в текстовом редакторе по выбору и скопируйте весь блок в разделе «ViewRegistrations».
- Откройте embryo.xml и замените блок "ViewRegistrations" на блок, скопированный из файла бисера. Если каналов несколько, замените регистрационную информацию для каждого канала, как указано выше. Регистрационная информация может быть передана как вручную, так и с помощью специально написанного кода MATLAB, который можно скачать здесь: https://github.com/sundar07/Multiview_analysis
- Откройте файл embryo.xml в "BigStitcher" и внимательно проверьте, успешно ли прошла регистрация для эмбриона. Повторите то же самое, что и для бусин, проверяя перекрытие интересующих структур в каждых двух последовательных видах.
ПРИМЕЧАНИЕ: Иногда регистрация эмбрионов может быть не столь желательна, несмотря на то, что бусины регистрируются идеально. Это возможно при незначительных изменениях кривизны трубки от места, где визуализируются бусины, до положения эмбриона. Кроме того, могут наблюдаться тонкие движения эмбриона между видами, поскольку он свободно плавает внутри хориона. В этом случае проводят второй раунд регистрации с помощью ядерного маркера в эмбрионе. - Для этого откройте файл embryo.xml в "BigStitcher", кликните правой кнопкой мыши по всем видам, на которых есть ядерный маркер, и выберите "Определить точки интереса".
- Переименуйте интересующие точки в «ядра» и продолжайте выполнять шаги, как для бусин.
- Устанавливая параметры «Разность гауссовых», убедитесь, что большинство, если не все, ядра обнаружены и что нет эктопического обнаружения ядра. Далее нажмите на «Готово».
- После этого зарегистрируйте эти представления, выбрав Регистрировать с помощью точек интереса , и выберите вариант На основе точного дескриптора (инвариантный перевод). Убедитесь, что выбран параметр «Сравнить все виды и точки интереса» и используйте «ядра» в качестве точек интереса. Используйте опцию для фиксации первого вида и не отображайте обратно.
- Для регистрации используйте аффинную модель с жесткой регуляризацией и параметрами по умолчанию в плагине.
- Перепроверьте успешность регистрации, сравнивая каждые два последовательных просмотра.
- После успешной регистрации нажмите « Сохранить » в окне «Multiview Explorer», чтобы сохранить обновленный файл .xml.
- Откройте файл embryo.xml в текстовом редакторе по выбору и скопируйте регистрационную информацию из ядерных маркеров в другие каналы.
- Извлечение и присвоение функции спреда по точкам
- Чтобы выполнить многоракурсную деконволюцию, извлеките PSF системы визуализации из зарегистрированного набора данных гранул и примените его к файлу эмбриона.
- Чтобы получить эту информацию, выберите все виды в файле бисера, а затем щелкните правой кнопкой мыши и выберите «Функции разброса точек » и «Параметры извлечения ».
- В появившемся диалоговом окне убедитесь, что установлены флажки Использовать точки соответствующего интереса и Удалить проекции минимальной интенсивности из PSF, продолжайте использовать размеры PSF по умолчанию и нажмите OK.
ПРИМЕЧАНИЕ: Если извлечение PSF прошло успешно для всех представлений, в файле журнала будет отображаться 'Извлечено n/n PSFs' - После этого пересохраните файл .xml. Появится отмеченный флажок в столбце PSF диалогового окна "Multiview Explorer", а в соответствующей папке будет сгенерирована папка 'psf' со всеми извлеченными PSF.
- Откройте файл embryo.xml и назначьте PSF для каждого вида отдельно. Щелкните правой кнопкой мыши «вид» → выберите «Функции разброса точек » → выберите «Назначить » → выберите «Дополнительно», а затем «Назначить новый PSF всем выбранным видам». Нажмите « Обзор», перейдите к .xml пути к файлу и откройте папку psf .
- Выберите соответствующий PSF с соответствующим ID в выбранном виде и нажмите OK , после чего в окне «Multiview Explorer» появится галочка напротив флажка PSF.
- Повторите этот процесс для всех остальных видов.
- Многовидовое слияние и деконволюция
- После того, как функция разброса точек будет назначена для всех видов, щелкните правой кнопкой мыши и выберите Многоракурсная деконволюция.
- Выберите ограничивающую рамку в качестве выбранных в данный момент видов. Для этой работы хорошо подходит стандартное ускорение OSEM и количество итераций.
- При необходимости уменьшайте разрешение изображений, если требуется более быстрое вычисление или если память процессора ограничена.
ПРИМЕЧАНИЕ: Если требуемый объем оперативной памяти превышает существующую память, в нижней части окна появится предупреждающее сообщение об ошибке, выделенное красным цветом. Не запускайте деконволюцию, если появится это предупреждение, так как плагин заглохнет и перестанет отвечать в какой-то момент обработки. - Чтобы оценить ход деконволюции, проверьте файл журнала, в котором будут отображаться результаты каждые 5 итераций.
- Чтобы увеличить скорость вычислений, выполните многовидовую деконволюцию в графическом процессоре, если он установлен ранее.
ПРИМЕЧАНИЕ: В конце этого процесса появится окно объединенного изображения, которое можно сохранить как файл tiff.
Результаты
Точная ориентация образца является жизненно важной частью эффективного использования микроскопической установки. Однако ручная ориентация образцов часто невозможна при использовании многоракурсной системы световых листов, учитывая требования к подготовке образцов в пробирке. Таким образом, чтобы проверить, существуют ли стереотипные позиции, которые эмбрионы занимают в хорионе, эмбрионы рыбок данио были визуализированы при 70% эпиболии (около 7 часов после оплодотворения (HPF)), поскольку в центре внимания этого исследования была покадровая визуализация от гаструляции до ранних стадий сомита. Когда образцы были подготовлены непосредственно перед визуализацией при 70% эпиболии, эмбрионы не показали специфической ориентации, которая часто наблюдается в образцах. Поскольку это часто нежелательно, образцы готовили задолго до гаструляции и хранили в микроцентрифужных пробирках при соответствующей температуре до начала визуализации. В этих условиях, при 70% эпиболии (N = 3; n = 87 эмбрионов), ориентации эмбрионов могут быть классифицированы следующим образом: (1) горизонтальными, когда животно-растительная ось (AV) эмбриона была ортогональна длинной оси полимерной трубки, (2) вертикальными, когда ось AV параллельна длинной оси полимерной трубки, и (3) косыми, когда ось АВ находилась под острым углом (рис. 3А). Горизонтальное положение было представлено меньше всего, в то время как вертикальное и косое положения наблюдались в равной степени (рис. 4).
Когда эмбрионы были оставлены в трубах, эмбрионы были стабильны в этих соответствующих положениях до 90% эпиболии, после чего большинство эмбрионов изменили свою ориентацию. Таким образом, потребовался второй раунд документирования ориентаций на стадии эмбриогенеза почек (около 10 HPF), чтобы учесть измененные ориентации. Это было сделано для самостоятельно подготовленных образцов. Ранее сообщалось, что для визуализации ранних стадий сомитов эмбрион с хордой, ортогонально длинной оси полимерной трубки, является идеальной ориентацией, поскольку он позволяет визуализировать множественные двусторонние сомиты, формирующиеся вдоль оси15. Когда образцы были подготовлены до гаструляции (N = 3, n = 93 эмбриона), около 25% эмбрионов демонстрировали эту ориентацию (рис. 4), и эти эмбрионы оставались стабильными в этой ориентации, по крайней мере, до стадии 8-сомита, что согласуется с предыдущими отчетами15. Остальные эмбрионы демонстрировали различные другие ориентации на стадии зачатка (классифицированы на рисунках 3B и 4); Однако многие из них переориентировались в горизонтальное положение во время раннего формирования сомитов. Интересно, что аналогичный процент эмбрионов имел горизонтальную ориентацию на стадии бутона, независимо от того, был ли образец подготовлен до гаструляции, при 70% эпиболии или непосредственно перед стадией бутонов. Таким образом, время подготовки образца представляется менее важным для горизонтальной ориентации, представляющей интерес для визуализации сомитных стадий, в отличие от того, что наблюдалось при визуализации при 70% эпиболии.
Преимуществом многоракурсной системы является возможность просмотра одного и того же образца под разными углами. Однако для эмбрионов рыбок данио на упомянутых стадиях количество просмотров, необходимых для получения клеточного разрешения по всему эмбриону, неясно. Чтобы охарактеризовать это, эмбрионы рыбок данио были визуализированы с использованием объектива 20x/1 NA в группе обнаружения с коэффициентом увеличения 1, что соответствовало толщине светового листа 4,57 мкм. При таких настройках зародыш покрывал все поле зрения sCMOS-камеры с размером пикселя 6,5 мкм и площадью 1920 на 1920 пикселей. Микроинъекция мРНК флуорофора, меченного гистоном (H2A-mCherry) в эмбрионы 1-клеточной стадии, полученные из трансгенной линии, маркирующей актиновые филаменты (Utr-GFP), позволила визуализировать как ядра, так и клеточные мембраны в эмбрионе. Для выполнения многоракурсного слияния эмбрионов с различными угловыми интервалами проводили 360° получение двойных трансгенных эмбрионов, а также бусин в пробирке с интервалом каждые 30° (n = 3 эмбриона при 70% эпиболии; n = 3 эмбриона на стадии почки) или 45° (n = 3 эмбриона при 70% эпиболии; n = 3 эмбриона на стадии почки) с интервалом около 100 срезов в каждом углу и интервалом среза 2 мкм. За счет пропуска альтернативных углов во время обработки изображений при съемке под углом 30° и 45° дополнительно предоставлялись наборы данных под углом 60° и 90°.
Затем полученные изображения регистрировались с использованием информации о бусинах, а регистрационные данные переносились в набор данных об эмбрионе, как описано в разделе протокола. Успешная регистрация с помощью плагина BigStitcher была достигнута для различных сборов, за исключением набора данных 90°, что, вероятно, связано с меньшим охватом образца с каждого угла. Чтобы преодолеть это, эмбрионы были визуализированы каждые 90° с примерно 400 срезами под каждым углом и интервалом среза 2 мкм, как на 70% стадии эпиболии, так и на стадии почки, которые были успешно зарегистрированы (n = 3 эмбриона на каждой стадии).
Следующим шагом было выполнение многоракурсного слияния и деконволюции зарегистрированных наборов данных. Это было сделано с 4-кратным понижением дискретизации для ускорения вычислений. Как видно на примере представления ядер с индивидуальных ракурсов и мультипроекционного реконструированного эмбриона (рис. 5), отдельные ракурсы охватывают меньшее поле зрения, что при слиянии дает изображение всего эмбриона. Для представления ядра были обнаружены с помощью Mastodon (https://github.com/mastodon-sc/mastodon), плагина на основе FIJI, который можно добавить в раздел «Управление сайтами обновлений» меню «Помощь» в FIJI и получить доступ к нему в меню плагинов после добавления. Для детектирования соответствующие изображения сначала конвертировались в формат XML/hdf5, а затем выполнялось ядерное детектирование с помощью плагина «Detection» компании Mastodon с DoG-детектором (диаметр 6 мкм и порог качества 80).
Среди различных объединенных изображений набор данных 90° показал очень высокий фон в глубине образца, что сделало его непригодным для проведения какой-либо количественной оценки. Таким образом, в отличие от более мелких образцов, таких как эмбрионы дрозофилы, которые часто визуализировались с интервалом 90° в других исследованиях 9,22, то же самое не рекомендуется для визуализации эмбрионов ранних рыбок данио-рерио с использованием объектива 20x/1 NA. Между 30°, 45° и 60° объединенными наборами данных качественно не было существенной разницы в информации о ядрах (рис. 6B, верхний ряд); тем не менее, более тонкие структуры, такие как границы ячеек, оказались гораздо лучше разрешенными с помощью набора данных с углом 30° по сравнению с остальными (рисунок 6C, верхний ряд).
Чтобы подтвердить это наблюдение, Mastodon был использован для обнаружения ядер на объединенных изображениях, полученных при визуализации через каждые 30°, 45° и 60°. Для анализа были выбраны три области на объединенных изображениях, по одной на глубине 20 мкм (рис. 6A), 50 мкм и 100 мкм от поверхности эмбриона. Для сравнения эффективности обнаружения ядер на изображениях было выполнено описанное выше детектирование с идентичными параметрами на объединенных изображениях с разных угловых интервалов. Во всех проанализированных областях каждое ядро было обнаружено независимо от слитых изображений, полученных при визуализации с шагом 30°, 45° или 60° (рис. 6B, нижний ряд). Таким образом, глобулярные структуры, такие как ядра, могут быть визуализированы в любом из вышеуказанных угловых интервалов без потери информации.
Для анализа клеточных границ использовали Tissue Analyzer23, плагин FIJI, обычно используемый для сегментации клеток 24,25,26. Как и в Mastodon, плагин Tissue Analyzer может быть добавлен в раздел «Управление сайтами обновлений» меню «Справка» в FIJI и доступен в меню плагинов после добавления. Границы клеток были сегментированы с помощью алгоритма водораздела с параметрами по умолчанию и сильным размытием в диапазоне от 1,5 до 2 в зависимости от глубины ткани и слабым размытием 1. Эти параметры поддерживались постоянными во всех анализах, что облегчало простое сравнение. Когда сегментированные изображения вручную сравнивались с исходными входными изображениями, наблюдались ошибки, когда программное обеспечение либо не смогло обнаружить границу ячейки, либо нарисовало несуществующие границы ячеек (рис. 6C, нижний ряд). Количество ошибок, допущенных плагином тканевого анализатора, было нормализовано к общему количеству обнаруженных связей в регионе и рассчитано как «Ошибка сегментации границ». Несмотря на то, что эти ошибки присутствовали во всех проанализированных областях, количество ошибок резко возросло на объединенных изображениях, полученных при визуализации на угловых интервалах 45° и 60°, по сравнению с 30° (рис. 6D). Это указывало на то, что разрешение на объединенных изображениях становилось все хуже при увеличении углового интервала. Таким образом, для сегментации более тонких структур, таких как границы ячеек, более узкий угловой интервал упрощает последующую обработку.
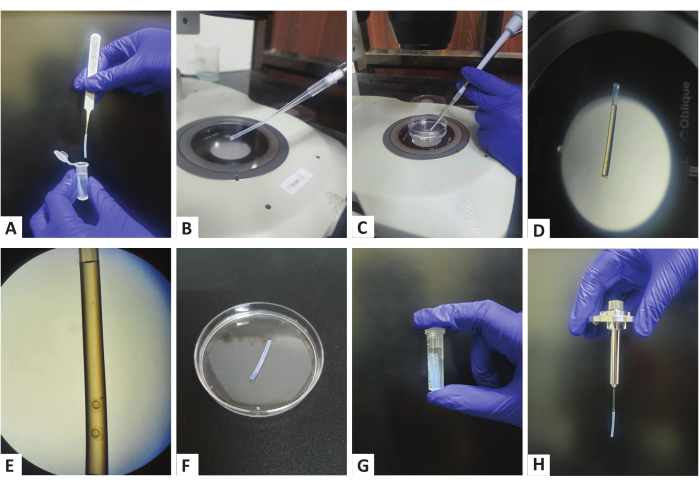
Рисунок 1: Подготовка образцов с использованием полимерных пробирок. (А) Полимерная пробирка из хранящихся микроцентрифужных пробирок берется с помощью щипцов. (B) Прикрепление пробирки к кончику микропипетки объемом 200 мкл. (В) Аспирация эмбрионов с помощью пипетки в пробирку. (Д,Э) Полимерная трубка с эмбрионами стадии почки, видимыми на дне пробирки. (F) Полимерные трубки помещают на чашку Петри с E3 для затвердевания агарозы. (G) Хранение полимерных пробирок в микроцентрифужной пробирке, заполненной Е3. (H) Собранный держатель образца с установленной полимерной трубкой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Рабочий процесс анализа изображений Multiview и регистрация с использованием бусин. (A) Конвейер анализа многоракурсных изображений. (B) На изображении показано окно "Multiview Explorer" в BigStitcher, плагине FIJI, где каждый вид отображается в виде одной строки и содержит информацию об угле, канале, регистрации, точках интереса и PSF. Все команды, описанные в протоколе, отображаются при выборе представления и последующем щелчке правой кнопкой мыши, как показано во всплывающем меню. Выбранные виды можно визуализировать в окне BigDataViewer, как показано на рисунке. (C) Репрезентативное изображение бусин до (слева) и после регистрации (справа), полученное с помощью изображений с угловыми интервалами 30°. Все угловые виды были выбраны и отображены. Масштабные линейки: 75 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Обзор стандартных ориентаций эмбрионов. Репрезентативные изображения ориентаций, в которые попадают эмбрионы в хорион на 70% эпиболии (А) и стадии почки (В). В верхнем ряду каждой панели изображены изображения в светлом поле, полученные с помощью системы световых листов, а в нижнем ряду — репрезентативные мультфильмы. Стрелки в (B) указывают на положение хорды, которая использовалась для определения ориентации. Ap, животный столб; Vp, растительный столб; А, передний; , задний. Масштабные линейки: 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Статистика различных ориентаций эмбрионов. (А) В столбце с укладкой указано процентное соотношение эмбрионов, которые попадают в указанную ориентацию при 70% эпиболии при подготовке образцов перед гаструляцией. (B) В сложенных столбцах указано процентное соотношение эмбрионов, которые попадают в указанные ориентации на стадиях зачатков при подготовке образцов до гаструляции (слева), при 70% эпиболии (в центре) и на стадиях зачатков (справа). N, число независимых кладок, из которых были получены эмбрионы; n, общее количество эмбрионов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Представление ядер из мультипроекционного реконструированного эмбриона. (А) 3D-диаграмма рассеяния представляет собой ядра, обнаруженные в мультипроекционно-реконструированном эмбрионе, изображенном с угловым интервалом 30̛°. Каждый круг представляет собой ядро, а центроид положения ядер нанесен на график. Ядерные координаты были получены с помощью Mastodon, плагина для Фиджи. (B) 3D-диаграммы рассеяния ядер из трех репрезентативных изображений одного и того же эмбриона, изображения которых находятся на расстоянии 60° друг от друга. Цвета для каждого ядра были присвоены случайным образом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Сравнение информации сотового масштаба в объединенных изображениях. (A) На изображении слева показан снимок эмбриона, реконструированного с помощью мультиракурса на глубине 20 мкм от поверхности. Желтым кругом обозначена область, используемая для дальнейшего анализа. Масштабные линейки: 50 μм (на всех панелях). (B) Репрезентативные необработанные изображения ядер на глубине 20 мкм от поверхности эмбриона из трех наборов данных, визуализированных с шагом 30°, 45° и 60° соответственно (вверху). Ядра обнаружены (выделены зеленым цветом) на тех же изображениях Mastodon, плагина для Фиджи (внизу). (C) Репрезентативные необработанные изображения на глубине 20 мкм от поверхности эмбриона из трех наборов данных, полученных с интервалом 30°, 45° и 60° соответственно, с использованием актинового маркера Utr-GFP (вверху). Границы, сегментированные с помощью Tissue Analyzer, плагина FIJI, показаны для тех же изображений (внизу). Стрелки указывают на ошибки, допущенные анализатором тканей при сегментации границ, при этом желтая стрелка представляет отсутствующую границу, а белая стрелка представляет неправильно обнаруженные границы, когда визуально кажется, что границ нет. (D) Ящичковая диаграмма показывает процент ошибок, допущенных тканевым анализатором между многоракурсными реконструированными эмбрионами, визуализированными каждые 30°, 45° и 60° на разной глубине. Погрешности указывают на 1,5-кратный межквартильный диапазон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Позиционирование эмбриона в правильной ориентации для получения изображения интересующей области является одним из шагов по ограничению скорости, который часто приводит к неудачному сеансу микроскопии для пользователя. Это особенно верно в многоракурсном световом листовом микроскопе, где ручное управление ориентацией затруднено, поскольку образцы встроены в пробирку. Чтобы помочь в этом процессе, в этом исследовании приводится статистика различных положений, в которых эмбрион данио-рерио занимает от 70% эпиболии до ранних сомитных стадий в хорионе, когда полимерная трубка с эмбрионами находится в вертикальном положении в микроцентрифужной пробирке.
При 70% эпиболии, вертикально или горизонтально ориентированные эмбрионы предоставляют дополнительную информацию о событиях на всем эмбрионе. В то время как горизонтальная ориентация позволяет визуализировать клеточную динамику в полюсе животного, а также динамику клеток, подвергающихся эпиболии, если смотреть с вегетального полюса, вертикальная ориентация позволяет визуализировать дорсальную и вентральную стороны эмбриона, включая клеточную динамику в дорсальном организаторе, интернализацию клеток во время гаструляции и потоки конвергенции-расширения. Данное исследование показывает, что существует высокая вероятность получения эмбриона в вертикальной ориентации чисто случайно, если образцы подготовлены за несколько часов до визуализации; Тем не менее, горизонтальная ориентация, по-видимому, гораздо менее распространена на этих стадиях. Для стадий до 70% эпиболии рекомендуется, чтобы пользователи документировали аналогичную статистику ориентации эмбрионов в хорионе, прежде чем приступать к покадровой визуализации, так как наличие этой информации заранее экономит время в долгосрочной перспективе.
Со стадии зачатка наилучшей ориентацией для визуализации является горизонтально расположенный эмбрион, так как это позволяет проследить клеточную динамику вдоль всей переднезадней оси тела эмбрионов15. Получить эмбрион в этой ориентации относительно просто, так как около 25% эмбрионов попадают в это стабильное положение независимо от того, когда образец подготовлен. В целом, для визуализации любого интересующего этапа рекомендуется подготовить около 15 пробирок с двумя-тремя эмбрионами в каждой пробирке, что обеспечит высокую вероятность получения эмбрионов в желаемой ориентации и, следовательно, успешный сеанс микроскопии в любой конкретный день. Кроме того, рекомендуется сортировать пробирки примерно за час до интересующего этапа, чтобы выбрать эмбрион с правильной ориентацией для покадровой визуализации.
После получения эмбриона в правильной ориентации важно учесть количество ракурсов и угловой интервал между видами для визуализации. Это зависит от минимально необходимого пространственного и временного разрешения. Чем больше углов, с которых визуализируется конкретная структура или область эмбриона, тем лучше пространственное разрешение (как показано на рисунке 6), но это приводит к компромиссу во временном разрешении. В этом протоколе, с помощью системы, которая имеет два луча подсветки и одно плечо обнаружения, визуализация двух каналов на все 360° с угловым интервалом 30° и около 100 z-срезов под каждым углом с расстоянием между срезами 2 мкм занимает около 3 минут для одной точки. Хотя этого достаточно для отслеживания клеток на ранних эмбриональных стадиях, если мы хотим зафиксировать события с более быстрой динамикой, необходимо получить меньшее количество углов, что обеспечивает лучшее временное разрешение, но с компромиссом в пространственном разрешении, особенно если необходимо сегментировать более тонкие структуры, такие как клеточные границы. Вторым вариантом, который следует рассмотреть для улучшения временного разрешения, является использование многовидовой системы с двумя детектирующими плечами, которая значительно увеличит скорость регистрации, как это недавно было использовано для отслеживания движений клеток во время гаструляции у эмбрионов данио-рерио16. Кроме того, несмотря на то, что в этом протоколе был протестирован только объектив 20x/1 NA, в зависимости от получаемого образца, требуемого пространственного разрешения и поля зрения необходимо учитывать правильный объектив. В целом, исходя из требуемой последующей обработки и количественного определения для конкретного образца и поля зрения, необходимо тщательно выбирать количество изображений и угловой интервал. Однако для визуализации целых ранних эмбрионов данио-рерио, особенно с разрешением в клеточном масштабе под разными углами, объектив 20x/1 NA представляется оптимальным, поскольку объектив с меньшим увеличением и NA (например, объектив 10x/0,5 NA) будет иметь гораздо более низкое разрешение, что, вероятно, приведет к большему количеству ошибок сегментации, в то время как объектив с большим увеличением и NA не будет целесообразным для покрытия всего эмбриона в поле зрения камеры.
В этом исследовании для обсуждения стратегий монтирования и визуализации был использован актиновый маркер, который может быть использован в качестве прокси для отслеживания клеточных границ, и маркер гистонов для обнаружения и отслеживания ядер. На самом деле, в большинстве ранее опубликованных исследований, в которых использовалась многоракурсная система световых листов, преимущественно использовались аналогичные маркеры 5,7,15,16,27. Основная причина выбора этих маркеров заключается в том, что многоракурсная световая листовая микроскопия в основном используется для отслеживания динамики клеточного масштаба (например, формы клеток и их перестройки) либо в масштабах тканей, либо по всему эмбриону в течение длительных периодов времени, охватывающих от нескольких часов до нескольких дней. С другой стороны, если существует необходимость в получении субклеточного разрешения, можно использовать другую трансгенную линию, обозначающую область интереса, но в этом сценарии многоракурсный световой листовой микроскоп может быть не лучшим выбором инструмента, а скорее конфокальным, системой со сверхвысоким разрешением или даже решетчатым световым листовым микроскопом28. 29 может больше подходить к исследуемой проблеме.
Обсуждаемый протокол хорошо работает от гаструляции до 15-сомитной стадии30 эмбрионов данио-рерио (около 17 hpf) без каких-либо модификаций, и, хотя он не тестировался здесь, он, вероятно, будет работать и для более ранних эмбрионов до стадии гаструляции. После стадии 15-сомита начинаются спонтанные мышечные сокращения 30,31, которые могут быть подавлены добавлением трикаина, анестетика, как в пробирку, так и в камеру для образца. Кроме того, примерно при 18 hpf начинается выворот хвоста в сторону от желтка30, что отодвигает эмбрион от поля зрения. Чтобы решить эту проблему, необходимо использовать алгоритм слежения, который отслеживает удлиняющийся конец, чтобы удерживать эмбрион в фокусе32. Кроме того, для визуализации эмбрионов на более поздних стадиях, когда они лишены хориона, например, для последующего развития нервной системы, необходимо использовать альтернативную стратегию монтирования, как это было недавно выполнено33.
Для визуализации эмбрионов рыбок данио с интактным хорионом захват как бусин, которые действуют как маркеры регистрации, так и эмбриона в одном и том же поле зрения невозможен с помощью объектива 20x/1 NA. Это исследование представляет собой простую альтернативу путем регистрации различных видов с информацией от бусин, которые присутствуют над или под образцом, с последующим смещением регистрации с бусин на эмбрион во время обработки. После того, как образец эмбриона зарегистрирован таким образом, может быть выполнен второй раунд регистрации с использованием ядер в качестве регистрационных маркеров, присутствующих в образце, для дальнейшей тонкой настройки первоначальной регистрации. При выполнении покадровой визуализации информация о ядрах, в свою очередь, может быть использована для регистрации последовательных временных точек, как сообщалось ранее21. Одной из альтернатив этому протоколу является отказ от бусин и использование информации о ядрах для первоначальной регистрации. Но регистрация часто не удавалась (не показана здесь) в плагине BigStitcher, возможно, из-за того, что комбинация многих ядер не обнаруживается глубже в эмбрионе во время обработки, а также из-за относительно меньшего количества ядер, которые присутствуют в эмбрионе при рассмотрении под определенными углами (например, при вентральном взгляде на поздних эпиболических стадиях).
В этом протоколе, поскольку информация о бусинах сверху или снизу образца используется для регистрации, и нет необходимости визуализировать бусины в том же виде, что и изображение образца, можно использовать этот протокол для визуализации только определенных областей интереса, но с большим увеличением под разными углами, а не всего эмбриона. Кроме того, этот протокол можно легко адаптировать для визуализации нескольких образцов, уложенных вертикально в пробирке, используя для регистрации информацию о гранулах между образцами.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Выражаем признательность д-ру Калидасу Кохале и его команде за обслуживание рыбного хозяйства, а также К. В. Боби за обслуживание светового листового микроскопа. SRN выражает признательность за финансовую поддержку со стороны Департамента атомной энергии (DAE) правительства Индии (номер идентификации проекта. RTI4003, DAE OM No 1303/2/2019/R\&D-II/DAE/2079 от 11.02.2020), программа Партнерской группы Общества Макса Планка (M.PG. A MOZG0010) и грант Совета по научным и инженерным исследованиям для стартапов (SRG/2023/001716).
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose, low gelling temperature | Sigma-Aldrich | A9414 | |
| Calcium Chloride dihydrate | Sigma-Aldrich | 12022 | |
| FIJI | Version: ImageJ 1.54f | ||
| Latex beads, carboxylate-modified polystyrene, fluorescent red, 0.5 μm mean particle size, aqueous suspension | Sigma-Aldrich | L3280 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | |
| mMESSAGE mMACHINE SP6 Transcription kit | ThermoFischer Scientific | AM1340 | For in vitro transccription of H2A-mCherry plasmid |
| Potassium Chhloride | Sigma-Aldrich | P9541 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P0662 | |
| PTFE Sleeving AWG 15L - 1.58 mm ID x 0.15 mm Wall +/-0.05 | Adtech Innovations in Fluoroplastics | STW15 | PTFE tubes |
| Sodium Chloride | Sigma-Aldrich | S3014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | 71640 | |
| Ultrasonic Cleaner | Labman | LMUC3 | Ultrasonicator |
| Zeiss LightSheet 7 System | Zeiss |
Ссылки
- Wan, Y., McDole, K., Keller, P. J. Light sheet microscopy and its potential for understanding developmental processes. Annu Rev Cell Dev Biol. 35, 655-681 (2019).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Keller, P. J., et al. high-contrast imaging of animal development with scanned light sheet-based structured-illumination microscopy. Nat Methods. 7 (8), 637-642 (2010).
- Keller, P. J. Imaging morphogenesis: Technological advances and biological insights. Science. 340 (6137), 1234168(2013).
- Schmid, B., et al. High-speed panoramic Light sheet microscopy reveals global endodermal cell dynamics. Nat Commun. 4 (1), 2207(2013).
- Strnad, P., et al. Inverted Light sheet microscope for imaging mouse pre-implantation development. Nat Methods. 13 (2), 139-142 (2016).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Krzic, U., Gunther, S., Saunders, T. E., Streichan, S. J., Hufnagel, L. Multiview Light sheet microscope for rapid in toto imaging. Nat Methods. 9 (7), 730-733 (2012).
- Preibisch, S., Saalfeld, S., Schindelin, J., Tomancak, P. Software for bead-based registration of selective plane illumination microscopy data. Nat Methods. 7 (6), 418-419 (2010).
- Swoger, J., Verveer, P., Greger, K., Huisken, J., Stelzer, E. H. K. Multiview image fusion improves resolution in three-dimensional microscopy. Opt Express. 15 (13), 8029-8042 (2007).
- Swoger, J., Huisken, J., Stelzer, E. H. Multiple imaging axis microscopy improves resolution for thick-sample applications. Opt Lett. 28 (18), 1654-1656 (2003).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. J Vis Exp. (84), e51119(2014).
- Naganathan, S. R., Popović, M., Oates, A. C. Left-right symmetry of zebrafish embryos requires somite surface tension. Nature. 605 (7910), 516-521 (2022).
- Shah, G., et al. Multi-scale imaging and analysis identify pan-embryo cell dynamics of germlayer formation in zebrafish. Nat Commun. 10 (1), 5753(2019).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Hörl, D., et al. BigStitcher: Reconstructing high-resolution image datasets of cleared and expanded samples. Nat Methods. 16 (9), 870-874 (2019).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , University of Oregon Press. (2000).
- Icha, J., et al. Using light sheet fluorescence microscopy to image zebrafish eye development. J Vis Exp. (110), e53966(2016).
- Tomer, R., Khairy, K., Amat, F., Keller, P. J. Quantitative high-speed imaging of entire developing embryos with simultaneous multiview Light sheet microscopy. Nat Methods. 9 (7), 755-763 (2012).
- Aigouy, B., Prud'homme, B. Segmentation and quantitative analysis of epithelial tissues. Methods Mol Biol. 2540, 387-399 (2022).
- Mancini, L., et al. Apical size and deltaA expression predict adult neural stem cell decisions along lineage progression. Science Adv. 9, 7519(2023).
- Piscitello-Gomez, R., Mahmoud, A., Dye, N., Eaton, S. Sensitivity of the timing of Drosophila pupal wing morphogenesis to external perturbations. bioRxiv. , (2023).
- Tsuboi, A., Fujimoto, K., Kondo, T. Spatiotemporal remodeling of extracellular matrix orients epithelial sheet folding. Science Adv. 9, 2154(2023).
- Fu, Q., Martin, B. L., Matus, D. Q., Gao, L. Imaging multicellular specimens with real-time optimized tiling Light sheet selective plane illumination microscopy. Nat Commun. 7 (1), 11088(2016).
- Chen, B. C., et al. Lattice Light sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution. Science. 346 (6208), 1257998(2014).
- York, H. M., et al. Deterministic early endosomal maturations emerge from a stochastic trigger-and-convert mechanism. Nat Commun. 14 (1), 4652(2023).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Melançon, E., Liu, D. W. C., Westerfield, M., Eisen, J. S. Pathfinding by identified zebrafish motoneurons in the absence of muscle pioneers. J Neurosci. 17 (20), 7796(1997).
- Rohde, L. A., et al. Cell-autonomous timing drives the vertebrate segmentation clock's wave pattern. eLife. , 13:RP93764 (2024).
- Haynes, E. M., et al. KLC4 shapes axon arbors during development and mediates adult behavior. eLife. 11, e74270(2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены