Method Article
早期斑马鱼胚胎的光片显微镜成像和安装策略
摘要
描述了使用光片显微镜对完整绒毛膜内的早期斑马鱼胚胎进行成像的样品制备策略。它分析了胚胎在 70% 的外生和芽期在绒毛膜内获得的不同方向,并详细介绍了使用光片系统在整个胚胎中获得细胞尺度分辨率的成像策略。
摘要
光片显微镜已成为斑马鱼胚胎长时间实时成像的首选方法,光毒性最小。特别是,允许样品旋转的多视图系统能够从不同角度对整个胚胎进行成像。然而,在大多数使用多视图系统的成像过程中,样品安装是一个麻烦的过程,因为样品通常在聚合物管中制备。为了帮助这个过程,该协议描述了在 70% 表观和早期体节阶段之间对早期斑马鱼发育进行成像的基本安装策略。具体来说,该研究提供了胚胎在绒毛膜内 70% 的外胚期和芽期默认处于各种位置的统计数据。此外,它还讨论了在发育早期对整个斑马鱼胚胎进行成像所需的最佳角度数和角度间隔,以便通过融合不同的视图来提取细胞尺度的信息。最后,由于胚胎覆盖了相机的整个视野,这是获得细胞级分辨率所必需的,因此该协议详细说明了使用来自胚胎上方或下方的珠子信息来记录不同视图的过程。
引言
确保最小的光毒性是长期对高时空分辨率的活胚胎进行成像的主要要求。在过去的十年中,光片显微镜已成为满足这一要求的首选方法 1,2,3,4,5,6,7。简而言之,在这项于 2004 年首次用于捕捉发育过程8 的技术中,两片对齐的激光从相对的两端穿过胚胎,仅照亮感兴趣的平面。将检测物镜正交放置,然后同时收集样品中所有照射点发射的荧光。然后通过按顺序将胚胎穿过静态光片来获得 3D 图像。
此外,在这种方法的一种特定形式中,称为多视图光片显微镜,样品可以悬浮在聚合物管中,该聚合物管可以使用转子旋转,从而能够从多个角度对同一胚胎进行成像 9,10,11。成像后,根据配准标记物对来自多个角度的图像进行融合,配准标记物通常是胚胎内(例如细胞核)或管中(例如荧光珠)中的球状荧光标记物。多视图成像和融合显著提高了轴向分辨率,在所有三个维度上提供各向同性分辨率12。虽然这是一个很大的优势,但多视图方法的一个主要挑战是样品安装,在整个成像过程中,胚胎必须安装并保持在试管中。
为了进行多视图成像,为了将胚胎保持在原位并防止成像时移动,可以将胚胎包埋在琼脂糖中。然而,这通常会导致有害的生长和发育,特别是对于早期斑马鱼胚胎13,这里讨论的模型系统。第二种安装策略是使用仅比胚胎直径略大的细管,其中胚胎可以与胚胎培养基一起拉入管中,然后用琼脂糖塞14 关闭管的底部。在这种方法中,由于试管中充满了胚胎培养基,因此荧光珠等配准标记物不能用于不同视图的融合,因此配准依赖于胚胎内的标记物。一般来说,微珠可以作为更好的配准标记物,因为由于任何显微镜的照明和检测限制,胚胎内标记物的信号在深入样品时都会减弱。
因此,第三种方法(将在此处详细介绍并之前使用 5,13,14,15,16)是用完整的绒毛膜对早期斑马鱼胚胎进行成像,并用最低百分比的琼脂糖填充管中,其中含有珠子作为注册标记。在这种情况下,由于无法手动干预将胚胎定位在绒毛膜内,因此本研究提供了有关早期斑马鱼胚胎所处默认方向的统计数据,特别关注 70% 的表皮和芽期。然后,它讨论了以细胞尺度分辨率对早期胚胎进行成像所需的最佳视图数量,并详细介绍了使用基于 FIJI 的插件 BigStitcher 的融合过程 10,17,18。总之,该协议使用 20x/1 NA 物镜,旨在促进斑马鱼胚胎学家使用多视图光片系统对具有细胞核和膜标志物的胚胎进行成像,从原肠胚形成到早期体节阶段。
研究方案
本研究中使用的斑马鱼维护和实验程序已获得机构动物伦理委员会的批准,参考文献 TIFR/IAEC/2023-1 和 TIFR/IAEC/2023-5。在单细胞阶段,通过杂交表达 Tg (actb2:GFP-Hsa.UTRN) 19 的杂合鱼获得的胚胎注射 H2A-mCherry mRNA (30 pg)。使用 pCS2+ H2A-mCherry 质粒(来自 Oates 实验室的礼物,EPFL)通过体外转录合成 H2A-mCherry mRNA。表达这两种标记物的胚胎,分别称为 Utr-GFP 和 H2A-mCherry,在方案的其余部分,在 70% 的外生和芽期进行成像。材料表中列出了研究中使用的试剂和设备的详细信息。
1. 用于多视图成像的样品制备
- FEP/PTFE 管的制备
- 按照前面描述的程序清洁 FEP/PTFE 管14.
- 清洁后,根据需要将试管切成 2-2.5 cm 的长度,并将它们储存在含有双蒸水的 2 mL 微量离心管中。试管可以以这种方式储存约一个月。
- 在样品制备之前,将试管在 70-75 °C 下加热约 25 分钟以拉直试管。避免每个微量离心管过度拥挤,以防止结块,确保有足够的空间进行有效的管子矫直。
注:在整个试管处理过程中,请戴上手套,因为试管上残留的任何指纹/灰尘颗粒都可能干扰成像。
- 琼脂糖的制备
- 如下准备 E3 缓冲液 50x 储备溶液:
- 原液 1 - 3.252 g Na2HPO4、0.285 g KH2PO4、11.933 g NaCl、0.477 g KCl 溶于 1 L 去离子水中
- 在 1 L 去离子水中储备 2 - 2.426 g CaCl2、4.067 g MgSO4。
- 要制备 1x E3 缓冲液,请在 960 mL 去离子水中加入 1 和 2 储备液各 20 mL。
注意:请勿在用于成像的 E3 缓冲液中添加亚甲蓝,因为它会导致光散射。 - 通过在加热块上以 70-75 °C 加热并搅拌,将低熔点琼脂糖溶解在 1x E3 中,直到溶液变得透明,没有结块或晶体。
- 对于多视图成像,将市售荧光珠(参见 材料表)添加到琼脂糖溶液中,这样就可以在分析过程中进行图像配准。在室温下以 40 kHz 频率在水浴超声仪中对珠子进行 20-30 分钟的超声处理,以解聚珠子。
- 超声处理后,将 1 μL 磁珠添加到 15 mL 试管中的 10 mL 琼脂糖溶液中,并充分涡旋试管以确保磁珠均匀分散。
注:要添加到琼脂糖中的微珠溶液的体积取决于储备溶液和制造商。尝试一系列体积,并选择在光片系统中成像时珠子看起来分散良好的浓度。尽管进行了超声处理和涡旋处理,但珠子过多仍会聚集,而珠子太少会影响图像配准。 - 在样品制备之前,将添加的珠子的琼脂糖管保存在 37 °C 的密闭水浴中至少 30 分钟。这确保了琼脂糖的温度从 70 °C 降至 37 °C。
- 如下准备 E3 缓冲液 50x 储备溶液:
- 样品制备
- 在成像前一天的晚上用隔板成对放置鱼。取下隔板约 15 分钟,并使用标准程序20 收集胚胎。
- 一旦胚胎达到样品制备的目标阶段,将保持在 37 °C 的整个 10 mL 琼脂糖(带珠子)倒入 6 cm 培养皿中。
- 等待约 2-3 分钟,使温度低于 33 °C,然后将 10 至 15 个胚胎转移到琼脂糖溶液中。
注意:这是防止对转移到琼脂糖的胚胎进行任何可能的热冲击的重要步骤。 - 确保在转移胚胎时向琼脂糖溶液中加入尽可能少的 E3 缓冲液。旋转培养皿,使本应转移的小缓冲液得到充分分散。
- 在样品制备程序的其余部分戴上手套。
- 取带有适当移液器吸头的 200 μL 微量移液器,将从微量离心管中取出的清洁直管插入移液器吸头,如图 1A、B 所示。
- 将少许琼脂糖吸入试管中,然后使用微量移液管吸出 2-3 个胚胎(图 1C,D)。确保胚胎靠近管底(图 1E),这在设置成像时将变得很重要。此外,确保不同胚胎之间有一点琼脂糖(图 1E),以便该区域的珠子可以用作注册标记。
- 在不释放移液器压力的情况下,从移液器吸头上拆下试管,并将其放在装有 E3 的培养皿的盖子上,使琼脂糖凝固(图 1F)。
- 重复步骤 1.3.6 至 1.3.8,直到培养皿中的所有胚胎都转移到试管中。
- 琼脂糖凝固后(可能需要 5-10 分钟,可以通过检查培养皿中的琼脂糖来确认),将试管转移到装有 E3 的 2 mL 微量离心管中(图 1G)。
- 在进行多视图成像之前,根据需要将带有胚胎的试管存放在 28 °C 或 33 °C 的培养箱中。
2. 多视图成像
注意:此步骤介绍了斑马鱼胚胎早期发育阶段多视图成像的一般程序。下面详述的方法可以轻松适用于任何多视图光片显微镜系统。
- 定位胚胎
注:用胚胎培养基20 填充显微镜的样品室,并在成像前至少 10 分钟将样品室的温度设置为感兴趣的温度。- 但是,按照前面描述21 组装样品架,但需要进行一次修改。由于成像将通过试管进行,因此将带有胚胎的试管直接插入正确直径的毛细管中,使其固定到位,而不会将琼脂糖推出并干扰底部的胚胎(图 1H)。
注意:由于样品室具有确定的高度,因此在样品制备过程中确保胚胎位于管底部(如步骤 1.3.7 中所述)将能够将胚胎定位在视野中而不会撞到腔室的地板。 - 将样品架插入多视图系统,并使用 x 和 y 控件将胚胎置于视野中心。
- 使用标本导航仪的 z 控件,然后将胚胎聚焦。
- 此时,胚胎在绒毛膜内的方向将清晰可见,如果不令人满意,请插入新管并选择具有感兴趣方向的胚胎。
- 但是,按照前面描述21 组装样品架,但需要进行一次修改。由于成像将通过试管进行,因此将带有胚胎的试管直接插入正确直径的毛细管中,使其固定到位,而不会将琼脂糖推出并干扰底部的胚胎(图 1H)。
- 对齐灯片
- 胚胎就位后,设置所有实验设置 - 激光器、光路、滤光片、分束器和相机。
- 在设置采集参数时,如果软件提供了 枢轴扫描选项,请选择它。枢轴扫描将减少光片在遇到样品中的任何结构或不透明区域时出现的阴影效果。
- 开始实时扫描样品。设置位大小、激光功率和所需的缩放比例,这将决定光片的厚度,从而决定轴向分辨率。
- 要对齐光片,请先切换到 单面照明 ,然后依次更改 两个光片 (左和右)的设置。以数字方式放大样品中可以看到清晰感兴趣结构的区域。
注意:在这项研究中,使用细胞核 (H2A-mCherry) 或膜 (Utr-GFP) 标记物来对齐片材。建议在软件中更改光片设置,以便在感兴趣区域获得最清晰的信号对比度。 - 一旦两个灯片单独优化以获得最佳信号,即可打开两个灯片。执行第二轮对齐,并确保闪烁最小,这表明两张图纸的对齐效果相当好。
- 对齐完成后,如果软件允许,请激活自动融合两张纸生成的图像的选项。或者,可以先通过聚焦样品周围的珠子来粗略对齐光片,然后使用样品中的信息微调对齐。
注意:当使用两个荧光团(例如核和膜标志物)进行成像时,两种结构的最佳对齐通常略有不同。在此方案中,请根据下游处理的约束选择设置。例如,如果要分割细胞边界,这相对处理强度更大,请根据膜标记对齐光片。
- 设置多视图成像
- 对齐光片后,激活用于执行 z 堆栈和多视图成像的选项。
- 开始 实时扫描 并使用标本导航仪导航以选择第一个视图。在此视图中,设置 切片间隔,然后是 z 堆栈的第一个和最后一个切片。在多视图对话框中添加此位置,该对话框会记下此视图的位置和 z 堆栈信息。
- 通过更改标本导航器中的角度移动到下一个视图。为第二个视图设置 z 堆栈,并在多视图对话框中添加信息。
- 对其他视图重复相同的操作。
注意:确保在每个视图中对切片进行一定数量的最小成像,以便不同视图之间有足够的重叠,这最终将有助于在处理过程中注册视图。最小切片数将取决于缩放系数以及选择用于成像的角度数。 - 设置完所有视图后,将此信息保存到一个文本文件(例如名为"胚位置")中,该文件将包含 z 堆栈信息、管的 (x、y、z) 坐标以及每个视图的角度规格。保存后,从多视图对话框中清除所有位置。
- 由于成像是用相对较大的完整绒毛膜完成的,因此无法以相同的设置查看试管中的珠子。因此,必须从管中的不同位置获取微珠信息。为此,请转换为远离可见珠子的胚胎的不同 "y" 坐标。将此位置添加到多视图对话框中,并将此位置保存在文本文件(例如,名为 'beads-y')中。
注:尽可能靠近胚胎样品对珠子进行成像,以尽量减少两个位置管曲率可能差异的影响。因此,如果管中安装了多个胚胎,重要的是在管之间留出一点琼脂糖以对珠子进行成像(如步骤 1.3.7 中所述)。 - 转到保存文本文件的文件夹,并将 'embryo-positions' 文件复制到名为 'beads-positions' 的新文件中。将 'beads-positions' 文件中所有视图的 y 坐标替换为 'beads-y' 文件中的 y 坐标。这将确保微珠以相同数量的视图、z 堆栈和 x 坐标进行成像,但在管材中处于不同的 y 位置。
- 返回成像软件并在软件中加载 'bead-positions' 文件。如果 time series 选项已激活,请选择一个周期并开始实验。将焊缝图像保存为 'beads',用于在图像处理过程中注册不同的视图。
- 拍摄珠子图像后,清除位置并在软件中加载初始"胚胎位置"文件。设置所需的循环数和适当的时间间隔并开始实验。
3. 多视图图像分析
注意:为了融合多视图图像,使用了斐济插件 BigStitcher,这是多视图重建插件的最新版本 10,17,18。可以通过在"管理更新站点"功能中添加 BigStitcher 插件来安装该插件,该功能可以在"帮助"菜单下的"更新"选项中访问。安装后,插件将出现在 'Plugins' 菜单下。融合涉及的主要步骤如下:(1) 为珠子和胚胎定义 .xml/.h5 文件对;(2) 将所有视图注册到 beads 文件中;(3) 珠子的提取点扩散函数 (PSF),可用于反卷积(图 2A);(4) 将注册和 PSF 信息从 beads 文件传输到胚胎文件,并开始多视图反卷积。这些步骤中的大多数已在前面详细描述过21,此处描述了处理方式不同的步骤。
- 定义 .xml 数据集
- 如前所述,将珠子和胚胎的新数据集分别定义为"beads.xml"和"embryo.xml",21。
- 使用兴趣点进行检测和注册
- 成功导出beads.xml文件后,在"Multiview Explorer"对话框中选择注册所需的视图(图 2B)。右键单击并选择 Detect Interest Points (检测兴趣点)。继续执行21 中所述的步骤。
- 检测到兴趣点后,选择所有视图,右键单击,然后选择 Register using Interest Points (使用兴趣点注册)。按照21 所述的协议进行操作。
- 仔细检查微珠套准是否成功。成功配准后,来自不同视图的重叠微珠会叠加(图 2C)。要检查套准的精确性,请选择两个连续的视图,转到重叠区域,然后在两个视图之间切换,以观察从不同角度成像的拉延筋是否叠加。对每个连续的视图重复此操作。
- 如果重叠不精确,请通过放宽注册所需的重要性和/或可接受的重叠错误(在"注册"对话框中称为"RANSAC 错误")来重试注册。
- 成功注册后,单击"Multiview Explorer"窗口中的 Save 以保存更新的.xml文件。
注意:还要保存日志文件,因为它包含有关注册效率的更多详细信息。要将注册信息从磁珠转换为胚胎,请按照以下步骤操作。 - 在所选的文本编辑器中打开 bead.xml 文件,并在 "ViewRegistrations" 下复制整个块。
- 打开 embryo.xml 并将 "ViewRegistrations" 块替换为从 beads 文件复制的块。如果有多个频道,请替换每个频道的注册信息,如上所示。注册信息可以手动传输,也可以使用自定义编写的 MATLAB 代码传输,该代码可在此处下载:https://github.com/sundar07/Multiview_analysis
- 在 "BigStitcher" 中打开 embryo.xml 文件,仔细检查胚胎的注册是否成功。重复与珠子相同的操作,检查每两个连续视图中感兴趣结构的重叠。
注意:有时,尽管珠子被完美地注册,但胚胎注册可能并不那么理想。如果从珠子成像的位置到胚胎位置的管曲率有轻微的变化,这是可能的。此外,胚胎在视图之间可能会有细微的运动,因为它在绒毛膜内自由漂浮。在这种情况下,使用胚胎中的核标记进行第二轮配准。 - 为此,请在 "BigStitcher" 中打开 embryo.xml 文件,右键单击所有具有核标记的视图,然后选择 Detect Interest Points。
- 将兴趣点重命名为 'nuclei' 并继续执行对珠子执行的步骤。
- 在设置"高斯差值"参数时,确保检测到大部分(如果不是全部)细胞核,并且没有异位核检测。接下来,点击 完成.
- 然后,通过选择 Register using Interest points 来注册这些视图,然后选择 Precise descriptor based (translation-invariant) 选项。确保选中 'compare all views and interest points' 选项,并使用 'nuclei' 作为兴趣点。使用选项修复第一个视图,并且不映射回来。
- 对于注册,请使用具有刚性正则化的仿射模型和插件中的默认参数。
- 通过比较每两个连续的视图来重新检查注册是否成功。
- 成功注册后,单击"Multiview Explorer"窗口中的 Save 以保存更新的.xml文件。
- 在所选的文本编辑器中打开 embryo.xml 文件,并将配准信息从 核标记 复制到其他通道。
- 点扩散函数提取和赋值
- 要执行多视图反卷积,请从注册的珠子数据集中提取成像系统的 PSF 并将其应用于胚胎文件。
- 要获取此信息,请选择拉延筋文件中的所有视图,然后右键单击并选择 Point Spread Functions 和 Extract 选项。
- 在出现的对话框中,确保选中 Use Corresponding Interest points 和 Remove min intensity projections from PSF 已选中,继续使用默认 PSF 大小,然后单击 OK。
注意:如果所有视图的 PSF 提取都成功,日志文件将显示"提取的 n/n PSF" - 然后,重新保存 .xml 文件。在"Multiview Explorer"对话框的 PSF 列中将出现一个勾选的复选框,并且将在相应的文件夹中生成一个"psf"文件夹,其中包含所有提取的 PSF。
- 打开 embryo.xml 文件并为每个视图单独分配 PSF。右键单击 "a view" → click Point Spread Functions →选择 Assign →选择 Advanced,然后选择 Assign new PSF to all selected views。点击 浏览,转到 .xml 文件路径,然后打开 psf 文件夹。
- 在所选视图中选择具有相应 ID 的匹配 PSF,然后单击 OK,然后 PSF 复选框将出现在 'Multiview Explorer' 窗口中。
- 对所有其他视图重复此过程。
- 多视图融合和反卷积
- 为所有视图分配点扩散函数后,右键单击并选择 Multiview Deconvolution (多视图反卷积)。
- 选择 边界框 作为当前选定的视图。对于这项工作,默认的 OSEM 加速和迭代次数效果很好。
- 如果需要更快的计算速度或 CPU 内存有限,请根据需要对图像进行缩减采样。
注意:如果所需的 RAM 超过现有内存,窗口底部将弹出一条红色的警告错误消息。如果弹出此警告,请不要启动反卷积,因为插件将在处理过程中的某个时间点停止并停止响应。 - 要评估反卷积的进度,请检查日志文件,该文件将每 5 次迭代显示一次结果。
- 要提高计算速度,请在 GPU 中执行多视图反卷积(如果之前已安装)。
注意:在此过程结束时,将弹出一个融合图像窗口,可以将其保存为 tiff 文件。
结果
以精确的方式定位样品是高效使用显微镜设置的重要组成部分。然而,考虑到需要在试管中制备样品,使用多视图光片系统时,通常无法手动定向样品。因此,为了检查胚胎在绒毛膜内是否存在刻板位置,斑马鱼胚胎在 70% 的外皮(受精后约 7 小时 (hpf))成像,因为从原肠胚形成到早期体节的延时成像是本研究的重点。当在成像前立即以 70% 的外生比例制备样品时,胚胎没有显示出在样品中经常观察到的特定方向。由于这通常是不可取的,因此在原肠胚形成之前就准备好样品,并在适当温度下储存在微量离心管中,直到成像开始。在这些条件下,在 70% 外生(N = 3;n = 87 个胚胎)时,胚胎方向可分为 (1) 水平,当胚胎的动物-植物 (AV) 轴与聚合物管的长轴正交时,(2) 垂直,当 AV 轴平行于聚合物管的长轴时,以及 (3) 倾斜, 当 AV 轴处于锐角时(图 3A)。水平位置的代表性最少,而垂直和倾斜位置的观察相同(图 4)。
当胚胎留在管中时,胚胎在这些各自的位置保持稳定,直到 90% 呈外生,之后大多数胚胎改变了方向。因此,需要对胚胎发生的芽期(约 10 hpf)的方向进行第二轮记录,以解释改变的方向。这是对独立制备的样品进行的。对于早期体节阶段的成像,先前报道的脊索与聚合物管的长轴正交的胚胎是理想的方向,因为它允许可视化沿轴15 形成的多个双侧体节。当在原肠胚形成前准备样品时(N = 3,n = 93 个胚胎),大约 25% 的胚胎表现出这种方向(图 4),并且这些胚胎在这个方向上保持稳定,至少直到 8 体节阶段,与之前的报道一致15。其余胚胎在芽期表现出各种其他方向(分类于 图 3B 和 图 4);然而,它们中的许多在早期体节形成期间重新定向到水平位置。有趣的是,相似百分比的胚胎在芽期呈现水平方向,无论样品是在原肠胚形成前、70% 的外生还是在芽期之前立即制备的。因此,与在 70% epiboly 下观察到的成像不同,样品制备时间对于成像体节阶段的感兴趣水平方向似乎不太重要。
多视图系统的优势在于能够从多个角度观察同一样品。然而,对于上述阶段的斑马鱼胚胎,获得整个胚胎细胞分辨率所需的视图数量尚不清楚。为了表征这一点,在检测臂中使用 20x/1 NA 物镜对斑马鱼胚胎进行成像,缩放系数为 1,对应于 4.57 μm 的光片厚度。在这些设置下,胚胎覆盖了像素尺寸为 6.5 μm、面积为 1920 x 1920 像素的 sCMOS 相机的整个视场。在标记肌动蛋白丝 (Utr-GFP) 的转基因系获得的 1 细胞期胚胎中显微注射组蛋白标记荧光团 (H2A-mCherry) 的 mRNA,可以观察胚胎中的细胞核和细胞膜。为了对具有不同角度间隔的胚胎进行多视图融合,每隔 30°(n = 3 个胚胎,70% 外皮;n = 3 个胚胎在芽期)或 45°(n = 3 个胚胎,70% 外皮;n = 3 个胚胎在芽期)进行 360° 采集,每个角度约 100 个切片,切片间隔为 2 μm。通过在图像处理过程中跳过交替角度,30° 和 45° 采集额外提供了 60° 和 90° 数据集。
然后使用珠子信息对采集的图像进行配准,并将配准详细信息传输到胚胎数据集,如方案部分所述。使用 BigStitcher 插件对不同的采集成功配准,但 90° 数据集除外,这可能是由于每个角度对样品的覆盖较少。为了克服这个问题,每 90° 对胚胎进行成像,每个角度约 400 个切片,切片间隔为 2 μm,在 70% 的外胚期和芽期,均成功注册(每个阶段 n = 3 个胚胎)。
下一步是对注册数据集执行多视图融合和反卷积。这是通过 4 倍下采样完成的,以加快计算速度。从单个视图和多视图重建胚胎的细胞核表示中可以看出(图 5),单个视图覆盖了较小的视野,在融合时,会产生整个胚胎的图像。对于表示,使用 Mastodon (https://github.com/mastodon-sc/mastodon) 检测细胞核,这是一个基于 FIJI 的插件,可以将其添加到 FIJI 中"帮助"菜单的"管理更新站点"部分,并在添加后在插件菜单下访问。为了进行检测,首先将相应的图像转换为 XML/hdf5 格式,然后使用带有 DoG 探测器(直径 6 μm 和质量阈值 80)的 Mastodon 的"检测"插件进行核检测。
在不同的融合图像中,90° 数据集在样品深处显示出非常高的背景,使其不适合进行任何定量。因此,与果蝇胚胎等较小的样品不同,在其他研究中经常以 90° 间隔成像 9,22,不建议使用 20x/1 NA 物镜对早期斑马鱼胚胎进行成像。在 30°、45° 和 60° 融合数据集之间,定性地,细胞核信息没有实质性差异(图 6B,顶行);然而,与其他数据集相比,使用 30° 融合数据集(图 6C,顶行)似乎可以更好地解析更精细的结构,例如细胞边界。
为了证实这一观察结果,使用 Mastodon 检测每 30°、45° 和 60° 成像获得的融合图像中的细胞核。选择融合图像中的三个区域,分别位于距胚胎表面 20 μm 深度(图 6A)、50 μm 和 100 μm 处进行分析。为了比较跨图像细胞核检测的效率,如上所述进行检测,在不同角度间隔的融合图像上使用相同的参数。在所有分析区域中,无论每 30°、45° 或 60° 成像获得一次融合图像,都检测到每个细胞核(图 6B,底行)。因此,球状结构(如原子核)可以以上述任何角度间隔成像,而不会丢失信息。
为了分析细胞边界,使用了 Tissue Analyzer23,这是一个通常用于分割细胞24、25、26 的 FIJI 插件。与 Mastodon 类似,Tissue Analyzer 插件可以添加到 FIJI 中"帮助"菜单的"管理更新站点"部分,并在添加后在插件菜单下访问。使用具有默认参数的分水岭算法对细胞边界进行分割,根据组织深度,强模糊范围为 1.5 到 2,弱模糊为 1。这些参数在所有分析中保持不变,便于直接比较。当手动将分割图像与原始输入图像进行比较时,会观察到错误,其中软件要么无法检测到细胞边界,要么绘制不存在的细胞边界(图 6C,底行)。组织分析仪插件产生的错误数被归一化为在该区域中检测到的键总数,并计算为"边界分割误差"。虽然这些误差存在于所有分析区域,但与 30° 相比,以 45° 和 60° 角度间隔成像获得的融合图像中的误差数量急剧增加(图 6D)。这表明,当角度间隔增加时,融合图像中的分辨率越来越差。因此,对于更精细的结构(如细胞边界)的分割,更紧密的角度间隔可以更轻松地进行下游处理。
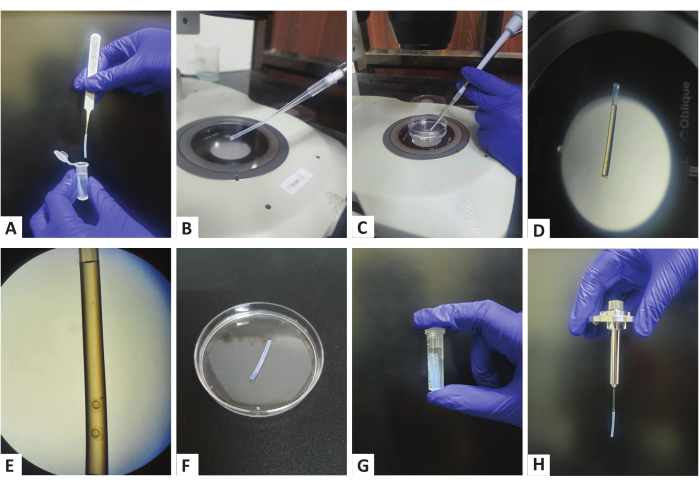
图 1:使用聚合物管进行样品制备。 (A) 使用镊子从储存的微量离心管中取出聚合物管。(B) 将试管连接到 200 μL 微量移液器的尖端。(C) 在移液管的帮助下将胚胎吸入试管中。(D,E)一根聚合物管,在管的底部可以看到芽期胚胎。(F) 将聚合物管放在装有 E3 的培养皿上以固化琼脂糖。(G) 将聚合物管储存在装有 E3 的微量离心管中。(H) 组装好的样品架,已安装的聚合物管。 请单击此处查看此图的较大版本。

图 2: 使用微珠的多视图图像分析工作流程和配准。 (A) 多视图图像分析管道。(B) 该图显示了 FIJI 插件 BigStitcher 中的"Multiview Explorer"窗口,其中每个视图显示为单行,并包含有关角度、通道、配准、兴趣点和 PSF 的信息。当选择视图并右键单击时,将显示协议中讨论的所有命令,如弹出菜单所示。所选视图可以在 BigDataViewer 窗口中可视化,如图所示。(C) 以 30° 角间隔成像获得配准前(左)和配准后(右)的代表性微珠图像。所有角度视图均已选择并显示。比例尺:75 μm。 请单击此处查看此图的较大版本。

图 3: 默认胚胎方向概述。胚胎在 70% 外向 (A) 和芽期 (B) 下落在绒毛膜内的方向的代表性图像。每个面板的顶行描绘了从光片系统获得的明场图像,底行描绘了具有代表性的卡通。(B) 中的箭头表示脊索的位置,用于标识方向。Ap, 动物杆;Vp,植物杆;A, 前部;P,后部。比例尺:100 μm。 请点击此处查看此图的较大版本。

图 4: 不同胚胎方向的统计数据。(A) 堆积柱表示在原肠胚形成前制备样品时,以 70% 的外延落入指定方向的胚胎的百分比。(B) 堆叠柱表示在原肠胚形成前(左)、70% 外生(中)和芽期(右)制备样品时,在芽期落入指定方向的胚胎的百分比。N,从中获得胚胎的独立离合器的数量;n,胚胎总数。 请单击此处查看此图的较大版本。

图 5: 来自多视图重建胚胎的细胞核表示。 (一)3D 散点图表示在以 30°°角间隔成像的多视图重建胚胎中检测到的细胞核。每个圆圈代表一个原子核,并绘制出原子核位置的质心。核坐标是使用 FIJI 插件 Mastodon 获得的。(B) 来自同一胚胎的三个代表性视图的细胞核的 3D 散点图 - 描绘相距 60°。每个细胞核的颜色是随机分配的。 请单击此处查看此图的较大版本。

图 6: 融合图像中细胞尺度信息的比较。(A) 左图显示了距离表面 20 μm 深度的多视图重建胚胎的快照。黄色圆圈表示用于进一步分析的区域。比例尺:50 μm(在所有面板中)。(B) 来自三个数据集,分别每 30°、45° 和 60° 成像一次,距离胚胎表面 20 μm 深度的细胞核的代表性原始图像(上图)。斐济插件 Mastodon 在相同的图像中检测到的细胞核(绿色)(下图)。(C) 使用肌动蛋白标记物 Utr-GFP(上图)分别每 30°、45° 和 60° 成像的三个数据集中距胚胎表面 20 μm 深度的代表性原始图像。由 FIJI 插件 Tissue Analyzer 分割的边界显示在相同的图像中(底部)。箭头表示 Tissue Analyzer 在边界分割时出现的错误,黄色箭头表示缺失的边界,白色箭头表示当视觉上似乎不存在边界时错误检测到的边界。(D) 箱形图描述了组织分析仪在不同深度每 30°、45° 和 60° 成像的多视图重建胚胎之间所犯的误差百分比。误差线表示四分位距的 1.5 倍。 请单击此处查看此图的较大版本。
讨论
将胚胎定位在正确的方向以对感兴趣区域进行成像是速率限制步骤之一,通常会导致用户的显微镜检查失败。在多视图光片显微镜中更是如此,因为样品嵌入管中,因此很难手动操作方向。为了帮助这一过程,本研究报告了斑马鱼胚胎在绒毛膜内占据 70% 的表外和早期体节阶段的各种位置的统计数据,当带有胚胎的聚合物管在微量离心管中保持直立时。
在 70% 的外生时,垂直或水平方向的胚胎提供整个胚胎事件的补充信息。虽然水平方向允许可视化动物极中的细胞动力学以及从植物极观察的经历上皮的细胞动力学,但垂直方向允许可视化胚胎的背侧和腹侧,包括背组织器中的细胞动力学、原肠胚形成过程中细胞的内化和会聚延伸流。这项研究表明,如果在成像前几个小时准备好样品,则很有可能纯粹偶然地获得垂直方向的胚胎;然而,在这些阶段,水平方向似乎不那么普遍。对于 70% epiboly 之前的阶段,建议用户在进行延时成像之前记录绒毛膜内胚胎方向的类似统计数据,因为从长远来看,事先拥有这些信息可以节省时间。
从芽阶段开始,成像的最佳方向是水平放置的胚胎,因为这允许沿胚胎的整个前后身体轴跟踪细胞动力学15。在这个方向上获得胚胎相对简单,因为无论何时制备样品,大约 25% 的胚胎都会落入这个稳定位置。一般来说,对于任何感兴趣的阶段的成像,建议准备大约 15 个试管,每个试管中含有 2 到 3 个胚胎,这将确保获得所需方向的胚胎的高概率,因此,在任何一天都能成功进行显微镜检查。此外,建议在感兴趣的阶段前大约一小时对试管进行分类,以选择具有正确方向的胚胎进行延时成像。
在获得正确方向的胚胎后,重要的是要考虑视图的数量和成像视图之间的角度间隔。这取决于所需的最低空间和时间分辨率。对胚胎的特定结构或区域进行成像的角度越多,空间分辨率就越好(如图 6 所示),但这会导致时间分辨率的妥协。在该协议中,使用具有两个照明和一个检测臂的系统,以 30° 的角度间隔在完整的 360° 上对两个通道进行成像,每个角度约有 100 个 z 切片,切片间距为 2 μm,一次点大约需要 3 分钟。虽然这足以追踪早期胚胎阶段的细胞,但如果要捕获具有更快动力学的事件,则必须获得较少的角度,以确保更好的时间分辨率,但会牺牲空间分辨率,尤其是在必须分割细胞边界等更精细的结构时。提高时间分辨率的第二个考虑选项是使用具有两个检测臂的多视图系统,这将大大提高采集速度,就像最近用于跟踪斑马鱼胚胎原肠胚形成过程中的细胞运动一样16。此外,尽管在该协议中仅测试了 20x/1 NA 物镜,但根据被成像的样品、所需的空间分辨率和视场,需要考虑正确的物镜。综上所述,根据特定样品和视野所需的下游处理和定量,需要仔细选择视图数量和角度间隔。然而,对于整个早期斑马鱼胚胎的成像,特别是从多个角度以细胞规模的分辨率成像,20x/1 NA 物镜似乎是最佳的,因为具有较低放大倍率和 NA 的物镜(例如,10x/0.5 NA 物镜)的分辨率要低得多,可能会导致更多的分割误差,而具有较高放大倍率和 NA 的物镜将无法在相机的视野中覆盖整个胚胎。
在这项研究中,为了讨论安装和成像策略,使用了肌动蛋白标记物(可用作追踪细胞边界的代理)和组蛋白标记物(用于检测和追踪细胞核)。事实上,以前发表的大多数使用多视图光片系统的研究都优先使用类似的标记 5,7,15,16,27。选择这些标记物的主要原因是多视图光片显微镜主要用于在组织尺度或整个胚胎中跟踪细胞尺度的动力学(例如,细胞形状和细胞重排),时间跨度长达数小时至数天。另一方面,如果需要获得亚细胞分辨率,可以使用标记感兴趣区域的不同转基因线,但在这种情况下,多视图光片显微镜可能不是最佳选择,而是共聚焦、超分辨率系统甚至晶格光片显微镜28,29 可能更适合正在调查的问题。
所讨论的方案从原肠胚形成到 15 体节期斑马鱼胚胎30(约 17 hpf)都运行良好,无需任何修改,虽然这里没有测试,但它也可能适用于原肠胚形成阶段之前的早期胚胎。超过 15 体节阶段,自发性肌肉收缩开始30,31,这可以通过在试管和样品室中添加麻醉剂三卡因来抑制。此外,在大约 18 hpf 时,尾部从蛋黄外翻开始30,这使胚胎远离视野。为了解决这个问题,需要采用一种跟踪伸长端的跟踪算法来保持胚胎聚焦32。此外,对于没有绒毛膜的后期胚胎进行成像,例如用于跟踪神经发育,需要采用替代安装策略,如最近执行的 33。
对于具有完整绒毛膜的斑马鱼胚胎进行成像,使用 20x/1 NA 物镜无法在同一视野中捕获用作配准标记的珠子和胚胎。这项研究提供了一种简单的替代方案,方法是使用样品上方或下方存在的珠子的信息注册不同的视图,然后在处理过程中将注册从珠子转移到胚胎。以这种方式对胚胎样本进行配准后,可以使用样本中存在的细胞核作为配准标记进行第二轮配准,以进一步微调初始配准。当进行延时成像时,原子核信息反过来可用于记录连续的时间点,如之前报道的21 所示。该协议的一种替代方法是放弃珠子,而是使用细胞核信息进行初始注册。但是在 BigStitcher 插件中注册经常失败(此处未显示),这可能是由于在处理过程中许多细胞核在胚胎更深处没有被检测到,也是因为从某些角度观察时(例如,在晚期上皮阶段从腹侧观察时),胚胎中存在的细胞核数量相对较少。
在该协议中,由于来自样品上方或下方的磁珠信息用于配准,并且不需要在与样品成像相同的视图中对磁珠进行成像,因此可以使用该协议仅对感兴趣的特定区域进行成像,但从不同角度以高放大倍率进行成像,而不是整个胚胎。此外,通过使用样品之间的珠子信息进行配准,很容易调整该方案以对垂直堆叠在管中的多个样品进行成像。
披露声明
作者声明没有竞争利益。
致谢
我们感谢 Kalidas Kohale 博士和他的团队对鱼类设施的维护,以及 KV Boby 对光片显微镜的维护。SRN 感谢印度政府原子能部 (DAE) 的财政支持(项目识别编号。RTI4003,DAE OM no. 1303/2/2019/R\&D-II/DAE/2079,日期为 2020 年 2 月 11 日)、马克斯普朗克学会合作伙伴小组计划(M.PG.A MOZG0010) 和科学与工程研究委员会启动研究补助金 (SRG/2023/001716)。
材料
| Name | Company | Catalog Number | Comments |
| Agarose, low gelling temperature | Sigma-Aldrich | A9414 | |
| Calcium Chloride dihydrate | Sigma-Aldrich | 12022 | |
| FIJI | Version: ImageJ 1.54f | ||
| Latex beads, carboxylate-modified polystyrene, fluorescent red, 0.5 μm mean particle size, aqueous suspension | Sigma-Aldrich | L3280 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | |
| mMESSAGE mMACHINE SP6 Transcription kit | ThermoFischer Scientific | AM1340 | For in vitro transccription of H2A-mCherry plasmid |
| Potassium Chhloride | Sigma-Aldrich | P9541 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P0662 | |
| PTFE Sleeving AWG 15L - 1.58 mm ID x 0.15 mm Wall +/-0.05 | Adtech Innovations in Fluoroplastics | STW15 | PTFE tubes |
| Sodium Chloride | Sigma-Aldrich | S3014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | 71640 | |
| Ultrasonic Cleaner | Labman | LMUC3 | Ultrasonicator |
| Zeiss LightSheet 7 System | Zeiss |
参考文献
- Wan, Y., McDole, K., Keller, P. J. Light sheet microscopy and its potential for understanding developmental processes. Annu Rev Cell Dev Biol. 35, 655-681 (2019).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Keller, P. J., et al. high-contrast imaging of animal development with scanned light sheet-based structured-illumination microscopy. Nat Methods. 7 (8), 637-642 (2010).
- Keller, P. J. Imaging morphogenesis: Technological advances and biological insights. Science. 340 (6137), 1234168(2013).
- Schmid, B., et al. High-speed panoramic Light sheet microscopy reveals global endodermal cell dynamics. Nat Commun. 4 (1), 2207(2013).
- Strnad, P., et al. Inverted Light sheet microscope for imaging mouse pre-implantation development. Nat Methods. 13 (2), 139-142 (2016).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Krzic, U., Gunther, S., Saunders, T. E., Streichan, S. J., Hufnagel, L. Multiview Light sheet microscope for rapid in toto imaging. Nat Methods. 9 (7), 730-733 (2012).
- Preibisch, S., Saalfeld, S., Schindelin, J., Tomancak, P. Software for bead-based registration of selective plane illumination microscopy data. Nat Methods. 7 (6), 418-419 (2010).
- Swoger, J., Verveer, P., Greger, K., Huisken, J., Stelzer, E. H. K. Multiview image fusion improves resolution in three-dimensional microscopy. Opt Express. 15 (13), 8029-8042 (2007).
- Swoger, J., Huisken, J., Stelzer, E. H. Multiple imaging axis microscopy improves resolution for thick-sample applications. Opt Lett. 28 (18), 1654-1656 (2003).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. J Vis Exp. (84), e51119(2014).
- Naganathan, S. R., Popović, M., Oates, A. C. Left-right symmetry of zebrafish embryos requires somite surface tension. Nature. 605 (7910), 516-521 (2022).
- Shah, G., et al. Multi-scale imaging and analysis identify pan-embryo cell dynamics of germlayer formation in zebrafish. Nat Commun. 10 (1), 5753(2019).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Hörl, D., et al. BigStitcher: Reconstructing high-resolution image datasets of cleared and expanded samples. Nat Methods. 16 (9), 870-874 (2019).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , University of Oregon Press. (2000).
- Icha, J., et al. Using light sheet fluorescence microscopy to image zebrafish eye development. J Vis Exp. (110), e53966(2016).
- Tomer, R., Khairy, K., Amat, F., Keller, P. J. Quantitative high-speed imaging of entire developing embryos with simultaneous multiview Light sheet microscopy. Nat Methods. 9 (7), 755-763 (2012).
- Aigouy, B., Prud'homme, B. Segmentation and quantitative analysis of epithelial tissues. Methods Mol Biol. 2540, 387-399 (2022).
- Mancini, L., et al. Apical size and deltaA expression predict adult neural stem cell decisions along lineage progression. Science Adv. 9, 7519(2023).
- Piscitello-Gomez, R., Mahmoud, A., Dye, N., Eaton, S. Sensitivity of the timing of Drosophila pupal wing morphogenesis to external perturbations. bioRxiv. , (2023).
- Tsuboi, A., Fujimoto, K., Kondo, T. Spatiotemporal remodeling of extracellular matrix orients epithelial sheet folding. Science Adv. 9, 2154(2023).
- Fu, Q., Martin, B. L., Matus, D. Q., Gao, L. Imaging multicellular specimens with real-time optimized tiling Light sheet selective plane illumination microscopy. Nat Commun. 7 (1), 11088(2016).
- Chen, B. C., et al. Lattice Light sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution. Science. 346 (6208), 1257998(2014).
- York, H. M., et al. Deterministic early endosomal maturations emerge from a stochastic trigger-and-convert mechanism. Nat Commun. 14 (1), 4652(2023).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Melançon, E., Liu, D. W. C., Westerfield, M., Eisen, J. S. Pathfinding by identified zebrafish motoneurons in the absence of muscle pioneers. J Neurosci. 17 (20), 7796(1997).
- Rohde, L. A., et al. Cell-autonomous timing drives the vertebrate segmentation clock's wave pattern. eLife. , 13:RP93764 (2024).
- Haynes, E. M., et al. KLC4 shapes axon arbors during development and mediates adult behavior. eLife. 11, e74270(2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。