Method Article
Light Sheet Microscopy Imaging and Mounting Strategies for Early Zebrafish Embryos
요약
광시트 현미경을 사용하여 온전한 융모막 내에서 초기 제브라피시 배아를 이미징하기 위한 샘플 준비 전략이 설명되어 있습니다. 70% epiboly 및 bud 단계에서 배아가 융모막 내에서 획득하는 다양한 방향을 분석하고 광시트 시스템을 사용하여 배아 전체에서 세포 규모의 해상도를 얻기 위한 이미징 전략을 자세히 설명합니다.
초록
광시트 현미경은 광독성을 최소화하면서 장기간에 걸쳐 제브라피시 배아의 실시간 이미징을 위해 선택되는 방법론이 되었습니다. 특히, 샘플 회전이 가능한 멀티뷰 시스템을 통해 다양한 각도에서 전체 배아를 이미징할 수 있습니다. 그러나 멀티뷰 시스템을 사용하는 대부분의 이미징 세션에서는 샘플이 일반적으로 폴리머 튜브에서 준비되기 때문에 샘플 장착은 번거로운 과정입니다. 이 과정을 돕기 위해 이 프로토콜은 70% 에피볼리 단계와 초기 소마이트 단계 사이의 초기 제브라피시 발달을 이미징하기 위한 기본 장착 전략을 설명합니다. 특히, 이 연구는 융모막 내 70%의 에피볼리(epiboly) 및 새싹 단계에서 배아가 기본적으로 위치하는 다양한 위치에 대한 통계를 제공합니다. 또한, 발달 초기 단계에서 전체 제브라피시 배아를 이미징하는 데 필요한 최적의 각도 수와 각도 사이의 간격에 대해 논의하여 서로 다른 관점을 융합하여 세포 규모의 정보를 추출할 수 있습니다. 마지막으로, 배아는 세포 규모의 해상도를 얻는 데 필요한 카메라의 전체 시야를 커버하기 때문에 이 프로토콜은 다양한 보기의 정합을 위해 배아 위 또는 아래의 비드 정보를 사용하는 과정을 자세히 설명합니다.
서문
광독성을 최소화하는 것은 살아있는 배아를 장기간 높은 시공간 해상도로 이미징하기 위한 주요 요구 사항입니다. 지난 10년 동안 광시트 현미경은 이 요구 사항 1,2,3,4,5,6,7을 충족하기 위해 선택되는 방법론이 되었습니다. 간단히 말해서, 발달 과정8을 포착하기 위해 2004년에 처음 사용된 이 기술에서는 두 개의 정렬된 얇은 레이저 시트가 반대쪽 끝에서 배아를 통과하여 관심 평면만 비춥니다. 검출 대물렌즈를 직각으로 배치한 다음 샘플의 모든 조명 지점에서 방출된 형광을 동시에 수집합니다. 그런 다음 정적 광 시트를 통해 배아를 순차적으로 이동하여 3D 이미지를 얻습니다.
또한, 멀티뷰 광시트 현미경이라고 하는 이 방법론의 특정 형태에서, 샘플은 로터를 사용하여 회전할 수 있는 폴리머 튜브에 현탁될 수 있으며, 이를 통해 여러 각도에서 동일한 배아를 이미징할 수 있습니다 9,10,11. 이미징 후, 여러 각도의 이미지는 일반적으로 배아(예: 핵) 또는 튜브(예: 형광 비드) 내의 구형 형광 마커인 등록 마커를 기반으로 융합됩니다. Multiview 이미징 및 융합은 축 방향 해상도를 크게 향상시켜 3차원 모두에 걸쳐 등방성 해상도를 제공합니다12. 이는 큰 장점이지만, 멀티뷰 방법론의 주요 과제는 이미징의 전체 시간 동안 배아를 튜브에 장착하고 제자리에 유지해야 하는 샘플 장착입니다.
멀티뷰 이미징을 수행하기 위해, 이미징 중 움직임을 방지하고 배아를 아가로스에 내장할 수 있습니다. 그러나 이것은 종종 해로운 성장과 발달로 이어지며, 특히 여기에서 논의되는 모델 시스템인 초기 단계의 제브라피시 배아13의 경우 더욱 그렇습니다. 두 번째 장착 전략은 배아의 직경보다 약간 큰 얇은 튜브를 사용하여 배아를 배아 배지와 함께 튜브 안으로 끌어들일 수 있는 다음 아가로스 플러그14로 튜브 바닥을 닫는 것입니다. 이 방법에서는 튜브가 배아 배지로 채워져 있기 때문에 형광 비드와 같은 등록 마커를 서로 다른 견해의 융합에 사용할 수 없으며 등록은 배아 내의 마커에 의존합니다. 일반적으로 비드는 배아 내 마커의 신호가 현미경의 조명 및 검출 제한으로 인해 샘플 깊숙이 들어갈수록 저하되기 때문에 더 나은 등록 마커 역할을 합니다.
따라서, 여기에서 상세히 설명되고 이전에사용된 5,13,14,15,16 세 번째 접근법은 온전한 융모막으로 초기 제브라피시 배아를 이미징하고 정합 마커로 구슬을 포함하는 아가로스를 최소의 비율로 튜브에 채우는 것입니다. 이 시나리오에서는 융모막 내에 배아를 배치하기 위한 수동 개입이 불가능하기 때문에 이 연구는 초기 제브라피시 배아가 속하는 기본 방향에 대한 통계를 제공하며, 특히 70%의 에피볼리 및 새싹 단계에 초점을 맞춥니다. 그런 다음 세포 규모 해상도에서 초기 단계 배아를 이미징하는 데 필요한 최적의 보기 수에 대해 논의하고 FIJI 기반 플러그인10,17,18인 BigStitcher를 사용한 융합 과정에 대해 자세히 설명합니다. 20x/1 NA 대물렌즈를 사용하는 이 프로토콜은 제브라피시 발생학자들이 위축에서 초기 소마이트 단계까지 핵 및 막 마커가 있는 배아를 이미징하기 위해 멀티뷰 광시트 시스템을 사용하는 것을 용이하게 하는 것을 목표로 합니다.
프로토콜
이 연구에 사용된 제브라피시 유지 관리 및 실험 절차는 기관 동물 윤리 위원회(참조 TIFR/IAEC/2023-1 및 TIFR/IAEC/2023-5)의 승인을 받았습니다. Tg(actb2:GFP-Hsa.UTRN)19를 발현하는 이형접합 어류를 교배하여 얻은 배아에 단세포 단계에서 H2A-mCherry mRNA(30pg)를 주입했습니다. H2A-mCherry mRNA는 pCS2+ H2A-mCherry 플라스미드(Oates lab, EPFL에서 선물)를 사용하여 in vitro transcription으로 합성되었습니다. 프로토콜의 나머지 부분에서 각각 Utr-GFP 및 H2A-mCherry라고 하는 두 마커를 모두 발현하는 배아는 70% 에피볼리 및 새싹 단계에서 이미지화되었습니다. 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. 멀티뷰 이미징을 위한 시료 전처리
- FEP/PTFE 튜브의 준비
- 이전에 설명한 절차에 따라 FEP/PTFE 튜브 청소14.
- 세척 후 요구 사항에 따라 튜브를 2-2.5cm 길이로 자르고 이중 증류수가 들어 있는 2mL 미세 원심분리기 튜브에 보관합니다. 튜브는 이러한 방식으로 약 한 달 동안 보관할 수 있습니다.
- 시료를 준비하기 전에 튜브를 70-75°C에서 약 25분 동안 가열하여 튜브를 곧게 펴십시오. 뭉침을 방지하기 위해 각 미세 원심분리기 튜브의 과밀을 피하고 효과적인 튜브 교정을 위한 충분한 공간을 확보하십시오.
알림: 튜브에 남아 있는 지문/먼지 입자가 이미징을 방해할 수 있으므로 전체 튜브 취급 절차 동안 장갑을 착용하십시오.
- 아가로스의 제조
- 다음과 같이 E3 버퍼 50x 스톡 용액을 준비합니다.
- 스톡 1 - Na2HPO4 3.252g, KH2PO4 0.285g, NaCl 11.933g, 탈이온수 1L에 KCl 0.477g
- 재고 2 - 2.426g의 CaCl2, 4.067L의 탈이온수 중 4g의 MgSO1g.
- 1x E3 완충액을 만들려면 960mL의 탈이온수에 스톡 1 및 2 용액 각각 20mL를 추가합니다.
참고: 이미징에 사용되는 E3 버퍼에 메틸렌 블루를 추가하면 빛이 산란될 수 있으므로 추가하지 마십시오. - 용액이 덩어리나 결정 없이 투명해질 때까지 교반하면서 열 블록에서 70-75°C로 가열하여 1x E3에서 저융점 아가로스를 용해시킵니다.
- 멀티뷰 이미징의 경우, 시중에서 판매되는 형광 비드( 재료 표 참조)를 아가로스 용액에 추가하면 분석 중에 이미지를 정합할 수 있습니다. 수조 초음파기에서 20-30 분 동안 40kHz 주파수로 실온에서 비드를 초음파 처리하여 비드를 분해합니다.
- 초음파 처리 후 15mL 튜브에 10mL의 아가로스 용액에 1μL의 비드를 추가하고 비드의 균일한 분산을 보장하기 위해 튜브를 잘 소용돌이시킵니다.
참고: 아가로스에 첨가되는 비드 용액의 부피는 스톡 용액과 제조업체에 따라 다릅니다. 다양한 부피를 시도하고 라이트 시트 시스템에서 이미징할 때 비드가 잘 분산되어 보이는 농도를 선택하십시오. 너무 많은 비드는 초음파 처리 및 와류에도 불구하고 응집될 수 있는 반면, 너무 적은 비드는 이미지 정합에 영향을 줄 수 있습니다. - 비드가 첨가된 아가로스 튜브를 시료 전처리 전에 37°C로 유지되는 밀폐된 수조에서 최소 30분 동안 보관하십시오. 이렇게 하면 아가로스의 온도가 70°C에서 37°C로 내려갑니다.
- 다음과 같이 E3 버퍼 50x 스톡 용액을 준비합니다.
- 시료 전처리
- 이미징 하루 전 저녁에 칸막이와 쌍으로 물고기를 설정하십시오. 약 15분 동안 칸막이를 제거하고 표준 절차20에 따라 배아를 채취합니다.
- 배아가 시료 전처리를 위한 관심 단계에 도달하면 37°C에서 보관한 아가로스(비드 포함) 10mL 전체를 6cm 페트리 접시에 붓습니다.
- 10-15개의 배아를 아가로스 용액으로 옮기기 전에 온도를 33°C 이하로 낮추기 위해 약 2-3분 동안 기다립니다.
참고: 이것은 아가로스로 전달된 배아에 대한 가능한 열 충격을 방지하기 위한 중요한 단계입니다. - 배아를 이식하는 동안 아가로스 용액에 가능한 한 적은 E3 완충액이 추가되도록 합니다. 옮겨졌을 작은 완충액이 잘 분산되도록 페트리 접시를 소용돌이칩니다.
- 나머지 샘플 준비 절차를 위해 장갑을 착용하십시오.
- 적절한 피펫 팁이 있는 200μL 마이크로피펫을 가져와서 그림 1A,B와 같이 미세원심분리기 튜브에서 꺼낸 세척된 직선 튜브를 피펫 팁에 삽입합니다.
- 튜브에 약간의 아가로스를 흡인한 다음 마이크로피펫을 사용하여 2-3개의 배아를 흡인합니다(그림 1C,D). 배아가 튜브 바닥에 가까이 있는지 확인하고(그림 1E), 이는 이미징을 설정하는 동안 중요해집니다. 또한 서로 다른 배아 사이에 약간의 아가로스가 있는지 확인하여(그림 1E) 이 영역의 비드를 등록 마커로 사용할 수 있습니다.
- 피펫에서 압력을 해제하지 않고 피펫 팁에서 튜브를 분리하고 아가로스가 응고되도록 E3로 채워진 페트리 접시의 뚜껑에 놓습니다(그림 1F).
- 페트리 접시의 모든 배아가 튜브로 옮겨질 때까지 1.3.6에서 1.3.8까지 반복합니다.
- 아가로스가 응고되면(5-10분이 소요될 수 있으며 페트리 접시에서 아가로스를 확인하여 확인할 수 있음) 튜브를 E3로 채워진 2mL 미세 원심분리기 튜브로 옮깁니다(그림 1G).
- 필요에 따라 배아가 있는 튜브를 28°C 또는 33°C 인큐베이터에 보관한 후 멀티뷰 이미징을 진행합니다.
2. 멀티뷰 이미징
참고: 이 단계는 초기 발달 단계에서 제브라피시 배아의 멀티뷰 이미징을 위한 일반적인 절차를 제시합니다. 아래에 설명된 방법은 모든 멀티뷰 광시트 현미경 시스템에 쉽게 적용할 수 있습니다.
- 배아 위치 파악
알림: 현미경의 샘플 챔버를 배아 배지20으로 채우고 이미징 최소 10분 전에 샘플 챔버의 온도를 관심 온도로 설정합니다.- 그러나 한 번의 수정으로 이전에 설명한 대로 샘플 홀더를 조립21. 이미징은 튜브를 통해 수행되므로 배아가 있는 튜브를 올바른 직경의 모세관에 직접 삽입하여 아가로스를 밀어내고 바닥의 배아를 방해하지 않고 제자리에 고정되도록 합니다(그림 1H).
참고: 샘플 챔버에는 정의된 높이가 있기 때문에 샘플 준비 중에 배아가 튜브 바닥을 향하도록 하면(1.3.7단계에서 언급됨) 챔버 바닥에 부딪히지 않고 시야에 배아를 배치할 수 있습니다. - 샘플 홀더를 멀티뷰 시스템에 삽입하고 x- 및 y- 컨트롤을 사용하여 배아를 시야의 중앙으로 가져옵니다.
- 표본 탐색기의 z 컨트롤을 사용하여 배아에 초점을 맞춥니다.
- 이 시점에서 융모막 내 배아의 방향이 명확하게 보이며 만족스럽지 않으면 새 튜브를 삽입하고 관심 있는 배아를 선택합니다.
- 그러나 한 번의 수정으로 이전에 설명한 대로 샘플 홀더를 조립21. 이미징은 튜브를 통해 수행되므로 배아가 있는 튜브를 올바른 직경의 모세관에 직접 삽입하여 아가로스를 밀어내고 바닥의 배아를 방해하지 않고 제자리에 고정되도록 합니다(그림 1H).
- 라이트 시트 정렬하기
- 배아가 제 위치에 놓이면 레이저, 광 경로, 필터, 빔 스플리터, 카메라 등 모든 실험 설정을 지정합니다.
- 획득 파라미터를 설정하는 동안 소프트웨어가 피벗 스캔 옵션을 제공하면 해당 옵션을 선택하십시오. 피벗 스캔은 샘플의 구조나 불투명 영역과 만날 때 광시트에서 나오는 그림자 효과를 줄입니다.
- 샘플의 실시간 스캔을 시작합니다. 비트 크기, 레이저 출력 및 원하는 줌을 설정하면 라이트 시트의 두께가 결정되고 그에 따라 축 해상도가 결정됩니다.
- 라이트 시트를 정렬하려면 먼저 단면 조명 으로 전환하고 두 라이트 시트 (왼쪽 및 오른쪽)의 설정을 순차적으로 변경합니다. 관심 있는 명확한 구조를 볼 수 있는 시료 영역을 디지털 방식으로 확대합니다.
참고: 이 연구에서는 핵(H2A-mCherry) 또는 멤브레인(Utr-GFP) 마커를 사용하여 시트를 정렬했습니다. 관심 영역에서 가장 선명한 신호 대비를 얻을 수 있도록 소프트웨어에서 라이트 시트 설정을 변경하는 것이 좋습니다. - 최상의 신호를 얻기 위해 두 개의 라이트 시트가 개별적으로 최적화되면 두 라이트 시트를 모두 켭니다. 두 번째 정렬을 수행하고 깜박임이 최소화되었는지 확인하여 두 시트가 상당히 잘 정렬되었음을 나타냅니다.
- 정렬이 완료되면 소프트웨어에서 허용하는 경우 두 시트에서 생성된 이미지를 자동으로 융합하는 옵션을 활성화합니다. 또는 먼저 시료 주변의 비드에 초점을 맞춰 광시트를 대략적으로 정렬한 다음 시료의 정보를 사용하여 정렬을 미세 조정할 수 있습니다.
참고: 두 개의 형광단(예: 핵 및 멤브레인 마커)으로 이미징하는 동안 최적의 정렬은 일반적으로 두 구조에 대해 약간 다릅니다. 이 시나리오에서는 다운스트림 처리에 대한 제약 조건에 따라 설정을 선택합니다. 예를 들어, 셀 경계를 분할해야 하는 경우(상대적으로 처리 집약적) 멤브레인 마커를 기준으로 광 시트를 정렬합니다.
- 멀티뷰 이미징 설정
- 라이트 시트를 정렬한 후 z-stack 및 multiview 이미징을 수행하기 위한 옵션을 활성화합니다.
- 실시간 스캔을 시작하고 표본 탐색기를 사용하여 탐색하여 첫 번째 보기를 선택합니다. 이 보기에서 조각 간격을 설정한 다음 z-stack의 첫 번째 조각과 마지막 조각을 설정합니다. 멀티뷰 대화 상자에 이 위치를 추가하면 이 뷰의 위치 및 Z 스택 정보가 기록됩니다.
- 시편 탐색기에서 각도를 변경하여 다음 보기로 이동합니다. 두 번째 보기에 대한 z-stack을 설정하고 멀티view 대화 상자에 정보를 추가합니다.
- 추가 뷰에 대해서도 동일한 작업을 반복합니다.
참고: 서로 다른 뷰 간에 충분한 겹침이 있도록 각 뷰에서 특정 최소 수의 슬라이스가 이미지화되도록 해야 하며, 이는 결국 처리 중에 뷰를 등록하는 데 도움이 됩니다. 최소 슬라이스 수는 확대/축소 비율과 이미징을 위해 선택한 각도 수에 따라 달라집니다. - 모든 보기를 설정한 후 이 정보를 텍스트 파일(예: 'embryo-positions')에 저장하면 z-stack 정보, 튜브의 (x, y, z) 좌표 및 각 보기의 각도 사양이 포함됩니다. 저장한 후 멀티뷰 대화 상자에서 모든 위치를 지웁니다.
- 이미징은 상대적으로 큰 온전한 융모막으로 수행되기 때문에 동일한 설정으로 튜브의 비드를 볼 수 없습니다. 따라서 비드 정보는 튜브의 다른 위치에서 획득해야 합니다. 이렇게 하려면 비드가 보이는 배아에서 떨어진 다른 'y' 좌표로 변환합니다. 이 위치를 멀티뷰 대화 상자에 추가하고 이 위치를 텍스트 파일(예: 'beads-y')에 저장합니다.
참고: 두 위치에서 튜브 곡률의 가능한 차이의 영향을 최소화하기 위해 비드를 가능한 한 배아 샘플에 가깝게 이미지화하십시오. 따라서 여러 배아가 튜브에 장착된 경우 비드를 이미지화하기 위해 튜브 사이에 약간의 아가로스를 남겨두는 것이 중요합니다(1.3.7단계에서 언급한 대로). - 텍스트 파일이 저장된 폴더로 이동하여 'embryo-positions' 파일을 'beads-positions'라는 새 파일에 복제합니다. 'beads-positions' 파일의 모든 뷰에 대한 y 좌표를 'beads-y' 파일의 y 좌표로 바꿉니다. 이렇게 하면 비드가 동일한 수의 뷰, z-스택 및 x 좌표로 이미지화되지만 튜브의 다른 y 위치에 있습니다.
- 이미징 소프트웨어로 돌아가서 소프트웨어에 'bead-positions' 파일을 로드합니다. 시계열 옵션이 활성화된 경우 하나의 주기를 선택하고 실험을 시작합니다. 비드 이미지를 'beads'로 저장하면 이미지 처리 중에 다른 뷰를 등록하는 데 사용됩니다.
- 비드 이미지를 촬영한 후 위치를 지우고 소프트웨어에서 초기 'embryo-positions' 파일을 로드합니다. 적절한 시간 간격으로 원하는 사이클 수를 설정하고 실험을 시작합니다.
3. 멀티뷰 이미지 분석
참고: 멀티뷰 이미지를 융합하기 위해 멀티뷰 재구성 플러그인의 최신 버전인 FIJI 플러그인인 BigStitcher가 10,17,18로 사용됩니다. 플러그인은 '업데이트 사이트 관리' 기능에 BigStitcher 플러그인을 추가하여 설치할 수 있으며, '도움말' 메뉴의 '업데이트' 옵션에서 액세스할 수 있습니다. 설치가 완료되면 플러그인이 '플러그인' 메뉴 아래에 나타납니다. 융합과 관련된 광범위한 단계는 다음과 같습니다: (1) 비드와 배아 모두에 대해 .xml/.h5 파일 쌍을 정의합니다. (2) 모든 뷰를 비즈 파일로 등록합니다. (3) 디콘볼루션에 사용할 수 있는 비드에 대한 추출 포인트 확산 기능(PSF)(그림 2A); (4) beads 파일의 registration 및 PSF 정보를 embryo 파일로 전송하고 멀티뷰 디콘볼루션을 시작합니다. 이러한 단계들의 대부분은 이전에 세부적으로 설명되었던 단계들(21)에서 설명되었으며, 여기에서, 상이하게 처리되는 단계들이 설명된다.
- .xml 데이터셋 정의
- 앞서 설명한 바와 같이 비드와 배아 모두에 대한 새 데이터 세트를 각각 'beads.xml' 및 'embryo.xml'로 정의합니다21.
- Detection and registration using interest points(관심 포인트를 사용한 감지 및 등록)
- beads.xml 파일을 성공적으로 내보낸 후 'Multiview Explorer' 대화 상자에서 등록에 필요한 보기를 선택합니다(그림 2B). 마우스 오른쪽 버튼을 클릭하고 Detect Interest Points(관심 포인트 감지)를 선택합니다. 21에 설명된 대로 단계를 진행합니다.
- 관심 포인트를 감지한 후 모든 보기를 선택하고 마우스 오른쪽 버튼을 클릭한 다음 Register using Interest Points(관심 포인트를 사용하여 등록)를 선택합니다. 21에 설명된 대로 프로토콜을 따릅니다.
- 비드 정합이 성공적으로 작동했는지 주의 깊게 확인하십시오. 성공적으로 정합하면 서로 다른 뷰의 겹치는 비드가 중첩됩니다(그림 2C). 정합이 얼마나 정확하게 이루어졌는지 확인하려면 두 개의 연속된 보기를 선택하고 겹치는 영역으로 이동한 다음 두 보기 사이를 전환하여 다른 각도에서 이미지화된 비드가 겹쳐지는지 관찰합니다. 모든 연속 뷰에 대해 이 작업을 반복합니다.
- 중복이 정확하지 않은 경우 등록에 필요한 중요도 및/또는 허용 가능한 중복 오류('등록' 대화 상자에서 'RANSAC 오류'라고 함)를 완화하여 등록을 다시 시도합니다.
- 등록에 성공하면 'Multiview Explorer' 창에서 저장 을 클릭하여 업데이트된 .xml 파일을 저장합니다.
참고: 등록 효율성에 대한 자세한 정보가 포함된 로그 파일도 저장하십시오. 비드에서 배아로 등록 정보를 변환하려면 아래에 설명된 단계를 따르십시오. - 선택한 텍스트 편집기에서 bead.xml 파일을 열고 "ViewRegistrations" 아래의 전체 블록을 복사합니다.
- embryo.xml 열고 "ViewRegistrations" 블록을 비즈 파일에서 복사한 블록으로 바꿉니다. 채널이 여러 개인 경우 위와 같이 각 채널에 대한 등록 정보를 바꿉니다. 등록 정보는 수동으로 전송하거나 여기에서 다운로드할 수 있는 사용자 지정 작성된 MATLAB 코드를 사용하여 전송할 수 있습니다 https://github.com/sundar07/Multiview_analysis
- "BigStitcher"에서 embryo.xml 파일을 열고 배아에 대한 등록이 성공적으로 작동했는지 주의 깊게 확인하십시오. 두 개의 연속적인 보기마다 관심 있는 구조의 겹침을 확인하여 비드에 대해 수행한 것과 동일한 작업을 반복합니다.
참고: 때때로, 비드가 완벽하게 등록되더라도 배아 등록이 바람직하지 않을 수 있습니다. 이는 비드가 이미징되는 위치에서 배아 위치까지 튜브 곡률에 약간의 변화가 있는 경우 가능합니다. 또한, 배아가 융모막 내에서 자유롭게 떠다니기 때문에 시야 사이에 배아의 미묘한 움직임이 있을 수 있습니다. 이 경우 배아에서 핵 마커를 사용하여 두 번째 등록을 수행합니다. - 이렇게 하려면 "BigStitcher"에서 embryo.xml 파일을 열고 핵 마커가 있는 모든 뷰를 마우스 오른쪽 버튼으로 클릭한 다음 관심 포인트 감지를 선택합니다.
- 관심 점의 이름을 'nuclei'로 바꾸고 비드에 대해 수행된 단계를 진행합니다.
- 'Difference of Gaussian' 매개변수를 설정하는 동안 전부는 아니더라도 대부분의 핵이 검출되고 이소성 핵 검출이 없는지 확인하십시오. 그런 다음 완료를 클릭합니다.
- 그런 다음 Register using Interest points(관심 포인트를 사용하여 등록 )를 선택하여 이러한 보기를 등록하고 Precise descriptor based (translation-invariant) 옵션을 선택합니다. '모든 보기 및 관심 포인트 비교' 옵션이 선택되어 있는지 확인하고 'nuclei'를 관심 포인트로 사용합니다. 첫 번째 뷰를 수정하는 옵션을 사용하고 다시 매핑하지 않습니다.
- 등록을 위해 플러그인에서 엄격한 정규화와 기본 매개변수가 있는 아핀 모델을 사용하십시오.
- 두 개의 연속적인 보기를 모두 비교하여 등록 성공 여부를 다시 확인합니다.
- 등록에 성공하면 'Multiview Explorer' 창에서 저장 을 클릭하여 업데이트된 .xml 파일을 저장합니다.
- 선택한 텍스트 편집기에서 embryo.xml 파일을 열고 핵 마커의 등록 정보를 다른 채널로 복사합니다.
- 포인트 스프레드 기능 추출 및 할당
- 멀티뷰 디콘볼루션을 수행하려면 등록된 beads 데이터셋에서 이미징 시스템의 PSF를 추출하여 배아 파일에 적용하십시오.
- 이 정보를 얻으려면 비드 파일에서 모든 뷰를 선택한 다음 마우스 오른쪽 버튼을 클릭하고 포인트 스프레드 함수(Point Spread Functions ) 및 추출(Extract) 옵션을 선택합니다.
- 표시되는 대화 상자에서 Use Corresponding Interest points 및 Remove min intensity projections from PSF 가 선택되어 있는지 확인하고 기본 PSF 크기를 계속 진행한 다음 OK를 클릭합니다.
참고: 모든 뷰에 대해 PSF 추출이 성공하면 로그 파일에 'Extracted n/n PSFs'가 표시됩니다. - 그런 다음 .xml 파일을 다시 저장하십시오. 'Multiview Explorer' 대화 상자의 PSF 열에 체크된 체크박스가 나타나고, 추출된 모든 PSF와 함께 해당 폴더에 'psf' 폴더가 생성됩니다.
- embryo.xml 파일을 열고 각 보기에 대해 개별적으로 PSF를 할당합니다. "a view"→를 마우스 오른쪽 버튼으로 클릭하고 Point Spread Functions를 클릭한 → Assign을 선택한 → Advanced를 선택한 다음 선택한 모든 뷰에 새 PSF를 Assign new PSF를 차례로 선택합니다. 찾아보기를 클릭하고 .xml 파일 경로로 이동한 다음 psf 폴더를 엽니다.
- 선택한 보기에서 해당 ID와 일치하는 PSF를 선택하고 OK를 클릭하면 PSF 확인란이 'Multiview Explorer' 창에 체크 표시되어 나타납니다.
- 다른 모든 뷰에 대해 이 프로세스를 반복합니다.
- 멀티뷰(Multiview) 융합 및 디콘볼루션(deconvolution)
- 모든 뷰에 포인트 스프레드 기능을 할당한 후 마우스 오른쪽 버튼을 클릭하고 Multiview Deconvolution을 선택합니다.
- 경계 상자를 현재 선택된 뷰로 선택합니다. 이 작업에서는 기본 OSEM 가속 및 반복 횟수가 잘 작동합니다.
- 더 빠른 계산이 필요하거나 CPU 메모리가 제한되는 경우 필요에 따라 이미지를 다운샘플링합니다.
참고: 필요한 RAM이 기존 메모리를 초과하면 창 하단에 빨간색 경고 오류 메시지가 나타납니다. 이 경고가 나타나면 플러그인이 처리 중 어느 시점에서 멈추고 응답을 중지하므로 디콘볼루션을 시작하지 마십시오. - 디콘볼루션의 진행 상황을 평가하려면 5회 반복마다 결과를 표시하는 로그 파일을 확인합니다.
- 계산 속도를 높이려면 GPU가 이전에 설치된 경우 GPU에서 멀티뷰 디콘볼루션을 수행합니다.
참고: 이 과정이 끝나면 tiff 파일로 저장할 수 있는 융합 이미지 창이 나타납니다.
결과
정확한 방식으로 샘플의 방향을 지정하는 것은 현미경 설정을 효율적으로 사용하는 데 있어 중요한 부분입니다. 그러나 튜브에서 샘플을 준비해야 하는 요구 사항을 감안할 때 멀티뷰 라이트 시트 시스템을 사용할 때 샘플의 방향을 수동으로 지정하는 것이 불가능한 경우가 많습니다. 따라서 배아가 융모막 내에서 차지하는 정형화된 위치가 있는지 확인하기 위해 제브라피시 배아를 70% 에피볼리(수정 후 약 7시간)로 이미징했는데, 이는 위축에서 초기 소마이트 단계까지의 타임랩스 이미징이 이 연구의 초점이었기 때문입니다. 70% epiboly에서 이미징하기 직전에 샘플을 준비했을 때, 배아는 샘플에서 자주 관찰되는 특정 방향이 나타나지 않았습니다. 이는 종종 바람직하지 않기 때문에 샘플은 위형성 훨씬 전에 준비하고 이미징이 시작될 때까지 적절한 온도의 미세 원심분리기 튜브에 보관했습니다. 이러한 조건 하에서, 70%의 에피볼리(epiboly)에서(N=3; n=87 배아), 배아 배향은 (1) 배아의 동물-식물(AV) 축이 고분자 튜브의 장축에 직교하는 경우, (2) AV 축이 고분자 튜브의 장축에 평행할 때 수직(Vertical), 및 (3) 비스듬한 배아(Oblique)로 분류할 수 있으며, AV 축이 예각일 때(그림 3A). 수평 위치는 가장 적게 나타났지만 수직 및 경사 위치는 동일하게 관찰되었습니다(그림 4).
배아가 튜브에 남아 있을 때, 배아는 90%의 에피볼리(epiboly)가 될 때까지 각각의 위치에서 안정적이었으며, 그 후에는 대부분의 배아가 방향을 변경했습니다. 따라서, 변화된 배향을 설명하기 위해 배아 발생의 새싹 단계(약 10 hpf)에서의 배향에 대한 두 번째 문서화가 필요했습니다. 이것은 독립적으로 준비된 샘플에 대해 수행되었습니다. 초기 소마이트 단계를 이미징하기 위해, 폴리머 튜브의 장축에 직교하는 notochord를 가진 배아가 축(15)을 따라 형성되는 여러 양측 소마이트를 시각화할 수 있기 때문에 이상적인 방향이라고 이전에 보고되었습니다. 위축(gastrulation) 전에 샘플을 준비했을 때(N = 3, n = 93 배아), 약 25%의 배아가 이러한 배향을 보였으며(그림 4), 이들 배아는 이전 보고와 일치하는 적어도 8-솜 단계까지 이 배향에서 안정적으로 유지되었다15. 나머지 배아는 새싹 단계에서 다양한 다른 방향을 나타냈다( 그림 3B 및 그림 4로 분류됨). 그러나 그들 중 많은 사람들이 초기 소마이트 형성 동안 수평 위치로 방향을 바꿨습니다. 흥미롭게도, 비슷한 비율의 배아가 샘플이 위암 형성 전에 준비되었는지, 70% 에피볼리에서 준비되었는지, 또는 새싹 단계 직전에 준비되었는지에 관계없이 새싹 단계에서 수평 방향을 나타냈습니다. 따라서, 시료 전처리 시기는 70% epiboly에서 이미징에서 관찰된 것과 달리 somite stages를 이미징하기 위한 관심의 수평 방향에 덜 중요한 것으로 보입니다.
멀티뷰 시스템의 장점은 동일한 샘플을 여러 각도에서 볼 수 있다는 것입니다. 그러나, 언급된 단계에 있는 제브라피시 배아의 경우, 전체 배아에 걸쳐 세포 해상도를 얻기 위해 필요한 뷰의 수는 명확하지 않습니다. 이를 특성화하기 위해 검출 암에서 줌 팩터 1의 20x/1 NA 대물렌즈를 사용하여 제브라피시 배아를 이미지화했으며, 이는 4.57μm의 광시트 두께에 해당합니다. 이러한 설정에서 배아는 6.5μm의 픽셀 크기와 1920 x 1920 픽셀의 영역으로 sCMOS 카메라의 전체 시야를 커버했습니다. 액틴 필라멘트(Utr-GFP)를 표시한 형질전환 라인에서 얻은 1세포 단계 배아에서 히스톤 태그 형광단(H2A-mCherry)에 대한 mRNA를 미세주입하면 배아의 핵과 세포막을 모두 시각화할 수 있습니다. 각도 간격이 다른 배아의 멀티뷰 융합을 수행하기 위해, 이중 형질전환 배아와 튜브 내 비드의 360° 획득을 각 각도에서 약 100개의 절편과 2μm의 절편 간격으로 30°(n = 70% epiboly에서 3개의 배아, n = 3개의 배아) 간격으로 수행했습니다. 이미지 처리 중 다른 각도를 건너뛸 수 있기 때문에 30° 및 45° 획득은 60° 및 90° 데이터 세트를 추가로 제공했습니다.
그런 다음 획득된 이미지를 비드 정보를 사용하여 등록하고, 등록 세부 정보를 프로토콜 섹션에 설명된 대로 배아 데이터 세트로 전송했습니다. BigStitcher 플러그인을 사용한 성공적인 정합은 90° 데이터 세트를 제외한 다양한 수집에 대해 달성되었는데, 이는 각 각도에서 샘플의 적용 범위가 적기 때문일 수 있습니다. 이를 극복하기 위해 배아를 각 각도에서 약 400개의 절편과 2μm의 절편 간격으로 90°마다 이미징했으며, 70% 에피볼리 단계와 새싹 단계 모두에서 성공적으로 등록되었습니다(각 단계에 대해 n = 3개의 배아).
다음 단계는 등록된 데이터 세트의 멀티뷰 융합 및 디콘볼루션을 수행하는 것이었습니다. 이 작업은 계산 속도를 높이기 위해 4배 다운샘플링으로 수행되었습니다. 개별 보기와 다중 보기로 재구성된 배아의 핵 표현에서 볼 수 있듯이(그림 5), 개별 보기는 더 작은 시야를 커버하며, 융합 시 전체 배아의 이미지를 산출합니다. 표현을 위해 피지 기반 플러그인인 Mastodon(https://github.com/mastodon-sc/mastodon)을 사용하여 핵을 감지했으며, 이는 피지의 "도움말" 메뉴의 "업데이트 사이트 관리" 섹션에 추가할 수 있으며 추가된 플러그인 메뉴에서 액세스할 수 있습니다. 탐지를 위해 먼저 각 이미지를 XML/hdf5 형식으로 변환한 다음 DoG 검출기(직경 6μm 및 품질 임계값 80)와 함께 Mastodon의 '탐지' 플러그인을 사용하여 핵 탐지를 수행했습니다.
다양한 융합 이미지 중에서 90° 데이터 세트는 샘플 깊숙한 곳에서 매우 높은 배경을 보여 정량화를 수행하기에 적합하지 않았습니다. 따라서,다른 연구에서 90° 간격으로 자주 이미징된 Drosophila 배아와 같은 작은 샘플과 달리9,22, 20x/1 NA objective를 사용하여 초기 제브라피시 배아를 이미징하는 데는 동일한 것이 권장되지 않습니다. 30°, 45° 및 60° 융합 데이터 세트 간에 정성적으로 핵 정보에는 큰 차이가 없었습니다(그림 6B, 상단 행). 그러나 세포 경계와 같은 더 미세한 구조는 나머지 부분에 비해 30° 융합 데이터 세트에서 훨씬 더 잘 해결된 것으로 나타났습니다(그림 6C, 상단 행).
이 관찰을 확인하기 위해 Mastodon을 사용하여 30°, 45° 및 60°마다 이미징하여 얻은 융합 이미지에서 핵을 감지했습니다. 배아 표면에서 각각 20μm(그림 6A), 50μm 및 100μm 깊이에 하나씩 융합된 이미지의 3개 영역을 분석을 위해 선택했습니다. 이미지 전반에 걸쳐 핵 검출의 효율성을 비교하기 위해, 검출은 위에서 설명한 대로 수행되었으며, 서로 다른 각도 간격의 융합 이미지에서 동일한 파라미터를 사용했습니다. 분석된 모든 영역에서 30°, 45° 또는 60°마다 이미징하여 얻은 융합 이미지에 관계없이 모든 핵이 검출되었습니다(그림 6B, 하단 행). 따라서, 핵과 같은 구상 구조는 정보의 손실 없이 위의 각도 간격 중 어느 것에서나 이미지화될 수 있다.
세포 경계를 분석하기 위해, 세포 24,25,26을 분할하기 위해 일상적으로 사용되는 FIJI 플러그인인 Tissue Analyzer23이 사용되었다. Mastodon과 마찬가지로 Tissue Analyzer 플러그인은 FIJI의 "도움말" 메뉴의 "업데이트 사이트 관리" 섹션에 추가할 수 있으며 추가된 플러그인 메뉴에서 액세스할 수 있습니다. 세포 경계는 기본 매개변수와 조직 깊이에 따라 1.5에서 2 사이의 강한 블러와 1의 약한 블러를 사용하여 watershed 알고리즘을 사용하여 분할되었습니다. 이러한 매개변수는 모든 분석에서 일정하게 유지되어 간단한 비교가 용이했습니다. 분할된 이미지를 원본 입력 이미지와 수동으로 비교했을 때 소프트웨어가 셀 경계를 감지하지 못하거나 존재하지 않는 셀 경계를 그리는 오류가 관찰되었습니다(그림 6C, 하단 행). 조직 분석기 플러그인에 의해 발생한 오류 수는 해당 영역에서 감지된 총 결합 수로 정규화되어 '경계 분할 오류'로 계산되었습니다. 이러한 오류는 분석된 모든 영역에 존재했지만, 45° 및 60° 각도 간격으로 이미징하여 얻은 융합 이미지에서 오류 수가 30°에 비해 크게 증가했습니다(그림 6D). 이는 각도 간격이 증가할 때 융합된 이미지의 해상도가 점점 더 나빠졌다는 것을 나타냅니다. 따라서 셀 경계와 같은 더 미세한 구조를 분할하기 위해 더 촘촘한 각도 간격을 사용하면 다운스트림 처리가 더 쉬워집니다.
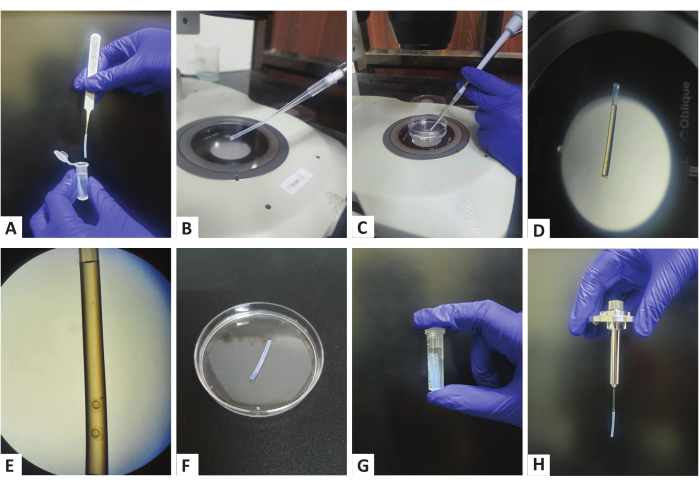
그림 1: 폴리머 튜브를 사용한 시료 전처리. (A) 저장된 미세 원심분리기 튜브에서 폴리머 튜브를 겸자를 사용하여 채취합니다. (B) 튜브를 200μL 마이크로피펫의 팁에 부착합니다. (C) 피펫을 사용하여 배아를 튜브에 흡인합니다. (D,E) 튜브 바닥을 향해 볼 수 있는 새싹 단계 배아가 있는 폴리머 튜브. (F) 폴리머 튜브를 E3가 있는 페트리 접시에 놓아 아가로스를 응고시킵니다. (G) E3로 채워진 마이크로 원심 분리기 튜브에 폴리머 튜브를 보관합니다. (H) 장착된 폴리머 튜브가 있는 조립된 샘플 홀더. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 멀티뷰 이미지 분석 워크플로우 및 비드를 사용한 정합. (A) 멀티뷰 이미지 분석 파이프라인입니다. (B) 이미지는 FIJI 플러그인인 BigStitcher의 "Multiview Explorer" 창을 보여주며, 각 보기는 단일 행으로 표시되며 각도, 채널, 정합, 관심 포인트 및 PSF에 대한 정보를 포함합니다. 프로토콜에서 설명하는 모든 명령은 팝업 메뉴에 표시된 대로 보기를 선택한 다음 마우스 오른쪽 버튼을 클릭하면 나타납니다. 선택한 뷰는 그림과 같이 BigDataViewer 창에서 시각화할 수 있습니다. (C) 30° 각도 간격으로 이미징하여 얻은 등록 전(왼쪽)과 후(오른쪽)의 대표적인 비드 이미지. 모든 각도 뷰가 선택되고 표시되었습니다. 스케일 바: 75 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 기본 배아 방향의 개요. 70%의 에피볼리(epiboly, A) 및 새싹 단계(B)에서 배아가 융모막 내에 속하는 방향의 대표 이미지. 각 패널의 맨 윗줄은 라이트 시트 시스템에서 얻은 명시야 이미지를 나타내고 맨 아래 줄은 대표적인 만화를 나타냅니다. (B)의 화살표는 방향을 식별하는 데 사용된 notochord의 위치를 나타냅니다. AP, 동물 극; Vp, 식물 극; A, 전방; P, 후방. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 다양한 배아 방향의 통계. (A) 누적 열은 위축법 전에 샘플을 준비할 때 70% 에피볼리에서 표시된 방향으로 떨어지는 배아의 백분율을 나타냅니다. (B) 누적된 열은 위형성 전에 샘플을 준비할 때 새싹 단계(왼쪽), 70% 에피볼리(가운데) 및 새싹 단계(오른쪽)에서 표시된 방향으로 떨어지는 배아의 백분율을 나타냅니다. N, 배아가 얻어진 독립적인 클러치의 수; n, 배아의 총 수입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: multiview reconstructed embryo의 핵 표현. (ᅡ)3D 산점도는 30̛° 각도 간격으로 이미징된 멀티뷰로 재구성된 배아에서 검출된 핵을 나타냅니다. 각 원은 핵을 나타내고 핵 위치의 중심이 표시됩니다. 핵 좌표는 FIJI 플러그인인 Mastodon을 사용하여 얻었습니다. (B) 동일한 배아에 대한 세 가지 대표적인 보기에서 얻은 핵의 3D 산점도 - 묘사는 60° 떨어져 있습니다. 각 핵의 색상은 무작위로 할당되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 융합 이미지의 세포 규모 정보 비교. (A) 왼쪽 이미지는 표면에서 20μm 깊이에서 멀티뷰로 재구성한 배아의 스냅샷을 보여줍니다. 노란색 원은 추가 분석에 사용되는 영역을 나타냅니다. 스케일 바: 50 μm(모든 패널에서). (B) 각각 30°, 45°, 60°마다 이미징된 3개의 데이터 세트에서 배아 표면에서 20μm 깊이에 있는 핵의 대표적인 원시 이미지(상단). FIJI 플러그인인 Mastodon에 의해 동일한 이미지에서 검출된 핵(녹색)(아래). (C) 액틴 마커인 Utr-GFP(상단)를 사용하여 각각 30°, 45° 및 60°마다 이미징된 3개의 데이터 세트에서 배아 표면에서 20μm 깊이의 대표적인 원시 이미지. FIJI 플러그인인 Tissue Analyzer에 의해 분할된 경계는 동일한 이미지에 대해 표시됩니다(하단). 화살표는 경계 분할 시 조직 분석기에 의해 발생한 오류를 나타내며, 노란색 화살표는 경계가 누락되었음을 나타내고 흰색 화살표는 시각적으로 경계가 없는 것처럼 보일 때 잘못 감지된 경계를 나타냅니다. (D) 상자 그림은 서로 다른 깊이에서 30°, 45° 및 60°마다 이미징된 멀티뷰 재구성 배아 간에 조직 분석기가 만든 오류의 백분율을 나타냅니다. 오차 막대는 사분위수 범위의 1.5배를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
관심 영역을 이미지화하기 위해 배아를 올바른 방향으로 배치하는 것은 종종 사용자의 현미경 세션 실패를 초래하는 속도 제한 단계 중 하나입니다. 이는 샘플이 튜브 내에 내장되어 있기 때문에 방향을 수동으로 조작하기 어려운 멀티뷰 광시트 현미경에서 더욱 그렇습니다. 이 과정을 돕기 위해 이 연구는 배아가 있는 고분자 튜브가 미세 원심분리기 튜브에 똑바로 세워져 있을 때 제브라피시 배아가 융모막 내에서 70%의 에피볼리(epiboly) 단계와 초기 소마이트(somite) 단계 사이에서 차지하는 다양한 위치에 대한 통계를 보고합니다.
70%의 epiboly, 수직 또는 수평 배아는 전체 배아에 걸쳐 이벤트에 대한 보완 정보를 제공합니다. 수평 방향은 식물 극에서 볼 때 epiboly를 겪는 세포의 역학뿐만 아니라 동물 극의 세포 역학을 시각화 할 수 있지만, 수직 방향은 배쪽 조직자의 세포 역학, 위산 중 세포의 내부화 및 수렴-확장 흐름을 포함하여 배아의 등쪽 및 복부 측면을 시각화 할 수 있습니다. 이 연구는 샘플이 이미징 몇 시간 전에 준비되는 경우 순전히 우연히 수직 방향으로 배아를 얻을 가능성이 높다는 것을 보여줍니다. 그러나 수평 방향은 이 단계에서 훨씬 덜 널리 퍼져 있는 것으로 보입니다. 70% epiboly 이전 단계의 경우, 사용자는 타임랩스 이미징을 진행하기 전에 융모막 내 배아 방향에 대한 유사한 통계를 문서화하는 것이 권장되며, 이 정보를 미리 가지고 있으면 장기적으로 시간을 절약할 수 있습니다.
새싹 단계에서, 이미징을 위한 최상의 방향은 수평으로 배치된 배아이며, 이는 배아의 전후방체 축(anteroposterior body axis15) 전체를 따라 세포 역학을 추적할 수 있게 해준다. 이 방향에서 배아를 얻는 것은 비교적 간단한데, 샘플이 준비되는 시기에 관계없이 배아의 약 25%가 이 안정적인 위치에 떨어지기 때문입니다. 일반적으로 관심 있는 모든 단계를 이미징하기 위해서는 각 튜브에 2-3개의 배아가 있는 약 15개의 튜브를 준비하는 것이 권장되며, 이는 원하는 방향으로 배아를 얻을 가능성이 높으므로 주어진 날짜에 성공적인 현미경 세션을 보장합니다. 또한, time-lapse imaging에 적합한 방향을 가진 배아를 선택하기 위해 관심 단계 약 한 시간 전에 튜브를 분류하는 것이 좋습니다.
올바른 방향의 배아를 얻은 후에는 이미징을 위해 시야 수와 시야 사이의 각도 간격을 고려하는 것이 중요합니다. 이는 필요한 최소 공간 및 시간 해상도에 따라 달라집니다. 배아의 특정 구조 또는 영역이 이미지화되는 각도가 많을수록 공간 해상도가 향상되지만( 그림 6 참조) 이로 인해 시간적 해상도가 저하됩니다. 이 프로토콜에서 2개의 조명과 1개의 검출 암이 있는 시스템을 사용하면 각도 간격이 30°이고 슬라이스 간격이 2μm인 각 각도에서 약 100개의 z 슬라이스로 전체 360°에 걸쳐 두 개의 채널을 이미징하는 데 1회 포인트에 약 3분이 걸렸습니다. 이는 초기 배아 단계의 세포를 추적하기에 충분하지만, 더 빠른 역학을 가진 이벤트를 캡처하려면 더 적은 수의 각도를 획득해야 하므로 더 나은 시간 해상도를 보장하지만 공간 해상도가 저하되며, 특히 세포 경계와 같은 더 미세한 구조를 분할해야 하는 경우 더욱 그렇습니다. 시간적 해상도를 개선하기 위해 고려할 수 있는 두 번째 옵션은 두 개의 검출 암이 있는 멀티뷰 시스템을 사용하는 것인데, 이는 제브라피시 배아에서 위축(gastrulation) 중 세포 움직임을 추적하기 위해 최근에 사용된 것처럼 획득 속도를 상당히 증가시킬 것이다16. 또한 이 프로토콜에서는 20x/1 NA 대물렌즈만 테스트했지만 이미징하는 샘플, 필요한 공간 해상도 및 시야에 따라 올바른 대물렌즈를 고려해야 합니다. 종합하면, 특정 샘플과 시야에 필요한 다운스트림 처리 및 정량화를 기반으로 시야 수와 각도 간격을 신중하게 선택해야 합니다. 그러나 초기 제브라피시 배아 전체를 이미징하는 경우, 특히 여러 각도에서 세포 스케일 해상도로 이미징하는 경우, 배율이 낮고 NA(예: 10x/0.5 NA objective)의 objective는 해상도가 훨씬 낮아 더 많은 segmentation error로 이어질 수 있는 반면, 배율과 NA가 높은 objective는 카메라의 시야에서 전체 배아를 커버하는 데 적합하지 않기 때문에 20x/1 NA objective가 최적인 것으로 보입니다.
이 연구에서는 장착 및 이미징 전략을 논의하기 위해 세포 경계를 추적하기 위한 프록시로 사용할 수 있는 actin marker와 핵을 감지하고 추적하기 위한 histone marker를 사용했습니다. 실제로, 이전에 발표된 대부분의 연구들은 멀티뷰 광시트 시스템을 사용하였으나, 유사한 마커 5,7,15,16,27을 우선적으로 사용하였다. 이러한 마커를 선택하는 주된 이유는 멀티뷰 광시트 현미경이 몇 시간에서 며칠에 이르는 장기간에 걸쳐 조직 규모 또는 전체 배아에서 세포 규모 역학(예: 세포 모양 및 세포 재배열)을 추적하는 데 주로 사용되기 때문입니다. 반면에, sub-cellular resolution을 얻을 필요가 있는 경우, 관심 영역을 표시하는 다른 형질전환 라인이 사용될 수 있지만, 이 시나리오에서는 멀티뷰 광시트 현미경이 기기의 최선의 선택이 아닐 수 있으며, 오히려 공초점, 초고해상도 시스템 또는 심지어 격자 광시트 현미경(28)이 최선의 선택이 될 수 있다. 29는 조사 중인 문제에 더 적합할 수 있습니다.
논의된 프로토콜은 위축에서 15-솜마이트 단계 제브라피시 배아30(약 17hpf)까지 어떠한 수정 없이 잘 작동하며, 여기에서 테스트되지는 않았지만 위형성 단계 이전의 초기 배아에서도 작동할 가능성이 높습니다. 15-솜 단계를 넘어서면 자발적인 근육 수축이 시작됩니다30,31 이는 튜브와 샘플 챔버에 마취제인 트리카인을 추가하여 억제할 수 있습니다. 또한, 약 18hpf에서 난황으로부터 멀어지는 꼬리 반전(30)이 시작되어 배아가 시야에서 멀어집니다. 이를 처리하기 위해, 배아의 초점(32)을 유지하기 위해 길쭉한 말단을 추적하는 추적 알고리즘을 사용해야 한다. 더욱이, 신경 발달을 따르기 위한 경우와 같이 융모막이 없는 후기 단계의 배아를 이미징하기 위해, 최근에 수행된 것과 같이 대체 장착 전략을 채택할 필요가 있다33.
온전한 융모막이 있는 제브라피시 배아를 이미징하는 경우, 20x/1 NA 대물렌즈를 사용하여 등록 마커 역할을 하는 비드와 배아를 동일한 시야에서 모두 캡처할 수 없습니다. 이 연구는 샘플 위 또는 아래에 있는 beads의 정보로 다양한 견해를 등록한 다음 처리 중에 bead에서 embryo로 등록을 이동함으로써 간단한 대안을 제공합니다. 배아 샘플이 이러한 방식으로 등록되면 초기 등록을 더욱 미세 조정하기 위해 샘플 내에 존재하는 핵을 등록 마커로 사용하는 두 번째 등록을 수행할 수 있습니다. 타임-랩스 이미징을 수행할 때, 핵 정보는 차례로 이전에 보고된 바와 같이 연속적인 시점의 정합에 사용될 수 있다21. 이 프로토콜에 대한 한 가지 대안은 beads를 포기하고 대신 초기 등록을 위해 핵 정보를 사용하는 것입니다. 그러나 BigStitcher 플러그인에서 등록이 종종 실패(여기에 표시되지 않음)했는데, 이는 처리 중에 배아에서 더 깊게 감지되지 않는 많은 핵의 조합과 특정 각도에서 볼 때(예: 후기 epiboly 단계에서 복부로 볼 때) 배아에 존재하는 핵의 수가 상대적으로 적기 때문일 수 있습니다.
이 프로토콜에서는 샘플 위 또는 아래의 비드 정보가 정합에 사용되며 샘플을 이미징하는 것과 동일한 보기에서 비드를 이미징할 필요가 없기 때문에 이 프로토콜을 사용하여 특정 관심 영역만 이미징할 수 있지만 전체 배아 대신 다른 각도에서 고배율로 이미징할 수 있습니다. 또한, 정합을 위해 시료 사이의 비드 정보를 사용하여 튜브에 수직으로 적층된 여러 시료를 이미징하기 위해 이 프로토콜을 쉽게 적용할 수 있습니다.
공개
저자는 경쟁 이해관계가 없음을 선언합니다.
감사의 말
우리는 물고기 시설의 유지 보수를 위해 Kalidas Kohale 박사와 그의 팀을, 그리고 광시트 현미경의 유지 보수를 위해 KV Boby에게 감사를 표합니다. SRN은 인도 정부 원자력부(DAE)의 재정 지원을 인정합니다(프로젝트 식별 번호). RTI4003, DAE OM no. 1303/2/2019/R\&D-II/DAE/2079 2020년 2월 11일자), 막스 플랑크 소사이어티 파트너 그룹 프로그램(M.PG. A MOZG0010) 및 과학 및 공학 연구 위원회 창업 연구 보조금(SRG/2023/001716).
자료
| Name | Company | Catalog Number | Comments |
| Agarose, low gelling temperature | Sigma-Aldrich | A9414 | |
| Calcium Chloride dihydrate | Sigma-Aldrich | 12022 | |
| FIJI | Version: ImageJ 1.54f | ||
| Latex beads, carboxylate-modified polystyrene, fluorescent red, 0.5 μm mean particle size, aqueous suspension | Sigma-Aldrich | L3280 | |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | |
| mMESSAGE mMACHINE SP6 Transcription kit | ThermoFischer Scientific | AM1340 | For in vitro transccription of H2A-mCherry plasmid |
| Potassium Chhloride | Sigma-Aldrich | P9541 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P0662 | |
| PTFE Sleeving AWG 15L - 1.58 mm ID x 0.15 mm Wall +/-0.05 | Adtech Innovations in Fluoroplastics | STW15 | PTFE tubes |
| Sodium Chloride | Sigma-Aldrich | S3014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | 71640 | |
| Ultrasonic Cleaner | Labman | LMUC3 | Ultrasonicator |
| Zeiss LightSheet 7 System | Zeiss |
참고문헌
- Wan, Y., McDole, K., Keller, P. J. Light sheet microscopy and its potential for understanding developmental processes. Annu Rev Cell Dev Biol. 35, 655-681 (2019).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Keller, P. J., et al. high-contrast imaging of animal development with scanned light sheet-based structured-illumination microscopy. Nat Methods. 7 (8), 637-642 (2010).
- Keller, P. J. Imaging morphogenesis: Technological advances and biological insights. Science. 340 (6137), 1234168(2013).
- Schmid, B., et al. High-speed panoramic Light sheet microscopy reveals global endodermal cell dynamics. Nat Commun. 4 (1), 2207(2013).
- Strnad, P., et al. Inverted Light sheet microscope for imaging mouse pre-implantation development. Nat Methods. 13 (2), 139-142 (2016).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Krzic, U., Gunther, S., Saunders, T. E., Streichan, S. J., Hufnagel, L. Multiview Light sheet microscope for rapid in toto imaging. Nat Methods. 9 (7), 730-733 (2012).
- Preibisch, S., Saalfeld, S., Schindelin, J., Tomancak, P. Software for bead-based registration of selective plane illumination microscopy data. Nat Methods. 7 (6), 418-419 (2010).
- Swoger, J., Verveer, P., Greger, K., Huisken, J., Stelzer, E. H. K. Multiview image fusion improves resolution in three-dimensional microscopy. Opt Express. 15 (13), 8029-8042 (2007).
- Swoger, J., Huisken, J., Stelzer, E. H. Multiple imaging axis microscopy improves resolution for thick-sample applications. Opt Lett. 28 (18), 1654-1656 (2003).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. J Vis Exp. (84), e51119(2014).
- Naganathan, S. R., Popović, M., Oates, A. C. Left-right symmetry of zebrafish embryos requires somite surface tension. Nature. 605 (7910), 516-521 (2022).
- Shah, G., et al. Multi-scale imaging and analysis identify pan-embryo cell dynamics of germlayer formation in zebrafish. Nat Commun. 10 (1), 5753(2019).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Hörl, D., et al. BigStitcher: Reconstructing high-resolution image datasets of cleared and expanded samples. Nat Methods. 16 (9), 870-874 (2019).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , University of Oregon Press. (2000).
- Icha, J., et al. Using light sheet fluorescence microscopy to image zebrafish eye development. J Vis Exp. (110), e53966(2016).
- Tomer, R., Khairy, K., Amat, F., Keller, P. J. Quantitative high-speed imaging of entire developing embryos with simultaneous multiview Light sheet microscopy. Nat Methods. 9 (7), 755-763 (2012).
- Aigouy, B., Prud'homme, B. Segmentation and quantitative analysis of epithelial tissues. Methods Mol Biol. 2540, 387-399 (2022).
- Mancini, L., et al. Apical size and deltaA expression predict adult neural stem cell decisions along lineage progression. Science Adv. 9, 7519(2023).
- Piscitello-Gomez, R., Mahmoud, A., Dye, N., Eaton, S. Sensitivity of the timing of Drosophila pupal wing morphogenesis to external perturbations. bioRxiv. , (2023).
- Tsuboi, A., Fujimoto, K., Kondo, T. Spatiotemporal remodeling of extracellular matrix orients epithelial sheet folding. Science Adv. 9, 2154(2023).
- Fu, Q., Martin, B. L., Matus, D. Q., Gao, L. Imaging multicellular specimens with real-time optimized tiling Light sheet selective plane illumination microscopy. Nat Commun. 7 (1), 11088(2016).
- Chen, B. C., et al. Lattice Light sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution. Science. 346 (6208), 1257998(2014).
- York, H. M., et al. Deterministic early endosomal maturations emerge from a stochastic trigger-and-convert mechanism. Nat Commun. 14 (1), 4652(2023).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Melançon, E., Liu, D. W. C., Westerfield, M., Eisen, J. S. Pathfinding by identified zebrafish motoneurons in the absence of muscle pioneers. J Neurosci. 17 (20), 7796(1997).
- Rohde, L. A., et al. Cell-autonomous timing drives the vertebrate segmentation clock's wave pattern. eLife. , 13:RP93764 (2024).
- Haynes, E. M., et al. KLC4 shapes axon arbors during development and mediates adult behavior. eLife. 11, e74270(2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유