Method Article
Обнаружение и количественное определение моно-рамнолипидов и ди-рамнолипидов, продуцируемых Pseudomonas aeruginosa
В этой статье
Резюме
Pseudomonas aeruginosa продуцирует рамнолипидные биоповерхностно-активные вещества. Тонкослойная хроматография обнаруживает и определяет долю моно- и дирамнолипидов, продуцируемых каждым штаммом. Количественное определение общего количества рамнолипидов включает в себя оценку эквивалентов рамнозы, присутствующих в этих биосурфактантах, экстрагированных из надосадочной жидкости культур с использованием метода орцинола.
Аннотация
Экологическая бактерия Pseudomonas aeruginosa является условно-патогенным микроорганизмом с высокой устойчивостью к антибиотикам, представляющим опасность для здоровья. Эта бактерия продуцирует высокие уровни биоповерхностно-активных веществ, известных как рамнолипиды (RL), которые представляют собой молекулы со значительной биотехнологической ценностью, но также связаны с вирулентными свойствами. В этом отношении обнаружение и количественная оценка ЛЛ могут быть полезны как для биотехнологических приложений, так и для биомедицинских исследовательских проектов. В этой статье мы пошагово демонстрируем метод детектирования продукции двух форм RL, продуцируемых P. aeruginosa с помощью тонкослойной хроматографии (TLC): монорамнолипидов (mRL), молекул, состоящих из димера жирных кислот (в основном C10-C10), связанных с одной группой рамнозы, и ди-рамнолипидов (dRL), молекул, состоящих из аналогичного димера жирных кислот, связанного с двумя группами рамнозы. Кроме того, мы представляем метод измерения общего количества RL, основанный на кислотном гидролизе этих биоповерхностно-активных веществ, экстрагированных из надосадочной жидкости культуры P. aeruginosa, и последующем обнаружении концентрации рамнозы, которая реагирует с орцином. Комбинация обоих методов может быть использована для оценки приблизительной концентрации mRL и dRL, продуцируемых конкретным штаммом, как показано здесь на примере типовых штаммов PAO1 (филогруппа 1), PA14 (филогруппа 2) и PA7 (филогруппа 3).
Введение
Pseudomonas aeruginosa является экологической бактерией и условно-патогенным микроорганизмом, вызывающим серьезную озабоченность из-за наличия у нее признаков, связанных с вирулентностью, и высокой устойчивости к антибиотикам 1,2. Характерным вторичным метаболитом, продуцируемым этой бактерией, является биосурфактант RL, который вырабатывается скоординированным образом с несколькими признаками, связанными с вирулентностью, такими как пиоцианин феназин, антибиотик с окислительно-восстановительной активностью, и протеаза эластаза3. Тензиоактивные и эмульгирующие свойства RL были использованы в различных промышленных приложениях и в настоящее время коммерциализируются4.
Большинство штаммов P. aeruginosa, принадлежащих к филогруппам 1 и 2, продуцируют два типа RL: mRL, который состоит из одной группы рамнозы, связанной с димером жирных кислот, в основном состоящим из 10 атомов углерода, и dRL, который содержит дополнительную группу рамнозы, связанную с первой рамнозой4 (см. рис. 1). Тем не менее, сообщалось, что две второстепенные филогруппы P. aeruginosa (группы 3 и 5) продуцируют только mRL 5,6. Эти два типа RL содержат смесь димеров жирных кислот, которые, как уже упоминалось, в основном представляют собой C10-C10, но также образуются меньшие доли молекул, содержащих димеры C12-C10, C12-C12 и C10-C12:1. Сообщается о характеристике конгенеров RL, продуцируемых различными штаммами с использованием ВЭЖХ, МС/МС 7,8. Методы, описанные в данной работе, позволяют дифференцировать только mRL и dRL, но не могут быть использованы для характеристики родственных соединений RL.
P. aeruginosa и некоторые виды Burkholderia являются естественными продуцентами RL9, но первая бактерия является наиболее эффективным продуцентом. Тем не менее, коммерчески используемый RL в настоящее время продуцируется в производных Pseudomonas putida KT2440, экспрессирующих гены P. aeruginosa, чтобы избежать использования этого условно-патогенного микроорганизма10,11. Обнаружение и количественное определение RL, продуцируемого P. aeruginosa, имеет большое значение для изучения молекулярных механизмов, участвующих в экспрессии признаков, связанных с вирулентностью12, в характеристике штаммов, принадлежащих к кладам 3 или 5,13, и для конструирования производных P. aeruginosa, которые в избытке продуцируют эти биоповерхностно-активные вещества, обладая при этом сниженной вирулентностью14. Производство биоповерхностно-активных веществ различными микроорганизмами было обнаружено на основе некоторых общих характеристик этих соединений, таких как метод капли коллапса или индекс эмульгирования15, но эти методы не являются ни точными, ни специфичными16.
В данной работе мы описываем протокол детектирования mRL и dRL с использованием жидкостной экстракции общего RL из супернатантов культур различных штаммов типа P. aeruginosa и разделения обоих типов RL с помощью TLC. В этом методе RL, выделенные из надосадочной жидкости культуры, разделяются по их дифференциальной растворимости в растворителях, используемых для TLC, вызывая дифференциальную миграцию на силикагелевой пластине. Таким образом, мРЛ имеют более быструю миграцию, чем дРЛ, и могут быть обнаружены как отдельные пятна при высыхании пластин и окрашивании α-нафтолом.
Описанный здесь метод выявления mRL и dRL методом TLC основан на ранее опубликованной статье17, который прост в исполнении и не требует дорогостоящего оборудования. Этот метод оказался полезным для обнаружения ЛЛ в различных изолятах 13 P. aeruginosa с использованием соответствующего контроля, такого как мутант, полученный из P. aeruginosa, неспособный продуцировать РЛ. Тем не менее, это не является предпочтительным методом для характеристики новых биоповерхностно-активных веществ, продуцируемых бактериями, отличными от Pseudomonas aeruginosa, из-за их недостаточной специфичности.
Кроме того, представлен метод количественной оценки рамнозных эквивалентов общего RL, экстрагированного из надосадочной жидкости культуры P. aeruginosa . Этот метод количественно определяет эти биоповерхностно-активные вещества на основе реакции орцина с восстановительными сахарами, в результате чего получается продукт, который может быть измерен спектрофотометрически при длине волны 421 нм, как описано ранее18. Поскольку реакция с орцинолом не является специфичной для рамнозы, важно выполнять этот метод с RL, экстрагированным из надосадочной жидкости культуры, которая не содержит значительных количеств других сахарсодержащих молекул, таких как липополисахариды (ЛПС). Для жидкой экстракции RL18 здесь используется подкисленная смесь хлороформа/метанола, но также можно использовать этилацетат, а твердофазная экстракция (SPE) дает оченьхорошие результаты. Описанный здесь метод орцина не требует сложного оборудования и может обеспечить надежные результаты, если его применять с особой тщательностью при подготовке анализируемых образцов, как уже говорилось. Чтобы обеспечить надлежащую подготовку образца, важно включить мутант Pseudomonas aeruginosa rhlA , неспособный продуцировать RL20 , и выполнить три биологические и три технические репликации для каждого определения.
В литературе16,21 существуют значительные разногласия относительно определения RL методом орцинола, при этом некоторые исследования предполагают, что продукция RL завышена и что анализу не хватает специфичности для рамнозы, что потенциально обнаруживает другие сахара. Тем не менее, мы демонстрируем здесь, что описанные методы могут быть точными и специфичными при соответствующих условиях. Кроме того, для сравнения с процедурами, описанными в этой статье, мы используем UPLC-MS/MS обнаружение стандарта dRL и демонстрируем, что аналогичные результаты получены с помощью метода орцина. Подробный протокол количественного определения RL с использованием этого метода включен в Дополнительный файл 1.
Эти протоколы иллюстрируются типовыми штаммами PAO1 (филогруппа 1), PA14 (филогруппа 2) и PA7 (филогруппа 3). Эти штаммы были выбраны потому, что они хорошо охарактеризованы и продуцируют различные профили RL.
протокол
Эта процедура схематизирована на дополнительном рисунке 1. Реагенты и оборудование, использованные для исследования, перечислены в Таблице материалов.
1. Обнаружение mRL и dRL в супернатантах культуры P. aeruginosa с помощью TLC
- Начните с центрифугированного бульона интересующего нас штамма P. aeruginosa , культивируемого в жидкой среде в течение 24 ч (чтобы достичь стационарной фазы роста, где образуется RL). Как правило, эти культуры содержат 1 х10 9 бактерий на мл.
- Отрегулируйте pH культуры до 2 с помощью концентрированной HCl.
- Поместите 5 мл подкисленной надосадочной жидкости культуры в полипропиленовую пробирку объемом 50 мл и добавьте 5 мл смеси хлороформа и метанола в соотношении 2:1.
- Перемешайте трубку путем инверсии три раза, каждый раз в течение 10 с, и оставьте трубку без инверсии на 2 минуты между каждым перемешиванием.
- Оставьте пробирку без перемешивания примерно на 3 часа, пока две фазы не разделятся, или центрифугируйте пробирку в течение 10 минут при 3 000 x g при 4 °C.
- Перенесите органическую фазу (нижний слой) в чистую пробирку и оставьте пробирку в вытяжном колпаке до тех пор, пока не наступит сухость.
- Повторите процесс, начиная с шага 1.3, поместив органическую фазу из второго хлороформа: экстракции метанола, в пробирку, которая использовалась при первой экстракции.
- Выпаривайте органическую фазу до тех пор, пока не останется 1 мл или 1,5 мл. Перенесите этот объем в центрифужную пробирку объемом 1,5 мл и выпарите растворитель до сухости в течение ночи.
- Добавьте 50 мкл метанола в высушенную пробирку для ресуспендирования RL.
- Провести тонкослойную хроматографию на пластинах с силикагелем.
ПРИМЕЧАНИЕ: Размер пластины TLC должен быть разрезан в соответствии с количеством образцов, которые будут анализироваться. Каждый образец следует наносить на расстоянии 1,5 см, а точка нанесения должна находиться на расстоянии 1 см от края пластины (карандашом нарисуйте горизонтальную линию). - Нанесите по 5 мкл каждого образца с помощью микропипетки объемом 10 мкл.
- Жидкая фаза TLC состоит из смеси хлороформ: метанол: уксусная кислота в соотношении 65:15:2. Чтобы приготовить 35 мл этой смеси, смешайте 26 мл хлороформа, 6 мл метанола и 0,8 мл 20% исходного раствора уксусной кислоты. Смешайте эти растворители и поместите их в закрытую камеру TLC не менее чем на 10 минут перед началом хроматографии, чтобы атмосфера насытилась летучими растворителями.
- Поместите пластину TLC в камеру, избегая контакта с местом, где были нанесены образцы.
- Закройте камеру и оставьте TLC до тех пор, пока растворитель не достигнет 1 см до края пластины. На этом этапе снимите пластину и дайте ей высохнуть (для ускорения процесса можно подать поток воздуха).
- Приготовьте раствор α-нафтола, растворив 5 г этого соединения в 33 мл этанола. После растворения добавьте 127,5 мл этанола, 12,6 мл воды и 20,5 мл холодного H2SO4.
- Чтобы обнаружить наличие mRL и dRL, распылите раствор α-нафтола на пластину в вытяжном шкафу и поместите распыленную пластину в духовку при температуре 85 °C на несколько минут, пока не станет заметным розоватый след от RL.
- Используйте изображение ТСХ, чтобы рассчитать долю моно- и ди-РЛ, присутствующих в каждом образце, с помощью программного обеспечения, которое определяет плотность каждого пятна.
2. Количественная оценка общего количества RL, измерение рамнозных эквивалентов, присутствующих в биосурфактанте
- Поместите 1,2 мл культуры в неподвижной фазе (выращенной в течение 24 ч) в центрифужную пробирку объемом 1,5 мл и центрифугируйте на 3 мин при 3000 x g при 4 °C. Соберите надосадочную жидкость в чистую пробирку.
- Переложите 333 мкл в чистую пробирку (выполните этот шаг в трех экземплярах) и добавьте 1 мл эфира.
- Энергично перемешиваем в вихре в течение 30 с. Повторяйте эту процедуру с одной трубкой за раз.
- Центрифугируйте в течение 2 минут при 3 000 x g при 4 °C. Соберите органическую фазу (верхнюю фазу), переложите ее в чистую пробирку и оставьте открытой в вытяжке до тех пор, пока не появится сухость.
- Повторите экстракцию эфиром, как описано в шаге 2.2. Повторите шаги 2.3 и 2.4.
- После полного высыхания добавьте по 1 мл воды в каждую трубку. Оставьте пробирки на 12 часов, чтобы дать RL гидратироваться, затем энергично перемешивайте в вихре.
- Поместите чистую колбу в лед на 5 минут (так как это экзотермическая реакция). Приготовьте раствор 60% Н2СО4 (беречь колбу от света).
- В чистой пробирке приготовьте 1,6% раствор орцина в дистиллированной воде. Для приготовления реагента орцинола смешайте 4,4 мл 60% раствора H2SO4 с 0,6 мл 1,6% раствора орцинола.
- Рассчитайте конечный объем необходимого реагента для орцинола. Добавьте 900 мкл этого реагента в каждый образец и к каждой концентрации калибровочной кривой, используя различные концентрации рамнозы (как правило, используются 9 концентраций рамнозы в диапазоне от 1 мкг/мл до 9 мкг/мл) и одну концентрацию 100 мкл воды, гарантируя, что все они выполняются в трех экземплярах.
- Добавьте 100 мкл каждого образца RL к 900 мкл реагента орцинола в стеклянной пробирке и смешайте два раствора.
- Выдерживать 30 мин на водяной бане, разогретой до 80 °С.
- Дайте трубкам остыть до комнатной температуры.
- Считывание коэффициента поглощения образцов и калибровочной кривой при длине волны 421 нм с помощью кварцевой ячейки.
- Рассчитайте концентрацию рамнозы в каждом образце путем интерполяции поглощения на калибровочной кривой и с учетом объема, использованного для определения.
- Чтобы рассчитать концентрацию μM, разделите полученную концентрацию в μг/мл на 182,2 (молекулярная масса рамнозы) и умножьте на 1000.
Результаты
В данной статье были использованы три различных типовых штамма P. aeruginosa для представления трех филогрупп, каждая из которых имеет различные уровни продукции RL и пропорции mRL и dRL. Эти штаммы включают PAO1 (раневой изолят из Австралии, 1955-22), PA14 (растительный изолят из США, 1977-23) и PA7 (клинический изолят из Аргентины, 2010-24). В качестве отрицательного контроля был использован мутант PAO1 rhlA, который не способен к продукции RL. Все штаммы культивировали в течение 24 ч в среде PPGAS, специально разработанной для повышения высокого уровня RL25 при 37 °C. Культуры PPGAS инокулировали при оптической плотности 0,05 при длине волны 600 нм с использованием культуры LB medium26 в течение ночи. Как правило, штаммы P. aeruginosa достигают оптической плотности 2, измеренной при длине волны 600 нм в среде PPGAS через 24 ч, что примерно соответствует 1 x 109 бактерий на мл. Для сбора надосадочной жидкости культур для детектирования и количественного определения RL культуры центрифугировали при 3000 x g при 4 °C в течение 15 мин, а клеточную гранулу отбрасывали. Результаты, полученные с помощью этих двух методов (рис. 2 и рис. 3), иллюстрируют, что как типы RL, продуцируемые каждым штаммом, так и количество их продукции различаются среди трех анализируемых штаммов. Как показано на рисунке 2, PAO1 продуцирует примерно 30% mRL и 70% dRL, в то время как PA14 продуцирует равное соотношение 50% mRL и 50% dRL, а PA7 продуцирует исключительно mRL. Данный профиль добычи RL согласуется с предыдущими отчетами12,14.
На рисунке 3А показано количество эквивалентов рамнозы, присутствующих в RL, продуцируемых каждым из этих трех типов штаммов. Из обнаруженных количеств рамнозы очевидно, что штамм PA14 продуцирует наибольшее количество RL, в то время как штамм PA7 продуцирует наименьшее количество. Однако эти результаты сами по себе не могут быть использованы для оценки μM концентрации RL, продуцируемой каждым штаммом. Кроме того, метод орцинола сам по себе не может обеспечить приблизительную концентрацию RL, поскольку он основан на характеристике пропорций mRL и dRL, продуцируемых каждым штаммом, представляющим интерес. Таким образом, для получения оценки μМ концентрации RL необходимо учитывать долю каждого типа RL, определенную в TLC, и включать стандартную кривую с различными концентрациями рамнозы (рис. 3B).
Метод орцина действительно может быть использован для количественного определения концентрации RL, когда производится только один тип этого биоповерхностно-активного вещества. В таких случаях μM концентрация обнаруженной рамнозы прямо соответствует μM концентрации mRL. Для dRL, поскольку две рамнозы образуются в результате гидролиза каждой молекулы dRL, концентрацию μM рамнозы, обнаруженной в RL, необходимо разделить на 2, чтобы получить их концентрацию μM (см. рис. 4).
Тем не менее, большинство штаммов P. aeruginosa продуцируют оба типа RL в различных пропорциях (как показано на рисунке 2), что позволяет определить только приблизительную концентрацию общего RL. Принимая это во внимание, мы оценили продукцию RL каждым штаммом следующим образом: для штамма PA7, поскольку он продуцирует только mRL, рамноза, входящая в состав RL (44,6 мкг/мл + 4,5 мкг/мл), прямо соответствует концентрации μМ (244,78), представляющей собой концентрацию этого биосурфактанта в надосадочной жидкости культуры, поскольку каждая молекула RL содержит одну часть рамнозы. Однако для штамма PAO1, хотя обнаруженная концентрация рамнозы составила 111,55 мкг/мл + 11,41 мкг/мл, только 30% соответствует мРЛ. Таким образом, 70% молекул RL содержат две рамнозы на молекулу. Для оценки концентрации RL концентрацию μM рамнозы (612,24) делили на 5, учитывая, что 1/5 соответствует концентрации μM mRL (122,49) и 2/5 (244,89) дRL. Таким образом, приблизительная μМ концентрация RL, продуцируемая этим штаммом, составляет 367,39.
Для штамма PA14 обнаруженная концентрация рамнозы составила 194,39 мкг/мл + 11,5 мкг/мл, что было переведено в концентрацию μМ (1 066,9) и разделено на 3. Результат представляет собой концентрацию каждого типа RL с учетом того, что каждый тип был произведен на 50% и что dRL содержит 2 рамнозы на молекулу. Таким образом, этот штамм продуцирует 355,63 мкМ мРЛ и ту же концентрацию дРЛ, в результате чего приблизительная мкм концентрация РЛ составляет 711,27, что почти в два раза больше, чем у штамма PAO1, и почти в три раза превышает концентрацию, производимую штаммом PA7.

Рисунок 1: Химический состав основных соединений моно-рамнолипидов и ди-рамнолипидов. (A) Моно-рамнолипиды. (Б) Ди-рамнолипиды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Обнаружение моно-рамнолипидов и ди-рамнолипидов с помощью тонкослойной хроматографии. (A) Изображение пластины TLC, показывающей стандарты RL и RL, продуцируемую штаммами PAO1, PA14, PA7 и мутантом ΔrhlA , производным из PAO1. (B) Оценка доли каждого типа RL (mRL и dRL) в каждом из образцов, протестированных в пункте (A), с использованием программного обеспечения ImageJ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Количественная оценка концентрации RL с использованием метода орцина. (A) Концентрация рамнозы (мкг/мл), содержащаяся в RL, экстрагированной из супернатантов культур штаммов PAO1 (черный бар), PA14 (светло-серый бар) и PA7 (темно-серый бар). Столбцы обозначают стандартное отклонение. (B) Калибровочная кривая рамнозы для эксперимента, показанного на рисунке (A). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
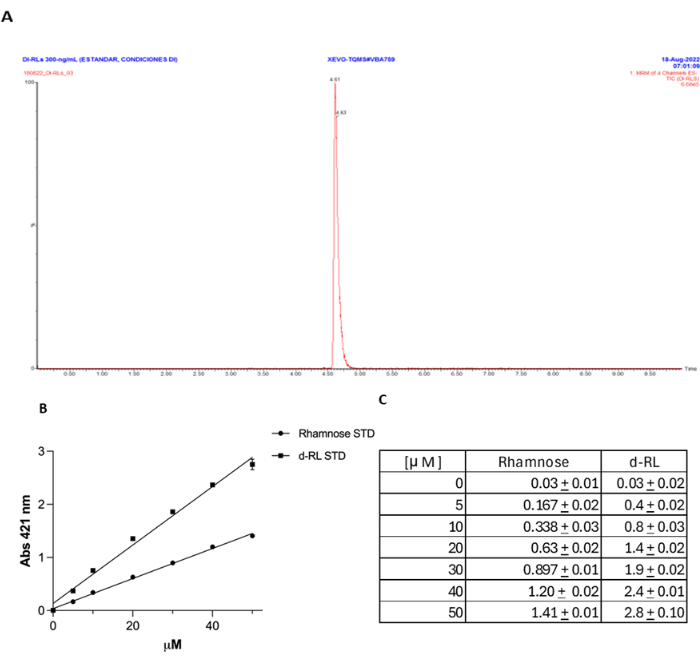
Рисунок 4: Валидация метода орцина в сравнении с UPLC-MS/MS для количественного определения dRL. (A) Стандарт dRL количественно определяли с использованием UPLC-MS/MS. (B) Метод орцинола сравнивали с концентрацией рамнозы, выраженной в мМ. (C) Та же мМ концентрация dRL, что и у рамнозы, дает примерно в два раза большую абсорбцию при 421 нм, как и ожидалось. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1: Схематическое изображение протокола. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Подробный протокол для количественного определения dRL с помощью UPLC-MS/MS. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Наиболее точным методом обнаружения и количественного определения RL является ВЭЖХ в сочетании с масс-спектрометрией (MS)7,8,27; Однако для этого требуется специализированное и дорогостоящее оборудование, которое может быть недоступно многим исследователям. Описанные здесь методы могут быть рутинно выполнены с использованием основных лабораторных материалов и оборудования для обнаружения и оценки концентраций RL, но они имеют некоторые ограничения, в частности, их неточность при определении смесей mRL и dRL. Кроме того, подготовка образца, используемого для количественного определения RL, должна быть выполнена тщательно. Культуры, используемые для обнаружения и количественного определения RL, не должны находиться в поздней стационарной фазе, так как клетки могут быть агрегированы или лизированы, что приведет к образованию неоднородных клеточных суспензий, которые могут вызвать вариабельность полученных результатов. Кроме того, клеточный мусор может мешать методу орцина.
Точные результаты могут быть получены при выполнении описанного протокола с соответствующими контрольными группами, такими как штамм Pseudomonas aeruginosa, неспособный продуцировать RL (например, мутант PAO1Δ rhlA 20, использованный в данной работе, рис. 2). Эти результаты полезны для характеристики различных изолятов P. aeruginosa 12,13, генетической модификации штаммов для увеличения продукции RL14 или изучения молекулярной генетики продукции RL различными изолятами P. aeruginosa 12.
Таким образом, описанные здесь методы могут быть использованы для характеристики штаммов Pseudomonas aeruginosa на предмет продукции ими факторов вирулентности и оценки их биотехнологического потенциала, особенно на ранних стадиях исследования. Важно отметить, что эти методы не предназначены для замены таких методов, как ВЭЖХ/МС, а скорее являются доступными методами для первоначальной характеристики штаммов и генетических манипуляций со штаммами P. aeruginosa .
Кроме того, если исследования сосредоточены на производстве RL в биомедицинских целях, важно признать, что продукция RL является лишь одним из нескольких факторов, продуцируемых Pseudomonas aeruginosa. Кроме того, тип производимых РЛ или количество их продукции не коррелируют строго с вирулентностью конкретного штамма, так как на вирулентность влияет множество факторов28.
Что касается воспроизводимости описанных здесь методов, особое внимание следует уделять при получении органических фаз как при определении ЛЛ с помощью ТСХ (шаг 1.6), так и при измерении ЛЛ с помощью метода орцинола (шаг 2.4). Даже небольшое количество другой фазы, взятой во время экстракции, может привести к значительному изменению полученных результатов. Экстракция RL из надосадочной жидкости культуры является важным этапом в достижении надежных и воспроизводимых результатов с помощью орцинолового метода. Крайне важно, чтобы при сборе органической фазы исключались интерфаза и жидкая фаза. Если эфирная фаза не полностью высушивается в течение 3 часов, она, скорее всего, содержит воду, что требует новой экстракции.
Использование метода орцина для количественного определения ЛЛ обсуждалось, с аргументами против его точности и специфичности. Утверждается, что РЛ часто переоцениваются, а метод не специфичен, так как орцинол может реагировать с различными сахарами, а не только с рамнозой. Имеющиеся данные показывают, что при эффективном извлечении RL из надосадочной жидкости культуры этот метод является специфичным, о чем свидетельствует отсутствие реакции при использовании мутанта rhlA в качестве отрицательного контроля. Однако, чтобы предоставить дополнительные доказательства точности метода в детектировании, независимо от процедуры экстракции, мы обнаружили стандарт dRL с помощью UPLC-MS/MS, как описано ранее27, и сравнили результаты, полученные с помощью методаорцинола 18 (Дополнительный файл 1, Рисунок 4A). Как сообщается18, мы обнаружили очень хорошую корреляцию между концентрацией RL, измеренной с помощью этого метода, где каждая обнаруженная концентрация dRL в μM соответствует примерно в два раза большей абсорбции при 421 нм, чем та же концентрация μM рамнозы (рис. 4B, C). Данный контрольный эксперимент наглядно демонстрирует точность данного метода количественного определения СО.
Тем не менее, из-за сложности измерения концентрации смесей mRL и dRL с помощью метода орцина, большинство публикаций сообщают о результатах в виде эквивалентов рамнозы в RL. Это значение может не иметь прямой корреляции с фактической концентрацией RL, как показано в представленных здесь примерах, но, тем не менее, оно служит полезным средством сравнения количеств RL в различных условиях, особенно при использовании одного и того же штамма P. aeruginosa .
Сообщалось об альтернативном методе количественного определения mRL и dRL, который основан на солюбилизации гидрофобного красителя Victoria Pure Blue BO, обычно используемого в шариковых ручках29. Этот способ является быстрым и недорогим. Тем не менее, этот протокол был разработан для количественной оценки гетерологичной продукции РЛ P. putida и не может быть использован с РЛ, продуцируемым P. aeruginosa, поскольку экспрессия синего токсина пиоцианина мешает этому методу.
Таким образом, описанные здесь методы представляют собой жизнеспособную альтернативу для обнаружения и количественного определения RL, продуцируемого P. aeruginosa, которая не требует сложного и дорогостоящего оборудования. Они обеспечивают практический подход для исследователей к оценке продукции RL в различных экспериментальных условиях.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Лаборатория GSCh частично поддерживается грантами IN201222 от Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT), Dirección General de Asuntos del Personal Académico -UNAM.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-NAPHTHOL | SIGMA-ALDRICH | 70442 | |
| ACETIC ACID | J.T. BAKER | 9508-02 | |
| CENTRIFUGE | For centrifuging tubes 1.5 mL and 50 mL | ||
| CHLOROFORM | J.T. BAKER | 9180-02 | |
| DRYING OVEN | |||
| ETHER | J.T. BAKER | 9244-02 | |
| GLASS PIPETTE | SIGMA-ALDRICH | CLS706510 | |
| HYDROCHLORIC ACID | J.T. BAKER | 5622-02 | |
| LB | |||
| L-RHAMNOSE MONOHYDRATE | SIGMA-ALDRICH | R-3875 | |
| METHANOL | J.T. BAKER | 9049-02 | |
| ORCINOL MONOHYDRATE | SIGMA-ALDRICH | O1875 | |
| PPGAS Broth | Tris HCL (0.12M), Potassium Chloride ( 0.02M) Ammonium Chloride (0.02M), Peptone (1%), pH 7.4 Autoclaved. Add Glucose (5%) and Magnesium Sulfate (0.0016M) | ||
| QUARTZ CELL (CUVETTE) | SIGMA-ALDRICH | Z276669 | |
| RECTANGULAR TLC DEVELOPING TANK | FISHER SCIENTIFIC | K4161801020 | |
| RHAMNOLIPIDS | SIGMA-ALDRICH | R-90 | |
| SPECTROPHOTOMETER | VIS | ||
| SPRAYER | SIGMA-ALDRICH | Z529710-1EA | |
| SULFURIC ACID | J.T. BAKER | 9681-02 | |
| TES TUBES 5mL | CORNING | 352002 | |
| TLC SILICA GEL 60 F254 | MERCK | 1.05554.0001 | |
| WATER BATH | > 80 °C |
Ссылки
- Moradali, M. F., Ghods, S., Rehm, B. H. A. Pseudomonas aeruginosa lifestyle: A paradigm for adaptation, survival, and persistence. Frontiers in Cell Infection and Microbiology. 7, 1-29 (2017).
- Gellatly, S. L., Hancock, R. E. W. Pseudomonas aeruginosa: New insights into pathogenesis and host defenses. Pathogens and Disease. 67 (3), 159-173 (2013).
- Williams, P., Cámara, M. Quorum sensing and environmental adaptation in Pseudomonas aeruginosa: a tale of regulatory networks and multifunctional signal molecules. Current Opinion in Microbiology. 12 (2), 182-191 (2009).
- Soberón-Chávez, G., González-Valdez, A., Soto-Aceves, M. P., Cocotl-Yañez, M. Rhamnolipids produced by Pseudomonas: From molecular genetics to the market. Microbial Biotechnology (MBT). 14 (1), 136-146 (2021).
- Freschi, L., et al. The Pseudomonas aeruginosa pan-genome provides new insights on its population structure, horizontal gene transfer, and pathogenicity. Genome Biology and Evolution. 11 (1), 109-120 (2019).
- Quiroz-Morales, S. E., García-Reyes, S., Ponce-Soto, G. Y., Servin-Gonzalez, L. Tracking the origins of Pseudomonas aeruginosa phylogroups by diversity and evolutionary analysis of important pathogenic marker genes. Diversity. 14 (5), 345 (2022).
- Déziel, E., et al. Liquid chromatography/mass spectrometry analysis of mixtures of rhamnolipids produced by Paeudomonas aeruginosa strain 57RP grown on mannitol or naphthalene. Biochemistry and Biophysic Acta. 1440 (2-3), 244-252 (1999).
- Abdel-Mawgoud, A. M., Lépine, F., Déziel, E. Rhamnolipids: Diversity of structures, microbial origins, and roles. Applied Microbiology and Biotechnology. 86 (5), 1323-1336 (2010).
- Toribio, J., Escalante, A. E., Soberón-Chávez, G. Production of rhamnolipids in bacteria other than Pseudomonas aeruginosa. European Journal of Lipid Science and Technology. 112, 1082-1087 (2010).
- Filbig, M., et al., Soberón-Chávez, G., et al. Metabolic and process engineering on the edge-Rhamnolipids are a true challenge: A review. Biosurfactants. Foundations and Frontiers in Enzymology. , 157-181 (2023).
- Noll, P., et al. Limits for sustainable biosurfactant production: Techno-economic and environmental assessment of a rhamnolipid production process. Bioresource Technology. 25, 101767 (2024).
- García-Reyes, S., Cocotl-Yañez, M., González-Valdez, A., Servín-González, L., Soberón Chávez, G. The PqsR-independent quorum-sensing response of Pseudomonas aeruginosa ATCC 9027 outlier-strain reveals new insights on the PqsE effect on RhlR activity. Molecular Microbiology. 116 (4), 1113-1123 (2021).
- Grosso-Becerra, M. V., et al. Pseudomonas aeruginosa ATCC 9027 is a non-virulent strain suitable for mono-rhamnolipids production. Applied Microbiology and Biotechnology. 100 (23), 9995-10004 (2016).
- Gutiérrez-Gómez, U., Soto-Aceves, M. P., Servín-González, L., Soberón-Chávez, G. Overproduction of rhamnolipids in Pseudomonas aeruginosa PA14 by redirection of the carbon flux from polyhydroxyalcanoate synthesis and overexpression of the rhlAB-R operon. Biotechnology Letters. 40 (11), 1561-1566 (2018).
- Zibek, S., Soberón-Chávez, G., Hausmann, R., Henkel, M. Overview on glycosylated lipids produced by bacteria and fungi: Rhamno-, Sophoro-, Mannosylerythritol and Cellobiose Lipids. Biosurfactants for a Biobased. Advances in Biochemical Engineering/Biotechnology. , 181 (2022).
- Twigg, M. S., et al. Microbial biosurfactant research: time to improve the rigour in the reporting of synthesis, functional characterization and process development. Microbial Biotechnology. 14 (1), 147-170 (2021).
- Matsuyama, T., Sogawa, M., Yano, I. Direct colony thin layer chromatography and rapid characterization of Serratia marscescens wetting agents. Applied and Environmental Microbiology. 53 (5), 1186-1188 (1987).
- Chandrasekaran, E. V., Bemiller, J. N. Constituent analyses of glycosaminoglycans. Methods on Carbohydrate Chemistry. 8, 89-96 (1980).
- Behrens, B., Engelen, J., Tiso, T., Blank, L. M., Hayen, H. Characterization of rhamnolipids by liquid chromatography/mass spectrometry after solid-phase extraction. Analytic and Bioanalytic Chemistry. 408 (10), 2505-2514 (2016).
- Rahim, R., et al. Cloning and functional characterization of the Pseudomonas aeruginosa rhlC gene that encodes rhamnosyltransferase 2, an enzyme responsible for di-rhamnolipid biosynthesis. Molecular Microbiology. 40 (3), 708-718 (2001).
- Irorere, V. U., Tripathi, L., Marchant, R., McClean, S., Banat, I. M. Microbial rhamnolipid production: A critical re-evaluation of published data and suggested future publication criteria. Applied Microbiology and Biotechnology. 101 (10), 3941-3951 (2017).
- Holloway, B. W. Genetic Recombination in Pseudomonas aeruginosa. Journal of General Microbiology. 13 (3), 572-581 (1955).
- Mathee, K. Forensic investigaction into the origin of Pseudomonas aeruginosa PA14-old but not lost. Journal of Medical Microbiology. 67 (8), 1019-1021 (2018).
- Roy, P. H., et al. Complete genome sequence of the multiresistant taxonomic outlier Pseudomonas aeruginosa PA7. PLoS ONE. 5, e8842 (2010).
- Zhang, Y., Miller, R. M. Enhanced octadecane dispersion and biodegradation by a Pseudomonas rhamnolipid surfactant (biosurfactant). Applied and Environmental Microbiology. 58 (10), 3276-3282 (1992).
- Miller, J. . Experiments in Molecular Genetics. , 352-355 (1992).
- Abdel-Mawgoud, A. M., Lépine, F., Déziel, E. Liquid chromatography/mass spectrometry for the identification and quantification of rhamnolipids. Pseudomonas Methods and Protocols. 30, 359-373 (2014).
- Lee, D. G., et al. Genomic analysis reveals that Pseudomonas aeruginosa virulence is combinatorial. Genome Biology. 7 (10), 90 (2006).
- Kubicki, S., et al. A straightforward assay for screening and quantification of biosurfactants in microbial culture supernatants. Frontiers in Bioengineering and Biotechnology. 8, 958 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены