Method Article
זיהוי וכימות של מונו-רמנוליפידים ודי-רמנוליפידים המיוצרים על ידי Pseudomonas aeruginosa
In This Article
Summary
Pseudomonas aeruginosa מייצר את biosurfactants rhamnolipid. כרומטוגרפיה בשכבה דקה מזהה וקובעת את שיעור המונו-רמנוליפידים והדי-רמנוליפידים המיוצרים על ידי כל זן. כימות של סך כל הרמנוליפידים כרוך בהערכת מקבילות של רמנוז הקיימות בביו-פעילי שטח אלה המופקים מתרבית העל-נאטנטים בשיטת אורצינול.
Abstract
החיידק הסביבתי Pseudomonas aeruginosa הוא פתוגן אופורטוניסטי בעל עמידות גבוהה לאנטיביוטיקה המהווה סכנה בריאותית. חיידק זה מייצר רמות גבוהות של ביו-פעילי שטח המכונים רמנוליפידים (RL), שהן מולקולות בעלות ערך ביוטכנולוגי משמעותי אך קשורות גם לתכונות אלימות. מבחינה זו, זיהוי וכימות של RL עשוי להיות שימושי הן עבור יישומים ביוטכנולוגיים והן עבור פרויקטים של מחקר ביו-רפואי. במאמר זה, אנו מדגימים שלב אחר שלב את הטכניקה לזיהוי הייצור של שתי צורות RL המיוצרות על ידי P. aeruginosa באמצעות כרומטוגרפיה שכבה דקה (TLC): מונו-רמנוליפידים (mRL), מולקולות המורכבות על ידי דימר של חומצות שומן (בעיקר C10-C10) הקשורות למויטי רמנוז אחד, ודי-רמנוליפידים (dRL), מולקולות המורכבות על ידי דימר חומצת שומן דומה המקושר לשני מואייטים של רמנוז. בנוסף, אנו מציגים שיטה למדידת הכמות הכוללת של RL בהתבסס על הידרוליזה חומצית של ביו-פעילי שטח אלה המופקים מסופרנאטנט תרבית P. aeruginosa והזיהוי הבא של ריכוז הרמנוז המגיב עם אורצינול. ניתן להשתמש בשילוב של שתי הטכניקות כדי להעריך את הריכוז המשוער של mRL ו-dRL המיוצר על ידי זן מסוים, כפי שמודגם כאן עם הזנים PAO1 (פילוגרופ 1), PA14 (פילוגרופ 2) ו-PA7 (פילוגרופ 3).
Introduction
Pseudomonas aeruginosa הוא חיידק סביבתי ופתוגן אופורטוניסטי בעל דאגה רבה בשל ייצורו של תכונות הקשורות לאלימות ועמידותו הגבוהה לאנטיביוטיקה 1,2. מטבוליט משני אופייני המיוצר על ידי חיידק זה הוא RL biosurfactant, אשר מיוצר באופן מתואם עם מספר תכונות הקשורות לאלימות כגון פנזין pyocyanin, אנטיביוטיקה עם פעילות חמצון-חיזור, ואת פרוטאז elastase3. תכונות הטנסיו-אקטיביות והתחליב של RL נוצלו ביישומים תעשייתיים שונים וכיום הן ממוסחרות4.
רוב זני P. aeruginosa, השייכים לקבוצות פילוגרופ 1 ו-2, מייצרים שני סוגים של RL: mRL, המורכב ממויטי רמנוז אחד המקושר לדימר חומצת שומן המורכב בעיקר מ-10 פחמנים, ו-dRL, המכיל רמנוז מואטי נוסף הקשור לרמנוז4 הראשון (ראו איור 1). עם זאת, דווח כי שתי קבוצות פילוגרופ מינוריות של P. aeruginosa (קבוצות 3 ו -5) מייצרות רק mRL 5,6. שני סוגי RL מכילים תערובת של דימרים של חומצות שומן, שכאמור הם בעיקר C10-C10, אך מיוצרים גם פרופורציות קטנות יותר של מולקולות המכילות דימרים C12-C10, C12-C12 ו-C10-C12:1. אפיון קונגנרי RL המיוצרים על ידי זנים שונים באמצעות HPLC MS/MS דווח 7,8. השיטות המתוארות בעבודה זו יכולות רק להבדיל בין mRL ו- dRL אך אינן יכולות לשמש לאפיון של קונגנרים RL.
P. aeruginosa וכמה מיני Burkholderia הם יצרנים טבעיים של RL9, אבל החיידק לשעבר הוא היצרן היעיל ביותר. עם זאת, RL בשימוש מסחרי מיוצר כיום בנגזרות Pseudomonas putida KT2440 המבטאות גנים P. aeruginosa כדי למנוע את השימוש בפתוגן אופורטוניסטיזה 10,11. לגילוי וכימות של RL המיוצר על ידי P. aeruginosa חשיבות רבה לחקר המנגנונים המולקולריים המעורבים בביטוי תכונות הקשורות לאלימות12, באפיון זנים השייכים לקלאדים 3 או 513, ובבניית נגזרות P. aeruginosa המייצרות יתר על המידה ביו-פעילי שטח אלה תוך הפחתת האלימות14. הייצור של biosurfactants על ידי מיקרואורגניזמים שונים זוהה מבוסס על כמה מאפיינים כלליים של תרכובות אלה, כגון שיטת נפילת קריסה או מדד תחליב15, אבל שיטות אלה אינן מדויקות או ספציפיות16.
במאמר זה אנו מתארים את הפרוטוקול לזיהוי mRL ו-dRL באמצעות מיצוי נוזלי של סך כל ה-RL מתרבית העל-נאטנטים של זנים שונים מסוג P. aeruginosa, וההפרדה של שני סוגי RL באמצעות TLC. בשיטה זו, ה-RL המופק מהתרבית מופרד על ידי המסיסות הדיפרנציאלית שלהם בממסים המשמשים ל-TLC, מה שגורם לנדידה דיפרנציאלית על צלחת ג'ל הסיליקה. לכן, mRL יש הגירה מהירה יותר מאשר dRL, והם יכולים להיות מזוהים כתמים נפרדים כאשר לוחות מיובשים ומוכתמים עם α-naphthol.
השיטה המתוארת כאן לאיתור mRL ו- dRL על ידי TLC מבוססת על מאמר17 שפורסם בעבר, שהוא קל לביצוע ואינו דורש ציוד יקר. שיטה זו הייתה שימושית לאיתור RL במבודדי P. aeruginosa שונים 13 באמצעות בקרות מתאימות, כגון מוטציה שמקורה ב-P. aeruginosa שאינה מסוגלת לייצר RL. עם זאת, זו אינה השיטה המועדפת לאפיון ביו-פעילי שטח חדשים המיוצרים על ידי חיידקים שאינם Pseudomonas aeruginosa בשל חוסר הספציפיות שלה.
בנוסף, מוצגת שיטה לכימות המקבילות של RL הכולל המופק מסופרנאטנט תרבית P. aeruginosa . שיטה זו מכמתת ביו-פעילי שטח אלה בהתבסס על התגובה של אורצינול עם סוכרים רדוקטיביים, וכתוצאה מכך נוצר מוצר שניתן למדוד ספקטרופוטומטרית ב-421 ננומטר, כפי שתואר קודם לכן18. מכיוון שהתגובה עם אורצינול אינה ספציפית לרמנוז, חשוב לבצע שיטה זו עם RL המופק מתרבית העל שאינה מכילה כמויות משמעותיות של מולקולות אחרות המכילות סוכר, כגון ליפופוליסכרידים (LPS). תערובת כלורופורם/מתנול חומצית משמשת כאן למיצוי נוזלי של RL18, אך ניתן להשתמש גם באתיל אצטט, ומיצוי בשלב מוצק (SPE) מניב תוצאות טובות מאוד19. שיטת האורצינול המתוארת כאן אינה דורשת ציוד מתוחכם ויכולה לספק תוצאות אמינות אם מבוצעת בזהירות מיוחדת בהכנת הדגימות המנותחות, כפי שנדון. כדי להבטיח הכנת דגימה נאותה, חשוב לכלול מוטנט Pseudomonas aeruginosa rhlA שאינו מסוגל לייצר RL20 ולבצע שלושה שכפולים ביולוגיים ושלושה טכניים לכל קביעה.
הייתה מחלוקת משמעותית בספרות16,21 לגבי קביעת RL בשיטת אורצינול, כאשר כמה מחקרים מציעים כי ייצור RL מוערך יתר על המידה וכי הבדיקה חסרה ספציפיות עבור rhamnose, פוטנציאל גילוי סוכרים אחרים. עם זאת, אנו מראים כאן כי השיטות המתוארות יכולות להיות מדויקות וספציפיות בתנאים המתאימים. יתר על כן, לצורך השוואה עם ההליכים המתוארים במאמר זה, אנו משתמשים בזיהוי UPLC-MS/MS של תקן dRL ומדגימים כי תוצאות דומות מתקבלות בשיטת אורצינול. הפרוטוקול המפורט לכימות RL בשיטה זו כלול בקובץ משלים 1.
פרוטוקולים אלה מודגמים באמצעות זני הסוג PAO1 (פילוגרופ 1), PA14 (פילוגרופ 2) ו-PA7 (פילוגרופ 3). זנים אלה נבחרו מכיוון שהם מאופיינים היטב ומייצרים פרופילי RL שונים.
Protocol
הליך זה מסוכם באיור משלים 1. הריאגנטים והציוד ששימשו למחקר מפורטים בטבלת החומרים.
1. זיהוי mRL ו-dRL בתרבית סופרנאטנטים של P. aeruginosa באמצעות TLC
- התחל עם מרק צנטריפוגה של זן P. aeruginosa של עניין, מעובד בתווך נוזלי במשך 24 שעות (כדי להגיע לשלב נייח של צמיחה שבו RL מיוצר). בדרך כלל, תרביות אלה מכילות 1 x 109 חיידקים לכל מ"ל.
- התאימו את רמת החומציות של התרבית ל-2 באמצעות HCl מרוכז.
- שים 5 מ"ל של supernatant תרבית acidified בצינור פוליפרופילן 50 מ"ל ולהוסיף 5 מ"ל של תערובת כלורופורם: מתנול 2: 1.
- יש לסעיר את הצינור על ידי היפוך שלוש פעמים, בכל פעם למשך 10 שניות, ולהשאיר את הצינור ללא היפוך למשך 2 דקות בין כל תסיסה.
- השאירו את הצינור ללא תסיסה למשך כ-3 שעות עד להפרדת שני השלבים, או צנטריפוגו את הצינור למשך 10 דקות בטמפרטורה של 3,000 x גרם ב-4°C.
- מעבירים את הפאזה האורגנית (שכבה תחתונה) לצינור נקי ומשאירים את הצינורית במכסה אדים עד להיווצרות יובש.
- חזור על התהליך החל משלב 1.3, לשים את השלב האורגני מן הכלורופורם השני: מיצוי מתנול, לתוך הצינור ששימש מיצוי הראשון.
- התאדו בשלב האורגני עד שנותרו 1 מ"ל או 1.5 מ"ל. מעבירים נפח זה לצינור צנטריפוגה בנפח 1.5 מ"ל ומאדים את הממס ליובש למשך הלילה.
- הוסף 50 μL של מתנול לצינור המיובש כדי להשהות מחדש את RL.
- בצע כרומטוגרפיה בשכבה דקה על לוחות ג'ל סיליקה.
הערה: יש לחתוך את גודל צלחת TLC בהתאם למספר הדגימות שינותחו. כל מדגם צריך להיות מיושם ב 1.5 ס"מ, ואת נקודת היישום צריך להיות 1 ס"מ מקצה הלוח (לצייר קו אופקי עם עיפרון). - יש למרוח 5 μL מכל דגימה באמצעות מיקרופיפטה של 10 μL.
- השלב הנוזלי TLC מורכב מתערובת 65:15:2 של כלורופורם: מתנול: חומצה אצטית. כדי להכין 35 מ"ל של תערובת זו, לערבב 26 מ"ל של כלורופורם, 6 מ"ל של מתנול, ו 0.8 מ"ל של תמיסת מלאי 20% של חומצה אצטית. ערבבו את הממסים הללו והניחו אותם בתא TLC סגור למשך 10 דקות לפחות לפני תחילת הכרומטוגרפיה, כך שהאטמוספירה רוויה בממיסים הנדיפים.
- הניחו את צלחת TLC לתוך התא, תוך הימנעות ממגע עם הנקודה שבה הדגימות יושמו.
- סגור את התא והשאר את TLC עד שהממס מגיע 1 ס"מ לפני קצה הצלחת. בשלב זה, להסיר את הצלחת ולתת לו להתייבש (זרימת אוויר ניתן להחיל כדי להאיץ את התהליך).
- הכן פתרון של α-naphthol על ידי המסת 5 גרם של תרכובת זו ב 33 מ"ל של אתנול. לאחר המסה, להוסיף 127.5 מ"ל של אתנול, 12.6 מ"ל של מים, ו 20.5 מ"ל של קר H2SO4.
- כדי לזהות נוכחות של mRL ו- dRL, רססו את תמיסת α-naphthol על הצלחת במכסה המנוע והניחו את הצלחת המרוססת בתנור בטמפרטורה של 85°C למשך מספר דקות עד שהסימן הוורדרד של RL ניכר.
- השתמש בתמונה של TLC כדי לחשב את היחס בין מונו ו- di-RL הקיימים בכל דגימה באמצעות תוכנה המזהה את הצפיפות של כל נקודה.
2. כימות הכמות הכוללת של RL המודדת את המקבילות לרמנוז הקיימות בביו-פעילי שטח
- מניחים 1.2 מ"ל של תרבית פאזה נייחת (גדלה במשך 24 שעות) בצינור צנטריפוגה 1.5 מ"ל וצנטריפוגה למשך 3 דקות ב 3,000 x גרם ב 4 ° C. אוספים את הסופרנאטנט בצינור נקי.
- מעבירים 333 μL לצינור נקי (בצעו שלב זה בשלשה) והוסיפו 1 מ"ל אתר.
- מערבבים במרץ במערבולת במשך 30 שניות. חזור על הליך זה עם צינור אחד בכל פעם.
- צנטריפוגה למשך 2 דקות ב-3,000 x גרם ב-4°C. אספו את הפאזה האורגנית (השלב העליון), העבירו אותה לצינורית נקייה והשאירו אותה פתוחה במכסה המנוע עד להיווצרות יובש.
- חזור על החילוץ באמצעות אתר כמתואר בשלב 2.2. חזור על שלבים 2.3 ו- 2.4.
- לאחר ייבוש מוחלט, להוסיף 1 מ"ל מים לכל צינור. השאירו את הצינורות למשך 12 שעות כדי לאפשר ל-RL להתייבש, ואז להתסיס במרץ במערבולת.
- מניחים בקבוק נקי בקרח למשך 5 דקות (מכיוון שמדובר בתגובה אקסותרמית). הכינו תמיסה של 60% H2SO4 (להגן על הבקבוק מפני אור).
- בצינור נקי, להכין תמיסת אורצינול 1.6% במים מזוקקים. כדי להכין את מגיב orcinol, לערבב 4.4 מ"ל של 60% H2SO4 פתרון עם 0.6 מ"ל של 1.6% תמיסת orcinol.
- חשב את הנפח הסופי של מגיב orcinol הדרוש. הוסף 900 μL של מגיב זה לכל דגימה ולכל ריכוז של עקומת הכיול, באמצעות ריכוזי rhamnose שונים (בדרך כלל, 9 ריכוזים של rhamnose משמשים בטווח של 1 מיקרוגרם / מ"ל עד 9 מיקרוגרם / מ"ל), ואחד עם 100 μL של מים, להבטיח כי כולם מבוצעים משולש.
- הוסף 100 μL של כל דגימת RL ל 900 μL של מגיב orcinol בצינור זכוכית ומערבבים את שתי התמיסות.
- יש לדגור במשך 30 דקות באמבט מים שחומם מראש ל-80 מעלות צלזיוס.
- תנו לצינורות להתקרר לטמפרטורת החדר.
- קרא את ספיגת הדגימות ועקומת הכיול ב- 421 ננומטר באמצעות תא קוורץ.
- חשב את ריכוז הרמנוז בכל דגימה על ידי אינטרפולציה של הספיגה על עקומת הכיול והתחשבות בנפח המשמש לקביעה.
- כדי לחשב את ריכוז μM, חלק את הריכוז המתקבל ב μg / mL ב 182.2 (המשקל המולקולרי של rhamnose) ולהכפיל ב 1000.
תוצאות
במאמר זה, שלושה זנים שונים מסוג P. aeruginosa שימשו כדי לייצג שלוש פילוקבוצות, כל אחת עם רמות ייצור RL שונות ופרופורציות שונות של mRL ו- dRL. זנים אלה כוללים PAO1 (מבודד פצע מאוסטרליה, 195522), PA14 (צמח מבודד מארה"ב, 197723), ו- PA7 (מבודד קליני מארגנטינה, 201024). כבקרה שלילית, נעשה שימוש במוטציה PAO1 rhlA, שאינה מסוגלת לייצר RL. כל הזנים טופחו במשך 24 שעות בתווך PPGAS, שתוכנן במיוחד כדי לקדם רמות RL גבוהות25, ב 37 ° C. תרביות PPGAS חוסנו בצפיפות אופטית של 0.05 ב-600 ננומטר באמצעות תרבית LB medium26 למשך הלילה. בדרך כלל, זני P. aeruginosa משיגים צפיפות אופטית של 2 הנמדדת ב-600 ננומטר בתווך PPGAS לאחר 24 שעות, המקבילה בערך ל-1 x 109 חיידקים למ"ל. כדי לאסוף את הסופרנאטנטים של התרבית לצורך גילוי וכימות RL, התרביות עברו צנטריפוגות בטמפרטורה של 3,000 x גרם ב-4°C למשך 15 דקות, וגלולת התא הושלכה. התוצאות שהתקבלו בשתי השיטות האלה (איור 2 ואיור 3) ממחישות שגם סוגי ה-RL המיוצרים על-ידי כל זן וגם כמות הייצור שלהם שונים בין שלושת הזנים שנותחו. כפי שמתואר באיור 2, PAO1 מייצר בערך 30% mRL ו-70% dRL, בעוד PA14 מייצר יחס שווה של 50% mRL ו-50% dRL, ו-PA7 מייצר mRL באופן בלעדי. פרופיל ייצור RL זה עקבי עם דוחות קודמים12,14.
איור 3A ממחיש את כמות המקבילות של רמנוז הקיימות ב-RL המיוצר על-ידי כל אחד משלושת סוגי הזנים האלה. מכמויות הרמנוז שזוהו, ניכר כי זן PA14 מייצר את הכמות הגבוהה ביותר של RL, בעוד שזן PA7 מייצר את הכמות הנמוכה ביותר. עם זאת, לא ניתן להשתמש בתוצאות אלה לבדן כדי להעריך את ריכוז המיקרומטר של RL המיוצר על ידי כל זן. בנוסף, שיטת אורצינול לבדה אינה יכולה לספק ריכוז RL משוער, שכן היא מסתמכת על אפיון הפרופורציות של mRL ו- dRL המיוצר על ידי כל זן מעניין. לכן, כדי לקבל אומדן של ריכוז המיקרומטר של RL, יש לקחת בחשבון את היחס של כל סוג RL שנקבע ב-TLC, ולכלול עקומה סטנדרטית עם ריכוזים שונים של רמנוז (איור 3B).
אכן ניתן להשתמש בשיטת האורצינול כדי לכמת את ריכוז ה-RL כאשר מיוצר רק סוג אחד של ביו-סורפקטנט זה. במקרים כאלה, ריכוז μM של rhamnose שזוהה מתאים ישירות לריכוז μM של mRL. עבור dRL, מאחר ששני רמנוזים מיוצרים על-ידי הידרוליזה של כל מולקולת dRL, ריכוז μM של רמנוז שמתגלה ב-RL צריך להיות מחולק ב-2 כדי לקבל את ריכוז ה-μM שלהם (ראו איור 4).
אולם רוב זני P. aeruginosa מייצרים את שני סוגי ה-RL בפרופורציות שונות (כפי שמוצג באיור 2), מה שמאפשר לקבוע רק ריכוז משוער של ה-RL הכולל. בהתחשב בכך, הערכנו את ייצור ה-RL בכל זן באופן הבא: עבור זן PA7, מאחר שהוא מייצר רק mRL, הרמנוז המהווה חלק מ-RL (44.6 מיקרוגרם/מ"ל + 4.5 מיקרוגרם/מ"ל) מתאים ישירות לריכוז ה-μM (244.78), המייצג את ריכוז הביו-פעילי שטח הללו בתרבית-על, שכן כל מולקולת RL מכילה מואטי רמנוז אחד. עם זאת, עבור זן PAO1, למרות שריכוז הרמנוז שזוהה היה 111.55 מיקרוגרם/מ"ל + 11.41 מק"ג/מ"ל, רק 30% מתאים ל-mRL. לכן, 70% ממולקולות ה-RL מכילות שני רמנוזים למולקולה. כדי להעריך את ריכוז ה-RL, ריכוז ה-μM rhamnose (612.24) חולק ב-5, בהתחשב בכך ש-1/5 מתאים לריכוז μM של mRL (122.49) ו-2/5 (244.89) ל-dRL. לפיכך, ריכוז μM המשוער של RL המיוצר על ידי זן זה הוא 367.39.
עבור זן PA14, ריכוז הרמנוז שזוהה היה 194.39 מיקרוגרם/מ"ל + 11.5 מק"ג/מ"ל, אשר הומר לריכוז המיקרומטר (1,066.9) וחולק ב-3. התוצאה מייצגת את הריכוז של כל סוג RL, בהתחשב בכך שכל סוג יוצר ב -50% וכי dRL מכיל 2 rhamnoses לכל מולקולה. לפיכך, זן זה מייצר 355.63 מיקרומטר של mRL וריכוז זהה של dRL, וכתוצאה מכך ריכוז μM משוער של RL של 711.27, כמעט פי שניים מזן PAO1 וכמעט פי שלושה מהריכוז המיוצר על ידי זן PA7.

איור 1: ההרכב הכימי של קונגנרים עיקריים של מונו-רמנוליפידים ודי-רמנוליפידים. (A) מונו-רמנוליפידים. (B) די-רמנוליפידים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: זיהוי מונו-רמנוליפידים ודי-רמנוליפידים באמצעות כרומטוגרפיה בשכבה דקה. (A) תמונה של לוח TLC המציג תקני RL, וה-RL המיוצר על-ידי הזנים PAO1, PA14, PA7 ומוטנט ΔrhlA הנגזר מ-PAO1. (B) הערכת היחס של כל סוג RL (mRL ו-dRL) בכל אחת מהדגימות שנבדקו ב-(A), באמצעות תוכנת ImageJ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: כימות ריכוז RL בשיטת אורצינול. (A) ריכוז רמנוז (מיקרוגרם/מ"ל) הכלול ב-RL המופק מזני התרבית PAO1 (סרגל שחור), PA14 (פס אפור בהיר) ו-PA7 (פס אפור כהה). הסורגים מציינים את סטיית התקן. (B) עקומת הכיול של הרמנוז עבור הניסוי המוצגת ב-(A). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
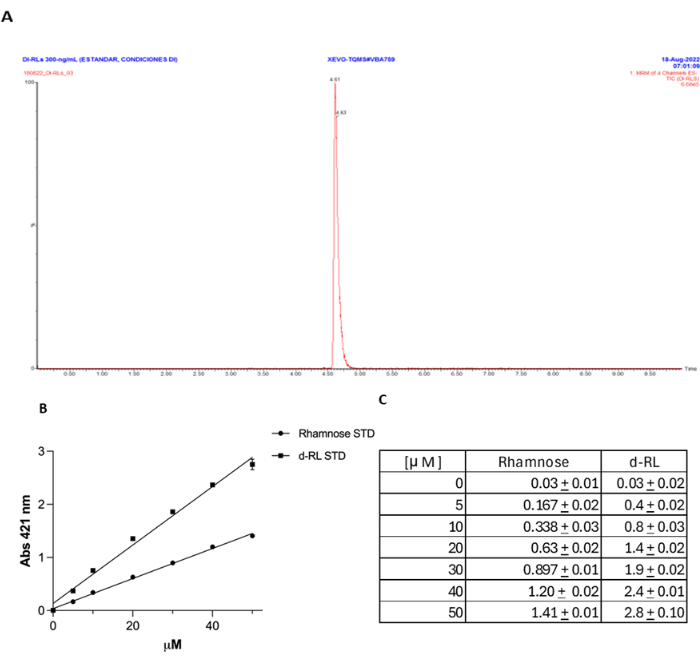
איור 4: אימות שיטת אורצינול בהשוואה ל-UPLC-MS/MS לכימות dRL. (A) תקן dRL כומת באמצעות UPLC-MS/MS. (B) שיטת האורצינול בהשוואה לריכוז הרמנוז המתבטא ב-mM. (C) אותו ריכוז mM של dRL כמו rhamnose נותן בערך פי שניים ספיגה ב 421 ננומטר, כצפוי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תרשים משלים 1: ייצוג סכמטי של הפרוטוקול. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: פרוטוקול מפורט לכימות dRL על ידי UPLC-MS/MS. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
השיטה המדויקת ביותר לגילוי וכימות RL היא HPLC בשילוב ספקטרומטריית מסות (MS)7,8,27; עם זאת, זה דורש ציוד מיוחד ויקר כי לא יכול להיות נגיש לחוקרים רבים. השיטות המתוארות כאן יכולות להתבצע באופן שגרתי עם חומרי מעבדה בסיסיים וציוד כדי לזהות ולהעריך ריכוזי RL, אך יש להן כמה מגבלות, במיוחד חוסר הדיוק שלהן בקביעת תערובות mRL ו- dRL. יתר על כן, הכנת המדגם המשמש לכימות RL צריכה להתבצע בקפידה. תרביות המשמשות לזיהוי וכימות RL לא צריכות להיות בשלב הנייח המאוחר, מכיוון שתאים עשויים להיות מצטברים או ליזה, וכתוצאה מכך מתלי תאים לא הומוגניים שעלולים לגרום לשונות בתוצאות המתקבלות. בנוסף, פסולת תאית עלולה להפריע לשיטת אורצינול.
ניתן לקבל תוצאות מדויקות כאשר הפרוטוקול המתואר מבוצע עם בקרות מתאימות, כגון זן Pseudomonas aeruginosa שאינו מסוגל לייצר RL (כמו מוטנט PAO1 ΔrhlA 20 המשמש בעבודה זו, איור 2). תוצאות אלה שימושיות לאפיון מבודדי P. aeruginosa שונים12,13, לשינוי גנטי של זנים כדי להגביר את ייצור RL14, או לחקר הגנטיקה המולקולרית של ייצור RL על ידי מבודדי P. aeruginosa שונים12.
לפיכך, ניתן להשתמש בשיטות המתוארות כאן כדי לאפיין זני Pseudomonas aeruginosa לייצור גורמי אלימות ולהעריך את הפוטנציאל הביוטכנולוגי שלהם, במיוחד בשלבים המוקדמים של המחקר. חשוב לציין כי שיטות אלה אינן מיועדות כתחליף לטכניקות כמו HPLC/MS אלא כטכניקות נגישות לאפיון ראשוני של זנים ומניפולציה גנטית של זני P. aeruginosa .
יתר על כן, אם המחקר מתמקד בייצור RL למטרות ביו-רפואיות, חשוב להכיר בכך שייצור RL הוא רק אחד מכמה גורמים המיוצרים על ידי Pseudomonas aeruginosa. בנוסף, סוג ה-RL המיוצר או כמות הייצור שלו אינם מתואמים באופן הדוק עם האלימות של זן מסוים, שכן אלימות מושפעת מגורמים מרובים28.
לגבי יכולת השחזור של השיטות המתוארות כאן, יש להקדיש תשומת לב מיוחדת בעת קבלת השלבים האורגניים הן בזיהוי RL על ידי TLC (שלב 1.6) והן במדידת RL בשיטת אורצינול (שלב 2.4). אפילו כמות קטנה של השלב השני שנלקח במהלך החילוץ יכול להוביל לשונות ניכרת בתוצאות המתקבלות. הפקת RL מתרבית העל היא שלב קריטי בהשגת תוצאות אמינות וניתנות לשחזור בשיטת אורצינול. חשוב מאוד שבעת איסוף הפאזה האורגנית, שלב הביניים והשלב הנוזלי אינם נכללים. אם שלב האתר אינו מתייבש לחלוטין תוך 3 שעות, סביר להניח שהוא מכיל מים, מה שמצריך שאיבה חדשה.
השימוש בשיטת אורצינול לכימות RL כבר שנוי במחלוקת, עם טיעונים נגד הדיוק והספציפיות שלה. נטען כי RL הם לעתים קרובות overestimated, ואת השיטה אינה ספציפית כמו orcinol יכול להגיב עם סוכרים שונים, לא רק rhamnose. הנתונים הנוכחיים מראים שאם RL מופק ביעילות מהסופרנטנט של התרבית, טכניקה זו היא ספציפית, כפי שמוצג על ידי חוסר התגובה כאשר מוטנט rhlA משמש כבקרה שלילית. עם זאת, כדי לספק ראיות נוספות לדיוק השיטה בזיהוי, ללא תלות בהליך החילוץ, זיהינו תקן dRL של UPLC-MS/MS כפי שתואר קודם לכן27, והשווינו את התוצאות שהתקבלו עם שיטת אורצינול18 (קובץ משלים 1, איור 4A). מצאנו, כפי שדווח18, מתאם טוב מאוד בין ריכוז ה-RL שנמדד בשיטה זו, כאשר כל ריכוז מיקרומטר של dRL שזוהה מקביל לספיגה כפולה בקירוב ב-421 ננומטר מאותו ריכוז μM של רמנוז (איור 4B,C). ניסוי בקרה זה מדגים בבירור את הדיוק של שיטה זו לכימות RL.
עם זאת, בשל האתגר של מדידת הריכוז של תערובות mRL ו- dRL בשיטת אורצינול, רוב הפרסומים מדווחים על התוצאות כמקבילות rhamnose ב- RL. ייתכן שלערך זה אין קשר ישיר עם ריכוז ה-RL בפועל, כפי שמודגם בדוגמאות המובאות כאן, אך בכל זאת, הוא משמש כאמצעי שימושי להשוואת כמויות RL בתנאים שונים, במיוחד כאשר משתמשים באותו זן P. aeruginosa .
דווח על שיטה חלופית לכימות mRL ו-dRL, המבוססת על מסיסות הצבע ההידרופובי Victoria Pure Blue BO, הנפוץ בעטים כדוריים29. שיטה זו מהירה וזולה. עם זאת, פרוטוקול זה פותח כדי לכמת את הייצור ההטרולוגי של RL על ידי P. putida והוא אינו ריאלי לשימוש עם RL המיוצר על ידי P. aeruginosa, כמו ביטוי של רעלן כחול pyocyanin מפריע לשיטה זו.
לסיכום, השיטות המתוארות כאן מציעות חלופה בת קיימא לאיתור וכימות של RL המיוצר על ידי P. aeruginosa שאינם דורשים ציוד מתוחכם ויקר. הם מספקים גישה מעשית לחוקרים להעריך את ייצור RL במגוון סביבות ניסוי.
Disclosures
למחברים אין ניגוד עניינים לחשוף.
Acknowledgements
המעבדה של GSCh נתמכת בחלקה על ידי IN201222 מענק מ- Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT), Dirección General de Asuntos del Personal Académico -UNAM.
Materials
| Name | Company | Catalog Number | Comments |
| 1-NAPHTHOL | SIGMA-ALDRICH | 70442 | |
| ACETIC ACID | J.T. BAKER | 9508-02 | |
| CENTRIFUGE | For centrifuging tubes 1.5 mL and 50 mL | ||
| CHLOROFORM | J.T. BAKER | 9180-02 | |
| DRYING OVEN | |||
| ETHER | J.T. BAKER | 9244-02 | |
| GLASS PIPETTE | SIGMA-ALDRICH | CLS706510 | |
| HYDROCHLORIC ACID | J.T. BAKER | 5622-02 | |
| LB | |||
| L-RHAMNOSE MONOHYDRATE | SIGMA-ALDRICH | R-3875 | |
| METHANOL | J.T. BAKER | 9049-02 | |
| ORCINOL MONOHYDRATE | SIGMA-ALDRICH | O1875 | |
| PPGAS Broth | Tris HCL (0.12M), Potassium Chloride ( 0.02M) Ammonium Chloride (0.02M), Peptone (1%), pH 7.4 Autoclaved. Add Glucose (5%) and Magnesium Sulfate (0.0016M) | ||
| QUARTZ CELL (CUVETTE) | SIGMA-ALDRICH | Z276669 | |
| RECTANGULAR TLC DEVELOPING TANK | FISHER SCIENTIFIC | K4161801020 | |
| RHAMNOLIPIDS | SIGMA-ALDRICH | R-90 | |
| SPECTROPHOTOMETER | VIS | ||
| SPRAYER | SIGMA-ALDRICH | Z529710-1EA | |
| SULFURIC ACID | J.T. BAKER | 9681-02 | |
| TES TUBES 5mL | CORNING | 352002 | |
| TLC SILICA GEL 60 F254 | MERCK | 1.05554.0001 | |
| WATER BATH | > 80 °C |
References
- Moradali, M. F., Ghods, S., Rehm, B. H. A. Pseudomonas aeruginosa lifestyle: A paradigm for adaptation, survival, and persistence. Frontiers in Cell Infection and Microbiology. 7, 1-29 (2017).
- Gellatly, S. L., Hancock, R. E. W. Pseudomonas aeruginosa: New insights into pathogenesis and host defenses. Pathogens and Disease. 67 (3), 159-173 (2013).
- Williams, P., Cámara, M. Quorum sensing and environmental adaptation in Pseudomonas aeruginosa: a tale of regulatory networks and multifunctional signal molecules. Current Opinion in Microbiology. 12 (2), 182-191 (2009).
- Soberón-Chávez, G., González-Valdez, A., Soto-Aceves, M. P., Cocotl-Yañez, M. Rhamnolipids produced by Pseudomonas: From molecular genetics to the market. Microbial Biotechnology (MBT). 14 (1), 136-146 (2021).
- Freschi, L., et al. The Pseudomonas aeruginosa pan-genome provides new insights on its population structure, horizontal gene transfer, and pathogenicity. Genome Biology and Evolution. 11 (1), 109-120 (2019).
- Quiroz-Morales, S. E., García-Reyes, S., Ponce-Soto, G. Y., Servin-Gonzalez, L. Tracking the origins of Pseudomonas aeruginosa phylogroups by diversity and evolutionary analysis of important pathogenic marker genes. Diversity. 14 (5), 345 (2022).
- Déziel, E., et al. Liquid chromatography/mass spectrometry analysis of mixtures of rhamnolipids produced by Paeudomonas aeruginosa strain 57RP grown on mannitol or naphthalene. Biochemistry and Biophysic Acta. 1440 (2-3), 244-252 (1999).
- Abdel-Mawgoud, A. M., Lépine, F., Déziel, E. Rhamnolipids: Diversity of structures, microbial origins, and roles. Applied Microbiology and Biotechnology. 86 (5), 1323-1336 (2010).
- Toribio, J., Escalante, A. E., Soberón-Chávez, G. Production of rhamnolipids in bacteria other than Pseudomonas aeruginosa. European Journal of Lipid Science and Technology. 112, 1082-1087 (2010).
- Filbig, M., et al., Soberón-Chávez, G., et al. Metabolic and process engineering on the edge-Rhamnolipids are a true challenge: A review. Biosurfactants. Foundations and Frontiers in Enzymology. , 157-181 (2023).
- Noll, P., et al. Limits for sustainable biosurfactant production: Techno-economic and environmental assessment of a rhamnolipid production process. Bioresource Technology. 25, 101767 (2024).
- García-Reyes, S., Cocotl-Yañez, M., González-Valdez, A., Servín-González, L., Soberón Chávez, G. The PqsR-independent quorum-sensing response of Pseudomonas aeruginosa ATCC 9027 outlier-strain reveals new insights on the PqsE effect on RhlR activity. Molecular Microbiology. 116 (4), 1113-1123 (2021).
- Grosso-Becerra, M. V., et al. Pseudomonas aeruginosa ATCC 9027 is a non-virulent strain suitable for mono-rhamnolipids production. Applied Microbiology and Biotechnology. 100 (23), 9995-10004 (2016).
- Gutiérrez-Gómez, U., Soto-Aceves, M. P., Servín-González, L., Soberón-Chávez, G. Overproduction of rhamnolipids in Pseudomonas aeruginosa PA14 by redirection of the carbon flux from polyhydroxyalcanoate synthesis and overexpression of the rhlAB-R operon. Biotechnology Letters. 40 (11), 1561-1566 (2018).
- Zibek, S., Soberón-Chávez, G., Hausmann, R., Henkel, M. Overview on glycosylated lipids produced by bacteria and fungi: Rhamno-, Sophoro-, Mannosylerythritol and Cellobiose Lipids. Biosurfactants for a Biobased. Advances in Biochemical Engineering/Biotechnology. , 181 (2022).
- Twigg, M. S., et al. Microbial biosurfactant research: time to improve the rigour in the reporting of synthesis, functional characterization and process development. Microbial Biotechnology. 14 (1), 147-170 (2021).
- Matsuyama, T., Sogawa, M., Yano, I. Direct colony thin layer chromatography and rapid characterization of Serratia marscescens wetting agents. Applied and Environmental Microbiology. 53 (5), 1186-1188 (1987).
- Chandrasekaran, E. V., Bemiller, J. N. Constituent analyses of glycosaminoglycans. Methods on Carbohydrate Chemistry. 8, 89-96 (1980).
- Behrens, B., Engelen, J., Tiso, T., Blank, L. M., Hayen, H. Characterization of rhamnolipids by liquid chromatography/mass spectrometry after solid-phase extraction. Analytic and Bioanalytic Chemistry. 408 (10), 2505-2514 (2016).
- Rahim, R., et al. Cloning and functional characterization of the Pseudomonas aeruginosa rhlC gene that encodes rhamnosyltransferase 2, an enzyme responsible for di-rhamnolipid biosynthesis. Molecular Microbiology. 40 (3), 708-718 (2001).
- Irorere, V. U., Tripathi, L., Marchant, R., McClean, S., Banat, I. M. Microbial rhamnolipid production: A critical re-evaluation of published data and suggested future publication criteria. Applied Microbiology and Biotechnology. 101 (10), 3941-3951 (2017).
- Holloway, B. W. Genetic Recombination in Pseudomonas aeruginosa. Journal of General Microbiology. 13 (3), 572-581 (1955).
- Mathee, K. Forensic investigaction into the origin of Pseudomonas aeruginosa PA14-old but not lost. Journal of Medical Microbiology. 67 (8), 1019-1021 (2018).
- Roy, P. H., et al. Complete genome sequence of the multiresistant taxonomic outlier Pseudomonas aeruginosa PA7. PLoS ONE. 5, e8842 (2010).
- Zhang, Y., Miller, R. M. Enhanced octadecane dispersion and biodegradation by a Pseudomonas rhamnolipid surfactant (biosurfactant). Applied and Environmental Microbiology. 58 (10), 3276-3282 (1992).
- Miller, J. . Experiments in Molecular Genetics. , 352-355 (1992).
- Abdel-Mawgoud, A. M., Lépine, F., Déziel, E. Liquid chromatography/mass spectrometry for the identification and quantification of rhamnolipids. Pseudomonas Methods and Protocols. 30, 359-373 (2014).
- Lee, D. G., et al. Genomic analysis reveals that Pseudomonas aeruginosa virulence is combinatorial. Genome Biology. 7 (10), 90 (2006).
- Kubicki, S., et al. A straightforward assay for screening and quantification of biosurfactants in microbial culture supernatants. Frontiers in Bioengineering and Biotechnology. 8, 958 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved