Method Article
Rilevamento e quantificazione di mono-ramnolipidi e di-ramnolipidi prodotti da Pseudomonas aeruginosa
In questo articolo
Riepilogo
Pseudomonas aeruginosa produce i biotensioattivi ramnolipidici. La cromatografia su strato sottile rileva e determina la proporzione di mono- e di-ramnolipidi prodotti da ciascun ceppo. La quantificazione dei ramnolipidi totali comporta la valutazione degli equivalenti di ramnosio presenti in questi biotensioattivi estratti dai surnatanti di coltura utilizzando il metodo dell'orcinolo.
Abstract
Il batterio ambientale Pseudomonas aeruginosa è un patogeno opportunista con un'elevata resistenza agli antibiotici che rappresenta un pericolo per la salute. Questo batterio produce alti livelli di biotensioattivi noti come ramnolipidi (RL), che sono molecole con un significativo valore biotecnologico ma sono anche associate a tratti di virulenza. A questo proposito, l'individuazione e la quantificazione dell'RL possono essere utili sia per applicazioni biotecnologiche che per progetti di ricerca biomedica. In questo articolo, dimostriamo passo dopo passo la tecnica per rilevare la produzione delle due forme di RL prodotte da P. aeruginosa mediante cromatografia su strato sottile (TLC): i mono-ramnolipidi (mRL), molecole costituite da un dimero di acidi grassi (principalmente C10-C10) legato a una frazione ramnosio, e i di-ramnolipidi (dRL), molecole costituite da un dimero simile di acidi grassi legato a due frazioni ramnosio. Inoltre, presentiamo un metodo per misurare la quantità totale di RL basato sull'idrolisi acida di questi biotensioattivi estratti da un surnatante di coltura di P. aeruginosa e il successivo rilevamento della concentrazione di ramnosio che reagisce con l'orcinolo. La combinazione di entrambe le tecniche può essere utilizzata per stimare la concentrazione approssimativa di mRL e dRL prodotti da un ceppo specifico, come esemplificato qui con i ceppi tipo PAO1 (filogruppo 1), PA14 (filogruppo 2) e PA7 (filogruppo 3).
Introduzione
Pseudomonas aeruginosa è un batterio ambientale e un patogeno opportunista di grande preoccupazione a causa della sua produzione di tratti associati alla virulenza e della sua elevata resistenza agli antibiotici 1,2. Un caratteristico metabolita secondario prodotto da questo batterio è il biotensioattivo RL, che viene prodotto in modo coordinato con diversi tratti associati alla virulenza come la fenazina piocianina, un antibiotico con attività redox, e la proteasi elastasi3. Le proprietà tensio-attive ed emulsionanti dell'RL sono state sfruttate in diverse applicazioni industriali e sono attualmente commercializzate4.
La maggior parte dei ceppi di P. aeruginosa, appartenenti ai filogruppi 1 e 2, produce due tipi di RL: mRL, che consiste in una porzione di ramnosio legata a un dimero di acidi grassi composto principalmente da 10 atomi di carbonio, e dRL, che contiene un'ulteriore porzione di ramnosio legata al primo ramnosio4 (vedi Figura 1). Tuttavia, è stato riportato che due filogruppi minori di P. aeruginosa (gruppi 3 e 5) producono solo mRL 5,6. I due tipi di RL contengono una miscela di dimeri di acidi grassi, che, come detto, sono principalmente C10-C10, ma vengono prodotte anche proporzioni minori di molecole contenenti dimeri C12-C10, C12-C12 e C10-C12:1. La caratterizzazione dei congeneri RL prodotti da diversi ceppi utilizzando HPLC MS/MS è stata riportata 7,8. I metodi descritti in questo lavoro possono solo distinguere tra mRL e dRL, ma non possono essere utilizzati per la caratterizzazione dei congeneri RL.
P. aeruginosa e alcune specie di Burkholderia sono produttori naturali di RL9, ma il primo batterio è il produttore più efficiente. Tuttavia, l'RL utilizzato commercialmente è attualmente prodotto in derivati di Pseudomonas putida KT2440 che esprimono geni di P. aeruginosa per evitare l'uso di questo patogeno opportunista10,11. La rilevazione e la quantificazione dei RL prodotti da P. aeruginosa sono di grande importanza per lo studio dei meccanismi molecolari coinvolti nell'espressione dei caratteri correlati alla virulenza12, nella caratterizzazione di ceppi appartenenti ai cladi 3 o 513 e per la costruzione di derivati di P. aeruginosa che sovraproducono questi biotensioattivi pur avendo una ridotta virulenza14. La produzione di biotensioattivi da parte di diversi microrganismi è stata rilevata sulla base di alcune caratteristiche generali di questi composti, come il metodo della goccia di collasso o l'indice di emulsione15, ma questi metodi non sono né accurati né specifici16.
Qui, descriviamo il protocollo per rilevare mRL e dRL utilizzando l'estrazione liquida di RL totale dai surnatanti di coltura di diversi ceppi di tipo P. aeruginosa e la separazione di entrambi i tipi di RL utilizzando TLC. In questo metodo, l'RL estratto dal surnatante di coltura viene separato dalla sua solubilità differenziale nei solventi utilizzati per la TLC, causando una migrazione differenziale sulla piastra di gel di silice. Pertanto, i mRL hanno una migrazione più rapida rispetto ai dRL e possono essere rilevati come punti separati quando le piastre vengono asciugate e colorate con α-naftolo.
Il metodo qui descritto per rilevare mRL e dRL mediante TLC si basa su un articolo17 pubblicato in precedenza, che è facile da eseguire e non richiede apparecchiature costose. Questo metodo è stato utile per rilevare RL in vari isolati di P. aeruginosa 13 utilizzando controlli appropriati, come un mutante derivato da P. aeruginosa incapace di produrre RL. Tuttavia, non è il metodo preferito per caratterizzare nuovi biotensioattivi prodotti da batteri diversi da Pseudomonas aeruginosa a causa della sua mancanza di specificità.
Inoltre, viene presentato un metodo per quantificare gli equivalenti ramnosio dell'RL totale estratto da un surnatante di coltura di P. aeruginosa . Questo metodo quantifica questi biotensioattivi sulla base della reazione dell'orcinolo con gli zuccheri riduttivi, ottenendo un prodotto che può essere misurato spettrofotometricamente a 421 nm, come descritto in precedenza18. Poiché la reazione con l'orcinolo non è specifica per il ramnosio, è importante eseguire questo metodo con RL estratto dal surnatante di coltura che non contiene quantità significative di altre molecole contenenti zucchero, come i lipopolisaccaridi (LPS). Per l'estrazione liquida di RL18 viene utilizzata una miscela acidificata di cloroformio/metanolo, ma può essere utilizzato anche l'acetato di etile e l'estrazione in fase solida (SPE) produce ottimi risultati19. Il metodo dell'orcinolo qui descritto non richiede apparecchiature sofisticate e può fornire risultati affidabili se eseguito con particolare cura nella preparazione dei campioni analizzati, come discusso. Per garantire un'adeguata preparazione del campione, è importante includere un mutante di Pseudomonas aeruginosa rhlA incapace di produrre RL20 ed eseguire tre repliche biologiche e tre repliche tecniche per ogni determinazione.
Ci sono state significative controversie in letteratura16,21 riguardo alla determinazione di RL con il metodo dell'orcinolo, con alcuni studi che suggeriscono che la produzione di RL è sovrastimata e che il test manca di specificità per il ramnosio, rilevando potenzialmente altri zuccheri. Tuttavia, dimostriamo qui che i metodi descritti possono essere accurati e specifici nelle condizioni appropriate. Inoltre, per il confronto con le procedure descritte in questo articolo, utilizziamo il rilevamento UPLC-MS/MS di uno standard dRL e dimostriamo che risultati simili si ottengono con il metodo orcinolo. Il protocollo dettagliato per quantificare l'RL utilizzando questo metodo è incluso nel file supplementare 1.
Questi protocolli sono esemplificati utilizzando i ceppi tipo PAO1 (filogruppo 1), PA14 (filogruppo 2) e PA7 (filogruppo 3). Questi ceppi sono stati scelti perché sono ben caratterizzati e producono diversi profili RL.
Protocollo
Questa procedura è schematizzata nella Figura 1 supplementare. I reagenti e le attrezzature utilizzate per lo studio sono elencati nella tabella dei materiali.
1. Rilevazione di mRL e dRL in surnatanti di coltura di P. aeruginosa mediante TLC
- Iniziare con il brodo centrifugato del ceppo di interesse P. aeruginosa , coltivato in terreno liquido per 24 ore (per raggiungere la fase stazionaria di crescita in cui viene prodotto RL). In genere, queste colture contengono 1 x 109 batteri per ml.
- Regolare il pH della coltura a 2 utilizzando HCl concentrato.
- Mettere 5 mL del surnatante di coltura acidificato in una provetta di polipropilene da 50 mL e aggiungere 5 mL di una miscela 2:1 di cloroformio: metanolo.
- Agitare il tubo per inversione tre volte, ogni volta per 10 s, e lasciare il tubo senza inversione per 2 minuti tra ogni agitazione.
- Lasciare la provetta senza agitazione per circa 3 ore fino a quando le due fasi non sono separate, oppure centrifugare la provetta per 10 minuti a 3.000 x g a 4 °C.
- Trasferire la fase organica (strato inferiore) in una provetta pulita e lasciare la provetta in una cappa di aspirazione fino a quando non si verifica la secchezza.
- Ripetere il processo a partire dal passaggio 1.3, inserendo la fase organica del secondo cloroformio: l'estrazione con metanolo, nella provetta utilizzata nella prima estrazione.
- Evaporare la fase organica fino a quando rimangono 1 mL o 1,5 mL. Trasferire questo volume in una provetta da centrifuga da 1,5 ml e far evaporare il solvente fino a renderlo asciutto durante la notte.
- Aggiungere 50 μl di metanolo alla provetta essiccata per risospendere l'RL.
- Eseguire cromatografia su strato sottile su piastre di gel di silice.
NOTA: La dimensione della lastra TLC deve essere tagliata in base al numero di campioni che verranno analizzati. Ogni campione deve essere applicato a 1,5 cm e il punto di applicazione deve essere a 1 cm dal bordo della lastra (tracciare una linea orizzontale con una matita). - Applicare 5 μl di ciascun campione utilizzando una micropipetta da 10 μl.
- La fase liquida TLC è costituita da una miscela 65:15:2 di cloroformio: metanolo: acido acetico. Per preparare 35 mL di questa miscela, mescolare 26 mL di cloroformio, 6 mL di metanolo e 0,8 mL di una soluzione madre al 20% di acido acetico. Mescolare questi solventi e metterli nella camera TLC chiusa per almeno 10 minuti prima di iniziare la cromatografia, in modo che l'atmosfera sia satura dei solventi volatili.
- Posizionare la piastra TLC nella camera, evitando il contatto con il punto in cui sono stati applicati i campioni.
- Chiudere la camera e lasciare il TLC fino a quando il solvente non raggiunge 1 cm prima del bordo della piastra. A questo punto togliete la piastra e lasciatela asciugare (si può applicare un flusso d'aria per accelerare il processo).
- Preparare una soluzione di α-naftolo sciogliendo 5 g di questo composto in 33 ml di etanolo. Una volta sciolto, aggiungere 127,5 ml di etanolo, 12,6 ml di acqua e 20,5 ml di H2SO4 freddo.
- Per rilevare la presenza di mRL e dRL, spruzzare la soluzione di α-naftolo sulla piastra della cappa di estrazione e porre la piastra spruzzata in forno a 85 °C per alcuni minuti fino a quando non è evidente il segno rosato di RL.
- Utilizza un'immagine del TLC per calcolare la proporzione di mono- e di-RL presente in ciascun campione utilizzando un software che rileva la densità di ogni spot.
2. Quantificazione della quantità totale di RL misurando gli equivalenti di ramnosio presenti nel biotensioattivo
- Porre 1,2 mL di coltura in fase stazionaria (coltivata per 24 ore) in una provetta da centrifuga da 1,5 mL e centrifugare per 3 minuti a 3.000 x g a 4 °C. Raccogliere il surnatante in una provetta pulita.
- Trasferire 333 μl in una provetta pulita (eseguire questo passaggio in triplice copia) e aggiungere 1 mL di etere.
- Mescolare energicamente a vortice per 30 s. Ripetere questa procedura con un tubo alla volta.
- Centrifugare per 2 minuti a 3.000 x g a 4 °C. Raccogliere la fase organica (fase superiore), trasferirla in una provetta pulita e lasciarla aperta nella cappa di aspirazione fino a quando non si verifica la secchezza.
- Ripetere l'estrazione con etere come descritto nel passaggio 2.2. Ripetere i passaggi 2.3 e 2.4.
- Una volta completamente asciugato, aggiungere 1 ml di acqua a ciascuna provetta. Lasciare i tubi per 12 ore per consentire all'RL di idratarsi, quindi agitare energicamente nel vortice.
- Mettere un pallone pulito nel ghiaccio per 5 minuti (poiché si tratta di una reazione esotermica). Preparare una soluzione al 60% di H2SO4 (proteggere il pallone dalla luce).
- In una provetta pulita, preparare una soluzione di orcinolo all'1,6% in acqua distillata. Per preparare il reagente orcinolo, mescolare 4,4 mL della soluzione di 60% H2SO4 con 0,6 mL della soluzione di orcinolo all'1,6%.
- Calcolare il volume finale del reagente orcinolo necessario. Aggiungere 900 μl di questo reagente a ciascun campione e a ciascuna concentrazione della curva di calibrazione, utilizzando diverse concentrazioni di ramnosio (in genere, vengono utilizzate 9 concentrazioni di ramnosio nell'intervallo da 1 μg/mL a 9 μg/mL) e una con 100 μL di acqua, assicurandosi che tutte vengano eseguite in triplice copia.
- Aggiungere 100 μl di ciascun campione di RL a 900 μl del reagente orcinolo in una provetta di vetro e mescolare le due soluzioni.
- Incubare per 30 minuti a bagnomaria preriscaldato a 80 °C.
- Lasciare raffreddare i tubi a temperatura ambiente.
- Leggere l'assorbanza dei campioni e la curva di calibrazione a 421 nm utilizzando una cella al quarzo.
- Calcolare la concentrazione di ramnosio in ciascun campione interpolando l'assorbanza sulla curva di calibrazione e considerando il volume utilizzato per la determinazione.
- Per calcolare la concentrazione di μM, dividere la concentrazione ottenuta in μg/mL per 182,2 (il peso molecolare del ramnosio) e moltiplicare per 1000.
Risultati
In questo articolo, sono stati utilizzati tre diversi ceppi di tipo P. aeruginosa per rappresentare tre filogruppi, ciascuno con diversi livelli di produzione di RL e proporzioni di mRL e dRL. Questi ceppi includono PAO1 (un isolato di ferita proveniente dall'Australia, 195522), PA14 (un isolato vegetale proveniente dagli Stati Uniti, 197723) e PA7 (un isolato clinico proveniente dall'Argentina, 201024). Come controllo negativo, è stato impiegato il mutante PAO1 rhlA, che è incapace di produrre RL. Tutti i ceppi sono stati coltivati per 24 ore in terreno PPGAS, specificamente progettato per promuovere alti livelli di RL25, a 37 °C. Le colture PPGAS sono state inoculate a una densità ottica di 0,05 a 600 nm utilizzando un terreno LB26 durante la notte. Tipicamente, i ceppi di P. aeruginosa raggiungono una densità ottica di 2 misurata a 600 nm in terreno PPGAS dopo 24 ore, che corrisponde all'incirca a 1 x 109 batteri per mL. Per raccogliere i surnatanti di coltura per la rilevazione e la quantificazione dell'RL, le colture sono state centrifugate a 3.000 x g a 4 °C per 15 minuti e il pellet cellulare è stato scartato. I risultati ottenuti utilizzando questi due metodi (Figura 2 e Figura 3) illustrano che sia i tipi di RL prodotti da ciascun ceppo che la quantità della loro produzione differiscono tra i tre ceppi analizzati. Come illustrato nella Figura 2, PAO1 produce circa il 30% di mRL e il 70% di dRL, mentre PA14 produce un rapporto uguale del 50% di mRL e del 50% dRL e PA7 produce esclusivamente mRL. Questo profilo di produzione RL è coerente con i precedenti rapporti12,14.
La Figura 3A illustra la quantità di ramnosio equivalenti presenti in RL prodotta da ciascuno di questi tre tipi di ceppi. Dalle quantità di ramnosio rilevate, è evidente che il ceppo PA14 produce la quantità più alta di RL, mentre il ceppo PA7 produce la quantità più bassa. Tuttavia, questi risultati da soli non possono essere utilizzati per stimare la concentrazione di μM di RL prodotta da ciascun ceppo. Inoltre, il metodo dell'orcinolo da solo non può fornire una concentrazione approssimativa di RL, poiché si basa sulla caratterizzazione delle proporzioni di mRL e dRL prodotte da ciascun ceppo di interesse. Pertanto, per ottenere una stima della concentrazione μM di RL, è necessario considerare la proporzione di ciascun tipo di RL determinata nella TLC e includere una curva standard con diverse concentrazioni di ramnosio (Figura 3B).
Il metodo dell'orcinolo può infatti essere utilizzato per quantificare la concentrazione di RL quando viene prodotto un solo tipo di questo biotensioattivo. In questi casi, la concentrazione di μM del ramnosio rilevato corrisponde direttamente alla concentrazione di μM di mRL. Per il dRL, poiché due ramnosi sono prodotte dall'idrolisi di ciascuna molecola di dRL, la concentrazione μM di ramnosio rilevata nel RL deve essere divisa per 2 per ottenere la loro concentrazione di μM (fare riferimento alla Figura 4).
Tuttavia, la maggior parte dei ceppi di P. aeruginosa produce entrambi i tipi di RL in proporzioni variabili (come mostrato nella Figura 2), rendendo possibile determinare solo una concentrazione approssimativa dell'RL totale. Tenendo conto di ciò, abbiamo stimato la produzione di RL per ciascun ceppo come segue: Per il ceppo PA7, poiché produce solo mRL, il ramnosio che fa parte di RL (44,6 μg/mL + 4,5 μg/mL) corrisponde direttamente alla concentrazione di μM (244,78), che rappresenta la concentrazione di questo biotensioattivo nel surnatante di coltura, poiché ogni molecola di RL contiene una porzione ramnosio. Tuttavia, per il ceppo PAO1, sebbene la concentrazione di ramnosio rilevata fosse di 111,55 μg/mL + 11,41 μg/mL, solo il 30% corrisponde a mRL. Pertanto, il 70% delle molecole RL contiene due ramnosi per molecola. Per stimare la concentrazione di RL, la concentrazione di μM di ramnosio (612,24) è stata divisa per 5, considerando che 1/5 corrisponde alla concentrazione di μM di mRL (122,49) e 2/5 (244,89) a dRL. Pertanto, la concentrazione approssimativa di μM di RL prodotta da questo ceppo è 367,39.
Per il ceppo PA14, la concentrazione di ramnosio rilevata era 194,39 μg/mL + 11,5 μg/mL, che è stata convertita nella concentrazione di μM (1.066,9) e divisa per 3. Il risultato rappresenta la concentrazione di ogni tipo di RL, considerando che ogni tipo è stato prodotto al 50% e che il dRL contiene 2 ramnosi per molecola. Pertanto, questo ceppo produce 355,63 μM di mRL e la stessa concentrazione di dRL, risultando in una concentrazione approssimativa di μM di RL di 711,27, quasi il doppio del ceppo PAO1 e quasi tre volte la concentrazione prodotta dal ceppo PA7.

Figura 1: Composizione chimica dei principali congeneri di mono-ramnolipidi e di-ramnolipidi. (A) Mono-ramnolipidi. (B) Di-ramnolipidi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Rilevazione di mono-ramnolipidi e di-ramnolipidi mediante cromatografia su strato sottile. (A) Immagine di una piastra TLC che mostra gli standard RL e l'RL prodotto dai ceppi PAO1, PA14, PA7 e dal mutante ΔrhlA derivato da PAO1. (B) Stima della proporzione di ciascun tipo di RL (mRL e dRL) in ciascuno dei campioni testati al punto (A), utilizzando il software ImageJ. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Quantificazione della concentrazione di RL con il metodo dell'orcinolo. (A) Concentrazione di ramnosio (μg/mL) contenuta nell'RL estratto dai surnatanti di coltura dei ceppi di PAO1 (barra nera), PA14 (barra grigio chiaro) e PA7 (barra grigio scuro). Le barre indicano la deviazione standard. (B) La curva di calibrazione del ramnosio per l'esperimento mostrato in (A). Clicca qui per visualizzare una versione più grande di questa figura.
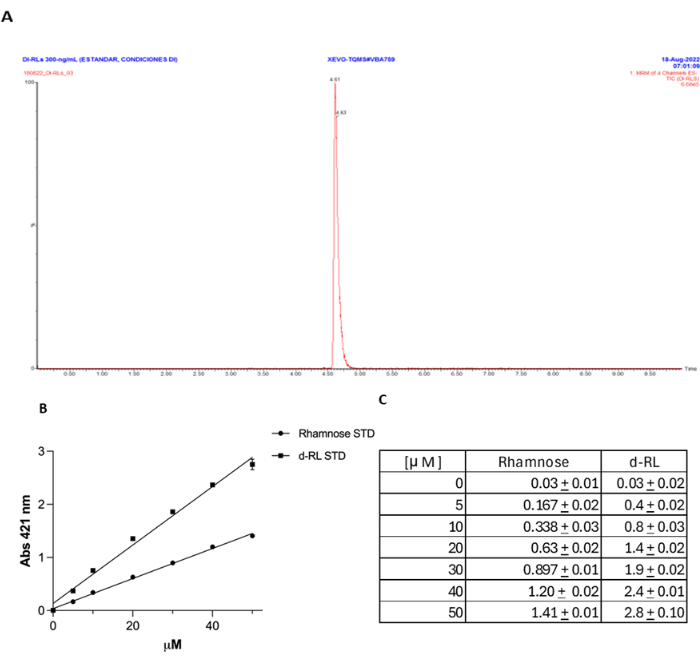
Figura 4: Convalida del metodo dell'orcinolo rispetto all'UPLC-MS/MS per la quantificazione del dRL. (A) Lo standard del dRL è stato quantificato utilizzando UPLC-MS/MS. (B) Il metodo dell'orcinolo rispetto alla concentrazione di ramnosio espressa in mM. (C) La stessa concentrazione mM di dRL del ramnosio fornisce circa il doppio dell'assorbanza a 421 nm, come previsto. Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Rappresentazione schematica del protocollo. Clicca qui per scaricare questo file.
File supplementare 1: Protocollo dettagliato per quantificare il dRL mediante UPLC-MS/MS. Clicca qui per scaricare questo file.
Discussione
Il metodo più accurato per rilevare e quantificare l'RL è l'HPLC accoppiato alla spettrometria di massa (MS)7,8,27; Tuttavia, richiede attrezzature specializzate e costose che potrebbero non essere accessibili a molti ricercatori. I metodi qui descritti possono essere eseguiti di routine con materiali e attrezzature di laboratorio di base per rilevare e stimare le concentrazioni di RL, ma presentano alcune limitazioni, in particolare la loro imprecisione nel determinare le miscele di mRL e dRL. Inoltre, la preparazione del campione utilizzato per la quantificazione RL deve essere eseguita con attenzione. Le colture utilizzate per la rilevazione e la quantificazione dei RL non devono trovarsi nella fase stazionaria tardiva, poiché le cellule potrebbero essere aggregate o lisizzate, con conseguente sospensione cellulare non omogenea che potrebbe causare variabilità nei risultati ottenuti. Inoltre, i detriti cellulari potrebbero interferire con il metodo dell'orcinolo.
Risultati accurati possono essere ottenuti quando il protocollo descritto viene eseguito con controlli appropriati, come un ceppo di Pseudomonas aeruginosa incapace di produrre RL (come il mutante PAO1 ΔrhlA 20 utilizzato in questo lavoro, Figura 2). Questi risultati sono utili per caratterizzare diversi isolati di P. aeruginosa 12,13, modificare geneticamente i ceppi per aumentare la produzione di RL14 o studiare la genetica molecolare della produzione di RL da parte di vari isolati di P. aeruginosa 12.
Pertanto, i metodi qui descritti possono essere utilizzati per caratterizzare i ceppi di Pseudomonas aeruginosa per la loro produzione di fattori di virulenza e valutare il loro potenziale biotecnologico, specialmente nelle prime fasi di indagine. È importante notare che questi metodi non sono intesi come sostituti di tecniche come HPLC/MS, ma piuttosto come tecniche accessibili per la caratterizzazione iniziale del ceppo e la manipolazione genetica dei ceppi di P. aeruginosa .
Inoltre, se l'obiettivo della ricerca è la produzione di RL per scopi biomedici, è fondamentale riconoscere che la produzione di RL è solo uno dei numerosi fattori prodotti da Pseudomonas aeruginosa. Inoltre, il tipo di RL prodotto o la quantità della loro produzione non è strettamente correlato alla virulenza di un particolare ceppo, poiché la virulenza è influenzata da molteplici fattori28.
Per quanto riguarda la riproducibilità dei metodi qui descritti, occorre prestare particolare attenzione quando si ottengono le fasi organiche sia nella rilevazione dell'RL mediante TLC (fase 1.6) che nella misurazione dell'RL utilizzando il metodo dell'orcinolo (fase 2.4). Anche una piccola quantità dell'altra fase assunta durante l'estrazione può portare a notevoli variazioni nei risultati ottenuti. L'estrazione di RL dal surnatante di coltura è un passaggio fondamentale per ottenere risultati affidabili e riproducibili con il metodo orcinolo. È fondamentale che nella raccolta della fase organica, l'interfase e la fase liquida siano escluse. Se una fase eterea non viene completamente essiccata entro 3 ore, è probabile che contenga acqua, rendendo necessaria una nuova estrazione.
L'uso del metodo dell'orcinolo per la quantificazione dell'RL è stato oggetto di dibattito, con argomenti contro la sua accuratezza e specificità. È stato affermato che gli RL sono spesso sopravvalutati e il metodo non è specifico in quanto l'orcinolo può reagire con diversi zuccheri, non solo con il ramnosio. I dati attuali dimostrano che se i RL vengono estratti in modo efficiente dal surnatante di coltura, questa tecnica è specifica, come dimostrato dalla mancanza di reazione quando il mutante rhlA viene utilizzato come controllo negativo. Tuttavia, per fornire ulteriori prove dell'accuratezza del metodo nel rilevamento, indipendentemente dalla procedura di estrazione, abbiamo rilevato uno standard dRL mediante UPLC-MS/MS come descritto in precedenza27 e abbiamo confrontato i risultati ottenuti con il metodo orcinolo18 (File supplementare 1, Figura 4A). Abbiamo trovato, come riportato18, un'ottima correlazione tra la concentrazione di RL misurata con questo metodo, dove ogni concentrazione di μM di dRL rilevata corrisponde a circa il doppio dell'assorbanza a 421 nm rispetto alla stessa concentrazione di μM di ramnosio (Figura 4B, C). Questo esperimento di controllo dimostra chiaramente l'accuratezza di questo metodo per la quantificazione RL.
Tuttavia, a causa della difficoltà di misurare la concentrazione di miscele di mRL e dRL con il metodo dell'orcinolo, la maggior parte delle pubblicazioni riporta i risultati come equivalenti di ramnosio in RL. Questo valore potrebbe non avere una correlazione diretta con l'effettiva concentrazione di RL, come illustrato negli esempi qui presentati, ma serve comunque come mezzo utile per confrontare le quantità di RL in condizioni diverse, specialmente quando si utilizza lo stesso ceppo di P. aeruginosa .
È stato riportato un metodo alternativo per la quantificazione di mRL e dRL, che si basa sulla solubilizzazione del colorante idrofobico Victoria Pure Blue BO, comunemente usato nelle penne a sfera29. Questo metodo è rapido ed economico. Tuttavia, questo protocollo è stato sviluppato per quantificare la produzione eterologa di RL da parte di P. putida e non è fattibile per l'uso con RL prodotto da P. aeruginosa, poiché l'espressione della tossina blu piocianina interferisce con questo metodo.
In sintesi, i metodi qui descritti offrono una valida alternativa per la rilevazione e la quantificazione dei RL prodotti da P. aeruginosa che non richiedono apparecchiature sofisticate e costose. Forniscono un approccio pratico ai ricercatori per valutare la produzione di RL in una varietà di contesti sperimentali.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi da rivelare.
Riconoscimenti
Il laboratorio di GSCh è sostenuto in parte da sovvenzioni IN201222 da Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT), Dirección General de Asuntos del Personal Académico -UNAM.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-NAPHTHOL | SIGMA-ALDRICH | 70442 | |
| ACETIC ACID | J.T. BAKER | 9508-02 | |
| CENTRIFUGE | For centrifuging tubes 1.5 mL and 50 mL | ||
| CHLOROFORM | J.T. BAKER | 9180-02 | |
| DRYING OVEN | |||
| ETHER | J.T. BAKER | 9244-02 | |
| GLASS PIPETTE | SIGMA-ALDRICH | CLS706510 | |
| HYDROCHLORIC ACID | J.T. BAKER | 5622-02 | |
| LB | |||
| L-RHAMNOSE MONOHYDRATE | SIGMA-ALDRICH | R-3875 | |
| METHANOL | J.T. BAKER | 9049-02 | |
| ORCINOL MONOHYDRATE | SIGMA-ALDRICH | O1875 | |
| PPGAS Broth | Tris HCL (0.12M), Potassium Chloride ( 0.02M) Ammonium Chloride (0.02M), Peptone (1%), pH 7.4 Autoclaved. Add Glucose (5%) and Magnesium Sulfate (0.0016M) | ||
| QUARTZ CELL (CUVETTE) | SIGMA-ALDRICH | Z276669 | |
| RECTANGULAR TLC DEVELOPING TANK | FISHER SCIENTIFIC | K4161801020 | |
| RHAMNOLIPIDS | SIGMA-ALDRICH | R-90 | |
| SPECTROPHOTOMETER | VIS | ||
| SPRAYER | SIGMA-ALDRICH | Z529710-1EA | |
| SULFURIC ACID | J.T. BAKER | 9681-02 | |
| TES TUBES 5mL | CORNING | 352002 | |
| TLC SILICA GEL 60 F254 | MERCK | 1.05554.0001 | |
| WATER BATH | > 80 °C |
Riferimenti
- Moradali, M. F., Ghods, S., Rehm, B. H. A. Pseudomonas aeruginosa lifestyle: A paradigm for adaptation, survival, and persistence. Frontiers in Cell Infection and Microbiology. 7, 1-29 (2017).
- Gellatly, S. L., Hancock, R. E. W. Pseudomonas aeruginosa: New insights into pathogenesis and host defenses. Pathogens and Disease. 67 (3), 159-173 (2013).
- Williams, P., Cámara, M. Quorum sensing and environmental adaptation in Pseudomonas aeruginosa: a tale of regulatory networks and multifunctional signal molecules. Current Opinion in Microbiology. 12 (2), 182-191 (2009).
- Soberón-Chávez, G., González-Valdez, A., Soto-Aceves, M. P., Cocotl-Yañez, M. Rhamnolipids produced by Pseudomonas: From molecular genetics to the market. Microbial Biotechnology (MBT). 14 (1), 136-146 (2021).
- Freschi, L., et al. The Pseudomonas aeruginosa pan-genome provides new insights on its population structure, horizontal gene transfer, and pathogenicity. Genome Biology and Evolution. 11 (1), 109-120 (2019).
- Quiroz-Morales, S. E., García-Reyes, S., Ponce-Soto, G. Y., Servin-Gonzalez, L. Tracking the origins of Pseudomonas aeruginosa phylogroups by diversity and evolutionary analysis of important pathogenic marker genes. Diversity. 14 (5), 345 (2022).
- Déziel, E., et al. Liquid chromatography/mass spectrometry analysis of mixtures of rhamnolipids produced by Paeudomonas aeruginosa strain 57RP grown on mannitol or naphthalene. Biochemistry and Biophysic Acta. 1440 (2-3), 244-252 (1999).
- Abdel-Mawgoud, A. M., Lépine, F., Déziel, E. Rhamnolipids: Diversity of structures, microbial origins, and roles. Applied Microbiology and Biotechnology. 86 (5), 1323-1336 (2010).
- Toribio, J., Escalante, A. E., Soberón-Chávez, G. Production of rhamnolipids in bacteria other than Pseudomonas aeruginosa. European Journal of Lipid Science and Technology. 112, 1082-1087 (2010).
- Filbig, M., et al., Soberón-Chávez, G., et al. Metabolic and process engineering on the edge-Rhamnolipids are a true challenge: A review. Biosurfactants. Foundations and Frontiers in Enzymology. , 157-181 (2023).
- Noll, P., et al. Limits for sustainable biosurfactant production: Techno-economic and environmental assessment of a rhamnolipid production process. Bioresource Technology. 25, 101767 (2024).
- García-Reyes, S., Cocotl-Yañez, M., González-Valdez, A., Servín-González, L., Soberón Chávez, G. The PqsR-independent quorum-sensing response of Pseudomonas aeruginosa ATCC 9027 outlier-strain reveals new insights on the PqsE effect on RhlR activity. Molecular Microbiology. 116 (4), 1113-1123 (2021).
- Grosso-Becerra, M. V., et al. Pseudomonas aeruginosa ATCC 9027 is a non-virulent strain suitable for mono-rhamnolipids production. Applied Microbiology and Biotechnology. 100 (23), 9995-10004 (2016).
- Gutiérrez-Gómez, U., Soto-Aceves, M. P., Servín-González, L., Soberón-Chávez, G. Overproduction of rhamnolipids in Pseudomonas aeruginosa PA14 by redirection of the carbon flux from polyhydroxyalcanoate synthesis and overexpression of the rhlAB-R operon. Biotechnology Letters. 40 (11), 1561-1566 (2018).
- Zibek, S., Soberón-Chávez, G., Hausmann, R., Henkel, M. Overview on glycosylated lipids produced by bacteria and fungi: Rhamno-, Sophoro-, Mannosylerythritol and Cellobiose Lipids. Biosurfactants for a Biobased. Advances in Biochemical Engineering/Biotechnology. , 181 (2022).
- Twigg, M. S., et al. Microbial biosurfactant research: time to improve the rigour in the reporting of synthesis, functional characterization and process development. Microbial Biotechnology. 14 (1), 147-170 (2021).
- Matsuyama, T., Sogawa, M., Yano, I. Direct colony thin layer chromatography and rapid characterization of Serratia marscescens wetting agents. Applied and Environmental Microbiology. 53 (5), 1186-1188 (1987).
- Chandrasekaran, E. V., Bemiller, J. N. Constituent analyses of glycosaminoglycans. Methods on Carbohydrate Chemistry. 8, 89-96 (1980).
- Behrens, B., Engelen, J., Tiso, T., Blank, L. M., Hayen, H. Characterization of rhamnolipids by liquid chromatography/mass spectrometry after solid-phase extraction. Analytic and Bioanalytic Chemistry. 408 (10), 2505-2514 (2016).
- Rahim, R., et al. Cloning and functional characterization of the Pseudomonas aeruginosa rhlC gene that encodes rhamnosyltransferase 2, an enzyme responsible for di-rhamnolipid biosynthesis. Molecular Microbiology. 40 (3), 708-718 (2001).
- Irorere, V. U., Tripathi, L., Marchant, R., McClean, S., Banat, I. M. Microbial rhamnolipid production: A critical re-evaluation of published data and suggested future publication criteria. Applied Microbiology and Biotechnology. 101 (10), 3941-3951 (2017).
- Holloway, B. W. Genetic Recombination in Pseudomonas aeruginosa. Journal of General Microbiology. 13 (3), 572-581 (1955).
- Mathee, K. Forensic investigaction into the origin of Pseudomonas aeruginosa PA14-old but not lost. Journal of Medical Microbiology. 67 (8), 1019-1021 (2018).
- Roy, P. H., et al. Complete genome sequence of the multiresistant taxonomic outlier Pseudomonas aeruginosa PA7. PLoS ONE. 5, e8842 (2010).
- Zhang, Y., Miller, R. M. Enhanced octadecane dispersion and biodegradation by a Pseudomonas rhamnolipid surfactant (biosurfactant). Applied and Environmental Microbiology. 58 (10), 3276-3282 (1992).
- Miller, J. . Experiments in Molecular Genetics. , 352-355 (1992).
- Abdel-Mawgoud, A. M., Lépine, F., Déziel, E. Liquid chromatography/mass spectrometry for the identification and quantification of rhamnolipids. Pseudomonas Methods and Protocols. 30, 359-373 (2014).
- Lee, D. G., et al. Genomic analysis reveals that Pseudomonas aeruginosa virulence is combinatorial. Genome Biology. 7 (10), 90 (2006).
- Kubicki, S., et al. A straightforward assay for screening and quantification of biosurfactants in microbial culture supernatants. Frontiers in Bioengineering and Biotechnology. 8, 958 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.