Method Article
Направленный нокдаун генов в сосудистом сплетении
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье мы опишем метод избирательного изменения экспрессии генов в сосудистом сплетении, избегая при этом какого-либо воздействия на другие области мозга.
Аннотация
Сосудистое сплетение (ЧП) служит важнейшими воротами для инфильтрации иммунных клеток в центральную нервную систему (ЦНС) как при физиологических, так и при патологических состояниях. Недавние исследования показали, что регуляция активности ChP может обеспечить защиту от заболеваний ЦНС. Тем не менее, изучение биологической функции ChP, не затрагивая другие области мозга, является сложной задачей из-за его тонкой структуры. В этом исследовании представлен новый метод нокдауна генов в тканях ChP с использованием аденоассоциированных вирусов (AAV) или белка рекомбиназы фермента циклизации (Cre), состоящего из последовательности TAT (CRE-TAT). Результаты показывают, что после введения AAV или CRE-TAT в боковой желудочек флуоресценция концентрировалась исключительно в ChP. Используя этот подход, исследование успешно сбило рецептор аденозинаА2А (A2AR) в ChP с помощью РНК-интерференции (РНК-интерференции) или Cre/локуса систем X-overP1 (Cre/LoxP) и показало, что этот нокдаун может облегчить патологию экспериментального аутоиммунного энцефаломиелита (ЭАЭ). Этот метод может иметь важное значение для будущих исследований роли ChP в заболеваниях ЦНС.
Введение
Часто считалось, что сосудистое сплетение помогает поддерживать функциональный гомеостаз мозга за счет секреции спинномозговой жидкости (ликвора) и нейротрофического фактора головного мозга (BDNF)1,2. Растущее количество исследований за последние три десятилетия показало, что ChP представляет собой особый путь инфильтрации иммунных клеток в центральную нервную систему (ЦНС).
Плотные соединения (ТЖ) ChP, состоящие из монослойного эпителия ChP, поддерживают иммунологический гомеостаз, предотвращая проникновение макромолекул и иммунных клеток в мозг3. Однако при определенных патологических состояниях ткань ChP обнаруживает и реагирует на опасные молекулярные паттерны (DAMPs) в ликворе и крови, что приводит к аномальной иммунной инфильтрации и дисфункции мозга 4,5. Несмотря на его важнейшую роль, небольшой размер ChP и уникальное расположение в мозге затрудняют изучение его функции, не затрагивая другие области мозга. Таким образом, манипулирование экспрессией генов именно в ChP является идеальным подходом к пониманию его функции.
Первоначально трансгенные линии фермента циклизационной рекомбинации (Cre), экспрессирующие Cre под контролем промоторов, специфичных для генов, экспрессируемых в ChP, обычно использовались для удаления генов-мишеней путем скрещивания с флоксированными генами-кандидатами 6,7,8. Например, транскрипционный фактор Forkhead box J1 (FoxJ1) экспрессируется исключительно в эпителии ChP пренатального мозга мыши7. Так, линия FoxJ1-Cre часто использовалась для удаления генов, расположенных в ChP 6,9. Однако успех этой стратегии в значительной степени зависит от специфики промоутера. Постепенно было обнаружено, что паттерн экспрессии FoxJ1 был недостаточно отчетливым, поскольку FoxJ1 также присутствовал в реснитчатых эпителиальных клетках в других частях мозга и периферической системы7. Для преодоления этого ограничения была проведена интрацеребровентрикулярная (ИКВ) инъекция Cre-рекомбиназы для доставки рекомбиназы в желудочки флоксированных трансгенных линий. Данная стратегия показала высокую специфичность, о чем свидетельствует наличие флуоресценции tdTomato исключительно в ткани ChP10,11. Однако этот метод все еще ограничен наличием флоксированных трансгенных линий мышей. Чтобы решить эту проблему, исследователи использовали ICV-инъекцию аденоассоциированного вируса (AAV) для достижения ChP-специфического нокдауна или гиперэкспрессии генов-мишеней12,13. Комплексная оценка различных серотипов AAV на ChP-инфекцию показала, что AAV2/5 и AAV2/8 проявляют сильные инфекционные способности в ChP, не инфицируя при этом другие области мозга. Тем не менее, было обнаружено, что AAV2/8 инфицирует окружающие эпендиму желудочки, в то время как группа AAV2/5 не показала инфекции14. Преимущество этого метода заключается в преодолении ограничений, связанных с приобретением флоксированных трансгенных животных.
В данной статье описан пошаговый протокол нокдауна гена в ChP с использованием двух методов: ICV AAV2/5, несущей шРНК рецептора аденозина А2А (А2А R) и белкаCre-рекомбиназы, состоящего из последовательности ТАТ (CRE-TAT) рекомбиназы для достижения ChP-специфического нокдауна A2AR. Результаты исследования свидетельствуют о том, что сбивание A2AR в ChP может облегчить экспериментальный аутоиммунный энцефаломиелит (ЭАЭ). Этот подробный протокол содержит полезные рекомендации для изучения функции ChP и специфического нокдауна генов в ChP.
протокол
Все процедуры с животными, описанные в этом исследовании, были проведены в соответствии с рекомендациями, изложенными в Руководстве NIH по уходу и использованию лабораторных животных и одобренными Комитетом по уходу и использованию животных в Медицинском университете Вэньчжоу.
1. Животные
- Приобретите самцов мышей C57BL/6 в возрасте 8-12 недель и весом 20-22 г.
- Получена трансгенная линия мышей Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9) и самцы мышей A2AR flox/flox .
- Случайным образом распределите мышей по двум группам и поместите их в клетки, максимум пять мышей в клетку, в соответствии со стандартным циклом 12 часов света / 12 часов темноты в течение 1 недели.
- Обеспечьте мышей достаточным количеством пищи и воды и поддерживайте их постоянную температуру 25 °C.
2. ChP-специфический нокдаун A 2ARs с AAV2/5-шРНК
- Взвесьте каждую мышку и запишите значения.
- Обезболивайте мышей внутрибрюшинно 1% пентобарбиталом натрия в дозировке 6-8 мл/кг, что эквивалентно 60-80 мг/кг пентобарбитала, и поместите мышь на грелку, чтобы она оставалась теплой.
ПРИМЕЧАНИЕ: Очень важно ввести правильную дозировку пентобарбитала натрия в соответствии с весом мыши, чтобы обеспечить успешную операцию. Анестезия не должна быть слишком глубокой, так как это может привести к летальному исходу, но и не должна быть слишком поверхностной, так как мышь может проснуться во время процедуры, что потенциально повлияет на эффективность инъекции вируса. Проверьте правильную дозу анестезии, ущипнув палец ноги и убедившись, что мыши не реагируют. - Используйте специализированную бритву для мышей, чтобы подстричь верхние волосы мышей, находящихся под наркозом.
- Нанесите глазную мазь на оба глаза, чтобы предотвратить высыхание, и зафиксируйте мышей на стереотаксическом аппарате, чтобы обездвижить мозг. Накройте животное стерильной простыней.
- Тщательно простерилизуйте кожу головы и шеи мышей тремя циклами йодофорного дезинфицирующего средства и 75% спирта, чтобы уменьшить послеоперационную инфекцию. Затем нанесите 1% лидокаин местно на кожу головы мышей и сделайте небольшой разрез, чтобы полностью обнажить череп под микроскопом.
ПРИМЕЧАНИЕ: Используйте стерильные инструменты на протяжении всей процедуры. - Подготовьте два шприца по 10 мкл: один с приобретенной AAV2/5-A2AR-shRNA (титр: 6,27 × 10 9 vg/мкл), а другой с приобретенным AAV2/5-Scramble (титр: 6,21 × 109 vg/мкл).
ПРИМЕЧАНИЕ: При использовании шприца передний конец должен быть подключен к стеклянному капилляру, и диапазон 10 мкл можно получить, контролируя длину стеклянного капилляра. - С помощью микроскопа найдите брегму и лямбду и установите координатную точку (AP: -0,58; ML: ±1.10; DL: -2,20) на шприце объемом 10 мкл (рис. 1). Координатная точка основана на стереотаксическом атласе мозга мыши15.
- Просверлите небольшое отверстие в черепе в скорректированной координатной точке.
ПРИМЕЧАНИЕ: Под микроскопом сверление выполняется стерильным микросверлом по поверхности черепа. После бурения, удаляя мозговые оболочки, покрывающие мозг, и обнажая нижележащую паренхиму мозга, предотвращается травмирование кровеносных сосудов. Этот шаг предотвращает разрыв кончика стеклянного капилляра мозговыми оболочками. Диаметр просверленного отверстия должен быть достаточным для того, чтобы кончик иглы мог войти в ткани мозга. - Ввести 2 мкл вируса AAV2/5-A2AR-shRNA в желудочек головного мозга путем боковой инъекции с постоянной скоростью 100 нл/мин. Держите иглу на месте в течение 10 минут перед извлечением. Отметим, что вирус вводился путем односторонней инъекции.
- Своевременно загерметизируйте поврежденную кожу с помощью медицинского биофибринового клея, чтобы предотвратить потерю вируса, который можно смыть спинномозговой жидкостью после удаления иглы, если клей не наносится быстро. Кроме того, не используйте ватные палочки для протирания ликвора, так как это также может привести к потере вируса.
- Чтобы облегчить восстановление, поместите мышь на грелку, чтобы поддерживать температуру тела на уровне 37,0 ± 0,5 °C, и нанесите 1% лидокаин местно на кожу головы мыши. Дайте мышам восстановиться в течение 2 недель, прежде чем индуцировать модель EAE, так как этот период необходим для экспрессии вируса AAV2/5-A 2A R-shRNA и последующего нокдауна A2AR.
3. ChP-специфичный нокдаун A 2AR с Cre/локусом системы X-overP1 (Cre/LoxP)
ПРИМЕЧАНИЕ: Следующие процедуры могут быть выполнены с помощью метода, описанного выше. Подробные методы впрыска см. в шагах 2.1-2.11.
- Ввести 2 мкл рекомбиназы CRE-TAT в каждый боковой желудочек мыши Rosa-LSL (Lox-StoP-Lox)-tdTomato в качестве экспериментальной группы и 2 мкл стерильного фосфатно-солевого буфера (PBS) в качестве контрольной группы. Используя тот же протокол, что и выше (раздел 2), введите 2 мкл рекомбиназы CRE-TAT в каждый из боковых желудочков мышей типа A2AR flox/flox вместе с 2 мкл стерильного PBS в качестве контрольной группы.
- Подготовьте замороженные срезы тканей и проведите ядерное окрашивание через 2 недели после инъекции рекомбиназы CRE-TAT. Дополнительные сведения см. в шагах 4.1-4.3.
4. Транскардиальная перфузия у мышей
- Вводят 60-80 мг/кг пентобарбитала натрия для глубокой анестезии мышей. Подтвердите плоскость анестезии щипком пальца ноги и выполните транскардиальную перфузию с использованием 40 мл стерильного раствора PBS с последующим введением 20 мл 4% параформальдегида (PFA).
ПРИМЕЧАНИЕ: На успешную перфузию указывает белый цвет печени, в то время как наличие увеличенных легких или оттока PBS изо рта во время перфузии указывает на неудачу процедуры. - Быстро извлекают мозг мыши, обеспечивая минимальную деградацию белка.
- Погрузите мозг мыши в 4% PFA/PBS на ночь для постфиксации с последующей заменой на 30% раствор сахарозы PB на 72 часа.
ПРИМЕЧАНИЕ: Очень важно избегать чрезмерного обезвоживания мозговой ткани, поэтому мозг не следует оставлять в растворе сахарозы PB слишком долго.
5. Срезы и окрашивание замороженных тканей
- Поместите ранее обезвоженный мозг мыши в клей с оптимальной температурой резки (OCT), заморозьте встроенный мозг и используйте скользящий микротом для вырезания корональных срезов толщиной 20 мкм.
- Поместите срезы мозга на предметное стекло. Как только срезы мозга высохнут, храните их в холодильнике при температуре -20 °C для последующих экспериментов.
- Поместите каждое предметное стекло в футляр и погрузите раму в контейнер, наполненный PBS, чтобы тщательно промыть предметное стекло. Аккуратно промойте предметные стекла раствором PBS три раза, каждый раз в течение 10 минут.
ПРИМЕЧАНИЕ: Следует соблюдать осторожность, чтобы предотвратить падение участков мозга со предметного стекла. - Окрасьте предметные стекла головного мозга раствором 4',6-диамидино-2-фенилиндола (DAPI) в течение 10 мин.
- Промыть предметные стекла мозга раствором PBS в течение 5 мин.
- Нанесите одну каплю монтирующего средства против затухания на участки мозга.
- Поместите покровное стекло на срезы мозга, запечатайте его лаком для ногтей и проанализируйте срезы с помощью обычного флуоресцентного микроскопа.
6. Индукция ЭАЭ
ПРИМЕЧАНИЕ: Выполняйте индукцию ЭАЭ через 2 недели после инъекции шРНК или CRE-TAT рекомбиназы11.
- Создают водный раствор, смешивая 2,5 мг гликопротеина олигодендроцитов миелина (MOG35-55) с 2 мл PBS. Приготовьте полный масляный раствор адъюванта Фройнда (CFA), смешав M. tuberculosis (H37Ra) с неполным адъювантом Freunds (IFA).
- Смешайте водный и масляный растворы в соотношении 1:1. Используйте тройник, чтобы взбить смесь до состояния масла в воде.
ПРИМЕЧАНИЕ: Тройник также называется трехходовой трубой. Это пластиковая трубка, которая может контролировать направление потока раствора для полного смешивания MOG35-55 и CFA. - Используйте высокоскоростной гомогенизатор для приготовления эмульсии антигена MOG для модели EAE в условиях ледяной бани.
- Обезболивают мышей внутрибрюшинно 1% пентобарбиталом натрия в дозировке 6-8 мл/кг, что эквивалентно 60-80 мг/кг пентобарбитала.
- Подкожно ввести эмульсию с антигеном MOG в четыре разные точки (шея, спина, левое и правое бедра) в объеме 10 мл/кг, всего четыре инъекции каждая.
ПРИМЕЧАНИЕ: Важно тщательно выбирать место инъекции, так как разные места могут по-разному влиять на заболеваемость и смертность мышей. Кроме того, повторные инъекции MOG могут привести к иммунной толерантности, поэтому исследовательская группа выбрала один метод инъекции, чтобы предотвратить эту потенциальную проблему. - Немедленно ввести 500 нг/мл коклюшного токсина (ПТ) внутрибрюшинно в дозировке 5 мг/кг после инъекции MOG.
ПРИМЕЧАНИЕ: ПТ повышает проницаемость гематоэнцефалического барьера (ГЭБ) и облегчает инфильтрацию Т-клеток в мозг. - Через 48 ч внутрибрюшинно вводят раствор ПТ в том же объеме.
7. Оценка неврологического дефицита
- Ежедневно оценивайте и оценивайте мышей по оценочной шкале 16 в диапазоне от 0 до15 для оценки частоты и тяжести ЭАЭ в соответствии со следующими неврологическими дефицитами:
Хвост: 0 указывает на отсутствие признаков, 1 означает полупарализованный хвост, а 2 указывает на полностью парализованный хвост.
Конечности: 0 указывает на отсутствие признаков, 1 означает слабую или измененную походку, 2 указывает на парез и 3 означает полностью парализованную конечность. - Присвойте парализованному животному, имеющему полный паралич, 12 баллов, а смертность — 15 баллов.
8. Окрашивание гематоксилин-эозином (H&E)
- Возьмите обезвоженный мышиный мозг и поместите его в расплавленный парафин. Дайте парафиновому блоку остыть и затвердеть для последующего использования.
ПРИМЕЧАНИЕ: Парафиновый блок должен быть полностью сухим и прохладным, чтобы избежать повреждения тканей. - Разрежьте блок парафина мозга мыши на предметные стекла толщиной 5 мкм. Поместите парафиновый срез мышиного мозга на предметное стекло и высушите его в духовке при температуре 60 °C в течение 3 часов.
- Погружают предметные стекла последовательно в раствор ксилола I на 10 мин, раствор ксилола II на 10 мин, 100% спирт I на 3 мин, 100% спирт II на 3 мин, 95% спирт на 3 мин, 90% спирт на 3 мин, 80% спирт на 3 мин, 70% спирт на 3 мин и дистиллированную воду на 1 мин.
9. Количественный анализ полимеразной цепной реакции (кПЦР)
- После перфузии мышей ПБС удаляют ЧП из желудочков и выделяют РНК с помощью Тризола. Синтезируйте кДНК с помощью первого набора для синтеза цепной кДНК.
- Проведите qPCR-анализ с использованием премикса Ex Taq SYBR-green и системы ПЦР в режиме реального времени. Используйте следующие грунтовки A2AR: форвард - GCCATCCCATTCGCCATCA; реверс - GCAATAGCCAAGAGGCTGAAGA.
Результаты
ChP-специфичный нокдаун A2AR путем ICV-инъекции AAV2/5-shRNA или CRE-TAT
РольА2АР в ЧП как мощного регулятора нейронной информации в патогенезе ЭАЭ остается неясной. Подавление экспрессии ChP-специфичного A 2A R может пролить свет на регуляторные эффекты A2AR на центральную иммунную систему при EAE и других воспалениях нервной системы. Вэтом исследовании использовалась внутривенная инъекция CRE-TAT для снижения экспрессии A 2A R в ChP мышей A2AR flox/flox. Для обеспечения специфичности ChP мы сначала вводили CRE-TAT в боковые желудочки мышей Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9). Изображения показывают, что спонтанная флуоресценция tdTomato была ограничена тканью ChP (рис. 2). Аналогичным образом, исследование вводило AAV2/5-CMV-A2AR-shRNA-CMV-усиленный зеленый флуоресцентный белок (EGFP) мышам C57BL/6 и обнаружило, что флуоресценция EGFP была ограничена слоем эпителиальных клеток ChP и не инфицировала окружающие паренхиматозные клетки вблизи боковых желудочков (рис. 3).
Индукция EAE с MOG35-55
Для индуцирования стабильной ЭАЭ мышам подкожно вводили эмульсию, состоящую из MOG35-55 и CFA, с последующим внутрибрюшинным введением ПТ на 0-е и 2-е сутки после иммунизации (рис. 4). Шкала клинических симптомов использовалась для ежедневной оценки баллов EAE в зависимости от состояния хвоста и конечностей. Начало ЭАЭ определялось как первый день с оценкой ЭАЭ ≥1, в то время как продолжительность между началом и пиковыми показателями ЭАЭ называлась прогрессирующей стадией.
ChP-специфический нокдаун A2AR облегчает патологию ЭАЭ
Чтобыизучить участие сигнала A 2A R в патологии EAE, в исследовании использовался ChP-специфичный нокдаун A2A R. В исследовании специально сбивали A2AR в ChP с помощью ICV-инъекции CRE-TAT или AAV2/5-A2AR-шРНК. Через 2 недели после нокдауна ЭАЭ индуцировали иммунизацией MOG35-55. Результаты показали, что по сравнению с контрольной группой у мышей с нокдауном A2AR развилась более легкая патология EAE, о чем свидетельствуют более низкие баллы и сниженная инфильтрация иммунных клеток в спинном мозге (рис. 5A,B,E,F). Кроме того, случайным образом были выбраны пять мышей, индуцированных ЭАЭ, из каждой группы на 20-й день после иммунизации MOG35-55. После перфузии PBS ЧП выделяли для экстракции РНК и кПЦР. АнализкПЦР показал, что уровни мРНК A 2A R были явно снижены в группах AAV2/5-shRNA (A2AR-Kd) и CRE-TAT по сравнению с каждой контрольной группой (рис. 5C, D).

Рисунок 1: Анатомическая локализация места инъекции бокового желудочка. (A) Схематическая схема, показывающая точку внедрения вируса. (B) Место инъекции бокового желудочка расположено на 0,58 мм ниже брегмы и на 1,1 мм латеральнее сагиттального шва, как указано красной точкой. (C) Изображение, показывающее место внедрения вируса в мышь. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
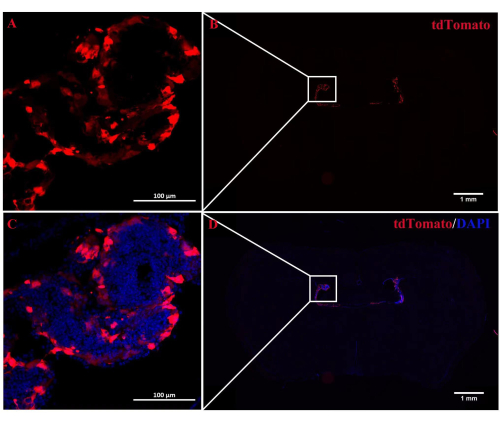
Рисунок 2: Локализация флуоресценции tdTomato в ChP . (A,B) Репрезентативное изображение мышей Rosa-LSL (Lox-StoP-Lox)-tdTomato, получавших ICV-инъекцию CRETAT. Через 2 недели аутофлуоресценция tdTomato была специфически локализована в ткани ChP (n = 3/группа). (С,Д) Объединенные изображения автофлуоресценции tdTomato и DAPI. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
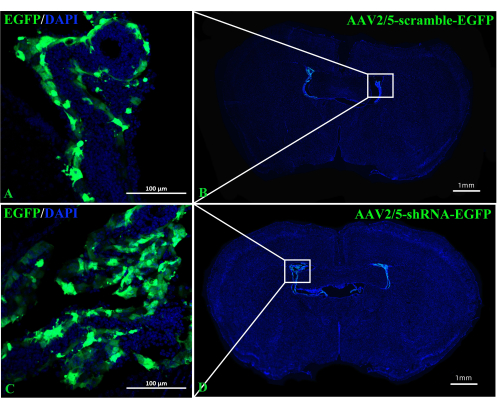
Рисунок 3: Репрезентативные изображения мышей C57BL/6, сделанные через 2 недели после введения ICV AAV2/5-scramble-EGFP или AAV2/5-shRNA-EGFP. (A,B) Репрезентативные изображения мышей, которым вводили AAV2/5-scramble-EGFP (n = 3/группа). (С,Д) Репрезентативные изображения мышей, которым вводили AAV2/5-shRNA-EGFP (n = 3/группа). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Индукция модели EAE. (А) Во-первых, эмульсия антигена MOG вводится подкожно в четыре различных места (шея, спина, левое и правое бедра), которые обозначаются красными точками. (Б) ПТ вводится внутрибрюшинно во время иммунизации и повторяется через 2 дня. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5: ChP-специфический нокдаун A 2A R облегчал патологию EAE. (A) ChP-специфичный нокдаун A 2A R у мышей A 2AR flox/flox, достигнутый путем введения ICV CRE-TAT, приводил к снижению клинических показателей EAE (n = 6-7/группа). Статистический анализ проводили с использованием двустороннего RM ANOVA с последующим множественным сравнительным тестом Сидака. (B) ChP-специфичный нокдаун A2AR у мышей дикого типа (WT), достигнутый с помощью ICV-инъекции AAV2/5-shRNA, снижал клинические показатели EAE (n = 7-8/группа). Статистический анализ проводили с использованием двустороннего RM ANOVA с последующим множественным сравнительным тестом Сидака. (С,Д) Результаты кПЦР-анализа уровней мРНКА2АР в ткани ХП (n = 5/группа). Статистический анализ проводили с помощью непарного t-критерия. (Д,Ж) Окрашивание H&E. ChP-специфический нокдаун A2AR ослаблял инфильтрацию иммунных клеток в спинной мозг. Статистическая значимость представлена как ###p < 0,001, **p < 0,01 и ***p < 0,001. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
В исследовании были представлены два различных подхода к направленному нокдауну генов ChP. Первый подход включал в себя ICV-инъекцию CRE-TAT, содержащей Cre-рекомбиназу, мышам линии A2AR flox/flox . Второй подход заключался в введении ICV AAV2/5, несущей шРНКA2AR. Используяэти две стратегии, в работе был достигнут селективный нокдаун A 2A R в ChP и удалось продемонстрировать защитные эффекты ингибирования передачи сигналов A2AR в ChP на патологию EAE. Следует отметить, что этот протокол включает в себя два важных этапа. Во-первых, необходима операция стереотаксической локализации, и значительное отклонение от предложенных координат может привести к случайным сбоям. Во-вторых, объем вводимого вируса имеет решающее значение, так как было обнаружено, что введение менее 1 мкл вируса (~6 x 1012) также имеет определенную вероятность неудачи. Возможно, это связано с необходимостью достаточного количества вирусных частиц для достаточного заражения.
Использование системы Cre/LoxP не позволило наблюдать точное распределение CRE-TAT-рекомбиназы в головном мозге после инъекции ICV. В результате в исследовании использовались мыши Rosa-LSL (Lox-StoP-Lox)-tdTomato для отслеживания распределения CRE-TAT с использованием автофлуоресценции белка tdTomato. Флуоресценция tdTomato была локализована исключительно в тканях ChP через 2 недели после инъекции CRE-TAT интрацеребровентрикулярно, что указывает на то, что рекомбиназа в первую очередь поглощалась ChP. Далее мышам линии A 2A R flox/flox вводили CRE-TAT, и в ткани ChP наблюдалось снижение уровня мРНК A2AR. Эта стратегия направленного нокдауна была использована для изучения роли кортикостероидной сигнализации в ChP в опосредовании психологического стресса17. В качестве альтернативы в исследовании использовался AAV2/5 для доставки шРНК, предназначенной для нацеливания на гены ChP. Предыдущие исследования оценивали инфекционную способность различных серотипов AAV и лентивирусов в тканях ChP и обнаружили, что AAV2/5 и AAV2/8 былинаиболее эффективными. Исследование показало, что AAV2/5 способен инфицировать ChP, не вызывая явных инфекций в других областях мозга. Эти два метода менее трудоемки, чем классические нокаутные стратегии, требующие двух трансгенных линий (Cre и Flox)6,18. Одним из ограничений этого исследования является отсутствие эксперимента с усилением функции с гиперэкспрессией генов. Тем не менее, возможный подход к достижению этой цели заключается в клонировании полной кДНК и упаковке ее в вирус AAV2/5, который будет вводиться через ICV-инфекцию. В предыдущем исследовании было обнаружено, что гиперэкспрессия NKCC1 в ChP с использованием AAV2/5 способствует клиренсу ликвора и уменьшает вентрикуломегалию in vivo9. Важно отметить, что стратегия AAV2/5 или Cre/LoxP имеют свое преимущество. Внутривенное введение CRE-TAT трансгенным мышам обеспечивает высокую эффективность нокдауна, так как ген-мишень удаляется непосредственно из ДНК клеток. Однако этот метод зависит от производства и разведения флоксированных мышей. С другой стороны, инъекция AAV2/5 ICV позволяет избежать трудоемкого процесса разведения трансгенных мышей. Однако нокдаунная эффективность этого метода во многом зависит от производительности спроектированной шРНК. Таким образом, исследователи могут выбрать подходящий метод, исходя из условий эксперимента.
Рассеянный склероз (РС) – это аутоиммунное заболевание, которое вызывает воспаление и демиелинизацию белого вещества в ЦНС19. Для изучения патологических механизмов рассеянного склероза исследователи использовали модель EAE, которая имитирует симптомы заболевания, такие как демиелинизация и иммунная инфильтрация. Эта модель считается идеальной для понимания рассеянного склероза. В 2009 году было обнаружено, что иммунные клетки проникают в ЦНС через ChP, что является ключевым путем проникновения иммунных клеток при патологии рассеянного склероза. «Первая волна» иммунных клеток проникает в ликвор через ЧП, за ней следует «вторая волна», которая проникает в паренхиму головного мозга через ГЭБ20. «Первая волна» иммунных клеток способствует воспалению и ускоряет утечку ГЭБ, поэтому ингибирование иммунной инфильтрации в ChP может быть полезно для раннего вмешательства при рассеянном склерозе. Хемокины и молекулы адгезии регулируют стробящую активность ChP, контролируя способность лимфоцитов проникать через него21,22,23.
В предыдущих исследованиях для изучения сигнальных молекул в ChP, но эти методы не позволяли точно определить их биологическую функцию в патологическом процессе РС. Внедавнем исследовании ученые сбили A 2A R, расположенный в ChP мышей A2AR flox/flox, и обнаружили, что показатели EAE и иммунная инфильтрация былизначительно снижены. Данное исследование подтверждает роль передачи сигналовА2АР в ЧП при патологии ЭАЭ и демонстрирует, что ЧП-специфические методы нокдауна являются полезными инструментами для изучения функции ЧП при патологиях ЦНС.
В заключение, протокол манипуляций, специфичный для ChP, является идеальным инструментом для изучения биологической функции ChP, участвующей в дегенеративных заболеваниях ЦНС, таких как болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз и так далее.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов или другой информации, которую они могли бы декларировать.
Благодарности
Мы выражаем признательность за поддержку этой работы Национальному фонду естественных наук Китая (грант No 31800903, присужден В. Чжэну) и Вэньчжоускому научно-техническому проекту (No Y2020426, присужден Ю. Ю. Вэну).
Материалы
| Name | Company | Catalog Number | Comments |
| A2ARflox/flox mice | State Key Laboratory of Ophthalmology, Optometry and Visual Science, Wenzhou Medical University | ||
| AAV2/5-A2AR-ShRNA virus | Shanghai Heyuan Biotechnology Co. LTD | pt-4828 | |
| antifade mounting medium | Beyotime Biotechnology | 0100-01 | |
| borosilicate glass capillary | Beijing Meiyaxian Technology Co. Ltd | B100-50-10 | |
| brain stereotaxic apparatus | RWD, Shenzhen | 69100 | |
| C57BL/6 mice | Beijing Vital Charles River Laboratory Animal Technology Company | ||
| CRE-TAT recombinase | Millipore | SCR508 | |
| DAPI | Absin | B25A031 | |
| frozen slicing machine | Leica | CM1950 | |
| H37Ra | Becton Dickinson and company | 231141 | |
| Hamilton syringe | Hamilton, American | P/N: 86259 | |
| Incomplete Freunds adjuvant | Sigma | F5506 | |
| Laser confocal microscope | Zeiss | LSM900 | |
| MOG35-55 | Suzhou Qiangyao Biotechnology Co., LTD | 4010006243 | |
| OCT glue | Epredia | 6502p | |
| paraformaldehyde | Chengdu Kelong Chemical Reagent Company | 30525-89-4 | |
| pentobarbital sodium | Boyun Biotech | PC13003 | |
| Pipette gun | Eppendorf | N45014F | |
| PrimeScript 1st Strand cDNA Synthesis Kit | Takara | 6110A | |
| Real- Time PCR System | BioRad | CFX96 | |
| Rosa-LSL (Lox-StoP-Lox)-tdTomato mice | Jackson Laboratory | ||
| sucrose | Sangon Biotech | A502792-0500 | |
| super high speed homogenizer | IKA | 3737025 | |
| Trizol | Invitrogen | 15596026 | |
| xylene solution | Chengdu Kelong Chemical Reagent Company | 1330-20-7 |
Ссылки
- Damkier, H. H., Brown, P. D., Praetorius, J. Cerebrospinal fluid secretion by the choroid plexus. Physiological Reviews. 93 (4), 1847-1892 (2013).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews: Neuroscience. 16 (8), 445-457 (2015).
- Wolburg, H., Paulus, W. Choroid plexus: biology and pathology. Acta Neuropathologica. 119 (1), 75-88 (2010).
- Solar, P., Zamani, A., Kubickova, L., Dubovy, P., Joukal, M. Choroid plexus and the blood-cerebrospinal fluid barrier in disease. Fluids Barriers CNS. 17 (1), 35(2020).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Myung, J., et al. The choroid plexus is an important circadian clock component. Nature Communications. 9 (1), 1062(2018).
- Zhang, Y., et al. A transgenic FOXJ1-Cre system for gene inactivation in ciliated epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 36 (5), 515-519 (2007).
- Johansson, P. A., et al. The transcription factor Otx2 regulates choroid plexus development and function. Development. 140 (5), 1055-1066 (2013).
- Xu, H., et al. Choroid plexus NKCC1 mediates cerebrospinal fluid clearance during mouse early postnatal development. Nature Communications. 12 (1), 447(2021).
- Spatazza, J., et al. Choroid-plexus-derived Otx2 homeoprotein constrains adult cortical plasticity. Cell Reports. 3 (6), 1815-1823 (2013).
- Zheng, W., et al. Choroid plexus-selective inactivation of adenosine A2A receptors protects against T cell infiltration and experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 19 (1), 52(2022).
- Steffensen, A. B., et al. Cotransporter-mediated water transport underlying cerebrospinal fluid formation. Nature Communications. 9 (1), 2167(2018).
- Zhu, L., et al. Klotho controls the brain-immune system interface in the choroid plexus. Proceedings of the National Academy of Sciences. 115 (48), E11388-E11396 (2018).
- Chen, X., et al. Different serotypes of adeno-associated virus vector- and lentivirus-mediated tropism in choroid plexus by intracerebroventricular delivery. Human Gene Therapy. 31 (7-8), 440-447 (2020).
- Konsman, J. P. The mouse brain in stereotaxic coordinates. Psychoneuroendocrinology. 6 (28), 827-828 (2003).
- Weaver, A., et al. An elevated matrix metalloproteinase (MMP) in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization. FASEB J. 19 (12), 1668-1670 (2005).
- Kertser, A., et al. Corticosteroid signaling at the brain-immune interface impedes coping with severe psychological stress. Science Advances. 5 (5), 4111(2019).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Compston, A., Coles, A. Multiple sclerosis. Lancet. 372 (9648), 1502-1517 (2008).
- Reboldi, A., et al. C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE. Nature Immunology. 10 (5), 514-523 (2009).
- Jovanova-Nesic, K., et al. Choroid plexus connexin 43 expression and gap junction flexibility are associated with clinical features of acute EAE. Annals of the New York Academy of Sciences. 1173, 75-82 (2009).
- Jovanova-Nesic, K., Jovicic, S., Sovilj, M., Spector, N. H. Magnetic brain stimulation upregulates adhesion and prevents Eae: MMP-2, ICAM-1, and VCAM-1 in the choroid plexus as a target. International Journal of Neuroscience. 119 (9), 1399-1418 (2009).
- Mills, J. H., Alabanza, L. M., Mahamed, D. A., Bynoe, M. S. Extracellular adenosine signaling induces CX3CL1 expression in the brain to promote experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 9, 193(2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены