Method Article
הפלה ממוקדת של גנים במקלעת הכורואיד
* These authors contributed equally
In This Article
Summary
במאמר זה אנו מתארים שיטה לשינוי סלקטיבי של ביטויי גנים במקלעת הכורואידים, תוך הימנעות מכל השפעה באזורים אחרים במוח.
Abstract
מקלעת הכורואיד (ChP) משמשת שער קריטי לחדירת תאי מערכת החיסון למערכת העצבים המרכזית (CNS) בתנאים פיזיולוגיים ופתולוגיים כאחד. מחקרים אחרונים הראו כי ויסות פעילות ChP עשוי להציע הגנה מפני הפרעות במערכת העצבים המרכזית. עם זאת, חקר התפקוד הביולוגי של ChP מבלי להשפיע על אזורי מוח אחרים הוא מאתגר בשל המבנה העדין שלו. מחקר זה מציג שיטה חדשנית להפלה גנטית ברקמת ChP באמצעות וירוסים הקשורים לאדנו (AAVs) או חלבון רקומבינאז רקומבינאז (Cyclization recombination enzyme (Cre) המורכב מרצף TAT (CRE-TAT). התוצאות מראות כי לאחר הזרקת AAV או CRE-TAT לחדר הצידי, הפלואורסצנטיות התרכזה באופן בלעדי ב- ChP. באמצעות גישה זו, המחקר הפיל בהצלחה את קולטן אדנוזין A 2A (A2A R) ב- ChP באמצעות הפרעותRNA (RNAi) או Cre/locus של מערכות X-overP1 (Cre/LoxP), והראה כי הפלה זו יכולה להקל על הפתולוגיה של אנצפלומיאליטיס אוטואימונית ניסיונית (EAE). טכניקה זו עשויה להיות השלכות חשובות על מחקר עתידי על תפקיד ChP בהפרעות CNS.
Introduction
מקלעת הכורואיד (ChP) נחשבה לעתים קרובות כמסייעת בשמירה על הומאוסטזיס תפקודי במוח על ידי הפרשת נוזל מוחי שדרתי (CSF) וגורם נוירוטרופי מוחי (BDNF)1,2. מחקר הולך וגובר בשלושת העשורים האחרונים גילה כי ChP מייצג מסלול ברור לחדירת תאי מערכת החיסון למערכת העצבים המרכזית (CNS).
הצמתים הצפופים (TJs) של ChP, המורכבים מאפיתל ChP חד-שכבתי, שומרים על הומאוסטזיס חיסוני על ידי מניעת כניסת מקרומולקולות ותאי חיסון למוח3. עם זאת, בתנאים פתולוגיים מסוימים, רקמת ChP מזהה ומגיבה לדפוסים מולקולריים הקשורים לסכנה (DAMPs) ב- CSF ובדם, מה שמוביל לחדירה חיסונית חריגה ולתפקוד לקוי של המוח 4,5. למרות תפקידו הקריטי, גודלו הקטן של ה-ChP ומיקומו הייחודי במוח מקשים על חקר תפקודו מבלי להשפיע על אזורי מוח אחרים. לכן, מניפולציה של ביטוי גנים במיוחד ב- ChP היא גישה אידיאלית להבנת תפקידו.
בתחילה, קווים טרנסגניים של אנזים רקומבינציה מחזורית (Cre), המבטאים Cre תחת שליטתם של מקדמים ספציפיים לגנים המבוטאים ב- ChP, שימשו בדרך כלל למחיקת גני מטרה על ידי רבייה עם גנים מועמדים floxed 6,7,8. לדוגמה, גורם השעתוק תיבת Forkhead J1 (FoxJ1) מתבטא באופן בלעדי באפיתל ChP של מוח העכבר לפני הלידה7. לפיכך, קו FoxJ1-Cre שימש לעתים קרובות למחיקת גנים הממוקמים ChP 6,9. עם זאת, ההצלחה של אסטרטגיה זו מסתמכת במידה רבה על הספציפיות של המקדם. בהדרגה התגלה כי דפוס הביטוי של FoxJ1 אינו ייחודי מספיק, שכן FoxJ1 היה נוכח גם בתאי אפיתל ריסניים בחלקים אחרים של המוח והמערכת ההיקפית7. כדי להתגבר על מגבלה זו, בוצעה הזרקה תוך-מוחית (ICV) של Cre recombinase כדי להעביר רקומבינאז לחדרים של קווים טרנסגניים פלוקסים. אסטרטגיה זו הראתה ספציפיות גבוהה, כפי שמעידה נוכחות של פלואורסצנטיות tdTomato אך ורק ברקמת ChP10,11. עם זאת, שיטה זו עדיין מוגבלת על ידי הזמינות של קווי עכבר טרנסגניים floxed. כדי לטפל בבעיה זו, חוקרים השתמשו בהזרקת ICV של וירוס הקשור לאדנו (AAV) כדי להשיג הפלה ספציפית ל- ChP או ביטוי יתר של גני מטרה12,13. הערכה מקיפה של סרוטיפים שונים של AAV עבור זיהום ChP גילתה כי AAV2/5 ו- AAV2/8 מפגינים יכולות זיהום חזקות ב- ChP, בעוד שאינם מדביקים אזורי מוח אחרים. עם זאת, AAV2/8 נמצא כמדביק את האפנדימה סביב החדרים, בעוד שקבוצת AAV2/5 לא הראתה זיהום14. שיטה זו יש את היתרון של התגברות על המגבלות של רכישת בעלי חיים טרנסגניים floxed.
מאמר זה מתאר פרוטוקול שלב אחר שלב להפלה גנטית ב- ChP באמצעות שתי שיטות: ICV של AAV2/5 הנושא shRNA של קולטן אדנוזין A 2A (A 2A R) וחלבון Cre recombinase המורכב מרקומבינאז רצף TAT (CRE-TAT) כדי להשיג הפלה ספציפית ל- ChP של A2A R. ממצאי המחקר מצביעים על כך שהפלת A2AR ב- ChP יכולה להקל על אנצפלומיאליטיס אוטואימונית ניסיונית (EAE). פרוטוקול מפורט זה מספק הדרכה שימושית למחקרי תפקוד ChP ולפירוק הספציפי של גנים ב- ChP.
Protocol
כל ההליכים בבעלי חיים המתוארים במחקר זה נערכו בהתאם להנחיות המפורטות במדריך NIH לטיפול ושימוש בחיות מעבדה ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטה הרפואית וונג'ואו.
1. בעלי חיים
- רכשו עכברי C57BL/6 זכרים בגילאי 8-12 שבועות ובמשקל 20-22 גרם.
- השג את קו העכבר המהונדס Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9), ואת עכברי A2AR flox/flox זכרים.
- הקצו את העכברים באופן אקראי לשתי קבוצות ושוכנו בכלובים, עם מקסימום חמישה עכברים בכל כלוב, תחת מחזור סטנדרטי של 12 שעות אור / 12 שעות חושך למשך שבוע אחד.
- לספק את העכברים עם מספיק מזון ומים ולשמור אותם בטמפרטורה קבועה ב 25 °C (75 °F).
2. הפלת ChP ספציפית של A2ARs עם AAV2/5-shRNA
- שקול כל עכבר ורשום את הערכים.
- מרדימים את העכברים תוך צפקית עם 1% נתרן pentobarbital במינון של 6-8 מ"ל / ק"ג שווה ערך 60-80 מ"ג / ק"ג pentobarbital, ומניחים את העכבר על כרית חימום כדי לשמור על חום.
הערה: חיוני לתת את המינון הנכון של נתרן pentobarbital בהתאם למשקל העכבר כדי להבטיח ניתוח מוצלח. ההרדמה לא צריכה להיות עמוקה מדי, כפי שהוא עלול לגרום לתמותה, אבל לא צריך להיות רדוד מדי, כמו העכבר עלול להתעורר במהלך ההליך, פוטנציאל להשפיע על האפקטיביות של הזרקת הנגיף. בדוק את מינון ההרדמה הנכון על ידי צביטת הבוהן וודא שהעכברים אינם מגיבים. - השתמש במכונת גילוח עכבר מיוחדת כדי לקצץ את השיער העליון של העכברים המורדמים.
- מרחו משחת עיניים על שתי העיניים כדי למנוע התייבשות, וקיבעו את העכברים על מכשיר סטריאוטקסי כדי לשתק את המוח. מכסים את החיה בשפריץ סטרילי.
- לעקר ביסודיות את העור של הראש והצוואר של העכברים עם שלושה סבבים של חיטוי יודופור ו 75% אלכוהול כדי להפחית את הזיהום לאחר הניתוח. לאחר מכן להחיל 1% לידוקאין מקומי על הקרקפת של עכברים ולעשות חתך קטן לחשוף באופן מלא את הגולגולת תחת מיקרוסקופ.
הערה: השתמש במכשירים סטריליים לאורך כל ההליך. - הכינו שני מזרקים של 10 μL: אחד עם AAV2/5-A 2A R-shRNA שנרכש (titer: 6.27 × 10 9 vg/μL) והשני עם AAV2/5-Scramble שנרכש (titer:6.21× 109 vg/μL).
הערה: בעת השימוש במזרק, יש לחבר את הקצה הקדמי לנימי זכוכית, וניתן לקבל טווח של 10 μL על ידי שליטה באורך נימי הזכוכית. - השתמש במיקרוסקופ כדי לאתר את הברגמה והלמדא וקבע את נקודת הקואורדינטות (AP: -0.58; מ"ל: ±1.10; DL: -2.20) על מזרק 10 μL (איור 1). נקודת הקואורדינטות מבוססת על האטלס הסטריאוטקסי של מוח העכבר15.
- קדח חור קטן בגולגולת בנקודת הקואורדינטות המותאמת.
הערה: תחת המיקרוסקופ, הקידוח מתבצע באמצעות מיקרו-מקדח סטרילי כנגד פני הגולגולת. לאחר הקידוח, על ידי הסרת קרומי המוח המכסים את המוח וחשיפת פרנכימה במוח הבסיסית, נמנעת פגיעה בכלי הדם. שלב זה מונע את שבירת קצה נימי הזכוכית על ידי קרומי המוח. קוטר החור שנקדח צריך להיות מספיק כדי לאפשר לקצה המחט להיכנס לרקמת המוח. - מתן 2 μL של נגיף AAV2/5-A2AR-shRNA לחדר המוח באמצעות הזרקה לרוחב בקצב קבוע של 100 nL/min. שמור את המחט במקום במשך 10 דקות לפני הנסיגה. יש לציין כי הנגיף ניתן בזריקה חד צדדית.
- אטמו את העור הפגוע באמצעות דבק ביופיברין רפואי באופן מיידי כדי למנוע אובדן וירוסים, אשר ניתן לשטוף עם CSF לאחר הסרת המחט אם הדבק אינו נמרח במהירות. כמו כן, אין להשתמש בצמר גפן כדי לנגב את CSF, כפי שהוא עלול גם לגרום לאובדן וירוסים.
- כדי להקל על ההתאוששות, הנח את העכבר על כרית חימום כדי לשמור על טמפרטורת הגוף ב 37.0 ± 0.5 מעלות צלזיוס, ומרח 1% לידוקאין מקומי על קרקפת העכבר. אפשרו לעכברים להתאושש במשך שבועיים לפני השראת מודל EAE, מכיוון שתקופה זו נחוצה לביטוי נגיף AAV2/5-A 2A R-shRNA ולאחר מכן להפלה של A2AR.
3. הפלת ChP ספציפית של A2AR עם Cre/locus של מערכת X-overP1 (Cre/LoxP)
הערה: ניתן להשיג את ההליכים הבאים באמצעות השיטה שתוארה קודם לכן. עיין בשלבים 2.1-2.11 לקבלת שיטות הזרקה מפורטות.
- הזריקו 2 μL של רקומבינאז CRE-TAT לכל חדר צדדי של עכבר Rosa-LSL (Lox-StoP-Lox)-tdTomato כקבוצת הניסוי ו-2 μL של מלח סטרילי חוצץ פוספט (PBS) כקבוצת הביקורת. באמצעות אותו פרוטוקול כמו לעיל (סעיף 2), הזריקו 2 μL של רקומבינאז CRE-TAT לכל אחד מהחדרים הצדיים של עכברי A2AR flox/flox יחד עם 2 μL של PBS סטרילי כקבוצת ביקורת.
- הכינו קטעי רקמות קפואות ובצעו צביעה גרעינית שבועיים לאחר הזרקת רקומבינאז CRE-TAT. עיין בשלבים 4.1-4.3 לקבלת מידע נוסף.
4. זילוח קרום הלב בעכברים
- לתת 60-80 מ"ג / ק"ג נתרן pentobarbital כדי להרדים עמוק את העכברים. אשר את מישור ההרדמה על ידי צביטת בוהן ובצע זילוח transcardial באמצעות 40 מ"ל של תמיסת PBS סטרילית ואחריה 20 מ"ל של 4% paraformaldehyde (PFA).
הערה: זילוח מוצלח מסומן על ידי צבע לבן בכבד, בעוד נוכחות של ריאות מוגדלות או PBS החוצה מהפה במהלך זילוח מרמז על כישלון של ההליך. - חלץ במהירות את מוח העכבר והבטיח פירוק חלבון מינימלי.
- השקיעו את מוח העכבר ב-4% PFA/PBS למשך הלילה לצורך קיבוע שלאחר הקיבוע, ולאחר מכן החליפו בתמיסת PB של 30% סוכרוז למשך 72 שעות.
הערה: זה קריטי כדי למנוע התייבשות מוגזמת של רקמת המוח, כך המוח לא צריך להישאר בתמיסת PB סוכרוז במשך זמן רב מדי.
5. חתך רקמות קפואות והכתמה
- הטמע את מוח העכבר שהתייבש בעבר בדבק טמפרטורת חיתוך אופטימלית (OCT), הקפיא את המוח המשובץ והשתמש במיקרוטום מחליק כדי לחתוך קטעי עטרה בעובי של 20 מיקרומטר.
- הניחו את חלקי המוח על מגלשת הזכוכית. ברגע שחלקי המוח יבשים, אחסנו אותם במקרר בטמפרטורה של -20°C לניסויים הבאים.
- הניחו כל שקופית זכוכית בתוך מארז מסגרת והטביעו את המסגרת במיכל מלא PBS כדי לשטוף היטב את המגלשה. שטפו בעדינות את מגלשות המוח בתמיסת PBS שלוש פעמים, במשך 10 דקות בכל פעם.
הערה: יש לנקוט משנה זהירות כדי למנוע מחלקי המוח ליפול ממגלשת הזכוכית. - הכתימו את המוח מחליק בתמיסת 4′,6-diamidino-2-phenylindole (DAPI) למשך 10 דקות.
- שטפו את מגלשות המוח בתמיסת PBS במשך 5 דקות.
- יש למרוח טיפה אחת של מדיום הרכבה נגד דהייה על חלקי המוח.
- הניחו את הכיסוי על חלקי המוח, אטמו את הכיסוי בלק ונתחו את המקטעים באמצעות מיקרוסקופ פלואורסצנטי קונבנציונלי.
6. אינדוקציה EAE
הערה: בצע השראת EAE לאחר שבועיים של הזרקת shRNA או CRE-TAT רקומבינאז11.
- צור תמיסה מימית על ידי ערבוב 2.5 מ"ג מיאלין אוליגודנדרוציטים גליקופרוטאין (MOG35-55) עם 2 מ"ל של PBS. הכינו תמיסת שמן אדג'ובנט שלמה של Freunds (CFA) על ידי ערבוב M . tuberculosis (H37Ra) עם אדג'ובנט Freunds לא שלם (IFA).
- מערבבים את תמיסות המים והשמן ביחס של 1:1. השתמשו בצינור טי כדי להקציף את התערובת למצב שמן במים.
הערה: צינור הטי נקרא גם צינור תלת-כיווני. זהו צינור פלסטיק שיכול לשלוט בכיוון התמיסה הזורמת כדי לערבב באופן מלא את MOG35-55 ו- CFA. - השתמש הומוגנייזר במהירות גבוהה כדי להפוך את תחליב האנטיגן MOG עבור מודל EAE בתנאי אמבט קרח.
- מרדימים את העכברים תוך צפקית עם 1% נתרן pentobarbital במינון של 6-8 מ"ל / ק"ג שווה ערך 60-80 מ"ג / ק"ג pentobarbital.
- הזריקו תת עורית את תחליב האנטיגן MOG לארבע נקודות שונות (צוואר, גב, ירכיים שמאליות וימניות) בנפח של 10 מ"ל/ק"ג ובסך הכל ארבע זריקות כל אחת.
הערה: חשוב לבחור בקפידה את אתר ההזרקה, שכן לאתרים שונים עשויות להיות השפעות שונות על התחלואה והתמותה של עכברים. בנוסף, זריקות MOG חוזרות ונשנות יכולות להוביל לסבילות חיסונית, ולכן צוות המחקר בחר שיטת הזרקה אחת כדי למנוע בעיה פוטנציאלית זו. - יש להזריק מיד 500 נ"ג/מ"ל של רעלן שעלת (PT) תוך צפקי במינון של 5 מ"ג/ק"ג לאחר הזרקת MOG.
הערה: PT מגביר את החדירות של מחסום הדם-מוח (BBB) ומקל על חדירת תאי T למוח. - לאחר 48 שעות, תוך פריטוניאלי להזריק את תמיסת PT באותו נפח.
7. ציון גירעון נוירולוגי
- הערך ודרג את העכברים מדי יום באמצעות סולם דירוג 16 הנע בין 0 ל -15 כדי להעריך את ההיארעות והחומרה של EAE על פי הליקויים הנוירולוגיים הבאים:
זנב: 0 מציין שאין סימנים, 1 מציין זנב משותק למחצה ו-2 מציין זנב משותק לחלוטין.
גפיים: 0 מציין שאין סימנים, 1 מייצג הליכה חלשה או שונה, 2 מציין פרזיס, ו-3 מייצג איבר משותק לחלוטין. - הקצו לבעל חיים מרובע בעל שיתוק מלא ציון 12, והקצו לתמותה ציון 15.
8. צביעת Hematoxylin-eosin (H&E)
- קח את מוח העכבר המיובש והטמע אותו בפרפין מותך. תנו לגוש הפרפין להתקרר ולהתגבש לשימוש מאוחר יותר.
הערה: בלוק הפרפין צריך להיות יבש לחלוטין וקריר כדי למנוע נזק לרקמות. - חתכו את גוש הפרפין במוח העכבר לשקופיות בעובי 5 מיקרומטר. מניחים את אזור המוח של עכבר הפרפין על מגלשת זכוכית ומייבשים אותו בתנור של 60 מעלות צלזיוס למשך 3 שעות.
- יש לטבול את המגלשות ברצף בתמיסת קסילן I למשך 10 דקות, תמיסת קסילן II למשך 10 דקות, 100% אלכוהול I למשך 3 דקות, 100% אלכוהול II למשך 3 דקות, 95% אלכוהול למשך 3 דקות, 90% אלכוהול למשך 3 דקות, 80% אלכוהול למשך 3 דקות, 70% אלכוהול למשך 3 דקות ומים מזוקקים למשך דקה.
9. ניתוח תגובת שרשרת פולימראז כמותי (qPCR)
- לאחר ערבוב העכברים עם PBS, להסיר את ChP מן החדרים לחלץ RNA עם Trizol. סנתז את ה- cDNA באמצעות ערכת סינתזת cDNA הראשונה של גדיל.
- בצע ניתוח qPCR באמצעות Premix Ex Taq SYBR-green ומערכת PCR בזמן אמת. השתמש בפריימרים הבאים של A2AR: קדימה - GCCATCCCATTCGCCATCA; הפוך - GCAATAGCCAAGAGGCTGAAGA.
תוצאות
ChP-specific A2AR knockdown על ידי הזרקת ICV של AAV2/5-shRNA או CRE-TAT
תפקידו של A2AR ב- ChP כמווסת רב עוצמה של מידע עצבי בפתוגנזה של EAE נותר לא ברור. הפלת ביטוי A 2A R ספציפי ל-ChP יכולה לשפוך אור על ההשפעות הרגולטוריות של A2AR על מערכת החיסון המרכזית ב-EAE ודלקות אחרות במערכת העצבים. מחקר זה השתמש בהזרקת ICV של CRE-TAT כדי להפחית ביטוי A 2A R ב- ChP של עכברי A2AR flox/flox. כדי להבטיח את הספציפיות של ChP, הזרקנו תחילה CRE-TAT לחדרים הצדיים של עכברי Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9). התמונות מצביעות על כך שהפלואורסצנטיות הספונטנית של tdTomato הוגבלה לרקמת ChP (איור 2). באופן דומה, המחקר נתן חלבון פלואורסצנטי ירוק משופר AAV2/5-CMV-A2AR-shRNA-CMV (EGFP) לעכברי C57BL/6 ומצא שהפלואורסצנטיות של EGFP הייתה מוגבלת לשכבת תאי האפיתל של ChP ולא הדביקה את התאים הפרנכימליים שמסביב ליד החדרים הצדיים (איור 3).
אינדוקציה EAE עם MOG35-55
כדי לגרום ל-EAE יציב, עכברים הוזרקו באופן תת-עורי עם תחליב המורכב מ-MOG35-55 ו-CFA, ולאחר מכן הזרקה תוך-צפקית של PT בימים 0 ו-2 לאחר החיסון (איור 4). סולם הסימפטומים הקליניים שימש להערכת ציוני EAE מדי יום, בהתבסס על מצב הזנב והגפיים. תחילת EAE הוגדרה כיום הראשון עם ציון EAE ≥1, בעוד שמשך הזמן בין תחילת ציוני EAE לשיא EAE נקרא השלב המתקדם.
ChP-specific A2AR knockdown מקל על פתולוגיה EAE
כדי לחקור את מעורבותו של אות A 2A R בפתולוגיה של EAE, המחקר השתמש בהפלת A2AR ספציפית ל- ChP. המחקר הפיל באופן ספציפי A 2A R ב- ChP באמצעות הזרקת ICV של CRE-TAT או AAV2/5-A2AR-shRNA. שבועיים לאחר ההפלה, EAE הושרה על ידי חיסון MOG35-55. התוצאות הראו שבהשוואה לקבוצת הביקורת, עכברים עם הפלה של A2AR פיתחו פתולוגיה מתונה יותר של EAE, כפי שמעידים ציונים נמוכים יותר וחדירה מופחתת של תאי מערכת החיסון לחוט השדרה (איור 5A,B,E,F). בנוסף, חמישה עכברים שקיבלו EAE מכל קבוצה ביום ה-20 לאחר חיסון MOG35-55 נבחרו באופן אקראי. לאחר זילוח עם PBS, ChPs בודדו עבור מיצוי RNA ו qPCR. ניתוח qPCR הראה כי רמות ה-mRNA של A 2A R ירדו בבירור בקבוצות AAV2/5-shRNA (A2AR-Kd) ו-CRE-TAT, בהשוואה לכל קבוצת ביקורת (איור 5C,D).

איור 1: לוקליזציה אנטומית של אתר הזרקת החדר הצידי. (A) תרשים סכמטי המציג את נקודת הזרקת הנגיף. (B) מקום ההזרקה של החדר הצידי נמצא 0.58 מ"מ מתחת לברגמה ו-1.1 מ"מ רוחבי לתפר הסגיטלי, כפי שמצוין בנקודה האדומה. (C) תמונה המציגה את אתר הזרקת הווירוסים על עכבר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
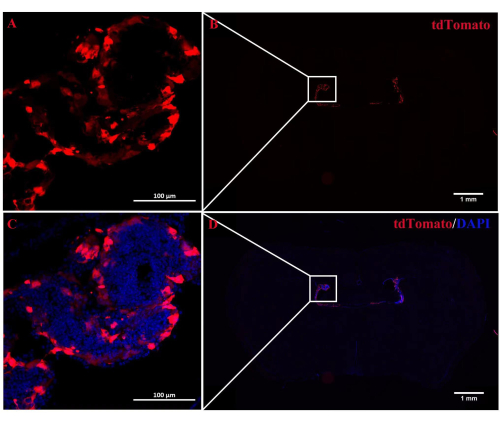
איור 2: לוקליזציה של פלואורסצנטיות tdTomato ב-ChP . (A,B) תמונה מייצגת של עכברי Rosa-LSL (Lox-StoP-Lox)-tdTomato שטופלו בהזרקת ICV של CRETAT. שבועיים לאחר מכן, tdTomato autofluorescence היה מקומי במיוחד לרקמת ChP (n = 3 / קבוצה). (ג,ד) התמונות הממוזגות של tdTomato autofluorescence ו- DAPI. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
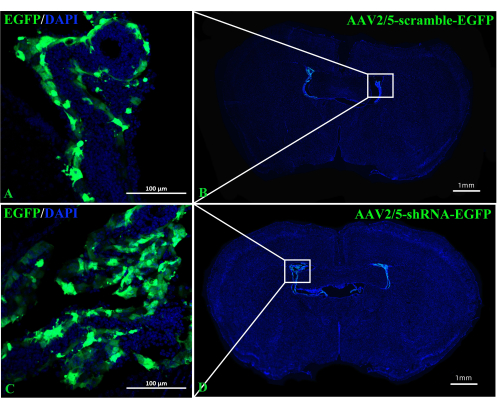
איור 3: תמונות מייצגות של עכברי C57BL/6 שצולמו שבועיים לאחר הזרקת ICV של AAV2/5-scramble-EGFP או AAV2/5-shRNA-EGFP. (A,B) התמונות המייצגות של עכברים שהוזרקו להם AAV2/5-scramble-EGFP (n = 3/group). (ג,ד) התמונות המייצגות של עכברים שהוזרקו AAV2/5-shRNA-EGFP (n = 3/group). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: אינדוקציה של מודל EAE. (A) ראשית, תחליב האנטיגן MOG מוזרק תת עורית לארבעה מקומות שונים (צוואר, גב, ירכיים שמאליות וימניות), המסומנים בנקודות אדומות. (B) PT מוזרק תוך צפקית בזמן החיסון וחוזר על עצמו יומיים לאחר מכן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: הפלה ספציפית ל-ChP של A 2A R הקלה על פתולוגיית EAE. (A) הפלה-ספציפית ל-ChP של A 2A R בעכברי A2AR flox/flox, שהושגה באמצעות הזרקת ICV של CRE-TAT, הובילה לירידה בציונים הקליניים של EAE (n = 6-7/group). הניתוח הסטטיסטי בוצע באמצעות RM ANOVA דו-כיווני ואחריו מבחן ההשוואה המרובה של סידאק. (B) הפלה ספציפית ל-ChP של A2AR בעכברי בר (WT), שהושגה עם הזרקת ICV של AAV2/5-shRNA, הפחיתה את התוצאות הקליניות של EAE (n = 7-8/קבוצה). הניתוח הסטטיסטי בוצע באמצעות RM ANOVA דו-כיווני ואחריו מבחן ההשוואה המרובה של סידאק. (ג,ד) תוצאות ניתוח qPCR של רמות mRNA A2AR ברקמת ChP (n = 5/group). הניתוח הסטטיסטי בוצע באמצעות מבחן t לא מזווג. (ה,ו) צביעת H&E. ChP ספציפי A2AR להפיל חדירה מוחלשת של תאי החיסון לתוך חוט השדרה. מובהקות סטטיסטית מיוצגת כ- ###p < 0.001, **p < 0.01 ו- ***p <- 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
המחקר הציג שתי גישות שונות להפלה ממוקדת של גנים ChP. הגישה הראשונה כללה הזרקת ICV של CRE-TAT, המכיל Cre recombinase, לעכברי A2AR flox/flox. הגישה השנייה כללה הזרקת ICV של AAV2/5 הנושא shRNA של A2AR. על ידי שימוש בשתי אסטרטגיות אלה, העבודה השיגה את ההפלה הסלקטיבית של A 2A R בתוך ChP והצליחה להדגים את ההשפעות המגינות של עיכוב איתות A2AR ב- ChP על פתולוגיה של EAE. יש לציין כי פרוטוקול זה כולל שני שלבים מכריעים. ראשית, פעולת הלוקליזציה הסטריאוטקסית היא חיונית, וסטייה משמעותית מהקואורדינטות המוצעות עלולה לגרום לכשלים אקראיים. שנית, נפח הנגיף המוזרק הוא קריטי, שכן נמצא כי הזרקת פחות מ 1 μL של וירוס (~ 6 x 1012) יש גם סיכוי מסוים לכישלון. ייתכן שהסיבה לכך היא הצורך בכמות מספקת של חלקיקי נגיף להדבקה מספקת.
השימוש במערכת Cre/LoxP לא איפשר תצפית על הפיזור המדויק של רקומבינאז CRE-TAT במוח לאחר הזרקת ICV. כתוצאה מכך, המחקר השתמש בעכברי Rosa-LSL (Lox-StoP-Lox)-tdTomato כדי לעקוב אחר התפלגות CRE-TAT באמצעות אוטופלואורסצנטיות של חלבון tdTomato. פלואורסצנטיות tdTomato הייתה ממוקמת באופן בלעדי ברקמות ChP שבועיים לאחר הזרקת CRE-TAT תוך רצית, מה שמצביע על כך שהרקומבינאז נספג בעיקר על ידי ChP. לאחר מכן, CRE-TAT ניתן לעכברי A 2A R flox/flox, ונצפתה ירידה ברמות A2AR mRNA ברקמת ChP. אסטרטגיית הפלה ממוקדת זו שימשה לחקר התפקיד של איתות קורטיקוסטרואידים ב- ChP בתיווך מתח פסיכולוגי17. לחלופין, המחקר השתמש ב- AAV2/5 כדי לספק shRNA שנועד להתמקד בגנים ChP. מחקרים קודמים העריכו את יכולת ההדבקה של סרוטיפים שונים של AAVs ולנטי-וירוסים ברקמת ChP ומצאו כי AAV2/5 ו-AAV2/8 היו14 היעילים ביותר. המחקר גילה כי AAV2/5 היה מסוגל להדביק את ChP באופן ספציפי מבלי לגרום לזיהומים ברורים באזורים אחרים במוח. שתי שיטות אלה פחות מייגעות מאסטרטגיות נוקאאוט קלאסיות הדורשות שני קווים טרנסגניים (קווי Cre ו- Flox)6,18. מגבלה אחת של מחקר זה היא היעדר ניסוי רווח של תפקוד עם ביטוי יתר של גנים. עם זאת, גישה אפשרית להשיג זאת תהיה לשכפל את ה- cDNA המלא ולארוז אותו לתוך וירוס AAV2/5, אשר ינוהל באמצעות זיהום ICV. במחקר קודם, ביטוי יתר של NKCC1 ב- ChP באמצעות AAV2/5 נמצא כמקדם פינוי CSF ומפחית את החדריות in vivo9. חשוב לציין כי לאסטרטגיית AAV2/5 או Cre/LoxP יש יתרון משלהם. הזרקת ICV של CRE-TAT לעכברים טרנסגניים מבטיחה יעילות הפלות גבוהה, מכיוון שגן המטרה נמחק ישירות מהדנ"א של התאים. עם זאת, שיטה זו תלויה בייצור ורבייה של עכברים פלוקסים. מצד שני, הזרקת ICV של AAV2/5 מונעת את התהליך הגוזל זמן של גידול עכברים טרנסגניים. עם זאת, יעילות הפליטה של שיטה זו תלויה במידה רבה בביצועים של shRNA מתוכנן. לכן, החוקרים יכולים לבחור שיטה מתאימה על סמך תנאי הניסוי שלהם.
טרשת נפוצה (MS) היא מחלה אוטואימונית הגורמת לדלקת ודה-מיאלינציה של החומר הלבן במערכת העצבים המרכזית19. כדי לחקור את המנגנונים הפתולוגיים של טרשת נפוצה, חוקרים השתמשו במודל EAE המדמה את תסמיני המחלה, כגון דמיאלינציה וחדירה חיסונית. מודל זה נחשב אידיאלי להבנת טרשת נפוצה. בשנת 2009 התגלה כי תאי מערכת החיסון חודרים למערכת העצבים המרכזית דרך ChP, שהוא נתיב מפתח לכניסת תאי מערכת החיסון בפתולוגיה של טרשת נפוצה. "הגל הראשון" של תאי החיסון נכנס CSF דרך ChP, ואחריו "הגל השני", אשר נכנס פרנכימה המוח דרך BBB20. "הגל הראשון" של תאי מערכת החיסון מקדם דלקת ומאיץ דליפת BBB, כך שעיכוב חדירת מערכת החיסון ב- ChP יכול להיות שימושי להתערבות מוקדמת בטרשת נפוצה. כימוקינים ומולקולות הידבקות מווסתים את פעילות ה- gating של ChP, ושולטים ביכולתם של לימפוציטים לחדור דרכו21,22,23.
מחקרים קודמים השתמשו בנוקאאוט של כל הגוף או בטכנולוגיה פרמקולוגית (כגון נוגדנים מנטרלים) כדי לחקור מולקולות איתות ב- ChP, אך שיטות אלה לא הגדירו במדויק את תפקידן הביולוגי בתהליך הפתולוגי של טרשת נפוצה. במחקר שנערך לאחרונה, חוקרים הפילו A 2A R, הממוקם ב- ChP של עכברי A2AR flox/flox, ומצאו כי ציוני EAE וחדירה חיסונית הופחתו באופן משמעותי11. מחקר זה מאשר את התפקיד של איתות A2AR ב- ChP במהלך פתולוגיה של EAE ומדגים כי שיטות דפיקה ספציפיות ל- ChP הן כלים שימושיים לחקר תפקוד ChP בפתולוגיות CNS.
לסיכום, פרוטוקול המניפולציה הספציפי ל- ChP הוא כלי אידיאלי לחקור את הפונקציה הביולוגית של ChP המעורב במחלות ניווניות במערכת העצבים המרכזית, כגון מחלת פרקינסון, מחלת אלצהיימר, טרשת נפוצה וכן הלאה.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים או גילויים אחרים להצהיר.
Acknowledgements
אנו מודים בהכרת תודה על תמיכתן של הקרן הלאומית למדעי הטבע של סין (מענק מס '31800903, שהוענק ל- W. Zheng) ופרויקט המדע והטכנולוגיה של וונג'ואו (מס 'Y2020426, הוענק ל- Y. Y. Weng) על עבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| A2ARflox/flox mice | State Key Laboratory of Ophthalmology, Optometry and Visual Science, Wenzhou Medical University | ||
| AAV2/5-A2AR-ShRNA virus | Shanghai Heyuan Biotechnology Co. LTD | pt-4828 | |
| antifade mounting medium | Beyotime Biotechnology | 0100-01 | |
| borosilicate glass capillary | Beijing Meiyaxian Technology Co. Ltd | B100-50-10 | |
| brain stereotaxic apparatus | RWD, Shenzhen | 69100 | |
| C57BL/6 mice | Beijing Vital Charles River Laboratory Animal Technology Company | ||
| CRE-TAT recombinase | Millipore | SCR508 | |
| DAPI | Absin | B25A031 | |
| frozen slicing machine | Leica | CM1950 | |
| H37Ra | Becton Dickinson and company | 231141 | |
| Hamilton syringe | Hamilton, American | P/N: 86259 | |
| Incomplete Freunds adjuvant | Sigma | F5506 | |
| Laser confocal microscope | Zeiss | LSM900 | |
| MOG35-55 | Suzhou Qiangyao Biotechnology Co., LTD | 4010006243 | |
| OCT glue | Epredia | 6502p | |
| paraformaldehyde | Chengdu Kelong Chemical Reagent Company | 30525-89-4 | |
| pentobarbital sodium | Boyun Biotech | PC13003 | |
| Pipette gun | Eppendorf | N45014F | |
| PrimeScript 1st Strand cDNA Synthesis Kit | Takara | 6110A | |
| Real- Time PCR System | BioRad | CFX96 | |
| Rosa-LSL (Lox-StoP-Lox)-tdTomato mice | Jackson Laboratory | ||
| sucrose | Sangon Biotech | A502792-0500 | |
| super high speed homogenizer | IKA | 3737025 | |
| Trizol | Invitrogen | 15596026 | |
| xylene solution | Chengdu Kelong Chemical Reagent Company | 1330-20-7 |
References
- Damkier, H. H., Brown, P. D., Praetorius, J. Cerebrospinal fluid secretion by the choroid plexus. Physiological Reviews. 93 (4), 1847-1892 (2013).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews: Neuroscience. 16 (8), 445-457 (2015).
- Wolburg, H., Paulus, W. Choroid plexus: biology and pathology. Acta Neuropathologica. 119 (1), 75-88 (2010).
- Solar, P., Zamani, A., Kubickova, L., Dubovy, P., Joukal, M. Choroid plexus and the blood-cerebrospinal fluid barrier in disease. Fluids Barriers CNS. 17 (1), 35(2020).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Myung, J., et al. The choroid plexus is an important circadian clock component. Nature Communications. 9 (1), 1062(2018).
- Zhang, Y., et al. A transgenic FOXJ1-Cre system for gene inactivation in ciliated epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 36 (5), 515-519 (2007).
- Johansson, P. A., et al. The transcription factor Otx2 regulates choroid plexus development and function. Development. 140 (5), 1055-1066 (2013).
- Xu, H., et al. Choroid plexus NKCC1 mediates cerebrospinal fluid clearance during mouse early postnatal development. Nature Communications. 12 (1), 447(2021).
- Spatazza, J., et al. Choroid-plexus-derived Otx2 homeoprotein constrains adult cortical plasticity. Cell Reports. 3 (6), 1815-1823 (2013).
- Zheng, W., et al. Choroid plexus-selective inactivation of adenosine A2A receptors protects against T cell infiltration and experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 19 (1), 52(2022).
- Steffensen, A. B., et al. Cotransporter-mediated water transport underlying cerebrospinal fluid formation. Nature Communications. 9 (1), 2167(2018).
- Zhu, L., et al. Klotho controls the brain-immune system interface in the choroid plexus. Proceedings of the National Academy of Sciences. 115 (48), E11388-E11396 (2018).
- Chen, X., et al. Different serotypes of adeno-associated virus vector- and lentivirus-mediated tropism in choroid plexus by intracerebroventricular delivery. Human Gene Therapy. 31 (7-8), 440-447 (2020).
- Konsman, J. P. The mouse brain in stereotaxic coordinates. Psychoneuroendocrinology. 6 (28), 827-828 (2003).
- Weaver, A., et al. An elevated matrix metalloproteinase (MMP) in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization. FASEB J. 19 (12), 1668-1670 (2005).
- Kertser, A., et al. Corticosteroid signaling at the brain-immune interface impedes coping with severe psychological stress. Science Advances. 5 (5), 4111(2019).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Compston, A., Coles, A. Multiple sclerosis. Lancet. 372 (9648), 1502-1517 (2008).
- Reboldi, A., et al. C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE. Nature Immunology. 10 (5), 514-523 (2009).
- Jovanova-Nesic, K., et al. Choroid plexus connexin 43 expression and gap junction flexibility are associated with clinical features of acute EAE. Annals of the New York Academy of Sciences. 1173, 75-82 (2009).
- Jovanova-Nesic, K., Jovicic, S., Sovilj, M., Spector, N. H. Magnetic brain stimulation upregulates adhesion and prevents Eae: MMP-2, ICAM-1, and VCAM-1 in the choroid plexus as a target. International Journal of Neuroscience. 119 (9), 1399-1418 (2009).
- Mills, J. H., Alabanza, L. M., Mahamed, D. A., Bynoe, M. S. Extracellular adenosine signaling induces CX3CL1 expression in the brain to promote experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 9, 193(2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved