Method Article
Knockdown mirato dei geni nel plesso coroideo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, descriviamo un metodo per alterare selettivamente le espressioni geniche nel plesso coroideo evitando qualsiasi impatto in altre aree cerebrali.
Abstract
Il plesso coroideo (ChP) funge da porta d'accesso critica per l'infiltrazione delle cellule immunitarie nel sistema nervoso centrale (SNC) sia in condizioni fisiologiche che patologiche. Recenti ricerche hanno dimostrato che la regolazione dell'attività di ChP può offrire protezione contro i disturbi del SNC. Tuttavia, studiare la funzione biologica del ChP senza influenzare altre regioni del cervello è impegnativo a causa della sua delicata struttura. Questo studio presenta un nuovo metodo per il knockdown genico nel tessuto ChP utilizzando virus adeno-associati (AAV) o proteina ricombinasi dell'enzima di ricombinazione della ciclizzazione (Cre) costituita dalla sequenza TAT (CRE-TAT). I risultati dimostrano che dopo l'iniezione di AAV o CRE-TAT nel ventricolo laterale, la fluorescenza è stata concentrata esclusivamente nel ChP. Utilizzando questo approccio, lo studio ha abbattuto con successo il recettore dell'adenosina A2A (A 2AR) nel ChP utilizzando l'interferenza dell'RNA (RNAi) o Cre/locus dei sistemi X-overP1 (Cre/LoxP) e ha dimostrato che questo knockdown potrebbe alleviare la patologia dell'encefalomielite autoimmune sperimentale (EAE). Questa tecnica può avere importanti implicazioni per la ricerca futura sul ruolo della ChP nei disturbi del SNC.
Introduzione
Si è spesso pensato che il plesso coroideo (ChP) aiutasse a mantenere l'omeostasi funzionale del cervello secernendo liquido cerebrospinale (CSF) e fattore neurotrofico derivato dal cervello (BDNF)1,2. L'aumento della ricerca negli ultimi tre decenni ha rivelato che il ChP rappresenta un percorso distinto per l'infiltrazione delle cellule immunitarie nel sistema nervoso centrale (SNC).
Le giunzioni strette (TJ) del ChP, composte da un epitelio ChP monostrato, mantengono l'omeostasi immunologica impedendo alle macromolecole e alle cellule immunitarie di entrare nel cervello3. Tuttavia, in determinate condizioni patologiche, il tessuto ChP rileva e risponde ai modelli molecolari associati al pericolo (DAMP) nel liquido cerebrospinale e nel sangue, portando a infiltrazioni immunitarie anomale e disfunzioni cerebrali 4,5. Nonostante il suo ruolo critico, le piccole dimensioni del ChP e la sua posizione unica nel cervello rendono difficile studiarne la funzione senza influenzare altre regioni cerebrali. Pertanto, manipolare l'espressione genica in modo specifico nel ChP è un approccio ideale per comprenderne la funzione.
Inizialmente, le linee transgeniche dell'enzima di ricombinazione della ciclizzazione (Cre), che esprimono Cre sotto il controllo di promotori specifici per i geni espressi nel ChP, sono state comunemente utilizzate per eliminare i geni bersaglio mediante l'ibridazione con i geni candidatifloxed 6,7,8. Ad esempio, il fattore di trascrizione Forkhead box J1 (FoxJ1) è espresso esclusivamente nell'epitelio ChP del cervello prenatale del topo7. Pertanto, la linea FoxJ1-Cre è stata spesso utilizzata per eliminare i geni situati nel ChP 6,9. Tuttavia, il successo di questa strategia dipende fortemente dalla specificità del promotore. Si scoprì gradualmente che il modello di espressione di FoxJ1 non era abbastanza distintivo, poiché FoxJ1 era presente anche nelle cellule epiteliali ciliate in altre parti del cervello e del sistema periferico7. Per superare questa limitazione, è stata eseguita un'iniezione intra-cerebroventricolare (ICV) di Cre ricombinasi per veicolare la ricombinasi nei ventricoli delle linee transgeniche floxate. Questa strategia ha mostrato un'elevata specificità, come evidenziato dalla presenza di fluorescenza tdTomato esclusivamente nel tessuto ChP10,11. Tuttavia, questo metodo è ancora limitato dalla disponibilità di linee di topi transgenici floxati. Per affrontare questo problema, i ricercatori hanno impiegato l'iniezione ICV di virus adeno-associato (AAV) per ottenere il knockdown specifico per ChP o la sovraespressione dei geni bersaglio12,13. Una valutazione completa di diversi sierotipi di AAV per l'infezione da ChP ha rivelato che AAV2/5 e AAV2/8 mostrano forti capacità di infezione nel ChP, pur non infettando altre regioni cerebrali. Tuttavia, è stato riscontrato che AAV2/8 infetta l'ependima che circonda i ventricoli, mentre il gruppo AAV2/5 non ha mostrato alcuna infezione14. Questo metodo ha il vantaggio di superare i limiti dell'acquisizione di animali transgenici floxati.
Questo articolo descrive un protocollo passo-passo per il knockdown genico nel ChP utilizzando due metodi: ICV di AAV2/5 che trasporta shRNA del recettore dell'adenosina A 2A (A 2AR) e proteina ricombinasi Cre costituita dalla sequenza TAT (CRE-TAT) ricombinasi per ottenere il knockdown specifico per ChP di A2A R. I risultati dello studio suggeriscono che abbattere A2AR nella ChP può alleviare l'encefalomielite autoimmune sperimentale (EAE). Questo protocollo dettagliato fornisce una guida utile per gli studi sulla funzione della ChP e per il knockdown specifico dei geni nella ChP.
Protocollo
Tutte le procedure sugli animali descritte in questo studio sono state condotte in conformità con le linee guida delineate nella Guida NIH per la cura e l'uso degli animali da laboratorio e approvate dal Comitato istituzionale per la cura e l'uso degli animali presso l'Università di Medicina di Wenzhou.
1. Animali
- Acquista topi maschi C57BL/6 di età compresa tra 8 e 12 settimane e del peso di 20-22 g.
- Ottenere la linea murina transgenica Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9) e topi maschi A2ARflox/flox .
- Assegnare in modo casuale i topi a due gruppi e alloggiarli in gabbie, con un massimo di cinque topi per gabbia, con un ciclo standard di 12 ore di luce/12 ore di buio per 1 settimana.
- Fornire ai topi cibo e acqua a sufficienza e mantenerli a una temperatura costante di 25 °C.
2. Knockdown ChP-specifico di A 2ARs con AAV2/5-shRNA
- Pesa ogni mouse e annota i valori.
- Anestetizzare i topi per via intraperitoneale con pentobarbital sodico all'1% al dosaggio di 6-8 ml/kg equivalenti a 60-80 mg/kg di pentobarbital e posizionare il mouse su un termoforo per tenerlo al caldo.
NOTA: È fondamentale somministrare il corretto dosaggio di pentobarbital sodico in base al peso del topo per garantire il successo dell'intervento. L'anestesia non deve essere troppo profonda, in quanto potrebbe causare mortalità, ma non deve essere troppo superficiale, poiché il topo potrebbe svegliarsi durante la procedura, compromettendo potenzialmente l'efficacia dell'iniezione del virus. Verificare la corretta dose di anestesia pizzicando le dita dei piedi e assicurandosi che i topi non rispondano. - Usa un rasoio per topi specializzato per tagliare i peli superiori dei topi anestetizzati .
- Applicare un unguento per gli occhi su entrambi gli occhi per evitare che si secchino e fissare i topi su un apparato stereotassico per immobilizzare il cervello. Copri l'animale con un telo sterile.
- Sterilizzare accuratamente la pelle della testa e del collo dei topi con tre cicli di disinfettante iodoforo e alcol al 75% per ridurre l'infezione postoperatoria. Quindi applicare l'1% di lidocaina per via topica sul cuoio capelluto dei topi e praticare una piccola incisione per esporre completamente il cranio al microscopio.
NOTA: Utilizzare strumenti sterili durante tutta la procedura. - Preparare due siringhe da 10 μL: una con AAV2/5-A2AR-shRNA acquistata (titolo: 6,27 × 109 vg/μL) e l'altra con AAV2/5-Scramble acquistata (titolo: 6,21 × 109 vg/μL).
NOTA: Quando si utilizza la siringa, l'estremità anteriore deve essere collegata a un capillare di vetro ed è possibile ottenere un intervallo di 10 μL controllando la lunghezza del capillare di vetro. - Utilizzare il microscopio per individuare il bregma e il lambda e impostare il punto di coordinate (AP: -0,58; ML: ±1,10; DL: -2.20) sulla siringa da 10 μL (Figura 1). Il punto di coordinate si basa sull'atlante stereotassico15 del cervello del topo.
- Praticare un piccolo foro nel cranio nel punto di coordinate regolato.
NOTA: Al microscopio, la perforazione viene eseguita utilizzando una microfresa sterile contro la superficie del cranio. Dopo la perforazione, rimuovendo le meningi che coprono il cervello ed esponendo il parenchima cerebrale sottostante, si prevengono lesioni ai vasi sanguigni. Questo passaggio impedisce che la punta del capillare di vetro venga spezzata dalle meningi. Il diametro del foro praticato deve essere sufficiente per consentire alla punta dell'ago di entrare nel tessuto cerebrale. - Somministrare 2 μL di virus AAV2/5-A2AR-shRNA nel ventricolo cerebrale tramite iniezione laterale a una velocità costante di 100 nL/min. Tenere l'ago in posizione per 10 minuti prima di estrarlo. Si noti che il virus è stato somministrato con iniezione unilaterale.
- Sigillare prontamente la pelle lesa utilizzando colla medica di biofibrina per prevenire la perdita di virus, che può essere risciacquata con liquido cerebrospinale dopo aver rimosso l'ago se la colla non viene applicata rapidamente. Inoltre, non utilizzare cotton fioc per pulire il liquido cerebrospinale, poiché potrebbe anche causare la perdita di virus.
- Per facilitare il recupero, posizionare il mouse su un termoforo per mantenere la temperatura corporea a 37,0 ± 0,5 °C e applicare l'1% di lidocaina per via topica sul cuoio capelluto del topo. Lasciare che i topi si riprendano per 2 settimane prima di indurre il modello EAE, poiché questo periodo è necessario per l'espressione del virus AAV2/5-A 2A R-shRNA e il successivo knockdown diA 2AR.
3. Knockdown specifico per ChP di A 2AR con un sistema Cre/locus di X-overP1 (Cre/LoxP)
NOTA: Le seguenti procedure possono essere eseguite utilizzando il metodo descritto in precedenza. Fare riferimento ai passaggi 2.1-2.11 per i metodi di iniezione dettagliati.
- Iniettare 2 μL di CRE-TAT ricombinasi in ciascun ventricolo laterale di un topo Rosa-LSL (Lox-StoP-Lox)-tdTomato come gruppo sperimentale e 2 μL di soluzione fisiologica sterile tamponata con fosfato (PBS) come gruppo di controllo. Utilizzando lo stesso protocollo di cui sopra (paragrafo 2), iniettare 2 μL di CRE-TAT ricombinasi in ciascuno dei ventricoli laterali di topi flox A2AR flox/flox insieme a 2 μL di PBS sterile come gruppo di controllo.
- Preparare sezioni di tessuto congelate ed eseguire la colorazione nucleare 2 settimane dopo l'iniezione di ricombinasi CRE-TAT. Per ulteriori informazioni, vedere i passaggi 4.1-4.3.
4. Perfusione transcardica nei topi
- Somministrare 60-80 mg/kg di pentobarbital sodico per anestetizzare in profondità i topi. Confermare il piano dell'anestesia pizzicando un dito del piede ed eseguire la perfusione transcardica utilizzando 40 mL di soluzione sterile di PBS seguita da 20 mL di paraformaldeide (PFA) al 4%.
NOTA: Il successo della perfusione è indicato da un colore bianco nel fegato, mentre la presenza di polmoni ingrossati o di deflusso di PBS dalla bocca durante la perfusione suggerisce un fallimento della procedura. - Estrai rapidamente il cervello del topo, garantendo una degradazione minima delle proteine.
- Immergere il cervello del topo in PFA/PBS al 4% durante la notte per la post-fissazione, seguita dalla sostituzione con una soluzione di PB al 30% di saccarosio per 72 ore.
NOTA: È fondamentale evitare un'eccessiva disidratazione del tessuto cerebrale, quindi il cervello non deve essere lasciato nella soluzione di saccarosio PB per troppo tempo.
5. Sezionamento e colorazione dei tessuti congelati
- Incorporare il cervello di topo precedentemente disidratato in colla a temperatura di taglio ottimale (OCT), congelare il cervello incorporato e utilizzare un microtomo scorrevole per tagliare sezioni coronali con uno spessore di 20 μm.
- Posiziona le sezioni cerebrali sul vetrino. Una volta che le sezioni cerebrali sono asciutte, conservarle in frigorifero a -20 °C per gli esperimenti successivi.
- Metti ogni vetrino in una custodia e immergi il telaio in un contenitore pieno di PBS per risciacquare accuratamente il vetrino. Sciacquare delicatamente i vetrini cerebrali con la soluzione PBS tre volte, per 10 minuti ogni volta.
NOTA: Prestare attenzione per evitare che le sezioni cerebrali cadano dal vetrino. - Colorare i vetrini cerebrali con una soluzione di 4′,6-diamidino-2-fenilindolo (DAPI) per 10 minuti.
- Sciacquare i vetrini cerebrali con soluzione PBS per 5 minuti.
- Applicare una goccia di mezzo di montaggio antisbiadimento sulle sezioni cerebrali.
- Posiziona un vetrino coprioggetto sulle sezioni cerebrali, sigilla il vetrino coprioggetto con smalto per unghie e analizza le sezioni utilizzando un microscopio a fluorescenza convenzionale.
6. Induzione EAE
NOTA: Eseguire l'induzione EAE dopo 2 settimane dall'iniezione di shRNA o CRE-TAT ricombinasi11.
- Creare una soluzione acquosa mescolando 2,5 mg di glicoproteina oligodendrocitaria mielinica (MOG35-55) con 2 mL di PBS. Preparare una soluzione completa di olio adiuvante di Freunds (CFA) mescolando M. tuberculosis (H37Ra) con adiuvante di Freunds (IFA) incompleto.
- Mescolare le soluzioni acquose e oleose in rapporto 1:1. Usa una pipa a T per montare la miscela in uno stato di olio in acqua.
NOTA: Il tubo a T è anche chiamato tubo a tre vie. È un tubo di plastica in grado di controllare la direzione del flusso della soluzione per miscelare completamente il MOG35-55 e il CFA. - Utilizzare un omogeneizzatore ad alta velocità per produrre l'emulsione dell'antigene MOG per il modello EAE in condizioni di bagno di ghiaccio.
- Anestetizzare i topi per via intraperitoneale con pentobarbital sodico all'1% alla dose di 6-8 ml/kg equivalenti a 60-80 mg/kg di pentobarbital.
- Iniettare per via sottocutanea l'emulsione dell'antigene MOG in quattro punti diversi (collo, schiena, fianchi sinistro e destro) a un volume di 10 ml/kg per un totale di quattro iniezioni ciascuna.
NOTA: È importante selezionare attentamente il sito di iniezione, poiché siti diversi possono avere effetti diversi sulla morbilità e sulla mortalità dei topi. Inoltre, ripetute iniezioni di MOG possono portare alla tolleranza immunitaria, quindi il team di ricerca ha scelto un singolo metodo di iniezione per prevenire questo potenziale problema. - Iniettare immediatamente 500 ng/mL di tossina della pertosse (PT) per via intraperitoneale alla dose di 5 mg/kg dopo l'iniezione di MOG.
NOTA: Il PT aumenta la permeabilità della barriera emato-encefalica (BBB) e facilita l'infiltrazione delle cellule T nel cervello. - Dopo 48 ore, iniettare per via intraperitoneale la soluzione di PT allo stesso volume.
7. Punteggio di deficit neurologico
- Valutare e classificare i topi giornalmente utilizzando una scala di valutazione 16 che va da 0 a15 per valutare l'incidenza e la gravità dell'EAE in base ai seguenti deficit neurologici:
Coda: 0 indica l'assenza di segni, 1 rappresenta una coda semiparalizzata e 2 indica una coda completamente paralizzata.
Arti: 0 indica l'assenza di segni, 1 rappresenta un'andatura debole o alterata, 2 indica la paresi e 3 rappresenta un arto completamente paralizzato. - Assegna un punteggio di 12 a un animale tetraplegico con paralisi completa e assegna un punteggio di 15 alla mortalità.
8. Colorazione con ematossilina-eosina (H&E)
- Prendi il cervello di topo disidratato e incorporalo in paraffina fusa. Lasciare raffreddare e solidificare il blocco di paraffina per un uso successivo.
NOTA: Il blocco di paraffina deve essere completamente asciutto e fresco per evitare danni ai tessuti. - Tagliare il blocco di paraffina cerebrale di topo in vetrini spessi 5 μm. Disporre la sezione di cervello di topo di paraffina su un vetrino e asciugarla in forno a 60 °C per 3 ore.
- Immergere i vetrini in sequenza nella soluzione di xilene I per 10 min, nella soluzione di xilene II per 10 min, nell'alcol 100% I per 3 min, nell'alcol 100% II per 3 min, nell'alcol al 95% per 3 min, nell'alcol al 90% per 3 min, nell'alcool all'80% per 3 min, nell'alcool al 70% per 3 min e nell'acqua distillata per 1 min.
9. Analisi quantitativa della reazione a catena della polimerasi (qPCR)
- Dopo aver perfuso i topi con PBS, rimuovere il ChP dai ventricoli ed estrarre l'RNA con Trizol. Sintetizzare il cDNA utilizzando il primo kit di sintesi del cDNA a filamento.
- Eseguire l'analisi qPCR utilizzando la premiscela Ex Taq SYBR-green e un sistema di PCR in tempo reale. Utilizzare i seguenti primer A2AR: avanti - GCCATCCCATTCGCCATCA; inverso - GCAATAGCCAAGAGGCTGAAGA.
Risultati
Knockdown di A2AR specifico per ChP mediante iniezione ICV di AAV2/5-shRNA o CRE-TAT
Il ruolo di A2AR nel ChP come potente regolatore dell'informazione neurale nella patogenesi dell'EAE rimane poco chiaro. Abbattere l'espressione di A 2ARspecifica per ChP potrebbe far luce sugli effetti regolatori di A2AR sul sistema immunitario centrale nell'EAE e in altre infiammazioni del sistema nervoso. Questo studio ha utilizzato l'iniezione ICV di CRE-TAT per ridurre l'espressione di A 2A R nel ChP di A2AR flox/topiflox. Per garantire la specificità di ChP, abbiamo prima iniettato CRE-TAT nei ventricoli laterali di topi Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9). Le immagini indicano che la fluorescenza spontanea di tdTomato era limitata al tessuto ChP (Figura 2). Allo stesso modo, lo studio ha somministrato la proteina fluorescente verde potenziata con AAV2/5-CMV-A2AR-shRNA-CMV (EGFP) in topi C57BL/6 e ha scoperto che la fluorescenza EGFP era limitata allo strato di cellule epiteliali del ChP e non infettava le cellule parenchimali circostanti vicino ai ventricoli laterali (Figura 3).
Induzione EAE con MOG35-55
Per indurre EAE stabile, ai topi è stata iniettata per via sottocutanea un'emulsione composta da MOG35-55 e CFA, seguita da un'iniezione intraperitoneale di PT nei giorni 0 e 2 dopo l'immunizzazione (Figura 4). La Clinical Symptom Scale è stata utilizzata per valutare i punteggi EAE ogni giorno, in base alle condizioni della coda e degli arti. L'insorgenza dell'EAE è stata definita come il primo giorno con un punteggio EAE ≥1, mentre la durata tra l'insorgenza e il picco dei punteggi EAE è stata chiamata fase progressiva.
Il knockdown di A2AR specifico per ChP allevia la patologia EAE
Per studiare il coinvolgimento del segnale A 2A R nella patologia EAE, lo studio ha impiegato un knockdown A2A Rspecifico per ChP. Lo studio ha specificamente abbattuto A2A R nel ChP utilizzando l'iniezione ICV di CRE-TAT o AAV2/5-A2AR-shRNA. A 2 settimane dall'abbattimento, l'EAE è stata indotta dall'immunizzazione MOG35-55. I risultati hanno mostrato che, rispetto al gruppo di controllo, i topi con knockdown di A2AR hanno sviluppato una patologia EAE più lieve, come evidenziato da punteggi più bassi e da una ridotta infiltrazione di cellule immunitarie nel midollo spinale (Figura 5A,B,E,F). Inoltre, sono stati selezionati in modo casuale cinque topi indotti da EAE di ciascun gruppo al giorno 20 dopo l'immunizzazione MOG35-55. Dopo la perfusione con PBS, i ChP sono stati isolati per l'estrazione dell'RNA e la qPCR. L'analisi qPCR ha mostrato che i livelli di mRNA di A2AR erano ovviamente diminuiti nei gruppi AAV2/5-shRNA (A2AR-Kd) e CRE-TAT, rispetto a ciascun controllo (Figura 5C,D).

Figura 1: Localizzazione anatomica del sito di iniezione del ventricolo laterale. (A) Un diagramma schematico che mostra il punto di iniezione del virus. (B) Il sito di iniezione del ventricolo laterale si trova 0,58 mm sotto il bregma e 1,1 mm lateralmente alla sutura sagittale, come indicato dal punto rosso. (C) Un'immagine che mostra il sito di iniezione del virus su un topo. Fare clic qui per visualizzare una versione più grande di questa figura.
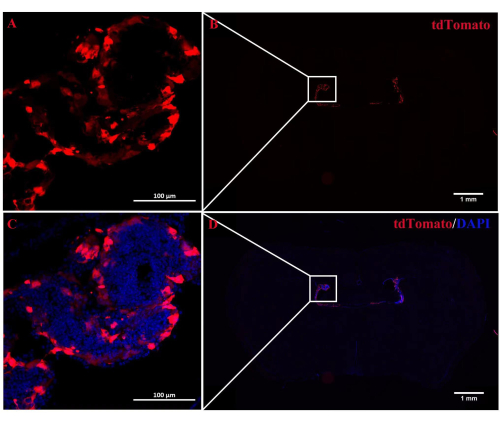
Figura 2: Localizzazione della fluorescenza di tdTomato nel ChP. (A,B) Immagine rappresentativa di topi Rosa-LSL (Lox-StoP-Lox)-tdTomato trattati con iniezione ICV di CRETAT. A 2 settimane di distanza, l'autofluorescenza di tdTomato è stata localizzata in modo specifico nel tessuto ChP (n = 3/gruppo). (C,D) Le immagini unite dell'autofluorescenza tdTomato e del DAPI. Fare clic qui per visualizzare una versione più grande di questa figura.
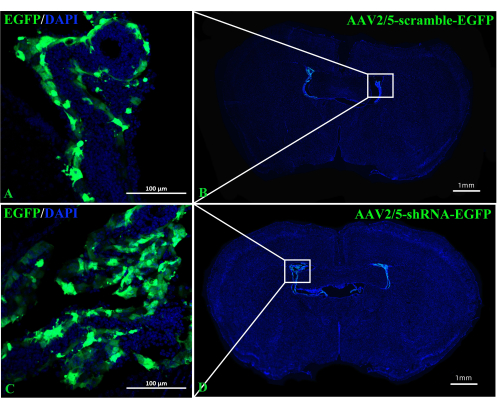
Figura 3: Immagini rappresentative di topi C57BL/6 scattate 2 settimane dopo l'iniezione ICV di AAV2/5-scramble-EGFP o AAV2/5-shRNA-EGFP. (A,B) Le immagini rappresentative dei topi iniettati con AAV2/5-scramble-EGFP (n = 3/gruppo). (C,D) Le immagini rappresentative di topi iniettati con AAV2/5-shRNA-EGFP (n = 3/gruppo). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Induzione del modello EAE. (A) In primo luogo, l'emulsione dell'antigene MOG viene iniettata per via sottocutanea in quattro diverse posizioni (collo, schiena, fianchi sinistro e destro), che sono contrassegnate da punti rossi. (B) Il PT viene iniettato per via intraperitoneale al momento dell'immunizzazione e ripetuto 2 giorni dopo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Il knockdown specifico per ChP di A 2A R ha alleviato la patologia EAE. (A) Il knockdown specifico per ChP di A 2A R in topiflox/flox A 2AR, ottenuto attraverso l'iniezione ICV di CRE-TAT, ha portato a una diminuzione dei punteggi clinici EAE (n = 6-7/gruppo). L'analisi statistica è stata eseguita utilizzando RM ANOVA a due vie, seguita dal test di confronto multiplo di Sidak. (B) Il knockdown ChP-specifico di A2AR in topi wild-type (WT), ottenuto con l'iniezione ICV di AAV2/5-shRNA, ha ridotto i punteggi clinici EAE (n = 7-8/gruppo). L'analisi statistica è stata eseguita utilizzando RM ANOVA a due vie, seguita dal test di confronto multiplo di Sidak. (C,D) Risultati dell'analisi qPCR dei livelli di mRNA A2AR nel tessuto ChP (n = 5/gruppo). L'analisi statistica è stata eseguita utilizzando un t-test spaiato. (E,F) Colorazione H&E. Il knockdown A2A Rspecifico per ChP ha attenuato l'infiltrazione delle cellule immunitarie nel midollo spinale. La significatività statistica è rappresentata come ###p < 0,001, **p < 0,01 e ***p < 0,001. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La ricerca ha presentato due approcci distinti per il knockdown mirato dei geni ChP. Il primo approccio prevedeva l'iniezione ICV di CRE-TAT, che contiene Cre ricombinasi, in topi flox A2AR/flox. Il secondo approccio ha comportato l'iniezione ICV di AAV2/5 trasportatore di shRNA di A2AR. Utilizzando queste due strategie, il lavoro ha ottenuto il knockdown selettivo di A 2A R all'interno del ChP ed è stato in grado di dimostrare gli effetti protettivi dell'inibizione della segnalazione di A2AR nel ChP sulla patologia EAE. Da notare che questo protocollo include due passaggi cruciali. In primo luogo, l'operazione di localizzazione stereotassica è essenziale e una deviazione significativa dalle coordinate suggerite può causare errori casuali. In secondo luogo, il volume del virus iniettato è fondamentale, poiché è stato riscontrato che anche l'iniezione di meno di 1 μL di virus (~6 x 1012) ha una certa possibilità di fallimento. Ciò è probabilmente dovuto alla necessità di una quantità adeguata di particelle virali per un'infezione sufficiente.
L'uso del sistema Cre/LoxP non ha permesso di osservare la distribuzione precisa della ricombinasi CRE-TAT nel cervello dopo l'iniezione di ICV. Di conseguenza, lo studio ha utilizzato topi Rosa-LSL (Lox-StoP-Lox)-tdTomato per tracciare la distribuzione di CRE-TAT utilizzando l'autofluorescenza della proteina tdTomato . La fluorescenza di tdTomato è stata localizzata esclusivamente nei tessuti ChP 2 settimane dopo l'iniezione intracerebroventricolare di CRE-TAT, indicando che la ricombinasi è stata assorbita principalmente dal ChP. Successivamente, CRE-TAT è stato somministrato a topi A2AR flox/flox ed è stata osservata una diminuzione dei livelli di mRNA A2AR nel tessuto ChP. Questa strategia di knockdown mirata è stata utilizzata per studiare il ruolo della segnalazione dei corticosteroidi nel ChP nel mediare lo stress psicologico17. In alternativa, la ricerca ha utilizzato AAV2/5 per fornire shRNA progettato per colpire i geni ChP. Studi precedenti hanno valutato la capacità di infezione di diversi sierotipi di AAV e lentivirus nel tessuto ChP e hanno scoperto che AAV2/5 e AAV2/8 erano i più efficaci14. Lo studio ha rivelato che AAV2/5 era in grado di infettare il ChP in modo specifico senza causare infezioni evidenti in altre regioni del cervello. Questi due metodi sono meno laboriosi delle classiche strategie di knockout che richiedono due linee transgeniche (linee Cre e Flox)6,18. Un limite di questo studio è l'assenza di un esperimento di guadagno di funzione con sovraespressione genica. Tuttavia, un possibile approccio per raggiungere questo obiettivo sarebbe quello di clonare l'intero cDNA e impacchettarlo nel virus AAV2/5, che verrebbe somministrato tramite infezione da ICV. In uno studio precedente, è stato riscontrato che la sovraespressione di NKCC1 nel ChP utilizzando AAV2/5 promuove la clearance del liquido cerebrospinale e riduce la ventricolomegalia in vivo9. È importante notare che la strategia AAV2/5 o Cre/LoxP ha il proprio vantaggio. L'iniezione ICV di CRE-TAT nei topi transgenici garantisce un'elevata efficienza di knockdown, poiché il gene bersaglio viene eliminato direttamente dal DNA delle cellule. Tuttavia, questo metodo dipende dalla produzione e dall'allevamento di topi floxati. D'altra parte, l'iniezione ICV di AAV2/5 evita il lungo processo di allevamento di topi transgenici. Tuttavia, l'efficienza di knockdown di questo metodo dipende in gran parte dalle prestazioni dell'shRNA progettato. Pertanto, i ricercatori possono scegliere un metodo adatto in base alle loro condizioni sperimentali.
La sclerosi multipla (SM) è una malattia autoimmune che causa infiammazione e demielinizzazione della sostanza bianca nel SNC19. Per studiare i meccanismi patologici della SM, i ricercatori hanno utilizzato un modello EAE che simula i sintomi della malattia, come la demielinizzazione e l'infiltrazione immunitaria. Questo modello è considerato ideale per la comprensione della SM. Nel 2009, è stato scoperto che le cellule immunitarie si infiltrano nel SNC attraverso il ChP, che è una via chiave per l'ingresso delle cellule immunitarie nella patologia della SM. La "prima ondata" di cellule immunitarie entra nel liquido cerebrospinale attraverso la ChP, seguita dalla "seconda ondata", che entra nel parenchima cerebrale attraverso la BBB20. La "prima ondata" di cellule immunitarie promuove l'infiammazione e accelera la perdita di BBB, quindi l'inibizione dell'infiltrazione immunitaria a livello della ChP potrebbe essere utile per un intervento precoce nella SM. Le chemochine e le molecole di adesione regolano l'attività di gating della ChP, controllando la capacità dei linfociti di infiltrarsi attraverso di essa21,22,23.
Studi precedenti hanno utilizzato knockout di tutto il corpo o tecnologia farmacologica (come gli anticorpi neutralizzanti) per studiare le molecole di segnalazione nella ChP, ma questi metodi non hanno definito con precisione la loro funzione biologica nel processo patologico della SM. In uno studio recente, i ricercatori hanno abbattuto A2AR, situato nel ChP di topiflox A2AR, e hanno scoperto che i punteggi EAE e l'infiltrazione immunitaria erano significativamente ridotti11. Questo studio conferma il ruolo della segnalazione A2AR nella ChP durante la patologia EAE e dimostra che i metodi di knockdown specifici per ChP sono strumenti utili per studiare la funzione di ChP nelle patologie del SNC.
In conclusione, il protocollo di manipolazione ChP-specifico è uno strumento ideale per esplorare la funzione biologica della ChP coinvolta nelle malattie degenerative del SNC, come il morbo di Parkinson, il morbo di Alzheimer, la sclerosi multipla e così via.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti o altre divulgazioni da dichiarare.
Riconoscimenti
Riconosciamo con gratitudine il sostegno della National Natural Science Foundation of China (Grant No. 31800903, assegnato a W. Zheng) e del Wenzhou Science and Technology Project (n. Y2020426, assegnato a Y. Y. Weng) per questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| A2ARflox/flox mice | State Key Laboratory of Ophthalmology, Optometry and Visual Science, Wenzhou Medical University | ||
| AAV2/5-A2AR-ShRNA virus | Shanghai Heyuan Biotechnology Co. LTD | pt-4828 | |
| antifade mounting medium | Beyotime Biotechnology | 0100-01 | |
| borosilicate glass capillary | Beijing Meiyaxian Technology Co. Ltd | B100-50-10 | |
| brain stereotaxic apparatus | RWD, Shenzhen | 69100 | |
| C57BL/6 mice | Beijing Vital Charles River Laboratory Animal Technology Company | ||
| CRE-TAT recombinase | Millipore | SCR508 | |
| DAPI | Absin | B25A031 | |
| frozen slicing machine | Leica | CM1950 | |
| H37Ra | Becton Dickinson and company | 231141 | |
| Hamilton syringe | Hamilton, American | P/N: 86259 | |
| Incomplete Freunds adjuvant | Sigma | F5506 | |
| Laser confocal microscope | Zeiss | LSM900 | |
| MOG35-55 | Suzhou Qiangyao Biotechnology Co., LTD | 4010006243 | |
| OCT glue | Epredia | 6502p | |
| paraformaldehyde | Chengdu Kelong Chemical Reagent Company | 30525-89-4 | |
| pentobarbital sodium | Boyun Biotech | PC13003 | |
| Pipette gun | Eppendorf | N45014F | |
| PrimeScript 1st Strand cDNA Synthesis Kit | Takara | 6110A | |
| Real- Time PCR System | BioRad | CFX96 | |
| Rosa-LSL (Lox-StoP-Lox)-tdTomato mice | Jackson Laboratory | ||
| sucrose | Sangon Biotech | A502792-0500 | |
| super high speed homogenizer | IKA | 3737025 | |
| Trizol | Invitrogen | 15596026 | |
| xylene solution | Chengdu Kelong Chemical Reagent Company | 1330-20-7 |
Riferimenti
- Damkier, H. H., Brown, P. D., Praetorius, J. Cerebrospinal fluid secretion by the choroid plexus. Physiological Reviews. 93 (4), 1847-1892 (2013).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews: Neuroscience. 16 (8), 445-457 (2015).
- Wolburg, H., Paulus, W. Choroid plexus: biology and pathology. Acta Neuropathologica. 119 (1), 75-88 (2010).
- Solar, P., Zamani, A., Kubickova, L., Dubovy, P., Joukal, M. Choroid plexus and the blood-cerebrospinal fluid barrier in disease. Fluids Barriers CNS. 17 (1), 35(2020).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Myung, J., et al. The choroid plexus is an important circadian clock component. Nature Communications. 9 (1), 1062(2018).
- Zhang, Y., et al. A transgenic FOXJ1-Cre system for gene inactivation in ciliated epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 36 (5), 515-519 (2007).
- Johansson, P. A., et al. The transcription factor Otx2 regulates choroid plexus development and function. Development. 140 (5), 1055-1066 (2013).
- Xu, H., et al. Choroid plexus NKCC1 mediates cerebrospinal fluid clearance during mouse early postnatal development. Nature Communications. 12 (1), 447(2021).
- Spatazza, J., et al. Choroid-plexus-derived Otx2 homeoprotein constrains adult cortical plasticity. Cell Reports. 3 (6), 1815-1823 (2013).
- Zheng, W., et al. Choroid plexus-selective inactivation of adenosine A2A receptors protects against T cell infiltration and experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 19 (1), 52(2022).
- Steffensen, A. B., et al. Cotransporter-mediated water transport underlying cerebrospinal fluid formation. Nature Communications. 9 (1), 2167(2018).
- Zhu, L., et al. Klotho controls the brain-immune system interface in the choroid plexus. Proceedings of the National Academy of Sciences. 115 (48), E11388-E11396 (2018).
- Chen, X., et al. Different serotypes of adeno-associated virus vector- and lentivirus-mediated tropism in choroid plexus by intracerebroventricular delivery. Human Gene Therapy. 31 (7-8), 440-447 (2020).
- Konsman, J. P. The mouse brain in stereotaxic coordinates. Psychoneuroendocrinology. 6 (28), 827-828 (2003).
- Weaver, A., et al. An elevated matrix metalloproteinase (MMP) in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization. FASEB J. 19 (12), 1668-1670 (2005).
- Kertser, A., et al. Corticosteroid signaling at the brain-immune interface impedes coping with severe psychological stress. Science Advances. 5 (5), 4111(2019).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Compston, A., Coles, A. Multiple sclerosis. Lancet. 372 (9648), 1502-1517 (2008).
- Reboldi, A., et al. C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE. Nature Immunology. 10 (5), 514-523 (2009).
- Jovanova-Nesic, K., et al. Choroid plexus connexin 43 expression and gap junction flexibility are associated with clinical features of acute EAE. Annals of the New York Academy of Sciences. 1173, 75-82 (2009).
- Jovanova-Nesic, K., Jovicic, S., Sovilj, M., Spector, N. H. Magnetic brain stimulation upregulates adhesion and prevents Eae: MMP-2, ICAM-1, and VCAM-1 in the choroid plexus as a target. International Journal of Neuroscience. 119 (9), 1399-1418 (2009).
- Mills, J. H., Alabanza, L. M., Mahamed, D. A., Bynoe, M. S. Extracellular adenosine signaling induces CX3CL1 expression in the brain to promote experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 9, 193(2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon