Method Article
Knockdown direcionado de genes no plexo coroide
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, descrevemos um método para alterar seletivamente a expressão gênica no plexo coroide, evitando qualquer impacto em outras áreas cerebrais.
Resumo
O plexo coroide (PCh) serve como uma porta de entrada crítica para a infiltração de células imunes no sistema nervoso central (SNC) em condições fisiológicas e patológicas. Pesquisas recentes mostraram que regular a atividade da ChP pode oferecer proteção contra distúrbios do SNC. No entanto, estudar a função biológica da ChP sem afetar outras regiões cerebrais é um desafio devido à sua estrutura delicada. Este estudo apresenta um novo método para knockdown gênico em tecido ChP usando vírus adenoassociados (AAVs) ou enzima de recombinação de ciclização (Cre) proteína recombinase consistindo de sequência TAT (CRE-TAT). Os resultados demonstram que, após a injeção de AAV ou CRE-TAT no ventrículo lateral, a fluorescência foi concentrada exclusivamente na ChP. Usando esta abordagem, o estudo derrubou com sucesso o receptor de adenosina A 2A (A2A R) na ChP usando RNA de interferência (RNAi) ou Cre/locus de sistemas X-overP1 (Cre/LoxP), e mostrou que esse knockdown poderia aliviar a patologia da encefalomielite autoimune experimental (EAE). Essa técnica pode ter implicações importantes para pesquisas futuras sobre o papel da ChP nos distúrbios do SNC.
Introdução
Acreditava-se que o plexo coroide (PCc) ajudava a manter a homeostase funcional do cérebro por meio da secreção de líquido cefalorraquidiano (LCR) e fator neurotrófico derivado do cérebro (BDNF)1,2. Pesquisas crescentes nas últimas três décadas têm revelado que a ChP representa uma via distinta para a infiltração de células imunes no sistema nervoso central (SNC).
As tight junctions (TJs) da ChP, compostas por um epitélio de ChP monocamada, mantêm a homeostase imunológica, impedindo a entrada de macromoléculas e células imunes no cérebro3. No entanto, sob certas condições patológicas, o tecido ChP detecta e responde a padrões moleculares associados ao perigo (DAMPs) no LCR e no sangue, levando a infiltração imunológica anormal e disfunção cerebral 4,5. Apesar de seu papel crítico, o pequeno tamanho da ChP e a localização única no cérebro dificultam o estudo de sua função sem afetar outras regiões cerebrais. Portanto, manipular a expressão gênica especificamente na ChP é uma abordagem ideal para entender sua função.
Inicialmente, linhagens transgênicas da enzima de recombinação de ciclização (Cre), que expressam Cre sob o controle de promotores específicos de genes expressos na ChP, foram comumente utilizadas para deletar genes-alvo por meio de cruzamento com genes candidatos floxados 6,7,8. Por exemplo, o fator de transcrição Forkhead box J1 (FoxJ1) é expresso exclusivamente no epitélio ChP do cérebro pré-natal de camundongos7. Assim, a linhagem FoxJ1-Cre foi frequentemente utilizada para deletar genes localizados na ChP 6,9. No entanto, o sucesso desta estratégia depende muito da especificidade do promotor. Descobriu-se gradualmente que o padrão de expressão de FoxJ1 não era suficientemente distinto, pois FoxJ1 também estava presente em células epiteliais ciliadas em outras partes do cérebro e sistema periférico7. Para superar essa limitação, foi realizada injeção intracerebroventricular (ICV) de Cre recombinase para liberar a recombinase nos ventrículos das linhas transgênicas floxed. Essa estratégia apresentou alta especificidade, evidenciada pela presença de fluorescência do tdTomato apenas no tecido daChP10,11. No entanto, este método ainda é limitado pela disponibilidade de linhagens de camundongos transgênicos floxed. Para resolver essa questão, pesquisadores têm empregado a injeção de ICV de vírus adenoassociado (AAV) para alcançar knockdown específico de ChP ou a superexpressão de genes-alvo12,13. Uma avaliação abrangente de diferentes sorotipos de AAV para infecção por ChP revelou que AAV2/5 e AAV2/8 exibem fortes habilidades de infecção na ChP, enquanto não infectam outras regiões cerebrais. No entanto, AAV2/8 infectou o ependima ao redor dos ventrículos, enquanto o grupo AAV2/5 não apresentou infecção14. Este método tem a vantagem de superar as limitações da aquisição de animais transgênicos floxed.
Este artigo descreve um protocolo passo-a-passo para knockdown gênico na ChP usando dois métodos: ICV de AAV2/5 carregando shRNA do receptor de adenosina A 2A (A 2A R) e proteína Cre recombinase consistindo de sequência TAT (CRE-TAT) recombinase para alcançar knockdown ChP-específico de A2A R. Os resultados do estudo sugerem que derrubar A2AR na ChP pode aliviar a encefalomielite autoimune experimental (EAE). Este protocolo detalhado fornece orientação útil para estudos da função ChP e knockdown específico de genes na ChP.
Protocolo
Todos os procedimentos em animais descritos neste estudo foram conduzidos de acordo com as diretrizes descritas no Guia do NIH para o Cuidado e Uso de Animais de Laboratório e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade Médica de Wenzhou.
1. Animais
- Compre camundongos C57BL/6 machos com idade entre 8-12 semanas e pesando 20-22 g.
- Obter a linhagem transgênica Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9) e camundongos machos A2ARflox/fox .
- Atribua aleatoriamente os camundongos a dois grupos e aloja-se em gaiolas, com um máximo de cinco camundongos por gaiola, sob um ciclo padrão de 12 h claro/12 h escuro por 1 semana.
- Fornecer aos ratos comida e água suficientes e mantê-los a uma temperatura constante a 25 °C.
2. Knockdown específico de ChP de A2ARs com AAV2/5-shRNA
- Pese cada mouse e anote os valores.
- Anestesiar os camundongos por via intraperitoneal com pentobarbital sódico a 1% na dose de 6-8 mL/kg equivalente a 60-80 mg/kg de pentobarbital e colocar o mouse em uma almofada de aquecimento para mantê-lo aquecido.
NOTA: É crucial administrar a dosagem correta de pentobarbital sódico de acordo com o peso do rato para garantir o sucesso da cirurgia. A anestesia não deve ser muito profunda, pois pode resultar em mortalidade, mas não deve ser muito superficial, pois o camundongo pode acordar durante o procedimento, potencialmente afetando a eficácia da injeção do vírus. Verifique a dose adequada de anestesia por pinça dos dedos dos pés e certifique-se de que os ratos não respondem. - Use um barbeador de rato especializado para aparar o cabelo superior dos ratos anestesiados.
- Aplique pomada ocular em ambos os olhos para evitar o ressecamento e fixe os ratos em um aparelho estereotáxico para imobilizar o cérebro. Cubra o animal com um campo estéril.
- Esterilize completamente a pele da cabeça e pescoço dos ratos com três rodadas de desinfetante iodóforo e álcool a 75% para reduzir a infecção pós-operatória. Em seguida, aplique lidocaína a 1% topicamente no couro cabeludo de camundongos e faça uma pequena incisão para expor totalmente o crânio sob um microscópio.
OBS: Utilizar instrumentos estéreis durante todo o procedimento. - Preparar duas seringas de 10 μL: uma com AAV2/5-A 2A R-shRNA comprado (título: 6,27 × 109 vg/μL) e outra com AAV2/5-Scramble comprado (título:6,21× 109 vg/μL).
NOTA: Ao usar a seringa, a extremidade frontal precisa ser conectada a um capilar de vidro, e uma faixa de 10 μL pode ser obtida controlando o comprimento do capilar de vidro. - Utilizar o microscópio para localizar o bregma e lambda e definir o ponto de coordenadas (AP: -0,58; LM: ±1,10; DL: -2,20) na seringa de 10 μL (Figura 1). O ponto coordenado é baseado no atlas estereotáxico cerebral de camundongos15.
- Faça um pequeno orifício no crânio no ponto de coordenada ajustado.
NOTA: Sob o microscópio, a perfuração é realizada usando uma microbroca estéril contra a superfície do crânio. Após a perfuração, removendo as meninges que cobrem o cérebro e expondo o parênquima cerebral subjacente, a lesão nos vasos sanguíneos é evitada. Essa etapa evita que a ponta do capilar de vidro seja quebrada pelas meninges. O diâmetro do orifício perfurado deve ser suficiente para permitir que a ponta da agulha entre no tecido cerebral. - Administrar 2 μL do vírus AAV2/5-A2AR-shRNA no ventrículo cerebral através de injeção lateral a uma taxa constante de 100 nL/min. Mantenha a agulha no lugar por 10 minutos antes de retirar. Note-se que o vírus foi administrado com injeção unilateral.
- Sele a pele lesionada usando cola de biofibrina médica imediatamente para evitar a perda de vírus, que pode ser enxaguado com LCR depois de remover a agulha se a cola não for aplicada rapidamente. Além disso, não use cotonetes para limpar o LCR, pois também pode causar perda de vírus.
- Para facilitar a recuperação, coloque o mouse em uma almofada de aquecimento para manter a temperatura corporal em 37,0 ± 0,5 °C e aplique lidocaína a 1% topicamente no couro cabeludo do mouse. Permitir que os camundongos se recuperem por 2 semanas antes de induzir o modelo EAE, pois esse período é necessário para a expressão do vírus AAV2/5-A2AR-shRNA e subsequente knockdown A2AR.
3. Knockdown específico de ChP de A2AR com um Cre/locus do sistema X-overP1 (Cre/LoxP)
Observação : os procedimentos a seguir podem ser obtidos usando o método descrito anteriormente. Consulte os passos 2.1-2.11 para obter métodos de injeção detalhados.
- Injetar 2 μL de CRE-TAT recombinase em cada ventrículo lateral de um camundongo Rosa-LSL (Lox-StoP-Lox)-tdTomato como grupo experimental e 2 μL de solução salina tamponada com fosfato estéril (PBS) como grupo controle. Usando o mesmo protocolo acima (seção 2), injete 2 μL de CRE-TAT recombinase em cada um dos ventrículos laterais de camundongos A2AR flox/flox juntamente com 2 μL de PBS estéril como grupo controle.
- Preparar cortes de tecido congelado e realizar coloração nuclear 2 semanas após a injeção de CRE-TAT recombinase. Consulte as etapas 4.1-4.3 para obter mais informações.
4. Perfusão transcárdica em camundongos
- Administrar 60-80 mg/kg de pentobarbital sódico para anestesiar profundamente os camundongos. Confirmar o plano de anestesia por uma pinça dos dedos dos pés e realizar a perfusão transcárdica usando 40 mL de solução estéril de PBS seguida de 20 mL de paraformaldeído (PFA) a 4%.
NOTA: A perfusão bem-sucedida é indicada por uma cor branca no fígado, enquanto a presença de pulmões aumentados ou saída de PBS da boca durante a perfusão sugere uma falha do procedimento. - Extraia rapidamente o cérebro do rato, garantindo uma degradação mínima das proteínas.
- Submergir o cérebro de camundongos em PFA/PBS a 4% durante a noite para pós-fixação, seguido de substituição por solução de sacarose PB a 30% por 72 h.
NOTA: É fundamental evitar a desidratação excessiva do tecido cerebral, por isso o cérebro não deve ser deixado na solução de sacarose PB por muito tempo.
5. Corte e coloração de tecidos congelados
- Incorpore o cérebro de camundongo previamente desidratado em cola de temperatura de corte ideal (OCT), congele o cérebro embutido e use um micrótomo deslizante para cortar seções coronais com uma espessura de 20 μm.
- Coloque as seções cerebrais na lâmina de vidro. Quando as seções cerebrais estiverem secas, armazene-as em uma geladeira de -20 °C para experimentos subsequentes.
- Coloque cada lâmina de vidro em uma caixa de moldura e submerja a moldura em um recipiente cheio de PBS para enxaguar completamente a lâmina. Enxaguar suavemente as lâminas cerebrais com solução de PBS três vezes, por 10 min cada vez.
NOTA: Deve-se ter cuidado para evitar que as seções cerebrais caiam da lâmina de vidro. - Manchar as lâminas cerebrais com solução de 4′,6-diamidino-2-fenilindol (DAPI) por 10 min.
- Enxaguar as lâminas cerebrais com solução PBS por 5 min.
- Aplique uma gota de meio de montagem antifade nas seções cerebrais.
- Coloque uma lamínula nas seções cerebrais, sele a lamínula com esmalte e analise as seções usando um microscópio de fluorescência convencional.
6. Indução do EAE
NOTA: Realizar indução de EAE após 2 semanas da injeção de shRNA ou CRE-TAT recombinase11.
- Criar uma solução aquosa misturando 2,5 mg de glicoproteína de oligodendrócitos de mielina (MOG35-55) com 2 mL de PBS. Preparar uma solução completa de óleo de adjuvante de Freunds (CFA) misturando M. tuberculosis (H37Ra) com adjuvante de Freunds incompleto (IFA).
- Misture as soluções aquosas e oleosas na proporção de 1:1. Use um tubo de tee para bater a mistura em um estado de óleo em água.
NOTA: O tee pipe também é chamado de tubo de três vias. É um tubo de plástico que pode controlar a direção da solução de fluxo para misturar totalmente o MOG35-55 e CFA. - Use um homogeneizador de alta velocidade para fazer a emulsão de antígeno MOG para o modelo EAE em condições de banho de gelo.
- Anestesiar os camundongos por via intraperitoneal com pentobarbital sódico a 1% na dose de 6-8 mL/kg equivalente a 60-80 mg/kg de pentobarbital.
- Injetar subcutaneamente a emulsão do antígeno MOG em quatro pontos diferentes (pescoço, costas, quadris esquerdo e direito) a um volume de 10 mL/kg para um total de quatro injeções cada.
NOTA: É importante selecionar cuidadosamente o local de injeção, pois diferentes locais podem ter efeitos variados na morbidade e mortalidade de camundongos. Além disso, injeções repetidas de MOG podem levar à tolerância imunológica, então a equipe de pesquisa escolheu um único método de injeção para evitar esse problema potencial. - Injetar imediatamente 500 ng/mL de toxina pertussis (TP) por via intraperitoneal na dose de 5 mg/kg após a injeção de MOG.
NOTA: O PT aumenta a permeabilidade da barreira hematoencefálica (BHE) e facilita a infiltração de células T no cérebro. - Após 48 h, injetar intraperitonealmente a solução de TP no mesmo volume.
7. Escore de déficit neurológico
- Avaliar e classificar os camundongos diariamente usando uma escala de classificação16 que varia de 0 a 15 para avaliar a incidência e gravidade do EAE de acordo com os seguintes déficits neurológicos:
Cauda: 0 indica nenhum sinal, 1 representa uma cauda semiparalisada e 2 indica uma cauda totalmente paralisada.
Membros: 0 indica nenhum sinal, 1 representa uma marcha fraca ou alterada, 2 indica paresia e 3 representa um membro totalmente paralisado. - Atribua a um animal tetraplégico com paralisia completa uma pontuação de 12 e atribua à mortalidade uma pontuação de 15.
8. Coloração hematoxilina-eosina (H&E)
- Pegue o cérebro de camundongo desidratado e embuta-o em parafina derretida. Deixe o bloco de parafina esfriar e solidificar para uso posterior.
NOTA: O bloco de parafina deve estar completamente seco e fresco para evitar danos teciduais. - Corte o bloco de parafina cerebral de camundongo em lâminas de 5 μm de espessura. Coloque a secção do cérebro do rato em parafina numa lâmina de vidro e seque-a num forno a 60 °C durante 3 horas.
- Submergir as lâminas sequencialmente em solução de xileno I por 10 min, solução de xileno II por 10 min, álcool 100% I por 3 min, álcool 100% II por 3 min, álcool 95% por 3 min, álcool 90% por 3 min, álcool 80% por 3 min, álcool 70% por 3 min e água destilada por 1 min.
9. Análise quantitativa da reação em cadeia da polimerase (qPCR)
- Depois de perfundir os camundongos com PBS, remova a ChP dos ventrículos e extraia o RNA com Trizol. Sintetizar o cDNA usando o primeiro Strand cDNA Synthesis Kit.
- Realize análise de qPCR usando pré-mistura verde Ex Taq SYBR e um sistema de PCR em tempo real. Use os seguintes primers A2AR: forward - GCCATCCCATTCGCCATCA; reverso - GCAATAGCCAAGAGGCTGAAGA.
Resultados
knockdown de A2AR específico para ChP por injeção ICV de AAV2/5-shRNA ou CRE-TAT
O papel de A2AR na ChP como um poderoso regulador da informação neural na patogênese do EAE permanece obscuro. Derrubar a expressão de A 2A R específica de ChP poderia lançar luz sobre os efeitos regulatórios de A2AR no sistema imunológico central em EAE e outras inflamações do sistema nervoso. Este estudo usou a injeção ICV de CRE-TAT para diminuir a expressão de A 2A R na ChP de camundongos A2AR flox/flox. Para garantir a especificidade da ChP, primeiramente injetamos CRE-TAT nos ventrículos laterais de camundongos Rosa-LSL (Lox-StoP-Lox)-tdTomato (Ai9). As imagens indicam que a fluorescência espontânea do tdTomato foi restrita ao tecido ChP (Figura 2). Da mesma forma, o estudo administrou AAV2/5-CMV-A2AR-shRNA-CMV-enhanced green fluorescent protein (EGFP) em camundongos C57BL/6 e descobriu que a fluorescência do EGFP era limitada à camada de células epiteliais da ChP e não infectava as células parenquimatosas vizinhas perto dos ventrículos laterais (Figura 3).
Indução de EAE com MOG35-55
Para induzir EAE estável, camundongos foram injetados por via subcutânea com uma emulsão composta por MOG35-55 e CFA, seguida de injeção intraperitoneal de TP nos dias 0 e 2 após a imunização (Figura 4). A Escala de Sintomas Clínicos foi utilizada para avaliar diariamente os escores da EAE, com base na condição da cauda e dos membros. O início do EAE foi definido como o primeiro dia com um escore de EAE ≥1, enquanto a duração entre o início e o pico do EAE foi chamada de estágio progressivo.
ChP-específico A2AR knockdown alivia a patologia EAE
Para investigar o envolvimento do sinal A 2A R na patologia EAE, o estudo empregou um knockdown A2AR específicopara ChP. O estudo derrubou especificamente A 2A R na ChP usando a injeção ICV de CRE-TAT ou AAV2/5-A2AR-shRNA. Após 2 semanas do knockdown, o EAE foi induzido pela imunização MOG35-55. Os resultados mostraram que, comparados ao grupo controle, camundongos com knockdown A2AR desenvolveram patologia EAE mais leve, evidenciada por escores mais baixos e menor infiltração de células imunes na medula espinhal (Figura 5A,B,E,F). Além disso, cinco camundongos induzidos por EAE de cada grupo no dia 20 após a imunização com MOG35-55 foram selecionados aleatoriamente. Após a perfusão com PBS, as ChPs foram isoladas para extração de RNA e qPCR. A análise de qPCR mostrou que os níveis de RNAm de A 2A R estavam obviamente diminuídos nos grupos AAV2/5-shRNA (A2AR-Kd) e CRE-TAT, em comparação com cada controle (Figura 5C,D).

Figura 1: Localização anatômica do local de injeção do ventrículo lateral. (A) Um diagrama esquemático mostrando o ponto de injeção do vírus. (B) O local de injeção do ventrículo lateral está localizado 0,58 mm abaixo do bregma e 1,1 mm lateral à sutura sagital, conforme indicado pelo ponto vermelho. (C) Uma imagem mostrando o local da injeção do vírus em um mouse. Clique aqui para ver uma versão maior desta figura.
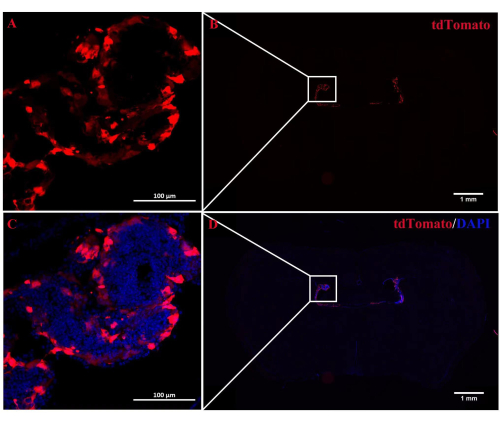
Figura 2: Localização da fluorescência do tdTomato na imagem representativa do ChP. (A,B) de camundongos Rosa-LSL (Lox-StoP-Lox)-tdTomato tratados com injeção ICV de CRETAT. Após 2 semanas, a autofluorescência tdTomato foi localizada especificamente no tecido ChP (n = 3/grupo). (C,D) As imagens mescladas da autofluorescência tdTomato e DAPI. Clique aqui para ver uma versão maior desta figura.
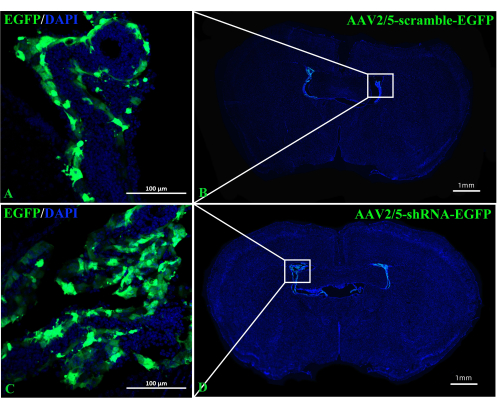
Figura 3: Imagens representativas de camundongos C57BL/6 obtidas 2 semanas após a injeção ICV de AAV2/5-scramble-EGFP ou AAV2/5-shRNA-EGFP. (A,B) As imagens representativas de camundongos injetados com AAV2/5-scramble-EGFP (n = 3/grupo). (C,D) As imagens representativas de camundongos injetados com AAV2/5-shRNA-EGFP (n = 3/grupo). Clique aqui para ver uma versão maior desta figura.

Figura 4: Indução do modelo EAE. (A) Em primeiro lugar, a emulsão antigênica MOG é injetada subcutaneamente em quatro locais diferentes (pescoço, costas, quadris esquerdo e direito), que são denotados por pontos vermelhos. (B) O TP é injetado intraperitonealmente no momento da imunização e repetido 2 dias depois. Clique aqui para ver uma versão maior desta figura.

Figura 5: Knockdown específico de ChP de A 2A R aliviou a patologia EAE. (A) O knockdown específico para ChP de A2AR em camundongos A 2AR flox/fox, obtido através da injeção ICV de CRE-TAT, levou à diminuição dos escores clínicos do EAE (n = 6-7/grupo). A análise estatística foi realizada por meio da ANOVA de RM twoway seguida do teste de comparações múltiplas de Sidak. (B) O knockdown específico para ChP de A2AR em camundongos selvagens (WT), obtido com a injeção de ICV de AAV2/5-shRNA, diminuiu os escores clínicos do EAE (n = 7-8/grupo). A análise estatística foi realizada por meio da ANOVA de RM twoway seguida do teste de comparações múltiplas de Sidak. (C,D) Resultados da análise por qPCR dos níveis de mRNAA 2AR no tecido ChP (n = 5/grupo). A análise estatística foi realizada por meio do teste t não pareado. (E,F) coloração H&E. ChP-específico A2AR knockdown atenuou a infiltração de células imunes na medula espinhal. A significância estatística é representada como ###p < 0,001, **p < 0,01 e ***p < 0,001. Clique aqui para ver uma versão maior desta figura.
Discussão
A pesquisa apresentou duas abordagens distintas para o knockdown direcionado de genes ChP. A primeira abordagem envolveu a injeção ICV de CRE-TAT, que contém Cre recombinase, em camundongos A2AR flox/flox. A segunda abordagem envolveu a injeção de ICV de AAV2/5 carregando shRNA de A2AR. Utilizando essas duas estratégias, o trabalho conseguiu o knockdown seletivo de A 2A R dentro da ChP e foi capaz de demonstrar os efeitos protetores da inibição da sinalização A2AR na ChP na patologia EAE. Vale ressaltar que esse protocolo inclui duas etapas cruciais. Em primeiro lugar, a operação de localização estereotáxica é essencial, e um desvio significativo das coordenadas sugeridas pode resultar em falhas aleatórias. Em segundo lugar, o volume do vírus injetado é crítico, pois foi descoberto que injetar menos de 1 μL de vírus (~6 x 1012) também tem uma certa chance de falha. Isto é possivelmente devido à necessidade de uma quantidade adequada de partículas virais para infecção suficiente.
O uso do sistema Cre/LoxP não permitiu observar a distribuição precisa da recombinase CRE-TAT no cérebro após a injeção de ICV. Como resultado, o estudo utilizou camundongos Rosa-LSL (Lox-StoP-Lox)-tdTomato para rastrear a distribuição de CRE-TAT usando a autofluorescência da proteína tdTomato. A fluorescência do tdTomato foi localizada exclusivamente nos tecidos da ChP 2 semanas após a injeção intracerebroventricular de CRE-TAT, indicando que a recombinase foi primariamente absorvida pela ChP. Em seguida, CRE-TAT foi administrado a camundongos A 2A R flox/flox, e uma diminuição nos níveis de mRNA A2AR foi observada no tecido ChP. Essa estratégia de knockdown direcionado foi utilizada para investigar o papel da sinalização de corticosteroides na ChP na mediação do estresse psicológico17. Alternativamente, a pesquisa usou AAV2/5 para entregar shRNA projetado para atingir genes ChP. Estudos anteriores avaliaram a capacidade de infecção de diferentes sorotipos de AAVs e lentivírus no tecido ChP e descobriram que AAV2/5 e AAV2/8 foram os mais efetivos14. O estudo revelou que AAV2/5 foi capaz de infectar a ChP especificamente sem causar infecções óbvias em outras regiões do cérebro. Esses dois métodos são menos trabalhosos do que as estratégias clássicas de knockout, que requerem duas linhagens transgênicas (linhas Cre e Flix)6,18. Uma limitação deste estudo é a ausência de um experimento de ganho de função com superexpressão gênica. No entanto, uma possível abordagem para conseguir isso seria clonar o cDNA completo e empacotá-lo no vírus AAV2/5, que seria administrado via infecção por ICV. Em um estudo anterior, a superexpressão de NKCC1 na ChP usando AAV2/5 foi encontrada para promover a depuração do LCR e reduzir a ventriculomegalia in vivo9. É importante notar que a estratégia AAV2/5 ou Cre/LoxP tem sua própria vantagem. A injeção ICV de CRE-TAT em camundongos transgênicos garante alta eficiência de knockdown, pois o gene alvo é diretamente deletado do DNA das células. No entanto, este método depende da produção e reprodução de camundongos floxed. Por outro lado, a injeção de AAV2/5 no ICV evita o demorado processo de criação de camundongos transgênicos. No entanto, a eficiência de knockdown deste método depende em grande parte do desempenho do shRNA projetado. Portanto, os pesquisadores podem escolher um método adequado com base em suas condições experimentais.
A esclerose múltipla (EM) é uma doença autoimune que causa inflamação e desmielinização da substância branca no SNC19. Para estudar os mecanismos patológicos da EM, os pesquisadores usaram um modelo de EAE que simula os sintomas da doença, como desmielinização e infiltração imunológica. Esse modelo é considerado ideal para o entendimento da EM. Em 2009, descobriu-se que as células imunes se infiltram no SNC através da ChP, que é uma rota chave para a entrada de células imunes na patologia da EM. A "primeira onda" de células imunes entra no LCR através da ChP, seguida pela "segunda onda", que entra no parênquima cerebral através da BBB20. A "primeira onda" de células imunes promove inflamação e acelera o extravasamento de BBB, de modo que inibir a infiltração imune na ChP poderia ser útil para a intervenção precoce na EM. As quimiocinas e moléculas de adesão regulam a atividade gating da ChP, controlando a capacidade de infiltração dos linfócitos através dela21,22,23.
Estudos anteriores usaram knockout de corpo inteiro ou tecnologia farmacológica (como anticorpos neutralizantes) para investigar moléculas sinalizadoras na ChP, mas esses métodos não definiram com precisão sua função biológica no processo patológico da EM. Em um estudo recente, os pesquisadores derrubaram A 2A R, localizado na ChP de camundongos A2ARflox/flox, e descobriram que as pontuações de EAE e a infiltração imunológica foram significativamente reduzidas11. Este estudo confirma o papel da sinalização A2AR na ChP durante a patologia EAE e demonstra que métodos knockdown específicos para ChP são ferramentas úteis para estudar a função da ChP em patologias do SNC.
Em conclusão, o protocolo de manipulação específico da ChP é uma ferramenta ideal para explorar a função biológica da ChP envolvida em doenças degenerativas no SNC, como doença de Parkinson, doença de Alzheimer, SM e assim por diante.
Divulgações
Os autores afirmam que não têm interesses financeiros concorrentes ou outras divulgações a declarar.
Agradecimentos
Agradecemos o apoio da Fundação Nacional de Ciências Naturais da China (Grant No. 31800903, concedido a W. Zheng) e do Wenzhou Science and Technology Project (No. Y2020426, concedido a Y. Y. Weng) por este trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| A2ARflox/flox mice | State Key Laboratory of Ophthalmology, Optometry and Visual Science, Wenzhou Medical University | ||
| AAV2/5-A2AR-ShRNA virus | Shanghai Heyuan Biotechnology Co. LTD | pt-4828 | |
| antifade mounting medium | Beyotime Biotechnology | 0100-01 | |
| borosilicate glass capillary | Beijing Meiyaxian Technology Co. Ltd | B100-50-10 | |
| brain stereotaxic apparatus | RWD, Shenzhen | 69100 | |
| C57BL/6 mice | Beijing Vital Charles River Laboratory Animal Technology Company | ||
| CRE-TAT recombinase | Millipore | SCR508 | |
| DAPI | Absin | B25A031 | |
| frozen slicing machine | Leica | CM1950 | |
| H37Ra | Becton Dickinson and company | 231141 | |
| Hamilton syringe | Hamilton, American | P/N: 86259 | |
| Incomplete Freunds adjuvant | Sigma | F5506 | |
| Laser confocal microscope | Zeiss | LSM900 | |
| MOG35-55 | Suzhou Qiangyao Biotechnology Co., LTD | 4010006243 | |
| OCT glue | Epredia | 6502p | |
| paraformaldehyde | Chengdu Kelong Chemical Reagent Company | 30525-89-4 | |
| pentobarbital sodium | Boyun Biotech | PC13003 | |
| Pipette gun | Eppendorf | N45014F | |
| PrimeScript 1st Strand cDNA Synthesis Kit | Takara | 6110A | |
| Real- Time PCR System | BioRad | CFX96 | |
| Rosa-LSL (Lox-StoP-Lox)-tdTomato mice | Jackson Laboratory | ||
| sucrose | Sangon Biotech | A502792-0500 | |
| super high speed homogenizer | IKA | 3737025 | |
| Trizol | Invitrogen | 15596026 | |
| xylene solution | Chengdu Kelong Chemical Reagent Company | 1330-20-7 |
Referências
- Damkier, H. H., Brown, P. D., Praetorius, J. Cerebrospinal fluid secretion by the choroid plexus. Physiological Reviews. 93 (4), 1847-1892 (2013).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews: Neuroscience. 16 (8), 445-457 (2015).
- Wolburg, H., Paulus, W. Choroid plexus: biology and pathology. Acta Neuropathologica. 119 (1), 75-88 (2010).
- Solar, P., Zamani, A., Kubickova, L., Dubovy, P., Joukal, M. Choroid plexus and the blood-cerebrospinal fluid barrier in disease. Fluids Barriers CNS. 17 (1), 35(2020).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Myung, J., et al. The choroid plexus is an important circadian clock component. Nature Communications. 9 (1), 1062(2018).
- Zhang, Y., et al. A transgenic FOXJ1-Cre system for gene inactivation in ciliated epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 36 (5), 515-519 (2007).
- Johansson, P. A., et al. The transcription factor Otx2 regulates choroid plexus development and function. Development. 140 (5), 1055-1066 (2013).
- Xu, H., et al. Choroid plexus NKCC1 mediates cerebrospinal fluid clearance during mouse early postnatal development. Nature Communications. 12 (1), 447(2021).
- Spatazza, J., et al. Choroid-plexus-derived Otx2 homeoprotein constrains adult cortical plasticity. Cell Reports. 3 (6), 1815-1823 (2013).
- Zheng, W., et al. Choroid plexus-selective inactivation of adenosine A2A receptors protects against T cell infiltration and experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 19 (1), 52(2022).
- Steffensen, A. B., et al. Cotransporter-mediated water transport underlying cerebrospinal fluid formation. Nature Communications. 9 (1), 2167(2018).
- Zhu, L., et al. Klotho controls the brain-immune system interface in the choroid plexus. Proceedings of the National Academy of Sciences. 115 (48), E11388-E11396 (2018).
- Chen, X., et al. Different serotypes of adeno-associated virus vector- and lentivirus-mediated tropism in choroid plexus by intracerebroventricular delivery. Human Gene Therapy. 31 (7-8), 440-447 (2020).
- Konsman, J. P. The mouse brain in stereotaxic coordinates. Psychoneuroendocrinology. 6 (28), 827-828 (2003).
- Weaver, A., et al. An elevated matrix metalloproteinase (MMP) in an animal model of multiple sclerosis is protective by affecting Th1/Th2 polarization. FASEB J. 19 (12), 1668-1670 (2005).
- Kertser, A., et al. Corticosteroid signaling at the brain-immune interface impedes coping with severe psychological stress. Science Advances. 5 (5), 4111(2019).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Compston, A., Coles, A. Multiple sclerosis. Lancet. 372 (9648), 1502-1517 (2008).
- Reboldi, A., et al. C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE. Nature Immunology. 10 (5), 514-523 (2009).
- Jovanova-Nesic, K., et al. Choroid plexus connexin 43 expression and gap junction flexibility are associated with clinical features of acute EAE. Annals of the New York Academy of Sciences. 1173, 75-82 (2009).
- Jovanova-Nesic, K., Jovicic, S., Sovilj, M., Spector, N. H. Magnetic brain stimulation upregulates adhesion and prevents Eae: MMP-2, ICAM-1, and VCAM-1 in the choroid plexus as a target. International Journal of Neuroscience. 119 (9), 1399-1418 (2009).
- Mills, J. H., Alabanza, L. M., Mahamed, D. A., Bynoe, M. S. Extracellular adenosine signaling induces CX3CL1 expression in the brain to promote experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 9, 193(2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados